一种黄素单氧化酶研究化合物代谢的方法与流程
1.本发明涉及药物代谢技术领域,特别涉及一种黄素单氧化酶研究化合物代谢的方法。
背景技术:
2.药物代谢是指药物分子被机体吸收后,在机体作用下发生化学结构转化的过程。药物代谢对药物的药效、毒性及临床合并用药时的药物相互作用等具有重要影响。作为体内最重要的ⅰ相药物代谢酶,细胞色素p450酶参与约75%的药物代谢反应。临床上基于代谢的药物相互作用大多都是通过对p450酶亚型的抑制或诱导实现的,因此这类酶及相关氧化代谢反应一直是新药研发中关注的焦点,相应的研究技术和评价策略也已趋于成熟;近年来,随着组合化学、高通量筛选等技术的发展,结构新颖的药物层出不穷,非p450酶催化的氧化代谢途径逐渐进入新药研发科学家的视线。然而,由于对非p450酶催化的特殊代谢途径认识不足,导致临床前实验动物种属选择失误,使临床试验阶段药物被终止开发的案例越来越多,常见的催化药物氧化代谢的非p450酶包括黄素单氧化酶(fmo)、单胺氧化酶(mao)、醛氧化酶(ao)、黄嘌呤氧化酶(xo)、乙醇脱氢酶(adh)和乙醛脱氢酶(aldh)。本发明就fmo,对非p450酶代谢提供了可靠的研究策略。
3.fmo为微粒体中除p450酶外的另一种氧化酶。与p450酶类似,fmo催化的氧化反应需要辅助因子nadph的参与。fmo和p450均能催化杂环类化合物发生n-氧化和s-氧化。不同的是,fmo的底物通常为含有n或s原子的弱亲核试剂,而p450酶的底物并不局限于亲核试剂。与p450酶相比,fmo对温度更敏感。在不加nadph时,45℃条件下预孵5min会使fmo失活,而p450酶活性不受影响。
4.fmo特征性底物在微粒体体系中的代谢反应过程分别如下:
[0005][0006][0007]
如上述反应过程所示,由于fmo和cyp450酶在肝亚细胞结构中均有表达,并使用相同的辅因子nadph。因此两个家族的酶都有可能在nadph和肝微粒体共同孵育时参与苄达明的代谢。
[0008]
因此,常规的代谢体系存在以下不足:
[0009]
1、在微粒体体系中不能完全避免cyp450酶对于苄达明的代谢;
[0010]
2、数据采集时,不能够选择多个采集通道以评估fmo的代谢。
[0011]
因此,评估fmo的代谢必须要区分fmo和cyp450酶的贡献,此外在数据采集时需要同时测定苄达明、n-氧化苄达明和n-去甲基苄达明来综合评估fmo的代谢。
附图说明
[0012]
图1为肝微粒体中,添加抑制剂组及肝微粒体灭活组与正常孵育组对cyp酶的代谢影响结果曲线图;
[0013]
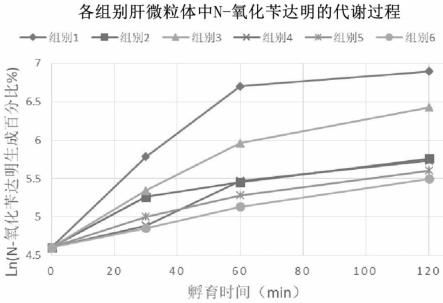
图2为肝微粒体中,添加fmo抑制剂组及肝微粒体灭活组与正常孵育组对fmo酶的代谢影响结果曲线图;
[0014]
图3为肝微粒体中,添加cyp抑制剂组与正常孵育组对cyp酶的代谢影响结果曲线图。
技术实现要素:
[0015]
为解决上述技术问题,本发明提供了一种fmo研究化合物代谢的方法,包括如下步骤:
[0016]
s1.体系设计;
[0017]
步骤s1详细体系见下表:
[0018][0019][0020]
(1)用磷酸缓冲盐溶液(pb)将肝微粒体(20mg/ml)稀释至1.20mg/ml的肝微粒体工作液,其中一份肝微粒体工作液于45℃水浴条件下孵育5min,目的在于热失活fmo;
[0021]
(2)底物(苄达明)用pb稀释至20μm,fmo特异性抑制剂甲巯咪唑或cyps特异性抑制剂氨基苯并三唑用50%乙腈分别稀释至1mm和2mm,nadph用pb:mgcl2=1:1(v/v)稀释至10mm;
[0022]
(3)组别和各组别组分体积设计见下表:
[0023][0024]
*备注:
“‑”
表示不添加,
“×”
表示用空白溶剂代替。
[0025]
具体的,将微粒体(正常/热失活)工作液(166μl)、底物工作液(10μl)、抑制剂工作液(4μl)、依次加入96孔处理板中,混匀后瞬离,置于37℃水浴中;nadph工作液(20μl)37℃水浴预孵育3~5min,然后加入孵育体系中来启动反应,同时开始计时,最终孵育体系200μl;相应的孵育120min,向体系中加入200μl含内标的乙腈终止反应;反应终止后,所得样品经振荡后离心(3700rpm,10min),转移上清液,加入等体积的去离子水稀释,混匀;采用lc-ms/ms方法进行对应特征代谢产物的分析。
[0026]
s2.采用液相色谱-质谱联用仪对样品进行检测;
[0027]
步骤s2中液相色谱条件为:采用反相色谱柱;流动相a为水性流动相,有机相成分为5%乙腈,同时含有5mm乙酸铵和0.025%的甲酸;流动相b为有机流动相,有机相成分为95%乙腈,含有5mm乙酸铵和0.025%的甲酸;进样器温度为4℃;进样量为5-10μl;流速为0.5ml/min;基于洗针液r0和r3的梯度洗脱程序为0~0.30min、15%b,0.30~0.80min、98%b,0.80~1.90min、98%b,1.90~1.91min、15%b,1.91~2.20系统控制;
[0028]
其中,步骤s2中质谱条件为:扫描方式为选择离子监测,离子化模式为正离子模式,离子源为电喷雾离子源,碰撞气压力中等,帘气压力为10psi,雾化气压力为45psi,辅助气压力为45psi,喷雾电压为5000v,雾化气温度为500℃;质谱检测时,待测物除原药苄达明以外,同时检测fmo代谢产物n-氧化苄达明和cyp酶代谢产物n-去甲基苄达明。
[0029]
通过上述技术方案,本发明的目的是开发一种fmo研究化合物代谢的方法,通过热失活肝微粒体及添加特异性抑制剂排除cyp酶对化合物代谢的干扰,评估fmo对化合物代谢的贡献。液相系统部分的流动相使用一定比例的离子对的流动相,采用质谱mrm检测模式同时检测原药苄达明、fmo代谢产物n-氧化苄达明和cyp酶代谢产物n-去甲基苄达明。
具体实施方式
[0030]
本实施例以特异性底物苄达明为例对本发明提供实验体系及液相质谱联用检测方法进行描述。
[0031]
1、实验目的:
[0032]
建立苄达明、n-氧化苄达明和n-去甲基苄达明的lc-ms/ms分析方法,用于测定肝微粒体孵育体系中苄达明、n-氧化苄达明和n-去甲基苄达明的浓度。
[0033]
2、实验材料:
[0034]
2.1实验仪器
[0035][0036]
2.2实验试剂
[0037][0038]
2.3溶剂信息
[0039]
[0040][0041][0042][0043][0044]
注:在必要时可以按比例改变溶液配制体积,实际配制体积将会在实验记录中录入。
[0045]
3液相质谱条件:
[0046]
3.1液相条件
[0047]
[0048][0049]
3.2质谱条件
[0050][0051]
4、孵育体系:
[0052][0053]
5、孵育组别:
[0054][0055]
*备注:
“‑”
表示不添加,
“×”
表示用空白溶剂代替。
[0056]
6、样本的处理过程:
[0057][0058][0059]
7、定量方法:
[0060][0061]
8、实验结果:
[0062]
肝微粒体中,添加抑制剂组(组别2/3)及肝微粒体灭活组(组别4/5/6)与正常孵育组(组别1)存在明显的差异,结果如图1(曲线由下至上依次为组别1-6)所示。
[0063]
肝微粒体中,添加fmo抑制剂组(组别2)及肝微粒体灭活组(组别4/5/6)与正常孵育组(组别1)存在明显的差异,cyp抑制剂组(组别3)对fmo酶的代谢影响不大,结果如图2所示。
[0064]
肝微粒体中,添加cyp抑制剂组(组别3/6)与正常孵育组(组别1)存在明显的差异,fmo抑制剂组(组别2)及肝微粒体灭活组(3/5)对cyp酶的代谢影响不大,结果如图3所示。
[0065]
基于上述实施例可知,本发明开发的一种fmo研究化合物代谢的方法,通过热失活肝微粒体及添加特异性抑制剂排除cyp酶对化合物代谢的干扰,评估fmo对化合物代谢的贡献。液相系统部分的流动相使用一定比例的离子对的流动相,采用质谱mrm检测模式同时检测原药苄达明、fmo代谢产物n-氧化苄达明和cyp酶代谢产物n-去甲基苄达明。
[0066]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对上述实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1