石房蛤毒素的检测方法和应用
1.本发明涉及化合物检测技术领域,具体而言,涉及一种石房蛤毒素的检测方法和应用。
背景技术:
2.贝类中毒多伴随群体性中毒事件,具有家族性、突发性、地域性,会导致众多人员中毒和死亡,造成的社会危害极大,日益引起社会重视。贝类毒素包括麻痹性贝类毒素、腹泻性贝类毒素、神经性贝类毒素和健忘性贝类毒素。
3.麻痹性贝类毒素是毒性很强的毒素之一,其毒性与河豚毒素相当。麻痹性贝类毒素是一种强极性的四氢嘌呤三环类化合物,它由20多种结构不同的甲藻产生的毒素组成,这些甲藻既可在热带水域又可在温带水域生长。麻痹性贝类毒素主要由石房蛤毒素(saxitoxin,stx)及其衍生物组成,其毒性是眼镜蛇毒性的80倍,是一般麻醉剂毒性的10万多倍,人口服0.5~1.0mg便可致死,小鼠腹腔注射石房蛤毒素的半数致死剂量ld
50
为24nmol/kg、灌胃的ld
50
为1 237nmol/kg;人口服的ld
50
为5.7μg/kg,相当于摄入时致死剂量为0.57mg。由于石房蛤毒素毒性大、反应快、无适宜解毒剂,给防治带来了许多困难。因此急需开发一种石房蛤毒素的精准检测方法,为保障水产品安全提供技术基础。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供一种石房蛤毒素的检测方法和应用。
6.本发明是这样实现的:
7.第一方面,本发明提供一种石房蛤毒素的检测方法,包括采用超高液相色谱-串联质谱法检测待测样品,液相色谱检测结束后对待测样品采用质子辅助电离技术处理,再进行质谱检测。
8.在可选的实施方式中,质子辅助电离技术包括将电离溶剂与色谱仪中流出的待测样品混合后通入质谱仪。
9.优选地,电离溶剂包括甲酸或乙酸溶液,电离溶剂的浓度为0.4~0.6%。
10.优选地,电离溶剂的流速为3~8μl/min。
11.在可选的实施方式中,超高液相色谱-串联质谱法包括采用waters acquity ultra performance lctm-premierxe ms/ms检测。
12.在可选的实施方式中,液相色谱柱为waters acquity uplc hilic,流动相a为乙酸铵-甲酸水溶液,流动性b为甲酸甲醇溶液,柱温为35~45℃,样品盘温度为2~6℃。
13.优选地,流动相a为5mm乙酸铵-0.1%甲酸水溶液,流动性b为0.5%甲酸甲醇溶液。
14.优选地,流动相的洗脱程序包括:0~2min,采用10%的流动相a洗脱,余量为流动相b;2~2.1min,采用10~30%的流动相a洗脱,余量为流动相b;2.1~4min,采用30%的流动相a洗脱,余量为流动相b;4~4.1min,采用30~60%的流动相a洗脱,余量为流动相b;4.1
~7min,采用60%的流动相a洗脱,余量为流动相b;7~7.1min,采用60~10%的流动相a洗脱,余量为流动相b;7.1~12min,采用10%的流动相a洗脱,余量为流动相b。
15.优选地,进样体积为1~4μl。
16.在可选的实施方式中,质谱包括采用waters tqs三重四极杆质谱仪检测。
17.优选地,离子源为esi离子源,离子源温度:140~160℃,毛细管电压:1.5~2.5kv,锥孔电压:50~70v,脱溶剂温度:450~550℃,脱溶剂气流量:800~1000l/h,锥孔气流量:140~160l/h。
18.在可选的实施方式中,待测样品的制备包括将贝肉与提取液混合提取后固液分离,重复提取至少两次,再对提取液除杂。
19.在可选的实施方式中,提取包括将贝肉与提取液涡旋再超声提取。
20.优选地,贝肉与提取液的质量体积比为0.8~1.2g:4~8ml。
21.优选地,提取液包括甲酸水溶液或甲酸乙腈溶液中的任一种。
22.优选地,甲酸水溶液中甲酸的含量为0.1~0.4%。
23.优选地,涡旋时间为2~7min。
24.优选地,超声提取为水浴超声提取,超声时间为8~12min,水浴温度为40~60℃。
25.在可选的实施方式中,固液分离包括离心、过率、压滤中的任一种。
26.优选地,固液分离为离心,离心机的转速为8000~12000rpm,离心时间为8~12min。
27.在可选的实施方式中,除杂包括加入除杂溶剂除杂和/或固相萃取除杂。
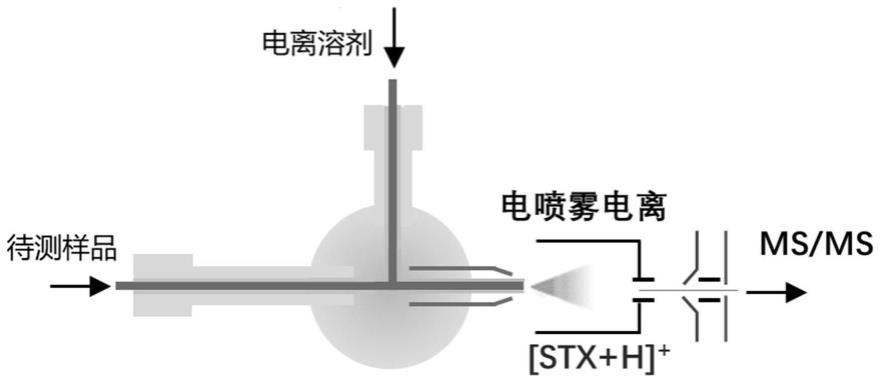
28.优选地,采用除杂溶剂除杂包括向提取液中加入除杂溶剂,涡旋后固液分离,保留上清液。
29.优选地,涡旋时间为2~5min,固液分离为离心,离心机的转速为8000~12000rpm,离心时间为8~12min。
30.优选地,除杂溶剂的添加量为3~12ml。
31.优选地,除杂溶剂包括正己烷、三氯甲烷中的至少一种。
32.优选地,固相萃取除杂的萃取柱为prime hlb,6cc,150mg、mcx,6cc,150mg中的至少一种。
33.第二方面,本发明提供一种如前述实施方式任一项的石房蛤毒素的检测方法在食品、药品检测或日化产品中的应用。
34.本发明具有以下有益效果:
35.本发明提供了一种石房蛤毒素的检测方法和应用,通过采用超高液相色谱-串联质谱法检测,结合质子辅助电离技术处理,提高了石房蛤毒素的检测灵敏度,即使待测样品中石房蛤毒素的浓度水平极低,也能够被检出,保证了水产品的使用安全性。
附图说明
36.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
37.图1为本发明提供的质子辅助电离技术的原理图;
38.图2为本发明实施例1提供的石房蛤毒素标准品溶液的色谱图;
39.图3为本发明实施例1提供的石房蛤毒素标准曲线图;
40.图4为本发明对比例1提供的石房蛤毒素标准品溶液的色谱图。
具体实施方式
41.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
42.第一方面,本发明提供一种石房蛤毒素的检测方法,包括采用超高液相色谱-串联质谱法检测待测样品,液相色谱检测结束后对待测样品采用质子辅助电离技术处理,再进行质谱检测。
43.由于石房蛤毒素毒性大、反应快、无适宜解毒剂,给防治带来了许多困难。因此急需开发一种石房蛤毒素的精准检测方法,发明人通过采用超高液相色谱-串联质谱法检测,结合质子辅助电离技术处理,提高了石房蛤毒素的检测灵敏度,即使待测样品中石房蛤毒素的浓度水平极低,也能够被检出,保证了水产品的使用安全性。
44.在可选的实施方式中,质子辅助电离技术包括将电离溶剂与色谱仪中流出的待测样品混合后通入质谱仪。
45.优选地,电离溶剂包括甲酸或乙酸溶液,电离溶剂的浓度为0.4~0.6%。
46.优选地,电离溶剂的流速为3~8μl/min。
47.请参见图1,质子辅助电离技术的原理包括:从色谱柱内流出的待测样品在进入质谱仪之前先与电离溶剂混合,再在质谱仪中经过电喷雾电离产生石房蛤毒素离子,显著增强了石房蛤毒素的电离效率,从而增强石房蛤毒素的检出灵敏度。
48.在可选的实施方式中,超高液相色谱-串联质谱法包括采用waters acquity ultra performance lctm-premierxe ms/ms检测。
49.在可选的实施方式中,液相色谱柱为waters acquity uplc hilic,流动相a为乙酸铵-甲酸水溶液,流动性b为甲酸甲醇溶液,柱温为35~45℃,样品盘温度为2~6℃。
50.优选地,流动相a为5mm乙酸铵-0.1%甲酸水溶液,流动性b为0.5%甲酸甲醇溶液。
51.优选地,流动相的洗脱程序包括:0~2min,采用10%的流动相a洗脱,余量为流动相b;2~2.1min,采用10~30%的流动相a洗脱,余量为流动相b;2.1~4min,采用30%的流动相a洗脱,余量为流动相b;4~4.1min,采用30~60%的流动相a洗脱,余量为流动相b;4.1~7min,采用60%的流动相a洗脱,余量为流动相b;7~7.1min,采用60~10%的流动相a洗脱,余量为流动相b;7.1~12min,采用10%的流动相a洗脱,余量为流动相b。
52.优选地,进样体积为1~4μl。
53.在可选的实施方式中,质谱包括采用waters tqs三重四极杆质谱仪检测。
54.优选地,离子源为esi离子源,离子源温度:140~160℃,毛细管电压:1.5~2.5kv,锥孔电压:50~70v,脱溶剂温度:450~550℃,脱溶剂气流量:800~1000l/h,锥孔气流量:140~160l/h。
55.通过控制超高液相色谱-串联质谱法的参数在上述范围内,能够更快、更清楚地检测出待测样品中石房蛤毒素的含量,为水产品中石房蛤毒素的检测提供了可参考的依据。
56.在可选的实施方式中,还包括采用超高液相色谱-串联质谱法检测一系列浓度梯度的石房蛤毒素标准品溶液,获得浓度-峰面积呈相关性的石房蛤毒素标准曲线,根据石房蛤毒素标准曲线获得待测样品的浓度。
57.优选地,石房蛤毒素标准品溶液和待测样品的检测方法和参数均相同。
58.在可选的实施方式中,待测样品的制备包括将贝肉与提取液混合提取后固液分离,重复提取至少两次,再对提取液除杂。
59.在可选的实施方式中,提取包括将贝肉与提取液涡旋再超声提取。
60.优选地,贝肉与提取液的质量体积比为0.8~1.2g:4~8ml。
61.优选地,提取液包括甲酸水溶液或甲酸乙腈溶液中的任一种。
62.优选地,甲酸水溶液可以更好地溶出石房蛤毒素,同时为了保证石房蛤毒素的结构稳定,甲酸水溶液中甲酸的含量为0.1~0.4%。
63.优选地,为了保证石房蛤毒素充分溶出,涡旋时间为2~7min。
64.优选地,超声提取为水浴超声提取,超声时间为8~12min,水浴温度为40~60℃。
65.在可选的实施方式中,固液分离包括离心、过率、压滤中的任一种。
66.优选地,固液分离为离心,离心机的转速为8000~12000rpm,离心时间为8~12min。
67.在可选的实施方式中,为了防止待测样品中的其他组分影响石房蛤毒素的检测结果,除杂包括加入除杂溶剂除杂和/或固相萃取除杂。
68.优选地,采用除杂溶剂除杂包括向提取液中加入除杂溶剂,涡旋后固液分离,保留上清液。
69.优选地,涡旋时间为2~5min,固液分离为离心,离心机的转速为8000~12000rpm,离心时间为8~12min。
70.优选地,除杂溶剂的添加量为3~12ml。
71.优选地,除杂溶剂包括正己烷、三氯甲烷中的至少一种。
72.优选地,固相萃取除杂的萃取柱为prime hlb,6cc,150mg、mcx,6cc,150mg中的至少一种。
73.第二方面,本发明提供一种如前述实施方式任一项的石房蛤毒素的检测方法在食品、药品检测或日化产品中的应用。
74.以下结合实施例对本发明的特征和性能作进一步的详细描述。
75.实施例1
76.s01、绘制石房蛤毒素标准曲线
77.将石房蛤毒素溶解于甲醇溶液中,制得浓度为100μg/ml的石房蛤毒素储备液,将石房蛤毒素储备液依次稀释为5ng/ml、12.5ng/ml、25ng/ml、50ng/ml、125ng/ml、250ng/ml、500ng/ml和1000ng/ml浓度,得到一系列石房蛤毒素标准品溶液,采用超高液相色谱-串联质谱法依次检测石房蛤毒素标准品溶液,获得标准品溶液的色谱图,其中,25ng/l的标准品溶液的色谱图如图2所示,通过计算各标准品溶液的色谱图中石房蛤毒素的峰面积,将峰面积与标准品溶液的浓度对应,绘制标准曲线,如图3所示。石房蛤毒素标准曲线的目标化合
物的相关系数(r2)为0.9992,说明色谱峰峰面积与化合物浓度间呈良好的定量关系,可满足目标物分析的要求。
78.检测过程先将标准品溶液通入色谱柱中进行超高液相色谱分离,然后利用质子辅助电离技术增强标准品溶液的响应强度再通入质谱仪中。
79.其中,超高液相色谱的色谱条件包括:液相色谱柱为waters acquity uplc hilic,流动相a为5mm乙酸铵-0.1%甲酸水溶液,流动性b为0.5%甲酸甲醇溶液,柱温为40℃,样品盘温度为4℃,进样体积为2μl。
80.流动相的洗脱程序包括:0~2min,采用10%的流动相a洗脱,余量为流动相b;2~2.1min,采用10~30%的流动相a洗脱,余量为流动相b;2.1~4min,采用30%的流动相a洗脱,余量为流动相b;4~4.1min,采用30~60%的流动相a洗脱,余量为流动相b;4.1~7min,采用60%的流动相a洗脱,余量为流动相b;7~7.1min,采用60~10%的流动相a洗脱,余量为流动相b;7.1~12min,采用10%的流动相a洗脱,余量为流动相b。
81.质子辅助电离包括:将电离溶剂与色谱仪中流出的待测样品混合后通入质谱仪。电离溶剂为0.5%甲酸溶液,电离溶剂的流速为3~8μl/min。
82.质谱条件包括:质谱仪为waters tqs三重四极杆质谱仪,离子源为esi离子源,离子源温度:150℃,毛细管电压:2kv,锥孔电压:60v,脱溶剂温度:500℃,脱溶剂气流量:900l/h,锥孔气流量:150l/h。
83.s02、制备石房蛤毒素待测样品
84.取清水洗净后的贝类样品1,擦干水分,去壳取出贝肉后放入匀浆机匀浆,取1g匀浆后的贝肉于15ml离心管中,加入0.2%的甲酸水溶液6ml涡旋5min,然后在50℃水浴中超声提取10min,提取完成后在10000rpm离心10min,上清液转移至50ml离心管中,重复上述提取操作一次,合并两次上清液,得到提取液。
85.向提取液中加入10ml正己烷,涡旋2min,然后在10000rpm离心10min,弃去上层液体。向下层液体中加入5ml三氯甲烷,涡旋5min,后在10000rpm离心10min,将上层清液转至15ml离心管备用。
86.取出5ml上述备用的上层清液通过萃取柱prime hlb(6cc,150mg),收集滤出液于15ml离心管中,向滤出液中加0.2%的甲酸水溶液1ml通过固相萃取柱,再次收集流出液至离心管中。向离心管内加入甲醇定容至10ml,涡旋混匀后取1ml过膜,用于超高液相色谱-串联质谱法分析。
87.其中,超高液相色谱-串联质谱法的参数与s01步骤相同。将检测得到的待测样品的峰面积带入石房蛤毒素标准曲线,获得待测样品中石房蛤毒素的浓度为25.36ng/kg。
88.采用实施例1的方法检测另外4种不同的贝类样品,得到样品中石房蛤毒素的浓度如表1所示:
89.表1不同贝类样品中石房蛤毒素的含量
[0090] 样品1样品2样品3样品4样品5浓度ng/kg25.3671.3476.3259.1266.61
[0091]
由表1可知,本发明实施例提供的检测方法可以检测出不同贝类待测样品中的石房蛤毒素含量。
[0092]
对比例1
[0093]
本对比例提供了一种石房蛤毒素的检测方法,其具体步骤与实施例1相似,区别仅在于不使用质子辅助电离技术。得到的25ng/l的标准品溶液的色谱图如图4所示,由图4和图2可知,本发明实施例采用质子辅助电离技术可以显著降低石房蛤毒素的响应浓度,因此可以检测出待测样品中更低浓度的石房蛤毒素,提高石房蛤毒素的检测灵敏度。
[0094]
对比例2
[0095]
本对比例提供了一种石房蛤毒素的检测方法,采用与实施例1相同的样品1~样品5作为原料,具体检测方法与实施例1相似,区别仅在于提取时加入0.5%的甲酸甲醇溶液6ml涡旋5min。采用将检测得到的峰浓度带入石房蛤毒素标准曲线,获得待测样品中石房蛤毒素的浓度如表2所示。
[0096]
表2不同贝类样品中石房蛤毒素的含量
[0097] 样品1样品2样品3样品4样品5浓度ng/kg20.130.5743.9221.6630.18
[0098]
由表2可知,提取时加入的甲酸甲醇溶液中甲酸含量增加,会导致贝类样品中石房蛤毒素的含量检出量降低。
[0099]
对比例3
[0100]
本对比例提供了一种石房蛤毒素的检测方法,采用与实施例1相同的样品1~样品5作为原料,检测方法与实施例1相似,区别仅在于质谱条件改为:毛细管电压:0.5kv。将检测得到的峰浓度带入石房蛤毒素标准曲线,获得待测样品中石房蛤毒素的浓度如表3所示。
[0101]
表3不同贝类样品中石房蛤毒素的含量
[0102] 样品1样品2样品3样品4样品5浓度ng/kg10.5822.7318.729.5219.92
[0103]
由表3可知,质谱条件中毛细管电压降低,会导致贝类样品中石房蛤毒素的含量检出量降低。
[0104]
试验例1
[0105]
将50ng/l浓度的石房蛤毒素标准品溶液作为qc样本进行重复性实验,分别采用实施例1和对比例1~3的方法检测qc样本中的石房蛤毒素,计算其加标回收率和标准相对偏差rsd值,得到如表4所示结果。
[0106]
表4石房蛤毒素的检测方法的精确度
[0107] 检测浓度(ng/l)加标回收率(%)rsd(%)实施例144.989.86.7对比例136.5573.18.8对比例232.4764.97.2对比例329.8159.69.3
[0108]
由表4可知,本发明实施例提供的检测方法的加标回收率更高,标准相对偏差rsd值更低,能够准确可靠地检测出样品中石房蛤毒素的含量,为石房蛤毒素的检测提供了依据。
[0109]
以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、
等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1