一种MOF-DNA生物条形码扩增的CRISPR检测方法及其应用
本发明涉及生物技术相结合,具体涉及一种mof-dna生物条形码扩增的crispr检测方法对肿瘤生物标志物及拓宽到其他分子检测上的应用。
背景技术:
1、近些年来,聚类规则间隔短回文重复序列(crispr/cas)系统在基因组编辑和生物传感领域受到广泛关注。在crispr/cas家族中,cas12a、cas12b、cas13a、cas13b、cas14和csm6等cas蛋白都具有反式切割的活性。因此它们在分子诊断领域显示出了巨大的潜力。由于crispr/cas系统的可编程性依赖于导向rna与核酸的相互作用,因此往往需要采用一些核酸扩增技术来增强核酸检测的信号输出,如聚合酶链式反应(pcr)、rpa(重组酶聚合酶扩增)和环介导等温扩增(lapm)等。然而,这些方法不仅耗时、费力、成本高,而且容易造成样品之间的交叉污染。因此,迫切需要有效的策略来实现信号转换和放大,以拓宽crispr/cas系统在非核酸靶标检测中的应用。
2、金纳米粒子dna生物条形码技术是一种高效的信号转换策略,可用于检测具有pcr敏感性的蛋白质。然而,该技术使用二硫代苏糖醇(dtt)作为试剂从金纳米粒子中释放dna生物条形码。由于dtt不稳定,且能减少cas蛋白中的二硫键,因此该信号转换策略很难与crispr/cas分析相结合。金属-有机骨架材料(mof)是指过渡金属离子与有机配体通过自组装形成的具有周期性网络结构的晶体多孔材料。由于其具有丰富的孔隙度、高比表面积、显著的吸附亲和力、良好的热稳定性等独特的优点,在生物传感中常被用作生物分子的载体。目前,通过mof金属位点和核酸化学基团之间形成化学键的策略已经被开发出来。zr-mof作为研究较多的mofs之一,它显示了对磷酸基(-po3)的高亲和力,可以形成牢固的zr-o-p配位键,基于这一特性,末端磷标记的dna链可以通过zr-o-p键直接共轭到zr-mofs表面,具有很高的修饰效率。有趣的是,高浓度的磷酸盐会导致zr-mof支架的分解,使装载在mofs上的dna释放。zr-mof具有易于加载和释放dna激活链的特点,这表明zr-mof可以与寡核苷酸功能化,构建一种新的生物条码工具来转换和放大信号。
3、然而目前,缺乏一种检测成本低的mof-dna生物条形码扩增的crispr检测方法及其应用。
技术实现思路
1、为了解决现有技术存在的问题,本发明提供了一种检测成本低的mof-dna生物条形码扩增的crispr检测方法对肿瘤生物标志物及其他分子检测的应用,
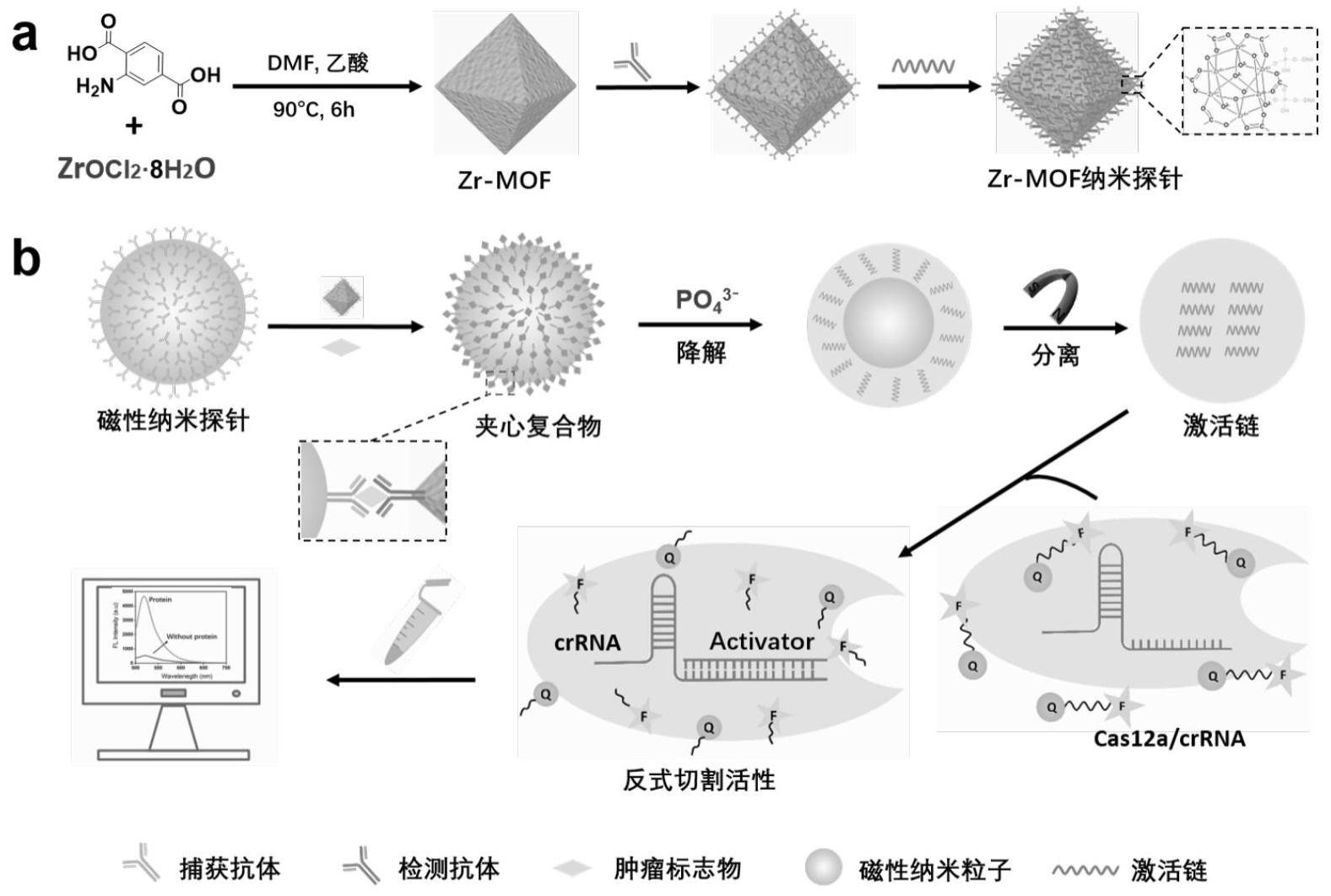
2、为此,本发明采用以下技术方案:本发明的一种zr-mof纳米探针的构建方法,所述的zr-mof纳米探针是由检测抗体和激活链依次通过共价连接到zr-mof纳米粒子上制备形成的;所述的激活链可特异性与crispr体系中的crrna结合,激活crispr蛋白的反式切割活性,切割荧光报告分子产生荧光信号。
3、进一步地,所述的zr-mof纳米粒子与激活链摩尔比为1:500,检测抗体的浓度为10μg/ml;所述的抗体为可特异性识别cea(癌胚抗原)、psa(前列腺癌特异性抗原)或其它生物标志物中的任意一种;所述的激活链为单链dna、双链dna或单链rna中的任意一种,所述的激活链为5’端修饰磷酸基团的核酸链。
4、本发明所述的zr-mof纳米探针的构建方法制得的zr-mof纳米探针。
5、本发明的一种mof-dna生物条形码扩增的crispr检测方法,包括如下步骤:(1)制备磁性纳米探针:将磁性纳米粒子与抗体共价连接得到磁性纳米探针;
6、(2)制备zr-mof纳米探针:将zr-mof纳米粒子与检测抗体、激活链依次共价连接得到zr-mof纳米探针;
7、(3)夹心结构的形成:磁性纳米探针制备完成以后,加入目标物进行反应,之后再加入zr-mof纳米探针,通过抗体对目标物的特异性识别作用,三者形成磁性纳米探针-目标物-zr-mof纳米探针的夹心复合物结构;
8、通过抗体对抗原的特异性识别原理,最后三者形成磁性纳米探针-目标物-zr-mof纳米探针的夹心结构;
9、(4)激活链的脱落处理:将一定浓度的磷酸盐对夹心复合物进行降解处理,使激活链从zr-mof纳米探针上脱落下来;
10、(5)基于crispr的荧光激活反应:将脱落的激活链加入crispr反应体系进行反应,激活链激活crispr蛋白的反式切割活性,切割荧光报告分子产生荧光信号,最后通过荧光分光光度计测量荧光强度,数据分析实现目标物的定量分析检测。
11、进一步地,在步骤(1)中,所述的磁性纳米粒子采用溶剂热法制得,粒径为550nm;在步骤(2)中,所述的zr-mof纳米粒子采用溶剂热法制得,粒径为65nm;在步骤(5)中,荧光激活反应在100μl的crispr试剂中进行,包括1×neb 2.1缓冲液、20nm cas12a蛋白、40nmcrrna、100nm荧光报告分子。
12、进一步地,在步骤(5)中,所述的crispr试剂包括crispr蛋白,crrna和荧光报告分子,所述的荧光报告分子为两端分别修饰有荧光基团和荧光猝灭基团的核酸链;所述的荧光报告分子中的核酸链为单链dna或单链rna中的任意一种;所述的具备反式切割活性的crispr蛋白为cas12a、cas12b、cas13a、cas13b、cas14或csm6中的任意一种。
13、本发明所述的将zr-mof纳米粒子进行降解处理的方法,用一定浓度的磷酸盐将zr-mof纳米粒子降解。
14、本发明利用所述的crispr检测方法进行检测的试剂盒。
15、进一步地,所述的试剂盒包括crispr试剂、阳性标准品和所述的zr-mof纳米探针。
16、本发明的一种利用所述的crispr检测方法用于肿瘤生物标志物及其他分子细菌、细胞检测中的应用。
17、本发明所述的crispr检测方法或如所述的试剂盒在疾病筛查、诊断、免疫分析等方面的应用。
18、有益效果:本发明的方法检测成本低、操作简单、灵敏度高、特异性强,为生物医学研究,食品安全,卫生监管等领域提供一种新的研究手段和思路。
19、与现有技术相比,本发明至少具有如下优点:
20、(1)本发明是将elisa、纳米技术与crispr生物技术相结合,利用抗体对目标物的特异性识别原理生成夹心复合物结构,完成了目标物识别信号到crispr反式切割活性信号的转化,最后再通过crispr生物技术,对目标物进行定量分析。整个过程成本低,操作简单、高灵敏度、高特异性。
21、(2)本发明所述的在zr-mof纳米粒子上共价连接抗体和激活链制成zr-mof纳米探针的策略,不仅可特异性识别目标物,而且还能激活crispr蛋白的反式切割活性,任意切割荧光报告分子产生荧光信号。实现了将目标物识别信号到crispr反式切割活性信号的转化。
22、(3)本发明所述的在zr-mof纳米粒子上共价连接抗体和激活链制成zr-mof纳米探针的策略,一方面,拓宽了zr-mof纳米粒子在生物分析检测中作为生物载体的应用;另一方面,zr-mof纳米探针上连接了大量的激活链,可用来代替pcr、lamp等核酸扩增手段,操作简单、省时。
23、(4)本发明所述的crispr检测方法,其设计思路具有通用性,通过改变zr-mof纳米探针上的抗体就可以推广到更多种类疾病肿瘤标志物、细菌、细胞及其他小分子的定量检测,不需更换激活链和相应的crrna,简化了检测的操作过程,因此,也充分说明了该检测方法有着极高的适用性。
24、(5)本发明所述的crispr检测方法可以将其与试剂盒相结合,使之能够在短时间得到检测结果,为生物医学研究,食品安全,卫生监管等领域提供一种新的研究手段和思路。
- 还没有人留言评论。精彩留言会获得点赞!