检测片、试剂盒以及POCT血细胞分析仪的制作方法
检测片、试剂盒以及poct血细胞分析仪
技术领域
1.本技术涉及医疗器械技术领域,特别是涉及一种检测片、试剂盒以及poct(point-of-care testing,即时检验)血细胞分析仪。
背景技术:
2.现有的血细胞分析仪使用的微孔片一般是用宝石材质(刚玉)制作而成的,这种微孔片在生产制造过程中使用的是研磨工艺,这种制造工艺制造出来的微孔片的强度和表面的精度是很高,微孔片表面和以及检测孔是十分光滑,可以使得细胞顺畅的通过检测,一般是不存在因为微孔片表面和检测孔表面粗糙度过大导致细胞经过检测时出现堵塞的现象。但,采用宝石材质制作的微孔片成本高。
3.申请人在专利号202110904079.0中提出微孔片的片体为塑胶片体,以利用塑胶代替宝石材质。申请人发现以下问题:现有的微孔片使用塑胶件制作,主要的生产工艺为注塑成型,而通过注塑成型制造的微孔片,微孔片的表面粗糙度通常比较大,血细胞分析仪使用这种微孔片进行检测时,由于微孔片的表面粗糙度不达标,导致血细胞经过微孔的时候出现堵孔的情况。而微孔片的表面粗糙度越低,微孔片的制造工艺难度越大,导致制造成本和装配成本增加。
技术实现要素:
4.本技术提供一种检测片、试剂盒以及poct血细胞分析仪,以解决现有技术中制造成本和装配成本增加的技术问题。
5.为解决上述问题,本技术提供一种用于血细胞分析仪的检测片,所述检测片为塑胶件,所述检测片包括第一区域和第二区域,所述第一区域设置有允许血细胞逐一通过的检测孔,所述第二区域围绕所述第一区域设置,所述第一区域的表面粗糙度大于或等于0.08μm且小于或等于0.12μm;
6.或者,所述检测片包括围绕所述检测孔设置的引流部,所述引流部的表面粗糙度大于等于大于或等于0.08μm且小于或等于0.12μm。
7.其中,所述检测片安装于供所述血细胞流动的流道内,所述检测片与所述流道的接触面的面积大于10平方毫米。
8.其中,所述检测片包括本体,所述本体具有相背设置的第一表面和第二表面,位于所述第一表面上的所述第一区域和所述第二区域与位于所述第二表面上的所述第一区域和所述第二区域的位置分别对应,位于所述第一表面上的引流部和位于所述第二表面上的引流部的表面粗糙度相等或不相等。
9.其中,所述第二区域的表面粗糙度大于或等于所述引流部的表面粗糙度。
10.其中,位于所述第一表面上的引流部在所述第一表面的投影面积与所述第一表面的面积之间的比值范围为1:2.5-1:5.5;位于所述第二表面上的引流部在所述第二表面的投影面积与所述第二表面的面积之间的比值范围为1:2.5-1:5.5。
11.其中,所述检测孔的深度与所述引流部的深度之间的比值范围为1:1.5-1:4.5。
12.其中,所述检测孔的深度与所述第二区域的厚度之间的比值范围为1:5-1:8.5。
13.其中,所述第二区域的厚度大于或等于0.6mm且小于或等于1.5mm。
14.其中,所述引流部与所述检测孔的连接处的表面粗糙度小于或等于8μm。
15.其中,所述检测片具有连接所述第一表面和所述第二表面的周侧壁,所述周侧壁的表面粗糙度大于或等于0.32μm且小于或等于0.4μm。
16.其中,所述引流部朝向所述本体的内部凹陷设置。
17.其中,所述第二区域的表面粗糙度大于或等于0.08μm且小于或等于0.16μm。
18.其中,所述检测孔的表面粗糙度大于或等于0.08μm且小于或等于0.12μm。
19.其中,所述接触面的径向尺寸大于1.5mm,且所述检测片的径向尺寸大于3.6mm。
20.为解决上述问题,本技术提供一种试剂盒,试剂盒包括:
21.盒体,包括前池、后池和过孔,所述过孔设置于所述前池和所述后池之间;
22.上述的检测片,所述前池、所述后池和所述检测片可拆卸连接,所述检测片固定于所述过孔的一端。
23.为解决上述问题,本技术提供一种poct血细胞分析仪,包括检测座,所述检测座用于与上述的试剂盒相配合,所述poct血细胞分析仪用于对样本进行分析检测。
24.本技术的检测片为塑胶件,检测片包括第一区域和第二区域,第一区域设置有允许血细胞逐一通过的检测孔,第二区域围绕第一区域设置,第一区域的表面粗糙度大于或等于0.08μm且小于或等于0.12μm;或者,检测片包括围绕检测孔设置的引流部,引流部的表面粗糙度大于等于大于或等于0.08μm且小于或等于0.12μm。通过上述方式,检测片既符合血细胞分析仪的试剂使用要求,也能降低检测片的制造成本和装配成本,进而使得血细胞通过检测片的检测孔更加流畅。此外,检测片安装于供血细胞流动的流道内,检测片与流道的接触面的面积大于10平方毫米,能够防止检测片与流道的接触面在检测过程中造成液体泄露的情况,提高了检测结果的准确性。
附图说明
25.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。其中:
26.图1是本技术提供的检测片的第一实施例的结构示意图;
27.图2是本技术提供的检测片的第二实施例的结构示意图;
28.图3是本技术提供的检测片的第三实施例的结构示意图;
29.图4是本技术提供的试剂盒的第一实施例的结构示意图;
30.图5是图4中的试剂盒的一视角的剖面示意图。
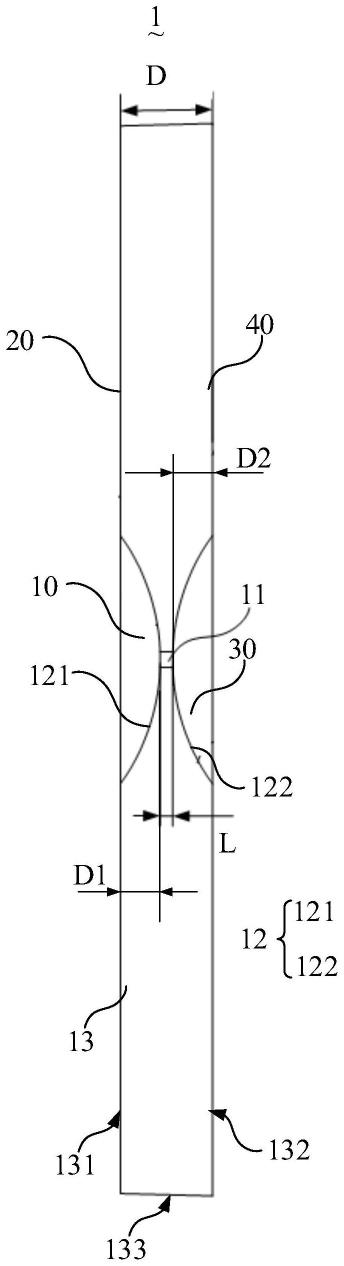
具体实施方式
31.下面将结合本实用新型实施例中的附图,对本实用新型实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本实用新型一部分实施例,而不是全部的
实施例。基于本实用新型中的实施例,本领域普通技术人员在没有做出创造性劳动情况下所获得的所有其他实施例,均属于本实用新型保护的范围。
32.需要说明,若本实用新型实施例中有涉及方向性指示(诸如上、下、左、右、前、后
……
),则该方向性指示仅用于解释在某一特定姿态(如附图所示)下各部件之间的相对位置关系、运动情况等,如果该特定姿态发生改变时,则该方向性指示也相应地随之改变。
33.另外,若本实用新型实施例中有涉及“第一”、“第二”等的描述,则该“第一”、“第二”等的描述仅用于描述目的,而不能理解为指示或暗示其相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。另外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本实用新型要求的保护范围之内。
34.本技术提供一种检测片,请参见图1所示,图1是本技术提供的检测片的第一实施例的结构示意图。本实施例的检测片1可以应用于血细胞分析仪,血细胞分析仪用于对样本进行检测,样本包括血细胞;血细胞分析仪具有供血细胞流动的流道,血细胞分析仪可以为poct血细胞分析仪。
35.其中,检测片1为塑胶件。可选地,检测片1可以采用注塑成型的方式生产;在其他实施例中,检测片1可以通过其他方式生产,例如挤压成型或旋转成型等。因此,本实施例的检测片1为塑胶件,易于制作,降低检测片1的制作成本,实现大批量生产。
36.检测片1包括第一区域10和第二区域20,第一区域10设置有允许血细胞逐一通过的检测孔11,检测孔11的直径可以根据血细胞的不同粒径进行对应设置。第二区域20围绕第一区域10设置,即第二区域20远离检测孔11设置。
37.其中,第一区域10的表面粗糙度大于或等于0.08μm且小于或等于0.12μm,例如第一区域10的表面粗糙度为0.08μm、0.09μm、0.1μm、0.11μm或0.12μm。将第一区域10的表面粗糙度设置成不同值,在满足了使用需求的前提下,使得第一区域10具有较宽的制造精度调整区间,相对降低了检测片1整体制造的难度。
38.由于本技术的检测片1为塑胶件,采用注塑成型的工艺制造检测片1;因此检测片1的表面粗糙度通常比较大,进而检测片1的表面粗糙度不达标,导致血细胞经过检测孔11的时候出现堵孔的现象。而检测片1的表面粗糙度越低,检测片1的制造工艺难度越大,导致制造成本增加,检测片1的装配成本增加。经过发明人长时间的研究分析,本实施例的第一区域10的表面粗糙度大于或等于0.08μm且小于或等于0.12μm,既符合血细胞分析仪的试剂使用要求,也能降低检测片1的制造成本和装配成本,进而使得血细胞通过检测片1的检测孔11更加流畅。
39.请参见图2所示,图2是本技术提供的检测片的第二实施例的结构示意图。本实施例的检测片1与第一实施例的检测片1不同之处在于:
40.检测片1包括围绕检测孔11设置的引流部12,即引流部12和检测孔11可以位于第一区域10内;引流部12可以呈球面形、锥形或圆弧曲面形,以利于引流部12将血细胞引流至检测片1的检测孔11。在其他实施例中,引流部12还可以位于第一区域10和第二区域20内。
41.其中,引流部12的表面粗糙度大于或等于0.08μm且小于或等于0.12μm,例如引流部12的表面粗糙度为0.08μm、0.09μm、0.1μm、0.11μm或0.12μm。在满足了使用需求的前提
下,不同的表面粗糙度,使得引流部12具有较宽的制造精度调整区间,相对降低了检测片1整体制造的难度。
42.由于本技术的检测片1为塑胶件,采用注塑成型的工艺制造检测片1;因此检测片1的表面粗糙度通常比较大,进而检测片1的表面粗糙度不达标,导致血细胞经过检测孔11的时候出现堵孔的现象。而检测片1的表面粗糙度越低,检测片1的制造工艺难度越大,导致制造成本增加,检测片1的装配成本增加。经过发明人长时间的研究分析,本实施例的引流部12的表面粗糙度大于或等于0.08μm且小于或等于0.12μm,既符合血细胞分析仪的试剂使用要求,也能降低检测片1的制造成本和装配成本,进而使得血细胞通过检测片1的检测孔11更加流畅。
43.可选地,检测片1安装于供血细胞流动的流道内,检测片1与流道的接触面的面积大于10平方毫米,例如检测片1与流道的接触面的面积为25平方毫米或者31平方毫米。
44.其中,检测片1与流道的接触面可以为检测片1与组成上述流道的部件相接触的面,或者检测片1与流道的接触面可以为检测片1与试剂盒的后池相接触的面,或者检测片1与流道的接触面可以为检测片1与试剂盒的盒体相接触的面。例如,检测片1与流道的接触面可以为第二区域20与组成上述流道的部件相接触的面,或者第二区域20与试剂盒的后池相接触的面,或者第二区域20与试剂盒的盒体相接触的面。
45.在检测片1与流道的接触面的面积小于10平方毫米的情况下,由于检测片1与流道的接触面的面积小,检测片1的两侧在流道内存在压力差,导致接触面在检测过程中造成液体泄露的情况。因此,本实施例的检测片1与流道的接触面的面积大于10平方毫米,能够防止检测片1与流道的接触面在检测过程中造成液体泄露的情况,提高了检测结果的准确性。
46.可选地,塑胶件的材料包括pe(polyethylene,聚乙烯)、pp(polypropylene,聚丙烯)、pvc(polyvinyl chloride,聚氯乙烯)、ps(polystyrene,聚苯乙烯)、abs(acrylonitrile butadiene styrene,丙烯腈-丁二烯-苯乙烯共聚物)、pmma(polymethyl methacrylate,聚甲基丙烯酸甲酯)、pom polyoxymethylene,聚甲醛树脂)或pc(polycarbonate,聚碳酸酯)中的至少一种。
47.其中,检测片1包括本体13,本体13具有向背设置的第一表面131和第二表面132,位于第一表面131上的第一区域10和第二区域20与位于第二表面132的第一区域30和第二区域40分别对应,即第一表面131和第二表面132可以沿本体13的中心轴呈轴对称设置。
48.可选地,第一表面131和第二表面132均设置有引流部12,具体为位于第一表面131上的引流部121和位于第二表面132上的引流部122。其中,位于第一表面131上的引流部121和位于第二表面132上的引流部122的表面粗糙度相同,能够保持第一表面131和第二表面132的一致性,以使检测片1在装配时没有防呆要求,降低检测片1的装配时间,提高检测片1的装配效率;此外,可以通过自动化方式装配检测片1,进一步提高检测片1的装配效率。
49.在其他实施例中,位于第一表面131上的引流部121和位于第二表面132上的引流部122的表面粗糙度不相同,位于第一表面131上的引流部121和位于第二表面132上的引流部122的表面粗糙度中较小者的作为检测片1的正面,其中检测片1的正面与本技术其他实施例的试剂盒的前池对应设置。例如,位于第一表面131上的引流部121的表面粗糙度为0.08μm,位于第二表面132上的引流部122的表面粗糙度为0.09μm,则第一表面131作为检测片1的正面。在其他实施例中,如图3所示,第一表面131设置有引流部12,则第一表面131作
为检测片1的正面。
50.可选地,引流部12朝向本体13的内部凹陷设置,利于血细胞通过检测片1的检测孔11更加流畅。其中,引流部12的弧度可以大于或等于1mm,例如引流部12的弧度均可以为1mm、1.2mm或2mm等。在其他实施例中,引流部12朝向本体13的外部,以使引流部12凸出于本体13设置。
51.可选地,第二区域20的表面粗糙度大于或等于0.08μm且小于或等于0.16μm,第二区域40的表面粗糙度大于或等于0.08μm且小于或等于0.16μm;例如第二区域20和第二区域40的表面粗糙度可以为0.08μm、0.09μm、0.1μm、0.11μm、0.12μm、0.13μm、0.14μm、0.15μm或0.16μm。在其他实施例中,引流部12位于第一区域10和第二区域20内,检测片1在引流部12外的第二区域20的表面粗糙度大于或等于0.08μm且小于或等于0.16μm。
52.由于检测片1的第二区域20或第二区域40作为检测片1的装配面,因此第二区域20的表面粗糙度大于或等于位于第一表面131上的引流部121的表面粗糙度,第二区域40的表面粗糙度大于或等于位于第二表面132上的引流部122的表面粗糙度,例如位于第一表面131上的引流部121的表面粗糙度和位于第二表面132上的引流部122的表面粗糙度均为0.08μm,第二区域20的表面粗糙度和第二区域40的表面粗糙度均为0.16μm;能降低检测片1的制造成本和装配成本。此外,第二区域20的表面粗糙度和第二区域40的表面粗糙度相等,能够保证第一表面131和第二表面132的一致性。
53.在其他实施例中,第二区域20的表面粗糙度和第二区域40的表面粗糙度不相等,例如第二区域20的表面粗糙度为0.14μm,第二区域40的表面粗糙度为0.16μm。
54.可选地,检测片1具有连接第一表面131和第二表面132的周侧壁133,周侧壁133的表面粗糙度大于或等于0.32μm且小于或等于0.4μm,即周侧壁133的表面粗糙度大于第二区域20的表面粗糙度,能降低检测片1的制造成本和装配成本。
55.可选地,检测片1的检测孔11的深度l与第二区域20的厚度d之间的比值范围为1:5-1:8.5。即,检测片1的检测孔11的深度l与第二区域20的厚度d之间的比值为1:5、1:6、1:7、1:8或1:8.5。
56.位于第一表面131上的引流部121在第一表面131上的投影面积与第一表面131的面积之间的比值范围为1:2.5-1:5.5,位于第一表面131上的引流部121在第一表面131上的投影面积与第一表面131的面积之间的比值可为1:2.5、1:3、1:4、1:5或1:5.5。位于第二表面132上的引流部122在第二表面132上的投影面积与第二表面132的面积之间的比值范围为1:2.5-1:5.5,位于第二表面132上的引流部122在第二表面132上的投影面积与第二表面132的面积之间的比值可为1:2.5、1:3、1:4、1:5或1:5.5。位于第一表面131上的引流部121的面积和位于第二表面132上的引流部122的面积相同或不相同。在第位于第一表面131上的引流部121的面积和位于第二表面132上的引流部122的面积相同的情况,能够保持第一表面131和第二表面132的一致性。
57.在位于第一表面131上的引流部121在第一表面131上的投影面积与第一表面131的面积之间的比值范围小于1:2.5,位于第二表面132上的引流部122在第二表面132上的投影面积与第二表面132的面积之间的比值范围小于1:2.5的情况下,即位于第一表面131上的引流部121和位于第二表面132上的引流部122的面积过小,对于血细胞流经检测孔11引流效果较差。在位于第一表面131上的引流部121在第一表面131上的投影面积与第一表面
131的面积之间的比值范围大于1:5.5,位于第二表面132上的引流部122在第二表面132上的投影面积与第二表面132的面积之间的比值范围大于1:5.5的情况下,即位于第一表面131上的引流部121和位于第二表面132上的引流部122的面积过大,影响检测片1的强度。本实施例的位于第一表面131上的引流部121在第一表面131上的投影面积与第一表面131的面积之间的比值范围为1:2.5-1:5.5,位于第二表面132上的引流部122在第二表面132上的投影面积与第二表面132的面积之间的比值范围为1:2.5-1:5.5,既能够保证检测片1的强度,也能提高血细胞流经检测孔11引流效果。
58.检测孔11的深度l与引流部12的深度d1之间的比值范围为1:1.5-1:4.5,例如检测孔11的深度l与位于第一表面131上的引流部121的深度d1之间的比值可以为1:1.5、1:2、1:3、1:4或1:4.5。检测孔11的深度l与位于第二表面132上的引流部122的深度d2之间的比值范围为1:1.5-1:4.5;例如检测孔11的深度l与位于第二表面132上的引流部122的深度d2之间的比值为1:1.5、1:2、1:3、1:4或1:4.5。检测孔11的深度l与引流部12的深度d2之间的比值范围过大,引流部对于引导血细胞流经检测孔11的引流效果较差,会影响检测效果。检测孔11的深度l与引流部12的深度d2之间的比值范围过小,会降低检测孔11附近的强度,检测孔11形状的均一性较差,会影响检测的准确性。本实施例的检测孔11的深度l与引流部12的深度d2之间的比值范围为1:1.5-1:4.5,能够提高血细胞流经检测孔11引流效果,同时保证检测孔11形状的均一性,避免检测孔11出现堵塞,提高检测准确性。其中,位于第一表面131上的引流部121的深度d1与位于第二表面132上的引流部122深度d2相等或不相等。在位于第一表面131上的引流部121的深度d1与位于第二表面132上的引流部122深度d2相等的情况,能够保持第一表面131和第二表面132的一致性。通过上述方式,能够提高检测片1的机械强度。
59.可选地,检测孔11与引流部12的连接处的表面粗糙度小于或等于8μm,即检测孔11与位于第一表面131上的引流部121的连接处的表面粗糙度小于或等于8μm。在检测孔11与位于第二表面132上的引流部122的连接处的表面粗糙度大于8μm的情况下,可能会导致检测孔11出现堵塞,造成血细胞的计数结果出现较大偏差。而本实施例检测孔11与引流部12的连接处的表面粗糙度小于或等于8μm,能够避免检测孔11出现堵塞,提高检测准确。
60.可选地,第二区域20(或第二区域40)的厚度d大于或等于0.6mm且小于或等于1.5mm。例如,第二区域20的厚度d为0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、1.1mm、1.2mm、1.3mm、1.4mm或1.5mm等。其中,第二区域20的厚度是指检测片1本身上处于第二区域20范围内的实体部分的厚度,在其他实施例中,检测片1可以称为微孔片,检测孔11可以称为微孔。
61.值得注意的是,第一区域10和第二区域20是用于示意检测片1的不同区域,例如第一区域10设置有检测孔11和引流部12,第二区域20远离检测孔11;在检测片1采用注塑成型的方式生产的情况下,第一区域10和第二区域20一体成型。
62.在检测片1的第二区域20的厚度d设置小于0.6mm的情况下,由于塑胶件的机械强度相对于宝石材料较弱,检测片1在装配至流道时可能出现扩孔、断裂或变形等情况。在检测片1的第二区域20的厚度d设置大于1.5mm的情况下,由于第二区域20的厚度d较厚造成检测片1的制作加工困难,在检测片1出模的时候检测片1的检测孔11很容易被拉伤,甚至造成检测片1的检测孔11堵塞,因此导致检测片1的表面粗糙度,检测片1的制造精度无法满足血细胞分析仪的使用要求,造成检测结果不准确。
63.本实施例的第二区域20的厚度d大于或等于0.6mm且小于或等于1.5mm。因此,检测片1的第二区域20的厚度d为0.6-1.5mm,以使检测片1的强度可以满足血细胞分析仪的实际使用要求,同时检测片1的表面粗糙度和检测片1的制造精度可以满足血细胞分析仪使用要求,血细胞经过检测孔11时堵塞现象大幅减少;即检测片1在保证血细胞分析仪使用强度要求的同时,也保证了检测片1的制造精度,降低检测片1的生产制造成本,提高了检测结果的准确性,降低了血细胞分析仪使用过程中的故障率。
64.可选地,检测片1通过第二区域20(或第二区域40)安装于供血细胞流动的流道内,检测片1与流道的接触面的径向尺寸大于1.5mm,例如第二区域20与流道的接触面的径向尺寸为1.6mm、2mm、2.5mm或3mm;其中,径向尺寸为沿检测片1的径向方向的尺寸。例如,检测片1的轮廓为圆形,第一区域10的截面形状呈圆形,第二区域20的截面形状均呈环形状,则检测片1与流道的接触面的径向尺寸等于检测片1的径向半径(径向尺寸)与第一区域10的径向半径(径向尺寸)之差;在检测片1的径向半径为3.5mm,第一区域10的径向半径为1.5mm的情况下,检测片1与流道的接触面的径向尺寸为2mm。
65.在检测片1与流道的接触面的径向尺寸小于1.5mm的情况下,由于检测片1与流道的接触面的径向尺寸过小,检测片1的两侧在流道内存在压力差,导致接触面在检测过程中造成液体泄露的情况。因此,本实施例的检测片1与流道的接触面的径向尺寸大于1.5mm,能够防止检测片1与流道的接触面在检测过程中造成液体泄露的情况,提高了检测结果的准确性。
66.可选地,检测片1的径向尺寸大于3.6mm,例如检测片1的轮廓为圆形,检测片1的径向直径(即径向尺寸)大于3.6mm,检测片1的径向直径为4mm、5mm、6mm或7mm。本实施例的检测片1的径向尺寸大于3.6mm,能够避免影响血细胞通过检测孔11,方便检测片1安装于流道内。
67.例如,检测片1的径向直径为7mm,检测片1与流道的接触面的径向尺寸为2mm,则检测片1与流道未接触部分的径向尺寸为7-2-2=3mm,此时检测片1与流道的接触面的面积为:πx3.5x3.5-πx1.5x1.5=31平方毫米。
68.可选地,检测片1的两侧的压力差为25-35kpa,即在检测片1设置于流道内,检测片1的两侧压力差为25-35kpa,例如检测片1的两侧压力差为25kpa、28kpa、30kpa、32kpa、34kpa或者35kpa。检测片1的两侧具有压力差,使得血细胞能够按照规定的方向从检测孔11流动通过,满足检测需求。而且设置成为不同的压力差,能够满足不同类型样本(如黏稠度不同)、不同流动速度的检测需求,提高了检测片1能够应用的范围。本实施例的检测片1的两侧的压力差为25-35kpa,以使血细胞能够顺利地通过检测孔11,能够避免血细胞经过检测孔11时出现堵塞现象。
69.可选地,检测孔11的表面粗糙度大于或等于0.08μm且小于或等于0.12μm,例如检测孔11的表面粗糙度为0.08μm、0.09μm、0.1μm、0.11μm或0.12μm。由于本技术的检测片1为塑胶件,采用注塑成型的工艺制造检测片1,因此检测孔11的表面粗糙度通常比较大,以使检测孔11的表面粗糙度不达标,导致血细胞经过检测孔11的时候出现堵孔的现象;而检测孔11的表面粗糙度越低,检测孔11的制造工艺难度越大,导致制造成本增加;经过发明人长时间的研究分析,本实施例的检测孔11的表面粗糙度大于或等于0.08μm且小于或等于0.12μm,既符合血细胞分析仪的试剂使用要求,也能降低检测孔11的制造成本和装配成本,进而
使得血细胞通过检测片1的检测孔11更加流畅。
70.请参见图4-5所示,图4是本技术提供的试剂盒的第一实施例的结构示意图;
71.图5是图4中的试剂盒的一视角的剖面示意图。本实施例的试剂盒2包括盒体21和上述实施例所揭示的检测片1。
72.其中,盒体21包括前池211、后池212和过孔213,过孔213设置于前池211和后池212之间,前池211、后池212和过孔213形成上述实施例所揭示的流道。其中,前池211、后池212和检测片1可拆卸连接,检测片1固定于过孔213的一端,以使位于前池211的细胞逐一通过检测片1的检测孔11到达后池212。本实施例的前池211、后池212和检测片1可拆卸连接,以便于前池211、后池212和检测片1进行装配。
73.可选地,检测片1通过焊接固定于过孔213的一端;或者,检测片1通过粘贴固定于过孔213的一端;或者,检测片1通过销钉紧压固定于过孔213的一端;通过上述固定方式,能够降低检测片1在试剂盒2的装配难度。其中,检测片1固定于过孔213靠近后池212的一端。
74.可选地,前池211设置有前池电极214,后池212设置有后池电极215。其中,前池电极214和后池电极215连接恒流电源,由于细胞具有不良导体的特性,细胞通过检测片1的检测孔11的时候,前池电极214和后池电极215之间的电阻会发生变化,进而在前池电极214和后池电极215上形成一个与细胞体积成比例的脉冲信号;在多个细胞连续通过检测孔11,前池电极214和后池电极215上产生多个电脉冲,而电脉冲的脉冲格数与通过检测孔11的细胞数量相当,进而实现细胞计数。
75.其中,前池211和后池212可以设置有两组,分别用于进行wbc(white blood corpuscle,白细胞)检测和rbc(red blood cells,红细胞)检测。在其他实施例中,前池211和后池212还可以设置一组或至少三组等。
76.其中,前池电极214的轴线和后池电极215的轴线大致在一条直线上,经实验验证,前池电极214的轴线和后池电极215的轴线同轴时检测的精度相对较高。在其他实施例中,前池电极214的轴线和后池电极215的轴线也可以不在一条直线上。
77.可选地,盒体21包括与前池211连通的安装腔22和后池本体23,后池本体23设置于安装腔22内,以使后池本体23形成后池212。其中,后池电极215设置于后池本体23上,例如后池电极215通过异形件包胶工艺安装在后池本体23上,以使前池电极214和后池电极215间隔位于检测片1的两侧。其中,后池本体23设置有轴向引流腔231,轴向引流腔231和前池211通过检测片1连通。
78.本技术实施例还提供一种poct血细胞分析仪,其包括检测座,检测座用于与上述的试剂盒2相配合,poct血细胞分析仪用于对样本进行分析检测。
79.以上所述仅为本技术的实施方式,并非因此限制本技术的专利范围,凡是利用本技术说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本技术的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1