广谱新冠病毒蛋白液相芯片、试剂盒、检测方法和应用与流程
本发明属于生物医学领域,具体而言,涉及广谱新冠病毒蛋白液相芯片、试剂盒、检测方法和应用。
背景技术:
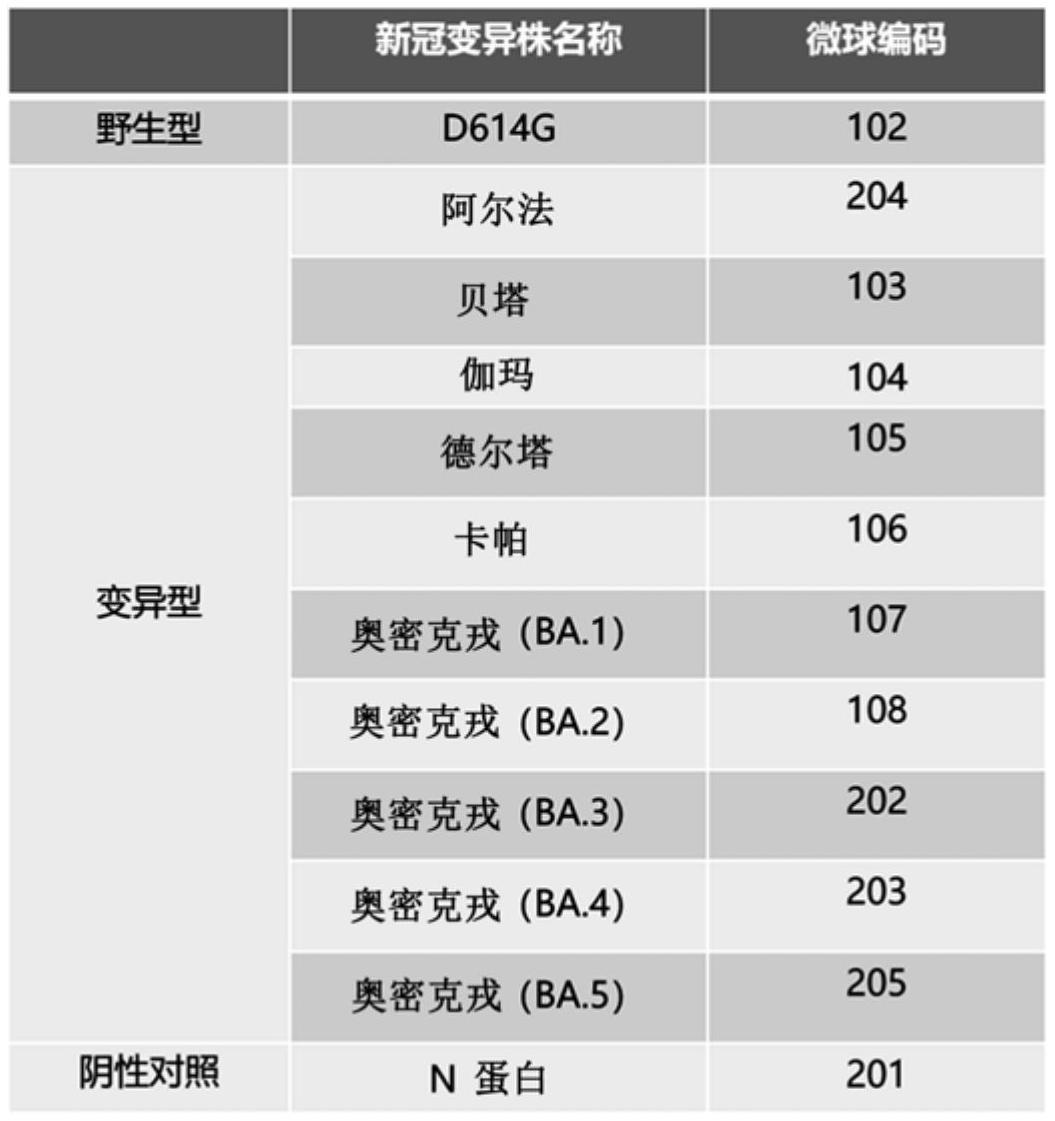
1、新冠病毒为单股正链rna病毒,其基因组在复制的过程中极易发生突变。随着新冠病毒在全球范围的不断传播,其病毒基因组序列发生改变产生了多种新冠病毒变异毒株,其中d614g、alpha(阿尔法)、beta(贝塔)、gamma(伽玛)、delta(德尔塔)、kappa(卡帕)和omicron(奥密克戎)变异株等表现出更高的传播性,而且对疫苗和中和抗体药物的抵抗力更高,给新冠病毒感染的预防和治疗带来巨大挑战。在缺乏有效治疗药物的情况下,安全且有效的新型冠状病毒肺炎疫苗是控制新冠疫情最有效的方法。新冠病毒中和抗体水平的检测是疫苗免疫效果评价的主要方法。中和抗体是免疫系统产生的一种保护性抗体,能够识别并阻止病原体结合到宿主细胞上,发挥保护效应,是评估疫苗效果,监测感染率、群体免疫和保护性免疫的标准。因此,快速、准确、高灵敏度和易操作的中和抗体检测方法,无论是对新冠肺炎治疗,还是对疫苗有效性的评估,都是十分重要的。
2、目前评估新冠中和抗体的检测主要有病毒侵染法(包括真病毒和假病毒中和试验)和免疫阻断法(包括酶联免疫法、化学发光法和poct试纸条)。真病毒中和试验是检测中和抗体的金标准,需要使用活病毒蚀斑减少中和试验(prnt),在高安全性实验室s3中进行;假病毒中和实验也需要细胞,并在一定安全级别的p2实验室完成,无法在大规模人群中应用。基于免疫阻断法的中和性抗体检测技术简单快速,在常规实验室就可操作,但仍存在以下问题:1)每次只能检测一种变异毒株,而检测多种毒株需要成倍的时间、样本和试剂用量,检测成本大大提高。2)每种突变体的中和性抗体反应相对独立,容易受到操作者、环境和试剂的影响,导致分析误差增加,影响结果的可比性。
技术实现思路
1、为解决上述现有技术中所存在的问题,本发明提供了广谱新冠病毒蛋白液相芯片、试剂盒、检测新冠病毒中和抗体的方法和应用。
2、具体而言,本发明提供了:
3、(1)一种广谱新冠病毒蛋白液相芯片,包括至少两种来自不同新冠病毒毒株的新冠病毒蛋白和至少两种作为载体的荧光编码微球,其中每种所述新冠病毒蛋白分别各自与一种荧光编码微球偶联,并且不与其他的荧光编码微球偶联,其中所述新冠病毒毒株包括奥密克戎ba.4毒株。
4、(2)根据(1)所述的液相芯片,其中所述新冠病毒蛋白选自新冠病毒毒株的s三聚体蛋白、s单体蛋白和rbd蛋白。
5、(3)根据(1)所述的液相芯片,其中所述新冠病毒毒株还包括d614g、阿尔法、贝塔、伽玛、德尔塔、卡帕和奥密克戎ba.1、ba.2、ba.3和ba.5毒株。
6、(4)根据(1)所述的液相芯片,其中偶联在每种所述荧光编码微球上的每种所述新冠病毒蛋白的量为1-10μg/106个微球。
7、(5)根据(1)所述的液相芯片,其中所述荧光编码微球上包被有荧光染料和/或量子点,不同的荧光编码微球的荧光染料和/或量子点的颜色不同,和/或浓度不同,使得不同的荧光编码微球的光谱信号不同;优选地,所述荧光编码微球具有磁性。
8、(6)根据(1)-(5)中任一项所述的广谱新冠病毒蛋白液相芯片在检测新冠病毒中和抗体中的应用。
9、(7)一种检测新冠病毒中和抗体的方法,包括以下步骤:
10、1)提供根据(1)-(5)中任一项所述的广谱新冠病毒蛋白液相芯片;
11、2)将所述液相芯片与待测样品混合;
12、3)将ace2蛋白与步骤2)所得的混合物混合以使其与新冠病毒蛋白结合,其中所述ace2蛋白标记有标签以用于引入可检测物质从而进行新冠病毒蛋白检测;其中当所述可检测物质包含荧光分子时,该荧光分子的光谱信号与所述荧光编码微球的光谱信号不同;
13、4)从步骤3)所得的体系中去除游离的所述可检测物质;
14、5)用流式细胞仪分选步骤4)所得的液相芯片并进行所述新冠病毒蛋白检测,其中基于所述荧光编码微球的不同的光谱信号进行所述分选。
15、(8)根据(7)所述的方法,其中所述待测样品为接种过新冠疫苗的生物体的血清样本;优选地,所述血清样本的稀释倍数为1-100倍;优选地,步骤2)所述的混合在室温下避光进行1-3小时。
16、(9)根据(7)所述的方法,其中在步骤3)中,所述ace2蛋白与所述新冠病毒蛋白的重量比为1000:1至1:1;优选地,步骤3)所述混合在室温下避光进行0.5-2小时。
17、(10)根据(7)所述的方法,其中所述ace2蛋白所标记的标签包括含有或不含有荧光分子的以下物质:生物素、亲和素、链霉亲和素、地高辛抗体、组氨酸抗体、含ni亲和分子、荧光素酶、碱性磷酸酶和过氧化物酶;其中优选含有或不含有荧光分子的生物素。
18、(11)根据(7)所述的方法,其中所述可检测物质能够与所述ace2蛋白的所述标签特异性结合;优选地,所述可检测物质与所述ace2蛋白的重量比为8:1至1:1;优选地,所述可检测物质为荧光分子标记的链霉亲和素。
19、(12)一种液相芯片试剂盒,包括根据(1)-(5)中任一项所述的广谱新冠病毒蛋白液相芯片和ace2蛋白,其中所述ace2蛋白标记有标签以用于引入可检测物质从而进行新冠病毒蛋白的检测;优选地,所述ace2蛋白标记有生物素,并且所述试剂盒还包括荧光分子标记的链霉亲和素。
20、本发明与现有技术相比具有以下优点和积极效果:
21、本发明提出用液相芯片技术制备包括新冠变异毒株奥密克戎ba.4蛋白在内的多种新冠蛋白的蛋白芯片,利用荧光编码微球的多种不同发射光以及荧光标记ace2(血管紧张素转化酶2,新冠病毒入侵细胞的受体蛋白)蛋白与中和抗体之间的竞争结合,巧妙地实现了待测样品中针对多种新冠病毒蛋白的中和抗体的高通量检测,并且可同时针对多种变异株进行检测,包括d614g、阿尔法、贝塔、伽玛、德尔塔、卡帕和奥密克戎ba.1-ba.5。
22、本发明的中和抗体检测方法灵敏度高、特异性强、重复性好,可进行高通量检测,并且灵活性强、可比性高、可实现检测自动化,还可大量节省试剂样本与实验成本,用常规实验室即可操作,不依赖p2或p3实验室。与传统中和抗体检测技术相比具有极大的优势和临床价值。
23、基于上述发明构思,本发明首次制备了包括新冠变异毒株奥密克戎ba.4蛋白在内的多种新冠蛋白的液相芯片,为新冠病毒的研究及疫苗和药物的开发提供了新的有效平台。
技术特征:
1.一种广谱新冠病毒蛋白液相芯片,包括至少两种来自不同新冠病毒毒株的新冠病毒蛋白和至少两种作为载体的荧光编码微球,其中每种所述新冠病毒蛋白分别各自与一种荧光编码微球偶联,并且不与其他的荧光编码微球偶联,其中所述新冠病毒毒株包括奥密克戎ba.4毒株。
2.根据权利要求1所述的液相芯片,其中所述新冠病毒蛋白选自新冠病毒毒株的s三聚体蛋白、s单体蛋白和rbd蛋白。
3.根据权利要求1所述的液相芯片,其中所述新冠病毒毒株还包括d614g、阿尔法、贝塔、伽玛、德尔塔、卡帕和奥密克戎ba.1、ba.2、ba.3和ba.5毒株。
4.根据权利要求1所述的液相芯片,其中偶联在每种所述荧光编码微球上的每种所述新冠病毒蛋白的量为1-10μg/106个微球。
5.根据权利要求1所述的液相芯片,其中所述荧光编码微球上包被有荧光染料和/或量子点,不同的荧光编码微球的荧光染料和/或量子点的颜色不同,和/或浓度不同,使得不同的荧光编码微球的光谱信号不同;优选地,所述荧光编码微球具有磁性。
6.根据权利要求1-5中任一项所述的广谱新冠病毒蛋白液相芯片在检测新冠病毒中和抗体中的应用。
7.一种检测新冠病毒中和抗体的方法,包括以下步骤:
8.根据权利要求7所述的方法,其中所述待测样品为接种过新冠疫苗的生物体的血清样本;优选地,所述血清样本的稀释倍数为1-100倍;优选地,步骤2)所述的混合在室温下避光进行1-3小时。
9.根据权利要求7所述的方法,其中在步骤3)中,所述ace2蛋白与所述新冠病毒蛋白的重量比为1000:1至1:1;优选地,步骤3)所述混合在室温下避光进行0.5-2小时。
10.根据权利要求7所述的方法,其中所述ace2蛋白所标记的标签包括含有或不含有荧光分子的以下物质:生物素、亲和素、链霉亲和素、地高辛抗体、组氨酸抗体、含ni亲和分子、荧光素酶、碱性磷酸酶和过氧化物酶;其中优选含有或不含有荧光分子的生物素。
11.根据权利要求7所述的方法,其中所述可检测物质能够与所述ace2蛋白的所述标签特异性结合;优选地,所述可检测物质与所述ace2蛋白的重量比为8:1至1:1;优选地,所述可检测物质为荧光分子标记的链霉亲和素。
12.一种液相芯片试剂盒,包括根据权利要求1-5中任一项所述的广谱新冠病毒蛋白液相芯片和ace2蛋白,其中所述ace2蛋白标记有标签以用于引入可检测物质从而进行新冠病毒蛋白的检测;优选地,所述ace2蛋白标记有生物素,并且所述试剂盒还包括荧光分子标记的链霉亲和素。
技术总结
本发明提供了广谱新冠病毒蛋白液相芯片、试剂盒、检测方法和应用。所述广谱新冠病毒蛋白液相芯片包括至少两种来自不同新冠病毒毒株的新冠病毒蛋白和至少两种作为载体的荧光编码微球,其中每种所述新冠病毒蛋白分别各自与一种荧光编码微球偶联,并且不与其他的荧光编码微球偶联,其中所述新冠病毒毒株包括奥密克戎BA.4毒株。基于本发明的液相芯片进行中和抗体的检测,可实现灵敏度高、特异性强、重复性好、高通量的检测,并且灵活性强、可比性高、可实现检测自动化,还可大量节省试剂样本与实验成本,用常规实验室即可操作。
技术研发人员:胡迪
受保护的技术使用者:旦生(北京)医学科技有限责任公司
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!