动态可控式水凝胶SERS基底及应用及制备方法
本发明属于微纳传感与微流控,面向癌症标志物检测,涉及三维动态水凝胶亲和基底动态可控式水凝胶sers基底及应用及制备方法。
背景技术:
1、在表面增强拉曼散射(sers)应用中,理想的检测基底不仅要具有高的增强因子、长期的稳定性和优异的可重复性,而且要使目标以足够的数量和亲和力进入增强区域。到目前为止,在基底制造领域已经有了百花齐放的发展趋势,按其状态可分为固态和液态基底。对于固态基底,虽然具有显著的再现性和稳定性,但不仅需要耗时费力的制备过程,而且由于光波长的限制,很难突破10nm的光学分辨率极限,导致sers增强效果不理想。而液态溶胶基底可以通过改变反应条件灵活调节纳米颗粒之间的距离,从而产生更强的电磁增强,提高检测灵敏度。然而,其常见的缺点是难以控制颗粒聚集,导致聚集体之间差异大或有效作用时间短,使得sers检测结果的再现性较差,这也被认为是阻碍定量检测应用的关键因素。因此迫切需要开发一种集固液态基底优势于一体的新型sers基底,用于痕量目标物的灵敏定量检测。
技术实现思路
1、本发明的目的是为了提供一种集固液态基底优势于一体的新型sers基底,本发明利用具有低光谱背景、长期稳定性、强抗干扰性等优异特性的水凝胶材料,制备了动态可控式的悬浮态基底,并合理利用核酸自组装技术使其具有强大的靶标亲和性,为检测复杂环境中的痕量目标物提供有效的解决方法。
2、为实现上述目的,本发明提供的技术方案是:
3、一种动态可控式水凝胶sers基底,包括聚丙烯酰胺凝胶基底物,功能化纳米银agnps颗粒,8条dna链:aptamer、initiator、h1、h2、h3、hp、cp、l,其序列如seq id no:1-8所示;其中,hp的5’端和3’端分别修饰荧光和猝灭基团对;
4、所述荧光和淬灭基团对选自fam和bhq1;
5、所述的8条dna链,其序列(5’-3’)分别是:
6、
7、其中,ap是cd63的适配体,in是引发剂,h1、h 2、h 3、hp是发夹结构,cp是捕获探针,l是修饰丙烯酰基的连接凝胶基底与银纳米颗粒的连接链;cd63是跨膜四超家族蛋白成员之一,与多种细胞功能有关,是本专利的检测目标物。
8、-sh是巯基(-(ch2)6-sh)的缩写,通过ag-s键将cp固定在agnps颗粒上。
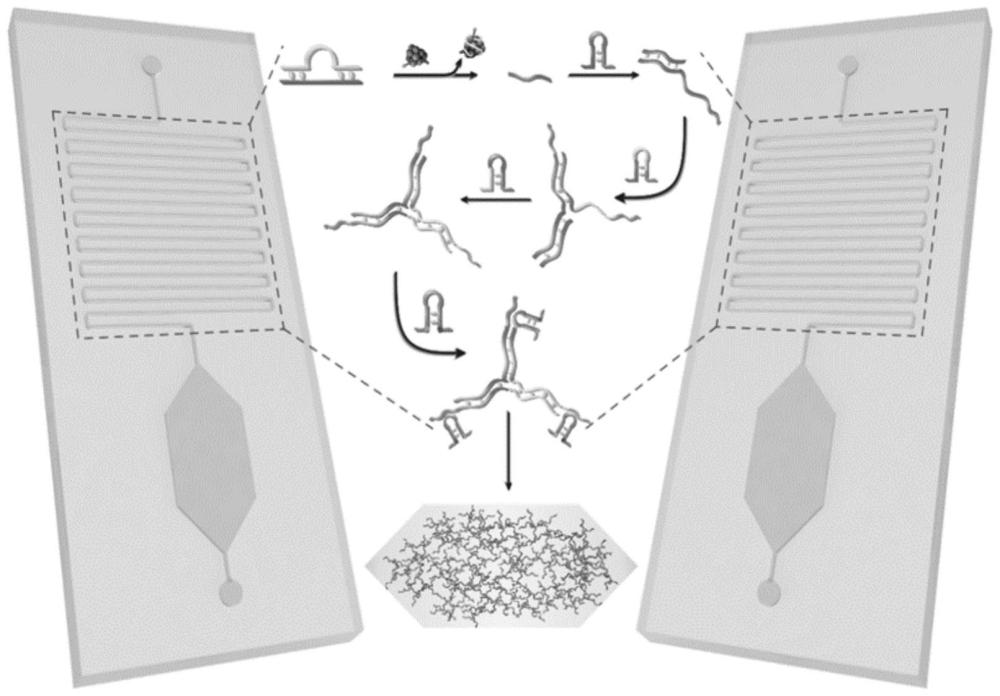
9、hp有两个官能团修饰,fam作为sers报告分子,当hp不被切割时,荧光信号被bhq1猝灭。
10、进一步的,
11、具有相同特征的序列之间存在互补碱基配对,包括,ap和in的斜体序列,in、h1、h2、h 3的单、双以及波浪下划线部分预计会杂交;
12、h1、h 2、h 3的粗体部分是劈开的dnazyme功能区,用于切断hp的ra;ra代表组成rna的腺嘌呤核糖核苷酸,是dnazyme切割的断裂位点。
13、当含有cd63的外泌体存在时,通过适体与靶蛋白的特殊结合使ap-in双链解链并释放引发剂,诱导催化发夹组装使三个发夹(h1,h2和h3)连续组装形成稳定的三足dnawalker。暴露出walker末端的dnazyme功能区,其具有很高的催化活性,可以催化hp loop域的核糖核酸(ra)裂解。另外,由于在hp的3’/5’端分别修饰了fam和bhq1,因此hp处于发夹状态时不产生荧光,经切割拆解成两条自由单链(rp1和rp2)后荧光恢复。rp1通过与cp的耦合作用稳定地附着在agnps上,从而产生较强的sers信号。随后,所有产物沿着芯片通道进入基底腔,这里充满了装载agnps的水凝胶基底。值得注意的是,水凝胶基底应进行预干燥,以产生毛细作用力促使物质进入凝胶。由于凝胶的分子筛作用,阻拦了大分子物质进入凝胶,而对于所有小分子物质来说,只有rp1可以留在底物室中,因为它会通过互补碱基配对与agnps修饰的捕获探针偶联,未结合的样品则被移至出口。最后,水凝胶基底经热脱水后收缩,导致agnps的距离明显减小,产生大量热点以增强sers检测信号。
14、本发明还提供了一种装载有上述的动态可控式水凝胶sers基底的微流控芯片。
15、本发明还提供了一种装载有动态可控式水凝胶sers基底的微流控芯片的制备方法,包括以下步骤:
16、步骤s1,制备pdms微流控芯片;
17、所述的步骤s1中,包括以下步骤:
18、使用autocad软件设计用于在光刻胶覆盖的玻璃载玻片上压印图案的pdms模具;
19、利用高分辨率掩模对准器在硅片上加工负su-8 2100光刻胶模具;
20、将pdms预聚体与固化剂按10:1(w/w)的比例混合,用真空泵除去气泡;
21、为了形成梭状腔室,使用不锈钢块隔离形成空腔结构;
22、将脱气后的pdms聚合物倒出后,将模具放入70℃烤箱中保存2小时;
23、将pdms层从模具中取出,并将不锈钢块从梭状腔中剥离;
24、在pdms层上打三个孔作为进、出口;
25、pdms层和载玻片经90s氧等离子体处理后,立即用玻片密封pdms层;
26、pdms梭状腔用于装载水凝胶基底。
27、步骤s2,合成并功能化agnps;
28、所述的步骤s2中,
29、agnps的制备具体为:根据柠檬酸盐还原法,将硝酸银溶解于蒸馏水中,搅拌加热,煮沸后加入1%柠檬酸钠,然后搅拌持续加热1h,自然冷却至室温;
30、制备的agnps保存于4℃;
31、agnps功能化步骤为低ph标记法,具体为将ph 7.0的tcep加入l链中,tecp是三(2-羰基乙基)磷盐酸盐,作为一种非硫醇还原剂,还原巯基之间形成的二硫键。室温孵育1h;然后将l和拉曼报告分子mgitc的混合物与agnps预混,然后分两次加入柠檬酸盐缓冲液,其间隔5min;逐渐添加nacl缓冲液;
32、在使用前,需要对功能化agnps进行三次离心洗涤处理,并最终分散在ph 7.4的0.5×pbs中。
33、步骤s3,在微流控芯片中原位聚合装载功能化agnps的水凝胶基底,并进行预干燥;
34、所述的步骤s3中,所述原位聚合装载功能化agnps的水凝胶基底步骤为:聚丙烯酰胺单体与亚甲基双丙烯酰胺交联剂的自由基共聚反应,在室温下进行聚合形成水凝胶基底;
35、具体为:将40% acry/bis溶液(29:1)与功能化agnps预混,用pbs调整凝胶的浓度,所得液体通入氮气吹除溶解氧。随后加入10% aps和temed,将混合后的胶体用注射器转移到底物腔中,在室温下进行聚合;
36、所述预干燥步骤为:将芯片基底腔部分打开,于50℃烘箱中干燥1h。
37、步骤s4,核酸探针制备,将链状发夹探针h1、h2、h3和hp退火形成发卡结构,将aptamer、initiator退火形成拱形探针;
38、步骤s4中,所述退火步骤为:溶液于95℃保温10min,缓慢冷却至室温。
39、步骤s5,将步骤s4的核酸产物混合并与系列浓度的外泌体标准液分别经两个入口由注射泵同时注入微流控芯片中,待体系注射完全后,注入pbs进行清洗;
40、步骤s5中,所述泵入步骤为:两个1ml注射器分别吸取200μl步骤s4的核酸混合液及等体积外泌体标准液,用硅胶软管连接芯片与注射器,将注射器固定在注射泵上,流速设置为20μl/min;
41、上述注射器再分别吸取200μl pbs缓冲液,以相同的流速进行清洗。
42、步骤s6,将步骤s5的芯片置于烘箱进行干燥;
43、所述干燥步骤为:将芯片基底腔部分打开,于50℃烘箱中干燥30min。
44、步骤s7,将步骤s6芯片进行sers检测。
45、步骤s7中,所述检测步骤为:在雷尼绍invia拉曼显微镜系统中进行sers测量,该系统安装了532和633nm的hene激光器、电荷耦合器件相机以及光谱分辨率为1cm-1的1800槽/mm光栅;激光通过50×显微镜物镜聚焦到样品上,光斑尺寸接近1.0μm;每个样品的积累次数和曝光时间分别为3s和1s,并且仅使用10%的激光功率;通过wire 5.5软件对所有拉曼光谱进行背景减除和平滑处理,然后获得5次或以上扫描的平均sers光谱,作为最终的sers结果。
46、与现有技术相比,本发明的有益效果是:
47、本发明的动态水凝胶基底具有灵敏度强、稳定性长、热点域可控等优点,克服了传统态基底的局限性;原位聚合制备sers基底,避免了复杂冗余的加工步骤,解决了基底与微流控芯片之间密封效果差的困境;核酸纳米技术解决了靶标进入有效热点区域亲和力或持久性差的问题,进一步放大了与靶标相关的信号,对任何类型的痕量物质都能进行灵敏检测,而且具有极强的特异性;微流控技术不仅缩短了核酸自组装反应时间,而且为即时检测提供了集成式的分析平台。本发明将有可能加速sers在定量检测中的应用,并可能对痕量肿瘤生物标志物的分析产生启发,从而为癌症筛查和早期检测提供一条有希望的途径。
- 还没有人留言评论。精彩留言会获得点赞!