一种硫酸阿米卡星注射液的质量检测方法与流程
本发明属于药物质量控制,具体涉及一种硫酸阿米卡星注射液的质量检测方法。
背景技术:
1、硫酸阿米卡星注射液是一种广谱抗生素,主要用于治疗严重的细菌感染,包括败血症、感染性休克、中枢神经系统感染、肾功能衰竭等。硫酸阿米卡星的主要成分阿米卡星,能够抑制细菌的蛋白质合成,从而破坏细菌的细胞壁,达到杀菌效果。这种药物对某些对其他抗生素耐药的细菌具有高效、低毒的特性,尤其对肠杆菌、绿脓杆菌等具有强大的抗菌作用。
2、硫酸阿米卡星注射液通常含有杂质a、杂质b、杂质e、杂质f、杂质h,具体结构式如下:
3、杂质a:
4、
5、杂质b:
6、
7、杂质e:
8、
9、杂质f:
10、
11、杂质h:
12、
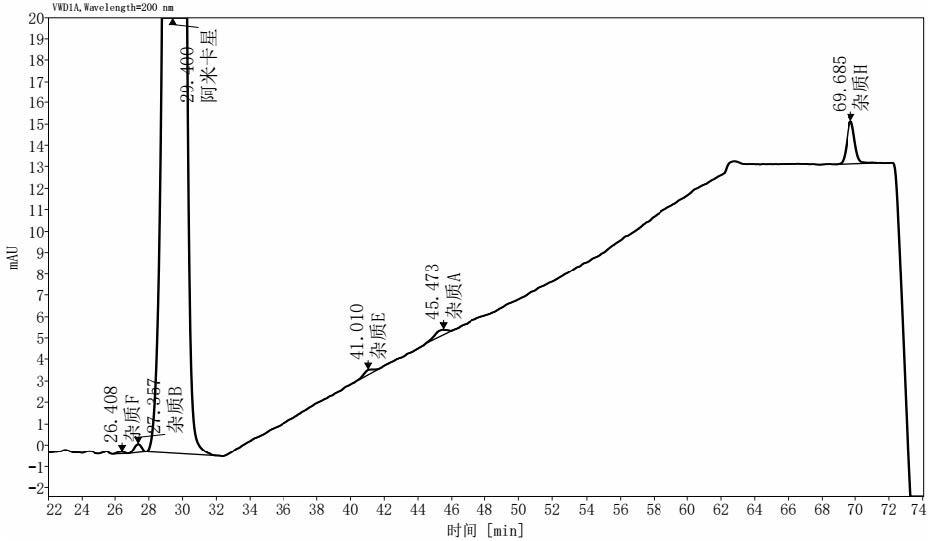
13、为了保证硫酸阿米卡星注射液的药品治疗,在生产过程中对于硫酸阿米卡星注射液有必要进行质量检测。《中国药典》中规定了对于硫酸阿米卡星注射液的质量检测方法,其中包括对杂质a、杂质e和杂质f的检测。由于杂质b具有与杂质a、杂质e和杂质f非常相似的官能团,因此,可以推测杂质b也可能具有与杂质a、杂质e和杂质f相似的毒性。然而,实际应用发现,《中国药典》中公开的方法并不能够对杂质b进行很好的分离,这对于全面控制硫酸阿米卡星注射液的治疗不利。因此,本领域亟需开发新的硫酸阿米卡星注射液的检测方法,实现对杂质b的分离和检测。
技术实现思路
1、针对现有技术的问题,本发明提供一种硫酸阿米卡星注射液的质量检测方法。
2、一种硫酸阿米卡星注射液的质量检测方法,包括如下步骤:
3、步骤1,稀释硫酸阿米卡星注射液,得到供试品溶液;
4、步骤2,采用hplc检测所述供试品溶液,得到hplc图谱;
5、其中,色谱条件为:
6、流动相的选择为:以磷酸盐缓冲液、磷酸溶液和乙腈按照体积比946:(10-100):(45-50)配制成流动相a,所述流动相a使用所述磷酸溶液调节ph为3.90-4.10;以磷酸盐缓冲液和乙腈按照体积比900:(95-100)配制成流动相b;
7、色谱柱为c18柱。
8、优选的,所述流动相的选择为:以磷酸盐缓冲液、磷酸溶液和乙腈按照体积比946:100: 50配制成流动相a,所述流动相a使用所述磷酸溶液调节ph为4.0;以磷酸盐缓冲液和乙腈按照体积比900:100配制成流动相b。
9、优选的,所述流动相a中,磷酸盐缓冲液的配制方法为: 0.15-0.25mol/l磷酸二氢钾溶液,用0.15-0.25mol/l磷酸溶液调节ph值至3.0,并加入18-20倍量的水进行稀释;
10、所述流动相b中,磷酸盐缓冲液的配制方法为:0.15-0.25mol/l磷酸二氢钾溶液,用0.15-0.25mol/l磷酸溶液调节ph值至3.0,并加入稀释16-18倍量的水进行稀释。
11、优选的,所述流动相a中,磷酸盐缓冲液的配制方法为:0.2mol/l磷酸二氢钾溶液,用0.2mol/l磷酸溶液调节ph值至3.0,并加入稀释19.57倍量的水进行稀释;
12、所述流动相b中,磷酸盐缓冲液的配制方法为:0.2mol/l磷酸二氢钾溶液,用0.2mol/l磷酸溶液调节ph值至3.0,并加入稀释17倍量的水进行稀释。
13、优选的,所述流动相a中,还包括浓度为1.7-1.9 g/l的辛烷磺酸钠和19-21g/l的硫酸钠;
14、所述流动相b中,还包括浓度为1.7-1.9 g/l的辛烷磺酸钠和19-21 g/l的硫酸钠。
15、优选的,所述流动相a中,还包括浓度为1.807 g/l的辛烷磺酸钠和20.08 g/l的硫酸钠;
16、所述流动相b中,还包括浓度为1.8 g/l的辛烷磺酸钠和20 g/l的硫酸钠。
17、优选的,所述色谱柱选自spursil柱,4.6mm×250mm,5μm。
18、优选的,所述色谱条件还包括:洗脱方式为线性梯度洗脱,洗脱梯度为:0-30 min,50%-50% 流动相a;30-60 min,50%-0% 流动相a;60-70 min, 0%-0% 流动相a;70-71 min,0%-50% 流动相a;71-100 min, 50%-50% 流动相a。
19、优选的,所述色谱条件还包括:流速为每分钟1.3-1.5ml;柱温为35-40℃;检测波长为200nm;进样体积10-20μl。
20、优选的,所述供试品溶液通过采用流动相a稀释硫酸阿米卡星注射液得到。
21、本发明对现有技术中硫酸阿米卡星注射液的hplc检测条件进行了优化,最终发现通过优化流动相的ph,能够将杂质b从硫酸阿米卡星注射液中分离出来,实现准确的检测。本发明完善了硫酸阿米卡星注射液的质量检测方法,有利于保障硫酸阿米卡星注射液的产品质量,具有很好的应用前景。
22、显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
23、以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
技术特征:
1.一种硫酸阿米卡星注射液的质量检测方法,其特征在于,包括如下步骤:
2.按照权利要求1所述的硫酸阿米卡星注射液的质量检测方法,其特征在于:所述流动相的选择为:以磷酸盐缓冲液、磷酸溶液和乙腈按照体积比946:100: 50配制成流动相a,所述流动相a使用所述磷酸溶液调节ph为4.0;以磷酸盐缓冲液和乙腈按照体积比900:100配制成流动相b。
3.按照权利要求1或2所述的硫酸阿米卡星注射液的质量检测方法,其特征在于:所述流动相a中,磷酸盐缓冲液的配制方法为: 0.15-0.25mol/l磷酸二氢钾溶液,用0.15-0.25mol/l磷酸溶液调节ph值至3.0,并加入18-20倍量的水进行稀释;
4.按照权利要求3所述的硫酸阿米卡星注射液的质量检测方法,其特征在于:所述流动相a中,磷酸盐缓冲液的配制方法为:0.2mol/l磷酸二氢钾溶液,用0.2mol/l磷酸溶液调节ph值至3.0,并加入稀释19.57倍量的水进行稀释;
5.按照权利要求1或2所述的硫酸阿米卡星注射液的质量检测方法,其特征在于:所述流动相a中,还包括浓度为1.7-1.9 g/l的辛烷磺酸钠和19-21g/l的硫酸钠;
6.按照权利要求5所述的硫酸阿米卡星注射液的质量检测方法,其特征在于:所述流动相a中,还包括浓度为1.807 g/l的辛烷磺酸钠和20.08 g/l的硫酸钠;
7.按照权利要求1所述的硫酸阿米卡星注射液的质量检测方法,其特征在于:所述色谱柱选自spursil柱,4.6mm×250mm,5μm。
8.按照权利要求1所述的硫酸阿米卡星注射液的质量检测方法,其特征在于:所述色谱条件还包括:洗脱方式为线性梯度洗脱,洗脱梯度为:0-30 min,50%-50% 流动相a;30-60min,50%-0% 流动相a;60-70 min, 0%-0% 流动相a;70-71 min, 0%-50% 流动相a;71-100min, 50%-50% 流动相a。
9.按照权利要求1所述的硫酸阿米卡星注射液的质量检测方法,其特征在于:所述色谱条件还包括:流速为每分钟1.3-1.5ml;柱温为35-40℃;检测波长为200nm;进样体积10-20μl。
10.按照权利要求1所述的硫酸阿米卡星注射液的质量检测方法,其特征在于:所述供试品溶液通过采用流动相a稀释硫酸阿米卡星注射液得到。
技术总结
本发明属于药物质量控制技术领域,具体涉及一种硫酸阿米卡星注射液的质量检测方法。本发明的检测方法包括如下步骤:步骤1,稀释硫酸阿米卡星注射液,得到供试品溶液;步骤2,采用HPLC检测所述供试品溶液,得到HPLC图谱;其中,色谱条件为:流动相的选择为:以磷酸盐缓冲液、磷酸溶液和乙腈按照体积比946:(10‑100):(45‑50)配制成流动相A,所述流动相A使用所述磷酸溶液调节pH为3.90‑4.10;以磷酸盐缓冲液和乙腈按照体积比900:100配制成流动相B;色谱柱为C18柱。本发明成功地从硫酸阿米卡星注射液中分离出了杂质B,实现了杂质B的准确检测,具有很好的应用前景。
技术研发人员:蒋达博,史凌洋,唐勇,谢雷,张安玲,李剑嵬,杨英红,黄芸枫
受保护的技术使用者:成都市海通药业有限公司
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!