一种使用液质联用检测TEM&SHV型β-内酰胺耐药酶的方法及其应用
本发明属于耐药微生物检测,具体涉及一种使用液质联用检测tem&shv型β-内酰胺耐药酶的方法及其在诊断细菌耐药性方面的应用。
背景技术:
1、自青霉素于20世纪40年代被发现并广泛应用于临床治疗以来,β-内酰胺类抗生素拯救了无数人的生命。该类药物具有高效和不良反应低的特点而被临床广泛使用,在细菌感染的治疗中占据重要地位。然而,由于长期的不规范使用,细菌耐药问题日益严重,现已成为全球面临的巨大挑战。β-内酰胺酶是一种针对β-内酰胺类抗生素的耐药酶,通过水解β-内酰胺结构使其开环而导致失活,是细菌对β-内酰胺类抗生素产生耐药性的重要原因之一,例如肠杆菌科包括大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌等,携带多种β-内酰胺酶,给临床诊断和治疗带来巨大压力。根据amber分类方法,将β-内酰胺酶分为a、b、c和d四类。β-内酰胺酶中代表的酶类有a类的tem、shv、ctx-m、kpc等,b类的ndm、vim、imp、gim等,c类的cmy、dha等,d类的oxa等。
2、a类β-内酰胺酶是目前四类β-内酰胺酶中分布最广,研究最多的酶。许多a类β-内酰胺酶具有水解三代头孢菌素和氨曲南的特征,被称为超广谱β-内酰胺酶(esbl),大多数esbls是tem或shv型酶的衍生物。1965年,研究者在一名为temoneira的希腊雅典患者的大肠埃希菌分离物中得到了tem-1,取该患者名字的前三个字母命名其为tem。tem-1仅对青霉素和早期头孢菌素具有抗性,对广谱头孢菌素几乎无活性,克拉维酸对其普遍起抑制作用。其后代的抗药性谱扩大到第二(头孢呋辛等),第三(头孢噻肟,头孢他啶等)和第四代头孢菌素(头孢吡肟等),单环类(氨曲南)甚至是β-内酰胺酶抑制剂(克拉维酸等)。shv是一种与tem具有相似水解活性的酶。shv-1最初于1972年被报道,它的水解底物谱类似于tem-1,但对氨苄青霉素的水解活性更好。shv-2是第一个被发现的shv类esbl,与shv-1的不同之处在于238位发生了由丝氨酸取代甘氨酸的突变,且研究发现,大多数具有esbl表型的shv变体在238位都存在此突变。此外,许多具有esbl表型的shv变体还存在240位赖氨酸取代谷氨酸的突变,例如shv-5,shv家族中另一个典型的esbl,与shv-1相比,即同时发生了238和240两个氨基酸位点的突变。有趣的是,238位和240位这两个位点的氨基酸突变与tem型esbls中的氨基酸突变相似。研究表明,238位的丝氨酸取代是对头孢他啶有效水解的关键,而240位的赖氨酸取代对头孢噻肟的有效水解至关重要。因此,这两类esbl酶大都对头孢他啶和头孢噻肟有很好的水解能力。研究发现,tem和shv关系密切。序列比对结果显示,tem和shv酶之间有63%-65%的同一性。根据bldb数据库统计,现已有超过200种tem型β-内酰胺酶和超过300种shv型酶。tem型和shv型esbls常见于大肠杆菌和肺炎克雷伯菌;当然,它们也存在于变形杆菌属、普罗维登斯属和肠杆菌科的其他属中。
3、通过早期高效准确的临床诊断,对临床用药做出有效指导,可以显著降低临床耐药性和死亡率。目前对β-内酰胺酶的检测包括三个方面,即表型的检测、基因水平检测和蛋白质水平检测。传统的mic实验、纸片实验、e-test等表型检测方法,需要对细菌进行分离和培养,既费时又只能确定耐药性,不能确定β-内酰胺酶的具体类型,且细菌的耐药表型是由耐药酶,外排泵,pbp蛋白等多种耐药因素共同决定的,结果干扰性比较大。基因的检测包括pcr、全基因检测等,该方法虽然可准确鉴定β-内酰胺酶基因型,但有研究表明,基因的成功表达受启动子,调控元件等多种因素影响,基因的检测并不能代表β-内酰胺酶的成功表达。对于耐药酶在蛋白水平的检测和定量,目前有基于抗原抗体反应的胶体金免疫层系技术以及rt-qpcr技术,针对本发明中的研究对象tem和shv酶,目前商品化抗体仅有tem-1有抗体且价格昂贵,不适用于临床大样本使用,而rt-qpcr技术需要提取mrna再进行分析,实验操作过程繁琐复杂,且易受多种因素影响,且批次效应明显,结果存在假阳性。基于液相色谱-串联质谱主要有基于maldi-tof-ms的检测技术,基于三重四极杆质谱的选择反应监测(selected reaction monitoring,srm),多反应监测(multiple reaction monitoring,mrm)等技术。srm/mrm实验是在三重四极杆质谱仪上进行的,前体离子在第一四极杆中选择,在第二四极杆中破碎,然后在第三个四极柱中选择目标特异性片段离子进行检测。通常,连续监测几个碎片离子。但是该方法需要花费时间用于前期的条件摸索以获得足够稳定的前体离子/产物离子对。
4、平行反应检测(parallel reaction monitoring,prm)技术是一种基于高分辨、高精度质谱的离子监测技术,能够对目标蛋白质、目标肽段(如发生翻译后修饰的肽段)进行监测,从而实现对目标蛋白质/肽段的定量。prm以高分辨率和高质量精度分析来自前体离子的所有产物离子。prm质量准确度可达ppm级,能比srm/mrm更好地消除背景干扰和假阳性,有效提高复杂背景下的检出限和灵敏度。prm无需选择离子对和优化碎裂能量,更容易建立分析。虽然prm相较wb等传统方法来说通量较高,但是仍然受到通量问题的困扰,即使采用窄窗口保留时间,也难以在一个采集时间中同时检测上百条肽段。此外,prm对保留时间依赖性较高,如液相条件变更,需重新建立检测方法。目前出现了更高通量的且不依赖于保留时间的检测模式即基于prm改进的surequant方法。surequant使用内标肽段进行一个低分辨,低离子注入时间的prm预扫(内标添加量较高,因此不会受到灵敏度影响),紧接着在线对该扫描进行实时谱图检索,如果匹配到目标序列则触发对应内源肽段的高分辨、高离子注入时间的prm扫描用于定量。如果一级扫描中未检测到内标肽段,那么就不会触发内源肽段的检测,因而能节省单个时间点内扫描的个数,只针对性的扫目标肽段信息,所以节省了扫描次数,使得扫描通量显著增加。迄今为止尚无采用surequant扫描技术检测β-内酰胺酶的报道。
5、在样品前处理中,待分析的样品经过预处理使样品中的完整蛋白质转化为肽段。预处理包括蛋白酶消化和化学反应两种方式,且酶解处理优先于物理化学处理,因为其更能保护蛋白结构并且更易控制。胰蛋白酶(trypsin)是一种目前被广泛应用的蛋白水解酶,能特异性酶切赖氨酸和精氨酸c端的肽键。它的两个主要优势是:
6、(1)酶切位点特异性高;(2)酶解得到的肽段产物两端各有一个碱性基团,有利于质谱的鉴定。但是由于胰酶在赖氨酸上的酶切效率比较低,常常产生不完全酶解的肽段,影响定量结果。因此,选择合适的定量肽,对准确的绝对蛋白质定量很重要:(1)首先,为确保所选择的定量肽是被完全酶解的肽段,要避免肽段的中间存在酶切位点(k/r)或两端存在kk/rr/kr/rk;(2)其次,为确保所选择的定量肽的稳定性,要避免肽段中存在易发生化学修饰的肽,一般来说m容易氧化,在选择时应被剔除。
技术实现思路
1、针对现有技术的不足,本发明的目的在于应用高灵敏度、高分辨率、高精确度的蛋白质谱检测技术(nanolc-orbitrap fusion lumos)和surequant数据采集方法,提供一种使用液质联用检测tem&shv型β-内酰胺耐药酶的方法及其在诊断细菌耐药性方面的应用,通过在质谱检测过程中对样品中的特定肽段进行定量,进而推断出该类酶在细菌中的表达情况,由此诊断细菌的耐药性,为临床耐药菌的诊断和治疗提供重要依据和技术支撑。
2、具体来说,本发明提供了如下技术方案:
3、本发明首先提供一种使用液质联用检测tem&shv型β-内酰胺耐药酶的方法,本发明的发明人通过构建shv-2,shv-11,tem-1,tem-52表达质粒与表达菌株,诱导表达并纯化,将获得的酶进行酶切,获得一系列肽段,通过ncbi blast检索,确定tem&shv的特异性肽段信息如下,m/z数值根据检测仪器不同可能会有差异,但差异<1:
4、tem no.1daedqlgar,487.73038m/z;
5、tem no.2wepelneaipnder,571.26764m/z;
6、tem no.3epelneaipnder,763.36023m/z;
7、tem no.4ihysqndlvk,608.82056m/z;
8、shv no.5svlpagwfiadk,652.35608m/z;
9、shv no.6nqqiagigaaliehwqr,635.67505m/z;
10、shv no.7wetelnealpgdar,800.88641m/z;
11、shv no.8lsesqlsgr,488.7562m/z;
12、shv no.9qsesqlsgr,496.24356m/z;
13、shv no.10vdagdeqlerk,630.31592m/z。
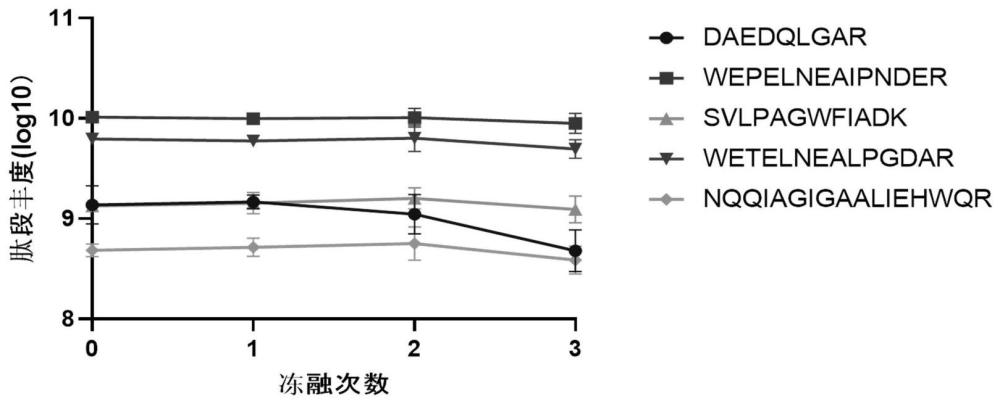
14、本发明进一步从得到的上述特异性肽段信息中筛选响应值高、稳定性好、定量准确的特征肽段,即为tem no.1、tem no.2、shvno.5、shv no.6、shv no.7。
15、本发明不限制待测样品种类及来源,涂布平板获得单菌落即可进行检测。
16、作为优选,所述tem no.1在质谱中所产生的检测信号的母离子具有m/z487.73038的质荷比;
17、所述tem no.2在质谱中所产生的检测信号的母离子具有m/z571.26764的质荷比;
18、所述shv no.5在质谱中所产生的检测信号的母离子具有m/z652.35608的质荷比;
19、所述shv no.6在质谱中所产生的检测信号的母离子具有m/z635.67505的质荷比;
20、所述shv no.7在质谱中所产生的检测信号的母离子具有m/z800.88641的质荷比。
21、作为优选,所述液质联用中的质谱检测结果采用surequant靶向蛋白组方法进行数据采集,并通过skyline软件定量分析;以特征肽段与已知肽段的肽谱图比值rdotp评价其是否为耐药酶表达菌株,并以特征肽段与已知浓度的内标肽段峰面积比值获得特征肽段浓度。
22、本发明通过对液相色谱分离后的肽段进行surequant检测,得到质谱数据,对所述质谱数据进行定量分析,得到tem&shv型β-内酰胺耐药酶的定量结果,大大提高检测灵敏度和准确度。
23、作为优选,所使用的内标肽段为da*edqlgar,wepelnea*ipnder,svlpagwfia*dk,nqqia*gigaaliehwqr,wetelnea*lpgdar,a*表示丙氨酸中所有c置换为13c,所有n置换为15n。
24、进一步优选的,所述内标肽段da*edqlgar在质谱中所产生的检测信号的母离子具有m/z 489.7341([m+2h]2+)的质荷比;
25、所述内标肽段wepelnea*ipnder在质谱中所产生的检测信号的母离子具有m/z572.6046([m+2h]2+)的质荷比;
26、所述内标肽段svlpagwfia*dk在质谱中所产生的检测信号的母离子具有m/z654.3954([m+2h]2+)的质荷比;
27、所述内标肽段nqqia*gigaaliehwqr在质谱中所产生的检测信号的母离子具有m/z637.0102([m+2h]2+)的质荷比;
28、所述内标肽段wetelnea*lpgdar在质谱中所产生的检测信号的母离子具有m/z535.5939([m+2h]2+)的质荷比。
29、本发明所使用的内标肽段,还可用其他可标记的氨基酸及标记形式,例如leu(13c6)、glu(n15)、tyr(15n)、pro(13c5,15n)、gly(13c2,15n)、ile(13c6,15n)、phe(13c9,15n)、gly(15n)、lys(13c6,15n)、ala(13c3,15n)、val(13c5,15n)、arg(13c6,15n4)、leu(13c6,15n)等标记的肽段。除了更大的质量外,重标肽段与天然肽的物理化学性质完全一致。将两种肽混合配置样品,经质谱检测,目标肽段和内标肽段的峰面积进行比较,就可对目标肽段进行定量,进而推断出其在细菌中的表达情况。
30、作为优选,所述液质联用中的液相色谱的色谱柱为:
31、预柱(reprosil-pur 120 c18-aq(3μm,dr.maisch gmbh,germany);20×0.05mm);
32、分析柱(reprosil-pur 120 c18(1.9μm,dr.maisch gmbh);130×0.15mm;
33、选用包含流动相a和流动相b的溶液为流动相,所述流动相a为0.1%甲酸水溶液,流动相b为含0.1%甲酸的80%乙腈,采用梯度洗脱,以所述流动相的总体积为100%计,
34、在第0~2min,所述流动相b的体积由11%递增为13%;
35、在第2~18min,所述流动相b的体积由13%递增为32%;
36、在第18~25min,所述流动相b的体积由32%递增为42%;
37、在第25~26min,所述流动相b的体积由42%递增为95%;
38、在第26~31min,所述流动相b的体积为95%。
39、作为优选,所述液质联用中的质谱检测的条件为:
40、ms1:orbitrap分析;分辨率,120000;质量范围:300~1500m/z;rf lens,30%;最大注入时间,50ms;
41、ms2:hcd,碰撞能量,32%;隔离窗口,1da;detector type,orbitrap。
42、作为优选,所述待测样品的前处理包括:
43、对待测样品(可以取单菌落进行检测)中的蛋白进行提取,采用胰蛋白酶对所述蛋白进行酶解。
44、进一步优选的,所述酶解的方式为膜上酶切和/或溶液内酶切。
45、进一步优选的,所述酶解为微波辅助酶解,具体为:加入胰蛋白酶后,先在微波条件下处理0-4min,然后在50-60℃下酶解10-60min。
46、本发明实验发现,采用溶液内酶切的方式,先在微波条件下处理0-4min,然后在50-60℃下酶解10-60min,可以对所选的5条多肽标志物组合进行有效酶解,证明了溶液内酶解的可行性,为基于96孔板高通量样品前处理的方法的开发提供了基础。
47、作为优选,所述液质联用的仪器为高分辨液质联用仪nanolc1200-orbitrapfusion lumos(thermo fisher scientific)。
48、本发明进一步提供上述的使用液质联用检测tem&shv型β-内酰胺耐药酶的方法在诊断细菌耐药性方面的应用。
49、本发明具有如下有益效果:
50、1)本发明提供的使用液质联用检测tem&shv型β-内酰胺耐药酶的方法,通过采用特定的特征肽段,可以从肽段水平快速准确直接检测tem&shv型β-内酰胺耐药酶是否表达,减少假阳性的产生;
51、2)本发明提供的使用液质联用检测tem&shv型β-内酰胺耐药酶的方法,通过采用surequant的方法,大大提高检测灵敏度和准确度,数据处理简单,快速。
52、3)传统酶切方法需要过夜,本发明提供的使用液质联用检测tem&shv型β-内酰胺耐药酶的方法,通过采用特定的微波炉辅助酶切的方法,缩短的蛋白酶切及前处理的时间,同时其适用于溶液内酶切,使大批量处理,例如96孔板处理样品成为可能。
- 还没有人留言评论。精彩留言会获得点赞!