一种优化恩格列净片剂溶出曲线及体内生物等效性的方法与流程
本发明属于药物制剂分析,尤其涉及一种优化恩格列净片剂溶出曲线及体内生物等效性的方法。
背景技术:
1、目前,恩格列净片剂的常规溶出检测条件是参考中国药典中第二法浆法进行,但是发明人发现市售不同型号的微晶纤维素会大大影响恩格列净片剂溶出过程中的崩散状态,进而影响溶出曲线结果以及生物等效性。而且目前针对该制剂没有标准或者相对标准的溶出曲线,都是企业自行开发。因此,有必要针对恩格列净片剂的溶出曲线进行优化和规范化。
技术实现思路
1、有鉴于此,本发明旨在开发一种优化恩格列净片剂溶出曲线及体内生物等效性的方法,以对恩格列净片剂的溶出曲线的标准化和规范化提供参考。
2、为达到以上技术目的,本发明采用的技术方案如下:
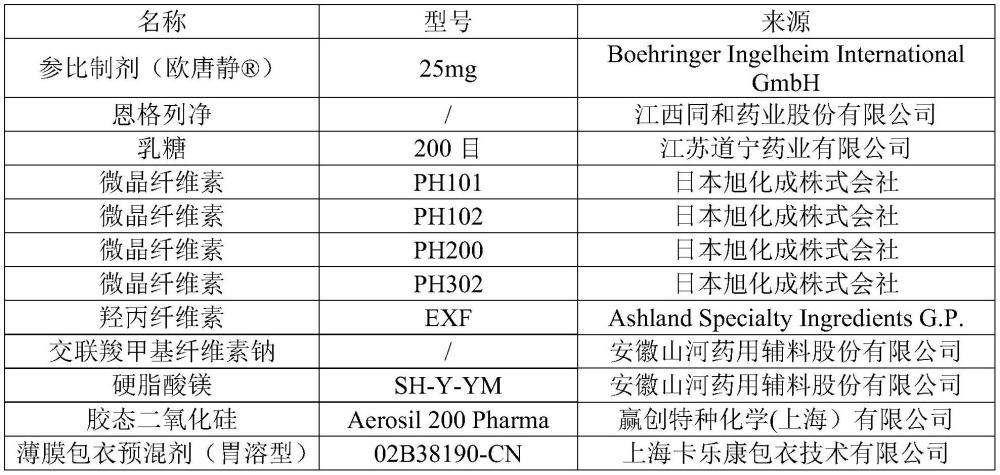
3、第一方面,本发明提供一种优化恩格列净片剂溶出曲线及体内生物等效性的方法,所述恩格列净片剂按照质量百分比的成分组成为:恩格列净4-15%,乳糖50-70%,微晶纤维素20-30%,羟丙纤维素2-4%,交联羧甲纤维素钠1-3%,胶态二氧化硅0-2%,硬脂酸镁0-2%;所述微晶纤维素的中位粒径为100~180μm,堆密度为0.29~0.46g/ml;采用浆法溶出,控制条件包括:温度为37±1℃,溶出介质的ph为1.0-6.8,转速为50~75rpm。
4、优选地,所述浆法溶出的过程包括:将一片恩格列净片放入900ml溶出介质中,然后定点取样进行hplc检测;所述恩格列净片的规格为10mg/片或者25mg/片。
5、优选地,所述定点取样时间点为5min、10min、15min、20min、30min。
6、优选地,所述溶出介质选自0.1m盐酸、ph4.5的酸性溶液、ph6.8的弱酸性溶液中的一种。
7、进一步优选地,所述ph4.5的酸性溶液包括醋酸盐缓冲液、磷酸盐缓冲液、或者柠檬酸盐缓冲液。
8、进一步优选地,所述ph6.8的弱酸性溶液包括醋酸盐缓冲液、磷酸盐缓冲液、或者柠檬酸盐缓冲液。
9、更为优选地,所述ph6.8的弱酸性溶液为ph6.8磷酸盐缓冲液。
10、优选地,所述微晶纤维素的中位粒径为180μm,堆密度为0.29~0.36g/ml。
11、优选地,所述转速为50rpm、60rpm或者75rpm。
12、进一步优选地,所述转速为50rpm。
13、和现有技术相比,本发明具有以下技术效果:
14、本发明选择中位粒径为100~180μm,堆密度为0.29~0.46g/ml的微晶纤维素作为辅料,并结合优化的溶出检测方法,可以满足自制样品与参比制剂在多条介质中溶出曲线相似,并保证与参比制剂体内疗效一致。
技术特征:
1.一种优化恩格列净片剂溶出曲线及体内生物等效性的方法,所述恩格列净片剂按照质量百分比的成分组成为:恩格列净4-15%,乳糖50-70%,微晶纤维素20-30%,羟丙纤维素2-4%,交联羧甲纤维素钠1-3%,胶态二氧化硅0-2%,硬脂酸镁0-2%;其特征在于,所述微晶纤维素的中位粒径为100~180μm,堆密度为0.29~0.46g/ml;采用浆法溶出,控制条件包括:温度为37±1℃,溶出介质的ph为1.0-6.8,转速为50~75rpm。
2.根据权利要求1所述的方法,其特征在于,所述浆法溶出的过程包括:将一片恩格列净片放入900ml溶出介质中,然后定点取样进行hplc检测;所述恩格列净片的规格为10mg/片或者25mg/片。
3.根据权利要求2所述的方法,其特征在于,所述定点取样时间点为5min、10min、15min、20min、30min。
4.根据权利要求1所述的方法,其特征在于,所述溶出介质选自0.1m盐酸、ph4.5的酸性溶液、ph6.8的弱酸性溶液中的一种。
5.根据权利要求4所述的方法,其特征在于,所述ph4.5的酸性溶液包括醋酸盐缓冲液、磷酸盐缓冲液、或者柠檬酸盐缓冲液。
6.根据权利要求4所述的方法,其特征在于,所述ph6.8的弱酸性溶液包括醋酸盐缓冲液、磷酸盐缓冲液、或者柠檬酸盐缓冲液。
7.根据权利要求6所述的方法,其特征在于,所述ph6.8的弱酸性溶液为ph6.8磷酸盐缓冲液。
8.根据权利要求1~7任一项所述的方法,其特征在于,所述微晶纤维素的中位粒径为180μm,堆密度为0.29~0.36g/ml。
9.根据权利要求8任一项所述的方法,其特征在于,所述转速为50rpm、60rpm或者75rpm。
10.根据权利要求9任一项所述的方法,其特征在于,所述转速为50rpm。
技术总结
本发明提供一种优化恩格列净片剂溶出曲线及体内生物等效性的方法,所述恩格列净片剂按照质量百分比的成分组成为:恩格列净4‑15%,乳糖50‑70%,微晶纤维素20‑30%,羟丙纤维素2‑4%,交联羧甲纤维素钠1‑3%,胶态二氧化硅0‑2%,硬脂酸镁0‑2%;其特征在于,所述微晶纤维素的中位粒径为100~180μm,堆密度为0.29~0.46g/mL;采用浆法溶出,控制条件包括:温度为37±1℃,溶出介质的pH为1.0‑6.8,转速为50~75rpm。本发明选择中位粒径为100~180μm,堆密度为0.29~0.46g/mL的微晶纤维素作为辅料,并结合优化的溶出检测方法,可以满足自制样品与参比制剂在多条介质中溶出曲线相似,并保证与参比制剂体内疗效一致。
技术研发人员:张立江,王燕敏,古国峰,马元战,王卫士,隋艳民
受保护的技术使用者:国药集团容生制药有限公司
技术研发日:
技术公布日:2024/3/12
- 还没有人留言评论。精彩留言会获得点赞!