一种IgE靶向药物的抗药抗体检测系统及方法与流程
本发明属于生物检测,是一种ige靶向药物的抗药抗体检测系统及方法。
背景技术:
1、过敏性疾病是一种超敏反应性疾病,常见的有特异性皮炎、过敏性鼻炎和过敏性哮喘。当个体暴露于过敏原时,活化b细胞分化成浆细胞,合成并分泌ige。ige的重链恒定区(fc片段)主要与效应细胞表面的ige受体中的高亲和力受体(fcεri)结合,介导过敏性炎症级联反应,导致个体出现炎症,严重时可能危及生命。由此可见,ige(免疫球蛋白e)在超敏反应中具有关键性作用,是药物治疗的关键点,也是药物开发的首选靶点。
2、以诺华和罗氏合作开发的奥马珠单抗为例,其作为全球首个治疗过敏性哮喘的ige靶向治疗药物,自上市以来累计销售额超过300亿美元,市场表现不俗。它的成功已经证明了ige靶点在过敏性疾病的有效性,反映出ige靶向药物所蕴含的巨大市场潜力,极大的增强了各厂商开发ige靶向药物的信心。当前已有很多厂商的ige靶向药物进入临床试验阶段,如诺华(ligelizumab,临床三期)、张江生物(cmab-007:aomaishu,临床三期)、罗氏(quilizumab,临床二期)、天辰生物(人源化人ige单克隆抗体注射液,临床一期)等,未来将会有越来越多的医药厂商布局ige靶向药物的开发和优化,ige靶向药物的研究已成为过敏性疾病的研究热点。
3、ige靶向药物作为大分子药物,具有免疫原性,可诱发个体的免疫应答,产生抗药抗体(anti-durg antibody,ada),一方面可能中和药物的生物学活性,导致药效显著降低;另一方面可能与内源性蛋白发生交叉反应,从而导致新的过敏反应以及细胞因子释放等,严重时可能危及生命。因此,在整个药物开发生命周期内,对ada进行检测和表征是必不可少的,故建立具有足够灵敏度和高度特异性的ada检测方法,对于药物的临床前及临床分析评价极为重要。
4、ige靶向药物靶点ige为分泌型免疫球蛋白,在健康个体中最高含量可达873.4ng/ml,在过敏性患者体内,浓度可显著提升10倍以上,变化显著。在ada检测过程中,一般以ige靶向药物为捕获试剂,而ige靶向药物与ige的特异性结合能力极强,故ige一定会与ada竞争结合捕获试剂,甚至其浓度变化会不同程度的影响检测结果。同时不同个体的ige水平不同,且ige的半衰期短,稳定性差,由此会进一步降低该检测方法的灵敏度、准确性、适用范围和稳定性。
5、针对ada检测过程中干扰去除,研究较多的是游离药物的干扰去除。在中国专利cn109358192a中,公布了一种去除抗药抗体检测样品中游离药物的装置和方法,其特征在于该装置将与药物特异结合的物质与固相载体偶联,且该物质不与除了游离药物以外的其它成分反应。发明人通过此药物吸附装置,很好地解决了ada分析中的药物干扰问题,但是根据其应用实例数据计算,该吸附装置在对药物浓度为4.41mg/ml的样品进行吸附测试时,吸附10分钟时的吸附清除率约为32%,在吸附20分钟时的吸附清除率约为33.3%,由此可见其吸附清除率约在30%左右,且不随时间推移而有显著变化。虽然游离药物、捕获试剂和检测试剂三者之间的主要区别在于标记分子或处理方式不同:游离药物为无处理游离状态;捕获试剂可能化学偶联在微珠上,或者物理吸附在孔板上;检测试剂则标记有生物素、荧光素或者钌,但是三者与靶标物质的结合能力无本质差异。当三者浓度差异低于10倍以下时,反应虽仍存在竞争,但检测结果与样品中ada浓度成正比,据此即可获得定性或半定量的检测结果。而ige靶向药物是人工筛选开发出的产品,与ige特异性结合能力强,在竞争反应中,可能是捕获试剂先与ige结合,过量的部分再结合ada,因此ada检测方法对靶点清除率比较敏感,清除率不足或存在细微差异都会显著影响ada的检测结果,因此将该发明专利直接转化应用于ada检测的靶点干扰去除,效果无法满足预期。
6、在中国专利cn115856322a中,公布了用于抗奥马株单抗药物抗体检测的试剂及其应用,其特征在于提供用于检测样品中抗奥马株单抗药物抗体的试剂,包括预处理试剂、解离试剂和检测试剂,可有效降低高浓度ige、奥马株单抗药物以及ige-奥马株单抗复合物对抗奥马株单抗药物抗体测定的影响。根据其应用实例的数据,并未测试10μg/ml以上浓度的ige干扰。由于ige对检测方法的干扰程度是随浓度提升而增强的,故无法根据实例数据推测上述方法是否可耐受更高浓度的ige干扰。而在过敏性患者体内,ige浓度通常在5μg/ml~20μg/ml之间,该方法显然无法满足所有样品的检测需求,需要建立至少可抵抗靶点干扰浓度为100μg/ml的检测方法。同时,在ada检测上,仅进行了0.1μg/ml和1μg/ml的抗奥马株单抗抗体检测,根据实例数据中的p/n(阳性样本测定值/阴性样本测定值)值推算,该方法灵敏度远达不到1ng/ml的要求。因而,该方法在实际应用过程中,存在较多不足,使用常规技术手段来改善优化该方法,恐难以达到预期要求。
7、在中国专利cn115667935a中,公布了一种使用抗靶抗体或者靶标受体及其辅因子来耗竭靶标(即靶点),从而减轻抗药抗体测定中靶标干扰的方法,同时还探究了多个条件下的测试效果,如不同ph、不同抗靶抗体、不同靶标受体及其辅因子浓度等。但根据其实例数据来看,靶标耐受浓度约为5μg/ml,无法满足ige靶向药物的抗药抗体检测的要求。其次根据应用实例显示,抗靶抗体,甚至可能会加剧抗药抗体检测过程中的假阳性,需要进行大量的抗靶抗体筛选。与此同时受体及其辅因子耗竭靶点的方法,并非适用于每个靶点,且重组表达出与人源化一致的受体及其辅因子,仍是一大难题。由此可见,该方法的局限性较大,恐难以广泛推广,进行规模化应用。
8、同时由于ige与ada同为免疫球蛋白,二者在结构上、理化性质上有较多的相似之处,常规的物理化学等处理方式,如酸化、加热、peg沉淀等处理方式,可能会导致ada与ige同步被去除。
9、因此,鉴于ige靶向药物靶点干扰的特殊情况,以及上述专利或方法存在的缺点,开发一种ige靶向药物的抗药抗体检测方法,以克服现有技术中靶点干扰严重的问题,提升ige靶向药物的抗药抗体检测方法的灵敏度、准确性和稳定性,是非常必要的。
技术实现思路
1、本发明的目的在于提供一种ige靶向药物的抗药抗体检测系统及方法,解决现有技术中靶点干扰严重,检测方法灵敏度低、准确性低、稳定性弱的技术问题,实现对ige靶向药物的抗药抗体准确高效的检测。
2、为实现上述目的,本发明采用的技术方案为:一种ige靶向药物的抗药抗体检测系统,主要分为两个部分:第一部分是样品处理系统,第二部分是检测系统。
3、所述样品处理系统,主要用于消除ada检测过程中药物干扰、靶点干扰以及可能存在的干扰,如类风湿因子干扰、基质效应干扰等,其中ige靶点干扰对ada检测结果具有非常关键的影响,消除ige靶点干扰是本发明的重点。
4、所述样品处理系统,包括复合微珠试剂和解离中和试剂,所述复合微珠试剂包括偶联有抗人ige抗体的3μm磁性微珠、抗人ige抗体的30μm磁性微珠和抗人ige抗体的1μm聚苯乙烯微球;所述解离中和试剂为常见的300mm醋酸(ph2.00±0.05)和1m tris溶液(ph9.5±0.5)。
5、所述的样品处理系统,包括前处理和后处理过程,所述前处理过程,是使用复合微珠试剂中的磁性微珠抓取分离ige,又可称为磁珠抓取过程;所述后处理过程分为两个部分,一部分是使用300mm醋酸(ph 2.00±0.05)将抗药抗体与药物解离,另一部分是使用复合微珠试剂中的聚苯乙烯微球来结合耗竭样品中剩余的ige。
6、所述检测系统,包括包被有奥马珠单抗的酶标板、生物素标记的奥马珠单抗、钌标记的奥马珠单抗、包被有链霉亲和素的msd板。
7、本发明的原理为:偶联有抗人ige抗体的30μm磁性微珠与样品中的ige特异性结合,经磁性分离装置分离磁珠,如此反复,可去除样品中95%以上的ige,得到样品1;再将偶联有抗人ige抗体的3μm磁性微珠与样品1充分震荡孵育,经磁性分离装置分离磁珠,可进一步去除ige,得到样品2,其中ige浓度≤0.5μg/ml;随后使用300mm醋酸酸化样品2,使得样品中的奥马珠单抗与抗药抗体解离,得到样品3;将样品3加入预先加入了1m tris溶液的包被有奥马珠单抗的酶标板,样品3中的抗药抗体与酶标板上包被的奥马珠单抗结合;洗板后,向酶标板中加入300mm醋酸,使抗药抗体和酶标板上包被的奥马珠单抗解离,吸取上清液,获得样品4;再将样品4与1m tris溶液、生物素标记的奥马珠单抗混合,随后加入到包被有链霉亲和素的msd板(即sa-msd板)中,抗药抗体与生物素标记的奥马珠单抗结合成复合物,再通过生物素与链霉亲和素的特异性结合,连接到msd板上;洗板后,加入钌标记的奥马珠单抗,形成钌标记得奥马珠单抗-抗药抗体-生物素标记的奥马珠单抗复合物;多次洗板后,使用msd读板机进行数据读取和分析。由于抗药抗体的浓度与仪器读取的信号值成正比,由此可根据标准品测试结果回算得到相应的浓度结果。除此以外,还可以某一标准品的检测信号值为cutoff信号值,然后将样品的测定信号值与cutoff信号值的比值定义为coi。样品最终测试结果以coi形式输出,当其coi<1时,样品结果为阴性,反之则为阳性,以此进行定性或半定量结果展示。
8、由于ige在过敏性患者体内浓度在5~20μg/ml之间,因此ige靶向药物的抗药抗体检测的靶点干扰浓度至少应达到50μg/ml,为防止极端情况发生,最好应达到100μg/ml。同时,由于抗药抗体的产生会严重干扰药物效果,导致使用者产生免疫反应,甚至可能危及使用者的生命,因此检测方法灵敏度越高,对药物的评价越完善,越能规避这些可能存在的未知风险,故方法灵敏度至少应达1ng/ml,以规避更多的风险。
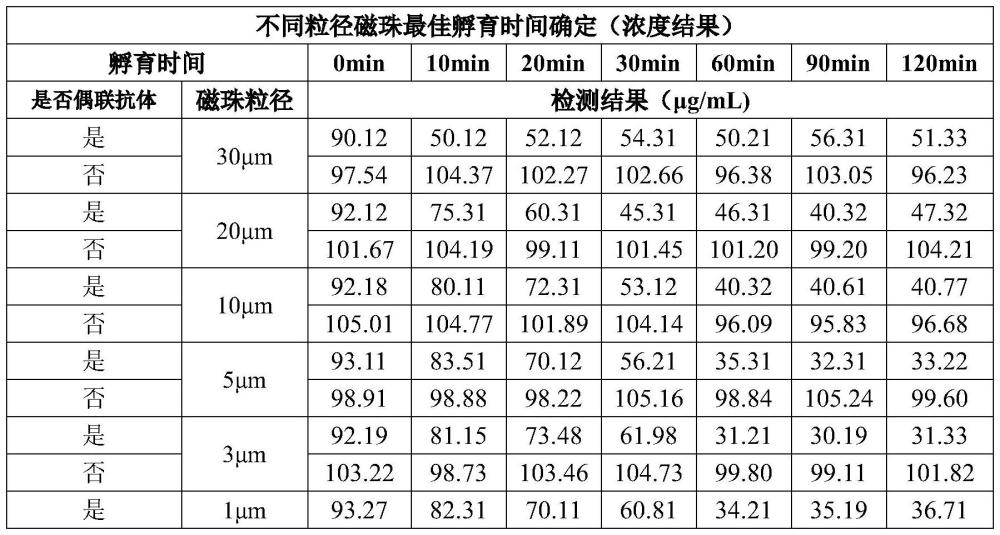
9、目前已知的专利与方法,均不能满足上述要求,在实际应用过程中存在较多不足。面对这一问题,发明人对已知的专利与方法进行了调整优化,以更好地适应ige靶向药物地抗药抗体检测,但除了在检测步骤上有所简化,在检测结果上略有提升以外,并无显著改善,远达不到预期要求。
10、将样品中的靶点ige与待测物质抗药抗体分离,是最好的解决靶点干扰方法之一。在实际测试过程中,发明人发现磁珠抓取,是较好的去除样品中ige的方法之一,常规清除率在40%~60%之间,优化后的磁珠单次抓取清除率最高可达70%。在已知的方法中一般仅使用一次抓取,发明人为提高抓取清除率,提出对样品进行多次反复抓取的实验方案。在重复9次磁珠抓取之后,ige的浓度下降至无法检出,可耐受100μg/ml的靶点干扰,但此时抗药抗体的灵敏度为55ng/ml左右。减少抓取次数,灵敏度无显著提升,耐受靶点干扰的能力显著下降。一方面可能是由于磁珠自带的液体有一定体积,重复抓取相当于对样品进行了稀释,同时该液体与样品的基质环境不同,可能导致样品中的抗药抗体的活性损失,最终导致整体的灵敏度下降;另一方面可能是由于多次磁珠抓取操作时间过长,一般需要在室温甚至37℃条件下,孵育处理约需10.5个小时,由此导致抗药抗体活性的散失,进而影响灵敏度。与此同时,复杂的操作步骤,对检测人员的操作要求较高,不适合实际应用。
11、上述的磁珠抓取是指将偶联有抗ige抗体的磁珠与样品混合,孵育10~60分钟,通过抗ige抗体与ige特异性结合的方式,将ige抓取在磁珠表面,最后通过磁力分离装置将磁珠与样品分离,从而将样品中的ige去除。其中磁珠与样品具体的孵育时间因磁珠的粒径大小和达到最佳清除率所需的时间不同而存在显著差异。
12、针对上述问题,为了将ige更加高效地从样品中分离,发明人选择不同粒径的磁珠,对样品中的ige进行抓取分离,包括偶联有抗人ige抗体的3μm磁性微珠和抗人ige抗体的30μm磁性微珠。
13、30μm的磁珠是市场上已知的最大直径且较为常见的磁珠,工艺成熟且稳定。虽然大直径磁珠比表面积小,可吸附ige的量远不如小直径磁珠,单次抓取清除率低,但大直径磁珠由于单个磁珠表面积大,与ige接触面大,短时间内即可达到自身最佳吸附量,同时由于样品中ige的浓度较高,其清除效率较为可观。而小直径磁珠单个磁珠表面积小,需要在样品中充分分散混合,才能保证各个磁珠充分地与ige结合,达到最佳的清除率,单次抓取时间长。综合实际情况考虑选择使用30μm粒径的磁珠对样品进行3次抓取,每次孵育10分钟,约在40分钟内完成大粒径磁珠的抓取,经实验测算,该步骤可清除90%以上的ige。此后再持续增加抓取次数,并不能达到预期的效果,甚至当ige的浓度到达1μg/ml后,不再有显著改变。这可能是由于,一方面大粒径磁珠的清除效率原本就不高,只是在高浓度ige下,有较为明显地清除效果,当ige浓度下降后,清除效率回归正常;另一方面大直径磁珠自身体积过大,无法充分分散在样品中与ige结合,当ige低于某一浓度后,清除效率极其低下。
14、为了更好地去除剩余的ige,发明人选用3μm的磁珠,进一步对ige进行抓取。3μm磁珠相较于30μm的磁珠,比表面积提升10倍,也更容易分散在样品中;相较于1μm及以下的磁珠,单个磁珠的可抓取量更多,更容易分离,达到最佳清除率所需的孵育时间更短。在实际测试中,使用3μm磁珠对ige浓度在5μg/ml样品进行2次抓取,每次孵育60分钟,此时ige的浓度约在200ng/ml~500ng/ml之间。
15、当ige的浓度在500ng/ml以下时,使用3μm或更小直径的磁珠继续进行抓取分离,可以将ige进一步消除,但效率极其低下,耗时较长,对整体检测结果的优化并不显著。可能是由于样品中的部分ige与药物或受体等蛋白结合,成结合态,无法被磁珠高效抓取。在磁珠抓取阶段引入解离剂,可能可以提高清除效率,但是反复地酸解和中和可能会进一步地增加抗药抗体活性丧失的风险。因此,发明人认为在磁珠抓取阶段,延长样本处理时间和引入解离剂来彻底地去除样品中的ige,可能不利于抗药抗体的检测。故考虑向样品中添加高浓度的抗ige抗体或者ige受体,使ige在样品孵育过程中先与其结合,尽量耗竭ige,可能可以减小甚至消除对抗药抗体检测的影响。当抗ige抗体或者ige受体浓度达到1ug/ml时,ige的干扰有显著下降,但持续提高其浓度,对检测结果无显著影响,且在测试过程中,可能会产生假阴性反应和假阳性反应。假阴性的结果是因为:ige受体与ige结合形成的免疫复合物,仍可以与检测过程中的捕获试剂或检测试剂结合,与抗药抗体形成竞争。假阳性的结果是因为:抗ige抗体与2个ige结合后形成复杂的免疫复合物,类似于抗药抗体,既可以连接捕获试剂,又可以连接检测试剂,产生阳性信号。
16、针对这一问题,发明人选择添加抗人ige抗体的1μm聚苯乙烯微球,在反应过程中,微球会先与样品中的ige结合,由于微球空间位阻的原因,结合到微球上的ige与抗药抗体竞争结合奥马珠单抗的能力显著下降,对抗药抗体检测影响显著减弱。其次聚苯乙烯微球与磁珠相比,不含氧化铁,在液相中的悬浮性更好,反应过程中不易沉降,可以给反应提供全程的保护。若微珠直径过小,空间位阻不足会加剧假阳性结果或假阴性结果。直径过大,分散性会下降,结果稳定性下降。
17、因此,本发明优选的ige干扰消除方案是选用复合微珠来抵抗检测过程中的ige干扰,其中在样品前处理过程中,使用偶联有抗人ige抗体的30μm磁性微珠和偶联有抗人ige抗体的3μm磁性微珠来抓取分离样品中的ige,使其浓度在3小时内,降低至0.5μg/ml以下。随后在样品后处理过程中,使用偶联有抗人ige抗体的1μm聚苯乙烯微球,来进一步结合消耗样品中游离的ige,避免ige对检测结果产生干扰。最终本方法可以抵抗样品中100μg/mlige的干扰,检测灵敏度可达0.69ng/ml。
18、由于磁珠自身携带的液体会稀释样品中的抗药抗体和改变样品的基质环境,进而导致抗药抗体检测灵敏度的下降,因此发明人采用两种方式来解决这一问题。一种是在磁珠与样品混匀前,先使用磁性分离装置将磁珠从液体中分离,再使用样品重悬磁珠,极大地减少引入液体的影响。另一方面是将磁珠冻干在96孔板表面,使用样品对其进行复溶,同样可达到上述效果。
19、本发明还提供一种ige靶向药物的抗药抗体检测方法,消除样品中ige。
20、具体地,使用磁珠的方式消除样品中ige。
21、优选地,使用复合微珠消除样品中ige,复合微珠包括抗人ige抗体的3μm磁性微珠、抗人ige抗体的30μm磁性微珠和抗人ige抗体的1μm聚苯乙烯微球。
22、优选地,所述抗药抗体检测方法包括前处理过程和后处理过程,所述前处理过程,是使用复合微珠试剂中的磁性微珠抓取分离ige,又可称为磁珠抓取过程;所述后处理过程分为两个部分,一部分是使用300mm醋酸(ph 2.00±0.05)将抗药抗体与药物解离,另一部分是使用复合微珠试剂中的聚苯乙烯微球来结合耗竭样品中剩余的ige。
23、相比于现有技术,本发明具有如下的有益效果:本系统和方法用于ige靶向药物的抗药抗体检测,检测灵敏度可达0.69ng/ml。
- 还没有人留言评论。精彩留言会获得点赞!