一种基于微分流行的多b值DWI图像评估的方法与流程
本发明是关于磁共振中多b值DWI图像评估领域,特别涉及一种基于微分流行的多b值DWI图像评估的方法。
背景技术:
肿瘤疗效的判定对临床治疗有十分重要的意义,可指导治疗计划的正确执行和个体化治疗策略的调整,或可终止无效治疗以避免毒副反应及不恰当治疗造成的肿瘤加速增长及耐药性。
近年来,随着快速成像磁共振技术的发展,基于平面回波技术的磁共振弥散加权成像(diffusion weighted imaging,DWI)已经被越来越广泛的应用于神经系统及许多重要脏器疾病的诊断。磁共振弥散成像实际上是测量水分子的布朗运动,在不同组织及不同的病理生理过程中都不一样,常用表观弥散系数(apparent diffusion coefficient,ADC)来描述。通过对ADC的分析,能帮助医师在诊疗工作中更准确的诊断肿瘤以及分析肿瘤治疗效果。但是由于单指数模型的ADC值整合了活体生物组织中真实扩散和假性灌注两方面的信息,使其反映的组织扩散特征受到了毛细血管内微循环影响,由此提出了多b值DWI双指数衰减模型和拉伸指数模型。双指数模型将生物组织真实的水分子扩散和毛细血管内的微循环灌注分离开来,同时反应出生物组织的细胞构成以及灌注方面信息,使测量数据更接近生物组织实际扩散值。拉伸指数模型通过描述体素内水分子的分布扩散指数(distributed diffusion coefficient,DDC)和体素内扩散异质性指数(the heterogeneity of intravoxel diffusion,α)反映更多的组织生物学特征方面的信息。此外常用的模型还有扩散峰度成像DKI等。实际临床中,ADC模型已被广泛应用于大脑等器官的组织分析,DDC、DKI等模型也被证实可以很好的反应不同组织的弥散的差异性。传统多b值DWI的模型,把不同b值的点拟合到一条曲线上。例如ADC模型用的是线性拟合,DDC等模型用的是非线性拟合。这些模型的缺点是,它们要求事先假设一个曲线的类型,即给定曲线的方程,然后通过不同b值的信号强度拟合出相应的参数。然而,几何弥散系数(geometric diffusion coefficient,GDC)模型不用事先假定出曲线的形式。
技术实现要素:
本发明的主要目的在于克服现有技术中的不足,提供一种计算上更加简便、更直观地反映出组织间的差异性的多b值DWI图像评估方法。为解决上述技术问题,本发明的解决方案是:
提供一种基于微分流行的多b值DWI图像评估的方法,具体包括下述步骤:
A、检查MRI图像,扫描得到多b值DWI图像;
B、对图像进行预处理;
C、计算出GDC;
所述步骤A具体是指:对人体进行磁共振(MRI)检查,(根据医生的需求)设定好k个b值(实施例中采用13个b值),扫描得到多b值的DWI图像,设定多少个b值就有多少组图像;所述k为自然数;
所述步骤B具体是指:对DWI图像采用高斯滤波进行去噪以及SPM刚性配准处理;
所述步骤C具体是指:对步骤B得到的图片选取ROI(region of interest),ROI中每个点对应不同的b值图像的信号强度关于b值进行积分;
所述积分有两类,一类是同一点不同b值的信号强度都除以b值为0的信号强度,然后关于b值的对数进行积分,记为GDC1,另一类是同一点不同b值的信号强度关于b值的对数进行积分,记为GDC2,公式如下:
GDC2=∫Sbd(logb)
其中,所述GDC1和GDC2是GDC模型需要计算的两个参数,S0表示b值等于0时的信号强度,Sb表示b值所对应的信号强度;
GDC模型参数确定的过程中,设定阈值T,对于某些高b值图像的信号强度减去更低b值图像的信号强度高于T的奇异点,进行舍弃,不计算到积分中(理论上配准、去噪后的图像,随着b值的升高,信号强度降低,但是由于噪点或者配准等可能会造成b值高的图像信号强度反而比b值低的图像信号强度低,故需舍弃这些奇异点);然后,对b值进行求对数;选取k个b值,即b1...bk,进行扫面数据(可以根据经验选取,比如平均选取,本实验中为了积分方便选取的b值为:0、20、35、55、100、150、250、400、650、1000、1800、3000、4500);公式如下:
GDC2=∫Sbd(logb)
积分得到所有点的GDC2:
其中,所述Sb′表示治疗后扫描得到的对应b值的信号强度,b1...bk表示治疗前对应b值的信号强度;因此,对于图像中的任一点,都能算出该点的GDC1和GDC2(通过GDC1、GDC2的升高或降低来评价肿瘤治疗前后的疗效)。
在本发明中,所述步骤B中,使用3×3模板(3个像素乘3个像素的小窗口)和sigma为0.7的高斯低通滤波对图像进行光滑去噪。
在本发明中,所述步骤B中,对各b值的图像位置进行刚性配准使用SPM算法。
与现有技术相比,本发明的有益效果是:
本发明将肿瘤看成是一张超曲面,不需要事先假定信号强度衰减的类型,因此计算上更加简便且能更直观地反映出组织间的差异性。
附图说明
图1为GDC模型的流程图。
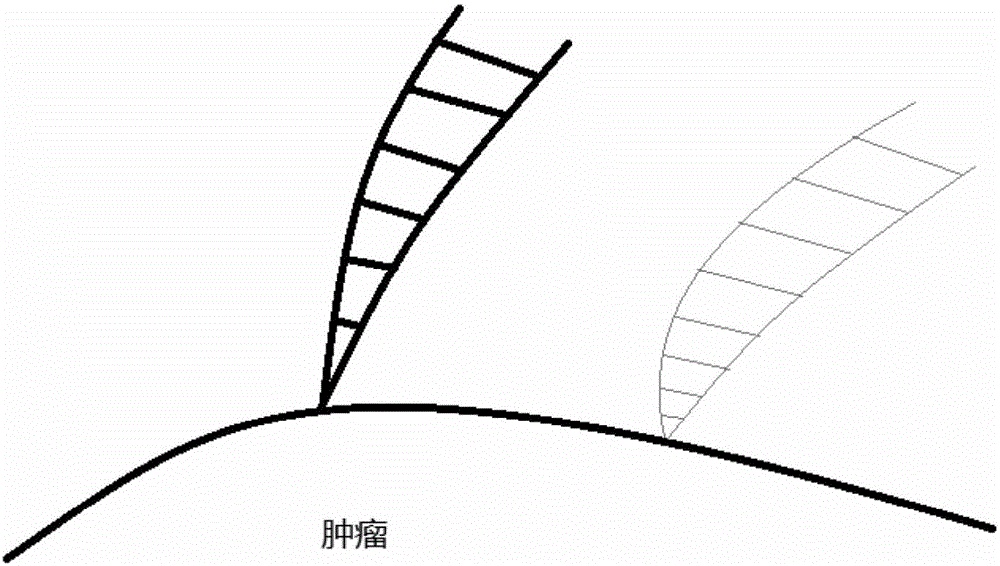
图2为GDC模型的简要说明图。
图3为传统模型的拟合结果图。
图4为ADC模型拟合的大脑结果图。
图5为DDC模型拟合的大脑结果图。
图6为DDC模型拟合的大脑结果图。
图7为双指数模型拟合的大脑结果图。
图8为双指数模型拟合的大脑结果图。
图9为DKI模型拟合的大脑结果图。
图10为DKI模型拟合的大脑结果图。
图11为DKI模型拟合的大脑结果图。
图12为GDC模型计算的参数结果图。
图13为GDC模型计算的参数结果图。
具体实施方式
下面结合附图与具体实施方式对本发明作进一步详细描述:
图1示出了GDC模型的具体过程,具体过程如下:
1、对人体进行磁共振(MRI)检查,设定好需要的13个b值扫描得到多b值的DWI图像。为了使log b能够尽量均匀度地分布在一条直线上,我们选取一组合适的b值,分别为:0 20 35 55 100 150 250 400 650 1000 1800 3000 4500,对人体进行扫描得到DWI图像。我们扫描了5个正常人的大脑图像。
2、对图像进行高斯滤波去噪,使用3*3模板和sigma为0.7的高斯低通滤波对图像进行光滑去噪,然后用SPM刚性配准处理。
3、选取ROI,例如我们选取了大脑中的灰质和白质。对ROI中的每个像素点进行积分,计算GDC模型的参数,GDC1和GDC2。
由于log0为负无穷大,因此不能作为积分的起始点。本发明选取0作为积分的起始点,选取对应的log(b)作为积分变量:0、2.99573227355399、3.55534806148941、4.00733318523247、4.60517018598809、5.01063529409626、5.52146091786225、5.99146454710798、6.47697236288968、6.90775527898214、7.49554194388426、8.00636756765025、8.41183267575841。计算GDC1时需要计算因此对于S0为0的点,我们不进行积分,直接把该点的GDC1值设为0。排除了S0为0的点,剩下的点就能通过积分公式
得到GDC1。通过
计算得到GDC2。
上述式中S0表示b值为0时的信号强度,Sb′表示治疗后的信号强度,Sb表示治疗前的信号强度。
图2简要说明了GDC模型,取了肿瘤超曲面中两个点,这两点对应了两组切丛,分别用粗线和细线表示,由于存在组织差异性,两点对应的切丛也各不相同。
图3中折线表示多b值信号强度,星号连接而成的线表示ADC模型,小圆圈链接而成的线表示DKI模型,小三角形连接而成的线表示双指数模型,虚线表示DDC模型。从上往下依次是白质、灰质和脑脊液的各模型拟合结果。
图4至图13分别是GDC与各模型的对比结果。图中可以看出GDC模型的组织显影结果更好。
下表1是实验中大脑白质和灰质各模型参数的对比结果,从结果可以看出,GDC模型的均值和方差在不同组织的差异性分析中p值更低,因此差异性更加明显。
表1大脑灰质和白质各模型的参数统计结果与比较表
最后,需要注意的是,以上列举的仅是本发明的具体实施例。显然,本发明不限于以上实施例,还可以有很多变形。本领域的普通技术人员能从本发明公开的内容中直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!