人工智能医学影像的肿瘤恶性风险分层辅助诊断系统的制作方法
本发明涉及一种肿瘤恶性风险分层辅助诊断系统和方法,具体涉及一种人工智能医学影像的肿瘤恶性风险分层辅助诊断系统和方法;属于医学影像人工智能辅助诊断技术领域。
背景技术:
肿瘤是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物。大部分良性病灶在无占位效应时无需手术干预。恶性肿瘤早期手术干预预后多良好,而晚期无论是手术干预还是放化疗普遍预后较差。目前,全球医疗机构都在不断投入巨资研究肿瘤的发生、发展和治疗,在现阶段,医生在进行肿瘤诊断过程中大多依靠其自身的经验和所掌握的知识、以及参考现有医学的医学指南进行诊断和治疗,具有诊断信心不足、效率较低和工作繁琐等问题。
以肺癌为例,肺癌每年造成全球约137万人死亡,占所有癌症死亡人数的18%,是全球发病率及死亡率最高的恶性肿瘤。随着ct技术的发展,肺结节的检出率迅速提高,这不仅使得影像医师的诊断工作量急剧上升,也给肺结节的临床决策及管理工作带来了巨大的挑战。为了辅助影像医师占位性病变临床诊断工作,提高工作效率和降低工作强度,近年来出现了一些人工智能辅助占位性病变良恶性诊断的探索。
申请号为201710737538.4的发明专利公布了一种病变良恶性风险分层辅助诊断系统,包括结节检测、医生指导、语义标注生成、样本生成、在线学习等步骤,需要医生指导,即医生标注关注点,自动计算得到关注区域内的肺结节轮廓与轮廓内各像素点的预测概率,生成含有精确语义轮廓的肺结节标注样本,供自学习系统学习。
总的来说,当前的系统大多利用公开数据集或单中心数据集进行训练,模型的泛化性和鲁棒性尚需检验;同时,数据质量参差不齐,有部分数据甚至无明确病理诊断信息,数据可靠性和数据的有效样本量受到质疑;此外,当前系统大多采用二分类思想,追求高准确率或者高auc(roc曲线下面积),但这种基于恶性可能性的分类方式并没有考虑到临床应用实际情况,不能切实为占位性病变临床决策管理提供参考。
鉴于上述原因,有必要对人工智能影像辅助诊断技术进行深入研究,切实帮助临床医生减轻工作压力,造福患者。
技术实现要素:
为解决现有技术的不足,本发明的目的在于提供一种人工智能医学影像的肿瘤恶性风险分层辅助诊断系统,提高临床医生诊断信心,辅助肿瘤性病变临床管理决策。
人工智能医学影像的肿瘤恶性风险分层辅助诊断系统,包括:
数据采集模块:用于采集现有数据,包括影像图像、临床信息、基因信息和病理良恶性标签,对数据完整性及数据质量进行验证评估后,进行数据脱敏处理并发送至数据预处理模块;
数据预处理模块:对采集到的现有数据进行降噪和数据归一化处理,寻找与病理结果对应的病变并对图像进行病变标注和分割;
模型建立模块:基于数据预处理模块得到的病变,对感兴趣区域进行特征提取和特征选择,筛选出低冗余高相关的特征,以医学影像图像为基础建立肿瘤恶性风险分层模型,并针对不同应用场景,选择高敏感性良性病变检出模型和高特异性恶性病变检出模型的模型参数及阈值:对于临床筛查应用场景,选择高敏感性的良性病变检出阈值,使阴性预测值/真良性率>99%;针对恶性病变明确诊断场景,选择高特异性的恶性病变检出阈值,使阳性预测值/真恶性率>99%,分层出极高风险病变;
模型验证与优化模块:用于评价模型在不同参数、不同场景下的有效性、泛化性和鲁棒性,并采用奖惩机制对模型性能进行迭代,在保证高敏感性和高特异性的前提下,逐步修改模型参数,提高诊断能力和准确性;
分层诊断模块:对检测样本进行诊断,将肿瘤分层为极低风险病变、极高风险病变及风险不确定病变,反馈给医生的终端设备和数据库平台;
数据库平台:与上述各模块连接,用于模型建立数据存储和调取,并不断收集新增数据,提供模型在线更新功能。
优选地,前述现有数据的来源包括:公开数据集及各级医院的病例数据。以肺癌举例来说,公开数据集包括但不限于nlst(nationallungscreeningtrial)及lidc-idri(thelungimagedatabaseconsortiumimagecollection)等数据集,各级医院包括社区医院、三甲医院等各级医院,数据来源尽量涵盖各类医疗机构及人群、高质量影像及常见临床疾病谱,影像检查设备包括目前国内外各大常用厂商,如西门子、飞利浦、东芝、ge、东软、联影等,尽量降低其他因素对诊断结果可能产生的影响。
优选地,前述的人工智能医学影像的肿瘤恶性风险分层辅助诊断系统,其特征在于,采集肺结节数据时,现有数据的采集标准为:纳入的所有结节均为大小小于3cm的原发结节,良性标签取自手术病理,恶性标签为手术、穿刺或支气管镜活检等手段取得,影像图像为无明显伪影的胸部ct平扫。
更优选地,前述脱敏处理包括隐去患者隐私信息和医疗机构信息,这样能够保证患者隐私不被泄漏。
更优选地,前述数据预处理模块中,通过医师寻找与病理结果对应的病变,然后利用经医师修改确认的自动分割方法或医生采用手工分割方法,对病变进行轮廓分割和局部方块分割。
进一步优选地,前述奖惩机制为:在训练集中,先构建分类模型,标记良性及恶性标签;对人工智能识别错误图像,以三位或以上医学专家的综合意见指导,对于医生明确诊断不应出错的图像对先前模型施加惩罚因子;对人工智能识别准确的图像,在模型改进中施加奖励因子;结合奖惩因子和原有模型,修改得到新的模型,并循环迭代优化模型,最终得到理想的良恶性分层模型,通过奖惩机制能够不断完善和优化模型,提高分层诊断结果的准确性和可靠性。
此外,本发明还公布了人工智能医学影像的肿瘤恶性风险分层辅助诊断方法,该方法基于如前所述的辅助诊断系统,包括如下方面:
(1)、采集数据:多途径采集现有的医学数据并进行筛选、脱敏;
(2)、图像分割:对采集到的影像图像进行轮廓分割和局部方块分割;
(3)、特征提取:在感兴趣区域提取图像的影像学特征,包括直方图特征、纹理特征、形状特征、滤波变换特征及卷积神经网络特征;
(4)、特征选择:使用短时间重复扫描的特征稳定性测试数据集挑选表现稳定的特征,然后在测试数据集中采用单变量分析法筛选高度相关的特征,最后再筛选低冗余度、高度相关的特征;
(5)、建立模型:采用多种机器学习和深度学习算法进行模型建立,并采用交叉验证建立模型;
(6)、优化模型:包括集成学习和奖惩机制,其中集成学习是将多种分类器进行组合,常可以获得比单一分类器更优越的泛化性能;奖惩机制是在训练集中,先构建分类模型,标记良性及恶性标签;对人工智能识别错误图像,以三位或以上医学专家的综合意见指导,对于医生明确诊断不应出错的图像对先前模型施加惩罚因子;对人工智能识别准确的图像,在模型改进中施加奖励因子;结合奖惩因子和原有模型,修改得到新的模型,并循环迭代优化模型,最终得到理想的良恶性分层模型;
(7)、验证模型:在验证数据集上进行模型验证,画出roc曲线,在高敏感性模型中寻找尽可能高的特异性指标,敏感性99%时对应的特异性指标应≥20%;在高特异性模型中寻找尽可能高的敏感性指标,特异性99%时对应的敏感性指标应≥20%;并计算阳性预测值(真恶性率)、阴性预测值(真良性率)及准确性指标;
(8)、临床诊断:采集测试数据,进行肿瘤分层诊断并输出诊断结果。
优选地,前述滤波变换包括:高斯-拉普拉斯滤波和/或小波变换,所述单变量分析法为t检验法和/或方差分析法。
更优选地,利用最小冗余最大关联法(mrmr,minimumredundancymaximumrelevance,)、最小绝对值收缩和选择器法(lasso,leastabsoluteshrinkageandselectionoperator,)筛选低冗余度、高度相关的特征。
进一步优选地,前述机器学习和深度学习算法包括:线性及非线性支持向量机(supportvectormachine,svm)、随机森林、决策树、k近邻、logistic回归、卷积神经网络、对抗生成网络、迁移学习中的一种或多种。
本发明的有益之处在于:
(1)本发明的肿瘤恶性风险分层辅助诊断系统借助人工智能技术,可实现对肿瘤的良恶性风险进行逐次分层,模拟临床诊断思路,以人工智能模型的高精度的良性病变检出和恶性肿瘤检出能力,对影像特征明确的占位性病变进行自动诊断,从而能够实质性辅助占位性病变临床管理决策,改进临床诊断现有工作流程,增加医师诊断信心,减轻工作压力,也减少低恶性风险病变患者的焦虑;
(2)该系统能不断验证和优化模型,解决了现有技术中计算机辅助软件无法反馈、无法自学习自更新的问题,提高了肿瘤分层的准确性和可靠性,通过该诊断系统,高敏感性模型的敏感性达到99%以上,特异性达到20%以上,高特异性模型的特异性达到99%以上,敏感性达到20%以上,大大提高了良性病变及恶性肿瘤的确诊率;
(3)本发明的系统具有奖惩机制,依托高质量的医生知识库,为人工智能学习能力的提升提供更有效的方式和更高的效率,以临床诊断流程为依托,有望实现人工智能临床辅助诊断的落地实施。
附图说明
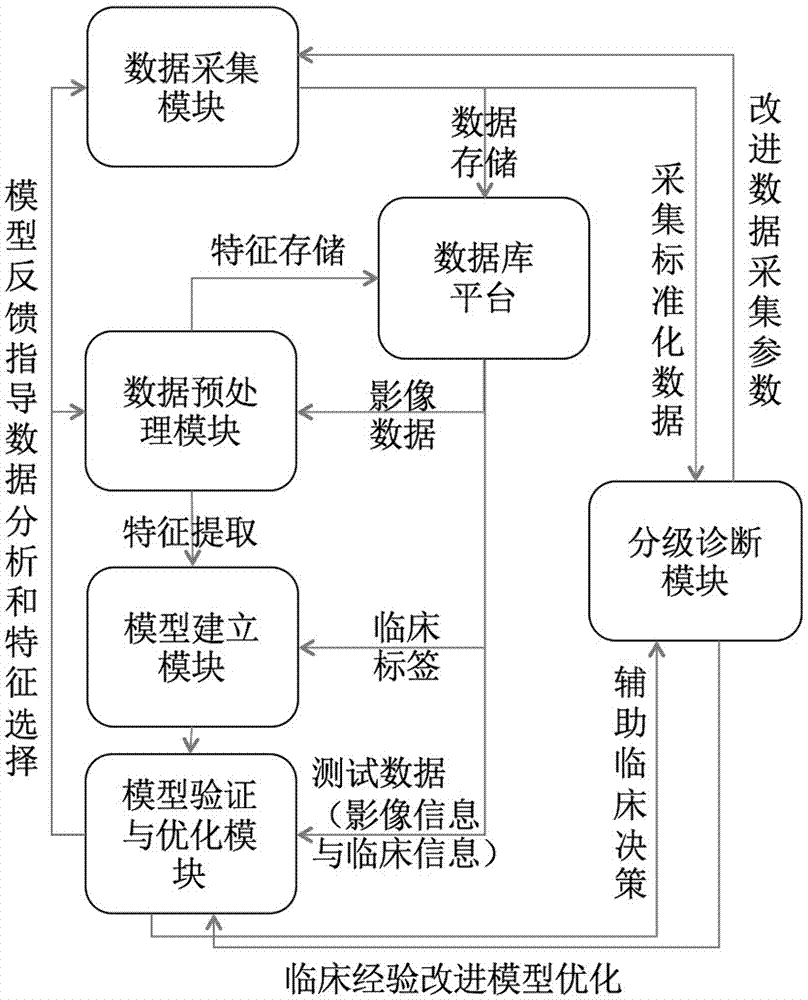
图1是本发明的肿瘤恶性风险分层辅助诊断系统的结构示意图;
图2是本发明的肿瘤恶性风险分层辅助诊断系统的分层管理决策示意图;
图3是本发明的肿瘤恶性风险分层辅助诊断方法的流程示意图。
具体实施方式
以下结合具体实施例对本发明作具体的介绍。
本发明中的医学影像,包括但不限于x-ray(x射线)图像、ct(电子计算机断层扫描)图像、mri(磁共振)图像及超声波检测等,本发明的肿瘤恶性风险分层辅助诊断系统可以集成在现有的这些医学影像设备上,也可以独立设置或者设置在服务器等终端上。
参见图1,本发明的肿瘤恶性风险分层辅助诊断系统是人工智能医学影像而实现的,包括:
(1)数据采集模块:用于采集现有数据,包括影像图像、临床信息、基因信息和病理良恶性标签,对数据完整性及数据质量进行验证评估后,进行数据脱敏处理并发送至数据预处理模块,所谓“脱敏处理”包括隐去患者隐私信息和医疗机构信息,这样能够保证患者隐私不被泄漏。
其中,现有数据的来源包括:公开数据集及各级医院的病例数据。以肺癌举例来说,公开数据集包括但不限于nlst(nationallungscreeningtrial)及lidc-idri(thelungimagedatabaseconsortiumimagecollection)等数据集,各级医院包括社区医院、三甲医院等各级医院,数据来源尽量涵盖各类医疗机构及人群、高质量影像及常见临床疾病谱,影像检查设备包括目前国内外各大常用厂商,如西门子、飞利浦、东芝、ge、东软、联影等,尽量降低其他因素对分层诊断结果可能产生的影响。
以肺部的ct图像为例,现有数据的采集标准为:纳入的所有肺部结节均为大小小于3cm的原发结节,良性标签取自手术病理,恶性标签为手术、穿刺或支气管镜活检等手段取得,影像图像为无明显伪影的胸部ct平扫,根据这些标准对数据进行有效筛选,这样能够更好地保证数据的有效性。当然,该采集方法同样适用于如胃、甲状腺、乳腺等器官,根据临床指导提出相应的采集标准。
(2)数据预处理模块:对采集到的现有数据进行降噪和数据归一化处理,寻找与病理结果对应的病变并对图像进行病变标注和分割。在该模块中,通过医师寻找与病理结果对应的病变,然后利用经医师修改确认的自动分割方法或医生采用手工分割方法,对病变进行轮廓分割和局部方块分割。目前,对于肺部的分割能够通过自动分割算法来实现分割,对于肺部以外的其他部位尚无自动分割算法,大多依赖于医生手工分割。
(3)模型建立模块:基于数据预处理模块得到的病变,对感兴趣区域进行特征提取和特征选择,筛选出低冗余高相关的特征,以医学影像图像为基础建立肿瘤恶性风险分层模型,并针对不同应用场景,选择高敏感性良性病变检出模型和高特异性恶性病变检出模型的模型参数及阈值:对于临床筛查应用场景,选择高敏感性的良性病变检出阈值,使阴性预测值/真良性率>99%,分层出极低风险病变;针对恶性病变诊断场景,选择高特异性的恶性病变检出阈值,使阳性预测值/真恶性率>99%,分层出极高风险病变。
(4)模型验证与优化模块:用于评价模型在不同参数、不同场景下的有效性、泛化性和鲁棒性,并采用奖惩机制对模型性能进行迭代,在保证高敏感性和高特异性的前提下,逐步修改模型参数,提高诊断能力和准确性。
本步骤中的奖惩机制对于模型优化起到了至关重要的作用,解决了现有技术中计算机辅助软件无法反馈、无法自学习自更新的问题,提高了肿瘤分层的准确性和可靠性。该机制的具体实施方式为:在训练集中,先构建分类模型,标记良性及恶性标签;对人工智能识别错误图像,以三位或以上医学专家的综合意见指导,对于医生明确诊断不应出错的图像对先前模型施加惩罚因子;对人工智能识别准确的图像,在模型改进中施加奖励因子;结合奖惩因子和原有模型,修改得到新的模型,并循环迭代优化模型,最终得到理想的良恶性分层模型,通过奖惩机制能够不断完善和优化模型,提高分层诊断结果的准确性和可靠性。
(5)分层诊断模块:对检测样本进行诊断,将肿瘤分层为极低风险病变、极高风险病变及风险不确定病变,反馈给医生的终端设备和数据库平台。
(6)数据库平台:与上述各模块连接,用于模型建立数据存储和调取,并不断收集新增数据,提供模型在线更新功能,从而不断丰富和优化数据库,提高了该系统的性能。
由上我们可知,本发明的肿瘤恶性风险分层辅助诊断系统由五大模块和一个平台组成,实际系统在应用时,也可根据需求和实际情况对模块功能进行拆分或合并,只要能够实现以上功能即可。
基于该系统的肿瘤恶性风险分层管理决策示意图如图2所示,首先采集患者数据(医学影像等)进行初步筛查,根据高敏感性良性病变检出模型分层出极低风险病变的患者,给出合理的临床意见,比如定期复查;接着,对于有恶性风险病变可能的肿瘤作进一步诊断,根据高特异性恶性病变检出模型分层出极高风险病变的患者,提出治疗方案,及时进行积极治疗,避免病情延误;对于风险不确定的病变,则需专业医生结合其他临床指标进行分析判断,按照临床指南进行随访或者治疗。该图中的分数是指通过模型计算得到的每一个结节的分值,良性线和恶性线是分别根据高敏感性良性病变检出模型和高特异性恶性病变检出模型得到的等级分数。
此外,为了更好地实施和理解本发明,下面对基于该系统的肿瘤恶性风险分层辅助诊断方法进行简要说明,该方法主要包括如下方面:
(a)采集数据:多途径采集现有的医学数据并进行筛选、脱敏;
(b)图像分割:对采集到的影像图像进行轮廓分割和局部方块分割;
(c)特征提取:在感兴趣区域提取图像的影像学特征,包括直方图特征、纹理特征、形状特征、滤波变换特征及卷积神经网络特征,其中,滤波变换包括:高斯-拉普拉斯滤波和/或小波变换;
(d)特征选择:使用短时间重复扫描的特征稳定性测试数据集挑选表现稳定的特征,然后在测试数据集中采用单变量分析法筛选高度相关的特征,最后利用最小冗余最大关联法(mrmr,minimumredundancymaximumrelevance,)、最小绝对值收缩和选择器法(lasso,leastabsoluteshrinkageandselectionoperator,)筛选出低冗余度、高度相关的特征;其中,单变量分析法为t检验法和/或方差分析法;
(e)建立模型:采用多种机器学习和深度学习算法进行模型建立,并采用交叉验证建立模型;其中,机器学习和深度学习算法包括:线性及非线性支持向量机(supportvectormachine,svm)、随机森林、决策树、k近邻、logistic回归、卷积神经网络、对抗生成网络、迁移学习中的一种或多种;
(f)优化模型:包括集成学习和奖惩机制,其中集成学习是将多种分类器进行组合,获得比单一分类器更优越的泛化性能;奖惩机制是在训练集中,先构建分类模型,标记良性及恶性标签;对人工智能识别错误图像,以三位或以上医学专家的综合意见指导,对于医生明确诊断不应出错的图像对先前模型施加惩罚因子;对人工智能识别准确的图像,在模型改进中施加奖励因子;结合奖惩因子和原有模型,修改得到新的模型,并循环迭代优化模型,最终得到理想的良恶性分层模型;
(g)验证模型:在验证数据集上进行模型验证,画出roc曲线,在高敏感性模型中寻找尽可能高的特异性指标,敏感性99%时对应的特异性指标应≥20%;在高特异性模型中寻找尽可能高的敏感性指标,特异性99%时对应的敏感性指标应≥20%;并计算阳性预测值(真恶性率)、阴性预测值(真良性率)及准确性指标;
(h)临床诊断:采集测试数据,进行肿瘤分层诊断并输出诊断结果。
综上,本发明的肿瘤恶性风险分层辅助诊断系统借助人工智能技术,可实现对肿瘤的良恶性风险进行逐次分层,将肿瘤分层为极低风险病变、极高风险病变及风险不确定病变,能够实质性辅助占位性病变临床管理决策,改进临床诊断现有工作流程,增加医师诊断信心,减轻工作压力,也减少低恶性风险病变患者的焦虑;而且,该系统能不断验证和优化模型,解决了现有技术中计算机辅助软件无法反馈、无法自学习自更新的问题,提高了肿瘤分层的准确性和可靠性,通过该诊断系统,高敏感性模型的敏感性达到99%,特异性达到20%以上,高特异性模型的特异性达到99%,敏感性达到20%以上,良性结节及恶性结节的确诊率。
以上显示和描述了本发明的基本原理、主要特征和优点。本行业的技术人员应该了解,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!