一种构建分子半加器和半减器的方法与流程
本发明属于分子计算机
技术领域:
,具体涉及一种构建分子半加器和半减器的方法。
背景技术:
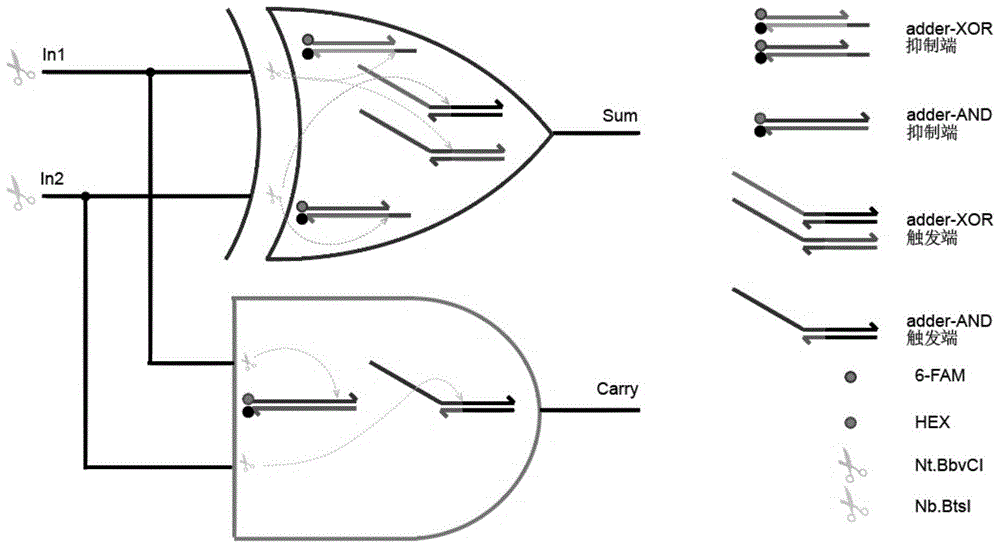
:逻辑电路是一种对离散信号的传递和特定处理,是以二进制逻辑运算为基本原理,实现对数字信号逻辑运算和操作的电路。在现在的电子计算机上,由大量的晶体管组成逻辑电路,它们的特点是以高、低电平代表二进制信号中的1和0。简单的逻辑电路有:与逻辑门、或逻辑门、异或逻辑门、同或逻辑门等,它们除了可以实现简单的逻辑运算,还可以通过级联并联等方式组合成更复杂的逻辑电路,如半加器,半减器等逻辑电路,它们都是构成电子计算机核心微处理器的算术逻辑运算单元的基础组件,在电子计算机中起着至关重要的作用。半加器是一种执行数字加法的运算部件,其功能是将两个一位二进制数相加求和,得到求和结果和进位结果,其真值表如下:input1input2sumoutputcarryoutput0000011010101101半减器是一种执行数字减法的运算部件,其功能是将两个一位二进制数相减求差,得到做差结果和借位结果,其真值表如下:input1input2differenceoutputborrowoutput0000011010111100在分子计算机领域,要求在分子水平上基于分子材料构建逻辑电路。众多分子材料中,dna因其具有体积小、易操控、可预测、天然生物特性等优点,成为最常见也是最有潜力的分子材料。利用dna分子内在多样性构建具有计算功能的微型系统,用分子的某种内在属性来描述分子电路的输入和输出信号,进而在分子水平上实现逻辑运算操作。现有技术中有基于调控核酶结构构建分子半加器和半减器的方法,基于g四聚体结构构建分子半加器和半减器的方法,基于dna链置换反应构建分子半加器和半减器的方法等,虽然很好的实现了半加器和半减器的逻辑运算功能,但实验反应时间较长,普遍时间在3~5小时,反应时间过长也就意味着受干扰影响时间长,系统容错度就会降低。技术实现要素:针对现有技术中反应时间较长的问题,我们提出一种构建分子半加器和半减器的方法,半加器的结构示意图如图1所示,加法逻辑运算系统由一个xor门和一个and门组合构成,每个逻辑门的内部都分为触发端口和抑制端口两部分。半减器的结构示意图如图2所示,减法逻辑运算系统由一个xor门和一个inhibit门组合构成,同样地,每个逻辑门的内部都分为触发端口和抑制端口两部分。切刻内切酶作用在不同的端口会使特定dna的结构发生改变,从而调控dna链置换反应的发生,实现逻辑运算的目的。该方法有效简化逻辑运算系统的结构,并且优化了信号传递的方式,从而缩短实现逻辑计算的时间。本发明采取的技术方案如下:一种构建分子半加器和半减器的方法,包括:取cutsmart缓冲液和若干dna双链构建逻辑运算系统,以两种切刻内切酶nb.btsi和nt.bbvci作为平行的两路输入信号,在切刻内切酶的特异性切刻作用下,特定双链dna的结构发生改变,产生可发生链置换反应的覆盖链,以及带有toehold区域的dna双链,从而允许反应体系发生dna链置换反应,并生成带有荧光标记的单链dna,荧光强度作为输出信号,在此基础上构建半加器和半减器。取cutsmart缓冲液和若干dna双链构建逻辑运算系统,以两种切刻内切酶nb.btsi和nt.bbvci作为平行的两路输入信号,在切刻内切酶的特异性切刻作用下,特定双链dna的结构发生改变,产生可发生链置换反应的覆盖链,以及带有toehold区域的dna双链,从而允许反应体系发生dna链置换反应,并生成带有荧光标记的单链dna,以修饰有6-fam荧光基团的dna单链释放荧光信号的归一化结果作为和位输出信号,以修饰有hex荧光基团的dna单链释放荧光信号的归一化结果作为进位输出信号,设定阈值为0.3,任何一路输出信号的结果大于阈值,认为该分子电路输出为1,任何一路输出信号的结果小于或等于阈值,认为该分子电路输出为0,构建半加器。取cutsmart缓冲液和若干dna双链构建逻辑运算系统,以两种切刻内切酶nb.btsi和nt.bbvci作为平行的两路输入信号,在切刻内切酶的特异性切刻作用下,特定双链dna的结构发生改变,产生可发生链置换反应的覆盖链,以及带有toehold区域的dna双链,从而允许反应体系发生dna链置换反应,并生成带有荧光标记的单链dna,以修饰有6-fam荧光基团的dna单链释放荧光信号的归一化结果作为差位输出信号,以修饰有rox荧光基团的dna单链释放荧光信号的归一化结果作为借位输出信号,设定阈值为0.3,任何一路输出信号的结果大于阈值,认为该分子电路输出为1,任何一路输出信号的结果小于或等于阈值,认为该分子电路输出为0,构建半减器。进一步地,所述切刻内切酶的nb.btsi和nt.bbvci是等比例且同时加入反应体系,作为半加器和半减器平行的两路输入信号。进一步地,切刻内切酶与其作用的dna双链用量比为10units:1ug。进一步地,dna双链通过以下方式制得:将包含切刻内切酶nb.btsi和nt.bbvci识别位点碱基序列的且具有互补能力的dna单链等量混合,于90℃加热10min,然后每分钟降低0.8℃,降低至20℃。与现有技术相比,本发明的有益效果是:基于切刻内切酶调控dna链置换反应构建半加器和半减器,相比其他方法构建的分子逻辑器件,由于切刻内切酶的高效特异性切刻作用,使得系统内信号的传递不只依赖于上游反应的产出结果,也受切刻内切酶辅助控制,使得分子器件系统结构简化,每个器件仅由6个特定dna双链构成,相比同类其他研究方法,系统结构中dna数量减少10%~35%。系统内信号传递由于酶的辅助传递作用,传递次数仅需1次,就可以输出逻辑运算的结果,相比同类其他研究方法,内部信号传递次数减少1~2次,使得本方法构建的分子器件反应速度快,反应时间得以缩短,从触发链置换反应开始计时,反应在前30分钟就有明显的反应趋势,反应至120分钟输出信号已经稳定且明显,总反应时间不超过220分钟。相比同类其他研究方法,反应时间减少140~500分钟。附图说明图1为分子半加器结构示意图。图2为分子半减器结构示意图。图3为实施例1中分子半加器输入为0&0时输出荧光信号曲线图。图4为实施例1中分子半加器输入为0&1时输出荧光信号曲线图。图5为实施例1中分子半加器输入为1&0时输出荧光信号曲线图。图6为实施例1中分子半加器输入为1&1时输出荧光信号曲线图。图7为实施例1中分子半减器输入为0&0时输出荧光信号曲线图。图8为实施例1中分子半减器输入为0&1时输出荧光信号曲线图。图9为实施例1中分子半减器输入为1&0时输出荧光信号曲线图。图10为实施例1中分子半减器输入为1&1时输出荧光信号曲线图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。一种构建分子半加器的方法,包括取cutsmart缓冲液和若干dna双链构建逻辑运算系统,以两种切刻内切酶nb.btsi和nt.bbvci作为平行的两路输入信号,在切刻内切酶的特异性切刻作用下,特定双链dna的结构发生改变,产生可发生链置换反应的覆盖链,以及带有toehold区域的dna双链,从而允许反应体系发生dna链置换反应,并生成带有荧光标记的单链dna,以修饰有6-fam荧光基团的dna单链释放荧光信号的归一化结果作为和位输出信号,以修饰有hex荧光基团的dna单链释放荧光信号的归一化结果作为进位输出信号,设定阈值为0.3,任何一路输出信号的结果大于阈值,认为该分子电路输出为1,任何一路输出信号的结果小于或等于阈值,认为该分子电路输出为0,构建半加器;所述切刻内切酶的nb.btsi和nt.bbvci是等比例且同时加入反应体系,作为半加器和半减器平行的两路输入信号。切刻内切酶与其作用的dna双链用量比为10units:1ug。一种构建分子半减器的方法,包括取cutsmart缓冲液和若干dna双链构建逻辑运算系统,以两种切刻内切酶nb.btsi和nt.bbvci作为平行的两路输入信号,在切刻内切酶的特异性切刻作用下,特定双链dna的结构发生改变,产生可发生链置换反应的覆盖链,以及带有toehold区域的dna双链,从而允许反应体系发生dna链置换反应,并生成带有荧光标记的单链dna,以修饰有6-fam荧光基团的dna单链释放荧光信号的归一化结果作为差位输出信号,以修饰有rox荧光基团的dna单链释放荧光信号的归一化结果作为借位输出信号,设定阈值为0.3,任何一路输出信号的结果大于阈值,认为该分子电路输出为1,任何一路输出信号的结果小于或等于阈值,认为该分子电路输出为0,构建半减器;所述切刻内切酶的nb.btsi和nt.bbvci是等比例且同时加入反应体系,作为半加器和半减器平行的两路输入信号。切刻内切酶与其作用的dna双链用量比为10units:1ug。所述的一种构建分子半加器或半减器的方法,dna双链通过以下方式制得:将包含切刻内切酶nb.btsi和nt.bbvci识别位点碱基序列的且具有互补能力的dna单链等量混合,于90℃加热10min,然后每分钟降低0.8℃,降低至20℃。实施例1(1)构建分子半加器,取四只ep管,编号为1、2、3、4,分别做如下处理:向1号管中加入15ul浓度为1x的cutsmart溶液,再加入三条浓度为8um的抑制端dna双链各1.25ul,其中两条用以异或逻辑运算,另一条用以与逻辑运算,得溶液1;向2号管中加入11ul浓度为1x的cutsmart溶液,再加入三条浓度为8um的抑制端dna双链各1.25ul,其中两条用以异或逻辑运算,另一条用以与逻辑运算,加入浓度为1u/ul的nt.bbvci切刻内切酶溶液4ul,得溶液2;向3号管中加入11ul浓度为1x的cutsmart溶液,再加入三条浓度为8um的抑制端dna双链各1.25ul,其中两条用以异或逻辑运算,另一条用以与逻辑运算,加入浓度为1u/ul的nb.btsi切刻内切酶溶液4ul,得溶液3;向4号管中加入7ul浓度为1x的cutsmart溶液,再加入三条浓度为8um的抑制端dna双链各1.25ul,其中两条用以异或逻辑运算,另一条用以与逻辑运算,加入浓度为1u/ul的nt.bbvci切刻内切酶溶液4ul,加入浓度为1u/ul的nb.btsi切刻内切酶溶液4ul,得溶液4。抑制端反应1h后,向四个溶液中均加入三条浓度为8um的触发端dna双链各1.25ul,分别置于37度恒温反应2h,期间检测荧光信号。dna双链通过以下方式制得:将包含切刻内切酶nb.btsi和nt.bbvci识别位点碱基序列的且具有互补能力的dna单链等量混合,于90℃加热10min,然后每分钟降低0.8℃,降低至20℃。测定四种溶液的6-fam荧光强度分别记为s1、s2、s3、s4,hex荧光强度分别记为c1、c2、c3、c4,将测定结果进行归一化处理,即测定值分别除以s3(四种溶液中6-fam荧光强度最大值)和c4(四种溶液中hex荧光强度最大值),将归一处理后的数据制成曲线图统计分析,设定阈值为0.3,信号输出小于0.3记为0,否则记为1。实验结果如下:图3为半加器输入为0&0时,进位和和位均为0;图4为输入为1&0时,进位输出为0,和位输出为1;图5为输入为0&1时,进位输出为0,和位输出为1;图6输入为1&1时,进位输出为1,和位输出为0。就这样,以酶nb.btsi做为第一路输入信号,以nt.bbvci做为第二路输入信号,以6-fam荧光强度为和位输出信号,以hex荧光强度为进位输出信号,成功构建分子半加器。(2)构建分子半减器取四只ep管,编号为1、2、3、4,分别做如下处理:向1号管中加入15ul浓度为1x的cutsmart溶液,再加入三条浓度为8um的抑制端dna双链各1.25ul,其中两条用以异或逻辑运算,另一条用以inhibit逻辑运算,得溶液1;向2号管中加入11ul浓度为1x的cutsmart溶液,再加入三条浓度为8um的抑制端dna双链各1.25ul,其中两条用以异或逻辑运算,另一条用以inhibit逻辑运算,加入浓度为1u/ul的nt.bbvci切刻内切酶溶液4ul,得溶液2;向3号管中加入11ul浓度为1x的cutsmart溶液,再加入三条浓度为8um的抑制端dna双链各1.25ul,其中两条用以异或逻辑运算,另一条用以inhibit逻辑运算,加入浓度为1u/ul的nb.btsi切刻内切酶溶液4ul,得溶液3;向4号管中加入7ul浓度为1x的cutsmart溶液,再加入三条浓度为8um的抑制端dna双链各1.25ul,其中两条用以异或逻辑运算,另一条用以inhibit逻辑运算,加入浓度为1u/ul的nt.bbvci切刻内切酶溶液4ul,加入浓度为1u/ul的nb.btsi切刻内切酶溶液4ul,得溶液4。抑制端反应1h后,向四个溶液中均加入三条浓度为8um的触发端dna双链各1.25ul,分别置于37度恒温反应2h,期间检测荧光信号。dna双链通过以下方式制得:将包含切刻内切酶nb.btsi和nt.bbvci识别位点碱基序列的且具有互补能力的dna单链等量混合,于90℃加热10min,然后每分钟降低0.8℃,降低至20℃。测定四种溶液的6-fam荧光强度分别记为d1、d2、d3、d4,rox荧光强度分别记为b1、b2、b3、b4,将测定结果进行归一化处理,即测定值分别除以d3(四种溶液中6-fam荧光强度最大值)和b3(四种溶液中rox荧光强度最大值),将归一处理后的数据制成曲线图统计分析,设定阈值为0.3,信号输出小于0.3记为0,否则记为1。实验结果如下:图7为半减器输入为0&0时,借位和差位均为0;图8为输入为1&0时,借位输出为0,差位输出为1;图9为输入为0&1时,借位输出为1,差位输出为1;图10为输入为1&1时,借位输出为0,差位输出为0。就这样,以酶nb.btsi做为第一路输入信号,以nt.bbvci做为第二路输入信号,以6-fam荧光强度为和位输出信号,以rox荧光强度为进位输出信号,成功构建分子半减器。尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1