一种直肠癌淋巴结转移的智能诊断方法与流程
本发明涉及智能医学影像诊断领域,尤其涉及一种直肠癌淋巴结转移的智能诊断方法。
背景技术:
直肠癌是指从齿状线至直肠乙状结肠交界处之间的恶性肿瘤,是消化道最常见的恶性肿瘤之一。近年来在中国,直肠癌的发病率越来越高,直肠癌易向肠外浸润并发生淋巴结及远
处转移,一旦发生转移病人常常需先进行辅助放化疗才能获得手术机会,患者预后较早期直
肠癌患者的预后差。在术前tnm分期中淋巴结转移情况是重要因素之一。因此研究淋巴结转移对临床医学研究来说十分重要。
目前针对直肠癌淋巴结转移诊断的研究方法,多数采用的是传统影像组学技术,通过对医学影像进行图像分割、特征提取和特征选择、建模预测等步骤来构建诊断模型。传统的影像组学方法在一定程度上推进了对直肠癌淋巴结转移研究的进展且达到了较高的准确率,但同时也存在些许不足。传统方法对医学影像的分割大多依靠医生手工分割,对一名患者的ct影像分割至少需要10分钟,长时间的阅片容易视觉疲劳,结果往往具有很强的主观性和误诊性,肿瘤分割精度不高,导致提取的影像组学特征不准,最终影响预测的准确率。
近年来伴随人工智能与大数据技术的发展,基于深度学习的影像组学研究受到广泛的关注。针对直肠癌ct影像的淋巴结转移诊断研究,使用深度学习技术来自动检测患者ct影像中有无肿瘤,且可自动分割出肿瘤区域,进一步提取ct肿瘤区域特征数据,最终基于特征数据构建分类模型,智能预测直肠癌有无发生淋巴结转移。
技术实现要素:
本发明针对背景技术的不足提供一种直肠癌淋巴结转移的智能诊断方法,其联合深度学习技术和传统影像组学方法,以直肠癌患者ct影像为研究数据,实现直肠癌淋巴结转移智能诊断的研究。
本发明解决其技术问题所采用的技术方案是:
一种直肠癌淋巴结转移的智能诊断方法,具体包括以下步骤:
步骤1、对患者腹部ct影像数据预处理,读取dcm影像文件,将文件转换成三维数组矩阵,对该矩阵进行数据规约;
步骤2、构建直肠癌ct影像分类模型,将规约后的数据作为训练样本送入建立的卷积神经网络模型进行监督学习,使用训练成熟的分类模型对ct影像数据进行分类,检测出ct影像中包含直肠癌肿瘤的vois区域;
步骤3、构建直肠癌ct影像肿瘤分割模型,使用改进的ags-unet网络模型,将vois区域对应的ct影像和肿瘤掩模图数据送入该模型中训练模型,使用训练成熟的分割模型识别出肿瘤位置和肿瘤对应的掩摸图;
步骤4、对肿瘤影像区域提取放射学特征数据,包括纹理特征、灰度特征、形态特征;构建朴素贝叶斯分类模型;选取有效的特征数据来训练模型,最终使用该分类模型实现直肠癌有无淋巴结转移的分类与诊断。
作为优选的技术方案,所述步骤1具体包括:
步骤1.1:读取患者腹部ct影像dcm文件,转换成三维矩阵数据,使用线性归一化方法处理三维矩阵数据;
步骤1.2:设置阈值使用图像强度分析法去除ct影像中的脂肪、骨头组织,使用图像连通区域法消除影像中的设备背景干扰信息;
步骤1.3:使用图像切片技术截取影像中的选定区域部分,构建预处理后的规约数据库。
作为优选的技术方案,所述步骤2具体包括:
步骤2.1:依据现有公开的竞赛数据库构建训练样本集,资深影像医生对数据库中的ct影像进行标注,给出ct影像中直肠癌肿瘤的分割掩摸图,对ct影像中有无直肠癌肿瘤添加对应的标签;
步骤2.2:构建卷积神经网络分类器cnn,cnn网络由输入层、卷积层、激活层、池化层和全连接层构成,卷积层通过卷积操作对输入图像进行降维和特征抽取,池化层对得到的特征图像进行分块,计算这些块内的最大值或平均值,得到池化后的图像,全连接层连接所有的特征,将输出值送给分类器,最终实现图像的分类;
步骤2.3:将规约后带标签的ct数据输入cnn网络训练分类模型,经3次卷积计算和3次池化计算交叉操作后,数据流向2次全连接层,第1个全连接层实现数据特征向量的提取,第2个全连接层实现分类判断,同时经反向梯度传播计算出损失函数值,从而更新相关的权参数,经20次迭代训练后,模型损失函数值近似趋于0,完成模型的训练,据此实现ct影像有无直肠癌肿瘤的检测。
作为优选的技术方案,所述步骤3具体包括:
步骤3.1:构建unet分割模型,目前unet模型是针对医学影像器官分割的主流模型,该模型由预处理、下卷积、上卷积和输出映射4个部分构成,与cnn模型相比,unet模型中的卷积计算增加了上采样功能,这使得模型的输出层能实现原图像大小的像素级语义分割,即更适合图像分割;
步骤3.2:构建ags-unet分割模型,ags-unet是对unet模型的一种改进,在原始unet模型的上采样和下采样层连接器中加入注意力机制(attentiongates(ags))模块,实现对显著性区域的重点关注,以及对无关背景区域的抑制,进一步提高模型的分割精度;
步骤3.3:使用步骤2检测出包含直肠癌肿瘤的ct影像及医生标注的肿瘤掩摸图构建数据集,并作数据增强操作扩大数据集规模,将该数据集送入ags-unet分割模型,经训练使得该模型能实现对直肠癌肿瘤的精确分割。
作为优选的技术方案,所述步骤4具体包括:
步骤4.1:依据肿瘤影像信息诊断直肠癌有无淋巴结转移情况,需要构建相应的预测分类模型,使用影像组学技术提取肿瘤图像对应的形态学特征、纹理特征、灰度特征数据;
步骤4.2:为提高模型的泛化能力,构建有效的分类模型,对步骤4.1中提取的特征进行优化选取,使用单变量统计度量方法选择最优特征构造特征向量;
步骤4.3:依据数据量和特征向量的大小,使用支持向量机svm模型构建分类模型,分类结果表明svm模型具有最好的分类性能,据此选取该模型实现基于肿瘤影像组学特征的淋巴结转移预测诊断。
通过以上技术方案,相对于现有技术,本发明具有以下有益效果:
(1).直肠癌肿瘤的精准分割。利用现有的直肠癌患者影像数据进行数据挖掘,建立影像数据检测与分割模型,检测出患者ct影像有无肿瘤,若有则识别出肿瘤位置,进行肿瘤分割,给出肿瘤对应的掩膜图;
(2).智能判断直肠肿瘤是否发生淋巴结转移。提取直肠癌ct影像相关的肿瘤影像特征量,构建分类模型,预测淋巴结转移情况,最终给出诊断结果。
附图说明
下面结合附图和实施例对本发明进一步说明。
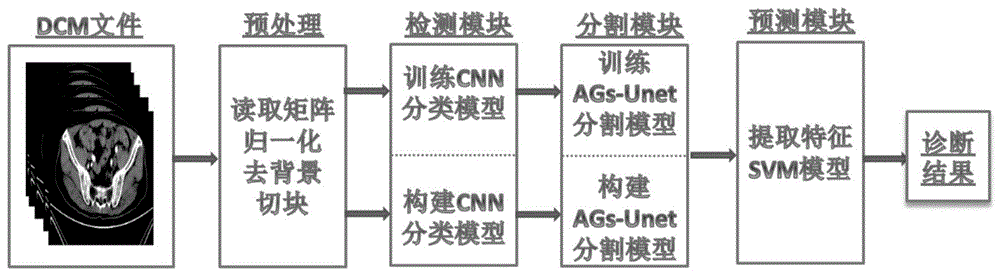
图1是本发明实施例中的直肠癌淋巴结转移的智能诊断方法及装置的流程图;
图2是本发明实施例中某患者的腹部ct影像;
图3是本发明实施例中使用卷积神经网络cnn模型检测肿瘤的流程图;
图4是本发明实施例中使用ags-unet网络模型分割肿瘤的流程图;
图5是本发明实施例中某患者的肿瘤分割图;
图6是本发明实施例中使用支持向量机svm预测淋巴结转移情况的流程图。
具体实施方式
现在结合附图对本发明作进一步详细的说明。这些附图均为简化的示意图,仅以示意方式说明本发明的基本结构,因此其仅显示与本发明有关的构成。下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
图1为本发明一种直肠癌淋巴结转移的智能诊断方法的流程图。如图所示,所述方法包括以下步骤:
步骤1、对患者腹部ct影像数据预处理,使用python编程开发技术读取dcm影像文件,将文件转换成三维数组矩阵,对该矩阵进行数据规约,具体步骤包括:
步骤1.1:使用simpleitk工具包读取患者腹部ct影像dcm文件,转换成三维矩阵数据,使用线性归一化方法处理三维矩阵数据;
步骤1.2:设置阈值使用图像强度分析法去除ct影像中的脂肪、骨头组织,使用图像连通区域法消除影像中的设备背景干扰信息;
步骤1.3:使用图像切片技术截取影像中的选定区域部分,构建预处理后的规约数据库。
步骤2、构建直肠癌ct影像分类模型,将规约后的数据作为训练样本送入构建的卷积神经网络模型进行监督学习,使用训练成熟的分类模型对ct影像数据进行分类,检测出ct影像中包含直肠癌肿瘤的vois区域,具体步骤包括:
步骤2.1:依据现有公开的竞赛数据库构建训练样本集,资深影像医生对数据库中的ct影像进行标注,给出ct影像中直肠癌肿瘤的分割掩摸图,对ct影像中有无直肠癌肿瘤添加对应的标签;
步骤2.2:使用tensorflow框架工具包构建卷积神经网络分类器cnn,cnn网络由输入层、卷积层、激活层、池化层和全连接层构成,卷积层通过卷积操作对输入图像进行降维和特征抽取,池化层对得到的特征图像进行分块,计算这些块内的最大值或平均值,得到池化后的图像,全连接层连接所有的特征,将输出值送给分类器,最终实现图像的分类;
步骤2.3:将规约后带标签的ct数据输入cnn网络训练分类模型,经3次卷积计算和3次池化计算交叉操作后,数据流向2次全连接层,第1个全连接层实现数据特征向量的提取,第2个全连接层实现分类判断,同时经反向梯度传播计算出损失函数值,从而更新相关的权参数,经20次迭代训练后,模型损失函数值近似趋于0,完成模型的训练,据此实现ct影像有无直肠癌肿瘤的检测。
设置卷积神经网络cnn的参数,定义卷积层c1:20个卷积核,卷积核大小为5*5,卷积层c2:40个卷积核,卷积核大小为4*4,卷积层c3:80个卷积核,卷积核大小为2*2,三个卷积层均用relu函数激活;三个池化层均采用最大池化操作maxpooling,pooling窗口为2x2,步长为2x2。全连接层为两层,第一层提取长度为400的特征向量,第二层使用softmax函数对特征向量分类。
步骤3、构建直肠癌ct影像肿瘤分割模型,使用改进的ags-unet网络模型,将vois区域对应的ct影像和肿瘤掩模图数据送入该模型中训练模型,使用训练成熟的分割模型识别出肿瘤位置和肿瘤对应的掩摸图,具体步骤为:
步骤3.1:使用keras框架工具包构建unet分割模型,目前unet模型是针对医学影像器官分割的主流模型,该模型由预处理、下卷积、上卷积和输出映射4个部分构成,与cnn模型相比,unet模型中的卷积计算增加了上采样功能,这使得模型的输出层能实现原图像大小的像素级语义分割,即更适合图像分割;
步骤3.2:构建ags-unet分割模型,ags-unet是对unet模型的一种改进,在原始unet模型的上采样和下采样层连接器中加入注意力机制(attentiongates(ags))模块,实现对显著性区域的重点关注,以及对无关背景区域的抑制,进一步提高模型的分割精度;
设置ags-unet网络的参数,定义三次下采样卷积层的卷积核为32、64、128,卷积核大小均为3*3,三个池化层均采用最大池化操作maxpooling,pooling窗口为2x2。三次上采样卷积层的卷积核为256、128、64,卷积核大小均为3*3,三个池化层均采用最大池化操作maxpooling,pooling窗口为2x2。三次反卷积连接操作均使用keras框架提供的concatenate函数,激活函数使用relu函数激活。
步骤3.3:使用步骤2检测出包含直肠癌肿瘤的ct影像及医生标注的肿瘤掩摸图构建数据集,并作数据增强操作扩大数据集规模,将该数据集送入ags-unet分割模型,经训练使得该模型能实现对直肠癌肿瘤的精确分割。
步骤4、对肿瘤影像区域提取放射学特征数据,包括纹理特征、灰度特征、形态特征;构建朴素贝叶斯分类模型;选取有效的特征数据来训练模型,最终使用该分类模型实现直肠癌有无淋巴结转移的分类与诊断,具体步骤为:
步骤4.1:依据肿瘤影像信息诊断直肠癌有无淋巴结转移情况,需要构建相应的预测分类模型,使用pyradiomics影像工具包提取肿瘤图像对应的形态学特征、纹理特征、灰度特征数据;
步骤4.2:为提高模型的泛化能力,构建有效的分类模型,对步骤4.1中提取的特征进行优化选取,使用单变量统计度量方法选择最优特征构造特征向量;
步骤4.3:依据数据量和特征向量的大小,使用sklearn工具包中的支持向量机svm模型构建分类模型,分类结果表明svm模型具有最好的分类性能,据此选取该模型实现基于肿瘤影像组学特征的淋巴结转移预测诊断。
实施例一
本发明一个实施例的直肠癌淋巴结转移的智能诊断方法及装置,具体包括以下步骤:
步骤1、对如图2所示的患者腹部ct影像数据预处理,使用simpleitk工具包读取dcm影像文件,使用numpy工具包将文件转换成三维数组矩阵,使用线性归一化方法处理三维矩阵数据,设置阈值使用图像强度分析法去除ct影像中的脂肪、骨头组织,使用图像连通区域法消除影像中的设备背景干扰信息,使用python切片技术截取影像中的有效区域,构建预处理后的规约数据库。
步骤2、使用卷积神经网络cnn分类器模型检测患者ct影像,识别出含有肿瘤的图像,cnn网络模型如图3所示。将规约后的ct数据输入cnn网络分类模型,经3次卷积计算和3次池化计算交叉操作后,数据流向2次全连接层,第1个全连接层实现数据特征向量的提取,第2个全连接层实现分类判断,据此实现ct影像有无直肠癌肿瘤的检测。
步骤3、使用改进的ags-unet网络模型对步骤2中检测出包含肿瘤的图像进行肿瘤分割,ags-unet网络模型如图4所示,ags-unet分割模型给出肿瘤位置和肿瘤对应的掩摸图,图5是某患者肿瘤分割结果。
步骤4、使用影像工具包提取肿瘤的放射影像特征向量,将特征向量输入支持向量机svm模型,给出淋巴结转移的预测结果,图6是淋巴结转移情况预测的流程图。
传统方法对医学影像的分割大多依靠医生手工分割,肿瘤分割精度不高,导致提取的影像组学特征不准,最终影响预测的准确率;采用深度学习技术实现直肠癌肿瘤的智能高效检测与精准分割,联合使用影像组学方法提取直肠肿瘤的特征进行分类预测,实现直肠癌肿瘤淋巴结转移的智能诊断。
以上述依据本发明的理想实施例为启示,通过上述的说明内容,相关工作人员完全可以在不偏离本项发明技术思想的范围内,进行多样的变更以及修改。本项发明的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定其技术性范围。
- 还没有人留言评论。精彩留言会获得点赞!