用于平台中立性全身图像分段的系统及方法与流程
相关申请的交叉引用本申请要求2019年1月07日提交的美国临时申请第62/789,155号、2019年4月24日提交的美国临时申请第62/837,941号、2019年6月19日提交的美国临时申请第62/863,608号、2019年7月03日提交的美国临时申请第62/870,210号、2019年9月27日提交的美国临时申请第62/907,158号、2019年11月12日提交的美国临时申请第62/934,305号的优先权及益处,所述申请中的每一者的内容以全文引用的方式并入本文中。本发明大体上涉及用于医学图像的自动分析的方法、系统及架构。更特定地说,在某些实施例中,本发明涉及个体的图像内的一或多个特定所关注区域(例如,对应于特定器官或组织)的自动鉴别。
背景技术:
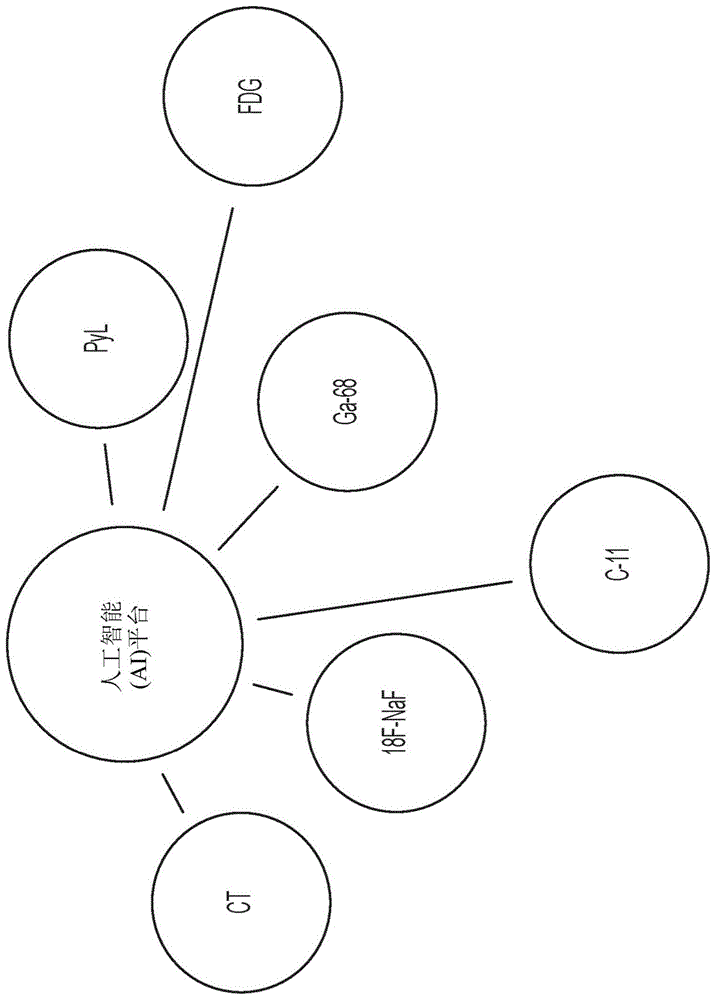
:靶向图像分析涉及使用放射性标记小分子,其结合到在疾病演变期间改变的体内特定受体、酶及蛋白质。在向患者投予之后,这些分子在血液中循环直到其发现其预期目标。已结合的放射性药品保留在疾病位点,而试剂的剩余部分自身体清除。分子的放射性部分充当信标,使得可使用全世界大部分医院中可见的常用核医学摄像机(已知为单光子发射计算机断层摄影术(single-photonemissioncomputerizedtomography;spect)或正电子发射断层摄影术(positronemissiontomography;pet)摄像机)获得描绘疾病位置及浓度的图像。医师随后可使用此信息以确定患者的疾病的存在及范围。医师可使用此信息以向患者提供建议的治疗过程且跟踪疾病的进展。存在多种可由放射科医师或医师使用的可用于分析及增强pet及spect图像的基于软件的分析技术。也存在大量可用于成像特定类型的癌症的放射性药品。用于所属领域中的成像剂包含(除其它以外包含),但不限于18f-naf、11c-胆碱、2-去氧-2[18f]氟-d-葡萄糖(fdg)及其类似者。举例来说,小分子诊断剂1404靶向前列腺特异性膜抗原(prostatespecificmembraneantigen;psma)(在>95%的前列腺癌细胞的表面上进行扩增的蛋白质及用于检测原发性及转移性前列腺癌的认证目标)的胞外域。1404用-99m标记,其为可广泛使用的、相对便宜的,有助于有效制备且具有对核医学成像应用有吸引力的光谱特征的γ发射极同位素。另一实例放射性药品为pyltm(亦已知为[18f]dcfpyl及18f-pyl),其为用于前列腺癌的临床阶段经氟化靶向psma的pet成像剂。在2016年4月的分子成像与生物学杂志期刊(issueofthejournalofmolecularimagingandbiology)中公布的概念验证研究证实通过pyltm的pet成像在假定转移性疾病及原发性肿瘤的位点中展示高水平的pyltm吸收,从而表明在检测前列腺癌中有高敏感性及特异性的潜能。肿瘤学家可使用来自患者的靶向pet或spect研究的图像作为其评估以下的输入:患者是否患有特定疾病(例如前列腺癌)、疾病的何种阶段为明显的、经建议的治疗过程(如果存在)将为什么、是否指示手术干预及可能的预后。肿瘤学家可将放射科医师报告用于此评估中。放射科医师报告为由放射科医师针对请求成像研究的医师而制备的对pet或spect图像的技术评估,且包含例如所执行的研究类型、临床历史、图像之间的比较、用于执行研究的技术、放射科医师的观测及发现,以及放射科医师可基于成像研究结果得出的总体印象及建议。将署名的放射科医师报告发送到预订研究的医师以供医师审查,接着医师与患者之间就结果及治疗建议进行讨论。因此,所述过程涉及使放射科医师对患者执行成像研究;分析所获得的图像;创建放射科医师报告;将报告转发到请求医师;使医师制定评估及治疗建议;及使医师将结果、建议及风险传达到患者。所述过程也可涉及由于不确定结果而重复成像研究或基于初始结果预订其它测试。如果成像研究展示患者患有特定疾病或病状(例如,癌症),那么医师会论述不同治疗选项(包含手术)以及不做任何事或采用谨慎等待或主动监测方法而不进行手术的风险。从医师的视角及从患者的视角二者来看,存在与此过程相关的限制。虽然放射科医师的报告必然有帮助,但医师最终必须依赖于其在对其患者制定评估及建议中的经验。此外,患者必须对其医师非常信任。医师可对患者展示其pet/spect图像且可告知患者与不同治疗选项相关的数值风险或特定预后的可能性,但患者可能很难理解此信息。此外,患者的家人将有可能具有问题,尤其当癌症经诊断,但患者选择不进行手术时。患者和/或其家族成员可在线上搜索补充信息且可产生关于诊断病状的风险的误会。艰难的考验可变得更具创伤性。因此,仍需要用于改进医学成像研究的自动分析且将那些结果、诊断、预后、治疗建议及相关风险传达到患者的系统及方法。尤其需要的是一种在整个身体中持续地、有效地及精确地检测解剖区域(包含软组织器官)的图像分析系统。技术实现要素:本文提出自动分析个体的三维(3d)医学图像以便自动鉴别所述3d图像内对应于特定解剖区域(例如,器官和/或组织)的特定3d体积的系统及方法。值得注意地,本文中所描述的图像分析方法不限于身体的单个特定器官或部分。相反,其较为稳定及可广泛适用,从而提供整个身体中的解剖区域(包含组织和/或器官)的一致、有效及精确的检测。在某些实施例中,一或多个此类体积的精确鉴别用于自动测定表示放射性药品在特定器官和/或组织区域中的吸收的定量度量。这些吸收度量可用于评估个体的疾病状态、测定个体的预后和/或测定治疗模式的功效。相比于仅鉴别2d图像中的2d区域的某些其它图像分析,本文中所描述的方法处理3d图像的能力是一重要优势。举例来说,有关于癌症检测的一种方法(exinidiagnosticsab的骨扫描指标(bsi)软件)检测疑似骨癌的区域(亦参见2014年10月7日发布的美国专利申请案第8,855,387号)。然而,与三维图像相反,对二维闪烁摄影术图像实行bsi分析。此外,随着可用于医师检测癌症的成像剂的选项不断增加,仍需要在使用多个检测模式(spect/ct、pet/ct及其类似者)分析来自任何各种成像剂的图像中具有效用的软件。例如spect及pet的功能图像提供关于体内生物过程的详细及特定信息,但其潜能仅在与详细解剖图组合时得以实现以使得功能可局部化于个别器官及结构。虽然ct及mri提供详细解剖信息,但器官及结构的常规(例如手动)鉴别为困难、主观及费时的,从而使某些评估在无计算机支持的情况下是不可行的。因此,通过提供允许适用于各种成像模式的精确及稳固图像分段的平台中立性图像分析方法,本文中所描述的系统及方法有助于与癌症检测、诊断、分期及其类似者特定有关的图像分析。举例来说,本文中所描述的全身分段方法允许解剖及功能图像的组合的自动分析以便精确地鉴别且分级个体内的癌病变。特定地说,在投予放射性药品,例如psma结合剂(如pyltm)后,可获得个体的pet/ct复合图像。本文中所描述的基于机器学习的自动分段方法用于在pet/ct复合物的ct图像内鉴别表示其中可能发现癌病变的目标组织区域的目标所关注体积(volumeofinterest;voi)。举例来说,可鉴别对应于个体的一或多个骨的图形表示的骨骼voi。一旦在解剖、ct、图像中鉴别出骨骼voi,那么可将其映射到pet图像以鉴别其中的对应骨骼体积。随后分析pet图像中的对应骨骼体积以检测一或多个相对高强度的局部化区域(称作热点)。这些热点在物理上对应于放射性药品积累增加的局部区域,且因此对应于潜在癌病变。在某些实施例中,利用经由本文中所描述的方法精确地及快速地执行全身分段的能力以提供有用及均一比例,在所述比例上评价和/或测量在对应于经检测热点的物理病变中的放射性药品吸收水平(例如,借此对特定生物分子(例如psma)的表达水平进行分级)。特定地说,除检测对应于其中可发生癌病变的特定目标组织区域的目标voi以外,还检测对应于参考组织区域的额外目标voi。另外将这些参考voi映射到pet图像以鉴别其中的对应参考体积。随后计算这些参考体积内的强度测量值(例如平均值、峰值、最大值等)且用作参考点,针对所述参考点评价个别经检测热点的强度且将其按比例转换为指标值。举例来说,在某些实施例中,在解剖图像内鉴别分别对应于主动脉及肝脏的一部分的表示的主动脉及肝脏voi且将其映射到功能图像以鉴别其中的对应参考体积。测定这些参考体积中的每一者的强度水平(例如,作为各参考体积内的立体像素强度的平均值、中位值、峰值等),且将其按一定比例分配对应指标水平。随后,针对各特定个别热点,测定热点强度水平(例如类似地,作为经检测热点内的立体像素强度的平均值、中位值、峰值等)。随后基于个别热点强度水平、主动脉参考强度水平及肝脏参考强度水平测定对应个别热点指标值。此方法提供评价及测量与不同图像之间的热点相关的吸收的标准化比例。举例来说,此允许比较在不同时间点针对单个个体所获得的多个图像以及不同个体的图像之间的比较。在某些实施例中,个别热点指标用于计算分析癌病变存在的个体和/或特定目标组织区域的总体指标。总体指标可充当疾病严重程度和/或风险的指示符,例如通过反映特定目标组织区域内的总病变体积,利用基于个别经检测热点的热点指标值的加权以解释病变内的放射性药品吸收。举例来说,骨骼体积内的psma加权总病变体积可计算为由其对应指标值加权的个别经检测热点体积的加权和。此指标可将癌转移的水平和/或侵袭性反映到骨中。对应于其它组织区域的体积可经类似地鉴别且用于测定总体指标值。举例来说,淋巴结体积也可用于评估癌转移的严重程度。也可鉴别及分析对应于最初发现局部化疾病的组织区域的体积以检测病变。举例来说,前列腺体积可用于评估前列腺癌在其初始阶段的严重程度。同样地,表示乳房组织区域的乳房体积及表示肺组织区域的肺体积可分别用于评估局部化乳癌及肺癌。因此,通过提供全身分段及对整个遍及个体身体的各种相关目标组织区域中的癌病变的基于图像的自动分析,本文中所描述的基于ai的系统及方法允许分析处于不同阶段的各种癌症。所述技术可用于鉴别有关组织区域中的局部化疾病(例如前列腺)且对其分期,例如用于初期筛选及监测;以及随着疾病进展而监测癌转移的区域,例如骨及淋巴结。同样地,本文中所描述的方法提供一套完整的工具以用于癌症的基于图像的自动检测,且跟踪疾病演变、进展及对治疗的反应。在一个方面,本发明涉及一种用于自动处理3d图像以鉴别所述3d图像内对应于特定目标组织区域的3d体积的方法,所述方法包括:(a)通过计算装置的处理器接收使用解剖成像模式[例如x射线计算机断层摄影术(ct);例如磁共振成像(magneticresonanceimaging;mri);例如超声波]所获得的个体的3d解剖图像,其中所述3d解剖图像包括个体内的组织(例如,软组织和/或骨)的图形表示;(b)针对多个目标组织区域中的每一者,通过所述处理器使用一或多个机器学习模块(例如,其中所述一或多个机器学习模块中的至少一者为卷积神经网络(convolutionalneuralnetwork;cnn)模块)自动鉴别所述3d解剖图像内的对应目标所关注体积(voi);(c)通过所述处理器测定表示多个3d分段掩模的3d分段图,各3d分段掩模表示特定鉴别的目标voi(例如,将所述多个3d分段掩模自动以数字方式拼接在一起以形成所述3d分段图);及(d)存储和/或提供所述3d分段图以用于显示和/或进一步处理。在某些实施例中,3d解剖图像为全身图像。在某些实施例中,步骤(c)包括将多个3d分段掩模以数字方式拼接在一起以形成3d分段图{例如,通过创建最初的空图像体积(例如,将所有立体像素值初始化成零)且接着将标记从各分段掩模插入到图像体积中[例如,通过将输入图像到一或多个机器学习模块的所标记(例如,作为表示如由机器学习模块测定的特定目标组织区域)立体像素映射到图像体积的立体像素(例如,以便将图像体积的立体像素与表示相同物理位置的输入图像的立体像素匹配,借此正确地标记图像体积的立体像素)]}。在某些实施例中,步骤(b)包括针对至少一个特定目标组织区域:使用第一模块(例如,定位模块)(例如,第一机器学习模块)测定3d解剖图像内的初始voi,所述初始voi对应于解剖区域(例如一组相关组织,例如骨盆区域、胸部区域、头部和/或颈部区域及其类似者),所述解剖区域含有特定目标组织区域(例如,其中初始voi会排除3d解剖图像中比其所包含更多的立体像素;例如,其中初始voi包含3d解剖图像的小于25%的立体像素;例如,其中初始voi内的大部分立体像素表示解剖区域内的物理体积);及使用第二模块(例如分段模块)(例如,第二机器学习模块)鉴别初始voi内对应于特定目标组织区域的目标voi。在某些实施例中,第二模块为实施cnn的cnn模块。在某些实施例中,第一模块为cnn模块,其实施cnn以执行粗略分段来自动鉴别对应于含有特定目标组织区域的解剖区域的初始voi[例如,通过自动鉴别解剖图像内一组相关组织的图形表示(例如,且随后将初始voi测定为完全包围所述组相关组织的经鉴别图形表示的矩形区域(例如,矩形柱或矩形框))][例如针对预期位于解剖区域内的一或多个特定组织区域中的每一者,通过自动鉴别解剖图像中的对应voi(例如,经由粗略分段),例如且将初始voi测定为完全包围对应于特定组织区域的所有经鉴别voi的矩形区域]。在某些实施例中,第一模块接收解剖图像的子采样[例如,利用沿着一或多个维度的两个或多于两个(例如四个)因素]版本作为输入,且使用解剖图像的子采样版本鉴别初始voi[例如,且其中第二模块接收裁剪到初始voi的解剖图像的全分辨率版本(例如,使得第一模块对表示物理体积比第二模块大的较低分辨率图像进行操作,而第二模块对较高分辨率但表示较小物理体积的图像进行操作)]。在某些实施例中,第一模块为第一cnn模块且第二模块为第二cnn模块,且其中第一cnn模块包括额外滤波器以便解释图像大小相对于第二cnn模块增大的变化率。在某些实施例中,3d解剖图像为全身图像且步骤(b)包括:使用一或多个实施机器学习技术的定位模块(例如,其中各定位模块为实施cnn的cnn模块)自动测定3d解剖图像内的多个初始voi,各初始voi对应于特定解剖区域(例如一组相关组织,例如骨盆区域、胸部区域、头部和/或颈部区域、脊柱区域、上半身区域、下半身区域等)且目标voi的相关子集位于其中;及针对各初始voi,使用一或多个实施机器学习技术的分段模块(例如,其中各分段模块为实施cnn的cnn模块)自动鉴别目标voi的相关子集。在某些实施例中,多个初始voi包括一或多个选自由以下组成的群组的成员:对应于个体的骨盆区域的骨盆区域初始voi(例如,其中位于骨盆区域初始voi中的目标voi子集包括一或多个对应于选自由以下组成的群组的目标组织区域的目标voi:左髂骨和/或右髂骨、骶骨及尾骨);对应于个体的脊柱的脊柱区域初始voi(例如,其中位于骨盆区域初始voi中的目标voi子集包括一或多个对应于选自由以下组成的群组的目标组织区域的目标voi:胸椎、腰椎及胸骨);对应于个体的上半身的左侧的左上半身区域初始voi(例如,其中位于骨盆区域初始voi中的目标voi子集包括一或多个对应于选自由以下组成的群组的目标组织区域的目标voi:一或多个左肋、左肩胛骨及左锁骨);及对应于个体的上半身的右侧的右上半身区域初始voi(例如,其中位于骨盆区域初始voi中的目标voi子集包括一或多个对应于选自由以下组成的群组的目标组织区域的目标voi:一或多个右肋、右肩胛骨及右锁骨)。在某些实施例中,方法包括:(e)通过处理器接收使用功能成像模式[例如单光子发射计算机断层摄影术(spect);例如正电子发射断层摄影术(pet)]所获得的个体的3d功能图像[例如,其中3d功能图像包括多个立体像素,其各自表示个体内的特定物理体积且具有表示从特定物理体积发射的所检测辐射的强度值,其中3d功能图像的多个立体像素的至少一部分表示个体的目标组织区域中的一或多者内的物理体积];及(f)通过处理器使用3d分段图在3d功能图像内鉴别一或多个各自对应于鉴别的目标voi的3d体积(例如,通过将3d分段图的3d分段掩模映射到3d功能图像)。在某些实施例中,方法包括:(g)通过处理器测定个体的癌症状态[(例如前列腺癌状态;例如转移癌状态(例如转移癌,包含例如转移性前列腺癌、乳癌、肺癌、结肠癌、皮肤癌等))](例如,使用功能图像内的立体像素强度及一或多个经鉴别3d体积)(例如,基于经检测病变)[例如,个体患有和/或罹患前列腺癌和/或特定阶段的前列腺癌(例如,转移性前列腺癌)的可能性][例如,个体患有和/或罹患转移癌(包含例如转移性前列腺癌、乳癌、肺癌、结肠癌、皮肤癌等)的可能性]。在某些实施例中,方法包括:针对在不同时间点采集的多个解剖及对应功能图像,反复地执行步骤(a)至(g)以测定在各时间点个体的癌症状态,借此跟踪随着时间推移的癌症状态(例如,评价疾病进展和/或治疗功效)。在某些实施例中,方法包括(例如,在步骤(g)之前):(h)通过处理器自动调节3d功能图像的立体像素强度以校正一或多个背景组织区域中的背景吸收(例如,放射性药品的吸收)(例如,校正在正常情形下发生在一或多个背景组织区域中且不必指示癌病变存在的放射性药品的吸收)。在某些实施例中,目标组织区域包括一或多个背景组织区域且步骤(h)包括:使用3d分段图以在3d功能图像内鉴别一或多个各自对应特定背景组织区域的3d背景组织体积(例如,通过将3d分段图的3d分段掩模映射到3d功能图像);及基于3d背景组织体积内的立体像素强度调节3d功能图像的立体像素强度(例如,通过使用3d背景组织体积内的立体像素强度来估计对3d背景组织体积外部的强度的贡献)。在某些实施例中,一或多个背景组织区域包括一或多个选自由以下组成的群组的成员:膀胱(bladder)(例如,膀胱)、肾脏、十二指肠、小肠、脾、肝脏、胰脏、胃、肾上腺、直肠及睾丸。在某些实施例中,方法包括:(i)通过处理器自动检测3d功能图像内的一或多个热点,所述热点基于3d功能图像内的立体像素强度[例如基于3d功能图像内的强度与阈值的比较(例如,其中3d功能图像为3dpet图像且阈值为特定标准吸收值(standarduptakevalue;suv)水平)](例如,且另外基于3d功能图像内鉴别的一或多个3d体积)经测定以表示病变。在某些实施例中,步骤(i)包括使用一或多个阈值[例如比较具有一或多个阈值的3d功能图像的立体像素强度(例如,其中一或多个阈值包括多个区域特定阈值,其各自用于3d功能图像内所鉴别的一或多个3d体积的特定子集)]。在某些实施例中,步骤(i)包括将一或多个滤波器应用于3d功能图像[例如,如同斑点(blob)检测技术;例如,其中一或多个滤波器包括一或多个高斯(gaussian)滤波器(例如高通高斯滤波器及低通高斯滤波器,如同高斯差分(differenceofgaussians)方法);例如,其中一或多个滤波器包括拉普拉斯(laplacian)滤波器(例如,如同高斯拉普拉斯(laplacianofagaussian)技术);例如,其中不同滤波器核用于3d功能图像内所鉴别的一或多个3d体积的不同子集]。在某些实施例中,步骤(i)包括使用两种或多于两种技术的组合以鉴别3d功能图像内所鉴别的一或多个3d体积的不同子集中的热点[例如,针对一或多个3d体积的第一子集使用第一滤波方法(例如,如同段落[0038])且针对第二子集使用第二滤波方法;例如针对一或多个3d体积的第一子集使用定限方法(例如,如段落[0037])且针对一或多个3d体积的第二子集使用滤波方法(例如,如段落[0038])]。在某些实施例中,步骤(i)包括:检测热点的初始集合,且针对初始集合的热点的至少一部分,将经检测热点的至少一部分的各热点分类为癌病变或非癌病变(例如,如噪声)[例如使用机器学习模块;例如基于热点的形状和/或位置(例如,结合解剖知识;例如,其中位置包含对应于热点位于其中的3d体积的特定目标组织区域的鉴别和/或特定目标组织区域内热点的相对位置);例如且从初始集合去除分类为非癌病变的热点,借此获得经测定以表示病变的热点的最终集合]。在某些实施例中,目标组织区域包括一或多个背景组织区域且方法包括:使用3d分段图以在3d功能图像内鉴别一或多个各自对应特定背景组织区域(例如,其中显著的放射性药品吸收在正常情形下发生且不必指示癌病变存在的背景组织区域)的3d背景组织体积(例如,通过将3d分段图的3d分段掩模映射到3d功能图像);且从用于在步骤(i)处自动检测一或多个热点的立体像素中排除3d背景组织内的3d立体像素。在某些实施例中,方法包括使用一或多个经检测热点(例如,一或多个经检测热点的强度)以测定个体的癌症状态。在某些实施例中,目标组织区域包括一或多个参考组织区域且方法包括:使用3d分段图以通过处理器在3d功能图像内鉴别一或多个3d参考体积,其各自对应于特定参考组织区域;通过处理器测定一或多个参考强度值,其各自与一或多个3d参考体积的特定3d参考体积相关且对应于特定3d参考体积内的强度测量值(例如,平均值(average/mean)、中位值、最大值等);通过处理器测定一或多个个别热点强度值,其各自与经检测的一或多个热点的至少一部分的特定热点相关且对应于特定热点的强度测量值(例如,平均值、中位值、最大值等);及通过处理器,使用一或多个个别热点强度值及一或多个参考强度值测定一或多个个别热点指标值[例如,其中各个别热点指标值与经检测的一或多个热点的至少一部分的特定热点相关,且使用(i)与特定热点相关的个别热点强度值及(ii)一或多个参考强度值(例如,基于其之间的比较)来测定]。在某些实施例中,测定一或多个个别热点指标值包括将一或多个参考强度值中的每一者按一定比例映射到对应参考指标值,且针对各个别热点强度值,使用参考强度值及对应参考指标值以内插对应个别热点指标值。在某些实施例中,参考组织区域包括一或多个选自由以下组成的群组的成员:肝脏、主动脉(例如胸部主动脉部分;例如腹部主动脉部分)及腮腺。在某些实施例中,第一参考强度值(i)为与对应于主动脉部分的3d参考体积相关的血液参考强度值,且(ii)映射到第一参考指标值;第二参考强度值(i)为与对应于肝脏的3d参考体积相关的肝脏参考强度值,且(ii)映射到第二参考指标值;以及第二参考强度值大于第一参考强度值且第二参考指标值大于第一参考指标值。在某些实施例中,参考强度值包括映射到最大参考指标值的最大参考强度值,且具有大于最大参考强度值的相关热点强度值的热点经分配等于最大参考指标值的热点指标值。在某些实施例中,方法包括通过处理器使用一或多个热点指标值的至少一部分测定指示个体的癌症状态的总体指标值。在某些实施例中,总体指标值测定为个别热点指标值的至少一部分[例如,位于对应于个体的骨骼区域的功能图像的3d体积内;例如位于对应于个体的淋巴区域的功能图像的3d体积内]的加权和[例如,其中各热点指标值的总和由相关热点的大小测量值(例如3d体积;例如平均直径)加权]。在某些实施例中,总体指标值与解剖图像内所鉴别的对应于特定目标voi的特定目标组织区域相关;且总体指标值是使用位于3d功能图像中对应于特定鉴别目标voi的特定3d体积内的热点子集的热点指标值来测定[例如,且其中总体指标值计算为热点子集的热点指标值的加权和(例如,其中加权和由特定目标组织区域的估计体积标准化(例如,计算为功能图像中特定3d体积的体积和/或特定目标voi的体积))]。在某些实施例中,特定目标组织区域是选自由以下组成的群组:包括个体的一或多个骨的骨骼区域、淋巴区域及前列腺区域。在某些实施例中,3d解剖图像为x射线计算机断层摄影术(ct)图像,且3d功能图像为3d单光子发射计算机断层摄影术(spect)图像。在某些实施例中,3d解剖图像为x射线计算机断层摄影术(ct)图像,且3d功能图像为3d正电子发射断层摄影术(pet)图像。在某些实施例中,在向个体投予包括前列腺特异性膜抗原(psma)结合剂的放射性药品后,获得个体的3dpet图像。在某些实施例中,放射性药品包括[18f]dcfpyl。在某些实施例中,步骤(b)包括通过处理器裁剪3d解剖图像以去除表示空气的立体像素[例如创建经裁剪的解剖图像,且使用经裁剪的解剖图像以鉴别一或多个目标voi(例如,使用经裁剪的解剖图像作为输入用于一或多个机器学习模块,与原始大小的3d解剖图像相反)]。在某些实施例中,目标组织区域包括一或多个选自由以下组成的群组的成员:左髋骨、右髋骨、骶骨及尾骨区域、左锁骨、右锁骨、左肋、右肋、左肩胛骨、右肩胛骨、胸骨、腰椎、胸椎、颅骨、颈椎、左股骨、右股骨、左肱骨、右肱骨、前列腺、膀胱、直肠、左臀大肌、右臀大肌、主动脉(例如胸部主动脉部分;例如腹部主动脉部分)、左肾脏、右肾脏、肝脏、左肺、右肺、脾、脑室、左肾上腺、右肾上腺、胆囊、大脑、胰脏、心脏、下颌骨、左支气管、右支气管、气管、左髂总动脉(leftcommoniliacartery)、右髂总动脉及腮腺。在某些实施例中,目标组织区域中的一或多者包括一或多个选自由以下组成的群组的特定骨:左锁骨、右锁骨、左股骨、右股骨、左腓骨、右腓骨、左髋骨、右髋骨、左肱骨、右肱骨、下颌骨、左髌骨、右髌骨、左桡骨、右桡骨、左胫骨、右胫骨、左尺骨、右尺骨、左肋(例如,第一左肋、第二左肋、第三左肋、第四左肋、第五左肋、第六左肋、第七左肋、第八左肋、第九左肋、第十左肋、第十一左肋、第十二左肋)、右肋(例如,第一右肋、第二右肋、第三右肋、第四右肋、第五右肋、第六右肋、第七右肋、第八右肋、第九右肋、第十右肋、第十一右肋、第十二右肋)、骶骨及尾骨(例如,经合并的骶骨及尾骨区域;例如单独地骶骨及尾骨,以便区分两者)、左肩胛骨、右肩胛骨、颅骨、胸骨、脊椎骨区域[例如颈椎区域,包括一或多个(例如至多所有)颈椎;例如腰椎区域,包括一或多个(例如至多所有)腰椎;例如胸椎区域,包括一或多个(例如至多所有)胸椎],及个别脊椎骨[例如个别颈椎(例如,第一颈椎、第二颈椎、第三颈椎、第四颈椎、第五颈椎、第六颈椎、第七颈椎);例如个别腰椎(例如,第一腰椎、第二腰椎、第三腰椎、第四腰椎、第五腰椎、第六腰椎);例如个别胸椎(例如,第一胸椎、第二胸椎、第三胸椎、第四胸椎、第五胸椎、第六胸椎、第七胸椎、第八胸椎、第九胸椎、第十胸椎、第十一胸椎、第十二胸椎)]。在某些实施例中,目标组织区域中的一或多者包括一或多个选自由以下组成的群组的特定骨:左锁骨、右锁骨、左髋骨、右髋骨、左肋(例如,第一左肋、第二左肋、第三左肋、第四左肋、第五左肋、第六左肋、第七左肋、第八左肋、第九左肋、第十左肋、第十一左肋、第十二左肋)、右肋(例如,第一右肋、第二右肋、第三右肋、第四右肋、第五右肋、第六右肋、第七右肋、第八右肋、第九右肋、第十右肋、第十一右肋、第十二右肋)、骶骨及尾骨(例如,经合并的骶骨及尾骨区域;例如单独地骶骨及尾骨,以便区分两者)、左肩胛骨、右肩胛骨、胸骨、脊椎骨区域[例如颈椎区域,包括一或多个(例如至多所有)颈椎;例如腰椎区域,包括一或多个(例如至多所有)腰椎;例如胸椎区域,包括一或多个(例如至多所有)胸椎],及个别脊椎骨[例如个别腰椎(例如,第一腰椎、第二腰椎、第三腰椎、第四腰椎、第五腰椎);例如个别胸椎(例如,第一胸椎、第二胸椎、第三胸椎、第四胸椎、第五胸椎、第六胸椎、第七胸椎、第八胸椎、第九胸椎、第十胸椎、第十一胸椎、第十二胸椎)]。在某些实施例中,目标组织区域中的一或多者包括一或多个选自由以下组成的群组的软组织区域(例如器官):左肾上腺、右肾上腺、主动脉(例如胸部主动脉部分;例如腹部主动脉部分)、大脑、左支气管、右支气管、胆囊、左臀大肌、右臀大肌、心脏、左总胯动脉、右总胯动脉、左肾脏、右肾脏、肝脏、左肺、右肺、胰脏、前列腺、直肠、脾、气管、膀胱、脑室及腮腺。在某些实施例中,一或多个目标组织区域包括一或多个选自由以下组成的群组的软组织区域(例如器官):胆囊、左肾脏、右肾脏、肝脏、左肺、右肺、前列腺及膀胱。在某些实施例中,目标组织区域包括一或多个骨区域,其各从对应于特定骨[例如,其中目标组织区域包括段落[0058]或[0059]中所列的至少一部分(例如,至多所有)骨];及一或多个软组织区域,其各自对应于特定软组织区域[例如,其中目标组织区域包括段落[0060]或[0061]中所列的至少一部分(例如,至多所有)软组织区域]。在另一方面,本发明涉及一种用于自动处理3d图像以自动鉴别个体内的癌病变的方法,所述方法包括:(a)通过计算装置的处理器接收使用解剖成像模式[例如x射线计算机断层摄影术(ct);例如磁共振成像(mri);例如超声波]所获得的个体的3d解剖图像,其中所述3d解剖图像包括所述个体内的组织(例如,软组织和/或骨)的图形表示;(b)针对多个目标组织区域中的每一者,通过所述处理器使用一或多个机器学习模块(例如,其中所述一或多个机器学习模块中的至少一者为卷积神经网络(cnn)模块)自动鉴别所述3d解剖图像内的对应目标所关注体积(voi);(c)通过所述处理器测定表示多个3d分段掩模的3d分段图,各3d分段掩模表示特定鉴别的目标voi(例如,将所述多个3d分段掩模自动以数字方式拼接在一起以形成所述3d分段图);(d)通过所述处理器接收使用功能成像模式[例如单光子发射计算机断层摄影术(spect);例如正电子发射断层摄影术(pet)]所获得的所述个体的3d功能图像[例如,其中所述3d功能图像包括多个立体像素,其各自表示所述个体内的特定物理体积且具有表示从所述特定物理体积发射的所检测辐射的强度值,其中所述3d功能图像的所述多个立体像素的至少一部分表示所述个体的所述目标组织区域中的一或多者内的物理体积];(e)使用所述3d分段图在所述3d功能图像内鉴别一或多个各自对应于鉴别的目标voi的3d体积(例如,通过将所述3d分段图的3d分段掩模映射到所述3d功能图像);及(f)通过所述处理器,在所述3d功能图像内鉴别的所述一或多个3d体积的至少一部分内自动检测一或多个热点,所述热点基于所述3d功能图像内的立体像素强度[例如,基于3d功能图像内的强度与阈值的比较(例如,其中所述3d功能图像为3dpet图像且所述阈值为特定标准吸收值(suv)水平)]经测定以表示病变。在某些实施例中,方法包括通过处理器使用一或多个经检测热点(例如,一或多个经检测热点的强度)以测定个体的癌症状态。在某些实施例中,目标组织区域包括一或多个参考组织区域且其中方法包括:使用3d分段图以通过处理器在3d功能图像内鉴别一或多个3d参考体积,其各自对应于特定参考组织区域;测定一或多个参考强度值,其各自与一或多个3d参考体积的特定3d参考体积相关且对应于特定3d参考体积内的强度测量值(例如,平均值、中位值、最大值等);通过处理器测定一或多个个别热点强度值,其各自与经检测的一或多个热点的至少一部分的特定热点相关且对应于特定热点的强度测量值(例如,平均值、中位值、最大值等);及通过处理器,使用一或多个个别热点强度值及一或多个参考强度值测定一或多个个别热点指标值[例如,其中各个别热点指标值与经检测的一或多个热点的至少一部分的特定热点相关,且使用(i)与特定热点相关的个别热点强度值及(ii)一或多个参考强度值(例如,基于其之间的比较)来测定]。在某些实施例中,参考组织区域包括一或多个选自由以下组成的群组的成员:肝脏、主动脉(例如胸部主动脉部分;例如腹部主动脉部分)及腮腺。在某些实施例中,方法包括通过处理器使用一或多个热点指标值的至少一部分测定指示个体的癌症状态的总体指标值。在某些实施例中,总体指标值测定为个别热点指标值的至少一部分[例如,位于对应于个体的骨骼区域的功能图像的3d体积内;例如位于对应于个体的淋巴区域的功能图像的3d体积内]的加权和[例如,其中各热点指标值的总和由相关热点的大小测量值(例如3d体积;例如平均直径)加权]。在某些实施例中,3d解剖图像为x射线计算机断层摄影术(ct)图像,且3d功能图像为3d正电子发射断层摄影术(pet)图像。在某些实施例中,在向个体投予包括前列腺特异性膜抗原(psma)结合剂的放射性药品后,获得个体的3dpet图像。在某些实施例中,放射性药品包括[18f]dcfpyl。在另一方面,本发明涉及一种用于自动处理3d图像以鉴别及测量放射性药品在患有癌症(例如前列腺癌、乳癌、肺癌;例如转移癌,例如转移性前列腺癌、转移性乳癌、转移性肺癌)或处于其风险下的个体内的癌病变(例如癌转移)中的吸收的方法,所述方法包括:(a)通过计算装置的处理器接收使用解剖成像模式[例如x射线计算机断层摄影术(ct);例如磁共振成像(mri);例如超声波]所获得的个体的3d解剖图像,其中所述3d解剖图像包括所述个体内的组织(例如,软组织和/或骨)的图形表示;(b)通过所述处理器,使用一或多个机器学习模块(例如,其中所述机器学习模块中的至少一者为卷积神经网络(cnn)模块)在所述3d解剖图像内自动鉴别:第一骨骼体积,其包括所述个体的一或多个骨的图形表示;第一主动脉体积,其包括所述个体的主动脉的至少一部分的图形表示;及第一肝脏体积,其包括所述个体的肝脏的图形表示;(c)通过所述处理器测定表示多个3d分段掩模的3d分段图,所述3d分段掩模包含表示经鉴别的第一骨骼体积的骨骼掩模、表示经鉴别的第一主动脉体积的主动脉掩模及表示经鉴别的第一肝脏体积的肝脏掩模;(d)通过所述处理器接收使用功能成像模式[例如单光子发射计算机断层摄影术(spect);例如正电子发射断层摄影术(pet)]所获得的所述个体的3d功能图像[例如,其中所述3d功能图像包括多个立体像素,其各自表示所述个体内的特定物理体积且具有表示从所述特定物理体积发射的所检测辐射的强度值,其中所述3d功能图像的所述多个立体像素的至少一部分表示所述个体的一或多个骨、主动脉部分和/或肝脏内的物理体积];(e)使用所述3d分段图在所述3d功能图像内自动鉴别(例如,通过将所述3d分段图的所述3d分段掩模映射到所述3d功能图像):第二骨骼体积,其对应于所述3d解剖图像内的第一鉴别骨骼体积;第二主动脉体积,其对应于所述3d解剖图像内鉴别的第一主动脉体积;及第二肝脏体积,其对应于所述3d解剖图像内鉴别的第一肝脏体积;(f)通过所述处理器,在所述第二骨骼体积内自动检测一或多个热点,所述热点基于所述第二骨骼体积内的立体像素强度经测定以表示病变(例如,所述一或多个热点对应于相对高强度的局部化区域,例如基于位于第二骨骼体积内的立体像素强度与阈值的比较来鉴别);及(g)针对所述一或多个经检测热点中的每一者,通过所述处理器通过以下方式来测定个别热点指标(例如,指示在由经检测热点表示的所述病变中的放射性药品吸收的测量值)值:基于所述第二主动脉体积内立体像素的强度测量值(例如,平均值、最大值、中位值等)测定主动脉参考强度水平;基于所述第二肝脏体积内立体像素的强度测量值(例如,平均值、最大值、中位值等)测定肝脏参考强度水平;且针对各个别经检测热点:基于经检测热点的立体像素的强度测量值(例如,平均值、最大值、中位值等)测定对应个别热点强度水平;及根据所述个别热点强度水平、所述主动脉参考强度水平及所述肝脏参考强度水平测定对应个别热点指标水平。在某些实施例中,方法包括通过处理器基于一或多个经检测热点的至少一部分的个别热点指标值测定指示个体的癌症状态的总体指标值。在某些实施例中,个体患有前列腺癌或处于其风险下。在某些实施例中,步骤(b)包括在3d解剖图像内自动鉴别包括个体的前列腺的图形表示的第一前列腺体积,在步骤(c)处测定的3d分段图进一步包含表示经鉴别的第一前列腺体积的前列腺掩模,步骤(e)包括在3d功能图像内自动鉴别对应于3d解剖图像内的第一鉴别前列腺体积的第二前列腺体积,步骤(f)包括自动检测第二前列腺体积中的一或多个热点,且方法进一步包括:通过处理器,(i)基于定位于第二骨骼体积中的一或多个经检测热点的至少一部分的个别热点指标值测定指示个体的一或多个骨中的病变含量(例如,及严重程度)的总体骨指标值;及(ii)基于位于第二前列腺体积中的一或多个经检测热点的至少一部分的个别热点指标值测定指示个体之前列腺中的病变含量(例如,及严重程度)的总体前列腺指标值。在某些实施例中,个体患有转移癌(例如,转移性前列腺癌、转移性乳癌、转移性肺癌及其它转移性骨癌)或处于其风险下。在另一方面,本发明涉及一种用于自动处理不同大小的全身3d解剖图像集合以在各3d解剖图像内自动鉴别对应于特定目标组织区域的多个3d体积的方法,所述方法包括:(a)通过计算装置的处理器接收使用解剖成像模式[例如x射线计算机断层摄影术(ct);例如磁共振成像(mri);例如超声波]所获得的一或多个个体的3d解剖图像集合,其中所述3d解剖图像包括所述一或多个个体中的每一者内的组织(例如,软组织和/或骨)的图形表示,其中所述3d解剖图像集合具有平均x维、平均y维及平均z维,其(所述平均x维、所述平均y维或所述平均z维)中的至少一者具有对应平均值的至少3%的标准差[例如,其(所述平均x维、所述平均y维或所述平均z维)中的至少一者具有至少3%、至少5%、至少10%、至少15%或至少20%的相对标准差];及(b)通过所述处理器,使用实施cnn的定位模块在所述3d解剖图像集合的各图像内自动测定至少一个对应于包括一或多个特定相关目标组织区域(例如一或多个特定骨,例如一或多个特定器官)的特定解剖区域(例如一组相关组织,例如骨盆区域及旋转区域)的初始voi,借此鉴别对应3d解剖图像的至少一个初始voi;及(c)针对各初始voi,通过所述处理器,使用各自对与所述初始voi对应的所述特定解剖区域相关的一或多个特定目标组织区域中的每一者实施cnn的一或多个分段模块来自动鉴别对应目标voi(例如所述特定目标组织区域的图形表示)。在另一方面,本发明涉及一种用于自动处理3d图像以鉴别所述3d图像内对应于特定目标组织区域的3d体积的系统,所述系统包括:计算装置的处理器;及在其上存储有指令的存储器,其中所述指令当由所述处理器执行时,使所述处理器:(a)接收使用解剖成像模式[例如x射线计算机断层摄影术(ct);例如磁共振成像(mri);例如超声波]所获得的个体的3d解剖图像,其中所述3d解剖图像包括个体内的组织(例如,软组织和/或骨)的图形表示;(b)针对多个目标组织区域中的每一者,使用一或多个机器学习模块(例如,其中所述一或多个机器学习模块中的至少一者为卷积神经网络(cnn)模块)自动鉴别所述3d解剖图像内的对应目标所关注体积(voi);(c)测定表示多个3d分段掩模的3d分段图,各3d分段掩模表示特定鉴别的目标voi(例如,将所述多个3d分段掩模自动以数字方式拼接在一起以形成所述3d分段图);及(d)存储和/或提供所述3d分段图以用于显示和/或进一步处理。在某些实施例中,3d解剖图像为全身图像。在某些实施例中,在步骤(c)处,指令使处理器将多个3d分段掩模以数字方式拼接在一起以形成3d分段图{例如,通过创建最初的空图像体积(例如,将所有立体像素值初始化为零)且接着将标记从各分段掩模插入到图像体积中[例如,通过将输入图像到一或多个机器学习模块的所标记(例如,作为表示如由机器学习模块测定的特定目标组织区域)立体像素映射到图像体积的立体像素(例如,以便将图像体积的立体像素与表示相同物理位置的输入图像的立体像素匹配,借此正确地标记图像体积的立体像素)]}。在某些实施例中,在步骤(b)处,针对至少一个特定目标组织区域,指令使处理器:使用第一模块(例如,定位模块)(例如,第一机器学习模块)测定3d解剖图像内的初始voi,所述初始voi对应于解剖区域(例如一组相关组织,例如骨盆区域、胸部区域、头部和/或颈部区域及其类似者),所述解剖区域含有特定目标组织区域(例如,其中初始voi会排除3d解剖图像中比其所包含更多的立体像素;例如,其中初始voi包含3d解剖图像的小于25%的立体像素;例如,其中初始voi内的大部分立体像素表示解剖区域内的物理体积);及使用第二模块(例如分段模块)(例如,第二机器学习模块)鉴别初始voi内对应于特定目标组织区域的目标voi。在某些实施例中,第二模块为实施cnn的cnn模块。在某些实施例中,第一模块为cnn模块,其实施cnn以执行粗略分段来自动鉴别对应于含有特定目标组织区域的解剖区域的初始voi[例如,通过自动鉴别解剖图像内一组相关组织的图形表示(例如,且随后将初始voi测定为完全包围所述组相关组织的经鉴别图形表示的矩形区域(例如,矩形柱或矩形框))][例如针对预期位于解剖区域内的一或多个特定组织区域中的每一者,通过自动鉴别解剖图像中的对应voi(例如,经由粗略分段),例如且将初始voi测定为完全包围对应于特定组织区域的所有经鉴别voi的矩形区域]。在某些实施例中,第一模块接收解剖图像的子采样[例如,利用沿着一或多个维度的两个或多于两个(例如四个)因素]版本作为输入,且使用解剖图像的子采样版本鉴别初始voi[例如,且其中第二模块接收裁剪到初始voi的解剖图像的全分辨率版本(例如,使得第一模块对表示物理体积比第二模块大的较低分辨率图像进行操作,而第二模块对较高分辨率但表示较小物理体积的图像进行操作)]。在某些实施例中,第一模块为第一cnn模块且第二模块为第二cnn模块,且其中第一cnn模块包括额外滤波器以便解释图像大小相对于第二cnn模块增大的变化率。在某些实施例中,3d解剖图像为全身图像且其中在步骤(b)处,指令使处理器:使用一或多个实施机器学习技术的定位模块(例如,其中各定位模块为实施cnn的cnn模块)自动测定3d解剖图像内的多个初始voi,各初始voi对应于特定解剖区域(例如一组相关组织,例如骨盆区域、胸部区域、头部和/或颈部区域、脊柱区域、上半身区域、下半身区域等)且目标voi的相关子集位于其中;及针对各初始voi,使用一或多个实施机器学习技术的分段模块(例如,其中各分段模块为实施cnn的cnn模块)自动鉴别目标voi的相关子集。在某些实施例中,多个初始voi包括一或多个选自由以下组成的群组的成员:对应于个体的骨盆区域的骨盆区域初始voi(例如,其中位于骨盆区域初始voi中的目标voi子集包括一或多个对应于选自由以下组成的群组的目标组织区域的目标voi:左髂骨和/或右髂骨、骶骨及尾骨);对应于个体的脊柱的脊柱区域初始voi(例如,其中位于骨盆区域初始voi中的目标voi子集包括一或多个对应于选自由以下组成的群组的目标组织区域的目标voi:胸椎、腰椎及胸骨);对应于个体的上半身的左侧的左上半身区域初始voi(例如,其中位于骨盆区域初始voi中的目标voi子集包括一或多个对应于选自由以下组成的群组的目标组织区域的目标voi:一或多个左肋、左肩胛骨及左锁骨);及对应于个体的上半身的右侧的右上半身区域初始voi(例如,其中位于骨盆区域初始voi中的目标voi子集包括一或多个对应于选自由以下组成的群组的目标组织区域的目标voi:一或多个右肋、右肩胛骨及右锁骨)。在某些实施例中,指令使处理器:(e)接收使用功能成像模式[例如单光子发射计算机断层摄影术(spect);例如正电子发射断层摄影术(pet)]所获得的个体的3d功能图像[例如,其中3d功能图像包括多个立体像素,其各自表示个体内的特定物理体积且具有表示从特定物理体积发射的所检测辐射的强度值,其中3d功能图像的多个立体像素的至少一部分表示个体的目标组织区域中的一或多者内的物理体积];及(f)使用3d分段图在3d功能图像内鉴别一或多个各自对应于鉴别的目标voi的3d体积(例如,通过将3d分段图的3d分段掩模映射到3d功能图像)。在某些实施例中,指令使处理器:(g)测定个体的癌症状态[(例如前列腺癌状态;例如转移癌状态(例如转移癌,包含例如转移性前列腺癌、乳癌、肺癌、结肠癌、皮肤癌等))](例如,使用功能图像内的立体像素强度及一或多个经鉴别3d体积)(例如,基于经检测病变)[例如,个体患有和/或罹患前列腺癌和/或特定阶段的前列腺癌(例如,转移性前列腺癌)的可能性][例如,个体患有和/或罹患转移癌(包含例如转移性前列腺癌、乳癌、肺癌、结肠癌、皮肤癌等)的可能性]。在某些实施例中,指令使处理器对在不同时间点采集的多个解剖及对应功能图像反复地执行步骤(a)至(g)以测定在各时间点个体的癌症状态,借此跟踪随时间推移的癌症状态(例如,评价疾病进展和/或治疗功效)。在某些实施例中,指令使处理器(例如,在步骤(g)之前):(h)自动调节3d功能图像的立体像素强度以校正一或多个背景组织区域中的背景吸收(例如,放射性药品的吸收)(例如,校正在正常情形下发生在一或多个背景组织区域中且不必指示癌病变存在的放射性药品的吸收)。在某些实施例中,目标组织区域包括一或多个背景组织区域且其中在步骤(h)处,指令使处理器:使用3d分段图以在3d功能图像内鉴别一或多个各自对应特定背景组织区域的3d背景组织体积(例如,通过将3d分段图的3d分段掩模映射到3d功能图像);及基于3d背景组织体积内的立体像素强度调节3d功能图像的立体像素强度(例如,通过使用3d背景组织体积内的立体像素强度来估计对3d背景组织体积外部的强度的贡献)。在某些实施例中,一或多个背景组织区域包括一或多个选自由以下组成的群组的成员:膀胱(例如,膀胱)、肾脏、十二指肠、小肠、脾、肝脏、胰脏、胃、肾上腺、直肠及睪丸。在某些实施例中,指令使处理器:(i)自动检测3d功能图像内的一或多个热点,所述热点基于3d功能图像内的立体像素强度[例如,基于3d功能图像内的强度与阈值的比较(例如,其中所述3d功能图像为3dpet图像且阈值为特定标准吸收值(suv)水平)](例如,且还基于3d功能图像内鉴别的一或多个3d体积)经测定以表示病变。在某些实施例中,在步骤(i)处,指令使处理器使用一或多个阈值[例如比较具有一或多个阈值的3d功能图像的立体像素强度(例如,其中一或多个阈值包括多个区域特定阈值,其各自用于3d功能图像内所鉴别的一或多个3d体积的特定子集)]。在某些实施例中,在步骤(i)处,指令使处理器将一或多个滤波器应用于3d功能图像[例如,如同斑点检测技术;例如其中一或多个滤波器包括一或多个高斯滤波器(例如高通高斯滤波器及低通高斯滤波器,如同高斯差分方法);例如其中一或多个滤波器包括拉普拉斯滤波器(例如,如同高斯拉普拉斯技术);例如,其中不同滤波器核用于3d功能图像内所鉴别的一或多个3d体积的不同子集]。在某些实施例中,在步骤(i)处,指令使处理器使用两种或多于两种技术的组合以鉴别3d功能图像内所鉴别的一或多个3d体积的不同子集中的热点[例如,针对一或多个3d体积的第一子集使用第一滤波方法(例如,如同段落[0096])且针对第二子集使用第二滤波方法;例如针对一或多个3d体积的第一子集使用定限方法(例如,如同段落[0095])且针对一或多个3d体积的第二子集使用滤波方法(例如,如同段落[0096])]。在某些实施例中,在步骤(i)处,指令使处理器检测热点的初始集合,且针对初始集合的热点的至少一部分,将经检测热点的至少一部分的各热点分类为癌病变或非癌病变(例如,如噪声)[例如使用机器学习模块;例如基于热点的形状和/或位置(例如,结合解剖知识;例如,其中位置包含对应于热点位于其中的3d体积的特定目标组织区域的鉴别和/或特定目标组织区域内热点的相对位置);例如且从初始集合去除分类为非癌病变的热点,借此获得经测定以表示病变的热点的最终集合]。在某些实施例中,目标组织区域包括一或多个背景组织区域且指令使处理器:使用3d分段图以在3d功能图像内鉴别一或多个各自对应特定背景组织区域(例如,其中显著的放射性药品吸收在正常情形下发生且不必指示癌病变存在的背景组织区域)的3d背景组织体积(例如,通过将3d分段图的3d分段掩模映射到3d功能图像);且从用于在步骤(i)处自动检测一或多个热点的立体像素中排除3d背景组织内的3d立体像素。在某些实施例中,指令使处理器使用一或多个经检测热点(例如,一或多个经检测热点的强度)以测定个体的癌症状态。在某些实施例中,目标组织区域包括一或多个参考组织区域且指令使处理器:使用3d分段图以在3d功能图像内鉴别一或多个3d参考体积,其各自对应于特定参考组织区域;测定一或多个参考强度值,其各自与一或多个3d参考体积的特定3d参考体积相关且对应于特定3d参考体积内的强度测量值(例如,平均值、中位值、最大值等);测定一或多个个别热点强度值,其各自与经检测的一或多个热点的至少一部分的特定热点相关且对应于特定热点的强度测量值(例如,平均值、中位值、最大值等);及使用一或多个个别热点强度值及一或多个参考强度值测定一或多个个别热点指标值[例如,其中各个别热点指标值与经检测的一或多个热点的至少一部分的特定热点相关,且使用(i)与特定热点相关的个别热点强度值及(ii)一或多个参考强度值(例如,基于其之间的比较)来测定]。在某些实施例中,指令使处理器通过将一或多个参考强度值中的每一者按一定比例映射到对应参考指标值,且针对各个别热点强度值,使用参考强度值及对应参考指标值以内插对应个别热点指标值来测定一或多个个别热点指标值。在某些实施例中,参考组织区域包括一或多个选自由以下组成的群组的成员:肝脏、主动脉(例如胸部主动脉部分;例如腹部主动脉部分)及腮腺。在某些实施例中,第一参考强度值(i)为与对应于主动脉部分的3d参考体积相关的血液参考强度值,且(ii)映射到第一参考指标值;第二参考强度值(i)为与对应于肝脏的3d参考体积相关的肝脏参考强度值,且(ii)映射到第二参考指标值;以及第二参考强度值大于第一参考强度值且第二参考指标值大于第一参考指标值。在某些实施例中,参考强度值包括映射到最大参考指标值的最大参考强度值,且其中具有大于最大参考强度值的相关热点强度值的热点经分配等于最大参考指标值的热点指标值。在某些实施例中,指令使处理器使用一或多个热点指标值的至少一部分测定指示个体的癌症状态的总体指标值。在某些实施例中,总体指标值测定为个别热点指标值的至少一部分[例如,位于对应于个体的骨骼区域的功能图像的3d体积内;例如位于对应于个体的淋巴区域的功能图像的3d体积内]的加权和[例如,其中各热点指标值的总和由相关热点的大小测量值(例如3d体积;例如平均直径)加权]。在某些实施例中,总体指标值与解剖图像内所鉴别的对应于特定目标voi的特定目标组织区域相关;且总体指标值是使用位于3d功能图像中对应于特定鉴别目标voi的特定3d体积内的热点子集的热点指标值来测定[例如,且其中总体指标值计算为热点子集的热点指标值的加权和(例如,其中加权和由特定目标组织区域的估计体积标准化(例如,计算为功能图像中特定3d体积的体积和/或特定目标voi的体积))]。在某些实施例中,特定目标组织区域是选自由以下组成的群组:包括个体的一或多个骨的骨骼区域、淋巴区域及前列腺区域。在某些实施例中,3d解剖图像为x射线计算机断层摄影术(ct)图像,且3d功能图像为3d单光子发射计算机断层摄影术(spect)图像。在某些实施例中,3d解剖图像为x射线计算机断层摄影术(ct)图像,且3d功能图像为3d正电子发射断层摄影术(pet)图像。在某些实施例中,在向个体投予包括前列腺特异性膜抗原(psma)结合剂的放射性药品后,获得个体的3dpet图像。在某些实施例中,放射性药品包括[18f]dcfpyl。在某些实施例中,在步骤(b)处,指令使处理器裁剪3d解剖图像以去除表示空气的立体像素[例如创建经裁剪的解剖图像,且使用经裁剪的解剖图像以鉴别一或多个目标voi(例如,使用经裁剪的解剖图像作为输入用于一或多个机器学习模块,与原始大小的3d解剖图像相反)]。在某些实施例中,目标组织区域包括一或多个选自由以下组成的群组的成员:左髋骨、右髋骨、骶骨及尾骨区域、左锁骨、右锁骨、左肋、右肋、左肩胛骨、右肩胛骨、胸骨、腰椎、胸椎、颅骨、颈椎、左股骨、右股骨、左肱骨、右肱骨、前列腺、膀胱、直肠、左臀大肌、右臀大肌、主动脉(例如胸部主动脉部分;例如腹部主动脉部分)、左肾脏、右肾脏、肝脏、左肺、右肺、脾、脑室、左肾上腺、右肾上腺、胆囊、大脑、胰脏、心脏、下颌骨、左支气管、右支气管、气管、左髂总动脉、右髂总动脉及腮腺。在某些实施例中,目标组织区域中的一或多者包括一或多个选自由以下组成的群组的特定骨:左锁骨、右锁骨、左股骨、右股骨、左腓骨、右腓骨、左髋骨、右髋骨、左肱骨、右肱骨、下颌骨、左髌骨、右髌骨、左桡骨、右桡骨、左胫骨、右胫骨、左尺骨、右尺骨、左肋(例如,第一左肋、第二左肋、第三左肋、第四左肋、第五左肋、第六左肋、第七左肋、第八左肋、第九左肋、第十左肋、第十一左肋、第十二左肋)、右肋(例如,第一右肋、第二右肋、第三右肋、第四右肋、第五右肋、第六右肋、第七右肋、第八右肋、第九右肋、第十右肋、第十一右肋、第十二右肋)、骶骨及尾骨(例如,经合并的骶骨及尾骨区域;例如单独地骶骨及尾骨,以便区分两者)、左肩胛骨、右肩胛骨、颅骨、胸骨、脊椎骨区域[例如颈椎区域,包括一或多个(例如到多所有)颈椎;例如腰椎区域,包括一或多个(例如至多所有)腰椎;例如胸椎区域,包括一或多个(例如至多所有)胸椎],及个别脊椎骨[例如个别颈椎(例如,第一颈椎、第二颈椎、第三颈椎、第四颈椎、第五颈椎、第六颈椎、第七颈椎);例如个别腰椎(例如,第一腰椎、第二腰椎、第三腰椎、第四腰椎、第五腰椎、第六腰椎);例如个别胸椎(例如,第一胸椎、第二胸椎、第三胸椎、第四胸椎、第五胸椎、第六胸椎、第七胸椎、第八胸椎、第九胸椎、第十胸椎、第十一胸椎、第十二胸椎)]。在某些实施例中,目标组织区域中的一或多者包括一或多个选自由以下组成的群组的特定骨:左锁骨、右锁骨、左髋骨、右髋骨、左肋(例如,第一左肋、第二左肋、第三左肋、第四左肋、第五左肋、第六左肋、第七左肋、第八左肋、第九左肋、第十左肋、第十一左肋、第十二左肋)、右肋(例如,第一右肋、第二右肋、第三右肋、第四右肋、第五右肋、第六右肋、第七右肋、第八右肋、第九右肋、第十右肋、第十一右肋、第十二右肋)、骶骨及尾骨(例如,经合并的骶骨及尾骨区域;例如单独地骶骨及尾骨,以便区分两者)、左肩胛骨、右肩胛骨、胸骨、脊椎骨区域[例如颈椎区域,包括一或多个(例如至多所有)颈椎;例如腰椎区域,包括一或多个(例如至多所有)腰椎;例如胸椎区域,包括一或多个(例如至多所有)胸椎],及个别脊椎骨[例如个别腰椎(例如,第一腰椎、第二腰椎、第三腰椎、第四腰椎、第五腰椎);例如个别胸椎(例如,第一胸椎、第二胸椎、第三胸椎、第四胸椎、第五胸椎、第六胸椎、第七胸椎、第八胸椎、第九胸椎、第十胸椎、第十一胸椎、第十二胸椎)]。在某些实施例中,目标组织区域中的一或多者包括一或多个选自由以下组成的群组的软组织区域(例如器官):左肾上腺、右肾上腺、主动脉(例如胸部主动脉部分;例如腹部主动脉部分)、大脑、左支气管、右支气管、胆囊、左臀大肌、右臀大肌、心脏、左髂总动脉、右髂总动脉、左肾脏、右肾脏、肝脏、左肺、右肺、胰脏、前列腺、直肠、脾、气管、膀胱、脑室及腮腺。在某些实施例中,一或多个目标组织区域包括一或多个选自由以下组成的群组的软组织区域(例如器官):胆囊、左肾脏、右肾脏、肝脏、左肺、右肺、前列腺及膀胱。在某些实施例中,目标组织区域包括一或多个骨区域,其各自对应于特定骨[例如,其中目标组织区域包括段落[0116]或[0117]中所列的至少一部分(例如,至多所有)骨];及一或多个软组织区域,其各自对应于特定软组织区域[例如,其中目标组织区域包括段落[0118]或[0119]中所列的至少一部分(例如,至多所有)软组织区域]。在另一方面,本发明涉及一种用于自动处理3d图像以自动鉴别个体内的癌病变的系统,所述系统包括:计算装置的处理器;及在其上存储有指令的存储器,其中所述指令当由所述处理器执行时,使所述处理器:(a)接收使用解剖成像模式[例如x射线计算机断层摄影术(ct);例如磁共振成像(mri);例如超声波]所获得的个体的3d解剖图像,其中所述3d解剖图像包括个体内的组织(例如,软组织和/或骨)的图形表示;(b)针对多个目标组织区域中的每一者,使用一或多个机器学习模块(例如,其中所述一或多个机器学习模块中的至少一者为卷积神经网络(cnn)模块)自动鉴别所述3d解剖图像内的对应目标所关注体积(voi);(c)测定表示多个3d分段掩模的3d分段图,各3d分段掩模表示特定鉴别的目标voi(例如,将所述多个3d分段掩模自动以数字方式拼接在一起以形成所述3d分段图);(d)接收使用功能成像模式[例如单光子发射计算机断层摄影术(spect);例如正电子发射断层摄影术(pet)]所获得的所述个体的3d功能图像[例如,其中所述3d功能图像包括多个立体像素,其各自表示所述个体内的特定物理体积且具有表示从所述特定物理体积发射的经检测辐射的强度值,其中所述3d功能图像的所述多个立体像素的至少一部分表示个体的所述目标组织区域中的一或多者内的物理体积];(e)使用所述3d分段图在所述3d功能图像内鉴别一或多个各自对应于鉴别的目标voi的3d体积(例如,通过将所述3d分段图的3d分段掩模映射到所述3d功能图像);及(f)在所述3d功能图像内鉴别的所述一或多个3d体积的至少一部分内自动检测一或多个热点,所述热点基于所述3d功能图像内的立体像素强度[例如,基于3d功能图像内的强度与阈值的比较(例如,其中所述3d功能图像为3dpet图像且所述阈值为特定标准吸收值(suv)水平)]经测定以表示病变。在某些实施例中,指令使处理器使用一或多个经检测热点(例如,一或多个经检测热点的强度)以测定个体的癌症状态。在某些实施例中,目标组织区域包括一或多个参考组织区域且其中指令使处理器:使用3d分段图以在3d功能图像内鉴别一或多个3d参考体积,其各自对应于特定参考组织区域;测定一或多个参考强度值,其各自与一或多个3d参考体积的特定3d参考体积相关且对应于特定3d参考体积内的强度测量值(例如,平均值、中位值、最大值等);测定一或多个个别热点强度值,其各自与经检测的一或多个热点的至少一部分的特定热点相关且对应于特定热点的强度测量值(例如,平均值、中位值、最大值等);及使用一或多个个别热点强度值及一或多个参考强度值测定一或多个个别热点指标值[例如,其中各个别热点指标值与经检测的一或多个热点的至少一部分的特定热点相关,且使用(i)与特定热点相关的个别热点强度值及(ii)一或多个参考强度值(例如,基于其之间的比较)来测定]。在某些实施例中,参考组织区域包括一或多个选自由以下组成的群组的成员:肝脏、主动脉(例如胸部主动脉部分;例如腹部主动脉部分)及腮腺。在某些实施例中,指令使处理器使用一或多个热点指标值的至少一部分测定指示个体的癌症状态的总体指标值。在某些实施例中,总体指标值测定为个别热点指标值的至少一部分[例如,位于对应于个体的骨骼区域的功能图像的3d体积内;例如位于对应于个体的淋巴区域的功能图像的3d体积内]的加权和[例如,其中各热点指标值的总和由相关热点的大小测量值(例如3d体积;例如平均直径)加权]。在某些实施例中,3d解剖图像为x射线计算机断层摄影术(ct)图像,且3d功能图像为3d正电子发射断层摄影术(pet)图像。在某些实施例中,在向个体投予包括前列腺特异性膜抗原(psma)结合剂的放射性药品后,获得个体的3dpet图像。在某些实施例中,放射性药品包括[18f]dcfpyl。在另一方面,本发明涉及一种用于自动处理3d图像以鉴别及测量放射性药品在患有癌症(例如,前列腺癌、乳癌、肺癌;例如转移癌,例如转移性前列腺癌、转移性乳癌、转移性肺癌)或处于其风险下的个体内的癌病变(例如,癌转移)中的吸收的系统,所述系统包括:计算装置的处理器;及在其上存储有指令的存储器,其中所述指令当由所述处理器执行时,使所述处理器:(a)接收使用解剖成像模式[例如x射线计算机断层摄影术(ct);例如磁共振成像(mri);例如超声波]所获得的个体的3d解剖图像,其中所述3d解剖图像包括个体内的组织(例如,软组织和/或骨)的图形表示;(b)使用一或多个机器学习模块(例如,其中所述机器学习模块中的至少一者为卷积神经网络(cnn)模块)在所述3d解剖图像内自动鉴别:第一骨骼体积,其包括个体的一或多个骨的图形表示;第一主动脉体积,其包括个体的主动脉的至少一部分的图形表示;及第一肝脏体积,其包括个体的肝脏的图形表示;(c)测定表示多个3d分段掩模的3d分段图,所述3d分段掩模包含表示经鉴别的第一骨骼体积的骨骼掩模、表示经鉴别的第一主动脉体积的主动脉掩模及表示经鉴别的第一肝脏体积的肝脏掩模;(d)接收使用功能成像模式[例如单光子发射计算机断层摄影术(spect);例如正电子发射断层摄影术(pet)]所获得的个体的3d功能图像[例如,其中所述3d功能图像包括多个立体像素,其各自表示个体内的特定物理体积且具有表示从所述特定物理体积发射的经检测辐射的强度值,其中所述3d功能图像的所述多个立体像素的至少一部分表示个体的一或多个骨、主动脉部分和/或肝脏内的物理体积];(e)使用所述3d分段图在所述3d功能图像内自动鉴别(例如,通过将所述3d分段图的所述3d分段掩模映射到所述3d功能图像):第二骨骼体积,其对应于所述3d解剖图像内的所述第一鉴别骨骼体积;第二主动脉体积,其对应于所述3d解剖图像内鉴别的所述第一主动脉体积;及第二肝脏体积,其对应于所述3d解剖图像内鉴别的所述第一肝脏体积;(f)在所述第二骨骼体积内自动检测一或多个热点,所述热点基于所述第二骨骼体积内的立体像素强度经测定以表示病变(例如,一或多个热点对应于相对高强度的局部化区域,例如基于位于第二骨骼体积内的立体像素强度与阈值的比较来鉴别);及(g)针对所述一或多个经检测热点中的每一者,通过以下方式来测定个别热点指标(例如,指示放射性药品吸收在由经检测热点表示的所述病变中的测量值)值:基于所述第二主动脉体积内的立体像素的强度测量值(例如,平均值、最大值、中位值等)测定主动脉参考强度水平;基于所述第二肝脏体积内立体像素的强度测量值(例如,平均值、最大值、中位值等)测定肝脏参考强度水平;且针对各个别经检测热点:基于经检测热点的立体像素的强度测量值(例如,平均值、最大值、中位值等)测定对应个别热点强度水平;及根据个别热点强度水平主动脉参考强度水平及肝脏参考强度水平测定对应个别热点指标水平。在某些实施例中,指令使处理器基于一或多个经检测热点的至少一部分的个别热点指标值测定指示个体的癌症状态的总体指标值。在某些实施例中,个体患有前列腺癌或处于其风险下。在某些实施例中,指令使处理器:在步骤(b)处,在3d解剖图像内自动鉴别包括个体之前列腺的图形表示的第一前列腺体积;在步骤(c)处,包含表示所测定的3d分段图中经鉴别的第一前列腺体积的前列腺掩模;在步骤(e)处,在3d功能图像内自动鉴别对应于3d解剖图像内的第一鉴别前列腺体积的第二前列腺体积;在步骤(f)处,自动检测第二前列腺体积中的一或多个热点;且(i)基于位于第二骨骼体积中的一或多个经检测热点的至少一部分的个别热点指标值测定指示个体的一或多个骨中的病变含量(例如,及严重程度)的总体骨指标值;及(ii)基于位于第二前列腺体积中的一或多个经检测热点的至少一部分的个别热点指标值测定指示个体的前列腺中的病变含量(例如,及严重程度)的总体前列腺指标值。在某些实施例中,个体患有转移癌(例如,转移性前列腺癌、转移性乳癌、转移性肺癌及其它转移性骨癌)或处于其风险下。在另一方面,本发明涉及一种用于自动处理不同大小的全身3d解剖图像集合以在各3d解剖图像内自动鉴别对应于特定目标组织区域的多个3d体积的系统,所述系统包括:计算装置的处理器;及在其上存储有指令的存储器,其中所述指令当由所述处理器执行时,使所述处理器:(a)接收使用解剖成像模式[例如x射线计算机断层摄影术(ct);例如磁共振成像(mri);例如超声波]所获得的一或多个个体的3d解剖图像集合,其中3d解剖图像包括一或多个个体中的每一者内的组织(例如,软组织和/或骨)的图形表示,其中3d解剖图像集合具有平均x维、平均y维及平均z维,其(平均x维、平均y维或平均z维)中的至少一者具有对应平均值的至少3%的标准差[例如,其(平均x维、平均y维或平均z维)中的至少一者具有至少3%、至少5%、至少10%、至少15%或至少20%的相对标准差];及(b)使用实施cnn的定位模块在3d解剖图像集合的各图像内自动测定对应于特定解剖区域(例如一组相关组织,例如骨盆区域及旋转区域)的至少一个初始voi,所述特定解剖区域包括一或多个特定相关目标组织区域(例如一或多个特定骨,例如一或多个特定器官),借此鉴别对应3d解剖图像的至少一个初始voi;及(c)针对各初始voi,使用各自对与初始voi对应的特定解剖区域相关的一或多个特定目标组织区域中的每一者实施cnn的一或多个分段模块来自动鉴别对应目标voi(例如特定目标组织区域的图形表示)。关于本发明的另一方面,可应用关于本发明的一个方面所描述的实施例的特征。附图说明通过结合附图参考以下描述,本发明的前述及其它目的、方面、特征及优势将变得更为显而易见且更好理解,在所述附图中:图1为展示根据一说明性实施例的不同成像模式与人工智能(ai)平台的整合的图式。图2为展示根据一说明性实施例的具有所鉴别的不同特定骨的个体的骨架的图像。图3为展示根据一说明性实施例的将不同功能成像模式中的全身分段用于不同应用的框图。图4为展示根据一说明性实施例的利用ai模块分类、定位及定量癌病变的不同信息数据集的处理流程的图式。图5a为根据一说明性实施例的用于自动处理3d图像以鉴别3d图像内对应于特定目标组织区域的3d体积的工艺的方框流程图。图5b为根据一说明性实施例的用于自动处理3d图像以鉴别3d体积且使用3d体积检测表示癌病变的热点的工艺的方框流程图。图6a为根据一说明性实施例的用于自动处理全身分段的ct图像的工艺的方框流程图。图6b为展示图6a中所展示的工艺的不同步骤的处理结果的ct图像集合。图7为根据一说明性实施例的三种图像的集合,所述图像用作用于分段ct图像的机器学习模块的训练数据。图8为两种图像的集合,其中经鉴别的所关注体积经重迭。图9a为在投予pyltm后,从个体获得的3dpet/ct图像的2d视图集合。图9b为在背景校正后与图9a中所展示相同的2d视图集合。图9c为在投予pyltm后,从个体获得的3dpet/ct图像的2d视图集合。图9d为在背景校正后与图9c中所展示相同的2d视图集合。图10a为展示根据一说明性实施例的用于分析pyltm-pet图像的实例工艺的方框流程图。图10b为在向个体投予pyltm后所获得的pet/ct图像。图10c为展示经由本文中所描述的机器学习方法鉴别的所关注体积的两种ct图像集合。图10d为说明根据一说明性实施例的pet图像的背景校正的3种图像集合。图11a为根据一说明性实施例的3dct图像的视图,其中所关注体积对应于用颜色标记的特定骨。图11b为图11a中所展示的具有经标记所关注体积的3dct图像的另一视图。图12为展示鉴别的背景组织区域的具有经重迭pet图像的ct图像。图13a为展示经检测病变的具有经重迭pet图像的ct图像的视图。图13b为展示经检测病变的具有图13a的经重迭pet图像的ct图像的另一视图。图13c为展示经检测病变的具有图13a的经重迭pet图像的ct图像的另一视图。图13d为展示经检测病变的具有图13a的经重迭pet图像的ct图像的另一视图。图14a为在对个体投予pyltm后所获得的具有经重迭pet图像的ct图像的两种视图集合。图14b展示与图14a相同的视图,但经由本文中所描述的机器学习方法处理后,提供背景校正及病变的检测。图15a为在对个体投予pyltm后所获得的具有经重迭pet图像的ct图像的两种视图集合。图15b展示与图15a相同的视图,但经由本文中所描述的机器学习方法处理后,提供背景校正及病变的检测。图16a为3dct图像的视图,其中经鉴别的所关注体积经重迭。图16b为图16a中所展示的3dct图像的另一视图,其中经鉴别的所关注体积经重迭。图17为用于某些实施例中的示范性云端计算环境的框图。图18为用于某些实施例中的实例计算装置及实例移动计算装置的框图。图19为根据一说明性实施例的三种图的集合,各图展示基于六种不同癌症适应症的pet/ct图像分析定量在特定组织区域中所鉴别的病变中pyltm-psma吸收的总体指标值。图20为根据一说明性实施例的图,其展示经由pet/ct图像分析针对在三个不同组织区域(骨、淋巴及前列腺)中所检测的病变所测定的个别病变psma指标(lpi)值。图21为根据一说明性实施例的两种图的集合,所述两种图比较经由血池参考值及肝脏参考值的手动及自动图像分析所测定的参考值。根据下文结合图式所阐述的详细描述,本发明的特征及优势将变得更显而易见,在所述图式中相似参考字符始终识别对应元件。在图式中,相似参考数字通常指示相同、功能上类似和/或结构上类似的元件。具体实施方式预期所要求的本发明的系统、架构、装置、方法及工艺涵盖使用来自本文中所描述的实施例的信息所进行的变化及调适。如此描述所涵盖,可执行本文中所描述的系统、架构、装置、方法及工艺的调适和/或修改。在整个实施方式中,当物品、装置、系统及架构描述为具有、包含或包括特定组分时,或当工艺及方法描述为具有、包含或包括特定步骤时,预期另外存在基本上由所列举的组分组成或由其组成的本发明的物品、装置、系统及架构,且存在基本上由所列举的处理步骤组成或由其组成的根据本发明的工艺及方法。应理解,步骤次序或执行某一动作的次序并不重要,只要本发明保持可操作即可。此外,可同时进行两个或多于两个步骤或动作。关于本文中所提出的权利要求书中的任一权利要求,本文中提及的任何公开案(例如在现有技术部分中)不允许公开案充当现有技术。现有技术部分是出于清楚起见而提出,且并不意谓作为对关于任何权利要求书的现有技术的描述。如所指示,文档以引用的方式并入本文中。当特定术语的含义存在任何差异时,以上述定义部分中所提供的含义为准。标头是为了方便读者而提供-标头的存在和/或放置不打算限制本文所描述的主题的范围。i.定义如本文中所使用,“放射性核种”是指包括至少一种元素的放射性同位素的部分。合适的示范性放射性核种包含(但不限于)本文中所描述的那些。在一些实施例中,放射性核种为用于正电子发射断层摄影术(pet)中的一者。在一些实施例中,放射性核种为用于单光子发射计算机断层摄影术(spect)中的一者。在一些实施例中,放射性核种的非限制性清单包含99mtc、111in、64cu、67ga、68ga、186re、188re、153sm、177lu、67cu、123i、124i、125i、126i、131i、11c、13n、15o、18f、153sm、166ho、177lu、149pm、90y、213bi、103pd、109pd、159gd、140la、198au、199au、169yb、175yb、165dy、166dy、105rh、111ag、89zr、225ac、82rb、75br、76br、77br、80br、80mbr、82br、83br、211at及192ir。如本文中所使用,术语“放射性药品”是指包括放射性核种的化合物。在某些实施例中,放射性药品用于诊断和/或治疗目的。在某些实施例中,放射性药品包含经一或多种放射性核种标记的小分子、经一或多种放射性核种标记的抗体及经一或多种放射性核种标记的抗体的抗原结合部分。如本文中所使用,关于“图像”的“3d”或“三维”意谓关于三维的传递信息。3d图像可以三维的数据集呈现和/或可以二维表示的集合或以三维表示显示。如本文中所使用,“图像”(例如个体的3d图像)包含任何视觉表示,例如像片、视频框、流式传输视频以及像片、视频框或流式传输视频的任何电子、数字或数学类似物。在某些实施例中,本文中所描述的任何设备包含用于显示图像或由处理器产生的任何其它结果的显示器。在某些实施例中,本文中所描述的任何方法包含显示图像或通过所述方法产生的任何其它结果的步骤。如本文中所使用,“个体”意谓人类或其它哺乳动物(例如,啮齿动物(小鼠、大鼠、仓鼠)、猪、猫、狗、马、灵长类动物、兔及其类似者)。如本文中所使用,“投予”试剂意谓将物质(例如成像剂)引入到个体中。大体而言,可利用任何投予途径,包括例如非经肠(例如静脉内)、经口、局部、皮下、腹膜、动脉内、吸入、经阴道、经直肠、经鼻、引入到脑脊髓液中或滴注到身体区室中。如本文中所使用,术语“滤波器(filter)”及“滤波(filtering)”(如同“滤波函数”或“滤波器(filter)”)是指对数据(例如图像数据,例如由cnn层计算的值)的输入阵列(例如,多维阵列)的局部化部分进行操作的函数,在本文中称作“子块(subpatch)”,从而针对既定子块计算响应值。大体而言,在整个阵列中以滑动窗方式应用滤波器以计算阵列的多个响应值。特定地说,针对既定多维阵列,阵列的子块可为具有特定大小(例如,具有与阵列相同数目的维度)的阵列的矩形区域。举例来说,针对6×3×3阵列,既定3×3×3子块是指阵列的相邻值(例如,邻域)的既定3×3×3集合,使得在6×3×3阵列中存在五个不同3×3×3子块(各块沿第一维度偏移一个位置)。举例来说,针对阵列的既定子块,滤波函数可使用子块的值计算响应值。可以滑动窗方式在整个阵列中应用滤波函数,从而针对阵列的多个子块中的每一者计算响应值。所计算的响应值可存储于输出阵列中以便维持响应值与输入阵列的子块之间的位置对应关系。举例来说,在第一步骤,以输入阵列的拐角中的子块开始,滤波器可计算第一响应值,且将第一响应值存储于输出阵列的对应拐角中。在某些实施例中,在第二步骤,滤波器随后计算第二子块的第二响应值,所述第二子块沿输入阵列的特定维度偏移一个位置。第二响应值可存储于输出阵列的对应位置(即,沿输出阵列的相同维度偏移一个位置)中。对于完整输入阵列,可沿输入阵列的各维度重复以下步骤:偏移子块的位置;计算响应值且将响应值存储于输出阵列的对应位置中。在某些实施例(例如跨步滤波方法)中,滤波器计算其响应值的子块每次沿既定维度偏移多于一个位置,使得并不针对输入阵列的每个可能子块计算响应值。如本文中所使用,术语“卷积神经网络(cnn)”是指其中至少一个层执行一或多个滤波函数的人工神经网络类型。如本文中所使用,术语“卷积层”是指接收作为输入的输入阵列且计算输出阵列的cnn层,其中输出阵列的值通过将一或多个滤波器应用于输入阵列来计算。特定地说,在某些实施例中,卷积层接收作为输入的具有n+1维的输入阵列且产生亦具有n+1维的输出阵列。操作于cnn的滤波层上的输入及输出阵列的前n个维度在本文中称作“空间维度”。输入的第(n+1)个维度在本文中称作“输入通道”维度。输入通道维度的大小在本文中称作“输入通道的数目”。输出的第(n+1)个维度在本文中称作”“输出通道”维度。输入通道维度的大小在本文中称作“输出通道的数目”。在某些实施例中,卷积层通过应用滤波器来计算响应值,所述滤波器对沿空间维度小于输入阵列但延伸跨越全部输出通道维度的子块进行操作。举例来说,n×m×l×k0大小的输入阵列具有三个空间维度及k0个输出通道。卷积层的滤波器可对具有nf×mf×lf×k0的大小的子块进行操作,其中nf≤n,mf≤m且lf≤l。通常,卷积层的滤波器对具有其中nf<n,mf<m和/或lf<l的大小的子块进行操作。举例来说,在某些实施例中,nf<<n,mf<<m和/或lf<<l。因此,对于卷积层所应用的一或多个滤波器中的每一者,由既定滤波器计算的响应值存储于对应输出通道中。因此,接收具有n+1个维度的输入阵列的卷积层计算也具有n+1个维度的输出阵列,其中第(n+1)个维度表示对应于卷积层所应用的一或多个滤波器的输出通道。在此方式中,由既定卷积层计算的输出阵列可由后续卷积层接收以作为输入。如本文中所使用,关于卷积层的滤波器的术语“大小”是指沿滤波器所操作的子块的空间维度的大小(例如,将沿输出通道维度的子块大小视为输出通道的全部数目)。如本文中所使用,关于卷积层的术语“大小”(如同“卷积层的大小”)是指卷积层的滤波器大小(例如,卷积层的各滤波器具有相同大小)。在某些实施例中,卷积层的滤波器具有多个经由机器学习训练程序测定的可变参数。在某些实施例中,既定滤波器的参数数目等于既定滤波器所操作的子块中的值数目。举例来说,在具有k0个输出通道的输入阵列上操作的大小nf×mf×lf滤波器具有nf×mf×lf×k0参数。在某些实施例中,滤波器实施为阵列,且由滤波器针对既定子块测定的响应值经计算为滤波器与既定子块之间的点积。如本文中所使用,术语“全卷积神经网络(fullyconvolutionalneuralnetwork;fcnn)”是指其中cnn的各层为卷积层的cnn。如本文中所使用,如关于cnn层的输入或输出所使用的术语“体积”是指由cnn层接收的输入阵列或由其计算的输出阵列。如本文中所使用,术语“cnn模块”是指计算机实施程序,其实施特定cnn以便测定既定输入,例如图像(例如2d图像;例如3d图像)的一或多个输出值。举例来说,cnn模块可接收个体的3d图像(例如ct图像;例如mri)作为输入,且针对图像的各立体像素,测定一值,所述值表示立体像素位于对应于个体的特定器官或组织的表示的3d图像的区域内的可能性。cnn模块可为软件和/或硬件。举例来说,cnn模块可完全以软件形式来实施或cnn模块的某些功能可经由专用硬件(例如,经由集成电路专用集成电路(applicationspecificintegratedcircuit;asic))来实行。如本文中所使用,术语“组织”是指骨(骨性组织)以及软组织。在某些实施例中,本文中所描述的方法可用于分段及鉴别个体的全身图像内的目标组织区域。如本文中所使用,在分段的情形中(互换)使用的术语“全身(fullbody/wholebody)”是指评价个体身体在3d解剖图像中的大部分(例如,大于50%)的图形表示以鉴别目标组织所关注区域的方法。在某些实施例中,全身分段是指对个体的至少整个躯干内的目标组织区域的鉴别。在某些实施例中,还包含肢体的部分以及个体的头部。a.经由核医学成像及自动图像分段检测及评估癌症状态本文描述提供基于人工智能(ai)的分段技术的系统及方法,所述分段技术提供用于检测、评价及预测关于个体的癌症状态的基础。特定地说,本文中所描述的基于ai的分段技术允许精确地及快速地鉴别不同组织区域于医学图像中的3d表示。本文中所描述的基于ai的分段技术利用机器学习技术,例如卷积神经网络(cnn)来自动鉴别多个目标3d所关注体积(voi),其各自对应于特定目标组织区域,例如一或多个器官、器官的部分、特定骨、骨骼区域等。各个鉴别的3dvoi可经由分段掩模表示。可将鉴别患者整个身体中的多个目标组织区域的多个分段掩模拼接在一起以形成分段图。分段图和/或其包括的不同分段掩模可用于根据医学图像计算不同量,例如充当测量和/或预测癌症状态、进展及对治疗的反应的有用指标。分段图及掩模还可显示(例如以医学图像上重迭的图形表示)以指导医师及其它医学从业者。在某些实施例中,使用提供关于个体身体内的组织的位置及范围的详细结构信息的解剖图像来执行基于ai的分段。解剖图像的实例包含(但不限于)x射线计算机断层摄影术(ct)图像、磁共振图像(mri)及超声波。解剖图像中的图像对比度为皮下组织的物理特性,例如密度、水及脂肪含量的函数。如本文中进一步详细描述,本发明的基于ai的分段技术分析解剖图像中的对比度变化及图案以鉴别对应于不同特定目标组织区域的目标3dvoi。在某些实施例中,来自解剖图像的结构信息及经鉴别的目标voi与经由功能成像模式所获得的图像组合和/或用于分析所述图像。功能图像反映个体的生理学特性及活性。其通常使用探针获得且具有反映探针在个体的成像部分内的空间分布的强度变化。举例来说,核医学图像(例如pet扫描;例如spect扫描;例如全身扫描;例如复合pet-ct图像;例如复合spect-ct图像)检测从放射性药品的放射性核种发射的辐射以形成图像。特定放射性药品在患者内的分布可通过生物机制(例如血流或灌注)以及通过特异性酶促或受体结合相互作用来测定。不同放射性药品可经设计以利用不同生物机制和/或特定特异性酶促或受体结合相互作用,且因此在向患者投予时,选择性地集中在患者内的特定类型组织和/或区域内。较大的辐射量从患者体内具有比其它区域更高浓度的放射性药品的区域发射,使得这些区域在核医学图像中看起来更亮。因此,核医学图像内的强度变化可用于映射放射性药品在患者体内的分布。放射性药品在患者体内的此映射分布可用于例如推断患者身体的不同区域内癌组织的存在。将分段图传送到功能图像(例如核医学图像,例如pet图像或spect图像)提供有价值内容以评价且推导根据功能图像中强度波动的含义。特定地说,其允许将功能图像的区域鉴别为对应于个体的特定组织区域。在此方式中,因此可将特定区域内的立体像素的强度值及波动理解为源自放射性药品在个体的特定组织区域(例如,器官或骨)中的潜在积累。如本文中进一步详细描述,此解剖内容适用多种用途。举例来说,其允许测量待评估的不同特定目标器官及组织区域(例如前列腺、淋巴结及骨)中的放射性药品吸收,且用作其中癌组织存在的指示符。鉴别功能图像的特定区域强度与什么相关还允许在适当背景下对其进行评价。举例来说,特定值的强度如果与前列腺区域相关,那么可比在另一器官(例如膀胱或肾脏)内发现的相同值的强度更有可能指示癌症。在某些实施例中,参考区域经鉴别且用于计算呈一定比例的标准化值及水平,其它区域中的强度与其进行比较以评价癌症状态。也可鉴别从图像排除或用于校正伪影的背景区域。因此,本文中所描述的基于ai的分段方法可充当一平台,在所述平台上可构建用于检测、评价及预测患者的癌症状态的多种工具及技术。此外,由于本文中所描述的基于ai的分段工具可鉴别患者的整个身体的多个重要组织区域,且随后将那些鉴别(例如,分段图)从解剖图像转印到不同功能图像,其可用作基于多种不同成像方法的分析技术的构建块,所述分析技术经由多种不同放射性药品获得对比度。图1至3说明此概念。特定地说,图1为说明在平台中立性基于ai的分段技术的背景中可如何整合不同解剖及功能成像模式的示意图。如图1中所说明,本文中所描述的ai分段平台可用作用于分析多种图像,例如解剖ct图像本身、18naf图像、c-11图像、ga-68图像、fdg图像及pyltm图像的基础。图2展示对个体的骨架执行的实例分段的结果,其中不同特定骨骼由不同颜色鉴别。可将图2中所展示的使用ct图像执行的分段转印到功能图像以便鉴别功能图像中对应于ct图像内鉴别的目标voi的3d体积。其它voi(例如软组织)也可鉴别且用于鉴别功能图像中的对应3d体积。举例来说,图3为方框流程图,其说明可如何使用不同软组织及骨区域基于解剖图像(例如,ct图像)的分段且使用不同探针(例如,99mtc-mip-1404、18f-pyl、68ga-psma-11、18f-naf、11c-胆碱、[18f]fdg、[18f]facbc等)将其映射到经由不同功能成像模式所获得的图像以执行基于图像的对疾病进展、状态及其类似者的诊断及评估。如图3中所展示,本文中所描述的全身分段技术可充当一平台,可在所述平台上充分利用且构建利用不同功能成像模式及探针的多种特殊应用图像分析技术。图4为展示可如何执行基于人工智能的图像分析400以分类且定位病变以及定量阳性病变,例如用于评估个体的癌症状态的图式。如图4中所展示,机器学习模块402(例如卷积神经网络(cnn))接收处境解剖信息(例如,ct图像或其它解剖成像模式)404以及功能信息(例如功能图像,例如spect、pet或使用特定成像探针所获得的其它功能图像)406。随后机器学习模块402使用功能406及解剖404信息以鉴别、分类和/或定量个体的癌病变410。机器学习模块402也可充分利用额外信息408,例如个体人口统计数据(例如,年龄、重量等)及其它诊断测试结果(例如,组织切片检查、格里森评分(gleasonscore)、基因测试结果、前列腺特异性抗原(psa)测试结果)、临床治疗(例如,外光束辐射、近距放射疗法、前列腺切除术、抗雄激素、免疫疗法(例如,普列威(provenge))、化学疗法等)作为输入且还基于此额外信息分类、鉴别和/或定量癌病变。图5为展示用于执行分段以鉴别多个目标组织区域的实例工艺500的方框流程图。如图5中所展示,机器学习模块接收3d解剖图像(例如,全身图像)作为输入502,且针对多个目标组织区域中的每一者,鉴别3d解剖图像内包括目标组织区域的图形表示的目标体积504。将目标体积拼接在一起506以形成包括多个分段掩模512的分段图510,其中各分段掩模表示经鉴别的目标体积。可存储和/或提供分段图510以用于显示和/或其它处理508。i.使用卷积神经网络(cnn)的图像分段在某些实施例中,本文中所描述的基于ai的图像分段方法利用机器学习技术(例如cnn)以执行分段。如本文中所描述,一或多个机器学习模块可用于执行图像的中间分析及处理,且最终鉴别目标voi。在某些实施例中,本文中所描述的基于ai的图像分段利用两步方法以鉴别解剖图像中表示目标组织所关注区域的3d目标voi中的一或多者。在此两步方法中,首先鉴别包括目标voi中的一或多者的初始所关注体积(voi)。初始voi可使用第一模块(称作定位模块)来鉴别。定位模块可为第一机器学习模块,例如第一卷积神经网络(cnn)模块。在鉴别初始voi后,第二模块(称作分段模块[例如,实施第二机器学习网络(例如第二cnn)以执行精细分段])用于鉴别初始voi内的一或多个目标voi。此方法为有利的,因为允许分段模块在可管理大小的标准化输入上操作,而不考虑所接收的原始解剖图像的尺寸及边界的变化。此两步方法尤其适用于在较大图像(例如全身扫描)内执行对组织区域的精确、经精细解析的分段。定位模块可执行粗分析,例如通过执行粗略分段以鉴别初始voi。无需适应不同图像大小且分析整个图像,分段模块可投入资源以执行精细分段从而精确地鉴别初始voi内的目标voi。此外,如本文中进一步详细描述,例如在实例1中,为鉴别在个体的整个身体内扩展的目标voi集合,可鉴别多个初始voi以便将全身图像分割成多个可管理初始voi,其各自包包括待鉴别的所需目标voi的子集。将全身图像分割成多个初始voi可使用单个定位模块,例如执行粗略分段以鉴别一般解剖区域(例如上半身、下半身、脊柱及骨盆区域)的机器学习模块来执行。在某些实施例中,可使用多个定位模块(例如,各自委以鉴别一或多个初始voi的任务)。针对各个经鉴别的初始voi,随后可使用一或多个分段模块以执行精细分段且鉴别初始voi内的一或多个所需目标voi。不同定位及分段模块可经组合且实施为单个模块和/或单个软件应用,或可经单独地实施为例如独立软件应用。多个不同方法可由定位模块使用以鉴别特定初始voi。举例来说,在一种方法中,定位模块可实施接收灰阶ct图像(例如,单个输入通道)作为输入且输出矩形voi(例如,限界框(boundingbox))的对置边角的坐标的cnn。在另一方法中,定位模块可实施接收以下两种输入通道的cnn:(i)灰阶ct图像及(ii)ct图像的预处理版本。ct图像的预处理版本可为ct图像的阈值版本,其中定限提供待鉴别的初始voi的粗鉴别。cnn经训练以分析两个这些输入通道以便输出表示矩形初始voi(例如,限界框)的对置边角的坐标。在第三种方法中,为鉴别包括一或多个特定目标voi的特定初始voi,定位模块执行粗略分段以粗略地鉴别特定目标voi。在此方式中,定位模块基本上为用于鉴别特定初始voi内的特定目标voi的分段模块的粗略版本。随后,矩形初始voi使用粗略鉴别的特定目标voi(例如,通过绘制适合其的最小框,或可添加一定缓冲距离)来产生。此处的区别为在此情况下定位模块的输出不仅仅为立方体顶点的坐标。举例来说,在此方法中,自动测定图像的各立体像素的似然值,得到立体像素如何分类的似然性-例如,立体像素是否为特定初始voi或背景。在某些实施例中,由机器学习模块执行的立体像素分类可经由迭代过程改进以便减少分类过程中的噪声。特定地说,在某些实施例中,机器学习模块(例如cnn模块)接收整个图像或其部分作为输入,且针对各特定立体像素,输出将特定立体像素分类为以下的标记:(i)对应于解剖区域或目标组织区域的预定义类别集合中的一者,或(ii)背景。举例来说,经训练以鉴别对应于脊柱、骨盆区域以及左上半身及右上半身的初始voi的定位模块可将各立体像素标记为分别针对脊柱、骨盆区域、左上半身及右上半身的1、2、3或4,或针对背景的0。鉴别特定初始voi内的一或多个目标组织区域的分段模块可接收特定初始voi作为输入,且输出各立体像素的整数标记,其中整数标记将彼立体像素鉴别为对应于特定目标组织区域或背景中的一者。举例来说,鉴别不同脊椎骨的分段模块可接收对应于脊柱的初始voi作为输入,且用对应于特定脊椎骨的整数标记初始voi中的各立体像素(例如,1用于第一腰椎,2用于第二腰椎,3用于第三腰椎等,其中其它整数标记其它骨)。由如上文所描述的机器学习模块执行的分类可产生有噪声结果,其中某些孤立立体像素具有与其环境不同的标记。举例来说,cnn模块可产生其中较大体积内的大部分立体像素分配第一标记的输出,其中孤立立体像素和/或小群立体像素分配不同,例如第二或第三标记,从而将其鉴别为对应于与其相邻者不同的解剖区域。通常,这些孤立立体像素和/或岛状物呈现在均匀标记的大区域的边缘上。这些小的非均匀性对应于分类过程中的噪声,且可经由如下迭代程序去除。第一,针对表示(i)特定解剖区域或目标组织区域或(ii)背景的各标记,鉴别经标记立体像素的相关最大连接组分。第二,针对各特定标记,紧邻与特定标记相关的最大连接组分的立体像素的不同标记的孤立立体像素和/或立体像素岛状物经鉴别且重新分配特定标记。在某些实施例中,在第三步骤中,随后可去除任何剩余孤立的经不同标记的立体像素岛状物。在第四步骤中,填充分段区域(标记为背景但完全通过非背景标记的立体像素包封的立体像素)中的孔(例如,通过对孔的立体像素分配包封其的非背景区域的标记)。重复第二至第四步骤,其中孤立立体像素和/或立体像素岛状物基于其环境重新标记,直到汇聚(即,一个迭代至下一个迭代无变化)为止。此方法减少和/或消除与其周围不同的标记的孤立立体像素,借此减少分类过程中的噪声。用于鉴别初始voi的这些不同方法可单独或组合使用以鉴别个体的解剖图像内的多个初始voi。在鉴别一或多个初始voi后,可鉴别各初始voi内的一或多个目标voi。举例来说,pct公开案wo2019/136349(其内容以全文引用的方式并入本文中)提供以下的其它细节:可在ct图像内如何鉴别对应于骨盆区域的单个初始voi;及可如何执行精细分段以鉴别对应于器官(例如前列腺、膀胱、臀部肌肉)的目标voi;以及可鉴别不同骨盆骨骼,例如骶骨、尾骨以及左髋骨及右髋骨。本文中所描述及尤其在实例1至4中的方法,展示多个初始voi可如何鉴别且用于鉴别个体的整个身体中的多个目标voi,借此提供精确的全身图像分段,所述全身图像分段可充当用于检测及评估不同器官及组织区域中的局部化阶段以及转移性阶段(其存在于患者身体中的多个区域中)下的癌症状态、进展及对治疗的反应的基础。ii.将解剖内容提供到3d功能图像通过解剖图像的自动基于ai的分析产生的分段图可转印到3d功能图像,以便在3d功能图像内鉴别对应于解剖图像中所鉴别的目标voi的3d体积。特定地说,在某些实施例中,(分段图的)个别分段掩模从3d解剖图像映射到3d功能图像。3d功能图像内鉴别的3d体积可用于分析图像以评估癌症状态的多种目的。某些鉴别的3d体积及对应目标voi对应于其中疑似和/或可发生癌症的组织区域。这些区域可包含例如前列腺、乳房组织、肺、大脑、淋巴结及骨。还可评价其它区域。某些区域(例如前列腺、乳房及肺)与检测在早期、局部化阶段下的癌症有关,而其它区域(例如淋巴结及骨)与评估转移癌有关。由于功能图像(例如pet及spect图像)的强度映射患者身体中的放射性药品积累的空间分布,因此通过精确地鉴别功能图像中对应于特定组织区域的特定3d体积,那些3d体积内的立体像素强度可用于测定放射性药品探针在其对应的特定组织区域内的吸收测量值。由于放射性药品探针可经设计以在癌组织中选择性累积(例如,经由增强癌组织中过度表达的生物分子的亲和力,例如前列腺特异性膜抗原(psma)),因此检测及定量特定探针在某些目标组织区域及所关注的器官中的吸收指示个体的癌症状态和/或可用于测定个体的癌症状态。举例来说,如pct公开案wo2019/136349(其内容以全文引用的方式并入本文中)中所描述,评估前列腺体积中的1404吸收可用于测定个体的前列腺癌状态。其它探针可用于评估存在于广泛多种其它组织区域(包含骨)中的转移癌。举例来说,实例2至6描述用于鉴别pyltm于患者整个身体的癌病变中的积累的分段。因此,在某些实施例中,将对解剖图像(例如ct图像)执行的分段转印(例如,映射)到共配准的功能图像(例如pet或spect图像),从而允许功能图像内对应于特定组织所关注区域的特定组织所关注体积得到鉴别。放射性药品于那些特定组织区域内的积累随后可基于位于特定组织所关注体积内的功能图像立体像素的强度来定量。多种方法可用于分析功能图像中的立体像素强度。举例来说,可计算特定体积内的平均强度、中位强度、总强度、最大强度等且用于定量。随后可将此计算值与例如针对其它组织区域所计算(例如,标准化)的其它值进行比较,且用于将癌症状态分配到患者(例如,基于与一或多个预定阈值的比较)。在某些实施例中,在特定3d体积内鉴别高强度的局部化区域(称作热点)。如下文部分b中进一步详细描述,这些局部化热点可鉴别为表示癌病变,且用于测定个体的癌症状态。在某些实施例中,可使用机器学习方法。举例来说,位于一或多个特定组织所关注体积内的功能图像立体像素的强度可用作机器学习模块的输入,所述机器学习模块计算本身可用于定量癌症、癌转移或癌症复发等的风险和/或与参考值(例如阈值)相比较以指定特定癌症状态的风险指标。在某些实施例中,除鉴别其中可存在癌组织的特定组织区域(例如,以便测定其中癌症的存在和/或状态)以外,可鉴别其它额外组织区域。这些额外组织区域可对应于背景区域,其中特定放射性药品探针在正常情形下积累,而不必存在病变。在某些实施例中,经鉴别的背景区域用于标准化立体像素强度以便标准化图像间的强度值。举例来说,如pct公开案wo2019/136349(其内容以全文引用的方式并入本文中)中所描述,可鉴别臀部肌肉且其吸收可用于标准化投予1404后所获得的spect图像的强度。某些背景区域的鉴别也可用于解释这些区域中的高探针积累水平。在某些实施例中,某些背景区域经鉴别且由分析排除。举例来说,如实例3中所描述,某些探针(例如pyltm)可在正常情形下积累于某些背景区域中,而那些区域内不存在任何癌病变或组织。因此,这些区域可经鉴别且由例如热点检测分析排除。这些区域的实例包含肾脏、十二指肠、小肠、脾、肝脏、胰脏、胃、肾上腺、直肠及睾丸。在某些实施例中,鉴别功能图像中对应于背景区域的3d体积可用于校正强度渗出效应(intensitybleedeffect),其中放射性药品于特定区域中的高积累可不仅在对应于特定区域的3d体积中且也在其邻域中产生高强度的功能图像。渗入到功能图像的其它区域中的此强度可遮蔽有用信号。举例来说,放射性药品通常以较高量积累于患者的膀胱中。当经由功能成像模式成像时,膀胱中的此高积累可经由散射效应促进对应于膀胱外部组织区域(例如前列腺)的3d体积中的强度。因此,考虑此强度渗出或“串扰(cross-talk)”可改进精确度,利用所述精确度,3d功能图像中的强度用于测量潜在放射性药品吸收。在某些实施例中,扩张对应于产生强度渗出的特定背景区域的3d体积。经扩张的背景区域可由分析排除,以便避免使用与背景区域直接相邻的区域的强度来测定吸收度量或热点的鉴别。在某些实施例中,模拟功能强度的概况的抑制方法也可用于调节邻近区域的强度水平以校正强度渗出。在此方法中,针对产生强度渗出的特定背景区域,从功能图像的特定立体像素去除的抑制量(即,强度渗出)视立体像素到对应于特定背景区域的特定3d背景体积内的高强度核心区域的距离而定。高强度核心区域可测定为包括立体像素的区域,所述立体像素具有高于预定值,或功能图像的特定区域中最大强度的特定部分内的强度。在某些实施例中,如果鉴别为对应于特定背景区域的3d体积内的最大功能图像强度大于特定倍增值乘以经测定背景强度值,那么利用此抑制。背景强度值可基于对应于特定参考体积的3d功能图像的立体像素强度而测定,所述特定参考体积对应于特定组织区域(例如臀部肌肉)。抑制方法可应用于在产生强度渗出的特定背景区域附近的3d功能图像的子区域。举例来说,其可应用于涵盖特定区域外加预定界限的矩形子区域。在某些实施例中,一或多个强度渗出函数经测定以执行抑制且借此校正针对渗出(例如,串扰)的3d功能图像的立体像素强度。举例来说,3d功能图像可裁剪成涵盖特定区域外加预定界限的前述矩形子区域。可从经裁剪图像区域内的立体像素强度减去经测定的背景强度值。随后可采集样品强度以测定当一个人从对应于特定背景区域的特定背景3d体积移开时,源自特定背景区域内的放射性药品吸收的强度如何降低。可使用以极端顶部、右边、左边及底部开始,且随后分别朝上、朝右、朝左及朝下移动的样品。其它方向同样为可能的。采样强度提供展示从高强度核心降低强度的曲线(例如,采样强度数据点的集合)。模板函数(例如n次多项式)可适合于这些采样曲线且用于计算特定3d背景体积附近的待用作校正因子的强度值。举例来说,pct公开案wo2019/136349(其内容以全文引用的方式并入本文中)描述了在1404-spect图像中,膀胱区域的鉴别可如何用于针对因膀胱中的高积累而导致强度渗出来调节前列腺立体像素强度。在某些实施例中,类似方法可用于用其它探针获得的其它图像,所述探针可积累于膀胱和/或其它区域(例如,肝脏、肾脏等)中。在某些实施例中,本文中所描述的分段方法假设3d解剖图像包含某些解剖区域。举例来说,本文中所描述的系统及方法的实施例可假设其输入解剖图像始终包含骨盆区域且自动尝试分段骨盆区域。针对其它解剖区域,如果其包含于解剖图像输入中,那么本文中所描述的系统及方法也可仅分段这些区域,例如首先执行关于其是否存在的测定。用于执行全身分段以鉴别对应于骨和/或软组织(例如,器官)的目标组织区域的方法进一步详细描述于下文实例1、2、3及4中。还描述使用这些全身分段以评估疾病状态,尤其患者的癌症的方法。b.热点及病变检测在某些实施例中,作为定量功能图像内特定体积中的总体吸收的替代或补充,检测局部化热点(相对高强度的局部化区域)。在某些实施例中,热点经由定限方法检测-通过比较功能图像内的立体像素强度与一或多个阈值。强度高于阈值的立体像素分组可检测为热点。可使用单个全域阈值,或在某些实施例中,也可使用多个区域特定阈值。举例来说,共配准的解剖图像的分段可用于设定用于热点检测的不同组织区域的不同阈值。如本文中所描述,也可使用共配准图像的分段以去除背景信号的效应,借此促进热点检测(例如,全域阈值和/或多个区域阈值是否使用)。在某些实施例中,热点可额外使用斑点检测技术来检测。一个方法为使用高斯差分方法,其中pet图像经由近似高斯核的高通滤波器及低通滤波器的组合来滤波。滤波器减少背景噪声且对于图像的不同区域中的背景水平的变化为恒定的(例如,与骨盆区域相比,胸腔可能由于肝脏及肾脏中的显著吸收而具有显著较高的背景水平)。此级联式高/低通滤波器方法将允许热点提取而不采用固定阈值,但可替代地鉴别pet强度的局部变化。另一方法为采用高斯拉普拉斯斑点检测方法。高斯拉普拉斯方法为一种使用拉普拉斯及高斯滤波核检测图像的边缘的方法。通过使用不同大小的核,检测不同大小结构的边缘。选择适当的核大小允许所述方法检测具有病变共有的特性的结构。所描述的方法可以单独方式使用,其中仅技术中的一者用于所有所关注区域;或其可同时使用,其中如通过对共配准解剖图像的语意分段,结合单个全域阈值或多个局域阈值来鉴别,可对不同组织区域采用不同方法。图5b展示使用本文中所描述的分段方法以检测表示癌病变的热点的实例工艺520。在第一步骤中,接收3d解剖图像522。在3d解剖图像内鉴别对应于特定目标组织区域的一或多个目标voi524,且将鉴别的目标voi拼接在一起526以创建包括多个分段掩模536的分段图534。分段图的各分段掩模表示特定目标voi。接着,接收3d功能图像(例如,pet图像)528,且将分段图转印到3d功能图像以针对各目标voi鉴别3d功能图像中的对应3d体积530。经鉴别的3d体积随后用于在3d功能图像内检测532对应于相对于其周围的高强度局部化区域的一或多个热点。特定地说,一或多个特定3d体积可对应于癌病变可形成的特定组织区域,且经分析以检测其中的热点。其它3d体积可用于执行背景校正,或有意地从热点检测过程中排除。如本文中进一步详细描述,另外其它体积可能有关,原因在于其用作用于计算可分配到热点以便对其评分,例如指示其表示的潜在病变的风险/严重程度的有用指标的参考体积。热点也可在其初始检测后分类为例如癌或非癌,和/或分配表示其成为癌转移的可能性的似然值。热点分类可通过提取热点特征(例如,描述特定热点的特征的度量)且将经提取热点特征用作分类的基础(例如,经由机器学习模块)来执行。在某些实施例中,热点分类也可在不使用机器学习的情况下执行。在这些实施例中,解剖知识可与关于经检测热点的形状及位置的信息组合以将热点分类为癌病变或噪声。举例来说,如果经检测热点位于面对肝脏的肋的边缘上且经检测峰值在围绕热点的区域中并非全域最大,那么有可能基于既定解剖及空间信息估计热点是否为肿瘤或非肿瘤。共配准解剖图像的分段可另外用于创建已知不含癌细胞的背景组织区域的强度模型,但其中特别高的功能图像立体像素强度为常见的。这些背景区域可致使背景区域自身的边界外部的强度渗出且影响癌病变可能存在的邻近区域。强度水平的概况可估计且用于减去存在于携带癌病变的邻近组织区域中的经估计额外强度水平以允许较稳固的热点检测。表示病变的热点可用于测定提供患者的疾病存在和/或状态(例如癌症状态,类似于格里森评分)的指示的风险指标。举例来说,度量(例如热点数目、经鉴别热点的总求和强度、热点占据的特定身体部分或区域(例如,骨架)的面积分数及其类似者)本身可用作和/或用于计算这些风险指标。在某些实施例中,经由本文中所描述的分段方法鉴别的区域可用于计算风险指标,例如用于计算度量(例如面积分数)。使用经鉴别热点来计算风险指标的方法的实例提供于本文中的实例5及7中。c.实例基于cnn的全身分段及病变检测方法以下实例表明对全身分段使用本文中所描述的基于ai的分段及热点检测方法,从而检测癌病变且测定用于评价个体的癌症状态的有用度量。i.实例1-基于cnn的全身分段实例1描述全身分段的实例方法。此实例中的实施方案使用五个神经网络来分段整个躯干内的骨骼。第一神经网络用于粗略地定位身体的不同区域。结果用于将身体划分成四个区域。在这些区域中的每一者中,对应神经网络随后用于将分段执行到不同骨骼中。随后将来自所有四个区域的结果合并成最终结果(例如,最终分段图)。此方法涉及本文中所描述的两步“限界框”方法,其中第一机器学习模块(例如,定位模块)用于粗略地定位对应于包括一或多个特定目标组织区域(例如,前列腺)的解剖区域的初始所关注体积(voi)。第二机器学习模块(例如,分段模块)随后执行初始voi内的精细分段以鉴别初始voi内对应于目标组织区域的目标体积。在此情况下针对全身分段,第一机器学习模块(定位模块)鉴别多个初始voi,其各自对应于不同解剖区域。随后,针对各解剖区域,对应第二机器学习模块(分段模块)鉴别一或多个目标体积,其各自表示特定目标组织区域。机器学习模块(例如,神经网络)可实施为独立模块,或可组合某些机器学习网络。举例来说,各第二分段网络可实施为独立模块,或在单个模块内。因此,在此实例中,第一模块(定位)用于鉴别ct内的解剖区域;即,发现其中可应用第二模块的网络以产生用于进一步分析的分段图的所关注体积。第二模块中的网络对全分辨率ct图像起作用,而定位网络使用ct图像的子采样版本在低分辨率中起作用。cnn网络的三个实例版本在根据方法实施全身分段的软件中使用。版本1及2对49个骨骼进行分段,且版本2对49个骨骼及8个软组织区域进行分段。基于cnn的分段平台实例版本1在用于全身分段的cnn网络的第一实例版本中,第一机器学习模块(定位模块)在此实例中被称为“粗略分段(coarse-seg)”,且经训练以鉴别子采样ct图像中的49个骨骼(沿各维度,子采样因子为4)。定位模块用于将身体的区域分化成骨盆区域、脊柱、左上半身及右上半身。四个精细分段网络如下:·“精细分段骨盆”:经训练以鉴别左髂骨及右髂骨以及骶骨及尾骨;·“精细分段脊柱”:经训练以鉴别12个胸椎、5个腰椎及胸骨;·“精细分段左上半身”:经训练以鉴别身体左侧的12个肋、左肩胛骨及左锁骨;及·“精细分段右上半身”:经训练以鉴别身体右侧的12个肋、右肩胛骨及右锁骨。各网络的输入图像大小如下:表1:五个神经网络的输入图像大小。网络名称输入图像大小(切片数、行数、列数)粗略分段(81,70,104)精细分段骨盆(93,146,253)精细分段脊柱(194,204,94)精细分段左上半身(158,187,144)精细分段右上半身(158,191,146)当定位模块的粗略分段网络接收(作为输入图像)表示大物理体积及包括个体身体的大部分的3d解剖图像时,其输入图像中的实际立体像素数目由于4个子采样因子而比另一网络低。输入图像到定位模块的立体像素数目及大小也通过裁剪(去除)不包含组织的图形表示,但替代地表示空气的图像区域来减少。去除这些立体像素作为预处理步骤进一步减少输入到定位模块的图像大小(参见例如下表4之前两列)。经由子采样减小输入到定位模块的图像大小允许粗略分段网络将其所操作的图像的分辨率交换为额外滤波,从而允许其例如解释其接收的图像的变化率且执行更精确及稳固的粗略分段来鉴别不同初始所关注体积。用于各神经网络中的滤波器数目及参数数目列于下表2至4中:表2:五个神经网络中卷积滤波器的数目。网络名称滤波器的总数目第一层中滤波器的数目粗略分段4096+49(49个类别)32精细分段骨盆4096+332精细分段脊柱2048+1816精细分段左上半身2048+1416精细分段右上半身2048+1416表3:五个神经网络中的参数的数目网络名称总参数可训练参数数目不可训练参数数目粗略分段5,881,9785,878,6783,300精细分段骨盆5,880,2765,877,0683,208精细分段脊柱1,472,8151,471,1771,638精细分段左上半身1,472,7311,471,1011,630精细分段右上半身1,472,7311,471,1011,630下表4也展示用于此实例中的原始数据及五个神经网络的输入图像大小的变化率。如表中所展示,四个第二精细分段网络的输入图像大小的变化率小于第一定位网络,因为针对第二机器学习模块,初始voi的鉴别产生更标准化的输入。表4:原始数据及五个神经网络的输入图像大小。基于cnn的分段平台实例版本2如上文所描述的cnn全身分段系统的经更新第二实例版本在此实例中包含输入图像大小的调节、卷积滤波器数目及用于执行分段的神经网络中所使用的参数。如下文所见的表5、6及7展示用于五个神经网络中的不同参数的更新值。表5展示表1中所展示的输入图像大小的更新值,表6展示表2中所展示的神经网络的卷积滤波器数目的更新值,且表7展示由表3中所展示的神经网络使用的参数数目的更新值。表5:五个神经网络的输入图像大小的更新值。表6:五个神经网络中卷积滤波器数目的更新值。网络名称滤波器的总数目第一层中滤波器的数目粗略分段4096+49(49个类别)32精细分段骨盆3328+326精细分段脊柱2048+1816精细分段左上半身2048+1416精细分段右上半身2048+1416表7:五个神经网络中的参数数目的更新值网络名称总参数可训练参数数目不可训练参数数目粗略分段5,882,4235,879,1323,300精细分段骨盆3,881,2003,883,8122,612精细分段脊柱1,472,8151,471,1771,638精细分段左上半身1,472,7311,471,1011,630精细分段右上半身1,472,7311,471,1011,630基于cnn的分段平台实例版本3cnn全身分段方法的另一第3实例版本用于分段软组织区域以及骨骼。如本文中所描述,此第3版本包含两个并行使用的粗略分段模块,在本文中称作“粗略分段02”及“粗略分段03”“粗略分段02”模块经训练以鉴别子采样ct图像中的49个骨骼。“粗略分段03”模块经训练以鉴别子采样ct图像中的49个骨骼及肝脏。“粗略分段02”模块对骨骼的定位胜过“粗略分段03”模块,且为利用各模块的益处,并行使用二者以鉴别不同精细分段网络的初始所关注体积(例如,“限界框”)。特定地说,在第3版本中,使用七个精细分段网络。七个精细分段网络当中的六者使用“粗略分段02”以用于初始所关注体积鉴别,且第七个(“精细分段腹部”)使用“粗略分段03”以用于初始所关注体积鉴别。cnn全身分段系统的此第3实例版本的七个精细分段网络如下:·“精细分段腹部”:经训练以鉴别肝脏、左肾脏及右肾脏以及胆囊;·“精细分段左肺”:经训练以鉴别左肺;·“精细分段右肺”:经训练以鉴别右肺;·“精细分段混合的骨盆区域”:经训练以鉴别左髂骨及右髂骨、前列腺、膀胱以及骶骨及尾骨;·“精细分段脊柱骨”:经训练以鉴别12个胸椎、5个腰椎及胸骨;·“精细分段左上半身骨”:经训练以鉴别身体左侧的12个肋、左肩胛骨及左锁骨;及·“精细分段右上半身骨”:经训练以鉴别身体右侧的12个肋、右肩胛骨及右锁骨。下表8、9及10展示基于cnn的分段系统的第3版本中的七个神经网络中所使用的不同参数的值。表8:七个神经网络及两个定位网络的输入图像大小。网络名称输入图像大小(切片数、行数、列数)粗略分段02(81,77,99)粗略分段03(81,77,99)精细分段腹部(92,176,259)精细分段左肺(154,171,140)精细分段右肺(154,171,141)精细分段左上半身骨(154,171,140)精细分段右上半身骨(154,170,140)精细分段混合的骨盆区域(92,144,251)精细分段脊柱骨(192,183,115)表9:七个神经网络及两个定位网络中卷积滤波器的数目。表10:七个神经网络及两个定位网络中参数的数目。网络名称总参数可训练参数数目不可训练参数数目粗略分段025,882,4325,879,1323,300粗略分段035,882,4695,879,1673,302精细分段腹部1,473,0031,471,3691,634精细分段左肺1,472,7521,471,1201,632精细分段右肺1,472,7521,471,1201,632精细分段左上半身1,472,7311,471,1011,630精细分段右上半身1,472,7311,471,1011,630精细分段混合的骨盆区域3,883,8123,881,2002,612精细分段脊柱骨1,472,8151,471,1771,638因此,此实例表明本文中所描述的分段方法可如何用于执行有效的全身分段。ii.实例2:低剂量ct中骨架的自动分段及[18f]dcfpylpet中转移性前列腺癌的定量psma-pet/ct混合成像为一种有前景的前列腺癌患者的诊断平台。虽然为了精确诊断及治疗规划,通常需要手动划定三维ct图像中的器官,但此手动划定为费时的过程。为解决此难题,此实例表明根据本文中所描述的全身分段技术,使用深度学习方法使全身ct图像中的精确骨分段的过程自动化。如此实例中所描述,经由此骨骼分段获得的解剖信息可用于在[18f]dcfpyl(pyltm-psma)pet/ct图像中创建全自动病变检测算法。研发基于级联式深度学习卷积神经网络的深度学习算法以用于12个骨骼区域的语意分段。特定地说,12个骨骼区域为胸椎及腰椎、左(sinister/left)/右((dexter/right)肋、胸骨、左/右锁骨、左/右肩胛骨、左/右髂骨及骶骨。低剂量ct图像及手动精制分段图对的训练集(n=90)及验证集(n=22)用于研发深度学习算法。在从pyltm-psma研究获得的低剂量ct图像的测试集(n=10)上评估算法的性能。在图像的测试集中,手动分段五个代表性身体部分:左髂骨、腰椎、左肋、右肩胛骨及胸骨。这些手动分段用作评估自动分段程序的真实数据(groundtruth)。自动分段可用于自动病变检测。举例来说,可执行使用基于pet图像立体像素强度的标准吸收值(suv)的硬式阈值的自动病变检测方法。sorensen-dice评分用于评价自动分段的精确度。分段方法获得在训练集上分别为0.95及0.024的sorensen-dice评分平均值及标准差,且在验证集上分别为0.93及0.036的平均值及标准差。针对测试集,五个区域中的每一者的平均值(其中标准差值展示于圆括号中)如下:右锁骨的0.94(0.016)、左肋的0.90(0.023)、胸骨的0.92(0.019)、腰椎的0.94(0.033)及左髂骨的0.97(0.0033)。总体平均值(相对于所有身体部分)为0.93,标准差为0.030。因此,此实例表明全身低剂量ct图像中12个骨骼区域的全自动分段方法的精确度及用于pyltm-psma/ct混合成像的自动病变检测方法的用途。iii.实例3:用于pyltm-pet图像分析及病变检测的自动全身分段此实例表明根据本文中所描述的全身分段技术,使用深度学习方法自动分段全身ct图像中的49个骨骼及27个软组织区域。此实例也表明经由此分段获得的解剖信息可如何用于在[18f]dcfpyl(pyltm-psma)pet/ct图像中创建全自动病变检测算法。此实例还展示分段可如何用于从pet图像去除背景信号以有助于观测及检测其中pyltm已积累的病变。图6a展示说明用于此实例中所描述的pyltm-pet/ct图像分析中的本文中所描述的分段工艺的实施例的方框流程图。如同图5中所展示的工艺500,在工艺600中接收解剖图像。特定地说,在工艺600中,接收ct图像610a。在此实例中,工艺600用于鉴别ct图像且将其分段成对应于49个特定骨骼及8个软组织区域的目标所关注体积(在此实例中,使用实例1中所描述的基于cnn的分段方法的实例版本3)。为鉴别目标体积,执行粗略分段620a以定位初始所关注体积或子区域集合,例如如实例1中所描述。随后在子区域中的每一者内执行精细分段以鉴别对应于目标49个骨骼及8个软组织区域的特定目标所关注体积630a。可创建及合并表示经鉴别的目标体积的分段掩模640a,例如创建3d全身分段图。如实例1(cnn网络版本3)中所提及,所分段的特定区域如下:49个骨骼:左_锁骨右_锁骨左_髋骨右_髋骨左肋_1左肋_10左肋_11左肋_12左肋_2左肋_3左肋_4左肋_5左肋_6左肋_7左肋_8左肋_9右肋_1右肋_10右肋_11右肋_12右肋_2右肋_3右肋_4右肋_5右肋_6右肋_7右肋_8右肋_9骶骨_及_尾骨左_肩胛骨右_肩胛骨胸骨腰椎_1腰椎_2腰椎_3腰椎_4腰椎_5胸椎_1胸椎_10胸椎_11胸椎_12胸椎_2胸椎_3胸椎_4胸椎_5胸椎_6胸椎_7胸椎_8胸椎_98个软组织区域:胆囊左_肾脏右_肾脏肝脏左_肺右_肺前列腺膀胱图6b展示与标注重迭的一系列ct图像,所述标注说明此实例中所描述的全身分段工艺600中的步骤。在步骤610a处接收的实例原始ct图像展示于610b中。图像620b展示用于鉴别ct图像中的初始所关注体积的粗略分段的结果(所鉴别的不同区域展示为彩色区域)。图像630b展示鉴别初始所关注体积的“限界框”,其中执行精细分段以鉴别对应于49个骨骼及8个软组织区域的目标所关注体积。图像640说明最终合并的全身分段。转向图7,为训练用于执行分段的机器学习模块,多个预标记样品图像(例如图7中所展示的三个图像(710、720、730))用作训练数据集。机器学习模块在发现分段平台的许多组件的最优选配置之前,使用1000个手动标注标记以及100个在几十个gpu上训练历经1000个小时的模型来微调。然而,一旦经训练,则可快速执行分段,其中结果(例如图8(810及820为两个实例图像)及图16a及16b中所展示的那些)在约几秒(通常低于180秒)中获得。通过分段ct图像所获得的解剖内容可用于检测pet图像中与ct图像共配准的病变,例如,如在快速连续获得个体的ct及pet图像的典型pet/ct成像模式中,其中使个体保持在与所记录图像大体上相同的位置。特定地说,如此实例中所表明,ct图像的分段可转印到pet图像以便鉴别所关注区域(例如前列腺或骨架),其中除了预期携带原发性或继发性前列腺癌肿瘤的区域以外的整个功能图像可由病变检测算法排除。在不希望束缚于任何特定理论的情况下,由病变检测算法排除区域对于其中积累会引起背景组织区域内及其周围的pet图像立体像素的高强度的背景区域而言可尤其重要。如果不将背景组织区域中的高强度从前列腺病变检测过程中排除,那么可导致将背景噪声错误分类为癌病变。在背景排除过程之后保留下的区域中,可采用简单阈值(例如,suv为3)结合病变分类算法以发现相关组织区域内的热点。分类算法可用作简单检查以确定热点位置及比较热点邻域的强度。如果热点为较大热点的一部分且位于身体部分的边缘上(例如,接近于肝脏的肋),那么可将病变分类为噪声且排除。图9a至9d说明对此背景减法及病变检测算法的需要且通过其所获得的益处,其中所关注区域仅包含于检测程序中,且图像的部分含有高强度背景立体像素。图9a及9c展示重迭于ct图像上的呈白色到红色到蓝色的假色的pet图像。蓝色指示低pet图像强度,随着强度增加从红色转变到白色。图9b及9d展示与9a及9c中相同但所有背景吸收从pet图像中去除的pet图像。在图9b及9d中,对应于癌病变的少数局部化热点为可见的。在无背景去除的pet图像中,这些热点经大背景信号淹没及遮蔽。图10a展示使用由全身ct分段提供的解剖内容以检测病变且测定有用风险指标的实例性工艺1000,所述有用风险指标使用在投予作为放射性药品的pyltm后所获得的pet/ct图像来定量个体的癌症状态(例如,前列腺癌状态)。如图10a中所展示,获得pet/ct图像1010,解剖内容经由骨骼及软组织的分段测定1012且用于从pet图像获得测量值(例如,病变和/或风险指标的测量值)1014。图10b展示实例性pet/ct图像1016,且图10c展示骨骼及软组织的实例性分段1018a及1018b。如图10d中所展示,骨骼及软组织的分段(例如,展示于图像1020a中)可用于去除背景信号(例如来自背景组织区域,例如展示于图像1020b中的那些),仅留下来自指示癌病变的热点1020c的所需信号。图11至13说明此工艺,其展示ct图像的分段可如何转印到pet图像,且用于提供用于背景去除及病变检测的解剖内容。特定地说,图11a及图11b展示ct图像的不同视图,其中已执行骨骼的分段。在图11a及图11b中所展示的视图中,不同分段骨骼用不同颜色标记。值得注意地,借助于本文中所描述的“限界框”方法,甚至此复杂及大规模分段可极其快速执行。在小于180秒内执行展示于图11a及11b中的分段。如图12中所展示,骨骼及软组织的分段可用于解释可在正常情形下发生且遮蔽指示癌病变存在的有用热点信号的某些背景组织区域中的正常吸收。在用pyltm执行的pet/ct成像中,正常吸收可在肾脏、十二指肠、小肠、脾、肝脏、胰脏、胃、肾上腺、直肠及睾丸中发生。图12展示以红色鉴别的前述区域。如图13a中所展示,在减去由于这些区域中的正常pyltm积累而导致的背景强度后,病变变为可容易观测且可检测。一个此类病变1302在图13a至13d中可见。病变(例如病变1302)可例如经由定限方法检测,且分类为例如如上文所描述的pyltm阳性(即,指示癌症)。如同分段一样,病变检测也为快速的。在小于5秒内检测病变1302。图14a及图14b展示对患有转移性耐去势性前列腺癌(metastaticcastrationresistantprostatecancer)的65岁男性所获得的pet/ct图像执行的上文所描述的pet图像处理及病变检测方法的结果。患者的前列腺特异性抗原(psa)评分为6.8ng/ml。pet图像在投予作为放射性药品的pyltm后获得。图14a展示初始、原始pet/ct图像。图14b展示在本文中所描述的处理后的图像。去除背景强度,且若干种小病变可容易观测。在小于180秒内执行49个骨骼及8个软组织区域(例如,器官)的分段。图15a及图15b展示对患有转移性耐去势性前列腺癌的54岁男性所获得的pet/ct图像执行的pet图像处理及病变检测方法的结果。患者的psa评分为33.55ng/ml。pet图像在投予作为放射性药品的pyltm后获得。图15a展示初始、原始pet/ct图像。图15b展示在本文中所描述的处理后的图像。去除背景强度,且若干种小病变可容易观测。在小于或约180秒内再次执行49个骨骼及8个软组织区域(例如,器官)的分段。因此,此实例表明本文中所描述的全身分段方法如何利用27个软组织器官及49个骨骼的自动分段对pyltm图像进行处境化(contextualizing)以检测、定量及跟踪pyltm亲合病变。所述方法将允许临床医师/医师询问临床上地有关问题以用于较好地管理前列腺癌患者。优势(例如,(统计学上)证实在人工智能辅助的1404-spect图像分析的背景下增大了诊断精确度、精密度、速度及再现性(参见例如pct公开案wo2019/136349,其内容以全文引用的方式并入本文中)),针对pyltm-pet图像也可获得。iv.实例4:实例骨骼及软组织分段区域此实例提供一组使用本文中所描述的方法及实施例研发的系统可经由ct图像的分段鉴别的实例骨骼及软组织区域的列表。特定地说,下文列出已在ct图像集合中手动标记(例如,由一或多个人类专家鉴别)的67个骨骼及22个软组织区域。这些手动标记的ct图像可用作本文中所描述的机器学习方法的训练数据。举例来说,虽然实例1至3描述实施对49个骨骼及8个软组织区域进行分段的全身分段方法的当前软件版本,但其功能性可易于更新以分段列于此实例中的67个骨骼及22个软组织区域的任何数目。因此,此实例展示本文中所描述的系统及方法的实施例可经研发以鉴别类似区域,包含(但不必限于)此实例中所描述的特定区域。某些系统及方法可鉴别不必列于此实例中的组织区域。在某些实施例中,鉴别骨骼及软组织区域二者。在某些实施例中,一些系统及方法可仅鉴别骨骼或仅鉴别软组织。如下文列表中所指示,某些左侧及右侧骨骼经鉴别为独立组织区域(例如,左锁骨及右锁骨),且在某些情况下,单独地鉴别大组骨骼的个别成员。举例来说,以下的实例列表展示个别肋及脊椎骨经由此实例的分段方法鉴别(特定肋及脊椎骨编号于列表中)。此实例也应明确,本文中所描述的方法可用于分段整个身体的多个区域,包含(但不必限于)本文中所列出的区域。分段区域:骨骼(67个)左_锁骨右_锁骨左_股骨右_股骨左_腓骨右_腓骨左_髋骨右_髋骨左_肱骨右_肱骨下颌骨左_髌骨右_髌骨左_桡骨右_桡骨左肋_1左肋_2左肋_3左肋_4左肋_5左肋_6左肋_7左肋_8左肋_9左肋_10左肋_11左肋_12右肋_1右肋_2右肋_3右肋_4右肋_5右肋_6右肋_7右肋_8右肋_9右肋_10右肋_11右肋_12骶骨_及_尾骨左_肩胛骨右_肩胛骨颅骨胸骨左_胫骨右_胫骨左_尺骨右_尺骨所有_颈椎腰椎_1腰椎_2腰椎_3腰椎_4腰椎_5腰椎_6胸椎_1胸椎_2胸椎_3胸椎_4胸椎_5胸椎_6胸椎_7胸椎_8胸椎_9胸椎_10胸椎_11胸椎_12软组织(22个):左_肾上腺右_肾上腺腹部主动脉_部分胸部主动脉_部分大脑左_支气管右_支气管胆囊左_臀大肌右_臀大肌心脏左_肾脏右_肾脏肝脏左_肺右_肺胰脏前列腺直肠脾膀胱脑室v.实例5:计算用于放射性药品吸收定量及临床终点评估的热点指标实例5为使用本文所描述的分段及热点检测方法以针对特定经检测热点,计算可用于推断和/或定量放射性药品在经检测热点表示的病变内的吸收的热点指标值的实例方法。所计算的热点指标可与临床终点有关,包含患者的存活率且与确定治疗策略有关。当对在不同时间点采集的多个图像进行计算时,所计算的指标值可与特定患者的各其它者相比较,且指标的变化用于评价治疗功效及预测指标在不久的将来将如何变化。在某些实施例中,所计算的指标可预测针对靶向成像配体的治疗的敏感性。在某些实施例中,所计算的指标也可包含于有效患者分层的列线图(nomogram)中。此实例中的方法使用针对特定患者,在投予包括psma结合剂(例如pyltm)的放射性药品后所获得的ct-pet图像集。然而,本文中所描述的方法对用于成像的特定放射性药品为中立性的,且可与多种不同放射性药品,例如99mtc-mip-1404、18f-pyl、68ga-psma-11、18f-naf、11c-胆碱、[18f]fdg、[18f]facbc等一起使用。根据本文中所描述的系统及方法的基于机器学习的方法用于鉴别ct图像内的不同目标voi。如本文中所描述,目标voi为由分段方法自动鉴别的ct图像中的体积,以对应特定目标组织区域。在此实例方法中,鉴别对应于肝脏、主动脉部分及腮腺的目标voi。如本文中所描述,这些特定组织区域(肝脏、主动脉部分及腮腺)充当用于计算热点指标的参考区域。除参考区域以外,还可鉴别对应于其它目标组织区域的其它目标voi。将表示经鉴别的目标voi的分段掩模映射到pet图像以鉴别pet图像内的对应3d体积。以此方式,在pet图像中鉴别对应于肝脏、主动脉部分及腮腺的3d参考体积。一旦鉴别,则各特定3d参考体积用于计算提供特定3d参考体积内立体像素的强度测量值的对应参考强度值。在此实例中,使用各体积内部的平均强度,尽管其它测量值(例如,中位值、最大值、模式等)为可能的。为计算特定鉴别的热点的指标值,针对彼特定热点计算热点强度值且与参考强度值相比较。类似于参考值,热点强度值提供热点的立体像素的强度测量值。在此实例中,计算最大值,但如同参考值一样,可使用其它测量值。如此实例展示,用于计算热点强度值的特定测量无需与用于计算参考强度值的测量相同。为计算热点指标值,参考强度值可按一定比例映射到参考指标值,且热点指标值随后可基于热点强度值是否位于参考值之上、参考值之下或参考值之间来计算。举例来说,通常由对应于主动脉部分(此主动脉区域用于提供血池中吸收的测量,且也可称作血液或血池参考值)的参考体积计算的参考强度值的值最小,接着肝脏且随后腮腺区域。因此,其热点强度值等于血液参考值的热点将分配等于100的热点指标值;其热点强度值等于肝脏参考值的热点将分配等于200的热点指标值;且其热点强度值等于腮腺参考值的热点将分配等于300的热点指标值。位于两个参考强度值之间的热点强度值的热点指标值可经由内插法(例如,线性内插法(linearinterpolation))测定。在此方式中,经检测热点可分配指标值,所述指标值以标准化方式(例如,以便可在不同图像之间比较)定量热点表示的特定病变中的放射性药品吸收的水平。如本文中所描述,这些指标可与存活率有关,反过来所述存活率使其对治疗管理有用。举例来说,可视患者的预期结果而考虑较多或较少积极治疗。也可包含治疗价格作为因素。指标在随着时间推移测量时尤其有用。当比较患者随时间及多个成像检查的指标时,指标的变化可用于评价治疗功效,且预测指标在不久的将来将如何变化。值得注意地,此实例中所描述的方法相对于先前方法的显著优势为能够根据由本文中所描述的基于人工智能的分段方法提供的自动鉴别的3d体积计算参考强度值(以及热点强度值)。尝试定量表示病变的图像区域的先前方法依赖于手动标记(例如经由放置圆形标记物)2d切片中的区域,以鉴别位于参考组织区域内的2d所关注区域。与这些小2d区域相反,经由本文中所使用的方法鉴别的3d体积捕获遍及整个器官的强度,且借此提供增加的精确度及可重复性。此外,通过使用精确自动分段,提供精确度及可重复性的进一步增加。另外,此实例的方法使用经由内插法计算的连续变化的指标,而非使用小数目个值中的一者分类经检测病变。此方法提供可用来管理治疗策略且以精细粒度及精确方式跟踪随时间推移的疾病进展和/或治疗功效的更详细信息。vi.实例6:骨骼及局部淋巴中的自动热点检测及吸收定量pyltm-psmapet/ct混合成像(例如,在向患者投予pyltm之后获得的患者的图像pet/ct图像)为用于检测转移性前列腺癌的有前景的工具。本发明的图像分段、热点检测及定量技术可用作提供骨骼及局部淋巴(即,定域于患者的骨盆区域内和/或与其实质性接近的淋巴结)中异常pyltm-psma吸收的自动定量评估的基础。特定地说,如此实例中所展示,根据本文中所描述的系统及方法的图像分段及热点检测技术可用于pet图像的自动分析以检测医师可能鉴别为恶性病变的热点。在此实例中,评价pet/ct扫描以在扫描的pet图像内自动鉴别对应于潜在骨骼及局部淋巴结病变的热点。针对各扫描,ct图像的语意分段使用本文中所描述的深度学习方法执行以便鉴别特定骨骼及软组织区域(例如,器官)的集合。一旦获得,则将ct图像分段转印(例如,映射)到pet/ct扫描的pet图像以鉴别pet图像中的对应3d体积。在各pet图像中,对应于背景吸收的强度通过抑制对应于膀胱、肝脏及肾脏的经鉴别体积中的强度来去除。分段也用于界定其中检测热点的有关体积。随后,应用斑点检测算法以鉴别表示可能骨骼病变或可能恶性局部淋巴结的异常热点。对应于肝脏及主动脉的胸部分的参考体积用于计算参考suv值。此实例中的热点检测方法的精确度通过比较pet图像中使用本文中所描述的自动方法检测的热点与由医师小组鉴别骨骼病变及淋巴结病变的手动标注来验证。标注为骨骼病变的157个pet/ct扫描(114个图像并不具有任何病变且11个图像具有超过三种病变)集合用于评价检测对应于骨骼病变的热点的精确度及标注为局部淋巴结病变的66个扫描(不具有病变的40个图像及具有超过三种病变的六个)集合。骨骼检测算法鉴别97%的所有标注骨骼病变,每个图像具有平均109个热点。局部淋巴检测算法发现96%的所有标注恶性局部淋巴结,每次扫描具有平均32个热点。另外,在此实例中评价深度学习分段的精确度。分段算法经训练以分段用于界定热点搜索区域或作为参考区域使用的52个骨骼及7个软组织区域(例如,器官)的集合。针对各特定区域(骨骼或软组织区域),使用ct图像中彼区域的手动鉴别来执行及评价训练及验证。举例来说,140个手动鉴别的肝脏用于训练肝脏分段的算法,且37个手动鉴别的肝脏用于验证。类似地,61个及14个手动鉴别的主动脉分别用于训练及验证主动脉区域分段。针对肝脏分段,分别获得关于训练及验证集的0.99及0.96的分割评分。针对主动脉分段,分别获得关于训练及验证的0.96及0.89的分割评分。最后,未使用算法研发的十个额外图像集合用于评估一般化。针对这些十个图像,表征肝脏及主动脉的分段精确度的分割评分分别为0.97±0.01及0.91±0.5。下文为此特定实例中所使用的特定52个骨骼(骶骨及尾骨在单线上列为“骶骨_及_尾骨”,但对应于两个经分段区域)及7个软组织区域的全部列表。骨区域:左_肩胛骨左_锁骨左_锁骨右_锁骨左_髋骨右_髋骨左肋_1左肋_10左肋_11左肋_12左肋_2左肋_3左肋_4左肋_5左肋_6左肋_7左肋_8左肋_9右肋_1右肋_10右肋_11右肋_12右肋_2右肋_3右肋_4右肋_5右肋_6右肋_7右肋_8右肋_9骶骨_及_尾骨左_肩胛骨右_肩胛骨胸骨腰椎_1腰椎_2腰椎_3腰椎_4腰椎_5胸椎_1胸椎_10胸椎_11胸椎_12胸椎_2胸椎_3胸椎_4胸椎_5胸椎_6胸椎_7胸椎_8胸椎_9软组织区域:腹部主动脉_部分胸部主动脉_部分左_肾脏右_肾脏肝脏前列腺膀胱因此,此实例表明基于深度学习的语意分段的用途,其用于在[18f]dcfpyl(pyltm-psma)pet/ct图像中自动鉴别热点且计算suv参考值。vii.实例7:病变psma评分及psma加权病变参与此实例提供一种基于个别热点强度与参考水平的比较分配经检测热点的热点指标,且随后使用经分配个别热点指标以测定表示病变大小的测量值的加权和的总体指标的方法。此实例中所使用的指标用于评估使用psma结合剂及pet-ct成像来成像的患者的癌症状态。特定地说,个别热点指标根据这些参考水平经由与实例5中所描述的方法类似的内插法来测定。在此实例中,将对应于主动脉部分及肝脏部分的参考voi分段且映射到pet图像中的对应3d体积。主动脉部分体积用于测定血液参考强度,且肝脏体积用于测定肝脏参考强度。在此实例中,各参考强度通过采用对应体积中的平均强度(suv),由其对应体积测定,但也可使用其它测量值(例如最大值、峰值或中位值)。按一定比例,将参考水平(称作病变psma评分(lesionpsmascore;lps))如下分配给基于血液及肝脏参考强度(suv)的强度值:lps0分配给0suv水平,lps1分配给血液参考强度,lps2分配给肝脏参考强度,且最大lps3分配给计算为两倍肝脏参考强度的参考强度。个别热点基于其个别强度分配lps评分。针对具有介于0至最大参考强度(两倍肝脏参考强度)范围内的强度的个别热点,对应于个别热点强度的lps评分根据参考比例内插。具有超过最大参考强度的强度的热点分配最大lps3。可使用经检测热点及个别热点指标(lps评分)计算的两个实例总体风险指标经计算为对应于其中可发生癌病变的组织区域的特定体积中的热点大小的加权和。第一实例指标为加权psma的总体骨骼/淋巴/前列腺病变体积或比率(ptlv或ptlr)。此指标为病变体积的加权和,权重为病变psma评分。针对对应于骨骼(例如,骨架区域)、淋巴结及前列腺的3d体积,将总和单独地计算为各特定区域中发现的热点的热点体积的加权和。特定地说,加权和计算如下:∑(病变体积×病变psma评分)在某些情况下,比率可为优选的且可通过将加权和除以特定区域(例如,在pet图像中)的总3d体积来计算。与例如suv或标准化suv相反,通过lps加权求和的热点体积为有利的,因为其以(标准化)suv值形式表达的psma可能不与疾病的侵袭性呈线性关系。即,例如,不能假定具有强度100的热点表示病变比由具有强度20的热点表示的病变差五倍。计算lps评分及通过lps评分加权热点得到比较不同热点的比例。另一实例指标为psma加权的骨骼/淋巴总直径(plad)。此指标也为病变大小的测量值的总和(由lps评分加权),但此指标使用各热点的平均直径(例如,平均x直径、y直径及z直径)而非体积。由于体积为三维数量,因此大病变的较小体积变化相对于较小病变的大小变化可占主导(例如,引起总和的大波动)。使用平均直径缓解此效应。此指标计算如下:∑(病变平均直径×病变psma评分)针对骨骼及淋巴,可计算加权总直径。vii.实例8:ai辅助式图像分析针对患有低风险或中等风险前列腺癌的患者的改进性能99mtcmip-1404(1404)为用于检测及分期临床上显著前列腺癌的靶向psma的成像剂。手动评估spect/ct图像中的示踪剂吸收会在读取器间及读取器内标准化方面引入固有限制。此实例描述评价psma-ai辅助读数的性能的研究,其中相比于手动评估及已知临床预测值,根据本文中所描述的实施例执行前列腺体积及其它目标组织区域的自动分段。研究分析464名患有极低风险、低风险或中等风险前列腺癌的可评价患者,其诊断切片检查指示格里森等级≤3+4和/或为主动监测的候选者(1404-3301)。所有个体接收1404的iv注射液且给药后3-6小时执行spect/ct成像。三个独立读取器评价图像。所有个体在给药后经受自愿rp(低风险及中等风险)或前列腺切片检查(极低风险)。在格里森等级7或更高的个体中宣告临床上显著的疾病。在分析之前研发及锁定psma-ai。三个不同的独立读取器使用psma-ai获得1404在针对背景的前列腺中的定量表达(psma指标)。所有读取器的psma指标及个体与组织病理学参考值相比较,从而得到6种接受者操作特征(receiveroperatingcharacteristic;roc)曲线(3个手动读数+3个psma-ai辅助读数)。1404psma-ai辅助读数的临床性能也通过比较具有及不具有psma指标的多变量模型(psa、临床分期及诊断格里森评分)的roc曲线下面积(auc)来评价。手动读数显示出0.62、0.62及0.63的auc。具有psma-ai的读数显示出0.65、0.66及0.66的auc。psma-ai性能就auc来说在两个读数群之间的所有3×3=9的成对比较中高于手动(其中统计学上显著的改进在五种情况中观测到(标称p<0.05)),而不考虑多重比较。基线多变量模型(无psma指标)的预测能力处于auc0.74。在添加psma指标后,模型预测能力增加到auc0.77。逻辑回归模型指示psma指标(p=0.004)、术前psa(0.018)及阳性核心%(p=<0.001)与临床上显著疾病显著相关。当测量再现性时,psmaai读数对的对数(psma指标)相关系数为0.94、0.97及0.98。因此,此实例中所描述的研究证实psma-ai提供标准化平台以产生1404的可再现性定量评估。psma-ai辅助读数证实相对于用于鉴别患有临床上显著疾病的男性的已知预测值的额外改进。ix.实例9:自动计算用于定量用于前列腺癌分期的pet/ct图像的18f-dcfpyl吸收的psma指标此实例表明自动图像分段、病变检测及基于经由本文中所描述的方法的实施例分配给经检测病变的热点指标计算标准化指标评分。自动图像分析程序用于在投予放射性药品18f-dcfpyl(pyltm)之后,评价经由pet/ct扫描成像的患者的癌症状态。在此实例中,级联式深度学习通道用于分段ct图像中的有关器官,且将分段投影到pet图像空间中。特定地说,与对应于个体的骨骼的骨体积、对应于淋巴区域的淋巴体积及对应于前列腺的前列腺体积相对应的目标区域在ct图像中经分段且映射以鉴别pet图像中的对应3d体积。同样地,对应于主动脉部分及肝脏的主动脉及肝脏体积也经分段且映射到pet图像以用作如本文中所描述的参考区域。在pet图像中检测热点。手动分段被视为表示病变的热点,以及通过算法未检测到的其它病变。各个别经检测热点通过计算称作病变mipsma指标(lpi)的个别热点指标来定量。如上文实例6及7中所描述,此实例中所使用的lpi为使用自动分段(与手动鉴别相反)体积计算的连续指标。因此,其相比先前方法提供优势,所述先前方法利用图像中的不同器官的手动鉴别,且仅使用少量的有限数目个枚举值分类病变。因此,此方法提供可用来管理治疗策略且以精细粒度及精确方式跟踪随时间推移的疾病进展和/或治疗功效的更详细信息。各个经检测热点的lpi是基于从血池(如从鉴别的主动脉体积测量)及肝脏参考区域测定的参考值来计算,例如与上文实例7中所描述类似。特定地说,血池参考强度(suv值)使用pet图像内的主动脉体积来测量,且肝脏参考强度由pet图像中所鉴别的肝脏体积测量。血池及肝脏参考强度水平二者在pet图像中的对应体积内测量为平均suv(suvmean)。参考lpi指标值1及2分别分配给血池及肝脏参考强度。最大参考指标水平3分配给对应于两倍肝脏参考强度值的参考强度。各个别经检测热点是基于(i)热点的所测量热点强度值及(ii)与血池及肝脏参考强度值及前述参考指标水平的比较来分配lpi评分。特定地说,针对各热点,对应于平均病变吸收的个别热点强度值计算为热点的全部立体像素的平均suv。对于个别热点,如果平均病变标准吸收值(suvmean)等于血池参考值,那么分配等于1的lpi;对于具有等于肝脏参考吸收值的平均病变吸收值的热点,分配等于2的lpi;且将等于3的lpi分配给平均病变吸收值等于或大于两倍肝脏参考吸收的热点。针对强度落于参考强度值之间的热点,基于热点强度值及参考强度-指标值对内插个别热点lpi。骨骼区域内的总病变体积计算为pet图像中的骨骼体积内所检测的个别热点的加权体积和,其中各热点的体积由其对应lpi加权。以此方式,计算针对骨骼区域的psma加权的总病变体积(pltv)指标,表示为ptlvbone。类似地,还计算针对淋巴(ptlvlymph)及前列腺(ptlvprostate)区域的pltv指标值。针对三个区域中的每一者,患有多种不同适应症的个体的pet/ct图像数据集用于自动测定pltv指标值。基于ai的自动技术的性能基于与手动器官分段的比较及图像的标注来评价以鉴别热点,且比较整个区域中针对不同适应症所计算的pltv指标值。使用人工专家解释作为比较的最高准则,测定自动热点检测算法,针对骨骼病变具有92.1%的敏感性(97.2%于52个自动分段骨中)及针对淋巴病变具有96.2%的敏感性。平均地,每次扫描检测到17个骨骼热点且每次扫描检测到23个淋巴热点。pltv指标值使用骨骼区域的197个pet/ct图像、淋巴区域的99个pet/ct图像及前列腺区域的43个pet/ct图像的样品数据集来计算。在数据集中,所测定的94%的个别热点lpi在1与3之间,其中骨骼、淋巴及前列腺区域所测定的最小lpi分别为0.82、1.1及1.3。骨骼、淋巴及前列腺区域的中位lpi值分别为1.5、2.0及2.3。针对各区域,针对患有多种不同适应症的个体,计算如下的pltv指标:治疗反应(tr)、筛查(s)、新诊断(nd)、转移性(m)、疑似复发(sr)、复发(r)。通过计算四分位间距(interquartilerange)中值的平均值(iqrmean)来比较适应症之间的pltv指标值,因此排除离群值。通过pltv值的iqrmean对适应症进行排序得到:针对骨骼区域的tr<s<nd<r<sr<m,针对淋巴区域的s=m<r<nd<sr及针对前列腺区域的m<sr<r<s<nd,从而很好地与疾病状态的临床预期对准。图19展示针对各区域的不同适应症所测定的pltv指标值。图20展示三个区域中的每一者中所检测的热点的个别热点lpi值的散布图。与用于测定定级病变的参考值的手动方法(例如eiber等人,2017)相比,血液及肝脏自动参考值是基于与手动参考方法相比较大的图像体积且因此预期更稳固。图21比较针对血池(左曲线)及肝脏(右曲线)区域,经由本文中所描述的自动分段方法计算的参考值与使用器官边界的手动鉴别计算的参考值。如图21中所展示,在20次pet/ct扫描的样品中,自动与手动参考之间的相关性(皮尔森相关系数(pearson'r))针对血液为0.92且针对肝脏为0.87。因此,此实例表明使用自动分段、热点检测及指标值计算以检测癌症且跟踪随时间推移的癌症进展和/或对治疗的反应。d.成像剂在某些实施例中,3d功能图像为使用包括放射性药品的成像剂的核医学图像。核医学图像是在向患者投予放射性药品后获得,且提供关于放射性药品在患者内的分布的信息。放射性药品为包括放射性核种的化合物。核医学图像(例如pet扫描;例如spect扫描;例如全身扫描;例如复合pet-ct图像;例如复合spect-ct图像)检测从放射性药品的放射性核种发射的辐射以形成图像。特定放射性药品在患者内的分布可通过生物机制(例如血流或灌注)以及通过特异性酶促或受体结合相互作用来测定。不同放射性药品可经设计以利用不同生物机制和/或特定特异性酶促或受体结合相互作用,且因此在向患者投予时,选择性地集中在患者内的特定类型组织和/或区域内。较大的辐射量从患者体内具有比其它区域更高浓度的放射性药品的区域发射,使得这些区域在核医学图像中看起来更亮。因此,核医学图像内的强度变化可用于映射放射性药品在患者体内的分布。放射性药品在患者内的此映射分布可用于例如推断患者身体的不同区域内癌组织的存在。举例来说,在向患者投予后,鎝99m亚甲基二膦酸酯(99mtcmdp)选择性地积累在患者的骨架区域内,尤其在与恶性骨病变相关的异常成骨的位点处。放射性药品在这些位点处的选择性浓度在核医学图像中产生高强度的可鉴别的热点-局部化区域。因此,与转移性前列腺癌相关的恶性骨病变的存在可通过鉴别患者的全身扫描内的这些热点来推断。与患者总存活率及指示疾病状态、进展、治疗功效及其类似者的其它预后度量相关的风险指标可基于在向患者投予99mtcmdp后所获得的全身扫描中的强度变化的自动分析来计算。在某些实施例中,也可以与99mtcmdp的类似方式使用其它放射性药品。在某些实施例中,所使用的特定放射性药品视所使用的特定核医学成像模式而定。举例来说,18f氟化钠(naf)也在骨骼病变中积累(类似于99mtcmdp),但可用于pet成像。在某些实施例中,pet成像也可利用放射性形式的维生素胆碱,其易于由前列腺癌细胞吸收。在某些实施例中,可使用选择性结合到特定蛋白质或所关注受体的放射性药品(尤其在癌组织中增加其表达的那些)。这些蛋白质或所关注受体包含(但不限于)肿瘤抗原,例如cea,其表达于结肠直肠癌中;her2/neu,其表达于多种癌症中;brca1及brca2,其表达于乳癌及卵巢癌中;及trp-1及trp-2,其表达于黑素瘤中。举例来说,人类前列腺特异性膜抗原(psma)在前列腺癌,包含转移性疾病中上调。几乎所有前列腺癌表达psma且其表达在低分化的转移性及激素难治性癌瘤中进一步增加。因此,用一或多个放射性核种标记的对应于psma结合剂的放射性药品(例如,对psma具有高亲和力的化合物)可用于获得患者的核医学图像,可从所述核医学图像评估患者的多个区域(例如,包含(但不限于)骨骼区域)内前列腺癌的存在和/或状态。在某些实施例中,当疾病处于局部状态时,使用psma结合剂所获得的核医学图像用于鉴别前列腺内癌组织的存在。在某些实施例中,当疾病为转移性时,使用包括psma结合剂的放射性药品所获得的核医学图像用于鉴别多个区域内的癌组织的存在,所述区域不仅包含前列腺,而且包含本身有关的其它器官及组织区域,例如肺、淋巴结及骨。特定地说,在向患者投予后,放射性核种标记的psma结合剂基于其对psma的亲和力选择性地积累在癌组织内。在上文所描述关于99mtcmdp的那种类似方式中,放射性核种标记的psma结合剂在患者内的特定位点处的选择性浓度在核医学图像中产生可检测热点。当psma结合剂集中在表达psma的身体的多个癌组织及区域内时,患者的前列腺内的局部癌症和/或患者身体的不同区域中的转移癌可经检测及评价。如下文中所描述,与患者总存活率及指示疾病状态、进展、治疗功效及其类似者的其它预后度量相关的风险指标可基于在向患者投予psma结合剂放射性药品后所获得的核医学图像中的强度变化的自动分析来计算。多种放射性核种标记的psma结合剂可用作核医学成像的放射性药品成像剂以检测及评价前列腺癌。在某些实施例中,使用的特定放射性核种标记的psma结合剂视因素,例如特定成像模式(例如,pet;例如spect)及待成像的患者的特定区域(例如,器官)而定。举例来说,某些放射性核种标记的psma结合剂适合于pet成像,而其它适合于spect成像。举例来说,某些放射性核种标记的psma结合剂有助于使患者的前列腺成像且主要在疾病经局部化时使用,而其它有助于使遍及患者身体的器官及区域成像且适用于评价转移性前列腺癌。多种psma结合剂及其放射性核种标记版本描述于美国专利第8,778,305号、第8,211,401号及第8,962,799号中,其中的每一者以全文引用的方式并入本文中。i.pet成像放射性核种标记的psma结合剂在某些实施例中,放射性核种标记的psma结合剂为适合于pet成像的放射性核种标记的psma结合剂。在某些实施例中,放射性核种标记的psma结合剂包括[18f]dcfpyl(又称作pyltm;又称作dcfpyl-18f):或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括[18f]dcfbc:或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括68ga-psma-hbed-cc(亦称作68ga-psma-11):或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括psma-617:或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括68ga-psma-617(其为用68ga标记的psma-617)或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括177lu-psma-617(其为用177lu标记的psma-617)或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括psma-i&t:或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括68ga-psma-i&t(其为用68ga标记的psma-i&t)或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括psma-1007:或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括18f-psma-1007(其为用18f标记的psma-1007)或其药学上可接受的盐。ii.spect成像放射性核种标记的psma结合剂在某些实施例中,放射性核种标记的psma结合剂为适合于spect成像的放射性核种标记的psma结合剂。在某些实施例中,放射性核种标记的psma结合剂包括1404(又称作mip-1404):或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括1405(又称作mip-1405):或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括1427(又称作mip-1427):或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括1428(又称作mip-1428):或其药学上可接受的盐。在某些实施例中,psma结合剂利用放射性核种,通过将其螯合到金属的放射性同位素[例如,鎝(tc)的放射性同位素(例如,鎝99m(99mtc));例如铼(re)的放射性同位素(例如,铼188(188re);例如铼186(186re));例如钇(y)的放射性同位素(例如,90y);例如镏(lu)的放射性同位素(例如,177lu);例如镓(ga)的放射性同位素(例如68ga;例如67ga);例如铟的放射性同位素(例如,111in);例如铜(cu)的放射性同位素(例如,67cu)]来标记。在某些实施例中,1404用放射性核种标记(例如,螯合到金属的放射性同位素)。在某些实施例中,放射性核种标记的psma结合剂包括99mtc-mip-1404,其为用(例如,螯合到)99mtc标记的1404:或其药学上可接受的盐。在某些实施例中,可将1404螯合到其它金属放射性同位素[例如,铼(re)的放射性同位素(例如,铼188(188re);例如铼186(186re));例如钇(y)的放射性同位素(例如,90y);例如镏(lu)的放射性同位素(例如,177lu);例如镓(ga)的放射性同位素(例如68ga;例如67ga);例如铟的放射性同位素(例如,111in);例如铜(cu)的放射性同位素(例如,67cu)]以形成化合物,所述化合物具有与上文对于99mtc-mip-1404所展示的结构类似的结构,其中另一金属放射性同位素取代99mtc。在某些实施例中,1405用放射性核种(例如,螯合到金属的放射性同位素)来标记。在某些实施例中,放射性核种标记的psma结合剂包括99mtc-mip-1405,其为用(例如,螯合到)99mtc标记的1405:或其药学上可接受的盐。在某些实施例中,可将1405螯合到其它金属放射性同位素[例如,铼(re)的放射性同位素(例如,铼188(188re);例如铼186(186re));例如钇(y)的放射性同位素(例如,90y);例如镏(lu)的放射性同位素(例如,177lu);例如镓(ga)的放射性同位素(例如68ga;例如67ga);例如铟的放射性同位素(例如,111in);例如铜(cu)的放射性同位素(例如,67cu)]以形成化合物,所述化合物具有与上文对于99mtc-mip-1405所展示的结构类似的结构,其中另一金属放射性同位素取代99mtc。在某些实施例中,1427用(例如,螯合到)金属的放射性同位素标记,以形成根据下式的化合物:或其药学上可接受的盐,其中m为标记1427的金属放射性同位素[例如,鎝(tc)的放射性同位素(例如,鎝99m(99mtc));例如铼(re)的放射性同位素(例如,铼188(188re);例如铼186(186re));例如钇(y)的放射性同位素(例如,90y);例如镏(lu)的放射性同位素(例如,177lu);例如镓(ga)的放射性同位素(例如,68ga;例如67ga);例如铟的放射性同位素(例如,111in);例如铜(cu)的放射性同位素(例如,67cu)]。在某些实施例中,1428用(例如,螯合到)金属的放射性同位素标记,以形成根据下式的化合物:或其药学上可接受的盐,其中m为标记1428的金属放射性同位素[例如,鎝(tc)的放射性同位素(例如,鎝99m(99mtc));例如铼(re)的放射性同位素(例如,铼188(188re);例如铼186(186re));例如钇(y)的放射性同位素(例如,90y);例如镏(lu)的放射性同位素(例如,177lu);例如镓(ga)的放射性同位素(例如,68ga;例如67ga);例如铟的放射性同位素(例如,111in);例如铜(cu)的放射性同位素(例如,67cu)]。在某些实施例中,放射性核种标记的psma结合剂包括psmai&s:或其药学上可接受的盐。在某些实施例中,放射性核种标记的psma结合剂包括99mtc-psmai&s(其为用99mtc标记的psmai&s)或其药学上可接受的盐。e.计算机系统及网络架构如图17中所展示,展示且描述用于提供本文中所描述的系统、方法及架构的网络环境1700的实施方案。简单概述,现参看图17,展示且描述示范性云端计算环境1700的框图。云端计算环境1700可包含一或多个资源提供者1702a、1702b、1702c(总体来说,1702)。各资源提供者1702可包含计算资源。在一些实施方案中,计算资源可包含用于处理数据的任何硬件和/或软件。举例来说,计算资源可包含能够执行算法、计算机程序和/或计算机应用程序的硬件和/或软件。在一些实施方案中,示范性计算资源可包含具有存储及检索能力的应用服务器和/或数据库。各资源提供者1702可与云端计算环境1700中的任何其它资源提供者1702连接。在一些实施方案中,资源提供者1702可经计算机网络1708连接。各资源提供者1702可经计算机网络1708,与一或多个计算装置1704a、1704b、1704c(总体来说,1704)连接。云端计算环境1700可包含资源管理器1706。资源管理器1706可经计算机网络1708与资源提供者1702及计算装置1704连接。在一些实施方案中,资源管理器1706可通过一或多个资源提供者1702有助于将计算资源提供到一或多个计算装置1704。资源管理器1706可接收来自特定计算装置1704的对于计算资源的请求。资源管理器1706可鉴别能够提供由计算装置1704请求的计算资源的一或多个资源提供者1702。资源管理器1706可选择资源提供者1702以提供计算资源。资源管理器1706可有助于资源提供者1702与特定计算装置1704之间的连接。在一些实施方案中,资源管理器1706可建立特定资源提供者1702与特定计算装置1704之间的连接。在一些实施方案中,资源管理器1706可将特定计算装置1704再导向到具有所请求的计算资源的特定资源提供者1702。图18展示可用于实施本发明中描述的技术的计算装置1800及移动计算装置1850的实例。计算装置1800打算表示各种形式的数字计算机,例如膝上型计算机、台式计算机、工作站、个人数字助理、服务器、刀锋型服务器、大型计算机及其它合适的计算机。移动计算装置1850打算表示各种形式的移动装置,例如个人数字助理、蜂窝蜂窝式电话、智能型电话及其它类似计算装置。此处展示的组件、其连接及关系以及其功能仅打算为实例,且不打算为限制。计算装置1800包含处理器1802、存储器1804、存储装置1806、连接到存储器1804及多个高速扩充端口1810的高速接口1808以及连接到低速扩充端口1814及存储装置1806的低速接口1812。处理器1802、存储器1804、存储装置1806、高速接口1808、高速扩充端口1810及低速接口1812中的每一者使用各种总线互连,且可安装在共同母板上或视需要以其它方式安装。处理器1802可处理用于在计算装置1800内执行的指令,包含存储于存储器1804中或在存储装置1806上的指令,以在外部输入/输出装置(例如耦接到高速接口1808的显示器1816)上显示gui的图形信息。在其它实施方案中,可视需要连同多个存储器及存储器类型一起使用多个处理器和/或多个总线。另外,可将多个计算装置与提供必需操作的部分的各装置连接(例如,作为服务器库、一组刀锋服务器或多处理器系统)。因此,当术语用于本文中时,其中多个功能描述为由“处理器”执行,此涵盖其中多个功能由任何数目的计算装置(一或多个)的任何数目的处理器(一或多个)执行的实施例。此外,当功能描述为由“处理器”执行时,此涵盖其中功能由任何数目的计算装置(一或多个)(例如,在分布式计算系统中)的任何数目的处理器(一或多个)执行的实施例。存储器1804将信息存储于计算装置1800内。在一些实施方案中,存储器1804为一或多个易失性存储器单元。在一些实施方案中,存储器1804为一或多个非易失性存储器单元。存储器1804也可为另一种形式的计算机可读媒体,例如磁碟或光盘。存储装置1806能够为计算装置1800提供大量存储。在一些实施方案中,存储装置1806可为或含有计算机可读媒体,例如软碟装置、硬盘装置、光盘装置或磁带装置、快闪存储器或其它类似固态存储器装置或装置的阵列,包含呈存储网络局域网或其它配置形式的装置。指令可存储于信息载体中。指令在由一或多个处理装置(例如处理器1802)执行时,执行一或多种方法,例如上文所述的那些方法。指令也可由一或多个存储装置(例如计算机可读媒体或机器可读媒体(例如存储器1804、存储装置1806或处理器1802上的存储器)存储。高速接口1808管理针对计算装置1800的带宽密集型操作,而低速接口1812管理带宽密集性较低的操作。此类功能的布置仅为实例。在一些实施方案中,将高速接口1808耦接到存储器1804、显示器1816(例如经由图形处理器或加速器)及高速扩充端口1810,其可容纳各种扩充卡(未展示)。在实施方案中,将低速接口1812耦接到存储装置1806及低速扩充端口1814。可包含各种通信端口(例如usb、网络以太网、无线网络以太网)的低速扩充端口1814可例如经由网络适配器耦接到一或多个输入/输出装置,例如键盘、指向装置、扫描器或网络连接装置(例如交换器或路由器)。计算装置1800可以多种不同形式实施,如图式中所展示。举例来说,其可作为标准服务器1820或多次以这些服务器的群组实施。另外,其可以个人计算机(例如膝上型计算机1822)的形式实施。其也可实施为框架服务器系统1824的一部分。可替代地,来自计算装置1800的组件可与例如移动计算装置1850的移动装置中的其它组件(未展示)组合。这些装置中的每一者可含有计算装置1800及移动计算装置1850中的一或多者,且整个系统可由彼此通信的多个计算装置构成。移动计算装置1850包含处理器1852、存储器1864、输入/输出装置(例如显示器1854)、通信接口1866及收发器1868以及其它组件。移动计算装置1850也可具备存储装置(例如微驱动或其它装置)以提供额外存储。处理器1852、存储器1864、显示器1854、通信接口1866及收发器1868中的每一者使用各种总线互连,且组件中的若干者可安装在共同母板上或视需要以其它方式安装。处理器1852可执行在移动计算装置1850内的指令,包含存储于存储器1864中的指令。处理器1852可实施为包含独立及多个模拟及数字处理器的芯片的芯片组。处理器1852可提供例如移动计算装置1850的其它组件(例如用户接口的控制件、由移动计算装置1850运行的应用程序及利用移动计算装置1850的无线通信)的协作关系。处理器1852可经由控制接口1858及耦接到显示器1854的显示接口1856与用户通信。显示器1854可为例如tft(薄膜晶体管液晶显示器)显示器或有机发光二极管(organiclightemittingdiode;oled)显示器或其它合适的显示器技术。显示接口1856可包括用于驱动显示器1854以将图形及其它信息呈现到用户的合适电路。控制接口1858可接收来自用户的命令且将其转化用以呈递到处理器1852。此外,外部接口1862可提供与处理器1852的通信,以使移动计算装置1850与其它装置的附近区域通信能够达成。外部接口1862可例如在一些实施方案中提供有线通信,或在其它实施方案中提供无线通信,且也可使用多个接口。存储器1864将信息存储于移动计算装置1850内。存储器1864可实施为以下中的一或多者:一或多个计算机可读媒体或媒介、一或多个易失性存储器单元或一或多个非易失性存储器单元。扩充存储器1874也可提供且经由扩充接口1872与移动计算装置1850连接,所述扩充接口1872可包含例如单列式存储器模块(singleinlinememorymodule;simm)卡接口。扩充存储器1874可提供用于移动计算装置1850的额外存储空间,或也可存储用于移动计算装置1850的应用程序或其它信息。特定地说,扩充存储器1874可包含进行或补充上文所描述的处理的指令,且还可包含安全信息。因此,举例来说,扩充存储器1874可提供为移动计算装置1850的安全模块,且可用准许安全使用移动计算装置1850的指令编程。另外,可经由simm卡提供安全应用程序以及额外信息,例如以不可侵入方式将鉴别信息放置于simm卡上。存储器可包含例如快闪存储器和/或nvram存储器(非易失性随机存取存储器),如下文所论述。在一些实施方案中,指令存储于信息载体中。指令在由一或多个处理装置(例如处理器1852)执行时,实施一或多种方法,例如上文所述的那些方法。指令也可由一或多个存储装置,例如一或多个计算机可读媒体或机器机器可读媒体(例如存储器1864、扩充存储器1874或处理器1852上的存储器)存储。在一些实施方案中,指令可以传播信号形式例如经由收发器1868或外部接口1862接收。移动计算装置1850可经由通信接口1866无线通信,必要时所述通信接口1866可包含数字信号处理电路。通信接口1866可提供各种模式或协议下的通信,例如gsm话音呼叫(全球移动通信系统)、短消息服务(shortmessageservice;sms)、增强消息服务(enhancedmessagingservice;ems)或mms传信(多媒体消息服务)、码分多址(codedivisionmultipleaccess;cdma)、时分多址(timedivisionmultipleaccess;tdma)、个人数字蜂窝(personaldigitalcellular;pdc)、宽带码分多址(widebandcodedivisionmultipleaccess;wcdma)、cdma2000或通用包无线电服务(generalpacketradioservice;gprs)以及其它。这些通信可例如经由收发器1868使用射频进行。另外,可例如使用wi-fitm或其它此类收发器(未展示)来进行短程通信。另外,全球定位系统(globalpositioningsystem;gps)接收器模块1870可将额外的导航有关及位置有关无线数据提供到移动计算装置1850,所述无线数据可视需要由移动计算装置1850上运行的应用程序来使用。移动计算装置1850也可使用音频编解码器1860有声地通信,所述音频编解码器1860可接收来自用户的语音信息并且将其转化成可用数字信息。音频编解码器1860可同样地对用户产生可听声音,例如经由例如在移动计算装置1850的听筒中的扬声器。此类声音可包含来自话音电话呼叫的声音,可包含所记录的声音(例如话音频息、音乐文件等)且还可包含由移动计算装置1850上操作的应用程序产生的声音。移动计算装置1850可以多种不同形式实施,如图式中所展示。举例来说,其可实施为蜂窝蜂窝式电话1880。其还可实施为智能型电话1882、个人数字助理或其它类似移动装置的部分。本文所描述的系统及技术的各种实施方案可以数字电子电路、集成电路、专门设计的asic(特定应用集成电路)、计算机硬件、固件、软件和/或其组合形式实现。这些各种实施方案可包含一或多个计算机程式中的实施方案,所述计算机程式可执行和/或可译于包含至少一个可编程处理器的可编程系统上,所述可编程处理器可为专用或通用,经耦合以接收来自以下的数据及指令且将数据及指令传送到以下:存储系统、至少一个输入装置及至少一个输出装置。这些计算机程序(另外已知为程序、软件、软件应用程序或程序码)包含可编程处理器的机器指令,且可以高级程序和/或面向对象的编程语言形式和/或以组装件/机器语言形式实施。如本文中所使用,术语机器可读媒体及计算机可读媒体是指用于将机器指令和/或数据提供到可编程处理器的任何计算机程序产品、设备和/或装置(例如磁盘、光盘、存储器、可编程逻辑装置(programmablelogicdevice;pld)),包含接收呈机器可读信号形式的机器指令的机器可读媒体。术语机器可读信号是指用于将机器指令和/或数据提供到可编程处理器的任何信号。为提供与用户的交互,本文所描述的系统及技术可实施于具有以下的计算机上:显示装置(例如阴极光线套管(cathoderaytube;crt)或液晶显示(liquidcrystaldisplay;lcd)监测器),其用于向用户显示信息;以及键盘及指向装置(例如鼠标或轨迹球),用户通过其可将输入提供到计算机。其它类型的装置也可用于提供与用户的交互;举例来说,向用户提供的反馈可为任何形式的感觉反馈(例如,视觉反馈、听觉反馈或触觉反馈);且可以任何形式接收来自用户的输入,包含声学、话音或触觉输入。本文所描述的系统及技术可实施于计算系统中,所述计算系统包含后端组件(例如,作为数据服务器)或包含中间软件组件(例如,应用程序服务器)或包含前端组件(例如,具有图形用户接口或用户可经由其与本文所描述的系统及技术的实施交互的网络浏览器的客户端计算机)或这些后端、中间软件或前端组件的任何组合。系统的组件可由任何形式或媒体的数字数据通信(例如,通信网络)互连。通信网络的实例包含网络局域网(localareanetwork;lan)、网络广域网(wideareanetwork;wan)及网络因特网。计算系统可包含客户端及服务器。客户端及服务器大体上彼此远离且通常经由通信网络交互。客户端与服务器的关系借助于在各别计算机上运行且彼此具有主从关系的计算机程序产生。在一些实施方案中,本文中所描述的各种模块可经分离、组合或并入单一或经组合模块中。图式中所描绘的模块并不打算将本文中所描述的系统限制于其中所展示的软件架构。本文中所描述的不同实施方案的元件可经组合以形成上文不特定阐述的其它实施方案。元件可从本文中所描述的处理、计算机程序、数据库等移出而不有害地影响其操作。另外,图式中所描绘的逻辑流程并不需要所展示的特定次序或依序次序以达成所需结果。可将各种独立元件组合成一或多个个别元件以执行本文中所描述的功能。在整个描述中,其中将设备及系统描述为具有、包含或包括特定组件,或其中将工艺及方法描述为具有、包含或包括特定步骤,另外,打算存在基本上由所叙述的组件组成或由其组成的本发明的设备及系统,且存在基本上由所叙述的处理步骤组成或由其组成的根据本发明的工艺及方法。应理解,步骤次序或执行某一动作的次序并不重要,只要本发明保持可操作即可。此外,可同时进行两个或多于两个步骤或动作。虽然已参考特定的优选实施例具体地展示及描述本发明,但熟习所属领域者应理解,在不脱离如所附权利要求书所定义的本发明的精神及范围的情况下,本文中可对形式及细节做出各种改变。除非技术上不兼容,否则本发明的各种描述实施例可联合一或多个其它实施例使用。虽然已参考特定的优选实施例具体地展示及描述本发明,但熟习所属领域者应理解,在不脱离如所附权利要求书所定义的本发明的精神及范围的情况下,本文中可对形式及细节做出各种改变。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1