术后肿瘤评估方法、装置及计算机存储介质与流程
1.本技术实施例涉及人工智能技术领域,特别涉及一种术后肿瘤评估方法、装置及计算机存储介质。
背景技术:
2.肿瘤消融术是一种微创治疗技术,其安全性高、并发症小,是治疗放化疗失败或不适宜接受手术切除的癌症患者的一个重要的选择。
3.现有的消融设备可将能量直接传递到目标组织,并在原位造成物理性损伤:其中,热消融疗法是指借由射频消融、微波消融等通过高频电场,将目标组织升温到高于60℃,使得蛋白质和细胞核快速变性;冷冻消融疗法则是基于焦耳
‑
汤姆逊原理,将目标组织冷却到低于
‑
40℃,以破坏细胞结构使之凋亡坏死;此外,加热与冷却联合的消融疗法,可通过目标组织内温度与应力的迅速变化,增强对肿瘤造成的直接热损伤以及间接免疫响应。
4.近年来,结合医学影像的发展,也提出了用于评价肿瘤消融手术的技术,以及预测消融后长期随访中肿瘤体积变化的方法。
5.需说明的是,在肿瘤消融治疗过程中,肿瘤的敏感程度与热剂量的精确施加,是治疗成功的关键因素。然而,现有的肿瘤消融术后评估仍有以下部分缺陷:
6.第一,不同患者在治疗过程中实际接受的热剂量是各异的,而受限于消融设备与成像设备的兼容性,治疗时的温度场难以在导航影像中直观可视,仅凭医生经验和理想的手术前规划,难以衡量待消融肿瘤,尤其安全边界所受的损伤程度。
7.第二,消融后坏死病灶保留在体内无法取出,临床上需要通过一年以上的影像随访,来评价肿瘤在治疗后长期的局部进展情况。但基于影像随访的人工诊断,只能衡量成像时已经发生,且能反映到宏观的组织变化,忽视了肿瘤微循环破坏、抗原释放等在影像中的潜在表现,影响对预后的长期估计。
8.第三,当前的肿瘤消融预后评估方法,难以在治疗结束后即时评价手术是否成功,也无法针对随时间进展的肿瘤复发风险做出预测,其主要原因在于缺乏相关的定量指标为医生提供有临床指导意义的参考,这将延误高风险患者的最佳补充治疗时间,带来潜在的复发风险。
9.有鉴于此,如何提供一种可在及时且准确地进行术后肿瘤复发评估的技术,即为本技术待解决的技术课题。
技术实现要素:
10.鉴于上述问题,本技术提供一种术后肿瘤评估方法,可快速预测消融术后肿瘤局部进展的风险,以帮助医生加强病情监控,及时补充治疗。、
11.本技术第一方面提供一种术后肿瘤评估方法,其包括:获取目标肿瘤的术前影像和多个热消融影像;根据所述目标肿瘤的预设治疗参数、各所述热消融影像,获得各所述热消融影像对应的各热剂量图谱;根据各所述热剂量图谱、所述术前影像、各所述热消融影
像、所述预设治疗参数,获得多个目标特征向量;以及根据各所述目标特征向量,获得所述目标肿瘤的术后评估结果。
12.本技术第二方面提供一种计算机存储介质,所述计算机存储介质中储存有用于执行上述第一方面所述的术后肿瘤评估方法的各所述步骤的指令。
13.本技术第三方面提供一种术后肿瘤评估装置,其包括:获取模块,用于获取目标肿瘤的术前影像、多个热消融影像、预设治疗参数;分析模块,用于根据所述预设治疗参数、各所述热消融影像,获得各所述热消融影像对应的各热剂量图谱,并根据各所述热剂量图谱、所述术前影像、各所述热消融影像、所述预设治疗参数,获得多个目标特征向量;评估模块,用于根据各所述目标特征向量,获得所述目标肿瘤的术后评估结果。
14.综上所述,本技术实施例提供的术后肿瘤评估方法、装置及计算机存储介质,通过结合分析目标肿瘤的术前影像、热消融影像和预设治疗参数,可快速且准确地针对术后肿瘤局部进展的风险进行评估。
附图说明
15.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术实施例中记载的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的附图。
16.图1为本技术第一实施例的术后肿瘤评估方法的流程示意图。
17.图2为本技术第二实施例的术后肿瘤评估方法的流程示意图。
18.图3为本技术第三实施例的术后肿瘤评估方法的流程示意图。
19.图4为温度场图谱和热剂量图谱的实施例示意图。
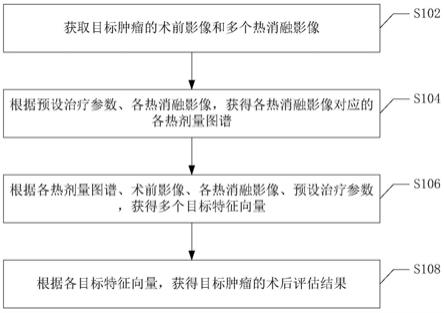
20.图5为本技术第四实施例的术后肿瘤评估方法的流程示意图。
21.图6为本技术第五实施例的术后肿瘤评估方法的流程示意图。
22.图7为本技术第七实施例的术后肿瘤评估装置的结构示意图。
23.元件标号700:术后肿瘤评估装置;702:获取模块;704:分析模块;706:评估模块;708:肿瘤评估模型。
具体实施方式
24.为了使本领域的人员更好地理解本技术实施例中的技术方案,下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本技术实施例一部分实施例,而不是全部的实施例。基于本技术实施例中的实施例,本领域普通技术人员所获得的所有其他实施例,都应当属于本技术实施例保护的范围。
25.呈上如背景技术部分所述,目前的肿瘤消融术后评估技术主要存在无法在直观显示治疗时的温度场,导致医生难以衡量待消融肿瘤,尤其安全边界所受的损伤程度,也难以在治疗结束后即时评价手术是否成功,以及无法针对随时间进展的肿瘤复发风险做出预测等问题。
26.有鉴于此,本技术各实施例提供一种术后肿瘤评估技术,可至少部分地解决上述
种种技术问题。
27.第一实施例
28.图1为本技术第一实施例的术后肿瘤评估方法的流程示意图。如图所示,本实施例的术后肿瘤方法主要包括:
29.步骤s102,获取目标肿瘤的术前影像和多个热消融影像。
30.可选地,可获取目标肿瘤执行消融术前的一个术前影像,并获取目标肿瘤对应于各热消融操作的各热消融影像。
31.于本实施例中,针对目标肿瘤所执行的消融术可包括单独冷消融、单独热消融、冷消融与热消融相结合等消融治疗方案。
32.其中,各热消融操作(例如射频消融)分别对应于目标肿瘤的不同消融位置。
33.可选地,还可获取目标肿瘤对应于冷消融操作的冷消融影像。
34.具体地,针对目标肿瘤所执行的消融术还可包括冷消融操作,其可在热消融操作之前执行。
35.可选地,术前影像、热消融影像、冷消融影像(若存在的话)可为包括mri影像、ct影像或超声影像,但并不以此为限,亦可采用影像类型。
36.于本实施例中,术前影像可为mri(核磁共振成像)影像,热消融影像、冷消融影像可为ct(电子计算机断层扫描)影像。
37.可选地,用于执行消融治疗的消融针可包括单极消融针、双极消融针、或多极消融针等。
38.步骤s104,根据预设治疗参数、各热消融影像,获得各热消融影像对应的各热剂量图谱。
39.可选地,可将预设治疗参数输入预设仿真模型中进行反演推算,以获得从各热消融操作开始起所累计的温度数据和热剂量数据。
40.于本实施例中,预设治疗参数是指于肿瘤消融术相关的各类治疗参数。
41.可选地,预设治疗参数可包括人体组织的初始阻抗和初始温度、消融针的输出功率、热消融操作的操作次数、对应于各热消融操作的各热消融时长等。
42.可选地,预设治疗参数还可包括患者年龄、肿瘤类型、肿瘤个数、治疗体位、冷消融操作的消融针个数等。
43.步骤s106,根据各热剂量图谱、术前影像、各热消融影像、预设治疗参数,获得多个目标特征向量。
44.于本实施例中,可从各热剂量图谱、术前影像、各热消融影像、预设治疗参数中获取影像组学特征和临床特征,并针对影像组学特征和临床特征进行任意组合,以获取多个目标特征向量。
45.步骤s108,根据各目标特征向量,获得目标肿瘤的术后评估结果。
46.可选地,可将各目标特征向量输入至训练好的肿瘤评估模型中进行预测,以输出目标肿瘤的术后评估结果。
47.可选地,目标肿瘤的术后评估结果可包括目标肿瘤的风险评分,其用于表示目标肿瘤的术后复发概率的高低。
48.可选地,目标肿瘤的术后评估结果还可包括目标肿瘤对应于各时段的各生存概率
值,以获得患者个体的生存概率曲线。
49.综上所述,本技术实施例的术后肿瘤评估方法,通过结合分析目标肿瘤的术前影像、热消融影像、预设治疗参数,可以快速且准确地针对目标肿瘤的术后复发风险进行评估预测,以协助临床医生更好地掌控患者病情。
50.第二实施例
51.图2示出了本技术第二实施例的流程示意图。如图所示,本实施例的术后肿瘤评估方法可在步骤s102之后且步骤s104之前执行,其主要包括以下步骤:
52.步骤s202,针对目标肿瘤的术前影像和各热消融影像执行影像配准。
53.于本实施例中,可基于第一次热消融操作的热消融影像,针对术前影像执行可变形配准,以及针对其他各热消融影像执行刚性配准。
54.具体地,可根据影像序列针对同一待消融组织(目标肿瘤)的成像差异,选择合适影像配准方式,以纠正治疗时体位变化和多次进退针操作(一次热消融操作会产生一次进退针)带来的组织形变。
55.例如,当执行术前影像和热消融影像的配准时,由于目标肿瘤及其周围组织受到实际治疗体位的影响,会产生较大的形变差异,于此情况下,可选择mri
‑
ct跨模态的可变形配准,以消除仰卧、侧卧、俯卧三种治疗体位产生的各向异性的体素移动。
56.例如,当执行对应于不同热消融操作的各热消融影像的配准时,由于目标肿瘤及其周围组织受到多次进退针操作的影响,会产生较小的形变差异,于此情况下,则可选择ct
‑
ct同模态的刚性配准。
57.可选地,还可基于第一次热消融操作的热消融影像,针对冷消融影像执行配准,其中,冷消融影像的配准方式可参考热消融影像,在此不予赘述。
58.步骤s204,根据配准后的术前影像和各热消融影像,确定感兴趣区域。
59.于本实施例中,可根据配准后的术前影像,确定目标肿瘤的肿瘤区域,并根据配准后的各热消融影像,确定目标肿瘤的监控范围区域,再根据肿瘤区域和监控范围区域,确定感兴趣区域。
60.于本实施例中,监控范围区域可包括消融针周围的最大消融半径范围及其目标肿瘤的周围组织。
61.可选地,还可根据配准后的冷消融影像,确定目标肿瘤的冷冻冰球。
62.步骤s206,根据配准后的各热消融影像,确定各热消融影像对应的各消融针位置。
63.于本实施例,可根据各热消融影像的横断面影像,确定对应于各热消融影像(即各热消融操作)的各消融针位置。
64.可选地,消融针位置可包括消融针的针尖位置坐标(x1,y1,z1)和针柄位置坐标(x2,y2,z2)。
65.综上所述,本技术实施例的术后肿瘤评估方法通过针对所获取的术前影像、热消融影像执行配准处理,借以提高后续术后肿瘤评估结果的准确性。
66.第三实施例
67.图3示出了本技术第三实施例的术后肿瘤评估方法的流程示意图。本实施例为上述步骤s104的具体实施方案,其主要包括以下步骤:
68.步骤s302,根据预设治疗参数,获得各热消融影像对应的各温度场数据和各热剂
量数据。
69.可选地,可根据预设治疗参数配置预设仿真模型,并基于配置后的预设仿真模型,获得热消融影像的感兴趣区域中各体素区块对应的各温度场数据、各热剂量数据。
70.于本实施例中,可利用预设仿真模型根据预设治疗参数反演各次热消融操作开始起累计的稳态温度场和热剂量分布,并以x坐标、y坐标、z坐标、温度值t的形式,导出温度场、热剂量点阵数据。
71.可选地,预设治疗参数可包括人体组织的初始阻抗和初始温度、消融针的输出功率、所述热消融操作的操作次数、对应于各所述热消融操作的各所述热消融时长等。其中,消融针的输出功率可根据不同的工作分段而分别设置。
72.可选地,消融针的针尖温度可利用温度感测器直接测得。
73.可选地,可通过准静电场方程与生物传热方程的耦合,来获取热剂量数据。
74.具体地,可利用下述预设换算规则获得热剂量数据:具体地,可利用下述预设换算规则获得热剂量数据:
75.其中,d表示对应于体素区块的热剂量数据,t表示热消融操作的热消融时长,t表示体素区块的瞬态温度值。
76.s304,根据各热消融影像的各空间坐标,转换各热消融影像对应的各温度场数据、各热剂量数据,获得各热消融影像对应的各温度场图谱和各热剂量图谱。
77.于本实施例中,热消融影像的空间坐标可从热消融影像的信息头中获取。
78.可选地,可根据各热消融影像的各空间坐标,插值计算各热消融影像对应的各温度场数据、各热剂量数据,获得各热消融影像对应的各温度场图像灰度值和各热剂量图像灰度值,再根据各温度场图像灰度值和各热剂量图像灰度值,获得各热消融影像对应的各温度场图谱和各热剂量图谱。
79.具体地,可根据热消融影像的信息头中的extent、origin、spacing,确定插值网格的尺寸大小,并利用线性插值法或三次样条插值法等方式插值计算各温度场图像灰度值和各热剂量图像灰度值。
80.而后,根据预设温度场点阵范围阈值,各热消融影像对应的各温度场图像灰度值,将超出预设温度场点阵范围阈值的各温度场图像灰度值标识为37,据以获得各热消融影像对应的各温度场图谱。
81.同样地,可根据预设热剂量场点阵范围阈值,各热消融影像对应的各热剂量图像灰度值,将超出预设热剂量场点阵范围阈值的各热剂量图像灰度值标识为0,以获得各热消融影像对应的各热剂量图谱。
82.请配合参考图4,其显示了利用本实施例的术后肿瘤评估方法所获得的温度场图谱和热剂量图谱,其中,序号a、b、c分别对应于仰卧、侧卧和俯卧三种情况。序号1、2分别为热消融操作的温度场图谱、热剂量图谱。
83.由图4可以看出,本实施例所构建的温度场图谱和热剂量图谱都反映了目标肿瘤
组织中热量积聚的程度,且热剂量图谱不容易受到消融针的形状的影响,从而更好地衡量待消融组织(即目标肿瘤)的边界损伤情况,以供快速确定消融手术是否成功。
84.步骤s306,根据各热消融影像对应的各消融针位置,针对各热消融影像对应的各温度场图谱和各热剂量图谱执行配准处理。
85.于本实施例中,可根据消融针的针尖位置坐标(x1,y1,z1)和针柄位置坐标(x2,y2,z2),针对各热消融影像对应的各温度场图谱和各热剂量图谱执行位移处理和/或旋转处理,以使各热消融影像对应的各温度场图谱和各热剂量图谱分别与消融针位置对齐。
86.具体地,可根据消融针的针尖位置坐标(x1,y1,z1)和针柄位置坐标(x2,y2,z2),确定垂直于热消融影像的横断面的旋转角度,据以计算位移变换矩阵和旋转变换矩阵;并根据平移变换矩阵和旋转变换矩阵针对温度场图谱和热计量图谱执行配准,以使各图谱的方向分别与消融针的插针方向相一致。
87.步骤s308,基于预设融合标准,融合配准后的各温度场图谱和各热剂量图谱、配准后的术前影像、配准后的各热消融影像,并输出融合结果。
88.于本实施例中,针对执行多次热消融操作的情况,需要考虑到能量的叠加作用,本实施例的方法还包括针对各热消融影像对应的各温度场图谱执行并集处理,以获得综合温度场图谱,并针对各热消融影像对应的各热剂量图谱执行加和处理,以获得综合热剂量图谱。
89.可选地,可针对综合温度场图谱、综合热剂量图谱执行归一化处理,以便于后续的融合显示及特征提取处理。
90.可选地,基于预设融合标准,融合配准后的各温度场图谱和各热剂量图谱、配准后的术前影像、配准后的各热消融影像可包括以下融合方式中的至少一个:
91.融合所述综合温度场图谱和术前影像;融合综合热剂量图谱和术前影像;融合任意一个热消融影像和对应于热消融影像的温度场图谱;融合任意一个热消融影像和对应于热消融影像的热剂量图谱。
92.例如,假设针对目标肿瘤执行了三次热消融操作,其中,将对应于三次热消融操作的三个温度场图谱分别标识为a1,a2,a3,将综合温度场图谱标识为a0,将对应于三次热消融操作的三个热剂量图谱分别标识为b1,b2,b3,将综合热剂量图谱标识为b0,将配准后的一个术前影像标识为c,将对应于三次热消融操作的三个热消融影像标识为d1,d2,d3,则上述各项数据的融合方式可包括以下四种:
93.方式一:a0+c的融合;方式二:b0+c的融合;方式三:对应于同一次热消融操作的温度场图谱和热消融影像的融合(例如,a1+d1、a2+d2、a3+d3,以此类推);融合方式四:对应于同一次热消融操作的热剂量图谱和热消融影像的融合(例如,b1+d1、b2+d2、b3+d3,以此类推)。
94.综上所述,本实施例的术后肿瘤评估方法根据预设治疗参数反演各次热消融操作对应的温度场图谱和热剂量图谱,并通过选择性融合配准后的各温度场图谱和各热剂量图谱、配准后的术前影像、配准后的各热消融影像,以生成多种融合结果,据以方便医生联动查看待消融组织(目标肿瘤)的边缘治疗情况,确保消融手术的技术成功。
95.再者,本实施例的术后肿瘤评估方法考虑到了患者在治疗过程中实际接受的热剂量的特异性,通过临床治疗参数精确反演温度场,并将热剂量的影响纳入肿瘤消融的术后
评估中,并实现了温度场图谱、热剂量图谱与目标肿瘤的术前影像、术中影像的融合,以直观显示肿瘤上每个体素的温度和能量信息。
96.第四实施例
97.图5示出了本技术第四实施例的术后肿瘤评估方法的流程示意图,本实施例主要示出了上述步骤s106的具体实施方案,其主要包括以下:
98.步骤s502,基于术前影像和综合热剂量图谱,分别获得对应于肿瘤区域和对应于监控范围区域的多个影像组学特征。
99.可选地,影像组学特征可包括灰度特征、几何特征、纹理特征、以及利用神经网络所获取的高阶特征中的任一个。
100.于本实施例中,针对术前影像,可以肿瘤区域为掩膜,提取多种纹理特征,包括tamara特征、law特征、灰度共生矩阵特征等,并提取目标肿瘤的几何特征。
101.于本实施例中,针对综合热剂量图谱,可以监控范围区域为掩膜,提取一阶灰度特征和如上所述的各项纹理特征。
102.于本实施例中,针对冷消融影像,亦可以监控范围区域为掩膜,提取冷冻冰球的几何特征。
103.可选地,可将术前影像、冷消融影像中的3d感兴趣区域,按照横断面进行划分,获得多个二维切片,并基于各二维切换,执行影像组学特征的提取操作。
104.步骤s504,基于预设治疗参数,获得多个临床特征。
105.可选地,预设治疗参数可包括病历系统所统计的各项病历信息以及消融设备的各项治疗参数。
106.例如,病历信息可包括年龄、肿瘤类型、肿瘤个数等参数,治疗参数可包括治疗体位、冷消融操作的平均功率、热消融操作的平均功率、冷消融操作的总时长、冷消融操作的总时长、冷消融操作的冷冻针数目、热消融操作的次数等。
107.可选地,可针对数值化的各临床特征执行归一化处理,并针对非数值化的各临床特征执行编码处理(例如one
‑
hot编码)。
108.步骤s506,根据影像组学特征和临床特征,获得各目标特征向量。
109.于本实施例中,可基于治疗顺序和特征来源,针对各影像组学特征和各临床特征执行分类,获得各类别特征;再基于预设筛选规则筛选各类别特征,获得各候选特征;并任意组合各候选特征,获得各目标特征向量。
110.可选地,类别特征至少包括临床类别特征、术前肿瘤类别特征、术中热剂量类别特征中的一个。
111.可选地,上述的预设筛选规则可包括非线性筛选方式和/或线性筛选方式。
112.例如,可采用lasso筛选方式(即非线性筛选)筛选出非零值的各分类特征,并利用线性筛选方式筛选出系数值小于0.6的各分类特征,据以获得各候选特征。
113.需说明的是,亦可采用其他筛选方式从分类特征中获取候选特征,本技术对此不作限制。
114.综上所述,利用本技术实施例的术后肿瘤评估方法,通过针对热剂量图谱、术前影像、各热消融影像、预设治疗参数执行特征提取,以组合成目标特征向量,所生成的目标特征向量包括临床特征、手术前肿瘤特征、手术中热剂量特征,既能表征肿瘤的组织特性,也
能反映所施加的特异性能量,不论直接的细胞坏死还是间接的免疫损伤,热量都是热物理消融产生治疗效果的根本原因,因此,本技术对于肿瘤消融风险的短期预测和长期估计均具有良好的预测潜力。
115.第五实施例
116.图6示出了本技术第五实施例的术后肿瘤评估方法,本实施例主要示出了肿瘤评估模型的训练流程,其主要包括:
117.步骤s602,利用各目标特征向量分别训练肿瘤评估模型,获得对应于各目标特征向量的各性能参数。
118.于本实施例中,肿瘤评估模型可基于支持向量机、随机森林、神经网络中的任一个所构建。
119.于本实施例中,目标特征向量的不同组合可例如为临床特征、手术前肿瘤特征、常规的术后消融区特征的组合;临床特征、术前肿瘤特征、术中热剂量特征的组合等,但并不以此为限,亦可采用其他组合模式生成目标特征向量。
120.于本实施例中,可首先基于预设最优超参数训练肿瘤评估模型:
121.例如,根据计算代价和预测误差,确定生存随机森林最佳的树木棵数n_tree,考虑到计算代价与预测精度,本实施例确定的最佳的树木棵数可为n_tree=880;通过gridsearchcv网格搜索,以确定最优超参数max_features、max_depth、min_node_size。而后,在训练集上以最优超参数训练生存随机森林模型,训练集通过10折交叉验证计算一致性系数c
‑
index,直到迭代至最优的训练集c
‑
index时,完成肿瘤评估模型的训练。
122.接着,可将完全训练的肿瘤评估模型在测试集上进行验证。
123.例如:将测试集分为10份,轮换计算每9份的一致性系数c
‑
index,以获得测试集性能的简单统计分布;并根据预测的测试集风险评分,计算时间依赖auc(iauc)、brier误差(ibs),以验证肿瘤评估模型在整个随访时间内的全局预测性能。
124.于本实施例中,可基于预设性能指标训练肿瘤评估模型,其中,预设性能指标包括:c
‑
index(一致性系数)=0.92
±
0.012,iauc(计算时间依赖)=0.889,ibs(brier误差)=0.041。
125.步骤s604,根据各目标特征向量对应的各性能参数,获得目标特征向量的最优组合以及基于最优组合的目标特征向量所训练完成的肿瘤评估模型。
126.于本实施例中,可通过比对各性能参数,获得目标特征向量的最优组合方式,并将基于最优组合的目标特征向量所训练的肿瘤评估模型作为最佳的肿瘤评估模型。
127.综上所述,利用本实施例所构建的肿瘤评估模型可预测目标肿瘤的风险评分和目标肿瘤对应于各时段的各生存概率值,能够给出时间依赖的定量信息。
128.第六实施例
129.本技术第六实施例提供一种计算机存储介质,所述计算机存储介质中储存有用于执行上述第一实施例至第五实施例中任一实施例所述的术后肿瘤评估方法的各所述步骤的指令。
130.第七实施例
131.图7示出了本技术第七实施例的术后肿瘤评估装置。如图所示,本实施例的术后肿瘤评估装置700主要包括:获取模块702、分析模块704、评估模块706。
132.获取模块702用于获取目标肿瘤的术前影像、多个热消融影像、预设治疗参数。
133.可选地,获取模块702还用于获取所述目标肿瘤执行消融术前的所述术前影像;以及获取所述目标肿瘤对应于各热消融操作的各所述热消融影像;其中,各所述热消融操作分别对应于所述目标肿瘤的不同消融位置。
134.可选地,所述术前影像、所述热消融影像包括mri影像、ct影像、超声影像中的任一个。
135.分析模块704用于根据所述预设治疗参数、各所述热消融影像,获得各所述热消融影像对应的各热剂量图谱,并根据各所述热剂量图谱、所述术前影像、各所述热消融影像、所述预设治疗参数,获得多个目标特征向量。
136.可选地,分析模块704还用于针对所述目标肿瘤的所述术前影像和各所述热消融影像执行影像配准;根据配准后的所述术前影像和各所述热消融影像,确定感兴趣区域;以及根据配准后的各所述热消融影像,确定各所述热消融影像对应的各消融针位置。
137.可选地,分析模块704还用于基于第一次所述热消融操作的所述热消融影像,针对所述术前影像执行可变形配准;以及基于第一次所述热消融操作的所述热消融影像,针对其他各所述热消融影像执行刚性配准。
138.可选地,分析模块704还用于根据配准后的所述术前影像,确定所述目标肿瘤的肿瘤区域;根据配准后的各所述热消融影像,确定所述目标肿瘤的监控范围区域;根据所述肿瘤区域和所述监控范围区域,根据所述肿瘤区域和所述监控范围区域,确定所述术前影像、所述热消融影像中的所述感兴趣区域。
139.可选地,分析模块704还用于根据所述预设治疗参数,获得各所述热消融影像对应的各温度场数据和各热剂量数据;根据各所述热消融影像的各空间坐标,转换各所述热消融影像对应的各所述温度场数据、各所述热剂量数据,获得各所述热消融影像对应的各温度场图谱和各所述热剂量图谱;根据各所述热消融影像对应的各所述消融针位置,针对各所述热消融影像对应的各所述温度场图谱和各所述热剂量图谱执行配准处理;基于预设融合标准,融合配准后的各所述温度场图谱和各所述热剂量图谱、配准后的所述术前影像、配准后的各所述热消融影像,并输出融合结果。
140.可选地,分析模块704还用于根据所述预设治疗参数配置预设仿真模型;基于配置后的所述预设仿真模型,获得所述感兴趣区域中的各体素区块对应的各所述温度场数据、各所述热剂量数据。
141.可选地,分析模块704还用于基于预设换算规则获得所述热剂量数据;所述预设换算规则表示为:算规则表示为:
142.其中,所述d表示对应于所述体素区块的所述热剂量数据,所述t表示所述热消融操作的热消融时长,所述t表示所述体素区块的瞬态温度值。
143.可选地,所述预设治疗参数包括人体组织的初始阻抗和初始温度、消融针的输出
功率、所述热消融操作的操作次数、对应于各所述热消融操作的各所述热消融时长。
144.可选地,分析模块704还用于根据各所述热消融影像的各所述空间坐标,插值计算各所述热消融影像对应的各所述温度场数据、各所述热剂量数据,获得各所述热消融影像对应的各温度场图像灰度值和各热剂量图像灰度值;根据预设温度场点阵范围阈值,各所述热消融影像对应的各所述温度场图像灰度值,获得各所述热消融影像对应的各所述温度场图谱;根据预设热剂量场点阵范围阈值,各所述热消融影像对应的各所述各热剂量图像灰度值,获得各所述热消融影像对应的各所述热剂量图谱。
145.可选地,所述消融针位置包括所述消融针的针尖位置坐标和针柄位置坐标,分析模块704还用于根据所述消融针的针尖位置坐标和针柄位置坐标,针对各所述热消融影像对应的各所述温度场图谱和各所述热剂量图谱执行位移处理和/或旋转处理。
146.可选地,分析模块704还用于针对各所述热消融影像对应的各所述温度场图谱执行并集处理,以获得综合温度场图谱;针对各所述热消融影像对应的各所述热剂量图谱执行加和处理,以获得综合热剂量图谱。
147.可选地,分析模块704还包括融合所述综合温度场图谱和所述术前影像,并输出所述融合结果。
148.可选地,分析模块704还包括融合所述综合热剂量图谱和所述术前影像,并输出所述融合结果。
149.可选地,分析模块704还包括融合任意一个所述热消融影像和对应于所述热消融影像的所述温度场图谱,并输出所述融合结果。
150.可选地,分析模块704还包括融合任意一个所述热消融影像和对应于所述热消融影像的所述热剂量图谱,并输出所述融合结果。
151.可选地,分析模块704还用于基于所述术前影像和所述综合热剂量图谱,分别获得对应于所述肿瘤区域和对应于所述监控范围区域的多个影像组学特征;基于所述预设治疗参数,获得多个临床特征;根据所述影像组学特征和所述临床特征,获得各所述目标特征向量。
152.可选地,所述影像组学特征包括灰度特征、几何特征、纹理特征、以及利用神经网络所获取的高阶特征中的任一个。
153.可选地,所述感兴趣区域为三维区域,分析模块704还用于针对所述术前影像中的所述感兴趣区域按横截面进行划分,获得多个二维切片;基于各所述二维切片,从所述术前影像中获得对应于所述肿瘤区域的所述影像组学特征。
154.可选地,分析模块704还用于针对数值化的各所述临床特征执行归一化处理,并针对非数值化的各所述临床特征执行编码处理。
155.可选地,分析模块704还用于基于治疗顺序和特征来源,针对各所述影像组学特征和各所述临床特征执行分类,获得各类别特征;基于预设筛选规则筛选各所述类别特征,获得各候选特征;任意组合各所述候选特征,获得各所述目标特征向量。
156.可选地,所述类别特征至少包括临床类别特征、术前肿瘤类别特征、术中热剂量类别特征中的一个。
157.可选地,分析模块704还用于采用lasso筛选出非零值的各所述分类特征,获得各所述候选特征。
158.评估模块706用于根据各所述目标特征向量,获得所述目标肿瘤的术后评估结果。
159.可选地,评估模块706用于利用训练好的肿瘤评估模型708以根据所述目标特征向量执行预测,获得所述目标肿瘤的术后评估结果。
160.可选地,所述目标肿瘤的术后评估结果包括所述目标肿瘤的风险评分和所述目标肿瘤对应于各时段的各生存概率值,其中,所述目标肿瘤的风险评分用于表示所述目标肿瘤的术后复发概率的高低。
161.可选地,可利用各所述目标特征向量分别训练所述肿瘤评估模型708,获得对应于各所述目标特征向量的各性能参数,并根据各所述目标特征向量对应的各所述性能参数,获得所述目标特征向量的最优组合以及基于最优组合的所述目标特征向量所训练完成的肿瘤评估模型708。
162.可选地,所述肿瘤评估模型708基于支持向量机、随机森林、神经网络中的任一个所构建。
163.可选地,可基于预设性能指标训练所述肿瘤评估模型708,其中,所述预设性能指标包括一致性系数为0.92
±
0.012,计算时间依赖为0.889,brier误差为0.041。
164.此外,本实施例的术后肿瘤评估装置700还可用于实现前述第一实施例至第五实施例中任一实施例所述的术后肿瘤评估方法中的其他步骤,并具有相应的方法步骤实施例的有益效果,在此不再赘述。
165.由上可知,本技术各实施例提供的术后肿瘤评估方法、装置及计算机存储介质,可快速且准确地预测术后肿瘤复发风险,以协助临床医生更精准地掌控患者病情。
166.最后应说明的是:以上实施例仅用以说明本技术实施例的技术方案,而非对其限制;尽管参照前述实施例对本技术进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本技术各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1