基于胶原纤维多元融合分析的瘢痕辅助检查工具
1.本发明属于生物组织的图像分析与疾病检测技术领域,具体涉及一种基于胶原纤维多元融合分析的瘢痕辅助检查工具。
背景技术:
2.瘢痕是热损伤、外伤性损伤和外科手术后的主要负面结果。这些疤痕坚硬、疼痛、发痒、隆起、收缩,导致局域功能的丧失,在某些情况下甚至会导致残疾。目前治疗瘢痕的方法有:病灶内注射糖皮质激素、激光治疗、手术治疗、冷冻治疗、放疗、硅胶制品应用等。尽管治疗方法众多,但临床效果并不令人满意。最重要的原因是对人类瘢痕的病理生理学缺乏了解。值得注意的是,皮肤疤痕在人类中是独一无二的。目前还没有类似于人类瘢痕的动物模型。这进一步阻碍了瘢痕病理生理学实验室研究的进展,进而阻碍了临床应用的发展。
3.瘢痕组织中胶原蛋白排列紊乱导致组织散射增加,弹性蛋白纤维的形态结构也与正常皮肤组织有明显区别。正常组织的弹性蛋白纤维呈长绳状,像弹簧一样卷曲、反冲,形成有弹性的皮肤结构,而瘢痕组织的弹性蛋白纤维存在于碎片状的纤维中。结果表明,皮肤瘢痕形成过程中弹性蛋白纤维的形态也发生了很大的变化,这可以作为指标,识别瘢痕组织和正常皮肤之间的界限,评估治疗反应,以及跟踪瘢痕的形成。
4.基于双光子激发荧光(tpef)和二次谐波(shg)的多光子显微技术是近年来生物成像领域最重要的发明之一。其采用红外飞秒激光器作为激发光源,具有减少试样光漂白、光损伤、增强穿透深度等独特优点。它已经成为成像未染色组织样本的强大工具,并有潜力无创评估和监测活组织的形态结构和功能状态。由于真皮中的胶原蛋白可以很容易地产生shg信号,而弹性蛋白则更有效地产生tpef,因此多光子显微技术可用于瘢痕检测,是追踪其病程发展过程,指导治疗方案以及评估治疗效果的有力工具。
5.现有技术弊端:
6.h&e(苏木精-伊红染色)切片:目前医生普遍通过h&e切片进行瘢痕组织的判断,但相对而言,h&e切片耗费较多的人力物力;同时,染色过程会破坏细胞,侵入性强;分辨率低。
7.单参量分析:此前,我们提出了对瘢痕组织胶原纤维图像进行单参量计算来进行表征和分类来辅助检查,但单参量由于参量单一,因此相对来说分类精度相对较低,准确度较低。
技术实现要素:
8.鉴于上述现有技术存在的缺陷,本发明提出了一种基于胶原纤维多元融合分析的瘢痕辅助检查工具。该工具可以对瘢痕组织胶原纤维图像进行多元融合分析,得到纤维取向、纤维弯曲度、纤维方向方差及纤维局域密度等多元结构参量,根据这些参量建立多参量瘢痕辅助检查模型自动进行瘢痕检测分析。该工具可以对多种光学显微技术所得到的胶原纤维图像进行处理与分析,具有快速、简洁、精确、适用性强等优点。
9.本发明采用以下技术方案实现:
10.本发明公开了一种基于胶原纤维多元融合分析的瘢痕辅助检查工具,其特征在于融合分析瘢痕组织胶原纤维的多元结构特征,建立用于表征和计算的瘢痕组织胶原纤维的分析模型辅助瘢痕检查,所述的检查工具的构建包括以下步骤:
11.1)将待检查组织通过二次谐波技术与双光子荧光技术对胶原纤维进行成像得到微米级分辨率的光学图像;
12.2)提取待检查组织对应胶原纤维图像中的胶原纤维的结构特征;
13.3)对胶原纤维的结构特征分别进行纤维取向、纤维方向方差、纤维弯曲度及纤维局域密度的多元结构参量的计算,得到数值结果;
14.4)对待检查组织中进行二次谐波/双光子荧光成像的位置进行标记,接着对待检查组织进行苏木精-伊红染色,用于病理学检查,接着根据病理学检查结果对标记区域是否含有瘢痕进行标签;
15.5)基于步骤3)中得到的多元结构参量计算的数值结果与步骤4)中得到的标签信息,运用fisher判别,构建多参量瘢痕辅助检查模型;
16.6)通过大量的多元参量与标签信息进行训练,最终得到一个基于胶原纤维多元参量分析的瘢痕辅助检查工具。
17.作为进一步地改进,本发明所述步骤3)中,纤维取向定量表征了胶原纤维的空间取向,提供定量读出组织的能力,取值范围为0
°‑
180
°
;纤维弯曲度定量计算了纤维的弯曲度,表征胶原纤维在组织中的走向情况;纤维方向方差定量表征了胶原纤维的有序程度,以定向统计为基础,基于三维矢量加权求和算法进行计算,取值范围为[0,1],当胶原纤维排列越无序时,三维方向方差数值越接近于1,当胶原纤维排列越接近于平行时,三维方向方差数值越接近于0;纤维局域密度量化了胶原纤维的空间分布情况。
[0018]
作为进一步地改进,本发明所述的纤维取向通过矢量加权求和算法计算,该算法根据不同方向上向量的长度和强度变化定义向量并对其进行加权求和,结果的分辨率为像素级别;纤维弯曲度通过领域内胶原纤维弯曲的程度得到,结果的分辨率为像素级别;纤维方向方差通过领域内胶原纤维取向的方差得到,结果的分辨率为像素级别;纤维密度通过计算领域内胶原纤维像素的比例得到,结果的分辨率为像素级别。
[0019]
作为进一步地改进,本发明所述步骤5)中,在多参量瘢痕辅助检查模型中,输入计算得到的正常组织图像组(类1)、瘢痕图像组(类2)和测试样本(类 sample)的纤维方向方差、纤维弯曲度和纤维密度,使用fisher判别——首先读入整体数据存为矩阵w12,将矩阵中对应各类的数据分别存为矩阵w1、w2和 sample;计算类1、类2和类sample的样本数r1、r2和r3;接着分别计算类1 和类2的均值(矩阵)m1和m2;计算类1和类2各类内离散度矩阵s1和s2(协方差矩阵,s1=cov(w1)*(r1-1),s2=cov(w2)*(r2-1));计算总类内离散度矩阵 sw(类1和类2的协方差矩阵相加);计算投影向量w(w=inv(sw)*(m1-m2)':将类1与类2的均值矩阵相减后取转置,再与总类内离散度矩阵相乘,最后对结果进行矩阵求逆),得到fisher判别式;计算投影后的一位空间内,各类的均值 y1和y2(y1=w'*m1',y2=w'*m2':类1和类2的均值分别为投影向量的转置和类1、类2的转置相乘);计算阈值w0(类1和类2,w0=-1/2*(y1+y2));将类 sample中的纤维方向方差、纤维弯曲度和纤维密度代入判别式进行求值并与阈值进行比较,判别其应归属于类1和类2哪一类,归属于类1则对应的输出值为1,归属于类2则对应的输出值为2;最终得到结果存入result单列矩阵中。
[0020]
作为进一步地改进,本发明所述步骤5)中,多参量瘢痕辅助检查模型是基于支持向量机的模型,计算出的结构参量数据集,按照留一法被分为训练集和测试集,训练集用于判别模型的构建与训练,测试集用于测试模型对于瘢痕检测的判别能力和优化检测模型。将纤维取向、纤维弯曲度、纤维方向方差及纤维局域密度等多元结构参量输入多参量瘢痕辅助检查模型,这些多元结构参量之间的互补性,保证了瘢痕检测模型的准确性和可信性。
[0021]
本发明使用多光子显微技术(二次谐波+双光子荧光成像),基于瘢痕组织胶原纤维的多元融合分析,高精度、快速无创以及节省人力物力。通过对瘢痕组织胶原纤维图像进行纤维取向、纤维弯曲度、纤维方向方差及纤维局域密度等多元结构参量的计算,实现对于胶原纤维的三维结构进行多维度量化的高准确率像素级分辨率分析,利用建立的瘢痕辅助检查工具,辅助医生进行检查,进一步加强对人类瘢痕的病理生理学了解。
[0022]
具体地,本发明与现有技术方案相比,具有如下优点:
[0023]
1.本发明通过对瘢痕组织胶原纤维图像进行多元结构特征提取,相比现有的h&e切片方法,有着高精度、快速无创以及节省人力物力的优势,同时能够实现对小病灶的成像。同时,相比现有的单一结构特征提取方法,提供了多维度、相互补充的胶原纤维结构信息,能更全方位地分析胶原纤维和瘢痕组织的形态学特征。
[0024]
2.由于目前还没有类似于人类瘢痕的动物模型,本发明提出的基于胶原纤维多元融合分析的瘢痕检测方法,建立了瘢痕辅助检查工具,通过对胶原纤维结构特征的分析,提供了对瘢痕组织各阶段更精确的描述,促进瘢痕组织的医学检测,从而能够推动瘢痕病理生理学实验室研究的进展,推动临床应用的发展。
[0025]
3.本发明所使用的纤维取向、纤维弯曲度、纤维方向方差及纤维局域密度等结构特征提供了像素级别分辨率的量化信息,通过使用伪彩色编码技术,这些信息被转化为更加生动形象的颜色图像进行呈现,具备较强的信息可读性,使辅助检测更加简单高效。
附图说明
[0026]
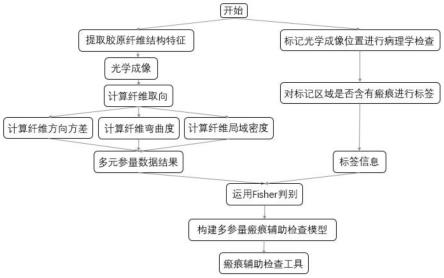
图1为构建胶原纤维多元融合分析的瘢痕辅助检查工具的流程示意图;
[0027]
图2为基于胶原纤维多元融合分析的瘢痕辅助检查工具光学成像结果图;图 2(a)为正常组织、瘢痕组织的胶原纤维多光子显微图像;图2(b)-(e)为纤维取向、纤维方向方差、纤维弯曲度及纤维局域密度的伪彩色编码的灰度图像。
[0028]
图3为多参量判别方法——fisher判别的具体过程示例示意图;
[0029]
图4为fisher判别示例的计算结果图;
[0030]
图5为单参量与多参量分类精度示意图。
具体实施方式
[0031]
为了更为具体地描述本发明,下面结合附图及具体实施方式对本发明的技术方案进行详细说明。
[0032]
本发明为一种基于胶原纤维多元参量分析的胰腺癌辅助检查工具,融合分析瘢痕组织多元结构特征,建立瘢痕检测模型辅助瘢痕检测与诊断,具体包含的步骤如图1所示:
[0033]
光学成像:对于组织中的胶原纤维进行成像。成像工具包括二次谐波成像、双光子荧光成像等。
[0034]
胶原纤维多元参量计算:对步骤1)中得到的待检查组织的胶原纤维图像进行多元量化分析,分别计算纤维方向方差、纤维弯曲度和纤维局域密度。
[0035]
纤维取向定量表征了胶原纤维的空间取向,提供定量读出组织的能力,在二维空间中,纤维的取向由它和x方向的夹角θ来描述,取值范围为0
°‑
180
°
。
[0036]
纤维弯曲度定量计算了纤维的空间曲率,表征胶原纤维在组织中的走向情况。对空间取向窗口内对空间曲率进行计算。首先分别计算窗口中所有非中心的有效像素的空间取向值与中心像素空间取向的差值,共计算n次,n为窗口中的非中心像素数,通过这样的方法来量化窗口邻域内空间取向的变化。对于纤维状结构数据,当差值为负值或者大于90
°
时需要进行修正,当差值为负值时需要取其绝对值,当差值大于90
°
时需要取其补角。最终将所有的修正后的空间取向差值进行求和,并将最后所得到数值除以n,再除以90得到最终的归一化空间曲率量值。最终按照计算得到的空间曲率数值对图像进行伪彩色编码以更加清晰明了地表示空间曲率的数值,从而得到图像中的纤维弯曲度
[0037]
纤维方向方差定量表征了胶原纤维的有序程度,以定向统计为基础,基于矢量加权求和算法进行计算。矢量加权求和算法:为了获取二维空间中n
×
n体素正方形窗口的中心体素的方向,首先计算正方形的中心像素的方向
‑‑
定义为穿过中心像素的向量,然后根据其他穿过中心像素的向量沿方向的长度和强度波动进行加权,即中心像素的方向被定义为所有这些加权向量的求和。纤维方向方差取值范围为[0,1],当胶原纤维排列越无序时,方向方差数值越接近于1,当胶原纤维排列越接近于平行时,方向方差数值越接近于0。
[0038]
纤维局域密度通过计算领域内胶原纤维像素的比例得到,它量化了胶原纤维的空间分布情况。可以看到,正常组织相对于瘢痕组织,纤维方向方差更小,纤维排列更有序;纤维弯曲度更小,纤维排列更趋近于平行;纤维局域密度更大,纤维排列更密集。
[0039]
对待检查组织中进行二次谐波/双光子荧光成像的位置进行标记,接着对待检查组织进行苏木精-伊红染色,用于病理学检查,接着根据病理学检查结果对标记区域是否含有瘢痕进行标签。
[0040]
基于得到的多元结构参量计算的数值结果与得到的标签信息,构建支持向量机模型;根据胶原纤维多元参量计算得到的纤维方向方差、纤维弯曲度和纤维局域密度三个参量检查组织内是否存在瘢痕组织。该模型保证了胶原纤维不同结构特征所提供的信息互补性,相较于单参量分析提高了精度,可以实现高准确率的瘢痕辅助检查应用。
[0041]
瘢痕辅助检查的实现利用了预先训练的以胶原纤维多元参量为特征的支持向量机数学模型,为了训练该模型,大量来自不同瘢痕组织的样本经过成像后进行多元参量的计算,接着将多元参量信息连同标签信息(组织中是否含有瘢痕) 一同用于支持向量机模型的训练,详细步骤如下:在支持向量机模型中,输入计算得到的正常组织图像组(类1)、瘢痕图像组(类2)和测试样本(类sample) 的纤维方向方差、纤维弯曲度和纤维密度,使用fisher判别——首先读入整体数据存为矩阵w12,将矩阵中对应各类的数据分别存为矩阵w1、w2和sample;计算类1、类2和类sample的样本数r1、r2和r3;接着分别计算类1和类2 的均值(矩阵)m1和m2;计算类1和类2各类内离散度矩阵s1和s2(协方差矩阵,s1=cov(w1)*(r1-1),s2=cov(w2)*(r2-1));计算总类内离散度矩阵sw(类 1和类2的协方差矩阵相加);计算投影向量w(w=inv(sw)*(m1-m2)':将类1 与类2的均值矩阵相减后取转置,再与总类内离散度矩阵相乘,最后对结果进行矩阵求逆),得到fisher判别式;计算投影后的一位空
间内,各类的均值y1和 y2(y1=w'*m1',y2=w'*m2':类1和类2的均值分别为投影向量的转置和类1、类2的转置相乘);计算阈值w0(类1和类2,w0=-1/2*(y1+y2));将类sample 中的纤维方向方差、纤维弯曲度和纤维密度代入判别式进行求值并与阈值进行比较,判别其应归属于类1和类2哪一类,归属于类1则对应的输出值为1,归属于类2则对应的输出值为2;最终得到结果存入result单列矩阵中。
[0042]
需要指出的是尽管本发明的胶原纤维多元参量计算涉及到纤维取向、纤维方向方差、纤维弯曲度和纤维局域密度四种参量的计算,但由于纤维取向的数值会由于参考坐标系的改变而发生变化,所以在瘢痕辅助检查中所使用的数学模型中并没有使用纤维取向参量;但由于纤维方向方差参量的计算是基于纤维取向进行的,其数值本身便蕴含了纤维取向所提供的形态学信息,并且这种参量的数值不受空间坐标系的影响。
[0043]
对于一个需要进行瘢痕检查的组织,首先对组织中的胶原纤维进行成像,接着对其各项结构参量进行计算,并将参量数值输入至胰腺癌辅助检查工具,进行求值并与训练得到的fisher判别阈值进行比较,判别其应归属于类1和类2哪一类,归属于类1则对应的输出值为1,归属于类2则对应的输出值为2,即:输出值为1为不包含瘢痕的正常组织图像,输出值为2为组织中包含瘢痕。
[0044]
下面结合说明书附图和具体实施例来详细说明本发明的具体实施方式,但本发明的应用不止于此。
[0045]
结合具体的正常组织和瘢痕组织进行举例说明,步骤如下,图1为构建胶原纤维多元融合分析的瘢痕辅助检查工具的流程示意图;图2为基于胶原纤维多元融合分析的瘢痕辅助检查工具光学成像结果图;图2(a)为正常组织、瘢痕组织的胶原纤维多光子显微图像;图2(b)-(e)为纤维取向、纤维方向方差、纤维弯曲度及纤维局域密度的伪彩色编码的灰度图像。1)首先对瘢痕组织中的胶原纤维进行光学成像。成像工具包括二次谐波成像、双光子荧光成像等。代表性的瘢痕组织与正常组织的二次谐波-双光子荧光图像如图2(a)所示。
[0046]
2)接着对所得的胶原纤维图像进行多元参量计算的计算,分别计算纤维去向、纤维方向方差、纤维弯曲度和纤维局域密度等参量。纤维取向定量表征了胶原纤维的空间取向,提供定量读出组织的能力,在二维空间中,纤维的取向由它和x方向的夹角θ来描述,取值范围为0
°‑
180
°
。
[0047]
纤维方向方差定量表征了胶原纤维的有序程度,以定向统计为基础,基于矢量加权求和算法进行计算。矢量加权求和算法:为了获取二维空间中n
×
n体素正方形窗口的中心体素的方向,首先计算正方形的中心像素的方向
‑‑
定义为穿过中心像素的向量,然后根据其他穿过中心像素的向量沿方向的长度和强度波动进行加权,即中心像素的方向被定义为所有这些加权向量的求和。纤维方向方差取值范围为[0,1],当胶原纤维排列越无序时,方向方差数值越接近于1,当胶原纤维排列越接近于平行时,方向方差数值越接近于0。
[0048]
纤维弯曲度定量计算了纤维的空间曲率,表征胶原纤维在组织中的走向情况。对空间取向窗口内对空间曲率进行计算。首先分别计算窗口中所有非中心的有效像素的空间取向值与中心像素空间取向的差值,共计算n次,n为窗口中的非中心像素数,通过这样的方法来量化窗口邻域内空间取向的变化。对于纤维状结构数据,当差值为负值或者大于90
°
时需要进行修正,当差值为负值时需要取其绝对值,当差值大于90
°
时需要取其补角。最终将所有的修正后的空间取向差值进行求和,并将最后所得到数值除以n,再除以90得到最终的
归一化空间曲率量值。最终按照计算得到的空间曲率数值对图像进行伪彩色编码以更加清晰明了地表示空间曲率的数值,从而得到图像中的纤维弯曲度
[0049]
纤维局域密度通过计算领域内胶原纤维像素的比例得到,它量化了胶原纤维的空间分布情况。可以看到,正常组织相对于瘢痕组织,纤维方向方差更小,纤维排列更有序;纤维弯曲度更小,纤维排列更趋近于平行;纤维局域密度更大,纤维排列更密集。
[0050]
多元参量的数值结果如图2(f)所示。除了多元参量结果外,还可以输出根据不同参量的数值结果生成的伪彩色编码图,以便更加清晰地对瘢痕组织的结构特征进行评估,代表性伪彩色编码图如图2(b-e)所示。
[0051]
3)接着将所得到的多元参量导入至瘢痕辅助检查工具,进行求值并与训练得到的fisher判别阈值进行比较,判别其应归属于正常组织图像组(类1)和瘢痕图像组(类2)哪一类,归属于类1则对应的输出值为1,归属于类2则对应的输出值为2,具体计算及每一步结果如图3所示。图3为多参量判别方法——fisher判别的具体过程示例示意图;多参量判别方法为,输入计算得到的正常组织图像组(类1)、瘢痕图像组(类2)和测试样本(类sample)的纤维方向方差、纤维弯曲度和纤维密度,使用fisher判别——首先读入整体数据存为矩阵w12,将矩阵中对应各类的数据分别存为矩阵w1、w2和sample;计算类1、类2和类sample的样本数r1、r2和r3;接着分别计算类1和类2的均值(矩阵)m1和m2;计算类1和类2各类内离散度矩阵s1和s2(协方差矩阵, s1=cov(w1)*(r1-1),s2=cov(w2)*(r2-1));计算总类内离散度矩阵sw(类1和类2的协方差矩阵相加);计算投影向量w(w=inv(sw)*(m1-m2)':将类1与类2 的均值矩阵相减后取转置,再与总类内离散度矩阵相乘,最后对结果进行矩阵求逆),得到fisher判别式;计算投影后的一位空间内,各类的均值y1和y2 (y1=w'*m1',y2=w'*m2':类1和类2的均值分别为投影向量的转置和类1、类 2的转置相乘);计算阈值w0(类1和类2,w0=-1/2*(y1+y2));将类sample中的纤维方向方差、纤维弯曲度和纤维密度代入判别式进行求值并与阈值进行比较,判别其应归属于类1和类2哪一类,归属于类1则对应的输出值为1,归属于类2则对应的输出值为2;最终得到结果存入result单列矩阵中。
[0052]
图4为fisher判别示例的计算结果图;类sample中14组数据根据其代入 fisher判别式后得到的具体值与阈值比较后,被分到类1和类2中,归属于类1 则对应的输出值为1,归属于类2则对应的输出值为2。从图4中本具体示例的结果可以看到,成功分类了类sample中的14组数据,其中类1为6个,类2 为8个,根据已知的类sample中14组数据对应原始图像的分类,前7组数据属于正常组织(类1),后7组数据属于瘢痕组织(类2),因此14组数据只有1 组的分类出错,具有较高的分类精度。
[0053]
图5为单参量与多参量分类精度示意图;图5(a)-(c)分别为以纤维方向方差、弯曲度和局域密度为单参量进行正常组织与瘢痕组织分类的结果示意图;图5(d)为以多参量进行正常组织与瘢痕组织分类的结果示意图;图5(e) 为分别以多参量进行正常组织与瘢痕组织分类的原始、交叉验证的结果表。根据图5可以看到,在本具体示例中,oca(original classification accuracy,原始分类精度)与cvca(cross-validation classification accuracy,交叉验证分类精度),单参量分类精度(纤维方向方差:65.0%和62.5%,弯曲度:62.5%,局域密度:82.5%)均低于多参量分类精度(97.5%),因此多参量能够较之前的单参量方法提高正常组织和瘢痕组织的分类精度。
[0054]
上述实例表明,本发明通过对正常组织和瘢痕组织胶原纤维图像进行多元结构特
征提取,定量表征了胶原纤维的方向方差、弯曲度和局域密度,提供了多维度、相互补充的胶原纤维结构信息,能更全方位地分析胶原纤维和瘢痕组织的形态学特征。同时,提供了胶原纤维方向方差、弯曲度和局域密度的伪彩色图像,分辨率为像素级别,将这些参量的胶原纤维结构信息,转化为更加生动形象的颜色图像进行呈现,具备较强的信息可读性,使辅助检测更加简单高效。
[0055]
上述对实施例的描述是为便于本技术领域的普通技术人员能理解和应用本发明。熟悉本领域技术的人员显然可以容易地对上述实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,对于本发明做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1