一种复发鼻咽癌放射治疗鼻咽坏死预测方法与流程
1.本发明涉及鼻咽癌坏死预测技术领域,特别涉及一种复发鼻咽癌放射治疗鼻咽坏死预测方法。
背景技术:
2.鼻咽癌好发于鼻咽黏膜,是一类常见的头颈部恶性肿瘤。到目前为止,放射治疗仍被认为是鼻咽癌的主要治疗方式,其原因是大部分鼻咽癌的病理类型为低分化鳞癌,对放射线具有较高的敏感性,放射治疗不仅可以达到理想的治疗效果,还保证了鼻咽部及颈部解剖结构的完整性,提高了患者的生活质量。从开展了鼻咽癌深部线放射治疗以来,经历年代放疗技术,使鼻咽癌单纯放疗的局部控制率达到。部分早期鼻咽癌患者甚至可以通过放疗达到治愈的效果。放疗前一般由物理师设计放疗计划,临床医生根据放疗计划,对病人进行放射治疗;由于受到肿瘤属性、物理师经验水准、病人自身情况等多因素影响,部分病人在接受放射治疗后会出现肿瘤区域坏死情况。
3.磁共振在鼻咽癌病灶的检测、疗效的评价、临床分期和预测等方面一直以来都发挥着重要的作用。传统的基于形态的mri对鼻咽癌治疗效果的早期预测几乎没有帮助。随着影像组学概念的提出,从医学影像中,通过自动化且可重复的分析方法,高通量地提取出定量特征,以捕获肿瘤内的异质性,例如基因、蛋白质、细胞、微环境、组织和器官。将这些特征与临床信息联系起来,用于建立描述和预测模型,而这些包括生物或医学数据的模型可以提供有价值的诊断、预后或预测信息。
4.现有技术中,基于多参数回归分析方法建立了基于临床特征数据(包括性别、再程放疗前是否坏死、gtv累计处方总剂量和复发肿瘤体积)的数学模型,以预测复发鼻咽癌患者调强放疗(imrt)发生鼻咽坏死(lethal nasopharyngeal necrosis,lnn)的风险。但是这种技术存在许多缺点:
①
数学模型建立复杂,仅能提供风险等级评分,个体化预测能力不足;
②
未能加入多mr序列影像组学特征进行预测,预测准确度低;
③
未能加入放疗剂量学特征进行预测,预测准确度低。
技术实现要素:
5.为了解决上述问题,本发明提供了一种复发鼻咽癌放射治疗鼻咽坏死预测方法,结合病人mri影像信息和放疗剂量来预测病人放疗坏死的概率,从而及时修改放射计划,避免人为原因造成放疗照射坏死。
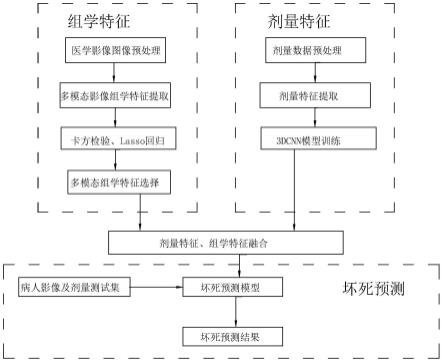
6.为此,本发明的技术方案是:一种复发鼻咽癌放射治疗鼻咽坏死预测方法,包括以下步骤:
7.1)医学影像图像预处理:分别获取病人的mri多模态数据t1、t1c、t2,再由医生手动分割出肿瘤区域;
8.2)多模态影像组学特征提取:利用python pyradiomics程序库对步骤1)中得到的多模态数据及肿瘤区域提取影像组学特征;
9.3)多模态组学特征选择:分别对三个模态数据提取到的影像组学特征进行特征参数相关性计算,筛选出相关系数高的多个特征,并将筛选出的多模态特征合并为病人组学特征;
10.4)剂量数据预处理:将剂量数据的维度调整到一致,再对剂量数据进行z-score归一化操作;
11.5)剂量特征提取:将步骤4)处理后的剂量数据输入多个3dcnn模块内,提取剂量特征,所述3dcnn模块由多个3d卷积算法、instancenorm算法、batchnorm算法、relu激活函数构成;
12.6)坏死概率预测:将步骤2)得到的组学特征和步骤5)得到的剂量特征全连接嵌入后进行拼接操作,再经过两层全连接层得到模型的输出结果,即病人以该剂量数据进行化疗后的坏死概率。
13.优选地,所述步骤5)中剂量特征提取的具体步骤如下:
14.i)输入值依次经过3d卷积算法、instancenorm算法处理后,被relu激活函数进行线性修正;
15.ii)步骤i)中修正后的值再经过3d卷积算法、batchnorm算法处理后,被relu激活函数进行线性修正;
16.iii)步骤ii)中修正后的值再经过3d卷积算法、instancenorm算法处理后,被relu激活函数进行线性修正;
17.iv)步骤iii)中修正后的值再经过3d卷积算法、batchnorm算法处理后,被relu激活函数进行线性修正,得到输出值;
18.v)重复3次步骤i)~步骤iv),每次步骤iv)得到的输出值均作为下一次步骤i)中的输入值;
19.vi)最终提取出剂量特征图,分辨率为k*k。
20.优选地,所述步骤5)中剂量数据的图像宽度为w,图像高度为h,图像通道数为c,即w
×h×
c,剂量数据经过4次3dcnn模块处理,提取剂量特征;所述第一轮3dcnn模块中3d卷积算法采用w/2
×
h/2
×
64,第二轮3dcnn模块中3d卷积算法采用w/4
×
h/4
×
128,第三轮3dcnn模块中3d卷积算法采用w/8
×
h/8
×
256,第四轮3dcnn模块中3d卷积算法采用1
×1×
512。
21.优选地,所述步骤3)中影像组学特征进行卡方检验算法或lasso正则化算法来筛选多个特征。
22.优选地,分析步骤6)得出的坏死概率,若坏死概率低,则按照医生制定的剂量数据进行放疗;若坏死概率高,则医生修改放疗剂量数据,重复步骤4)~6),直至得到的坏死概率降低,按照坏死概率低的剂量数据进行放疗。
23.与现有技术相比,本发明的有益效果是:根据病人放射治疗前的影像数据及放疗计划,得出组学特征与剂量特征,通过两者的特征融合来预测鼻咽癌坏死情况;医生可根据预测的坏死情况来修改放疗计划,在一定程度上使得病人免于放射治疗副作用的影响,保护病人的身体健康。
附图说明
24.以下结合附图和本发明的实施方式来作进一步详细说明
25.图1为本发明的方法流程图;
26.图2为本发明的坏死预测模块结构图;
27.图3为本发明3dcnn模块的流程框图;
28.图4为本发明剂量特征提取的3dcnn网络架构图。
具体实施方式
29.参见附图。本实施例所述的复发鼻咽癌放射治疗鼻咽坏死预测方法,通过使用3dcnn深度学习网络提取剂量特征,同时融合病人影像组学特征,进行特征融合,联合3dcnn网络进行深度神经网络训练,包括医学影像图像预处理、影像组学特征提取、多模态组学特征选择、剂量数据预处理、剂量特征提取、3dcnn深度神经网络模型搭建、坏死概率预测模块。
30.具体包括以下步骤:
31.1)医学影像图像预处理:分别获取病人的mri多模态数据t1、t1c、t2,再由经验医生手动分割肿瘤区域(roi);
32.在mri成像的过程中,通过改变mr信号的影响因素,可以得到不同的影像,这些不同的影像就称之为序列。如根据t1值加权,可得t1序列,根据t2值加权可得t2序列。一个病例可以有多个序列,每个序列由许多切片组成。t1序列主要用于观察解剖结构,t2序列用于确定病变部位信息,t1c序列用于观察肿瘤内部情况,鉴别肿瘤与非肿瘤性病变。在影像上把肿瘤或者部分肿瘤当做我们感兴趣的区域,给勾画出来,即为肿瘤roi区域。
33.2)影像组学特征提取:根据不同模态影像数据及肿瘤区域使用python pyradiomics程序库提取影像组学特征;提取提取影像组学特征时,可以指定用于提取特征的图像类型。通过重采样的方法将图像大小及体素标准化以减少影像分辨率不同对实验造成的影响,同时使用n4biasfieldcorrection对mr图像进行偏置场校正,以减轻扫描仪本身以及许多未知问题等因素可导致mr图像上的亮度差异。提取的组学特征分为形状特征、一阶统计特征、二阶统计特征、高阶特征。分别对t1、t1c、t2提取组学特征,组成三个特征集,每个特征集分别包括14个形状特征、18个一阶统计特征、24个灰度共生矩阵特征、14个灰度相关矩阵特征、16个灰度游程矩阵(glrlm)特征、16个灰度大小区域矩阵(glszm)特征、5个相邻灰度差矩阵(ngtdm)特征共107个特征。
34.3)多模态组学特征选择:特征选择主要是选择较少的变量来拟合响应变量的过程,经过特征选择使模型更容易解释,删除冗余的变量,不添加任何信息。减少问题的规模,使算法更快地工作,使处理高维数据成为可能,减少过拟合。运用卡方检验(chi-squaretest)分别对三个特征集进行特征初筛,再通过lasso算法对组学特征进行多元回归分析,筛选出对坏死预测具有重要价值的特征,从而提高预测模型的准确性。
35.lasso是一种建立在广义线性模型上的回归算法,无论因变量是连续或者离散都能处理;除此之外能对变量进行筛选,通过正则化权重系数,对参数进行稀疏化表示。由于提取的组学特征具有较高的维数,需要特征选择,找出具有代表性的、不高度相关的特征。通过卡方检验、lasso特征选择,我们在167例鼻咽癌患者放疗前mri图像上对三个特征集分别进行特征选择得到特征子集,然后将三个合并成一个特征集作为最终的组学特征集,共32个特征。
36.4)剂量数据预处理:将dicom格式的剂量数据维度统一调整到120x120x80尺寸,再对剂量数据进行z-score归一化操作;放疗医生根据勾画的肿瘤区域(roi)制作放疗计划,获得剂量数据,剂量数据格式为序列图片。
37.z-score归一化操作是将原始数据的均值和标准差来进行数据的标准化,处理后的数据均值为0,方差为1,符合标准正态分布,且无量纲,将不同量级的数据统一化为同一个量级,统一用计算出的z-score值衡量,保证了数据间具有可比性;公式如下所示:
38.xn=(x-μ)/σ
39.其中,x表示原始数据,μ表示原始数据的平均值,σ表示原始数据的标准差,xn表示归一化后的数据。
40.5)剂量特征提取:将步骤4)处理后的剂量数据输入多个3dcnn模块内,提取剂量特征,所述3dcnn模块由多个3d卷积、instancenorm算法、batchnorm算法、relu激活函数构成;;instancenorm算法、batchnorm算法主要用于归一化;relu主要作用是增加了神经网络各层之间的非线性关系;
41.3dcnn模块的输入向量首先经过第一层3d卷积层进行通道扩增,施加instancenorm在空间方向上归一化,经过第二个3d卷积层用于切片进行下采样,通过使用残差连接,减少特征丢失,增加模型可训练性。
42.剂量特征提取的具体步骤如下:
43.i)输入值依次经过3d卷积、instancenorm算法处理后,被relu激活函数进行线性修正;
44.ii)步骤i)中修正后的值再经过3d卷积、batchnorm算法处理后,被relu激活函数进行线性修正;
45.iii)步骤ii)中修正后的值再经过3d卷积、instancenorm算法处理后,被relu激活函数进行线性修正;
46.iv)步骤iii)中修正后的值再经过3d卷积、batchnorm算法处理后,被relu激活函数进行线性修正,得到输出值;
47.v)重复3次步骤i)~步骤iv),每次步骤iv)得到的输出值均作为下一次步骤i)中的输入值;
48.剂量数据的图像宽度为w,图像高度为h,图像通道数为c,即w
×h×
c,剂量数据经过4次3dcnn模块处理,提取剂量特征;所述第一轮3dcnn模块中3d卷积算法采用w/2
×
h/2
×
64,第二轮3dcnn模块中3d卷积算法采用w/4
×
h/4
×
128,第三轮3dcnn模块中3d卷积算法采用w/8
×
h/8
×
256,第四轮3dcnn模块中3d卷积算法采用1
×1×
512;
49.vii)最终提取出剂量特征图,分辨率为15*15。
50.如图4所示的网络结构中,以整个80张剂量切片序列作为3dcnn模型的输入,分辨率大小为120x120。hardwired主要用来编码剂量先验,这样比随机初始化更有价值,使用3x3x3大小的3d卷积核,为了提取序列信息,通过使用3dcnn卷积块不断增加通道数量,l6层通过1x1卷积是的特征输出128x1x1。
51.6)坏死概率预测:将步骤2)得到的组学特征和步骤5)得到的剂量特征线性嵌入(全连接)后进行拼接操作,再经过两层全连接层得到模型的输出结果,模型输出结果前采用sigmoid函数处理,由于其单增以及反函数单增等性质,sigmoid函数常被用作神经网络
的激活函数,将变量映射到0,1之间,从而得到病人以该剂量数据进行化疗后的坏死概率;在cnn结构中,经多个卷积层和池化层后,连接着1个或1个以上的全连接层。全连接层中的每个神经元与其前一层的所有神经元进行全连接。全连接层可以整合卷积层或者池化层中具有类别区分性的局部信息。
52.若得出的坏死概率低,则按照医生制定的剂量数据进行放疗;若坏死概率高,则医生修改放疗剂量数据,重复步骤4)~6),直至得到的坏死概率降低,按照坏死概率低的剂量数据进行放疗。
53.以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1