光伏动力生成系统和相关方法与流程
本申请要求2014年3月3日提交的美国临时专利申请No.61/947,019、2014年3月7日提交的美国临时专利申请No.61/949,271、2014年3月21日提交的美国临时专利申请No.61/968,839、2014年3月31日提交的美国临时专利申请No.61/972,807的优先权权益,这些专利申请的全部内容都以引用方式并入本文中。
本公开涉及动力生成领域,特别地,涉及用于动力生成的系统、装置和方法。更具体地,本公开的实施方式涉及产生光动力、等离子体、和热动力并且借助光-电动力转换器、等离子体-电动力转换器、光子-电动力转换器、或热-电动力转换器来发电的发电装置和系统,以及相关方法。另外,本公开的实施方式描述了使用水或基于水的燃料源的点燃以使用光伏动力转换器产生光动力、机械动力、电力、和/或热动力的系统、装置和方法。在本公开中详细描述了这些和其他相关实施方式。
动力生成可采取许多形式,利用来自等离子体的动力。等离子体的成功商业化可取决于能够有效形成等离子体并随后采集所产生等离子体的动力的动力生成系统。
可在特定燃料点燃期间,形成等离子体。这些燃料可包括水或基于水的燃料源。在点燃期间,形成电子带原子的等离子体云,并且可释放高光功率。本公开的电转换器可利用等离子体的高光功率。离子和激发态原子可复合,经历电子弛豫,发出光功率。可用光伏将光功率转换成电。
本公开的特定实施方式涉及一种动力生成系统,包括:多个电极,其被构造成将电力传递到燃料,以点燃燃料,产生等离子体;电源,其被构造成将电能传递到多个电极;至少一个光伏动力转换器,其被设置成接收至少多个等离子体光子。
在一个实施方式中,本公开涉及一种生成直接电能和热能中的至少一种的动力系统,该动力系统包括:
至少一个容器;
反应物,其包括:
a)催化剂的至少一个源或含新生H2O的催化剂;
b)原子氢的至少一个源或原子氢;
c)导体和导电基质中的至少一个;以及
至少一组电极,其用于约束至少一个分数氢反应物,
电源,其用于传递高电流电能的短脉冲;
重新装载系统;
至少一个系统,其用于从反应产物再生初始反应物,以及
至少一个等离子体动力学转换器或至少一个光伏转换器。
在一个示例性实施方式中,一种产生电力的方法可包括:将燃料供应到多个电极之间的区域;为这多个电极供能,以点燃燃料,形成等离子体;用光伏动力转换器将多个等离子体光子转换成电力;输出电力的至少一部分。
在另一个示例性实施方式中,一种产生电力的方法可包括:将燃料供应到多个电极之间的区域;为这多个电极供能,以点燃燃料,形成等离子体;用光伏动力转换器将多个等离子体光子转换成热动力;输出电力的至少一部分。
在本公开的实施方式中,一种生成动力的方法可包括将一定量的燃料传递到燃料装载区域,其中,燃料装载区域位于多个电极之间;通过向这多个电极施加电流使至少大约2,000A/cm2的电流流过燃料来点燃燃料,产生等离子体、光和热中的至少一种;在光伏动力转换器中接收光的至少一部分;使用光伏动力转换器将光转换成不同形式的动力;输出不同形式的动力。
在另外的实施方式中,本公开涉及一种水电弧等离子体动力系统,该动力系统包括:至少一个密闭的反应容器;包括H2O源和H2O中的至少一种的反应物;至少一组电极;用于传递H2O的初始高击穿电压并且提供后续高电流的电源;热交换器系统,其中,动力系统产生电弧等离子体、光和热能;至少一个光伏动力转换器。
本公开的特定实施方式涉及一种动力生成系统,包括:至少大约2,000A/cm2或至少大约5,000kW的电源;多个电极,其电联接到所述电源;燃料装载区域,其被构造成接收固体燃料,其中,所述多个电极被构造成将电力传递到所述固体燃料,以产生等离子体;等离子体动力转换器、光伏动力转换器和热-电动力转换器中的至少一个,其被设置成接收通过反应而产生的等离子体、光子、和/或热的至少一部分。其他实施方式涉及一种动力生成系统,包括:多个电极;燃料装载区域,其位于所述多个电极之间并且被构造成接收导电燃料,其中,所述多个电极被构造成向导电燃料施加足以点燃导电燃料的电流并且产生等离子体和热动力中的至少一个;传递机构,其用于将导电燃料移入所述燃料装载区域中;用于将等离子体光子转换成动力形式的光伏动力转换器、或用于将热动力转换成包括电力或机械动力的非热形式动力的热-电转换器中的至少一个。其他实施方式涉及一种生成动力的方法,该方法包括:将一定量的燃料传递到燃料装载区域,其中,所述燃料装载区域位于多个电极之间;通过向所述多个电极施加电流使至少大约2,000A/cm2的电流流过所述燃料来点燃所述燃料,产生等离子体、光和热中的至少一种;在光伏动力转换器中接收光的至少一部分;使用所述光伏动力转换器将光转换成不同形式的动力;输出不同形式的动力。
另外的实施方式涉及一种动力生成系统,该动力生成系统包括:至少大约5,000kW的电源;间隔开的多个电极,其中,所述多个电极至少部分包围燃料,电连接到所述电源,被构造成接收用于点燃所述燃料的电流,所述多个电极中的至少一个能移动;传递机构,其用于移动所述燃料;以及光伏动力转换器,其被构造成将通过点燃所述燃料而产生的等离子体转换成非等离子体形式的动力。另外在本公开中提供了一种动力生成系统,该动力生成系统包括:至少大约2,000A/cm2的电源;间隔开的多个电极,其中,所述多个电极至少部分包围燃料,电连接到所述电源,被构造成接收用于点燃所述燃料的电流,所述多个电极中的至少一个能移动;传递机构,其用于移动所述燃料;以及光伏动力转换器,其被构造成将通过点燃所述燃料而产生的等离子体转换成非等离子体形式的动力。
其他实施方式涉及一种动力生成系统,该动力生成系统包括:至少大约5,000kW或至少大约2,000A/cm2的电源;间隔开的多个电极,其中,所述多个电极中的至少一个包括压缩机构;燃料装载区域,其被构造成接收燃料,其中,所述燃料装载区域被所述多个电极包围,使得所述至少一个电极的所述压缩机构向着所述燃料装载区域取向,并且其中,所述多个电极电连接到所述电源并且被构造成将电力供应到所述燃料装载区域中接收的燃料,以点燃所述燃料;传递机构,其用于将所述燃料移入所述燃料装载区域中;以及光伏动力转换器,其被构造成将通过点燃所述燃料而产生的光子转换成非光子形式的动力。本公开的其他实施方式涉及一种动力生成系统,该动力生成系统包括:至少大约2,000A/cm2的电源;间隔开的多个电极,其中,所述多个电极中的至少一个包括压缩机构;燃料装载区域,其被构造成接收燃料,其中,所述燃料装载区域被所述多个电极包围,使得所述至少一个电极的所述压缩机构向着所述燃料装载区域取向,并且其中,所述多个电极电连接到所述电源并且被构造成将电力供应到所述燃料装载区域中接收的燃料,以点燃所述燃料;传递机构,其用于将所述燃料移入所述燃料装载区域中;以及等离子体动力转换器,其被构造成将通过点燃所述燃料而产生的等离子体转换成非等离子体形式的动力。
本公开的实施方式还涉及一种动力生成系统,该动力生成系统包括:多个电极;燃料装载区域,其被所述多个电极包围并且被构造成接收燃料,其中,所述多个电极被构造成点燃位于所述燃料装载区域中的燃料;传递机构,其用于将所述燃料移入所述燃料装载区域中;光伏动力转换器,其被构造成将通过点燃所述燃料而产生的光子转换成非光子形式的动力;去除系统,其用于去除点燃的所述燃料的副产物;以及再生系统,其可操作地联接到所述去除系统,用于将被去除的点燃的所述燃料的所述副产物再循环到再循环燃料中。本公开的某些实施方式还涉及一种动力生成系统,该动力生成系统包括:至少大约2,000A/cm2或至少大约5,000kW的电源;间隔开的多个电极,其电连接到所述电源;燃料装载区域,其被构造成接收燃料,其中,所述燃料装载区域被所述多个电极包围,使得所述多个电极被构造成将电力供应到所述燃料,以在所述燃料被接收在所述燃料装载区域中时点燃所述燃料;传递机构,其用于将所述燃料移入所述燃料装载区域中;光伏动力转换器,其被构造成将通过点燃所述燃料而产生的多个光子转换成非光子形式的动力。某些实施方式还可包括:输出功率端子中的一个或更多个,其可操作地联接到所述光伏动力转换器;动力存储装置;传感器,其被构造成测量与所述动力生成系统关联的至少一个参数;以及控制器,其被构造成控制至少与所述动力生成系统关联的处理。本公开的某些实施方式还涉及一种动力生成系统,该动力生成系统包括:电源,其被构造成输出至少大约2,000A/cm2或至少大约5,000kW的电力;间隔开的多个电极,其中,所述多个电极至少部分包围燃料,电连接到所述电源,被构造成接收用于点燃所述燃料的电流,并且所述多个电极中的至少一个是能移动的;传递机构,其用于移动燃料;光伏动力转换器,其被构造成将通过点燃所述燃料而产生的光子转换成不同形式的动力。
本公开的另外实施方式涉及一种动力生成系统,该动力生成系统包括:至少5,000kW或至少大约2,000A/cm2的电源;间隔开的多个电极,其电连接到所述电源;燃料装载区域,其被构造成接收燃料,其中,所述燃料装载区域被所述多个电极包围,其中所述多个电极被构造成将电力供应到所述燃料,以在所述燃料被接收在所述燃料装载区域中时点燃所述燃料;传递机构,其用于将所述燃料移入所述燃料装载区域中;光伏动力转换器,其被构造成将通过点燃所述燃料而产生的多个光子转换成非光子形式的动力;传感器,其被构造成测量与动力生成系统关联的至少一个参数;以及控制器,其被构造成控制至少与所述动力生成系统关联的处理。其他实施方式涉及一种动力生成系统,该动力生成系统包括:至少2,000A/cm2的电源;间隔开的多个电极,其电连接到所述电源;燃料装载区域,其被构造成接收燃料,其中,所述燃料装载区域被所述多个电极包围,其中,所述多个电极被构造成将电力供应到所述燃料,以在所述燃料被接收在所述燃料装载区域中时点燃所述燃料;传递机构,其用于将所述燃料移入所述燃料装载区域中;等离子体动力转换器,其被构造成将通过点燃所述燃料而产生的等离子体转换成非等离子体形式的动力;传感器,其被构造成测量与动力生成系统关联的至少一个参数;以及控制器,其被构造成控制至少与所述动力生成系统关联的处理。
本公开的某些实施方式涉及一种动力生成系统,该动力生成系统包括:至少大约5,000kW或至少大约2,000A/cm2的电源;间隔开的多个电极,其电连接到所述电源;燃料装载区域,其被构造成接收燃料,其中,所述燃料装载区域被所述多个电极包围,使得所述多个电极被构造成将电力供应到所述燃料,以在所述燃料被接收在所述燃料装载区域中时点燃所述燃料,并且其中,所述燃料装载区域中的压力是部分真空;传递机构,其用于将所述燃料移入所述燃料装载区域中;光伏动力转换器,其被构造成将通过点燃所述燃料而产生的等离子体转换成非等离子体形式的动力。一些实施方式可包括以下另外特征中的一个或更多个:所述光伏动力转换器可位于真空单元内;所述光伏动力转换器可包括抗反射涂层、光阻匹配涂层、或保护涂层中的至少一个;所述光伏动力转换器可以可操作地联接到被构造成清洁所述光伏动力转换器的至少一部分的清洁系统;所述动力系统可包括光滤波器;所述光伏动力转换器可包括单晶电池、多晶电池、非晶电池、串/带硅电池、多结电池、同质结电池、异质结电池、p-i-n器件、薄膜电池、染料敏化电池和有机光伏电池中的至少一个;所述光伏动力转换器可包括多结电池,其中,所述多结电池包括倒置电池、直立电池、晶格失配电池、晶格匹配电池、包括III-V族半导体材料的电池中的至少一个。
另外,示例性实施方式涉及一种被构造成生成动力的系统,该系统包括:燃料源,其被构造成供应燃料;功率源,其被构造成供应电力;以及至少一个齿轮,其被构造成接收所述燃料和所述电力,其中,所述至少一个齿轮选择性将所述电力导向所述齿轮周围的局部区域,以点燃所述局部区域内的所述燃料。在一些实施方式中,所述系统还可具有以下特征中的一个或更多个:所述燃料可包括粉末;所述至少一个齿轮可包括两个齿轮;所述至少一个齿轮可包括第一材料和具有比所述第一材料低的导电率的第二材料,所述第一材料电联接到所述局部区域;所述局部区域可与所述至少一个齿轮的齿和间隙中的至少一个相邻。其他实施方式可使用取代齿轮的支承构件,而其他实施方式可使用齿轮和支承构件。一些实施方式涉及一种生成电力的方法,该方法包括:将燃料供应到齿轮;旋转所述齿轮,以将所述燃料中的至少一些定位在所述齿轮的一定区域处;将电流供应到所述齿轮,以点燃定位的燃料,生成能量;以及将通过点燃而生成的能量中的至少一些转换成电力。在一些实施方式中,旋转所述齿轮可包括旋转第一齿轮和第二齿轮,供应电流可包括将电流供应到所述第一齿轮和所述第二齿轮。
其他实施方式涉及一种动力生成系统,该动力生成系统包括:至少大约2,000A/cm2的电源;间隔开的多个电极,其电连接到所述电源;燃料装载区域,其被构造成接收燃料,其中,所述燃料装载区域被所述多个电极包围,并且其中,所述多个电极被构造成将电力供应到所述燃料,以在所述燃料被接收在所述燃料装载区域中时点燃所述燃料,其中,所述燃料装载区域中的压力是部分真空;传递机构,其用于将所述燃料移入所述燃料装载区域中;以及光伏动力转换器,其被构造成将通过点燃所述燃料而产生的等离子体转换成非等离子体形式的动力。
其他实施方式涉及一种动力生成电池,该动力生成电池包括:出口端口,其联接到真空泵;多个电极,其电联接到至少5,000kW的电源;燃料装载区域,其被构造成接收包括多数H2O的基于水的燃料,其中,所述多个电极被构造成将电力传递到基于水的燃料,以生成电弧等离子体和热动力中的至少一个;动力转换器,其被构造成将电弧等离子体和热动力中的至少一个的至少一部分转换成电力。另外公开了一种动力生成系统,该动力生成系统包括:至少5,000A/cm2的电源;多个电极,其电联接到所述电源;燃料装载区域,其被构造成接收包括多数H2O的基于水的燃料,其中,所述多个电极被构造成将电力传递到所述基于水的燃料,以生成电弧等离子体和热动力中的至少一个;动力转换器,其被构造成将电弧等离子体和热动力中的至少一个的至少一部分转换成电力。在实施方式中,动力转换器包括将光动力转换成电的光伏转换器。
另外的实施方式涉及一种生成动力的方法,该方法包括:将燃料装载到燃料装载区域中,其中,所述燃料装载区域包括多个电极;将至少大约2,000A/cm2的电流施加到所述多个电极,以点燃所述燃料,生成电弧等离子体和热动力中的至少一个;执行使电弧等离子体经过光伏转换器以生成电力和使热动力经过热-电转换器以生成电力中的至少一个;输出所生成的电力的至少一部分。另外公开了一种动力生成系统,该动力生成系统包括:至少5,000kW的电源;多个电极,其电联接到所述功率源,其中,所述多个电极被构造成将电力传递到包括多数H2O的基于水的燃料,以生成热动力;热交换器,其被构造成将所述热动力的至少一部分转换成电力;光伏动力转换器,其被构造成将光的至少一部分转换成电力。另外,另一个实施方式涉及一种动力生成系统,该动力生成系统包括:至少5,000kW的电源;间隔开的多个电极,其中,所述多个电极中的至少一个包括压缩机构;燃料装载区域,其被构造成接收包括多数H2O的基于水的燃料,其中,所述燃料装载区域被所述多个电极包围,使得所述至少一个电极的所述压缩机构向着所述燃料装载区域取向,并且其中,所述多个电极电连接到所述电源并且被构造成将电力供应到接收在所述燃料装载区域中的基于水的燃料,以点燃所述燃料;传递机构,其用于将所述基于水的燃料移入所述燃料装载区域中;光伏动力转换器,其被构造成将通过点燃所述燃料而生成的等离子体转换成非等离子体形式的动力。
附图的简要描述
附图被并入本说明书中,构成本说明书的部分,示出本公开的一些实施方式并且与描述一起用于说明本公开的原理。在附图中:
图1是示出按照本公开的实施方式的等离子体动力学转换器的SF-CHIT电池发电器的示意图。
图2A是示出按照本公开的实施方式的光伏转换器的SF-CHIT电池发电器的示意图。
图2B是示出按照本公开的实施方式的光伏转换器的电弧H2O等离子体电池发电器的示意图。
图3是根据示例性实施方式的并网光伏发电系统的示意图。
图4是根据示例性实施方式的混合光伏发电系统的示意图。
图5是根据示例性实施方式的直接耦合光伏发电系统的示意图。
图6A是根据示例性实施方式的DC光伏发电系统的示意图。
图6B是根据示例性实施方式的AC光伏发电系统的示意图。
图7是根据示例性实施方式的AC/DC光伏发电系统的示意图。
图8是根据示例性实施方式的AC光伏发电系统的示意图。
图9是根据示例性实施方式的光伏发电系统的示意图。
图10是根据示例性实施方式的光伏发电系统的示意图。
图11是根据示例性实施方式的光伏发电系统的示意图。
图12是根据示例性实施方式的光伏发电系统的示意图。
图13A是根据示例性实施方式的光伏动力转换器位于与反应部位不同的区域中的光伏发电系统的示意图。
图13B是根据示例性实施方式的光伏动力转换器位于与反应部位相同的区域中的光伏发电系统的示意图。
图14是根据示例性实施方式的系统的示意图。
图15是根据示例性实施方式的齿轮的示意图。
图16是根据示例性实施方式的齿轮的放大视图。
图17是根据示例性实施方式的两个齿轮的放大视图。
图18A和图18B是根据示例性实施方式的齿轮齿部的侧视图和横向视图。
图19A和图19B是根据示例性实施方式的齿轮齿部的侧视图和横向视图。
图20A和图20B是根据示例性实施方式的齿轮齿部的侧视图和横向视图。
图21A和图21B是根据示例性实施方式的齿轮齿部的侧视图和横向视图。
图22A是根据示例性实施方式的齿轮齿部和间隙的放大视图。
图22B是根据示例性实施方式的齿轮齿部和间隙的放大视图。
图22C是根据示例性实施方式的齿轮齿部和间隙的放大视图。
图23A和图23B是根据示例性实施方式的齿轮的剖视图。
图24是根据示例性实施方式的运动系统的示意图。
图25是根据示例性实施方式的支承构件的示意图。
图26是根据示例性实施方式的支承构件的剖视图。
图27是根据示例性实施方式的支承构件的剖视图。
图28是根据示例性实施方式的支承构件的示意图。
图29是根据示例性实施方式的支承构件的示意图。
图30是根据示例性实施方式的支承构件的示意图。
图31A和图31B是根据示例性实施方式的支承构件的下层视图。
图32A至图32D是根据示例性实施方式的处于操作中的接触元件的视图。
图33是根据示例性实施方式的处于操作中的支承构件的视图。
图34是根据示例性实施方式的接触元件的放大剖视图。
图35A至图35D是根据示例性实施方式的处于操作中的接触元件的视图。
图36A至图36C是根据示例性实施方式的处于操作中的接触元件的视图。
图37A至图37C是根据示例性实施方式的处于操作中的接触元件的视图。
图38A至图38C是根据示例性实施方式的处于操作中的接触元件的视图。
图39是根据示例性实施方式的带有光伏电池的接触元件的示意图。
图40是根据示例性实施方式的等离子体源和太阳的可见光谱的归一化叠加,展示了它们二者发出大约5800-6000K的黑体辐射。
本文中公开了用于释放来自原子氢的能量以形成较低能态的催化剂系统,其中,电子壳相对于核处于较靠近的位置。利用释放的功率来发电,另外,新的氢物种和化合物是所期望的产物。这些能态是通过经典物理定律预测的,需要催化剂接受来自氢的能量,以经历对应的能量释放跃迁。
经典物理学给出了氢原子、氢阴离子、氢分子离子、和氢分子的闭式解并且预测具有分数主量子数的对应物种。使用麦克斯韦(Maxwell)方程组,电子的结构演变为边界值问题,其中,在边界n=1状态电子不可辐射能量的限制下,电子包括在跃迁期间时变电磁场的源电流。通过H原子的解而预测的反应涉及从原本稳定的原子氢到能够接受能量的催化剂以形成能态比之前想到可能的低的氢的共振、非辐射能量传递。具体地,经典物理学预测原子氢会经历与特定原子、受激准分子、离子和二价氢阴离子的催化剂反应,从而提供具有原子氢的势能Eh=27.2eV的整数倍的净焓的反应,其中,Eh是1个哈特里(Hartree)。能基于其已知电子能级进行辨别的特定物种(例如,He+、Ar+、Sr+、K、Li、HCl、和NaH、OH、SH、SeH、新生H2O、nH(n=整数))需要伴随氢原子存在,以催化处理。该反应涉及进行非辐射能量传递,之后进行q·13.6eV连续谱发射或将q·13.6eV传递到氢,以形成能量比对应于分数主量子数的未反应原子氢低的异常热的、激发态H和氢原子。也就是说,在氢原子的主能级的公式中:
n=1,2,3,...(2)
其中,αH是氢原子的波尔(Bohr)半径(52.947pm),e是电子的电荷量级,εo是真空介电常数,分数量子数:
其中,p≤137是整数(3)
取代针对氢激发态的里德伯公式(Rydberg equation)中的公知参数n=整数并且代表所谓的“分数氢”的低能态氢原子。然后,类似于具有麦克斯韦方程组的解析解的激发态,分数氢原子还包括电子、质子和光子。然而,后者的电场增加了对应于能量解析附的键合,而不是像激发态一样因能量吸附使中心场减小,所得的分数氢的光子-电子间反应是稳定的,而非辐射性的。
氢的n=1状态和氢的状态是非辐射性的,但借助非辐射能量传递,可以进行两个非辐射状态之间的跃迁(比如说,n=1至n=1/2)。氢是通过等式(1)和(3)给出的稳态的特定情况,其中,通过下式给出氢或分数氢原子的对应半径:
其中,p=1,2,3,...。为了能量守恒,能量必须以以下为单位从氢原子传递到催化剂
m·27.2eV,m=1,2,3,4,....(5)
并且半径跃迁至催化剂反应涉及两步能量释放:非辐射能量传递到催化剂,之后随着半径减小,进行另外的释放能量,直至对应的稳定最终状态。据信,随着反应净焓更接近地匹配m·27.2eV,催化作用的速率增加。已经发现,反应净焓在m·27.2eV的±10%(优选地,±5%)内的催化剂适于大多数应用。在分数氢原子被催化成较低能态的情况下,按与分数氢原子的势能相同的因子用相对论校正m·27.2eV(等式(5))的反应净焓。
因此,通过下式给出总体反应:
Cat(q+r)++re-→Catq++m·27.2eV (8)
整体反应是:
q、r、m和p是整数。具有氢原子的半径(对应于分母中的1)和等同于质子的(m+p)倍的中心场,是半径是H的的对应稳态。随着电子经历从氢原子的半径到是此距离的的半径的径向加速,能量作为特征光发射或第三体动能被释放。发射可以是具有处于[(p+m)2-p2-2m]·13.6eV或的边缘并且扩展至较长波长的极紫外连续谱辐射的形式。除了辐射之外,还可出现形成快速H的共振动能传递。后续通过与背景H2碰撞来激发这些快速H(n=1)原子,之后发射对应的H(n=3)快速原子,造成巴尔默α发射(Balmerαemission)被加宽。另选地,快速H是用作催化剂的H或分数氢的直接产物,其中,共振能量传递的接受涉及势能而非电离能。能量守恒在前一种情况下给出动能对应于一半势能的质子并且在后一种情况下给出基本上停留的催化剂离子。快速质子的H复合辐射造成巴尔默α发射被加宽,该巴尔默α发射与和过量功率平衡一致的热氢的清单不成比例。
在本公开中,诸如分数氢反应、H催化作用、H催化反应、当适用于氢时的催化剂,形成分数氢的氢反应、和分数氢形成反应的术语都指的是诸如通过等式(5)定义的催化剂的等式(6)至(9)与原子H反应以形成具有通过等式(1)和(3)给出的能级的氢的状态的反应。当适用于执行具有通过等式(1)和(3)给出的能级的H至H状态或分数氢状态的催化作用的反应混合物时,诸如分数氢反应物、分数氢反应混合物、催化剂混合物、形成分数氢的反应物、产生或形成低能态氢或分数氢的反应物的对应术语也可互换地使用。
本公开的催化低能氢跃迁需要从原子H接收能量以造成跃迁的催化剂,该催化剂可以是未被催化的原子氢的势能(27.2eV)的整数m的吸热化学反应的形式。吸热催化剂反应可以是源自诸如原子或离子的物种中的一个或更多个电子的电离(例如,对于Li→Li2+,m=3)并且还可包括键断裂与源自初期键的配对物中的一个或更多个的一个或更多个电子的电离的协同反应(例如,对于NaH→Na2++H,m=2)。He+履行催化剂标准—伴随等于27.2eV的整数倍的焓改变的化学或物理处理,因为它在54.417eV(即,2·27.2eV)下电离。整数的氢原子也可用作焓是27.2eV的整数倍的催化剂。氢原子H(1/p)p=1,2,3,...137可经历进一步跃迁至通过等式(1)和(3)给出的较低能状态,其中,1个原子的跃迁是通过一个或更多个另外的H原子来催化的,这些另外的原子共振地非辐射性地接受m·27.2eV,伴随其势能相反地改变。用下式表达通过m·27.2eV共振传递至H(1/p')而引起的H(1/p)跃迁至H(1/(m+p))的整体总公式:
H(1/p')+H(1/p)→H+H(1/(m+p))+[2pm+m2-p'2+1]·13.6eV (10)
氢原子可用作催化剂,其中,m=1、m=2和m=3针对分别充当另一个原子的催化剂的1个,2个或3个原子。当异常的快速H与分子碰撞形成2H时,两原子催化剂2H的比率可以高,其中,两个原子共振地非辐射性地接受来自碰撞配对物的第三个氢原子的54.4eV。通过相同的机制,两个热H2的碰撞提供3H,用作第四个氢原子的3·27.2eV的催化剂。EUV在22.8nm和10.1mn连续,观察到异常(>100eV)的巴尔默α线加宽、高度激发的H状态、产物气体H2(1/4)、和大能量释放,与预测是一致的。
H(1/4)是基于其多极性和其形成选择规则的优选分数氢状态。因此,在形成H(1/3)的情况下,可根据等式(10)通过H快速催化地出现至H(1/4)的跃迁。类似地,H(1/4)是对应于等式(5)中的m=3的大于或等于81.6eV的催化剂能量的优选状态。在这种情况下,能量传递至催化剂包括形成等式(7)的H*(1/4)中间物的81.6eV以及中间物衰减而得的27.2eV的整数倍。例如,具有108.8eV的焓的催化剂可通过从122.4eV的H*(1/4)衰减能量接受81.6eV以及27.2eV来形成H*(1/4)。剩余95.2eV的衰减能量释放到环境中,形成优选状态H(1/4),其随后发生反应形成H2(1/4)。
合适的催化剂因此可提供m·27.2eV的反应净正焓。也就是说,催化剂共振地从氢原子接受非辐射能量传递并且将能量释放到周遭,以实现电子跃迁至分数量子能级。非辐射能量传递带来的结果是,氢原子变得不稳定,进一步发射能量,直到它实现具有通过等式(1)和(3)给出的主能级的较低非辐射能态。因此,催化剂释放来自氢原子的能量,伴随着氢原子大小的减小(rn=naH,其中,n是通过等式(3)给出的)。例如,H(n=1)至H(n=1/4)的催化剂释放204eV,并且氢半径从aH减小至
催化剂产物H(1/p)还可与电子反应,形成分数氢氢阴离子H-(1/p),或者两个H(1/p)可发生反应,形成对应的分子分数氢H2(1/p)。具体地,催化剂产物H(1/p)还可与电子反应,形成具有键能EB的新型氢阴离子H-(1/p):
其中,p=整数>1,s=1/2,是普朗克(Planck)常数拔(bar),μo是真空的磁导率,me是电子的质量,μe是通过给出的约化电子质量,其中,mp是质子的质量,ao是波尔半径,离子半径是根据等式(11),计算出的氢阴离子的电离能是0.75418eV,实验值是6082.99±0.15cm-1(0.75418eV)。可通过X射线光电子能谱(XPS)测量分数氢氢阴离子的键能。
往高磁场位移的NMR峰是存在具有相对于普通氢阴离子而言减小的半径并且具有质子的抗磁屏蔽增加的低能态氢的直接证据。通过两个电子的抗磁和幅度p的光子场的作用叠加,给出位移(Mills GUTCP等式(7.87)):
其中,第一项应用于H-,其中,对于H-(1/p),p=1且p=整数>1并且α是精细结构常数。预测的分数氢氢阴离子的峰相对于普通氢阴离子异常地往高磁场位移。在实施方式中,峰是TMS的高磁场。相对于TMS的NMR位移可大于已知的普通H-,H,H2,或H+(单独的或包括化合物)中的至少一个的NMR位移。该位移可大于0、-1、-2、-3、-4、-5、-6、-7、-8、-9、-10、-11、-12、-13、-14、-15、-16、-17、-18、-19、-20、-21、-22、-23、-24、-25、-26、-27、-28、-29、-30、-31、-32、-33、-34、-35、-36、-37、-38、-39和-40ppm中的至少一个。相对于裸露质子绝对位移的范围(其中,TMS的位移相对于裸露质子是大约-31.5ppm)可以是大约±5ppm、±10ppm、±20ppm、±30ppm、±40ppm、±50ppm、±60ppm、±70ppm、±80ppm、±90ppm和±100ppm中的至少一个的范围内的-(p29.9+p22.74)ppm(等式(12))。相对于裸露质子的绝对位移的范围可以是大约0.1%至99%、1%至50%和1%至10%中的大约至少一个的范围内的-(p29.9+p21.59×10-3)ppm(等式(12))。在另一个实施方式中,因固体基质(诸如,诸如NaOH或KOH的氢氧化物的基质)中存在分数氢物种(诸如,分数氢原子,氢阴离子,或分子),造成基质质子往高磁场位移。基质质子(诸如,NaOH或KOH的质子)可进行交换。在实施方式中,位移会造成基质峰到达相对于TMS的大约-0.1ppm至-5ppm的范围内。NMR确定可包括魔角旋转1H核磁共振光谱(MAS1H NMR)。
H(1/p)可与质子反应并且两个H(1/p)可发生反应,分别形成H2(1/p)+和H2(1/p)。在非辐射的限制下,用椭圆坐标中的Laplacian算子来求解氢分子离子和分子电荷和电流密度函数、键距离和能量。
在长球体分子轨道的各焦点处具有+pe的中心场的氢分子离子的总能量ET是:
其中,p是整数,c是真空中的光速,μ是约化的原子核质量。在长球体分子轨道的各焦点处具有+pe的中心场的氢分子的总能量是:
氢分子H2(1/p)的键解离能ED是对应氢原子的总能量与ET之差
ED=E(2H(1/p))-ET (16)
其中,
E(2H(1/p))=-p227.20eV (17)
通过等式(16)至(17)和(15)给出ED:
ED=-p227.20eV-ET
=-p227.20eV-(-p231.351eV-p30.326469eV) (18)
=p24.151eV+p30.326469eV
可通过X射线光电子光谱(XPS)来识别H2(1/p),其中,除了电离的电子之外的电离产物可以是诸如包括两个质子和电子(氢(H)原子、分数氢原子、分子离子、氢分子离子和H2(1/p)+)的可能物中的至少一种,其中,能量可因基质而位移。
催化产物气体的NMR提供了H2(1/p)的理论上预测的化学位移的决定性测试。通常,经预测,由于椭圆坐标中的分数半径,导致H2(1/p)的1H NM共共振是从H2的1H NMR共振向着高磁场,其中,电子明显更靠近原子核。通过这两个电子的反磁性和幅度p的光子场的作用叠加,给出H2(1/p)的预测位移(Mills GUTCP等式(11.415-11.416)):
其中,第一项应用于H2,其中,对于H2(1/p),p=1且p=整数>1。实验绝对H2气相共振位移-28.0ppm与预测的绝对气相位移-28.01ppm相吻合(等式(20))。预测的分子分数氢的峰相对于普通H2异常地往高磁场位移。在实施方式中,峰是TMS的高磁场。相对于TMS的NMR位移可大于已知的普通H-,H,H2,或H+(单独的或包括化合物)中的至少一个的NMR位移。该位移可大于0、-1、-2、-3、-4、-5、-6、-7、-8、-9、-10、-11、-12、-13、-14、-15、-16、-17、-18、-19、-20、-21、-22、-23、-24、-25、-26、-27、-28、-29、-30、-31、-32、-33、-34、-35、-36、-37、-38、-39和-40ppm中的至少一个。相对于裸露质子的绝对位移的范围(其中,TMS的位移相对于裸露质子是大约-31.5ppm)可以是大约±5ppm、±10ppm、±20ppm、±30ppm、±40ppm、±50ppm、±60ppm、±70ppm、±80ppm、±90ppm和±100ppm中的至少一个的范围内的-(p28.01+p22.56)ppm(等式(20))。相对于裸露质子的绝对位移的范围可以是大约0.1%至99%、1%至50%和1%至10%中的大约至少一个的范围内的-(p28.01+p21.49×10-3)ppm(等式(20))。
供氢型分子H2(1/p)从υ=0跃迁至υ=1的振动能量Evib是
Evib=p20.515902eV (21)
其中,p是整数。
供氢型分子H2(1/p)从J跃迁至J+1的旋转能量Erot是
其中,p是整数并且I是惯性力矩。捕获在固体基质中的气体中的电子束激发分子中观察到H2(1/4)的振转发射。
由原子核间距离的反向p相关性和对惯性力矩I的对应影响,得到旋转能量的p2相关性。H2(1/p)的预测原子核间距离2c'是
可通过电子束激发发射光谱仪、Raman光谱仪、傅里叶变换红外(FTIR)光谱仪中的至少一种来测量H2(1/p)的旋转和振动能量中的至少一个。H2(1/p)可被捕获在基质中(诸如,MOH,MX和M2CO3(M=碱;X=卤化物)中的至少一种中),以便进行测量。
I.催化剂
经预测,He+、Ar+、Sr+、Li、K、NaH、nH(n=整数)、H2O用作催化剂,因为它们满足催化剂标准—焓改变等于原子氢势能27.2eV的整数倍的化学或物理处理。具体地,通过原子中的t个电子均电离成连续谱能级来提供催化系统,使得t个电子的电离能之和是大致m·27.2eV,其中,m是整数。此外,诸如在其中首先形成H(1/2)的情况下,可出现其他催化跃迁:等。一旦催化开始,分数氢就在被称为歧化的处理中进一步自催化,其中,H或H(1/p)用作另一个H或H(1/p’)的催化剂(p可等于p’)。
氢和分数氢可用作催化剂。氢原子H(1/p)p=1,2,3,...137可经历跃迁至通过等式(1)和(3)给出的较低能态,其中,一个原子的跃迁通过共振地非辐射性地接受m·27.2eV并伴随着其势能反向变化的第二个原子来催化。用等式(10)表达因m·27.2eV共振传递至H(1/p')而引起的H(1/p)到H(1/(m+p))的跃迁的整体总等式。因此,氢原子可用作催化剂,其中,m=1,m=2和m=3是针对分别充当另一个原子的催化剂的1个,2个或3个原子的。只有当H密度高时,两原子或三原子催化剂例的比率才将是可预见的。但是,高H密度并不常见。用作第三个或第四个原子的能量受体的2H或3H所容许的高氢原子浓度可以在许多情形下(诸如,由于温度和重力驱动密度而导致在太阳和星星的表面上,支承多个单层的金属表面上,高度解离的等离子体尤其是析出氢等离子体中)实现。另外,当因热H与H2碰撞而得到2个H原子时,容易实现三体H互动。这个事件常常可以是出现在具有大量异常快速H的等离子体中。原子H发射的不常见密度证明了这点。在这些情况下,可出现借助多极联接从氢原子到足够接近度内的两个其他原子的能量传递,该接近度通常是几纳米。然后,通过下式给出借此两个原子共振地非辐射性地从第三个氢原子接受54.4eV使得2H用作催化剂的三个氢原子之间的反应:
并且,整体反应是
其中,具有氢原子的半径和等同于质子的中心场的3倍的中心场,是半径是H的1/3的对应稳态。因为电子经历从氢原子的半径到是此距离的1/3半径的径向加速,所以能量作为特征光发射或第三体动能被释放。
在涉及直接跃迁至状态的另一个H原子催化剂反应中,2个H2热分子发生碰撞并且解离,使得3个H原子用作第四个H原子的3·27.2eV的催化剂。然后,通过下式给出借此3个原子共振地非辐射性地从第四个氢原子接受81.6eV使得3H用作催化剂的4个氢原子之间的反应:
并且,整体反应是
经预测,由于等式(28)的介值而导致的极紫外连续谱辐射带具有122.4eV(10.1nm)的短截止波长并且扩展至更长波长。通过实验确认这个连续谱带。通常,由于接受m·27.2eV而导致的H至的跃迁给出具有短截止波长和通过下式给出的能量并且延伸到比对应截止长的波长的连续谱带:
在星系介质、太阳和白矮星中,通常实验观察到10.1nm、22.8nm和91.2nm连续谱的氢发射系列。
H2O的势能是81.6eV(等式(43))[Mills GUT]。然后,通过同一机制,新生H2O分子(非固态、液态、或气态下键合的氢)可用作催化剂(等式(44)至(47))。观察到,处于10.1nm并且转到实现理论上预测的H跃迁至低能(所谓的“分数氢”状态)的较长波长的连续谱辐射仅仅是由首先在BlackLight Power,Inc.(BLP)并且在Harvard Center for Astrophysics(CfA)再现的脉动夹入氢释放引起的。观察到,匹配H至分数氢状态的预测跃迁的10至30m区域内的连续辐射仅仅是由用金属氧化物进行的脉动夹入氢释放引起的,金属氧化物对于经历H还原以形成HOH催化剂是热力学上有利的;然而,不利的那些并没有表现出任何连续谱,即便接受测试的低熔点金属非常有利于在更强有力的等离子体源中形成具有强短波连续谱的金属离子等离子体。
另选地,形成快速H的共振动能传递可与观察到对应于高动能H加宽的异常巴尔默α线加宽并存地出现。能量传递至2个H还造成催化剂激发态的抽运,如通过示例性的等式(24)、(28)和(47)并且通过共振动能传递给出地,直接生成快速H。
II.分数氢
通过下式给出具有键能的氢原子
其中,p是大于1的整数,优选地从2至137,是本公开的H催化反应的产物。也被称为电离能的原子、离子或分子的键能是从原子、离子或分子中去除一个电子所需的能量。具有等式(34)中给出的键能的氢原子在下文中被称为“分数氢原子”或“分数氢”。半径的分数氢的命名是其中,aH是普通氢原子的半径并且p是整数。具有半径aH的氢原子在下文中被称为“普通氢原子”或“正常氢原子”。普通氢原子通过13.6eV的其键能来表征。
通过普通氢原子与具有以下的反应净焓的适宜催化剂来形成分数氢
m·27.2eV(35)
其中,m是整数。据信,随着反应的净焓更接近地匹配m·27.2eV,催化作用的速率增加。已经发现,具有m·27.2eV的±10%,优选地±5%内的反应净焓的催化剂适于大多数应用。
此催化作用使得从氢原子释放能量,伴随着氢原子的大小减小rn=naH。例如,H(n=1)至H(n=1/2)的催化作用释放40.8eV,并且氢半径从aH减小至催化系统是通过原子中的t个电子均电离成连续谱能级使得这t个电子的电离能之和大致是m·27.2eV来提供的,其中,m是整数。作为电源,催化作用期间放出的能量比催化剂所丢失的能量大得多。相比于传统的化学反应,所释放的能量大。例如,当氢气和氧气经历燃烧形成水
时,已知的形成水的焓是各氢原子ΔHf=-286kJ/mole或1.48eV。相比之下,经历催化作用的各(n=1)普通氢原子释放40.8eV的净焓。此外,可出现其他催化跃迁:等。一旦催化开始,分数氢就在被称为歧化的处理中进一步自催化。此机制类似于无机离子催化作用的机制。但是,由于焓更好地匹配m·27.2eV,导致分数氢催化作用应该具有比无机离子催化剂的反应速率高的反应速率。
III.分数氢催化剂和分数氢产物
在表1中给出能够提供大致m·27.2eV的反应净焓以生成分数氢(由此原子或离子电离成t个电子)的氢催化剂,其中,m是整数。第一列中给出的原子或离子被电离,提供在第十列中给出的m·27.2eV的反应净焓,其中,在第十一列中给出m。参与电离的电子被提供电离势能(也被称为电离能或键能)。原子或离子的第n个电子的电离势能被命名为IPn并且通过CRC给出。也就是说,例如,Li+5.39172eV→Li++e-并且Li++75.6402eV→Li2++e-。分别在第二列和第三列中给出第一电离势能IP1=5.39172eV和第二电离势能IP2=75.6402eV。Li的双电离的反应净焓是81.0319eV,如第十列中给出的,并且等式(5)中的m=3,如第十一列中给出的。
表1.氢催化剂。
本公开的分数氢氢阴离子可通过电子源与分数氢(也就是说,具有大约的键能的氢原子)的反应来形成,其中,并且p是大于1的整数。用H-(n=1/p)或H-(1/p)来代表分数氢氢阴离子。
分数氢氢阴离子与包括普通氢原子核和具有大约0.8eV键能的两个电子的普通氢阴离子区分开。后者在下文中被称为“普通氢阴离子”或“正常氢阴离子”。分数氢氢阴离子包括含氕、氘或氚的氢原子核和处于根据等式(39)和(40)的键能的两个可区分电子。
可用下面的公式来表达分数氢氢阴离子的键能:
其中,p是大于1的整数,s=1/2,π是圆周率,是普朗克常数bar,μo是真空的磁导率,me是电子的质量,μe是通过给出的约化的电子质量,其中,mp是质子的质量,aH是氢原子的半径,ao是波尔半径,e是元电荷。通过下式给出半径:
在表2中示出随p的变化而变化的分数氢氢阴离子H-(n=1/p)的键能,其中,p是整数。
表2.随p的变化而变化的分数氢氢阴离子H-(n=1/p)的代表性键能,等式(39)。
a等式(40)
b等式(39)
根据本公开,提供了具有根据等式(39)和(40)的键能的分数氢氢阴离子(H-),对于p=2直至23,该键能大于普通氢阴离子的键能(大约0.75eV),而对于p=24(H-),该键能更小。对于等式(39)和(40)的p=2至p=24,氢阴离子键能分别是3、6.6、11.2、16.7、22.8、29.3、36.1、42.8、49.4、55.5、61.0、65.6、69.2、71.6、72.4、71.6、68.8、64.0、56.8、47.1、34.7、19.3和0.69eV。本文中还提供了包括新型氢阴离子的示例性组分。
还提供了包括一个或更多个分数氢氢阴离子和一个或更多个其他元素的示例性化合物。此化合物被称为“分数氢氢阴离子化合物”。
普通氢物种通过以下的键能来表征:(a)氢阴离子,0.754eV(“普通氢阴离子”);(b)氢原子(“普通氢原子”),13.6eV;(c)双原子氢分子,15.3eV(“普通氢分子”);(d)氢分子离子,16.3eV(“普通氢分子离子”);和(e)22.6eV(“普通三氢分子离子”)。本文中,参照氢的形式,“正常”和“普通”是同义词。
根据本公开的其他实施方式,提供了一种化合物,该化合物包括至少一种键能增加的氢物种诸如(a)氢原子,其具有大约(诸如,在大约的0.9至1.1倍的范围内)的键能,其中,p是从2至137的整数;(b)氢阴离子(H-),其具有大约(诸如,在该键能的大约0.9至1.1倍的范围内)的键能,其中,p是从2至24的整数;(c)(d)三分数氢分子离子其具有大约(诸如,在的大约0.9至1.1倍的范围内)的键能,其中,p是从2至137的整数;(e)二分数氢,其具有大约(诸如,在的大约0.9至1.1倍的范围内)的键能,其中,p是从2至137的整数;(f)二分数氢分子离子,其具有大约(诸如,在的大约0.9至1.1倍的范围内)的键能,其中,p是整数,优选地,是从2至137的整数。
根据本公开的其他实施方式,提供了一种化合物,该化合物包括至少一种键能增加的氢物种,诸如(a)双分数氢分子离子,其具有大约
(诸如,在总能量ET的大约0.9至1.1倍的范围内)的总能量,其中,p是整数,是普朗克常数bar,me是电子的质量,c是真空中的光速,μ是约化的原子核质量,和(b)二分数氢分子,其具有大约
(诸如,在ET的大约0.9至1.1倍的范围内)的总能量,其中,p是整数,ao是波尔半径。
根据本公开的一个实施方式,其中,化合物包括带负电的键能增加的氢物种,化合物还包括一个或更多个阳离子(诸如,光子、普通或普通)。
本文中提供了制备包括至少一个分数氢氢阴离子的化合物的方法。这种化合物在下文中被称为“分数氢氢阴离子化合物”。该方法包括原子氢与具有大约的反应净焓的催化剂反应(其中,m是大于1的整数,优选地小于400的整数),以生成具有大约的键能的键能增加的氢原子,其中,p是整数,优选地从2至137的整数。催化作用的其他产物是能量。键能增加的氢原子可与电子源反应,以生成键能增加的氢阴离子。键能增加的氢阴离子可与一个或更多个阳离子反应,以生成包括至少一个键能增加的氢阴离子的化合物。
该新型氢组成物种可包括:
(a)至少一个中性、正、或负的氢物种(下文中“键能增加的氢物种”),其具有以下键能
(i)大于对应普通氢物种的键能,或者
(ii)大于使得对应普通氢物种不稳定或者观察不到(因为普通氢物种的键能小于环境条件(标准温度和压力,STP)下的热能,或者是负的)的任何氢物种的键能;以及
(b)至少一种其他元素。本公开的化合物在下文中被称为“键能增加的氢化合物”。
此上下文中的“其他元素”意指除了键能增加的氢物种外的元素。因此,其他元素可以是普通氢物种,或者除了氢外的任何元素。在一组化合物中,其他元素和键能增加的氢物种是中性的。在另一组化合物中,其他元素和键能增加的氢物种带电,使得其他元素提供平衡电荷,以形成中性化合物。前一组化合物通过分子和配位键来表征;后一组通过离子键来表征。
另外,提供了包括以下的新型化合物和分子离子:
(a)至少一个中性、正、或负的氢物种(下文中“键能增加的氢物种”),其具有以下总能量
(i)大于对应普通氢物种的总能量,或者
(ii)大于使得对应普通氢物种不稳定或者观察不到(因为普通氢物种的总能量小于环境条件下的热能,或者是负的)的任何氢物种的总能量;以及
(b)至少一种其他元素。
氢物种的总能量是用于从氢物种去除所有电子的能量之和。根据本公开的氢物种具有比对应普通氢物种的总能量大的总能量。根据本公开的总能量增加的氢物种也被称为“键能增加的氢物种”,即便总能量增加的氢物种的一些实施方式可具有比对应普通氢物种的第一电子键能小的第一电子键能。例如,对于p=24,等式(39)和(40)的氢阴离子具有比普通氢阴离子的第一键能小的第一键能,而对于p=24,等式(39)和(40)的氢阴离子的总能量比对应普通氢阴离子的总能量大得多。
另外,本文中提供了包括以下的新型化合物和分子离子:
(a)多个中性、正、或负的氢物种(下文中“键能增加的氢物种”),其具有以下键能
(i)大于对应普通氢物种的键能,或者
(ii)大于使得对应普通氢物种不稳定或者观察不到(因为普通氢物种的键能小于环境状况中的热能或者是负的)的任何氢物种的键能;以及
(b)可选地,一种其他元素。本公开的化合物在下文中被称为“键能增加的氢化合物”。
可通过将一个或更多个分数氢原子与电子、分数氢原子、包含所述键能增加的氢物种中的至少一个和除了键能增加的氢物种外的至少一个其他原子、分子、或离子的化合物中的一个或更多个反应,形成键能增加的氢物种。
另外,提供了包括以下的新型化合物和分子离子:
(a)多个中性、正、或负的氢物种(下文中“键能增加的氢物种”),其具有以下总能量
(i)大于普通分子氢的总能量,或者
(ii)大于使得对应普通氢物种不稳定或者观察不到(因为普通氢物种的总能量小于环境状况下的热能,或者是负的)的任何氢物种的总能量;以及
(b)可选地,一种其他元素。本公开的化合物在下文中被称为“键能增加的氢化合物”。
在实施方式中,提供了一种化合物,该化合物包括选自以下的至少一种键能增加的氢物种:(a)氢阴离子,其具有根据等式(39)和(40)的键能,对于p=2直至23,该键能大于普通氢阴离子的键能(大约0.8eV),而对于p=24,该键能更小(“键能增加的氢阴离子”或“分数氢氢阴离子”);(b)氢原子,其具有比普通氢原子的键能(大约13.6eV)大的键能(“键能增加的氢原子”或“分数氢”);(c)氢分子,其具有大于大约15.3eV的第一键能(“键能增加的氢分子”或“二分数氢”);(d)分子氢离子,其具有大于大约16.3eV的键能(“键能增加的分子氢离子”或“二分数氢分子离子”)。在本公开中,键能增加的氢物种和化合物也被称为较低能量的氢物种和化合物。分数氢包括键能增加的氢物种或(等同地)较低能量的氢物种。
IV.另外的MH型催化剂和反应
通常,在表3A中给出用于生成分数氢的MH型氢催化剂,MH型氢催化剂通过断开M-H键加上将原子M中的t个电子均电离至连续能级使得t个电子的键能和电离能之和是大致m·27.2eV而提供,其中,m是整数。在第一列中给出各MH催化剂,在第二列中给出对应的M-H键能量。第一列中给定的MH物种的原子M被电离以提供m·27.2eV的反应净焓,外加第二列中的键能。在第八列中给出催化剂的焓,其中,在第九列中给出m。用电离势能(也被称为电离能或键能)给出参与电离的电子。例如,在第二列中给出NaH的键能1.9245eV。原子或离子的第n个电子的电离势能被命名为IPn并且通过CRC给出。也就是说,例如,Na+5.13908eV→Na++e-并且Na++47.2864eV→Na2++e-。分别在第二列和第三列中给出第一电离势能IP1=5.13908eV和第二电离势能IP2=47.2864eV。NaH键的断开和Na的双电离的反应的净焓是54.35eV,如第八列中给出的,并且等式(35)中的m=2,如在第九列中给出的。BaH的键能是1.98991eV并且IP1、IP2、IP3分别是5.2117eV、10.00390eV、和37.3eV。BaH键的断开和Ba的三重电离的反应的净焓是54.35eV,如第八列中给出的,并且等式(35)中的m=2,如在第九列中给出的。SrH的键能是1.70eV并且IP1、IP2、IP3、IP4和IP5分别是5.69484eV、11.03013eV、42.89eV、57eV和71.6eV。SrH键的断开和Sr至Sr5+的电离的反应的净焓是190eV,如第八列中给出的,并且等式(35)中的m=7,如在第九列中给出的。
表3A。能够提供大致m·27.2eV的反应净焓的MH型氢催化剂。能量的单位是eV。
在其他实施方式中,在表3B中给出用于生成分数氢的MH-型氢催化剂,MH-型氢催化剂通过将电子传递到受体A,断开M-H键加上将原子M中的t个电子均电离至连续能级,使得包括MH和A的电子亲和性(EA)差异的电子传递能量、M-H键能和M中的t个电子的电离能之和是大致m·27.2eV而提供,其中,m是整数。各MH-催化剂、受体A、MH的电子亲和性、A的电子亲和性和M-H键能分别在第一列、第二列、第三列和第四列中给出。用后续列中的电离势能(也被称为电离能或键能)给出参与电离的MH中的对应原子M的电子并且在最后一列中给出催化剂的焓和对应的整数m。例如,OH和H的电子亲和性分别是1.82765eV和0.7542eV,使得电子传递能量是1.07345eV,如第五列中给出的。OH的键能是4.4556eV,如第六列中给出的。原子或离子的第n个电子的电离势能用IPn来命名。这是例如O+13.61806eV→O++e-并且O++35.11730eV→O2++e-。分别在第七列和第八列中给出第一电离势能IP1=13.61806eV和第二电离势能IP2=35.11730eV。电子传递反应、OH键的断开和O的双重电离的净焓是54.27eV,如第十一列中给出的,并且等式(35)中的m=2,如第十二列中给出的。在其他实施方式中,通过负离子的电离使得其EA加上一个或更多个电子的电离能之和是大致m·27.2eV来提供用于形成分数氢的H的催化剂,其中,m是整数。另选地,负离子的第一电子可被传递到受体,之后再有至少一个更多电子被电离,使得电子传递能量加上一个或更多个电子的电离能之和是大致m·27.2eV,其中,m是整数。电子受体可以是H。
表3B。能够提供大致m·27.2eV的反应净焓的MH-型氢催化剂。能量的单位是eV。
在其他实施方式中,通过可带负电的供体A的电子传递、M-H键的断开、原子M中的t个电子均电离成连续谱能级使得包括MH和A的电离能差异的电子传递能量、M-H键能和M中的t个电子的电离能之和是大致m·27.2eV,而提供用于生成分数氢的MH+型氢催化剂,其中,m是整数。
在实施方式中,催化剂包括能够接受m·27.2eV的能量的处于基态或激发态的诸如原子、带正电或负电的离子、带正电或负电的分子离子、分子、激发态原子、化合物、或其任何组合的任何物种,m=1,2,3,4,....(等式(5))。据信,随着反应的净焓更接近地匹配m·27.2eV,催化作用的速率增加。已经发现,反应的净焓在m·27.2eV的±10%(优选地,±5%)内的催化剂适于大多数应用。在分数氢原子被催化成较低能态的情况下,按与分数氢原子的势能相同的因子用相对论校正m·27.2eV(等式(5))的反应的净焓。在实施方式中,催化剂共振地非辐射性地从原子氢接受能量。在实施方式中,接受的能量使催化剂的势能大小减小达大约从原子氢传递的量。由于初始束缚电子的动能守恒,可导致高能的离子或电子。至少一个原子H用作至少一个另一个原子的催化剂,其中,受体的27.2eV势能被传递或来自正被催化的供体H原子的27.2eV来抵消。受体催化剂H的动能可被保存作为快速质子或电子。另外,在催化的H中形成的中间状态(等式(7))随着第三体中的辐射或感生动能的形式进行连续谱能量发射而衰减。这些能量释放会导致电流流入本公开的CIHT电池中。
在实施方式中,分子或带正电或带负电的分子离子中的至少一个用作随着分子或带正电或带负电的分子离子的势能大小减小大约m27.2eV从原子H接受m27.2eV的催化剂。例如,在Mills GUTCP中给出的H2O的势能是
随着分子的势能大小减小所述能量从原子H接受m·27.2eV的分子可用作催化剂。例如,关于H2O的势能的催化反应(m=3)是
并且,整体反应是
其中,具有氢原子的半径和等同于质子的中心场的4倍的中心场,是半径是H的1/4的对应稳态。因为电子经历从氢原子的半径到是此距离的1/4半径的径向加速,所以能量作为特征光发射或第三体动能被释放。基于从0℃的冰转为100℃的水的蒸发热的10%的能量改变,沸水中的各水分子的H键的平均数量是3.6。因此,在实施方式中,H2O必须以化学方式形成为具有适宜激活能量的隔离分子,以用作形成分数氢的催化剂。在实施方式中,H2O催化剂是新生H2O。
在实施方式中,nH、O、nO、O2、OH和H2O(n=整数)中的至少一个可用作催化剂。作为催化剂的H和OH的产物可以是H(1/5),其中,催化剂焓是大约108.8eV。作为催化剂的H和H2O的反应产物可以是H(1/4)。分数氢产物也可发生反应,成为较低态。H(1/4)和作为催化剂的H的产物可以是H(1/5),其中,催化剂焓是大约27.2eV。H(1/4)和作为催化剂的OH的产物可以是H(1/6),其中,催化剂焓是大约54.4eV。H(1/5)和作为催化剂的H的产物可以是H(1/6),其中,催化剂焓是大约27.2eV。
另外,OH可用作催化剂,因为OH的势能是
H状态p=1和p=2之间的能量差异是40.8eV。因此,OH可从H接受大约40.8eV,用作用于形成H(1/2)的催化剂。
类似于H2O,Mills GUTCP中给出的酰胺官能团NH2的势能是-78.77719eV。根据CRC,用对应的各ΔHf计算出的用于NH2反应形成KNH2的ΔH是(-128.9-184.9)kJ/mole=-313.8kJ/mole(3.25eV)。根据CRC,用对应的各ΔHf计算出的用于NH2反应形成NaNH2的ΔH是(-128.9-184.9)kJ/mole=-308.7kJ/mole(3.20eV)。根据CRC,用对应的各ΔHf计算出的用于NH2反应形成LiNH2的ΔH是(-179.5-184.9)kJ/mole=-364.4kJ/mole(3.78eV)。因此,可被用作H催化剂以形成分数氢的碱酰胺MNH2(M=K、Na、Li)接受的净焓是分别对应于酰胺基团的势能和用酰胺基团形成酰胺的能量之和的大约82.03eV、81.98eV和82.56eV(等式(5)中的m=3)。诸如分子分数氢的分数氢产物可造成通过诸如MAS NMR的手段观察到的高磁场矩阵位移。
类似于H2O,Mills GUTCP中给出的H2S官能团的势能是-72.81eV。抵消此势能还消除了与3p壳的杂交关联的能量。通过氢阴离子轨道半径和初始原子轨道半径的比率与壳的总能量相乘来给出这个7.49eV的杂交能量。另外,由于形成1.10eV的2个S-H键而导致的S3p壳的能量改变被归入催化剂能量中。因此,H2S催化剂的净焓是81.40eV(等式(5)中的m=3)。H2S催化剂可由MHS(M=碱)通过以下反应来形成:
2MHS→M2S+H2S(49)
此可逆反应可形成在跃迁状态下的活性催化状态下的H2S,以产生可将H催化成分数氢的H2S。反应混合物可包括形成H2S和原子H的源的反应物。诸如分子分数氢的分数氢产物可造成通过诸如MAS NMR的手段观察到的高磁场矩阵位移。
此外,原子氧是在与原子氢的波尔半径相等的相同半径具有两个未配对电子的特殊原子。当原子H用作催化剂时,接受27.2eV的能量,使得用作另一个原子的催化剂的各电离H的动能是13.6eV。类似地,O的两个电子中的每个可因传递到O离子的13.6eV的动能被电离,使得断开OH的O-H键和后续两个外部未配对电子的电离的净焓是80.4eV,如表3中给出的。在OH-电离成OH期间,可出现进一步反应形成H(1/4)和O2++2e-的能量匹配,其中,所释放的204eV的能量促成了CIHT电池的电力。如下地给出反应:
并且,整体反应是:
其中,等式(5)中m=3。动能还可被保存在热电子中。观察到水蒸气等离子体中的H粒子数反转是这种机制的证明。诸如分子分数氢的分数氢产物可造成通过诸如MAS NMR的手段观察到的高磁场矩阵位移。在本公开中给出识别分子分数氢产物的其他方法(诸如,FTIR,Raman和XPS)。
在其中氧或包括氧的化合物参与氧化或还原反应的实施方式中,O2可用作催化剂或催化剂的源。氧分子的键能是5.165eV,氧原子的第一、第二和第三电离能分别是13.61806eV,35.11730eV和54.9355eV。反应O2→O+O2+,O2→O+O3+和2O→2O+分别提供了是Eh的大约2倍、4倍和1倍的净焓,并且包括通过从H接受这些能量以造成形成分数氢的用于形成分数氢的催化剂反应。
在实施方式中,观察到作为大约1950cm-1处的逆Raman效应(IRE)峰的分子分数氢产物。通过使用包括与支持表面增强型Raman散射(SERS)的Raman激光波长相当的粗糙特征或颗粒大小的导电材料来增强峰,以表现出IRE峰。
VI.化学反应器
本公开还涉及用于生成本公开的键能增加的氢物种和化合物(诸如,二分数氢分子和分数氢氢化物化合物)的其他反应器。根据电池类型,催化作用的其他产物是功率和(可选地)等离子体和光。这种反应器在下文中被称为“氢反应器”或“氢电池”。氢反应器包括用于形成分数氢的电池。用于形成分数氢的电池可采取化学反应器或气体燃料电池(诸如,气体放电电池、等离子体炬电池、或微波功率电池、和电化学电池)的形式。用于形成分数氢的电池的示例性实施方式可采取液体燃料电池、固体燃料电池、异构燃料电池、CIHT电池、和SF-CIHT电池的形式。这些电池中的每个包括:(i)原子氢的源;(ii)选自用于形成分数氢的固体催化剂、熔融催化剂、液体催化剂、气态催化剂、或其混合物的至少一种催化剂;(iii)用于氢和催化剂反应形成分数氢的容器。如本文中使用的并且如本公开料想到的,除非另外指明,否则术语“氢”不仅包括氕(1H),而且还包括氘(2H)和氚(3H)。示例性的化学反应混合物和反应器可包括本公开的SF-CIHT、CIHT、或热电池实施方式。在这个“化学反应器”部分中给出另外的示例性实施方式。在本公开中给出在混合物反应期间形成的用H2O作为催化剂的反应混合物的示例。其他催化剂(诸如,表1和表3中给出的催化剂)可用于形成键能增加的氢物种和化合物。表3A的示例性M-H型催化剂是NaH。可用这些示例性例,调节反应和调节的参数(诸如,反应物、反应物重量%、H2压力和反应温度)。合适的反应物、条件和参数范围是本公开的反应物、条件和参数范围。因13.6eV的整数倍的预测连续谱辐射带、另外H线的多普勒线加宽、H线的反向、在没有击穿电场的情况下的等离子体形成、在辉光持续期间之后的异常等离子体测得的不可解释的异常高H动能,分数氢和分子分数氢表现为是本公开的反应器的产物(如Mills在先公开文献中报告的)。数据(诸如,关于CIHT电池和固体燃料的数据)已经由其他研究人员在场外独立验证。还通过连续长持续时间内输出的电能来确认通过本公开的电池形成分数氢,在没有替代源时这些电能是电输入的多倍,在大多数情况下超过输入大于10的因子。通过MAS H NMR(表现出预测的大约-4.4ppm的高电场位移矩阵峰)、ToF-SIMS和ESI-ToFMS(表现出与吸气基质关联作为m/e=M+n2峰的H2(1/4),其中,M是母离子的质量并且n是整数)、电子束激发发射光谱和光致发光发射光谱(表现出具有H2的能量的16或量子数p=4平方倍数的H2(1/4)的预测的旋转和振动光谱)、Raman和FTIR光谱(表现出是H2的旋转能量的16或量子数p=4平方倍数的1950cm-1的H2(1/4)的旋转能量)、XPS(表现出500eV的H2(1/4)预测总键能)、和ToF-SIMS峰(到达时间在对应于具有与在能量传递到第三体H时预测的从H到H(1/4)的能量释放匹配的大约204eV的动能的H的m/e=1峰之前),将预测的分子分数氢H2(1/4)识别为CIHT电池和固体燃料的产物,如其全文以引用方式并入本文中的Mills在先公开文献中以及R.Mills X Yu,Y.Lu,G Chu,J.He,J.Lotoski的“Catalyst Induced Hydrino Transition(CIHT)Electrochemical Cell”,International Journal of Energy Research,(2013)中以及R.Mills,J.Lotoski,J.Kong,G Chu,J.He,J.Trevey的“High-Power-Density Catalyst Induced Hydrino Transition(CIHT)Electrochemical Cell”(2014)中报告的。
使用水流热量计和Setaram DSC 131差示扫描热量计(DSC)二者,通过观察超过最大理论能量60倍倍数的分数氢形成固体燃料的热量来确认通过本公开的电池(诸如,包括用于生成热动力的固体燃料的电池)形成分数氢。MAS H NMR表现出大约-4.4ppm的预测H2(1/4)高磁场矩阵位移。始于1950cm-1的Raman峰匹配H2(1/4)的自由空间旋转能量(0.2414eV)。在其全部内容以引用方式并入本文中的Mills在先公开文献中以及R.Mills,J.Lotoski,W.Good,J.He的“Solid Fuels that Form HOH Catalyst”(2014)中报告了这些结果。
在实施方式中,固体燃料反应形成H2O和H作为产物或中间反应产物。H2O可用作用于形成分数氢的催化剂。反应物包括至少一种氧化剂和一种还原剂,反应包括至少一种氧化-还原反应。反应物可包括诸如碱金属的金属。反应混合物还可包括氢的源和H2O的源,并且可选地可包括诸如碳、碳化物、硼化物、氮化物、诸如TiCN的甲腈,或腈的载体。载体可包括金属粉末。在实施方式中,氢载体包括Mo或Mo合金,诸如,本公开的Mo或Mo合金,诸如MoPt、MoNi、MoCu和MoCo。在实施方式中,通过如本领域的技术人员已知的诸如选择不氧化载体的反应混合物的其他组分、选择不发生氧化反应的温度和条件、和保持还原气氛(诸如,H2气氛)的方法来避免载体的氧化来避免载体被氧化。H的源可选自碱、碱土金属、过渡、内过渡、稀土氢化物、和本公开的氢化物组成的组。氢的源可以是氢气,氢气还可包括解离子,诸如本公开的那些,诸如碳或氧化铝的载体和本公开的其他载体上的贵金属。水的源可包括脱水而成的化合物(诸如,氢氧化物或氢氧化物络合物,诸如Al、Zn、Sn、Cr、Sb和Pb)。水的源可包括氢的源和氧的源。氧源可包括含氧化合物。示例性的化合物或分子是O2、碱或碱土氧化物、过氧化物、或超氧化物、TeO2、SeO2、PO2、P2O5、SO2、SO3、M2SO4、MHSO4、CO2、M2S2O8、MMnO4、M2Mn2O4、MxHyPO4(x、y=整数)、POBr2、MClO4、MNO3、NO、N2O、NO2、N2O3、Cl2O7、和O2(M=碱;碱土或其他阳离子可取代M)。其他示例性反应物包括选自Li、LiH、LiNO3、LiNO、LiNO2、Li3N、Li2NH、LiNH2、LiX、NH3、LiBH4、LiAlH4、Li3AlH6、LiOH、Li2S、LiHS、LiFeSi、Li2CO3、LiHCO3、Li2SO4、LiHSO4、Li3PO4、Li2HPO4、LiH2PO4、Li2MoO4、LiNbO3、Li2B4O7(四硼酸锂)、LiBO2、Li2WO4、LiAlCl4、LiGaCl4、Li2CrO4、Li2Cr2O7、Li2TiO3、LiZrO3、LiAlO2、LiCoO2、LiGaO2、Li2GeO3、LiMn2O4、Li4SiO4、Li2SiO3、LiTaO3、LiCuCl4、LiPdCl4、LiVO3、LiIO3、LiBrO3、LiXO3(X=F、Br、Cl、I)、LiFeO2、LiIO4、LiBrO4、LiIO4、LiXO4(X=F、Br、Cl、I)、LiScOn、LiTiOn、LiVOn、LiCrOn、LiCr2On、LiMn2On、LiFeOn、LiCoOn、LiNiOn、LiNi2On、LiCuOn、和LiZnOn(其中,n=1、2、3或4)、氧离子、强酸的氧离子、氧化剂、分子氧化剂(诸如V2O3、I2O5、MnO2、Re2O7、CrO3、RuO2、AgO、PdO、PdO2、PtO、PtO2、和NH4X,其中,X是硝酸根或CRC中给出的其他合适阴离子)、和还原剂组成的组中选择的试剂。另一种碱金属或其他阳离子可取代Li。另外的氧源可选自MCoO2、MGaO2、M2GeO3、MMn2O4、M4SiO4、M2SiO3、MTaO3、MVO3、MIO3、MFeO2、MIO4、MClO4、MScOn、MTiOn、MVOn、MCrOn、MCr2On、MMn2On、MFeOn、MCoOn、MNiOn、MNi2On、MCuOn、和MZnOn(其中,M是碱且n=1、2、3、或4)、氧离子、强酸的氧离子、氧化剂、分子氧化剂(诸如V2O3、I2O5、MnO2、Re2O7、CrO3、RuO2、AgO、PdO、PdO2、PtO、PtO2、I2O4、I2O5、I2O9、SO2、SO3、CO2、N2O、NO、NO2、N2O3、N2O4、N2O5、Cl2O、ClO2、Cl2O3、Cl2O6、Cl2O7、PO2、P2O3、和P2O5)组成的的组。反应物可以是形成分数氢的任何所期望比率。示例性反应混合物是0.33g的LiH、1.7g的LiNO3、1g的MgH2和4g的活化C粉末的混合物。另一个示例性反应混合物是火药的反应混合物,诸如、KNO3(75重量%)、软材木炭(可包括大致配方C7H4O)(15重量%)、和S(10重量%);KNO3(70.5重量%)、软材木炭(29.5重量%)或者这些比率在大约±1-30重量%的范围内。氢的源可以是包括大致配方C7H4O的木炭。
在实施方式中,反应混合物包括形成氮、二氧化碳和H2O的反应物,其中,H2O用作在反应中另外形成的H的分数氢催化剂。在实施方式中,反应混合物包括氢的源和H2O的源,可包括可用作H的源的硝酸盐、硫酸盐、过氯酸盐、诸如过氧化氢的过氧化物、诸如三过氧化三丙酮(TATP)或二过氧化二丙酮(DADP)的过氧化合物,特别地,外加O2或诸如含硝基化合物(诸如,硝化纤维(APNC))、氧或含氧或氧离子化合物的其他化合物的另一种氧源。反应混合物可包括化合物的源或化合物,或包括氢、碳、羟基和氧-氮键中的至少两个的官能团的源或官能团。反应物可包括硝酸盐、亚硝酸盐、芳氧基和硝铵。硝酸盐可包括诸如碱硝酸盐的金属,可包括硝酸铵或本领域的技术人员已知的其他硝酸盐(诸如,碱、碱土金属、过渡、内过渡、或稀土金属、或Al、Ga、In、Sn、或Pb硝酸盐)。硝基基团可包括有机化合物的官能团(诸如,硝基甲烷、硝化甘油、三硝基甲苯或本领域的技术人员已知的类似化合物)。示例性的反应化合物是NH4NO3以及可含氧的碳源(诸如长链烃(CnH2n+2),诸如燃用油、柴油燃料、煤油,诸如糖蜜或糖或硝化甘油(诸如硝基甲烷))或诸如煤屑的碳源。H源还可包括NH4、诸如燃料油的烃、或糖,其中,H-C键提供了H的受控释放。H释放可以是自由基反应。C可与O反应,释放H并且形成诸如CO、CO2、和甲酸盐的碳-氧化合物。在实施方式中,单个化合物可包括形成氮、二氧化碳和H2O的官能团。还包括烃官能团的硝铵是环三亚甲基三硝胺,常被称为黑索金(Cyclonite)或用RDX代码命名。可用作H的源和H2O催化剂的源中的至少一种(诸如,O的源和H的源中的至少一种的源)的其他示例性化合物是选自以下的组中的至少一种:硝酸铵(AN)、黑粉末(75%KNO3+15%木炭+10%S)、硝酸铵/燃油(ANFO)(94.3%AN+5.7%燃油)、赤藓糖醇四硝酸酯、三硝基甲苯(TNT)、阿马托炸药(80%TNT+20%AN)、特屈儿混合炸药(70%三硝基苯甲硝胺+30%TNT)、特屈儿(2,4,6-三硝基苯基甲基硝胺(C7H5N5O8))、C-4(91%RDX)、C-3(基于RDX)、组分B(63%RDX+36%TNT)、硝化甘油、RDX(环三亚甲基三硝胺)、Semtex(94.3%PETN+5.7%RDX)、PETN(季戊四醇四硝酸酯)、HMX或奥克托今(环四亚甲基四硝胺)、HNIW(CL-20)(六硝基六氮杂异伍兹烷)、DDF、(4,4'-二硝基-3,3'-氧化偶氮呋喃)、七硝基立方烷、八硝基立方烷、2,4,6-三(三硝基甲基)-1,3,5-三唑、TATNB(1,3,5-三硝基苯,,3,5-三叠氮-2,4,6-三硝基苯)、三硝基氨酸、TNP(2,4,6-三硝基苯酚或苦味酸)、D型炸药(苦味酸铵)、甲基苦味酸、甲基苦味酸、苦味酸氯化物(2-氯-1,3,5-三硝基苯)、三硝基甲酚、收敛酸铅(铅-2,4,6-三硝基间苯二酚,C6HN3O8Pb)、TATB(三氨基三硝基苯)、甲基硝酸盐、硝化甘醇、甘露糖醇六硝酸酯、乙二硝铵、硝基胍、四硝基甘脲、硝基纤维素、硝酸脲、六亚甲基三过氧化二胺(HMTD)。氢、碳、氧和氮的比率可以是任何所期望的比率。在被称为硝酸铵/燃油(ANFO)的硝酸铵(AN)和燃油(FO)的反应混合物的实施方式中,给出大致平衡反应的合适化学计量是大约94.3重量%的AN和5.7重量%的FO,但FO有可能过量。AN和硝基甲烷的示例性平衡反应是
3NH4NO3+2CH3NO2to 4N2+2CO2+9H2O (80)
其中,H中的一些也被转换成诸如H2(1/p)和H-(1/p)(诸如,p=4)的较低能量的氢物种。在实施方式中,氢、氮和氧的莫尔比与诸如具有化学式C3H6N6O6的RDX中的近似。
在实施方式中,使用诸如H2气的原子氢的另外源或诸如碱、碱土金属、过渡、内过渡、稀土金属氢化物的氢化物和诸如碳、碳化物、硼化物、或氮化物或氧化硅或氧化铝的载体上的诸如Ni、Nb或贵金属的解离剂来增加能量。反应混合物可在形成H2O催化剂和原子H的反应期间产生压缩或冲击波,以增加形成分数氢的动能。反应混合物可包括在用于形成H和H2O催化剂的反应期间增加热的至少一种反应物。反应混合物可包括可散布在固体燃料的小颗粒或小球之间的氧源(诸如,空气)。例如,AN小球可包括大约20%的空气。反应混合物还可包括感光剂(诸如,充气玻璃珠)。在示例性实施方式中,添加诸如Al的粉末状金属,以增加反应的热和动力学。例如,可在ANFO中添加Al金属粉末。其他反应混合物包括也具有H的源和催化剂的源(诸如,H2O)的烟火材料。在实施方式中,分数氢的形成具有高活化能量,该能量可以是通过诸如能量反应(诸如,能量或烟火材料的反应)提供的,其中,形成分数氢有助于反应混合物的自加热。另选地,活化能量可以是通过电化学反应(诸如,具有对应于11,600K/eV的高相当温度的CIHT电池的电化学反应)提供的。
另一个示例性反应混合物是可在大约0.01atm至大约100atm的压力范围内的H2气、诸如碱硝酸盐(诸如,KNO3)的硝酸盐、诸如Pt/C、Pd/C、Pt/Al2O3或Pd/Al2O3的氢解离剂。该混合物还可包括诸如石墨或GTA级Grafoil(Union Carbide)的碳。反应比率可以是任何所期望的(诸如,混合有大约50重量%的硝酸盐和平衡碳的混合物的大约0.1至10重量%的碳上的大约1至10%的Pt或Pd);但在示例性实施方式中,这些比率可更改大约5至10的倍数。在使用碳作为载体的情况下,保持一定温度,低于此温度导致C反应形成诸如碳酸盐(诸如,碱碳酸盐)的化合物。在实施方式中,温度被保持在诸如大约50℃-300℃或大约100℃-250℃的范围内,使得NH3形成在N2上方。
反应物和再生反应和系统可包括本公开中的那些或者在以下的此发明人的在先美国专利申请中:诸如,其全部内容以引用方式并入本文中的PCT/US08/61455“Hydrogen Catalyst Reactor”(2008年4月24日提交的PCT);PCT/US09/052072“Heterogeneous Hydrogen Catalyst Reactor”(2009年7月29日提交的PCT);PCT/US10/27828“Heterogeneous Hydrogen Catalyst Power System”(2010年3月18日提交的PCT);PCT/US11/28889“Electrochemical Hydrogen Catalyst Power System”(2011年3月17日提交的PCT);PCT/US12/31369“H2O-Based Electrochemical Hydrogen-Catalyst Power System”(2012年3月30日提交的PCT);PCT/US13/041938“CIHT Power System”(2013年5月21日提交的PCT)和PCT/IB2014/058177“Power Generation Systems and Methods Regarding Same”(“Mills在先申请”)。
在实施方式中,反应可包括诸如N2O、NO2、或NO的氮氧化物而非硝酸盐。另选地,还在反应混合物中添加气体。可通过已知工业方法(诸如,进行Haber处理,之后进行Ostwald处理)来生成NO、NO2和N2O和碱硝酸盐。在一个实施方式中,步骤的示例性顺序是:
具体地,Haber处理可用于使用含某种氧化物的催化剂(诸如,α铁)在升高的温度和压力下用N2和H2生成NH3。Ostwald处理可用于在诸如热铂或铂-铑催化剂的催化剂作用下将氨氧化成NO、NO2和N2O。在实施方式中,产物是氨和碱化合物中的至少一种。可通过将NH3氧化来形成N2O。N2O可溶解在水中,形成硝酸,硝酸与诸如M2O、MOH、M2CO3、或MHCO3的碱化合物反应,形成M硝酸盐,其中,M是碱。
在实施方式中,诸如MNO3(M=碱)的氧源形成H2O催化剂、(ii)用诸如H2的源形成原子H和(iii)形成分数氢的反应中的至少一种反应通过可被加热的诸如贵金属(诸如,Pt)的传统催化剂或在其上发生。被加热的催化剂可包括热灯丝。灯丝可包括热Pt灯丝。诸如MNO3的氧源可以是至少部分气态的。可通过加热诸如KNO3的MNO3来控制气态状态及其气相压力。诸如MNO3的氧源可处于被加热以释放气态MNO3的敞口船形器皿中。可用诸如热灯丝的加热器进行加热。在示例性实施方式中,将MNO3置于石英船形器皿中并且将Pt灯丝缠绕船形器皿,以用作加热器。MNO3的气相压力可保持在大约0.1托至1000托或大约1托至100托的压力范围内。氢源可以是保持在大约1托至100atm、大约10托至10atm、或大约100托至1atm的压力范围内的气态氢。灯丝还用于解离可通过气体管线供应到电池的氢气。电池还可包括真空管线。电池反应引起H2O催化剂和原子H反应形成分数氢。可在能够保持真空、环境压力或大于大气压的压力中的至少一种的容器中保持进行反应。可从电池中去除诸如NH3和MOH的产物并且可进行再生。在示例性实施方式中,MNO3与氢源反应,形成H2O催化剂和在单独反应容器中再生或者作为通过氧化进行的单独步骤再生的NH3。在实施方式中,通过电解或热方式中的至少一种,用水来生成诸如H2气的氢源。示例性的热方法是铁氧化物循环、铈(IV)氧化物-铈(III)氧化物循环、锌氧化锌循环、硫-碘循环、铜-氯循环和混合硫循环和本领域的技术人员已知的其他。用于形成进一步与H反应形成分数氢的H2O催化剂的示例性电池反应是
KNO3+9/2H2→K+NH3+3H2O (82)
KNO3+5H2→KH+NH3+3H2O (83)
KNO3+4H2→KOH+NH3+2H2O (84)
KNO3+C+2H2→KOH+NH3+CO2 (85)
2KNO3+C+3H2→K2CO3+1/2N2+3H2O (86)
通过等式(81)给出用于形成氧化氮的示例性再生反应。诸如K、KH、KOH和K2CO3的产物可与通过将氧化氮添加到水中而形成的硝酸反应,形成KNO2或KNO3。在表4、5和6中给出用于形成H2O催化剂和H2中的至少一个的另外合适的示例性反应。
表4.关于H2O催化剂和H2的热可逆反应循环[L.C.Brown,G.E.Besenbruch,K.R.Schultz,A.C.Marshall,S.K.Showalter,P.S.Pickard和J.F.Funk,“Nuclear Production of Hydroge Usig Thermochemical Water-Splitting Cycles”(2002年6月19-13在佛罗里达州好莱坞的International Congress on Advanced Nuclear Power Plants(ICAPP)提出的并且在会议记录中公开的论文的预印本)。]
*T=热化学,E=电化学。
表5.关于H2O催化剂和H2的热可逆反应循环[C.Perkins和A.W.Weimer,Solar-Thermal Production of Renewable Hydrogen,AIChE Journal,55(2),(2009),第286-293页。]
表6.关于H2O催化剂和H2的热可逆反应循环[S.Abanades,P.Charvin,G.Flamant,P.Neveu,“Screening of Water-Splitting Thermochemical Cycles Potentially Attractive for Hydrogen Production by Concentrated Solar Energy”,Energy,31,(2006),第2805–2822页。]
用于形成H2O催化剂的反应物可包括O(诸如,O物种)的源和H的源。O物种的源可包括O2、空气和化合物或含O化合物的混合物中的至少一种。含氧化合物可包括氧化剂。含氧化合物可包括氧化物、氢氧化合物、氢氧化物、过氧化物和超氧化物中的至少一种。合适的示例性金属氧化物是诸如Li2O、Na2O和K2O的碱氧化物,诸如MgO、CaO、SrO和BaO的碱稀土氧化物,诸如NiO、Ni2O3、FeO、Fe2O3和CoO的过渡氧化物,内过渡和稀土金属氧化物,诸如Al、Ga、In、Si、Ge、Sn、Pb、As、Sb、Bi、Se和Te的其他金属和准金属的那些,这些和含氧的其他元素的混合物。氧化物可包括诸如本公开的氧化物阴离子的氧化物阴离子(诸如,金属氧化物阴离子和诸如碱、碱土、过渡、内过渡和稀土金属阳离子的阳离子)和诸如MM’2xO3x+1或MM’2xO4(M=碱土金属,M’=诸如Fe或Ni或Mn的过渡金属,x=整数)和M2M’2xO3x+1或M2M’2xO4(M=碱,M’=诸如Fe或Ni或Mn的过渡金属,x=整数)的其他金属和准金属(诸如、Al、Ga、In、Si、Ge、Sn、Pb、As、Sb、Bi、Se和Te)。合适的示例性金属氢氧化物是AlO(OH)、ScO(OH)、YO(OH)、VO(OH)、CrO(OH)、MnO(OH)(α-MnO(OH)锰榍石和γ-MnO(OH)亚锰酸盐)、FeO(OH)、CoO(OH)、NiO(OH)、RhO(OH)、GaO(OH)、InO(OH)、Ni1/2Co1/2O(OH)和Ni1/3Co1/3Mn1/3O(OH)。合适的示例性氢氧化物是诸如碱、碱土、过渡、内过渡和稀土金属的那些金属的氢氧化物和诸如Al、Ga、In、Si、Ge、Sn、Pb、As、Sb、Bi、Se和Te的其他那些金属和准金属的氢氧化物和混合物。合适的羟基复合离子是Li2Zn(OH)4、Na2Zn(OH)4、Li2Sn(OH)4、Na2Sn(OH)4、Li2Pb(OH)4、Na2Pb(OH)4、LiSb(OH)4、NaSb(OH)4、LiAl(OH)4、NaAl(OH)4、LiCr(OH)4、NaCr(OH)4、Li2Sn(OH)6和Na2Sn(OH)6。另外的示例性合适氢氧化物是Co(OH)2、Zn(OH)2、Ni(OH)2、其他过渡金属氢氧化物、Cd(OH)2、Sn(OH)2、和Pb(OH)中的至少一种。合适的示例性过氧化物是H2O2、有机化合物、诸如M2O2的那些金属(其中,M是诸如Li2O2、Na2O2、K2O2的碱金属)、诸如碱土过氧化物(诸如,Ca、Sr、或Ba过氧化物)的其他离子过氧化物、诸如镧系的那些其他阳电金属、和诸如Zn、Cd和Hg的共价金属过氧化物。合适的示例性超氧化物是金属MO2(其中,M是诸如NaO2、KO2、RbO2和CsO2的碱金属)和碱土金属超氧化物。在实施方式中,固态燃料包括碱过氧化物和氢源(诸如,氢化物、烃、或诸如BH3NH3的储氢材料)。反应混合物可包括氢氧化物(诸如,碱、碱土、过渡、内过渡和稀土金属和Al、Ga、In、Sn、Pb和形成氢氧化物的其他元素的氢氧化物)和氧源(诸如,诸如碳酸盐(诸如,包括碱、碱土、过渡、内过渡和稀土金属和Al、Ga、In、Sn、Pb和本公开的其他的碳酸盐)的包括至少一种氧离子的化合物)。其他合适的含氧化合物是铝酸盐、钨酸盐、锆酸盐、钛酸盐、硫酸盐、磷酸盐、碳酸盐、硝酸盐、铬酸盐、重铬酸盐、和锰酸盐、氧化物、氢氧化合物、过氧化物、超氧化物、硅酸盐、钛酸盐、钨酸盐、和本公开的其他的组的氧电离合物中的至少一种。通过下式给出氢氧化物和碳酸盐的示例性反应
Ca(OH)2+Li2CO3→CaO+H2O+Li2O+CO2 (87)
在其他实施方式中,氧源是气态的或者容易形成气体,诸如NO2、NO、N2O、CO2、P2O3、P2O5和SO2。如Mills在先申请中给出的,通过用氧或其源进行燃烧,可将因形成诸如C、N、NH3、P、或S的H2O催化剂而被还原的氧化物产物再转换回氧化物。电池可生成可用于加热应用的过量热,或者可通过诸如Rankine或Brayton系统的装置将热转换成电。另选地,可使用电池来合成低能氢物种(诸如,分子分数氢和分数氢氢阴离子和对应的化合物)。
在实施方式中,用于形成分数氢以进行较低能量氢物种和化合物生成并且能量生成中的至少一种的反应混合物包括原子氢的源和催化剂的源,催化剂包括诸如H2O催化剂的H和O中的至少一个(诸如,本公开的催化剂)。反应混合物还可包括诸如H2SO3、H2SO4、H2CO3、HNO2、HNO3、HClO4、H3PO3和H3PO4的酸或诸如酸酐或无水酸的酸的源。后者可包括SO2、SO3、CO2、NO2、N2O3、N2O5、Cl2O7、PO2、P2O3和P2O5的组中的至少一个。反应混合物可包括碱和碱酐(诸如,M2O(M=碱)、M’O(M’=碱土)、ZnO、或其他过渡金属氧化物、CdO、CoO、SnO、AgO、HgO、或Al2O3)中的至少一种。其他示例性的酐包括对于H2O而言稳定的金属(诸如,Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In)。酐可以是碱金属或碱土金属氧化物,水合物可包括氢氧化物。反应混合物可包括诸如FeOOH、NiOOH、或CoOOH的氢氧化合物。反应混合物可包括H2O的源和H2O中的至少一种。可通过在存在原子氢的情况下通过水合和脱水反应可逆地形成H2O。用于形成H2O的示例性反应是
Mg(OH)2→MgO+H2O (88)
2LiOH→Li2O+H2O (89)
H2CO3→CO2+H2O (90)
2FeOOH→Fe2O3+H2O (91)
在实施方式中,通过脱水包括磷酸盐的至少一种化合物(诸如,磷酸盐、磷酸氢盐、和磷酸二氢盐的盐,诸如阳离子的那些,诸如包括诸如碱、碱土、过渡、内过渡和稀土金属的金属和诸如Al、Ga、In、Si、Ge、Sn、Pb、As、Sb、Bi、Se和Te的其他金属和准金属的阳离子)和混合物,以形成缩聚磷酸盐(诸如,诸如[PnO3n+1](n+2)-的聚磷酸盐、诸如[(PO3)n]n-的长链偏磷酸盐、诸如[(PO3)n]n-的环形偏磷酸盐(n≥3)、和诸如P4O10的超级磷酸盐中的至少一种),来形成H2O催化剂。示例性的反应是
脱水反应的反应物可包括R-Ni,R-Ni可包括Al(OH)3和Al2O3中的至少一种。反应物还可包括诸如碱金属、金属氢化物MH、诸如碱氢氧化物的金属氢氧化物(诸如,本公开的金属氢氧化物)的金属M(诸如,本公开的金属M)和氢的源(诸如,H2以及本征氢)。示例性的反应是:
2Al(OH)3+→Al2O3+3H2O (94)
Al2O3+2NaOH→2NaAlO2+H2O (95)
3MH+Al(OH)3+→M3Al+3H2O (96)
MoCu+2MOH+4O2→M2MoO4+CuO+H2O(M=Li,Na,K,Rb,Cs)(97)
反应产物可包括合金。可通过再水合来重新生成R-Ni。用于形成H2O催化剂的反应混合物和脱水反应可包括并且涉及氢氧化合物(诸如在以下示例性反应中给出的本公开的氢氧化合物):
3Co(OH)2→2CoOOH+Co+2H2O (98)
可通过解离,用H2气形成原子氢。氢解离剂可以是本公开的氢解离剂中的一种(诸如,碳或Al2O3上的诸如Ni或Pt或Pd的载体上的R-Ni或贵金属或过渡金属)。另选地,原子H可以是来自穿过隔膜(诸如,本公开的隔膜)的H渗透。在实施方式中,电池包括允许H2选择性扩散通过同时防止H2O扩散的隔膜(诸如,陶瓷隔膜)。在实施方式中,通过包括氢源的电解液(诸如,含水的水溶液或熔融电解液)的电解,向电池供应H2和原子H中的至少一个。在实施方式中,通过将酸或碱脱水成酐的形式,可逆地形成H2O催化剂。在实施方式中,通过改变电池PH或活性、温度、压力中的至少一个来传播用于形成催化剂H2O和分数氢的反应,其中,可通过改变温度来改变压力。可通过如本领域中的技术人员已知的添加盐来改变诸如酸、碱、或甘酸的物种的活性。在实施方式中,反应混合物可包括可吸收或者是气体(诸如,H2)的盐的碳或用于形成分数氢的反应的酸酐气体的材料。反应物可以是任何所期望的浓度和比率。反应混合物可以是熔融的或者包括含水浆液。
在另一个实施方式中,H2O催化剂的源是酸和碱之间的反应(诸如,氢卤酸、硫酸、硝酸、亚硝酸中的至少一种和碱的反应)。其他合适的酸反应剂是H2SO4、HCl、HX(X-卤化物)、H3PO4、HClO4、HNO3、HNO、HNO2、H2S、H2CO3、H2MoO4、HNbO3、H2B4O7(M四硼酸盐)、HBO2、H2WO4、H2CrO4、H2Cr2O7、H2TiO3、HZrO3、MAlO2、HMn2O4、HIO3、HIO4、HClO4、或诸如蚁酸或乙酸的有机酸的水溶液。合适的示例性碱是氢氧化物、氢氧化合物、或包括碱、碱土、过渡、内过渡、或稀土金属、或Al、Ga、In、Sn或Pb的氧化物。
在实施方式中,反应物可包括分别与碱或酸酐反应以分别形成H2O催化剂和碱的阳离子和酸酐的阴离子或碱酐的阳离子和酸的阴离子的化合物。酸酐SiO2与碱NaOH的示例性反应是
4NaOH+SiO2→Na4SiO4+2H2O (99)
其中,对应酸的脱水反应是
H4SiO4→2H2O+SiO2 (100)
其他合适的示例性酐可包括诸如来自Mo、Ti、Zr、Si、Al、Ni、Fe、Ta、V、B、Nb、Se、Te、W、Cr、Mn、Hf、Co、和Mg的组的元素、金属、合金、或混合物。对应的氧化物可包括MoO2、TiO2、ZrO2、SiO2、Al2O3、NiO、Ni2O3、FeO、Fe2O3、TaO2、Ta2O5、VO、VO2、V2O3、V2O5、B2O3、NbO、NbO2、Nb2O5、SeO2、SeO3、TeO2、TeO3、WO2、WO3、Cr3O4、Cr2O3、CrO2、CrO3、MnO、Mn3O4、Mn2O3、MnO2、Mn2O7、HfO2、Co2O3、CoO、Co3O4、Co2O3、和MgO中的至少一个。在示例性实施方式中,碱包括可形成对应的碱氧化物(诸如,诸如Li2O和H2O的M2O)的氢氧化物(诸如,诸如LiOH的MOH(M=碱)的碱氢氧化物)。碱氧化物可与酐氧化物反应,形成产物氧化物。在释放H2O的LiOH与酐氧化物的示例性反应中,产物氧化物化合物可包括Li2MoO3或Li2MoO4、Li2TiO3、Li2ZrO3、Li2SiO3、LiAlO2、LiNiO2、LiFeO2、LiTaO3、LiVO3、Li2B4O7、Li2NbO3、Li2SeO3、Li3PO4、Li2SeO4、Li2TeO3、Li2TeO4、Li2WO4、Li2CrO4、Li2Cr2O7、Li2MnO4、Li2HfO3、LiCoO2和MgO。其他合适的示例性氧化物是As2O3、As2O5、Sb2O3、Sb2O4、Sb2O5、Bi2O3、SO2、SO3、CO2、NO2、N2O3、N2O5、Cl2O7、PO2、P2O3、和P2O5的组中的至少一种。通过等式(91)给出另一个示例。合适的金属氧化物是
2LiOH+NiO至Li2NiO2+H2O (101)
3LiOH+NiO至LiNiO2+H2O+Li2O+1/2H2 (102)
4LiOH+Ni2O3至2Li2NiO2+2H2O+1/2O2 (103)
2LiOH+Ni2O3至2LiNiO2+H2O (104)
诸如Fe、Cr和TI的其他过渡金属、内过渡、和稀土金属和诸如Al、Ga、In、Si、Ge、Sn、Pb、As、Sb、Bi、Se和Te的其他金属和准金属可取代Ni,诸如Li、Na、Rb和Cs的其他碱金属可取代K。在实施方式中,氧化物可包括Mo,其中,在用于形成H2O的反应期间,新生H2O催化剂和H可形成进一步反应形成分数氢的物种。示例性的固体燃料反应和可能的氧化还原路径是
3MoO2+4LiOH→2Li2MoO4+Mo+2H2O (105)
2MoO2+4LiOH→2Li2MoO4+2H2 (106)
O2-→1/2O2+2e- (107)
2H2O+2e-→2OH-+H2 (108)
2H2O+2e-→2OH-+H+H(1/4) (109)
Mo4++4e-→Mo (110)
反应还可包括氢的源(诸如,氢气)和解离剂(诸如,Pd/Al2O3)。氢可以是氕、氘或氚中的任一个或其组合。用于形成H2O催化剂的反应可包括两种氢氧化物形成水的反应。氢氧化物的阳离子可具有不同的氧化状态(诸如,碱金属氢氧化物与过渡金属或碱土氢氧化物的反应)。反应混合物和反应还可包括并且涉及来自源的H2,如在示例性反应中给出的:
LiOH+2Co(OH)2+1/2H2→LiCoO2+3H2O+Co (111)
反应混合物和反应还可包括并且涉及诸如碱的金属M或碱土金属,如示例性反应中给出的:
M+LiOH+Co(OH)2→LiCoO2+H2O+MH (112)
在实施方式中,反应混合物包括金属氧化物和可用作H源的氢氧化物并且可选地包括另一个H源,其中,金属氧化物中的金属(诸如,Fe)可具有多种氧化态,使得它在反应形成H2O以用作催化剂与H反应形成分数氢期间经历氧化还原反应。示例是FeO,其中,Fe2+可在反应形成催化剂期间经历氧化成Fe3+。示例性的反应是
FeO+3LiOH至H2O+LiFeO2+H(1/p)+Li2O (113)
在实施方式中,诸如金属氧化物、氢氧化物、或氢氧化合物的至少一种反应物用作氧化剂,其中,诸如Fe、Ni、Mo、或Mn的金属原子可处于比另一种可能的氧化态高的氧化态。形成催化剂和分数氢的反应可造成原子经历被还原成至少一种较低氧化态。形成H2O催化剂的金属氧化物、氢氧化物、和氢氧化合物的示例性反应是
2KOH+NiO→K2NiO2+H2O (114)
3KOH+NiO→KNiO2+H2O+K2O+1/2H2 (115)
2KOH+Ni2O3→2KNiO2+H2O (116)
4KOH+Ni2O3→2K2NiO2+2H2O+1/2O2 (117)
2KOH+Ni(OH)2→K2NiO2+2H2O (118)
2LiOH+MoO3→Li2MoO4+H2O (119)
3KOH+Ni(OH)2→KNiO2+2H2O+K2O+1/2H2 (120)
2KOH+2NiOOH→K2NiO2+2H2O+NiO+1/2O2 (121)
KOH+NiOOH→KNiO2+H2O (122)
2NaOH+Fe2O3→2NaFeO2+H2O (123)
诸如Ni、Fe、Cr和Ti的其他过渡金属、内过渡金属、稀土金属和诸如Al、Ga、In、Si、Ge、Sn、Pb、As、Sb、Bi、Se和Te的其他金属或准金属可取代Ni或Fe,诸如Li、Na、K、Rb和Cs的其他碱金属可取代K或Na。在实施方式中,反应混合物包括对于H2O而言稳定的金属(诸如,Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In)的氧化物和氢氧化物中的至少一种。另外,反应混合物包括诸如H2气体的氢的源和(可选地)载体上的诸如贵金属的解离剂。在实施方式中,固体燃料或含能材料包括至少一种金属卤化物(诸如,诸如溴化物(诸如,FeBr2)的至少一种过渡金属卤化物)和形成氢氧化合物、氢氧化物、或氧化物的金属和H2O的混合物。在实施方式中,固体燃料或含能材料包括金属氧化物、氢氧化物、和氢氧化合物(诸如,诸如Ni2O3和H2O的至少一种过渡金属氧化物)中的至少一种的混合物。
碱酐NiO与酸HCl的示例性反应是
2HCl+NiO→H2O+NiCl2 (124)
其中,对应碱的脱水反应是
Ni(OH)2→H2O+NiO (125)
反应物可包括Lewis酸或碱和Bronsted-Lowry酸或碱中的至少一种。反应混合物和反应还可包括并且涉及含氧化合物,其中,酸与含氧化合物反应,形成水,如示例性反应中给出的:
2HX+POX3→H2O+PX5 (126)
(X=卤化物)。类似于POX3的化合物是合适的(诸如,其中P被S取代的化合物)。其他合适的示例性酐可包括可溶于酸的元素、金属、合金、或混合物的氧化物(诸如,氢氧化物、氢氧化合物、或含诸如来自Mo、Ti、Zr、Si、Al、Ni、Fe、Ta、V、B、Nb、Se、Te、W、Cr、Mn、Hf、Co和Mg的组中的一种的碱、碱土、过渡、内过渡、或稀土金属、或Al、Ca、In、Sn、或Pb的氧化物)。对应的氧化物可包括MoO2、TiO2、ZrO2、SiO2、Al2O3、NiO、Ni2O3、FeO或Fe2O3、TaO2、Ta2O5、VO、VO2、V2O3、V2O5、B2O3、NbO、NbO2、Nb2O5、SeO2、SeO3、TeO2、TeO3、WO2、WO3、Cr3O4、Cr2O3、CrO2、CrO3、MnO、Mn3O4、Mn2O3、MnO2、Mn2O7、HfO2、Co2O3、CoO、Co3O4、Co2O3、和MgO。其他合适的示例性氧化物是Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的组中的那些。在示例性实施方式中,酸包括氢卤酸并且产物是H2O和氧化物的金属卤化物。反应混合物还包括氢的源(诸如,H2气)和解离剂(诸如,Pt/C),其中,H和H2O催化剂反应形成分数氢。
在实施方式中,固态燃料包括H2源(诸如,渗透隔膜)或H2气和解离剂(诸如,Pt/C)和含氧的H2O催化剂的源或还原成H2O的氢氧化物。氧化物或氢氧化物的金属可形成用作H的源的金属氢化物。碱氢氧化物和氧化物(诸如,LiOH和Li2O)的示例性反应是
LiOH+H2→H2O+LiH (127)
Li2O+H2→LiOH+LiH (128)
反应混合物可包括经历氢还原成为H2O的金属的氧化物或氢氧化物(诸如,Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的氧化物或氢氧化物)和氢的源(诸如,H2气)和解离剂(诸如,Pt/C)。
在另一个实施方式中,反应混合物包括H2源(诸如,H2气)和解离剂(诸如,Pt/C)和过氧化合物(诸如,H2O2),过氧化合物被分解成H2O催化剂和含氧的其他产物(诸如,O2)。H2和分解产物(诸如,O2)中的某个可发生反应,也形成H2O催化剂。
在实施方式中,用于形成作为催化剂的H2O的反应包括形成醛和H2O的有机脱水反应(诸如,诸如多元醇(诸如,糖)的醇的有机脱水反应)。在实施方式中,脱水反应涉及从末端醇释放H2O,形成醛。末端醇可包括释放可用作催化剂的H2O的糖或其衍生物。合适的示例性醇是赤藓醇、半乳糖醇或己糖醇、和聚乙烯醇(PVA)。示例性的反应混合物包括糖+氢解离剂(诸如,Pd/Al2O3+H2)。另选地,反应包括金属盐(诸如,具有至少一个水合水的金属盐)的脱水。在实施方式中,脱水包括使水合物(诸如,水合离子)和盐水合物(诸如,BaI2 2H2O和EuBr2nH2O)失去将用作催化剂的H2O。
在实施方式中,用于形成H2O催化剂的反应包括含氧(诸如,CO)、氧离子(诸如,MNO3(M=碱))、金属氧化物(诸如,NiO、Ni2O3、Fe2O3、或SnO)、氢氧化物(诸如,Co(OH)2)、氢氧化合物(诸如,FeOOH、CoOOH、和NiOOH)的化合物和能被氢还原成H2O的化合物、氧离子、氧化物、氢氧化物、氢氧化合物、过氧化物、超氧化物、和含氧物种(诸如,本公开的那些)的其他组分的氢还原。含氧或氧离子的示例性化合物是SOCl2、Na2S2O3、NaMnO4、POBr3、K2S2O8、CO、CO2、NO、NO2、P2O5、N2O5、N2O、SO2、I2O5、NaClO2、NaClO、K2SO4、和KHSO4。用于氢还原的氢的源可以是H2气和诸如金属氢化物的氢化物(诸如,本公开的氢化物)中的至少一种。反应混合物还可包括可形成含氧的化合物或离子的还原剂。氧离子的阳离子可形成包括另一个阴离子的产物化合物(诸如,卤化物、其他硫元素化物、磷化物、其他氧离子、氮化物、硅化物、砷化物、或本公开的其他阴离子)。示例性的反应是
4NaNO3(c)+5MgH2(c)→5MgO(c)+4NaOH(c)+3H2O(l)+2N2(g) (129)
P2O5(c)+6NaH(c)→2Na3PO4(c)+3H2O(g) (130)
NaClO4(c)+2MgH2(c)→2MgO(c)+NaCl(c)+2H2O(l) (131)
KHSO4+4H2→KHS+4H2O (132)
K2SO4+4H2→2KOH+2H2O+H2S (133)
LiNO3+4H2→LiNH2+3H2O (134)
GeO2+2H2→Ge+2H2O (135)
CO2+H2→C+2H2O (136)
PbO2+2H2→2H2O+Pb (137)
V2O5+5H2→2V+5H2O (138)
Co(OH)2+H2→Co+2H2O (139)
Fe2O3+3H2→2Fe+3H2O (140)
3Fe2O3+H2→2Fe3O4+H2O (141)
Fe2O3+H2→2FeO+H2O (142)
Ni2O3+3H2→2Ni+3H2O (143)
3Ni2O3+H2→2Ni3O4+H2O (144)
Ni2O3+H2→2NiO+H2O (145)
3FeOOH+1/2H2→Fe3O4+2H2O (146)
3NiOOH+1/2H2→Ni3O4+2H2O (147)
3CoOOH+1/2H2→Co3O4+2H2O (148)
FeOOH+1/2H2→FeO+H2O (149)
NiOOH+1/2H2→NiO+H2O (150)
CoOOH+1/2H2→CoO+H2O (151)
SnO+H2→Sn+H2O (152)
反应混合物可包括阴离子的源或阴离子和氧的源或氧(诸如,含氧化合物),其中,用于形成H2O的反应物包括阴离子-氧交换反应,可选地,来自源的H2与氧反应,形成H2O。示例性的反应是
2NaOH+H2+S→Na2S+2H2O (153)
2NaOH+H2+Te→Na2Te+2H2O (154)
2NaOH+H2+Se→Na2Se+2H2O (155)
LiOH+NH3→LiNH2+H2O (156)
在另一个实施方式中,反应混合物包括硫属元素化物之间的交换反应(诸如,含O和S的反应物之间的交换反应)。示例性的硫属元素化物反应物(诸如,四面体四硫代钼酸铵)包含([MoS4]2-)阴离子。用于形成新生H2O催化剂和(可选地)新生H的示例性反应包括在存在氨气的情况下钼酸盐[MoO4]2-与氢化硫的反应:
[NH4]2[MoO4]+4H2S→[NH4]2[MoS4]+4H2O (157)
在实施方式中,反应混合物包括氢的源、含氧化合物、和能够与反应混合物的至少一种其他元素形成合金的至少一种元素。用于形成H2O催化剂的反应可包括含氧化合物中的氧和能够与氧化合物中的阳离子形成合金的元素的交换反应,其中,氧与来自源的氢反应,形成H2O。示例性的反应是
NaOH+1/2H2+Pd→NaPb+H2O (158)
NaOH+1/2H2+Bi→NaBi+H2O (159)
NaOH+1/2H2+2Cd→Cd2Na+H2O (160)
NaOH+1/2H2+4Ga→Ga4Na+H2O (161)
NaOH+1/2H2+Sn→NaSn+H2O (162)
NaAlH4+Al(OH)3+5Ni→NaAlO2+Ni5Al+H2O+5/2H2 (163)
在实施方式中,反应混合物包括含氧化合物(诸如,氢氧化合物)和形成氧化物的还原剂(诸如,金属)。用于形成H2O催化剂的反应可包括氢氧化合物与金属反应,形成金属氧化物和H2O。示例性的反应是
2MnOOH+Sn→2MnO+SnO+H2O (164)
4MnOOH+Sn→4MnO+SnO2+2H2O (165)
2MnOOH+Zn→2MnO+ZnO+H2O (166)
在实施方式中,反应混合物包括含氧化合物(诸如,氢氧化物)、氢的源、含不同阴离子的至少一种其他化合物(诸如,卤化物或另一种元素)。用于形成H2O催化剂的反应可包括氢氧化物与其他化合物或元素反应,其中,阴离子或元素与氢氧化物交换,形成阴离子或元素的另一种化合物,并且因氢氧化物与H2反应,形成H2O。阴离子可包括卤化物。示例性的反应是
2NaOH+NiCl2+H2→2NaCl+2H2O+Ni (167)
2NaOH+I2+H2→2NaI+2H2O (168)
2NaOH+XeF2+H2→2NaF+2H2O+Xe (169)
BiX3(X=卤化物)+4Bi(OH)3→3BiOX+Bi2O3+6H2O (170)
可选择氢氧化物和卤化物化合物,使得用于形成H2O和另一种卤化物的反应是热可逆的。在实施方式中,总体交换反应是
NaOH+1/2H2+1/yMxCly=NaCl+6H2O+x/yM (171)
其中,示例性化合物MxCly是AlCl3、BeCl2、HfCl4、KAgCl2、MnCl2、NaAlCl4、ScCl3、TiCl2、TiCl3、UCl3、UCl4、ZrCl4、EuCl3、GdCl3、MgCl2、NdCl3、和YCl3。在升高的温度下,诸如大约100℃至2000℃的范围内的等式(171)的反应具有大约0kJ的焓和自由能量中的至少一个并且是可逆的。用各反应的对应热动力参数,计算可逆温度。代表性的温度范围是大约800K至900K的NaCl-ScCl3、大约300K-400K的NaCl-TiCl2、大约600K-800K的NaCl-UCl3、大约250K-300K的NaCl-UCl4、大约250K-300K的NaCl-ZrCl4、大约900K-1300K的NaCl-MgCl2、大约900K-1000K的NaCl-EuCl3、大约>1000K的NaCl-NdCl3、大约>1000K的NaCl-YCl3。
在实施方式中,反应混合物包括诸如金属氧化物(诸如,碱、碱土、过渡、内过渡、和稀土金属氧化物)的氧化物和诸如Al、Ga、In、Si、Ge、Sn、Pb、As、Sb、Bi、Se和Te的其他金属和准金属的氧化物、诸如M2O2(诸如,Li2O2、Na2O2、K2O2)的过氧化物(其中,M是碱金属)、诸如MO2(诸如,NaO2、KO2、RbO2、和CsO2的超氧化物(其中,M是碱金属)、和碱土金属超氧化物、和氢的源。离子过氧化物还可包括Ca、Sr或Ba的过氧化物。用于形成H2O催化剂的反应可包括氧化物、过氧化物、或超氧化物被氢还原,形成H2O。示例性的反应是
Na2O+2H2→2NaH+H2O (172)
Li2O2+H2→Li2O+H2O (173)
KO2+3/2H2→KOH+H2O (174)
在实施方式中,反应混合物包括氢的源(诸如,H2、诸如碱、碱土、过渡、内过渡、和稀土金属氢化物中的至少一种的氢化物和本公开的那些)和氢的源或含可燃氢的其他化合物(诸如,金属酰胺)和氧的源(诸如,O2)。用于形成H2O催化剂的反应可包括氧化H2、氢化物、或氢化合物(诸如,金属酰胺)以形成H2O。示例性的反应是
2NaH+O2→Na2O+H2O (175)
H2+1/2O2→H2O (176)
LiNH2+2O2→LiNO3+H2O (177)
2LiNH2+3/2O2→2LiOH+H2O+N2 (178)
在实施方式中,反应混合物包括氢的源和氧的源。用于形成H2O催化剂的反应可包括分解氢的源和氧的源中的至少一种,形成H2O。示例性的反应是
NH4NO3→N2O+2H2O (179)
NH4NO3→N2+1/2O2+2H2O (180)
H2O2→1/2O2+H2O (181)
H2O2+H2→2H2O (182)
在这个“化学反应器部分”中这里公开的反应混合物还包括用于形成分数氢的氢的源。该源可以是原子分数氢的源(诸如,氢解离剂和H2气)或金属氢化物(诸如,解离剂和本公开的金属氢化物)。用于提供原子氢的氢的源可以是诸如氢氧化物或氢氧化合物的含氢化合物。反应形成分数氢的H可以是通过一种或更多种反应物(其中,至少一种包括氢的源)反应(诸如,氢氧化物和氧化物反应)而形成的新生H。反应还可形成H2O催化剂。氧化物和氢氧化物可包括同一化合物。例如,诸如FeOOH的氢氧化合物可脱水,得到H2O催化剂并且还得到用于脱水期间的分数氢反应的新生H:
4FeOOH→H2O+Fe2O3+2FeO+O2+2H(1/4) (183)
其中,在反应期间形成的新生H发生反应,成为分数氢。其他示例性的反应是氢氧化物和氢氧化合物或氧化物的反应(诸如,NaOH+FeOOH或Fe2O3),以形成诸如NaFeO2+H2O的碱金属氧化物,其中,反应期间形成的新生H可形成分数氢,其中,H2O用作催化剂。氧化物和氢氧化物可包括同一化合物。例如,诸如FeOOH的氢氧化合物可脱水,得到H2O催化剂并且还得到用于脱水期间的分数氢反应的新生H:
4FeOOH→H2O+Fe2O3+2FeO+O2+2H(1/4) (184)
其中,在反应期间形成的新生H发生反应,成为分数氢。其他示例性的反应是氢氧化物和氢氧化合物或氧化物的反应(诸如,NaOH+FeOOH或Fe2O3),以形成诸如NaFeO2+H2O的碱金属氧化物,其中,反应期间形成的新生H可形成分数氢,其中,H2O用作催化剂。氢氧化物离子在形成H2O和氧化物离子时被还原和氧化。氧化物离子可与H2O反应,形成OH-。可用氢氧化物-卤化物交换反应(诸如,以下反应)得到同一途径
2M(OH)2+2M'X2→H2O+2MX2+2M'O+1/2O2+2H(1/4) (185)
其中,示例性的M和M'金属分别是碱土和过渡金属(诸如,Cu(OH)2+FeBr2、Cu(OH)2+CuBr2、或Co(OH)2+CuBr2)。在实施方式中,固体燃料可包括金属氢氧化物和金属卤化物,其中,至少一种金属是Fe。可添加H2O和H2中的至少一种,以再生反应物。在实施方式中,M和M'可选自碱、碱土、过渡、内过渡、和稀土金属、Al、Ga、In、Si、Ge、Sn、Pb、第13、14、15和16族元组、和氢氧化物或卤化物的其他阳离子(诸如,本公开的那些阳离子)的组。用于形成HOH催化剂、新生H和分数氢中的至少一种的示例性反应物是
4MOH+4M'X→H2O+2M'2O+M2O+2MX+X2+2H(1/4) (186)
在实施方式中,反应混合物包括氢氧化物和卤化物化合物(诸如,本公开的那些反应混合物)中的至少一种。在实施方式中,卤化物可用于促成新生HOH催化剂和H中的至少一种的形成和保持中的至少一种。在实施方式中,混合物可用于降低反应混合物的熔点。
在实施方式中,固体燃料包括混合物Mg(OH)2+CuBr2。产物CuBr可升华,形成与不易挥发MgO分离的CuBr冷凝产物。可用冷阱捕集Br2。CuBr可与Br2反应,形成CuBr2,MgO可与H2O反应,形成Mg(OH)2。Mg(OH)2可与CuBr2结合,形成再生的固体燃料。
酸碱反应是形成H2O催化剂的另一种方法。因此,热化学反应类似于用于形成分数氢的电化学反应。示例性的卤化物和氢氧化物混合物是Bi、Cd、Cu、Co、Mo和Cd的混合物和氢氧化物和具有Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、和Zn的组的具有低水反应性的金属的卤化物的混合物。在实施方式中,反应混合物还包括可用作H和催化剂(诸如,新生H2O)中的至少一种的源的H2O。水可以是在反应期间分解或以其他方式反应的水合物的形式。
在实施方式中,固体燃料包括H2O和形成新生H和新生H2O的无机化合物的反应混合物。无机化合物可包括与H2O反应的卤化物(诸如,金属卤化物)。反应产物可以是氢氧化物、氢氧化合物、氧化物、卤氧化物、羟基卤化物、和水合物中的至少一种。其他产物可包括含氧和卤素的阴离子(诸如,XO-、和(X=卤素))。产物还可以是还原的阳离子和卤素气体中的至少一种。卤化物可以是金属卤化物(诸如,碱、碱土、过渡、内过渡、和稀土金属和形成卤化物的Al、Ga、In、Sn、Pb、S、Te、Se、N、P、As、Sb、Bi、C、Si、Ge和B和其他元素中的一种)。该金属或元素可另外地是形成氢氧化物、氢氧化合物、氧化物、卤氧化物、羟基卤化物、和水合物中的至少一种的金属或元素、和形成具有含氧和卤素的阴离子(诸如,XO-、和(X=卤素))的化合物的金属或元素。合适的示例性金属和元素是碱、碱土、过渡、内过渡、和稀土金属和Al、Ga、In、Sn、Pb、S、Te、Se、N、P、As、Sb、Bi、C、Si、Ge和B中的至少一种。示例性的反应是
5MX2+7H2O→MXOH+M(OH)2+MO+M2O3+11H(1/4)+9/2X2 (187)
其中,M是金属(诸如,诸如Cu的过渡金属)并且X是卤素(诸如,Cl)。
在实施方式中,H2O用作保持低浓度以提供新生H2O的催化剂。在实施方式中,通过将H2O分子分散在另一种材料(诸如,固体、液体、或气体)中来实现低浓度。H2O分子可被稀释,直至分离新生分子的极限。材料还包括H的源。材料可包括离子化合物(诸如,碱卤化物,诸如钾卤化物(诸如,KCl))或过渡金属卤化物(诸如,CuBr2)。还可动态地实现用于形成新生H的低浓度,其中,通过反应形成H2O。可以相对于导致稳态低能的形成速率的一定速率来去除产物H2O,以提供新生H和新生HOH中的至少一种。用于形成H2O的反应可包括脱水、燃烧、酸-碱反应和其他(诸如,本公开的反应)。可通过诸如蒸发和冷凝的手段来去除H2O。示例性的反应物是用于形成氧化铁和H2O的FeOOH,其中,还用进一步反应来形成新生H,以形成分数氢。其他示例性的反应混合物是Fe2O3+NaOH和H2中的至少一种和FeOOH+NaOH和H2中的至少一种。反应混合物可保持于升高温度(诸如,大约100℃至600℃的范围内)。可通过在反应器的冷点(诸如,保持低于100℃的气体管线)冷凝流来去除H2O产物。在另一个实施方式中,含H2O作为混合物或化合物的内含物或部分的材料(诸如,分散或吸收在点阵(诸如离子化合物,诸如碱卤化物,诸如钾卤化物,诸如KCl的点阵)中的H2O)可伴随着高能粒子的轰击。粒子可包括光子、离子和电子中的至少一种。粒子可包括诸如电子束的束。轰击可提供H2O催化剂、H、和用于形成分数氢的反应的激活中的至少一个。在SF-CIHT电池的实施方式中,H2O含量可以高。可通过高电流点燃H2O,以高速率形成分数氢。
反应混合物还可包括载体(诸如,导电、表面积大的载体)。合适的示例性载体是本公开的载体(诸如,诸如Ni或R-Ni的金属粉末、诸如Ni、Ni celmet、Ni网的金属滤网、碳、诸如TiC和WC的碳化物、和硼化物)。载体可包括诸如Pd/C或Pd/C的解离剂。反应物可具有任何所期望的摩尔比。在实施方式中,化学计量有利于用于形成H2O催化剂的反应完成,以提供用于形成分数氢的H。反应温度可在任何所期望的范围内(诸如,在大约常温至1500℃的范围内)。压力范围可以是诸如大约0.01托至500atm的范围内的任何所期望的。这些反应通过其全部内容以引用方式并入本文中的这里和Mills在先申请(诸如PCT/US08/61455“Hydrogen Catalyst Reactor”(2008年4月24日提交的PCT);PCT/US09/052072“Heterogeneous Hydrogen Catalyst Reactor”(2009年7月29日提交的PCT);PCT/US10/27828“Heterogeneous Hydrogen Catalyst Power System”(2010年3月18日提交的PCT);PCT/US11/28889“Electrochemical Hydrogen Catalyst Power System”(2011年3月17日提交的PCT);PCT/US12/31369“H2O-Based Electrochemical Hydrogen-Catalyst Power System”(2012年3月30日提交);PCT/US13/041938“CIHT Power System”(2013年5月21日提交))中公开的方法是再生和可逆中的至少一个。如本领域的技术人员已知想到的,可通过改变反应条件(诸如,温度和压力)以允许进行消耗H2O的逆反应,使形成H2O的反应是可逆的。例如,逆向反应中,H2O压力可增大,通过再水合,用产物转化反应物。在其他情况下,可通过氧化(诸如,通过与氧和H2O中的至少一种反应),再生被氢还原的产物。在实施方式中,可使反应中不再有逆反应产物,使得继续进行逆或再生反应。因不再有至少一个逆反应产物,即使在没有基于平衡态热力学而有利的情况下,逆反应也会变得有利。在示例性实施方式中,再生的反应物(逆或再生反应产物)包括诸如碱氢氧化物的氢氧化物。可通过诸如熔化或升华的方法,去除氢氧化物。在后一种情况下,碱氢氧化物升华,在大约350℃至400℃的范围内的温度下不变。反应可保持在Mills在先申请的发电站系统中。来自发电电池的热能可向经历再生的至少一个其他电池提供热,如之前所公开的。另选地,可通过由于如之前公开的电池的所选择区域处的冷却剂而改变具有温度梯度的系统设计的水冷壁的温度,使用于形成H2O催化剂的反应和逆再生反应的平衡有移动。
在实施方式中,卤化物和氧化物可经历交换反应。交换反应的产物可彼此分离。可通过加热产物混合物来执行交换反应。可通过升华进行分离,可通过加热和施加真空中的至少一种来驱动升华。在示例性实施方式中,CaBr2和CuO可经历由于加热至诸如大约700℃至900℃的范围内的高温而导致的交换反应,以形成CuBr2和CaO。可使用诸如大约100℃至2000℃的范围内的任何其他合适的温度范围。可通过升华分离和收集CuBr2,可通过施加热和低压来实现升华。CuBr2可形成分离带。CaO可与H2O反应,形成Ca(OH)2。
在实施方式中,固体燃料或含能材料包括单态氧的源。用于产生单态氧的示例性反应是
NaOCl+H2O2→O2+NaCl+H2O (188)
在另一个实施方式中,固体燃料或含能材料包括芬顿反应(Fenton reaction)的源或试剂(诸如,H2O2)。
在实施方式中,使用含H和O中的至少一个的催化剂(诸如H2O)来合成较低能量氢物种和化合物。用于合成示例性较低能量氢化合物MHX的反应混合物(其中,M是碱并且可以是诸如碱土的另一种金属,其中,化合物具有对应的化学计量,H是分数氢(诸如,分数氢氢阴离子),X是诸如卤离子的阴离子)包括M和X的源(诸如,诸如KCl的碱卤化物、诸如碱金属的金属还原物、诸如Ni的氢解离剂(诸如,Ni网或R-Ni)和可选地诸如碳的载体)、诸如可取代M和H2气的至少一种金属氢化物(诸如,MH)的氢的源、和诸如金属氧化物或含氧化合物的氧的源。合适的示例性金属氧化物是Fe2O3、Cr2O3和NiO。反应温度可保持在大约200℃至1500℃或大约400℃至800℃的范围内。反应物可以是任何所期望的比率。用于形成KHCl的反应混合物可包括K、Ni网、KCl、氢气、以及Fe2O3、Cr2O3和NiO中的至少一种。示例性的重量和条件是1.6g K、20g KCl、40g Ni网、金属氧化物(诸如,1.5g Fe2O3和1.5g NiO)中的与K等摩尔数的氧、1atm H2、和大约550-600℃的反应温度。该反应通过H与金属氧化物中的O反应来形成H2O催化剂,并且H与催化剂反应,形成分数氢和分数氢氢阴离子,它们形成产物KHCl。用于形成KHI的反应混合物可包括K、R-Ni、KI、氢气、以及Fe2O3、Cr2O3和NiO中的至少一种。示例性的重量和条件是1g K、20g KI、15g R-Ni 2800、金属氧化物(诸如,1g Fe2O3和1g NiO)中的与K等摩尔数的氧、1atm H2、和大约450-500℃的反应温度。该反应通过H与金属氧化物中的O反应来形成H2O催化剂,并且H与催化剂反应,形成分数氢和分数氢氢阴离子,它们形成产物KHI。在实施方式中,CIHT电池、SF-CIHT电池、固体燃料、或化学电池中的至少一个的产物是造成往高磁场H NMR基质位移的H2(1/4)。在实施方式中,固体基质(诸如,诸如NaOH或KOH的氢氧化物的基质)中存在分数氢物种(诸如,分数氢原子或分子)造成基质质子往高磁场位移。基质质子(诸如,NaOH或KOH的基质的质子)可交换。在实施方式中,位移可造成基质峰在相对于TMS的大约-0.1至-5ppm的范围内。
在实施方式中,可通过添加至少一个H2和H2O来进行氢氧化物和卤化物化合物混合物(诸如,Cu(OH)2+CuBr2)的再生反应。可通过卤化物的升华来分离诸如卤化物和氧化物的产物。在实施方式中,可在加热条件下,在反应混合物中添加H2O,以造成氢氧化物和卤化物(诸如,CuBr2和Cu(OH)2)形成反应产物。在实施方式中,可通过热循环的步骤来实现再生。在实施方式中,诸如CuBr2的卤化物是H2O可溶的,而诸如Cu(OH)2的氢氧化物是不可溶的。可通过过滤或沉淀来分离再生的化合物。可对化学品进行干燥,其中,热能可来自反应。可通过带走水蒸气来恢复热。恢复可以是通过热交换器或者通过使用直接用于加热的蒸气进行的,或者用于使用例如涡轮机和发电机来发电。在实施方式中,通过使用析H2O催化剂来实现用CuO再生Cu(OH)2。合适的催化剂是载体(诸如,Pt/Al2O3和通过烧结CuO和Al2O3而形成的CuAlO2、钴-磷、硼酸钴、甲基硼酸钴、硼酸镍、RuO2、LaMnO3、SrTiO3、TiO2、和WO3)上的贵金属。用于形成析H2O催化剂的示例性方法是电势分别为0.92V和1.15V(相比于正常氢电极)处、pH 9.2的大约0.1M磷酸硼酸钾电解液中的Co2+和Ni2+溶液的受控制电解反应。示例性地,热可逆固体燃料周期是
T 100 2CuBr2+Ca(OH)2→2CuO+2CaBr2+H2O (189)
T 730 CaBr2+2H2O→Ca(OH)2+2HBr (190)
T 100 CuO+2HBr→CuBr2+H2O (191)
T 100 2CuBr2+Cu(OH)2→2CuO+2CaBr2+H2O (192)
T 730 CuBr2+2H2O→Cu(OH)2+2HBr (193)
T 100 CuO+2HBr→CuBr2+H2O (194)
在实施方式中,选择具有作为反应物的H2和作为产物的H2O中的至少一种的固体燃料以及作为反应物和产物中的至少一种的H2或H2O中的一种或更多种的反应混合物,使得任何传统反应的最大理论自由能量是限制试剂的-500至+500kJ/mole范围内或优选地限制试剂的-100至+100kJ/mole的范围内的大约0。反应物和产物的混合物可保持在大致使自由能量是大约0的最佳温度和大致使反应可逆的最佳温度中的一个或更多个,以在至少比在没有保持混合物和温度的情况下的反应时间长的持续时间内得到再生或稳定功率。温度可以在最佳的大约+/-500℃或大约+/-100℃的范围内。示例性的混合物和反应温度是800K的Fe、Fe2O3、H2和H2O的化学计量的混合物和800K的化学计量的Sn、SnO、H2和H2O。
在其中碱金属M(诸如,K或Li)以及(n=整数)、OH、O、2O、O2和H2O中的至少一种用作催化剂的实施方式中,H的源是诸如MH的金属氢化物和金属M和金属氢化物MH中的至少一种与H的源反应形成H中的至少一种。一种产物可以是氧化的M(诸如,氧化物或氢氧化物)。用于形成原子氢和催化剂中的至少一种的反应可以是电子传输反应或氧化还原反应。反应混合物还可包括H2、诸如Ni网或R-Ni的H2解离剂(诸如,本公开的H2解离剂)和诸如这些解离剂和其他以及本公开的载体(诸如,碳和碳化物、硼化物和碳氮化物)的导电载体中的至少一种。M或MH的示例性氧化反应是
4MH+Fe2O3→+H2O+H(1/p)+M2O+MOH+2Fe+M(195)
其中,H2O和M中的至少一个可用作用于形成H(1/p)的催化剂。反应混合物还可包括分数氢的吸气剂,诸如化合物,诸如盐,诸如卤化物盐,诸如碱卤化物盐,诸如KCl或KI。产物可以是MHX(M=诸如碱的金属;X是诸如卤离子的反离子;H是分数氢物种)。其他分数氢催化剂可取代M,诸如本公开的那些,诸如表1中的那些。
在实施方式中,氧的源是化合物,该化合物具有与水的生成热近似的生成热,使得氧源化合物的还原产物和氢之间的氧交换在最小能量释放内出现。合适的示例性氧源化合物是CdO、CuO、ZnO、SO2、SeO2、和TeO2。当H2O催化剂的源是MnOx、AlOx、和SiOx时,诸如金属氧化物的其他还可以是可经历脱水反应的酸或碱的酐。在实施方式中,氧化物层氧源可涵盖诸如金属氢化物(诸如,钯氢化物)的氢的源。可通过加热涂覆氧化物的氢源(诸如,涂覆金属氧化物的钯氢化物)来开始用于形成H2O催化剂和进一步反应形成分数氢的原子H的反应。钯氢化物可通过氢不可渗透层(诸如,金膜的层)被涂覆在氧源的相反侧,以致使释放的氢选择性迁移至氧的源(诸如,诸如金属氧化物的氧化物层)。在实施方式中,用于形成分数氢催化剂的反应和再生反应分别包括氧源化合物和氢之间以及水和还原氧源化合物之间的氧交换。合适的还原氧源是Cd、Cu、Zn、S、Se和Te。在实施方式中,氧交换反应可包括用于用热的方式形成氢气的氧交换反应。示例性的热方法是氧化铁循环、铈(IV)氧化物-铈(III)氧化物循环、锌氧化锌循环、硫-碘循环、铜-氯循环和混合硫循环和本领域的技术人员已知的其他。在实施方式中,用于形成分数氢催化剂的反应和诸如氧交换反应的再生反应同时在同一反应容器中发生。可控制诸如温度和压力的条件,以实现反应的同时性。另选地,可在与功率形成反应的条件不同的条件下发生至少一个其他分离容器中去除和再生产物,如本公开和Mills的在先申请中给出的。
在实施方式中,诸如LiNH2的酰胺的NH2基团用作催化剂,其中,势能是对应于等式(5)中的m=3的大约81.6eV。类似于在酐中添加酸或碱之间的可逆的H2O去除或添加反应(反之亦然),酰胺和亚酰胺或氮化物之间的可逆反应导致形成NH2催化剂,NH2催化剂进一步与原子H反应,形成分数氢。酰胺与亚酰胺和氮化物中的至少一个之间的可逆反应还可用作氢的源(诸如,原子H)。
在实施方式中,通过H以及OH和H2O催化剂中的至少一个的反应,合成诸如分子分数氢或分数氢氢阴离子的分数氢物种。可通过诸如碱、碱土、过渡、内过渡、和稀土金属、Al、Ga、In、Si、Ge、Sn、Pb、As、Sb和Te的金属、诸如LaNi5H6的金属氢化物和本公开的其他金属氢化物、诸如0.1M直至饱和浓度的碱氢氧化物(诸如,KOH)的氢氧化物水溶液、诸如碳、Pt/C、水碳、炭黑、碳化物、硼化物、或腈、和氧的载体的组中的至少两个来生成分数氢物种。用于形成分数氢物种(诸如,分子分数氢)的合适的示例性反应混合物是(1)含O2和不含O2的Co PtC KOH(饱和)、(2)Zn或Sn+LaNi5H6+KOH(饱和)、(3)Co、Sn、Sb、或Zn+O2+CB+KOH(饱和)、(4)Al CB KOH(饱和)、(5)含O2和不含O2的涂覆Sn Ni的石墨KOH(饱和)、(6)Sn+SC或CB+KOH(饱和)+O2、(7)Zn Pt/C KOH(饱和)O2、(8)Zn R-Ni KOH(饱和)O2、(9)Sn LaNi5H6KOH(饱和)O2、(10)Sb LaNi5H6KOH(饱和)O2、(11)Co、Sn、Zn、Pb、或Sb+KOH(饱和溶液)+K2CO3+CB-SA、和(12)LiNH2LiBr和LiH或Li和H2或其源和(可选地)诸如Ni或R-Ni的氢解离剂。另外的反应混合物包括熔融氢氧化物、氢的源、氧的源、和氢解离剂。用于形成分数氢物种(诸如,分子分数氢)的合适的示例性反应混合物是(1)Ni(H2)LiOH-LiBr气体或O2、(2)Ni(H2)NaOH-NaBr气体或O2、和(3)Ni(H2)KOH-NaBr气体或O2。
在实施方式中,用于形成分数氢的化学、SF-CIHT和CIHT电池反应中的至少一种的产物是包括分数氢或较低能量氢物种(诸如,与无机化合物络合的H2(1/p))的化合物。化合物可包括氧离子化合物(诸如,碱或碱土碳酸盐或氢氧化物或本公开的其他这种化合物)。在实施方式中,产物包括M2CO3·H2(1/4)和MOH·H2(1/4)(M=碱或本公开的其他阳离子)络合物中的至少一种。产物可通过ToF-SIMS识别为分别包括和的正谱中的一系列离子,其中,n是整数并且整数和整数p>1可被4取代。在实施方式中,含硅和氧的化合物(诸如,SiO2或石英)可用作H2(1/4)的吸气剂。H2(1/4)的吸气剂可包括过渡金属、碱金属、碱土金属、内部过渡金属、稀土金属、这些金属的组合、诸如Mo合金(诸如,MoCu)的合金、储氢材料(诸如,本公开的储氢材料)。
通过本公开的方法合成的较低能量氢化合物可具有化学式MH、MH2、或M2H2,其中,M是碱阳离子并且H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式MHn,其中,n是1或2,M是碱土阳离子并且H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式MHX,其中,M是碱阳离子,X是中性原子(诸如,卤原子)、分子、或带单个负电荷的阴离子(诸如,卤阴离子)中的一个,H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式MHX,其中,M是碱土阳离子,X是带单个负电荷的阴离子,H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式MHX,其中,M是碱土阳离子,X是带两个负电荷的阴离子,H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式M2HX,其中,M是碱阳离子,X是带单个负电荷的阴离子,H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式MHn,其中,n是整数,M是碱阳离子并且化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式M2Hn,其中,n是整数,M是碱土阳离子并且化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式M2XHn,其中,n是整数,M是碱土阳离子,X是带单个负电荷的阴离子,并且化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式M2X2Hn,其中,n是1或2,M是碱土阳离子,X是带单个负电荷的阴离子,化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式M2X3H,其中,M是碱土阳离子,X是带单个负电荷的阴离子,H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式M2XHn,其中,n是1或2,M是碱土阳离子,X是带两个负电荷的阴离子,化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式M2XX’H,其中,M是碱土阳离子,X是带单个负电荷的阴离子,X’是带两个负电荷的阴离子,H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式MM’Hn,其中,n是从1至3的整数,M是碱土阳离子,M’是碱金属阳离子,化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式MM’XHn,其中,n是1或2,M是碱土阳离子,M’是碱金属阳离子,X是带单个负电荷的阴离子并且化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式MM’XH,其中M是碱土阳离子,M’是碱金属阳离子,X是带两个负电荷的阴离子并且H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式MM’XX’H,其中M是碱土阳离子,M’是碱金属阳离子,X和X’是带单个负电荷的阴离子并且H是键能增加的氢阴离子或键能增加的氢原子。化合物可具有化学式MXX’Hn,其中,n是从1至5的整数,M是碱或碱土阳离子,X是带单个或两个负电荷的阴离子,X’是金属或准金属、过渡元素、内部过渡元素、或稀土元素,化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式MHn,其中,n是整数,M是诸如过渡元素、内部过渡元素、或稀土元素的阳离子,化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式MXHn,其中,n是整数,M是诸如碱阳离子、碱土阳离子的阳离子,X是诸如过渡元素、内部过渡元素、或稀土元素的另一种阳离子,化合物的氢含量Hn包括至少一种键能增加的氢物种。化合物可具有化学式[KHmKCO3]n,其中,m和n均是整数并且化合物的氢含量Hm包括至少一种键能增加的氢物种。化合物可具有化学式其中,m和n均是整数,X是带单个负电荷的阴离子,化合物的氢含量Hm包括至少一种键能增加的氢物种。化合物可具有化学式[KHKNO3]n,其中,n是整数并且化合物的氢含量H包括至少一种键能增加的氢物种。化合物可具有化学式[KHKOH]n,其中,n是整数并且化合物的氢含量H包括至少一种键能增加的氢物种。含阴离子或阳离子的化合物可具有化学式[MHmM'X]n,其中,m和n均是整数,M和M’均是碱或碱土阳离子,X是带单个或两个负电荷的阴离子,化合物的氢含量Hm包括至少一种键能增加的氢物种。含阴离子或阳离子的化合物可具有化学式其中,m和n均是整数,M和M’均是碱或碱土阳离子,X和X'是带单个或两个负电荷的阴离子,化合物的氢含量Hm包括至少一种键能增加的氢物种。阴离子可包括本公开的阴离子中的一种。合适的示例性的带单个负电荷的阴离子是卤素离子、氢氧根离子、碳酸氢根离子、或硝酸根离子。合适的示例性的带两个负电荷的阴离子是碳酸根离子、氧化物、或硫酸根离子。
在实施方式中,键能增加的氢化合物或混合物包括诸如分数氢原子、分数氢氢阴离子、诸如金属或离子格的点阵(诸如,晶格)中嵌入的二分数氢分子的至少一种较低能量的氢物种。在实施方式中,点阵不与较低能量的氢物种反应。基质可以在诸如嵌入式分数氢氢阴离子的情况中是质子惰性的。化合物或混合物可包括嵌入诸如碱或碱土盐(诸如,卤化物)的盐点阵中的H(1/p)、H2(1/p)、和H-(1/p)中的至少一种。示例性的碱卤化物是KCl和KI。在嵌入式H-(1/p)的情况下,盐可不含任何H2O。其他合适的盐点阵包括本公开的点阵。可通过氢与非质子催化剂(诸如,表1的那些)的催化作用,形成较低能量的氢物种。
本发明的化合物优选地单纯地大于0.1原子百分率。更优选地,化合物单纯地大于1原子百分率。甚至更优选地,化合物单纯地大于10原子百分率。最优选地,化合物单纯地大于50原子百分率。在另一个实施方式中,化合物单纯地大于90原子百分率。在另一个实施方式中,化合物单纯地大于95原子百分率。
在用于形成分数氢的化学反应器的另一个实施方式中,用于形成分数氢并且释放动力(诸如,热动力)的电池包括内燃机、火箭引擎、或燃气涡轮机的燃烧腔室。反应混合物包括用于生成催化剂和分数氢的氢的源和氧的源。催化剂的源可以是含氢物种和含氧物种中的至少一种。物种或其他反应产物可以是含O和H中的至少一个的物种中的至少一种(诸如,H2、H、H+、O2、O3、O、O+、H2O、H3O+、OH、OH+、OH-、HOOH、OOH-、O-、O2-、和)。催化剂可包括氧或氢物种(诸如,H2O)。在另一个实施方式中,催化剂包括nH(n=整数)、O2、OH、和H2O催化剂中的至少一种。氢的源(诸如,氢原子的源)可包括含氢燃料(诸如,H2气或烃)。可通过烃燃烧期间烃的高温分解来生成氢原子。反应混合物还可包括氢解离剂(诸如,本公开的解离剂)。还可通过氢的解离来形成H原子。O的源还可包括空气中的O2。反应物还可包括可用作H和O中的至少一个的源的H2O。在实施方式中,水用作可通过电池中的H2O的高温分解而供应的氢和氧中的至少一种的其他源。可在表面(诸如,气缸或活塞头部)上用热或催化的方式将水解离成氢原子。该表面可包括用于将水解离成氢和氧的材料。水解离材料可包括元素、化合物、合金、或过渡元素或内部过渡元素的混合物、铁、铂、钯、锆、钒、镍、钛、Sc、Cr、Mn、Co、Cu、Zn、Y、Nb、Mo、Tc、Ru、Rh、Ag、Cd、La、Hf、Ta、W、Re、Os、Ir、Au、Hg、Ce、Pr、Nd、Pm、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Vb、Lu、Th、Pa、U、活性炭(碳)、或Cs插层型碳(石墨)。H和O可反应形成用于形成分数氢的催化剂和H。可通过对应口或进气口(诸如,进气阀或歧管)吸入氢和氧的源。可通过排放口或出口排放出产物。可通过控制通过各个口的进气和出气速率来控制流量。
在实施方式中,通过加热催化剂的源和氢的源(诸如,本公开的固体燃料)来形成分数氢。加热可以是热加热和冲击加热中的至少一种。通过实验,Raman光谱确认通过对诸如氢氧化物和卤化物的混合物(诸如,包括诸如Li的碱金属的混合物)的固体燃料进行球磨来形成分数氢。例如,观察2308cm-1处的用球磨后的LiOH+LiI和LiOH+LiF的逆Raman效应的峰。因此,合适的示例性混合物是LiOH+LiI或LiF。在实施方式中,通过快速反应来实现热和冲击加热中的至少一个。在这种情况下,通过形成分数氢,提供另外的含能反应。
VII.固体燃料催化剂诱导的分数氢转换(SF-CIHT)电池和动力转换器
在实施方式中,产生直接电能和热能中的至少一个的动力系统包括:至少一个容器;反应物,其包括(a)至少一个催化剂的源或含新生H2O的催化剂;(b)至少一个原子氢的源或原子氢;(c)导体和导电基质中的至少一个;至少一组电极,其用于限制分数氢反应物;电源,其用于传递高电流电能的短脉冲;重装载系统;至少一个系统,其用于用反应产物再生初始反应物;至少一个直接转换器(诸如,诸如PDC的等离子体-电力转换器、光伏转换器和至少一个热-电力转换器中的至少一个)。在其他实施方式中,容器能够具有大气压、超过大气压和低于大气压中的至少一个的压力。在实施方式中,再生系统可包括水合、热、化学和电化学系统中的至少一个。在另一个实施方式中,至少一个直接等离子体-电力转换器可包括等离子体动力学功率转换器、直接转换器、磁流体动力学功率转换器、磁流体磁镜动力学功率转换器、电荷漂移转换器、Post或Venetian Blind功率转换器、振动陀螺仪、光子集束微波功率转换器和光电转换器构成的组中的至少一种。在其他实施方式中,至少一个热-电力转换器可包括热力发动机、蒸气发动机、蒸气涡轮机和发电机、气体涡轮机和发电机、Rankine循环发动机、Brayton循环发动机、Stirling发动机、热离子功率转换器、和热电功率转换器构成的组中的至少一种。
在实施方式中,在以热、等离子体和电磁(光)功率中的至少一种的形式释放高能量的情况下,点燃H2O,形成分数氢。(本公开中的“点燃”表示H到分数氢的非常高的反应速率,可表现为脉冲、脉动或其他形式的高功率释放)。H2O可包括可通过施加高电流(诸如,大约2000A至100,000A的范围内的高电流)点燃的燃料。这可通过施加诸如5,000至100,000V的高压以首先形成高导电的等离子体(诸如,电弧)来实现。另选地,高电流可经过包括H2O的化合物或混合物,其中,诸如固体燃料的所得燃料的导电性高。(在本公开中,使用固体燃料或含能材料来指代形成进一步反应形成分数氢的诸如HOH和H的催化剂的反应混合物。然而,反应混合物可包括除了固体外的物体状态。在实施方式中,反应混合物可以是气态、液体、固体、浆液、溶胶凝胶、溶液、混合物、气态悬浮、气动流、和本领域的技术人员已知的其他状态中的至少一种状态)。在实施方式中,具有非常低的电阻的固体燃料包括含H2O的反应混合物。低电阻可以是由于反应混合物的导体成分导致的。在实施方式中,固体燃料的电阻是大约10-9欧姆至100欧姆、10-8欧姆至10欧姆、10-3欧姆至1欧姆、10-4欧姆至10-1欧姆、和10-4欧姆至10-2欧姆的范围内的至少一个。在另一个实施方式中,具有高电阻的燃料包括含痕量或微量摩尔百分比的添加的化合物或材料的H2O。在后一种情况下,高电流可流过燃料,通过致使击穿实现点燃,以形成高度导电状态(诸如,电弧或电弧等离子体)。
在实施方式中,反应物可包括H2O的源和导电基质,以形成催化剂的源、催化剂、原子氢的源和原子氢中的至少一个。在其他实施方式中,包括H2O的源的反应物可包括以下中的至少一种:体相H2O、除了体相H2O外的状态、经历用于形成H2O和释放结合H2O的反应中的至少一个的化合物或多种化合物。另外,结合H2O可包括与H2O相互作用的化合物,其中,H2O处于吸附H2O、结合H2O、物理吸附H2O、和水合水中的至少一个的状态。在实施方式中,反应物可包括导体和一种或更多种化合物或材料,这些化合物或材料经历释放的体相H2O、吸附H2O、结合H2O、物理吸附H2O和水合水中的至少一个并且其反应产物是H2O。在其他实施方式中,新生H2O催化剂的源和原子氢的源中的至少一个可包括(a)至少一个H2O的源、(b)至少一个氧的源和(c)至少一个氢的源中的至少一个。
在另外的实施方式中,用于形成催化剂的源、催化剂、原子氢的源和原子氢中的至少一个的反应物包括以下中的至少一种:H2O和H2O的源;O2、H2O、HOOH、OOH-、过氧离子、超氧离子、氢化物、H2、卤化物、氧化物、氢氧化合物、氢氧化物、含氧化合物、水合化合物、选自卤化物、氧化物、氢氧化合物、氢氧化物、含氧化合物中的至少一个的组的水合化合物;导电基质。在某些实施方式中,氢氧化合物可包括TiOOH、GdOOH、CoOOH、InOOH、FeOOH、GaOOH、NiOOH、AlOOH、CrOOH、MoOOH、CuOOH、MnOOH、ZnOOH、和SmOOH的组中的至少一个;氧化物可包括CuO、Cu2O、CoO、Co2O3、Co3O4、FeO、Fe2O3、NiO、和Ni2O3的组中的至少一个;氢氧化物可包括Cu(OH)2、Co(OH)2、Co(OH)3、Fe(OH)2、Fe(OH)3、和Ni(OH)2的组中的至少一个;含氧化合物可包括硫酸盐、磷酸盐、硝酸盐、碳酸盐、碳酸氢盐、铬酸盐、焦磷酸盐、过硫酸盐、高氯酸盐、过溴酸盐、和高碘酸盐、MXO3、MXO4(M=诸如碱金属(诸如,Li、Na、K、Rb、Cs)的金属;X=F、Br、Cl、I)、钴镁氧化物、镍镁氧化物、铜镁氧化物、Li2O、碱金属氧化物、碱土金属氧化物、CuO、CrO4、ZnO、MgO、CaO、MoO2、TiO2、ZrO2、SiO2、Al2O3、NiO、FeO、Fe2O3、TaO2、Ta2O5、VO、VO2、V2O3、V2O5、P2O3、P2O5、B2O3、NbO、NbO2、Nb2O5、SeO2、SeO3、TeO2、TeO3、WO2、WO3、Cr3O4、Cr2O3、CrO2、CrO3、CoO、Co2O3、Co3O4、FeO、Fe2O3、NiO、Ni2O3、稀土氧化物、CeO2、La2O3、氢氧化合物、TiOOH、GdOOH、CoOOH、InOOH、FeOOH、GaOOH、NiOOH、AlOOH、CrOOH、MoOOH、CuOOH、MnOOH、ZnOOH、和SmOOH的组中的至少一个,导电基质可包括金属粉末、碳、碳化物、硼化物、氮化物、诸如TiCN的甲腈、或腈的组中的至少一个。
在实施方式中,反应物可包括金属、其金属氧化物和H2O的混合物,其中,金属与H2O的反应就热力学而言是不利的。在其他实施方式中,反应物可包括金属、金属卤化物和H2O的混合物,其中,金属与H2O的反应就热力学而言是不利的。在另外的实施方式中,反应物可包括过渡金属、碱土金属卤化物和H2O的混合物,其中,金属与H2O的反应就热力学而言是不利的。并且,在其他实施方式中,反应物可包括导体、吸湿材料和H2O的混合物。在实施方式中,导体可包括金属粉末或碳粉末,其中,金属或碳与H2O的反应就热力学而言是不利的。在实施方式中,吸湿材料可包括溴化锂、氯化钙、氯化镁、氯化锌、碳酸钾、磷酸钾、诸如KMgCl3·6(H2O)的光卤石、柠檬酸铁铵、氢氧化钾和氢氧化钠和浓硫酸和磷酸、纤维素纤维、糖、焦糖、蜂蜜、甘油、乙醇、甲醇、柴油燃料、甲基苯丙胺、肥料化学品、盐、干燥剂、二氧化硅、活性炭、硫酸钙、氯化钙、分子筛、沸石、潮解材料、氯化锌、氯化钙、氢氧化钾、氢氧化钠和潮解盐的组中的至少一个。在某些实施方式中,动力系统可包括导体、吸湿材料和H2O的混合物,其中,(金属/导体)、(吸湿材料)、(H2O)的相对摩尔量的范围是大约(0.000001至100000)、(0.000001至100000)、(0.000001至100000);(0.00001至10000)、(0.00001至10000)、(0.00001至10000);(0.0001至1000)、(0.0001至1000)、(0.0001至1000);(0.001至100)、(0.001至100)、(0.001至100);(0.01至100)、(0.01至100)、(0.01至100);(0.1至10)、(0.1至10)、(0.1至10);(0.5至1)、(0.5至1)、(0.5至1)中的至少一个。在某些实施方式中,与水的反应就热力学而言不利的金属可以是Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的组中的至少一个。在另外的实施方式中,可通过添加H2O来再生反应物。
在其他实施方式中,反应物可包括金属、其金属氧化物和H2O的混合物,其中,金属氧化物能够在低于1000℃的温度下进行H2还原。在其他实施方式中,反应物可包括不容易在轻微热的情况下被H2还原的氧化物、其氧化物在低于1000℃的温度下能够被H2还原成金属的金属、和H2O的混合物。在实施方式中,其氧化物在低于1000℃的温度下能够被H2还原成金属的金属可以是Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的组中的至少一个。在实施方式中,不容易在轻微热的情况下被H2还原的金属氧化物包括氧化铝、碱土氧化物和稀土氧化物中的至少一个。
在实施方式中,固体燃料可包括碳或活性碳和H2O,其中,通过在添加H2O的情况下进行再水合来再生混合物。在其他实施方式中,反应物可包括浆液、溶液、乳液、复合物和化合物中的至少一个。在实施方式中,用于传递高电流电能的短脉冲的电源的电流充分大,足以致使分数氢反应物经历非常高速的形成分数氢的反应。在实施方式中,用于传递高电流电能的短脉冲的电源包括以下中的至少一个:被选择成致使100A至1,000,000A、1kA至1,00,000A、10kA至50kA中的至少一个的范围内的电流的高AC、DC、或AC-DC混合的电压;在100A/cm2至1,000,000A/cm2、1000A/cm2至100,000A/cm2、和2000A/cm2至50,000A/cm2中的至少一个的范围内的DC或峰值AC电流密度;通过固体燃料或含能材料的导电性确定电压,其中,通过所期望电流乘以固体燃料或含能材料样本的电阻来给出电压;DC或峰值AC电压可以在从大约0.1V至500kV、0.1V至100kV和1V至50kV中选择的至少一个范围内,并且AC频率可以在大约0.1Hz至10GHz、1Hz至1MHz、10Hz至100kHz、和100Hz至10kHz的范围内。在实施例中,固态燃料或含能材料样本的电阻在从大约0.001毫欧至100兆欧、0.1欧姆至1兆欧和10欧姆至1千欧中选择的至少一个范围,并且有效用于形成分数氢的每电极面积的合适负载的导电率在从大约10-10ohm-1cm-2至106ohm-1cm-2、10-5ohm-1cm-2至106ohm-1cm-2、10-4ohm-1cm-2至105ohm-1cm-2、10-3ohm-1cm-2至104ohm-1cm-2、10-2ohm-1cm-2至103ohm-1cm-2、10-1ohm-1cm-2至102ohm-1cm-2、和1ohm-1cm-2至10ohm-1cm-2中选择的至少一个范围。
在实施方式中,固体燃料是导电的。在实施方式中,固体燃料的一部分、小球、或部分的电阻是在大约10-9ohm至100ohms、10-8ohm至10ohm、10-3ohm至1ohm、10-3ohm至10-1ohm、和10-3ohm至10-2ohm的至少一个范围内。在实施例中,分数氢反应速率取决于高电流的施加或形成。可由通过导电燃料的低电压、高电流流来启动分数氢催化反应(诸如,含能分数氢催化反应)。能量释放可以非常高,并且可形成冲击波。在实施方式中,选择电压,以致使造成点燃的电流(诸如,高电流)的高AC、DC、或AC-DC混合在100A至1,000,000A、1kA至100,000A、10kA至50kA中的至少一个范围内。电流密度可在可包括小球(诸如,被施压小球)的燃料的100A/cm2至1,000,000A/cm2、1000A/cm2至100,000A/cm2、和2000A/cm2至50,000A/cm2、的至少一个范围内。DC或峰值AC电压可在从大约0.1V至100kV V、0.1V至1kV、0.1V至100V、和0.1V至15V中选择的至少一个范围内。AC频率可在大约0.1Hz至10GHz、1Hz至1MHz、10Hz至100kHz、和100Hz至10kHz的范围内。脉冲时间可在从大约10-6s至10s、10-5s至1s、10-4s至0.1s、和10-3s至0.01s中选择的至少一个范围内。
在实施方式中,固体燃料或含能材料可包括H2O的源或H2O。H2O摩尔%含量可在大约0.000001%至100%、0.00001%至100%、0.0001%至100%、0.001%至100%、0.01%至100%、0.1%至100%、1%至100%、10%至100%、0.1%至50%、1%至25%、和1%至10%的至少一个范围内。在实施方式中,分数氢反应速率取决于高电流的施加或形成。在实施方式中,选择电压,以致使在100A至1,000,000A、1kA至100,000A、10kA至50kA中的至少一个范围内的电流的高AC、DC、或AC-DC混合。DC或峰值AC电流密度可在100A/cm2至1,000,000A/cm2、1000A/cm2至100,000A/cm2、和2000A/cm2至50,000A/cm2中的至少一个的范围内。在实施方式中,通过固体燃料或含能材料的导电性来确定电压。固态燃料或含能材料样本的电阻在从大约0.001毫欧至100兆欧、0.1欧姆至1兆欧和10欧姆至1千欧中选择的至少一个范围。有效用于形成分数氢的每电极面积的合适负载的导电率在从大约10-10ohm-1cm-2至106ohm-1cm-2、10-5ohm-1cm-2至106ohm-1cm-2、10-4ohm-1cm-2至105ohm-1cm-2、10-3ohm-1cm-2至104ohm-1cm-2、10-2ohm-1cm-2至103ohm-1cm-2、10-1ohm-1cm-2至102ohm-1cm-2、和1ohm-1cm-2至10ohm-1cm-2中选择的至少一个范围内。在实施方式中,通过所期望电流乘以固体燃料或含能材料样本的电阻来给出电压。在电阻是大约1兆欧的示例性情况下,电压低(诸如<10V)。在其中电阻基本上无限的基本上纯H2O的示例性情况下,为了实现用于点燃的高电流而施加的电压高(诸如,超过诸如大约5kV或更高的H2O的击穿电压)。在实施方式中,DC或峰值AC电压可在从大约0.1V至500kV、0.1V至100kV、和1V至50kV中选择的至少一个范围内。AC频率可在大约0.1Hz至10GHz、1Hz至1MHz、10Hz至100kHz、和100Hz至10kHz的范围内。在实施方式中,DC电压被放电,形成包括离子化H2O的等离子体,其中,电流欠阻尼并且在它衰减时振荡。
在实施方式中,通过诸如超级电容器的电容器放电来实现高电流脉冲,这些电容器可进行串联和并联连接中的至少一者,以实现所期望电压和电流,其中,该电流可以是DC或用诸如本领域的技术人员已知的变压器(诸如,低电压变压器)的电路元件进行调节。可通过诸如电网、发电机、燃料电池、或电池的电源对电容器进行充电。在实施方式中,电池供应电流。在实施方式中,可通过调节电容器或电池的输出的功率来实现合适的频率、电压和电流波形。
固体燃料或含能材料可包括导体或导电基质或载体(诸如,金属、碳、或碳化物)和诸如可反应形成H2O或可释放结合H2O的一种或多种化合物(诸如,本公开的化合物)的H2O或H2O的源。固体燃料可包括H2O、与H2O相互作用的化合物或材料、和导体。H2O可按除了体相H2O外的状态(诸如,诸如物理吸附H2O或水合水的吸附或结合H2O)存在。另选地,在高度导电或通过施加合适电压而高度导电的混合物中,H2O可作为体相H2O存在。固体燃料可包括H2O和提供高导电率的材料或化合物(诸如,金属粉末或碳)和有助于形成H和(可能地)HOH催化剂的材料或化合物(诸如,诸如金属氧化物的氧化物)。示例性的固体燃料可包括仅仅R-Ni和添加剂(诸如过渡金属和Al的添加剂),其中,R-Ni通过水合Al2O3和Al(OH)3的分解来释放H和HOH。合适的示例性固体燃料包括至少一种氢氧化合物(诸如,TiOOH、GdOOH、CoOOH、InOOH、FeOOH、GaOOH、NiOOH、AlOOH、CrOOH、MoOOH、CuOOH、MnOOH、ZnOOH、和SmOOH)和导电基质(诸如,金属粉末和碳粉末中的至少一种)和可选地H2O。固体燃料可包括至少一种氢氧化物(诸如,诸如Cu(OH)2、Co(OH)2、Co(OH)3、Fe(OH)2、和Ni(OH)2中的至少一种的过渡金属氢氧化物)、导体(诸如,碳粉末和金属粉末中的至少一种)和可选地H2O。固体燃料可包括至少一种氧化物(诸如,诸如CuO、Cu2O、NiO、Ni2O3、FeO和Fe2O3中的至少一种的过渡金属氧化物中的至少一种)、诸如Al(OH)3的氢氧化铝、导体(诸如,碳粉末和金属粉末中的至少一种)和H2O。固体燃料可包括至少一种卤化物(诸如,诸如碱土金属卤化物(诸如,MgCl2)的金属卤化物)、导体(诸如,碳粉末和诸如Co或Fe的金属粉末中的至少一种)和H2O。固体燃料可包括固体燃料(诸如含氢氧化物、氢氧化合物、氧化物和诸如金属卤化物的卤化物中的至少两种、和至少一种导体或导电基质的固体燃料)和H2O的混合物。导体可包括涂覆有反应混合物的其他组分中的一个或更多个的金属筛网中的至少一种,该反应混合物包括本领域的技术人员已知的固体燃料、R-Ni、诸如过渡金属粉末的金属粉末、Ni或Co多孔金属、碳、或碳化物或其他导体、或导电载体或导电基质。在实施方式中,基于H2O的固体燃料的至少一种导体包括诸如金属粉末(诸如,诸如Cu、Al和Ag的过渡金属中的至少一种)的金属。
在实施方式中,固体燃料包括诸如活性碳的碳和H2O。在在真空或惰性气氛中发生点燃而形成等离子体的情况下,等离子体-电生成之后,用等离子体凝聚而成的碳可再水合,在再生周期中重组固体。固态燃料可包括酸性、碱性、或中性H2O和活性碳、木炭、软材木炭、经蒸汽和氢中的至少一种处理后的碳、和金属粉末的混合物中的至少一种。在实施方式中,碳-金属混合物中的金属至少部分不与H2O反应。至少部分稳定趋于与H2O反应的合适金属是Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的组中的至少一种。可通过再水合(包括添加)H2O,再生混合物。
在实施方式中,基本所需的反应物是允许高电流在点燃期间渗透材料的H的源、O的源、和良好导体基质。固体燃料或含能材料可被容纳在密封容器(诸如,诸如密封铝容器的密封金属容器)中。固体燃料或含能材料可通过诸如通过点焊机形成的低电压、高电流脉冲(诸如,通过Taylor-Winfield model ND-24-75点焊机的两个铜电极之间的限制实现的并且经受低电压、高电流电能的短脉冲)反应。60Hz电压可以是大约5至20V RMS并且电流可以是大约10,000至40,000A/cm2。
示例性的含能材料和条件是作为浆液涂覆在Ni筛网网片上并且进行干燥随后经受大约60Hz、8V RMS和40,000A/cm2的电脉冲的TiOOH、GdOOH、CoOOH、InOOH、FeOOH、GaOOH、NiOOH、AlOOH、CrOOH、MoOOH、CuOOH、MnOOH、ZnOOH、SmOOH、Ni2O3.H2O、La2O3.H2O和Na2SO4.H2O中的至少一种。
在实施方式中,固体燃料或含能材料包括H2O和用于形成新生H2O和H的分散剂和解离剂。合适的示例性分散剂和解离剂是诸如金属卤化物(诸如,诸如溴化物(诸如,FeBr2)的过渡金属卤化物)的卤化物化合物、形成诸如CuBr2的水合物的化合物、和诸如具有能够有多重氧化状态的金属的氧化物和卤化物的化合物。其他包括氧化物、氢氧化合物、或氢氧化物(诸如,诸如CoO、Co2O3、Co3O4、CoOOH、Co(OH)2、Co(OH)3、NiO、Ni2O3、NiOOH、Ni(OH)2、FeO、Fe2O3、FeOOH、Fe(OH)3、CuO、Cu2O、CuOOH、和Cu(OH)2的过渡元素的氧化物、氢氧化合物、或氢氧化物)。在其他实施方式中,过渡金属被诸如碱、碱土、内过渡、和稀土金属、和13和14族金属的另一种金属取代。合适的示例是La2O3、CeO2和LaX3(X=卤化物)。在另一个实施方式中,固体燃料或含能材料包括作为无机化合物(诸如,氧化物、氢氧化合物、氢氧化物、或卤化物)的水合物的H2O。其他合适水合物是本公开的金属化合物(诸如,硫酸盐、磷酸盐、硝酸盐、碳酸盐、碳酸氢盐、铬酸盐、焦磷酸盐、过硫酸盐、次氯酸盐、亚氯酸盐、氯酸盐、过氯酸盐、次溴酸盐、溴酸盐、溴酸酯、过氯酸盐、次碘酸盐、碘酸盐、碘酸酯、高碘酸盐、硫酸氢盐、磷酸氢盐或磷酸二氢盐、与阳离子的其他金属化合物、和金属卤化物的组中的至少一种)。分散剂和解离剂(诸如,金属氧化物或卤化物化合物)的摩尔比是是引起点燃事件的任何期望的摩尔比。至少一种化合物的摩尔数与H2O的摩尔数的合适比率在大约0.000001至100000、0.00001至10000、0.0001至1000、0.01至100、0.1至10、和0.5至1的至少一个范围内,其中,该比率被定义为(化合物的摩尔数/H2O的摩尔数)。固体燃料或含能材料还可包括本领域的技术人员已知的导体或导电基质(诸如,诸如过渡金属粉末的金属粉末、Ni或Co多孔金属、碳粉末、或碳化物或其他导体、或导电载体或导电基质中的至少一种)。含至少一种化合物和H2O的水合化合物的摩尔数与导体的摩尔数的合适比率在大约0.000001至100000、0.00001至10000、0.0001至1000、0.01至100、0.1至10、和0.5至1的至少一个范围内,其中,该比率被定义为(水合化合物的摩尔数/导体的摩尔数)。
在实施方式中,通过添加H2O用产物来再生反应物。在实施方式中,固体燃料或含能材料包括H2O和适于使本公开的低电压、高电流流过水合材料以导致点燃的导电基质。导电基质材料可以是金属表面、金属粉末、碳、碳粉末、碳化物、硼化物、氮化物、诸如TiCN的甲腈、腈、本公开的或者本领域的技术人员已知的另一种中的至少一种。添加H2O以形成固体燃料或含能材料或用产物再生它可以是连续或间歇的。
固体燃料或含能材料可包括导电基质、氧化物(诸如,诸如过渡金属和其氧化物中的至少一种的金属(诸如,选自Fe、Cu、Ni或Co的金属)和对应金属氧化物的混合物)和H2O的混合物。H2O可以是水合氧化物的形式。在其他实施方式中,金属/金属氧化物反应物包括与对应于能够容易地被还原成金属的氧化物的H2O的反应率低的金属,或该金属在分数氢反应期间不氧化。具有低H2O反应率的合适示例性金属是选自Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr的金属。金属可在反应期间被转换成氧化物。可通过本领域的技术人员已知的系统和方法用氢反应将对应于金属反应物的氧化物产物再生成初始金属。可在升高温度下进行氢还原。可通过电解H2O来供应氢。在另一个实施方式中,通过碳还原、与诸如更具氧活性金属的还原物进行的还原、或者通过电解(熔盐中进行的电解)用氧化物再生金属。可通过本领域的技术人员已知的系统和方法用氧化物来实现形成金属。金属与金属氧化物与H2O的摩尔量是当经受如本公开中给出的低电压、高电流电脉冲时导致点燃的任何所期望摩尔量。(金属)、(金属氧化物)、(H2O)的相对摩尔量的合适范围是大约(0.000001至100000)、(0.000001至100000)、(0.000001至100000);(0.00001至10000)、(0.00001至10000)、(0.00001至10000);(0.0001至1000)、(0.0001至1000)、(0.0001至1000);(0.001至100)、(0.001至100)、(0.001至100);(0.01至100)、(0.01至100)、(0.01至100);(0.1至10)、(0.1至10)、(0.1至10);(0.5至1)、(0.5至1)、(0.5至1)中的至少一个。固体燃料或含能材料可包括浆液、溶液、乳液、复合物和化合物中的至少一种。
固体燃料或含能材料可包括导体基质、卤化物(诸如,第一金属和对应的第一金属卤化物或第二金属卤化物的混合物)和H2O的混合物。H2O可以是水合卤化物的形式。第二金属卤化物可比第一金属卤化物更稳定。在实施方式中,第一金属与对应于能够容易地被还原成金属的氧化物的H2O的反应率低,或该金属在分数氢反应期间不氧化。具有低H2O反应率的合适示例性金属是选自Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr的金属。金属与金属卤化物与H2O的摩尔量是当经受如本公开中给出的低电压、高电流电脉冲时导致点燃的任何所期望摩尔量。(金属)、(金属卤化物)、(H2O)的相对摩尔量的合适范围是大约(0.000001至100000)、(0.000001至100000)、(0.000001至100000);(0.00001至10000)、(0.00001至10000)、(0.00001至10000);(0.0001至1000)、(0.0001至1000)、(0.0001至1000);(0.001至100)、(0.001至100)、(0.001至100);(0.01至100)、(0.01至100)、(0.01至100);(0.1至10)、(0.1至10)、(0.1至10);(0.5至1)、(0.5至1)、(0.5至1)中的至少一个。固体燃料或含能材料可包括浆液、溶液、乳液、复合物和化合物中的至少一种。
在实施方式中,固体燃料或含能材料可包括导体(诸如,诸如金属或碳的本公开的导体)、亲水材料、和H2O。合适的示例性亲水材料是溴化锂、氯化钙、氯化镁、氯化锌、碳酸钾、磷酸钾、诸如KMgCl3·6(H2O)的光卤石、柠檬酸铁铵、氢氧化钾和氢氧化钠和浓硫酸和磷酸、纤维素纤维(诸如,棉和纸)、糖、焦糖、蜂蜜、甘油、乙醇、甲醇、柴油燃料、甲基苯丙胺、许多肥料化学品、盐(包括食盐)和本领域的技术人员已知的各种各样的其他物质以及解离剂(诸如,二氧化硅、活性炭、硫酸钙、氯化钙、和分子筛(典型地,沸石)或潮解材料(诸如,氯化锌、氯化钙、氢氧化钾、氢氧化钠)和本领域的技术人员已知的许多不同潮解盐。(金属)、(亲水材料)、(H2O)的相对摩尔量的合适范围是大约(0.000001至100000)、(0.000001至100000)、(0.000001至100000);(0.00001至10000)、(0.00001至10000)、(0.00001至10000);(0.0001至1000)、(0.0001至1000)、(0.0001至1000);(0.001至100)、(0.001至100)、(0.001至100);(0.01至100)、(0.01至100)、(0.01至100);(0.1至10)、(0.1至10)、(0.1至10);(0.5至1)、(0.5至1)、(0.5至1)中的至少一个。固体燃料或含能材料可包括浆液、溶液、乳液、复合物和化合物中的至少一种。
在示例性的含能材料中,在密封在铝DSC盘(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、非密封(Setaram,S08/HBB37409))并且使用Taylor-Winfield model ND-24-75点焊机在大约8V RMS下的15,000至25,000A之间的电流点燃的20mg的Co3O4或CuO中添加0.05ml(50mg)的H2O。观察到将样本(均作为含能的高度电离的膨胀等离子体)蒸发的大能量脉冲。以与类似结果相同的方式点燃的另一种示例性固体燃料包括密封在铝DSC盘(71.1mg)(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、非密封(Setaram,S08/HBB37409))中的Cu(42.6mg)+CuO(14.2mg)+H2O(16.3mg)。
在实施方式中,固体燃料或含能材料包括新生H2O催化剂的源和H的源。在实施方式中,固体燃料或含能材料是导电的或者包括致使新生H2O催化剂的源和H的源的混合物导电导电基质材料。新生H2O催化剂的源和H的源中的至少一种的源是化合物或化合物的混合物和含至少O和H的材料。含O的化合物或材料可以是氧化物、氢氧化物、和氢氧化合物中的至少一种,诸如碱、碱土、过渡金属、内过渡金属、稀土金属、和13和14族金属氧化物、氢氧化物和氢氧化合物。含O的化合物或材料可以是硫酸盐、磷酸盐、硝酸盐、碳酸盐、碳酸氢盐、铬酸盐、焦磷酸盐、过硫酸盐、高氯酸盐、过溴酸盐、和高碘酸盐、MXO3、MXO4(M=诸如碱金属(诸如,Li、Na、K、Rb、Cs)的金属;X=F、Br、Cl、I)、钴镁氧化物、镍镁氧化物、铜镁氧化物、Li2O、碱金属氧化物、碱土金属氧化物、CuO、CrO4、ZnO、MgO、CaO、MoO2、TiO2、ZrO2、SiO2、Al2O3、NiO、FeO、Fe2O3、TaO2、Ta2O5、VO、VO2、V2O3、V2O5、P2O3、P2O5、B2O3、NbO、NbO2、Nb2O5、SeO2、SeO3、TeO2、TeO3、WO2、WO3、Cr3O4、Cr2O3、CrO2、CrO3、诸如CeO2或La2O3的稀土氧化物、诸如TiOOH、GdOOH、CoOOH、InOOH、FeOOH、GaOOH、NiOOH、AlOOH、CrOOH、MoOOH、CuOOH、MnOOH、ZnOOH、和SmOOH的氢氧化合物。H的示例性源是H2O,具有结合或吸附H2O的化合物(诸如,水合物、氢氧化物、氢氧化合物、或硫酸氢盐、磷酸氢根或磷酸二氢根、和碳氢化合物)。导电基质材料可以是金属粉末、碳、碳粉末、碳化物、硼化物、氮化物、诸如TiCN的甲腈、或腈中的至少一种。在不同的实施方式中,本公开的导体可以是致使包括具有导体的混合物的固体燃料或含能材料导电的不同物理形式(诸如,块、颗粒、粉末、纳米粉末、本领域的技术人员已知的其他形式)。
示例性的固体燃料或含能材料包括H2O和导电基质中的至少一种。在示例性实施方式中,固体燃料包括H2O和金属导体,诸如过渡金属,诸如Fe,诸如Fe金属粉末导体形式和Fe化合物(诸如,氢氧化铁、氧化铁、羟基氧化铁、和卤化铁),其中,后者可作为用作H2O的源的水合物来取代H2O。其他金属可取代Fe,这些金属处于它们物理形式(诸如,金属和化合物)以及状态(诸如,块、片、筛网、网片、布线、颗粒、粉末、纳米粉末和固体、液体和气体)中的任一种。导体可包括一种或更多种物理形式的碳(诸如,块状碳、颗粒碳、碳粉末、碳气凝胶、碳纳米管、活性碳、石墨、KOH活性碳或纳米管、碳化物衍生碳、碳纤维布、和富勒烯中的至少一种)。合适的示例性固体燃料或含能材料是CuBr2+H2O+导电基质;Cu(OH)2+FeBr2+导电基质材料(诸如,碳或金属粉末);FeOOH+导电基质材料(诸如,碳或金属粉末);Cu(OH)Br+导电基质材料(诸如,碳或金属粉末);AlOOH或Al(OH)3+Al粉末(其中,向反应供应添加的H2,以通过Al与通过AlOOH或Al(OH)3的分解而形成的H2O反应来形成分数氢);可以被蒸汽激活的导电纳米颗粒(诸如,碳纳米管和富勒烯)中的H2O和金属化沸石中的H2O(其中,可使用分散剂来润湿诸如碳的亲水材料);NH4NO3+H2O+NiAl合金粉末;LiNH2+LiNO3+Ti粉末;LiNH2+LiNO3+Pt/Ti;LiNH2+NH4NO3+Ti粉末;BH3NH3+NH4NO3;BH3NH3+CO2、SO2、NO2、以及硝酸盐、碳酸盐、硫酸盐;LiH+NH4NO3+过渡金属、稀土金属、Al或其他可氧化金属;NH4NO3+过渡金属、稀土金属、Al或其他可氧化金属;NH4NO3+R-Ni;具有本公开的氢氧化物、LiNO3、LiClO4和S2O8中的每个的P2O5+导电基质;诸如氢氧化物、氢氧化合物、储氢材料(诸如,本公开的一种或更多种)的H的源、柴油燃料和诸如P2O5的也可作为电子受体和诸如CO2、CO2、或NO2的也可用作其他酸酐的氧的源。
用于形成分数氢的固体燃料或含能材料可包括至少一种高度反应或含能材料(诸如,NH4NO3、tritonal、RDX、PETN、和本公开的其他)。固体燃料或含能材料可另外包括导体、导电基质、或导体材料(诸如,金属粉末、碳、碳粉末、碳化物、硼化物、氮化物、诸如TiCN的甲腈,或腈)、碳氢化合物(诸如,柴油燃料、氢氧化合物、氢氧化物、氧化物、和H2O)中的至少一种。在示例性实施方式中,固体燃料或含能材料包括高度反应或含能材料(诸如,NH4NO3、tritonal、RDX、PETN)和导电基质(诸如,诸如Al的金属粉末或过渡金属粉末和碳粉末中的至少一种)。固体燃料或含能材料可与高电流反应,如本公开中给出的。在实施方式中,固体燃料或含能材料还包括感光剂(诸如,玻璃微球)。
A.等离子动力学转换器(PDC)
等离子体的带正电离子的质量是电子的质量的至少1800倍;因此,回旋轨道大1800倍。此结果允许电子被磁力线磁捕获,而离子可漂移。可发生电荷分离,以向等离子体动力学转换器提供电压。
B.磁流体动力学(MHD)转换器
基于在交叉磁场中形成离子质量流的电荷分离是磁流体动力学(MHD)功率转换的熟知技术。正离子和负离子在相反方向上经历洛伦兹导向(Lorentzian direction)并且在对应MHD电极被接收,影响其间的电压。用于形成离子质量流的典型MHD方法是通过喷嘴膨胀接种离子的高压气体,以用相对于用于接收偏转离子的偏转场交叉的一组MHD电极,形成通过交叉磁场的高速流。在本公开中,压力通常大于大气压,但不一定如此,并且可通过固体燃料的反应,实现定向质量流,以形成高度电离的径向膨胀等离子体。
C.电磁场导向(交叉场或漂移)转化器,导向转换器
可采用带电粒子在磁场和交叉电场中的导向中心漂移来分离和收集空间上分离的电极处的电荷。因为装置提取垂直于导向场的粒子能量,所以可不必等离子体膨胀。理想化的转换器的性能取决于离子和电子之间的惯性差异,该惯性差异是电荷分离和相对于交叉场方向的对向电极处的电压产生的源头。还可独立地或与收集结合地使用漂移收集。
D.电荷漂移转换器
Timofeev和Glagolev描述的直接功率转换器[A.V.Timofeev,“A scheme for direct conversion of plasma thermal energy into electrical energy”,Sov.J.Plasma Phys.,第四卷第四期,1978年7-8月,第464-468页;V.M.Glagolev和A.V.Timofeev,“Direct Conversion of thermonuclear into electrical energy a drakon system”,Plasma Phys.Rep.,第19卷第12期,1993年12月,第745-749页]依赖于为了从等离子体提取功率而进行的电荷注入到漂移分离正离子。此电荷漂移转换器包括在与磁通B的源和具有磁力线的曲率的磁通B的源的方向横切的方向上的磁场梯度。在这两种情况下,漂移的带负电和带正电离子在与B所形成的平面垂直的相反方向和B具有曲率的磁场梯度或平面的方向上移动。在每种情况下,分离的离子在对向电容器上产生电压,对向电容器与伴随着离子热能减小的平面平行。在一个电荷漂移转换器电极上接收电子并且在另一个上接收正离子。由于离子的迁移率比电子的迁移率小得多,因此可直接地或通过将它们从升温的电荷漂移转换器电极蒸发来执行电子注入。功率损耗小,功率平衡的成本并不大。
E.磁约束
考虑爆炸或点燃事件是用于形成分数氢的H的催化剂加速至非常高的速率时。在实施方式中,通过爆炸或点燃事件生成的等离子体是膨胀等离子体。在这种情况下,磁流体动力学(MHD)是适宜的转换系统和方法。另选地,在实施方式中,等离子体受到约束。在这种情况下,可用等离子体动力学转换器、磁流体动力学转换器、电磁导向(交叉场或漂移)转换器、直接转换器、和电荷漂移转换器中的至少一种来实现转换。在这种情况下,除了SF-CIHT电池和包括点燃、重新装载、再生、燃料操纵和等离子体-电功率转换系统的设备平衡之外,动力生成系统还包括等离子体约束系统。可用磁场(诸如,螺线管磁场)来实现约束。磁体可包括永久磁体和电磁体中的至少一个(诸如,未冷却、水冷却和超导磁体中的至少一个),对应的低温管理系统包括液体氦杜瓦瓶、液体氮杜瓦瓶、辐射挡板中的至少一个,辐射挡板可含有铜、高真空绝缘的辐射遮挡物、和可通过基于分数氢的发电机的功率输出来供电的冷泵和压缩机。磁体可以是诸如赫姆赫兹线圈(Helmholtz coils)的开路线圈。还可通过本领域的技术人员已知的其他系统和方法将等离子体约束在磁瓶中。
两个或更多个磁镜可形成磁瓶,约束通过用于形成分数氢的H的催化作用形成的等离子体。在本申请人的全部内容以引用方式并入本文中的诸如“Microwave Power Cell,Chemical Reactor,And Power Converter”(02年3月7日提交的PCT/US02/06955(短版本)、02年3月7日提交的PCT/US02/06945(长版本)、03年9月5日提交的美国案件号10/469,913的现有申请中给出了约束理论。在瓶内的中心区域中形成的离子将沿着轴盘旋,但将被各端部的磁镜反射。具有与所期望轴平行的高速率分量的更多含能离子将在瓶的端部逸出。因此,在实施方式中,瓶可产生从磁瓶的端部到磁流体动力学转换器的离子的基本线性流。由于电子会由于它们相对于正离子的较低质量而优先受到约束,因此在本公开的等离子体动力学实施方式中形成电压。电力在接触受约束电子的阳极和阴极(诸如,收集正电子的约束容器壁)之间流动。电力可在外部负载中被消散。
F.固体燃料催化剂诱导的分数氢转换(SF-CIHT)电池
本发明的化学反应物可被称为固体燃料或含能材料或这二者。固体燃料可执行由此当形成并且保持条件以致使用于形成分数氢的非常高的反应动力学时,包括含能材料。在实施方式中,分数氢反应速率取决于高电流的施加或形成。在SF-CIHT电池的实施方式中,用于形成分数氢的反应物经受致使非常快速的反应速率和能量释放的低电压、高电流、高功率脉冲。该速率可足以形成冲击波。在示例性实施方式中,60Hz电压小于15V峰,电流在10,000A/cm2和50,000A/cm2峰之间,功率在150,000W/cm2和750,000W/cm2之间。是这些参数的大约1/100倍至100倍的范围中的其他频率、电压、电流和功率是合适的。在实施方式中,分数氢反应速率取决于高电流的施加或形成。在实施方式中,选择电压,以致使得到100A至1,000,000A、1kA至1,00,000A、10kA至50kA中的至少一个的范围内的电流的高AC、DC、或AC-DC混合。DC或峰值AC电流密度可在100A/cm2至1,000,000A/cm2、1000A/cm2至100,000A/cm2、和2000A/cm2至50,000A/cm2中的至少一个的范围内。DC或峰值AC电压可以在从大约0.1V至1000kV、0.1V至100V、0.1V至15V和1V至15V中选择的至少一个范围内。AC频率可在大约0.1Hz至10GHz、1Hz至1MHz、10Hz至100kHz、和100Hz至10kHz的范围内。脉冲时间可在选自大约10-6s至10s、10-5s至1s、10-4s至0.1s、和10-3s至0.01s的至少一个范围内。
在用于形成分数氢的H催化作用期间,通过从被催化成HOH的H传递的能量,用HOH催化剂使电子电离。催化作用的步骤是(1)原子氢与被称为催化剂的能量受体反应,其中,能量从原子氢传递到由于接受到能量而形成正离子和电离电子的催化剂;(2)然后,H的负电子降至较靠近正质子的较低原子壳,以形成较小的氢原子、分数氢,从而释放能量以根据系统的设计来生成电力或热;(3)催化剂正离子复得它们损失的电子,以在释放从H(原子氢)接受的初始能量的情况下,重新形成用于另一个周期的催化剂。SF-CIHT电池的高电流对抗损失其电子的催化剂中的电荷累积效果的限制效应,导致灾难性的高反应速率。这些电子(步骤2)可在施加的高电路电流中导通,以防止催化剂反应因电荷积累而自我限制。高电流还会引起电子受激转换或电子受激串联,其中,一个或更多个电流电子增加了氢(H)原子电子经受用于形成分数氢的转换的速率。高电流会引起灾难性衰退或灾难性分数氢反应速率。由分数氢形成的等离子体动力可直接被转换成电力。
通过快速动力学产生爆炸,这进而造成大量电子电离。在实施方式中,使用至少一个专用等离子-电子转换器(诸如,MHD、PDC和直接转换器中的至少一个)将来自固体燃料点燃的等离子体动力转换成电力。这些和其他等离子体-电功率转换器的细节在本申请人的全部内容以引用方式并入本文中的现有公开(诸如,R.M.Mayo,R.L.Mills,M.Nansteel,“Direct Plasmadynamic Conversion of Plasma Thermal Power to Electricity”,IEEE Transactions on Plasma Science,2002年10月,第5期第30卷,第2066–2073页;R.M.Mayo,R.L.Mills,M.Nansteel,“On the Potential of Direct and MHD Conversion of Power from a Novel Plasma Source to Electricity for Microdistributed Power Applications”,IEEE Transactions on Plasma Science,2002年8月,第4期第30卷,第1568–1578页;R.M.Mayo,R.L.Mills,“Direct Plasmadynamic Conversion of Plasma Thermal Power to Electricity for Microdistributed Power Applications”,40th Annual Power Sources Conference,Cherry Hill,NJ,2002年6月10日至13日,第1-4页,(“Mills现有等离子体功率转换公开文献”))和本申请人的全部内容以引用方式并入本文中的现有申请(诸如“Microwave Power Cell,Chemical Reactor,And Power Converter”,02年3月7日提交的PCT/US02/06955(短版本)、02年3月7日提交的PCT/US02/06945(长版本)、03年9月5日提交的美国案件号10/469,913;Plasma Reactor And Process For Producing Lower-Energy Hydrogen Species,04年4月8日提交的PCT/US04/010608、15年10月12日提交的US/10/552,585;“Hydrogen Power,Plasma,and Reactor for Lasing,and Power Conversion”,02年11月8日提交的PCT/US02/35872、04年5月6日提交的US/10/494,571(“Mills现有等离子体功率转换公开文献”))中给出。
转换成电力的等离子体能量在外部电路中消散。如在Mills现有等离子体功率转换公开文献中用实验方法通过计算展示的,可实现超过50%的等离子体能量-电力转换。通过各SF-CIHT电池来生成热以及等离子体。可直接使用热或者可使用本领域的技术人员已知的转换器(诸如,诸如蒸汽机或蒸汽或气体涡轮机和发电机的热力发动机、Rankine或Brayton循环发动机、或Stirling发动机)将热转换成机械或电功率。至于功率转换,各SF-CIHT单电池可与Mill现有公开文献中描述的热能或等离子体-机械或电功率的转换器以及本领域的技术人员已知的转换器(诸如,热力发动机、蒸汽或气体涡轮系统、Stirling发动机、或热离子或热电转换器)中的任一个相互作用。其他等离子体转换器包括Mills现有公开文献中公开的等离子体动力学功率转换器、直接转换器、磁流体动力学功率转换器、磁镜磁流体动力学功率转换器、电荷漂移转换器、Post或Venetial Blind功率转换器、陀螺振子、光子聚束微波功率转换器和光电转换器中的至少一种。在实施方式中,电池包括Mills现有热动力转换公开文献、Mills现有等离子体功率转换公开文献和Mills现有申请中给出的内燃机的至少一个气缸。
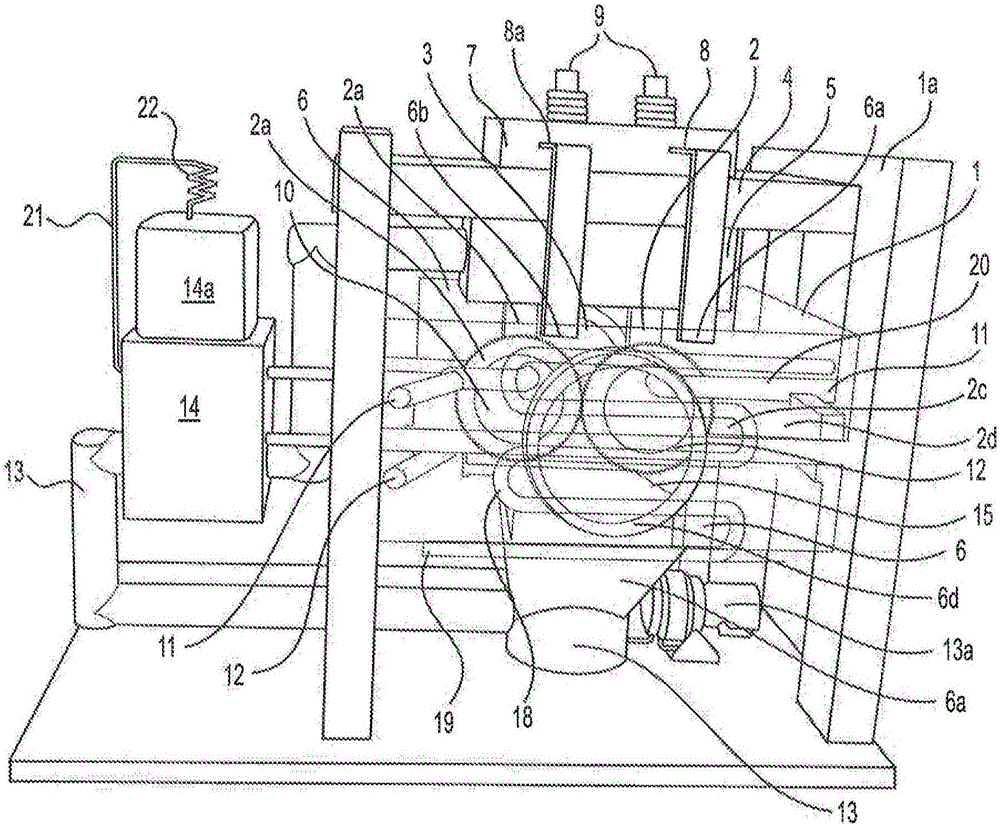
图1中示出的固体燃料诱导的分数氢转换(SF-CIHT)电池发电机包括具有结构支承框架1a的至少一个SF-CIHT电池1,SF-CIHT电池1均具有至少两个电极2和电源4,电极2约束固体燃料3的样本、小球、一部分、或部分,电源4用于通过燃料3传递低电压、高电流电能的短脉冲。电流点燃燃料,因形成分数氢而释放能量。动力是能够被直接转换成电力的燃料3的热动力和高度电离等离子体的形式。(本文中,“点燃或形成爆炸”是指由于施加到燃料的高电流而导致创建了高分数氢反应动力学。)等离子体可被接种,以增加导电或导电持续时间。在实施方式中,诸如元素或化合物(诸如,碱金属或诸如K2CO3的碱金属化合物)的组成物质可被添加到固体燃料和等离子体中的至少一个,以将其接种带电荷的离子。在实施方式中,等离子体包括离子接种源(诸如,当等离子体冷却时保持导电的碱金属或碱金属化合物)。用于实现固体燃料点燃以形成等离子体的示例性电源是Taylor-Winfield model ND-24-75点焊机和EM Test Model CSS 500N10CURRENT SURGE GENERATOR(8/20US UP TO 10KA)的电源。在实施方式中,电源4是DC,等离子体-电功率转换器适于DC磁场。用DC磁场进行操作的合适转换器是磁流体动力学、等离子体动力学和功率转换器。
在实施方式中,示例性固体燃料混合物包括过渡金属粉末、其氧化物和H2O。细小粉末可气动地喷射到当电极2打开时形成在电极2之间的间隙中。在另一个实施方式中,燃料包括粉末和浆液中的至少一种。燃料可被注入所期望区域中,被约束在电极2之间,通过高电流被点燃。为了更好地约束粉末,电极2可具有形成腔室容纳燃料的凸-凹对搭接。在实施方式中,燃料和电极2可带相反的静电电荷,使得燃料流入电极间区域中并且静电粘附于燃料在其中点燃的各电极2的所期望区域中。
在图1中示出的动力生成器的实施方式中,电极表面2可与重力轴平行,固体燃料粉末3可在重力作用下从架空储料器5作为间歇流体流出,其中,随着电极2打开接纳流动的粉末状燃料3并且关闭以便点燃燃料流体,间歇流流体的时间匹配电极2的尺寸。在另一个实施方式中,电极2还包括其端部的辊2a,辊2a通过其中填充燃料流的小间隙而分开。导电燃料3完整了电极2之间的电路,通过燃料的高电流流动点燃了燃料。燃料流体3可以是间歇的,以防止膨胀的等离子体扰乱燃料流体流动。
在另一个实施方式中,电极2包括由结构元件2b支承的一组齿轮2a。这组齿轮可在传动齿轮2c的作用下旋转,传动齿轮2c由传动齿轮电机2d提供动力。传动齿轮2c还可用作各齿轮2a的散热器,其中,可通过从传动齿轮2c接收热的电极热交换器(诸如,10)去除热。齿轮2a(诸如,人字齿轮)均包括整数(n个)齿,其中,当第n-1个齿间间隙中的燃料被相配合齿轮的第n-1个齿压缩时,燃料流入第n个齿间间隙或齿槽底面中。齿轮的其他几何形状或齿轮(诸如,本领域的技术人员已知的叉指多边形或三角形齿状齿轮、螺旋齿轮和螺旋钻)的功能在本公开的范围内。在实施方式中,燃料和电极2a的齿轮齿的所期望区域(诸如,齿槽底面)可带相反的静电电荷,使得当齿啮合时燃料流入并且静电粘附于燃料在其中点燃的一个或两个电极2a的所期望区域中。在实施方式中,诸如细小粉末的燃料3被气动喷射到齿轮2a的所期望区域中。在另一个实施方式中,燃料3被注入约束在电极2a之间的所期望区域(诸如,齿轮2a的齿的叉指区域)中,以通过高电流被点燃。在实施方式中,辊或齿轮2a通过诸如装载弹簧或气动或液压致动的手段保持向着彼此的张力。齿的啮合和压缩致使通过导电燃料在相配合齿之间形成电接触。在实施方式中,齿轮在啮合期间接触燃料的叉指区域中是导电的并且在其他区域中是绝缘的,使得电流选择性流过燃料。在实施方式中,齿轮2a包括陶瓷齿轮,带有金属涂层,在没有接地路径的情况下在叉指区域中是导电或者电隔离的。另外,传动齿轮2c可在没有接地路径的情况下是不导电或电隔离的。可通过电刷来提供从电极2到齿的叉指部分的电接触和供应。示例性的电刷包括被推动在例如弹簧的作用下与齿轮接触的碳条或杆。
在另一个实施方式中,可通过对应的齿轮毂和轴承,直接提供从电极2到齿的叉指部分的电接触和供应。结构元件2b可包括电极2。如图1中所示,这对电极中的各电极2可定心在各齿轮上并且连接到各齿轮的中心,既用作结构元件2b又用作电极2,其中,将各齿轮2a连接到其轴或毂的齿轮轴承用作电接触件,并且只在对向齿轮的接触齿之间存在接地路径。在实施方式中,各齿轮的外部部分围绕其中心毂转动,以在其较大半径处具有通过额外轴承进行的更大电接触。毂还可用作大散热器。电极热交换器10还可附接毂,以从齿轮带走热。热交换器10可用诸如金刚石或金刚石状碳膜的具有高导热性的薄绝缘体层(诸如,电绝缘体)与毂电隔离。可使用计算机和开关晶体管(诸如,无电刷型DC电动机中使用的计算机和开关晶体管)定时进行齿轮的起电。在实施方式中,齿轮被间歇地供应能量,使得当齿轮啮合时,高电流流过燃料。可定时进行燃料流动,以匹配齿轮啮合时向着齿轮的燃料传递并且致使电流流过燃料。随之发生的高电流流动致使燃料点燃。燃料可连续地流过齿轮或辊2a,齿轮或辊2a进行旋转,以驱动燃料通过间隙。当燃料旋转以填充电极2之间的间隔时,燃料可被连续地点燃,该间隔包括一组辊的啮合区域或一组辊的对向侧。在这种情况下,输出功率会是稳定的。在实施方式中,所得的等离子体膨胀超出齿轮的侧面并且流向朝向电力转换器6的等离子体。等离子体膨胀流动可以是沿着与各齿轮的轴平行并且与燃料流体3的流动方向横切的轴。轴向流动可以是朝向如图1中所示的PDC转换器6或MHD转换器。可用约束磁体(诸如,Helmholtz线圈或磁瓶6d那些)来实现其他的定向流动。
电极可以是用固体燃料3的组分通过金属连续或间歇再生中的至少一者。固体燃料可包括在点燃期间熔融使得与表面进行的粘附、熔合、焊接、或形成合金以取代电极2a材料的形式的金属(诸如,在操作期间被腐蚀掉或磨损的金属)。SF-CIHT电池动力生成器还可包括用于修复电极形状的装置(诸如,齿轮2a的齿)。该装置可包括铸型、研磨机、和铣床中的至少一个。可在操作期间连续修复齿轮腐蚀。可通过放电加工(EDM)或通过电镀(通过诸如EDM电镀的手段)来连续修复SF-CIHT电池的齿轮电极。在真空中进行操作(诸如,冷喷射、热喷射或溅射)期间齿轮的连续刷新的系统和方法是本领域技术人员已知的。
在实施方式中,叉指齿轮被设计成捕获过量固体燃料(诸如,高度导电的固体燃料粉末)。齿轮区域(诸如,各齿和对应的相配合齿轮的齿槽底部)具有几何设计和选择性起电中的至少一者,使得只有过量燃料的一部分引爆。所选择的一部分可通过未选择的未引爆燃料不与齿轮表面接触。叉指区域中燃料的体积形状可以是使得所选择的较小体积具有足以允许引爆的高电流;然而,电流可从中通过的周围较大体积具有比引爆所需的电流密度低的电流密度。在实施方式中,所捕获的过量燃料导通流过较大面积或体积的燃料的电流并且被集中到较小的面积或体积中,其中,超过了用于引爆的电流阈值,并且在具有较高电流密度的燃料的所选择部分中发生引爆。在实施方式中,由于确定通过燃料一些部分的电流路径长度的几何设计和选择性起电,导致选择性燃料部分具有相对于未选择部分的较低电阻。在实施方式中,齿轮的几何形状致使所选择区域具有比未选择区域高的燃料压缩,使得在所选择区域中,电阻较低。因此所选择区域中的电流密度较高,超过引爆阈值。相比之下,未选择区域中的电阻较高。因此,未选择区域中的电流密度较低,低于引爆阈值。在示例性实施方式中,所选择区域包括燃料的沙漏形状部分的夹点。
周围过量的未引爆燃料吸收如果被直接暴露于缺乏没有引爆的介入的固体燃料的状况时原本会致使齿轮腐蚀的状况中的至少一些。这些状况可包括轰击或暴露于高热、高压(诸如,由于冲击波导致的高压或爆炸波阵面超压)、抛射体、等离子体、电子和离子中的至少一种。未引爆燃料可被燃料恢复系统连接并且再循环。关于图1和图2,燃料恢复和再循环系统可包括蒸汽冷凝器15、倾槽6a、产物去除器/燃料装载器13、再生系统14和储料器5。
在另一个实施方式中,齿轮能在紧固机构(诸如,往复连接杆)的作用下移动并且被曲柄轴引起启动,类似于内燃机的活塞系统的系统和方法。随着齿轮的对向电极部分旋转成对向配合位置,对向电极在紧固机构的作用下在压缩时被一起驱动并且在点燃后移开。对向电极可以是任何期望形状并且可被选择性起电,以致使燃料中的至少一种经历所选择区域中的较大压缩和所选择区域中较大的电流密度。对向电极可形成半球状壳,半球状壳压缩燃料,使中心的压缩最大。最高电流密度也可处于中心,以选择性实现中心区域中的引爆阈值。膨胀等离子体可流到半球状壳的敞口部分之外。在另一个实施方式中,对向电极可形成沙漏形状,其中,所选择区域可包括沙漏的腕部或颈部。
在实施方式中,齿轮可包括至少两种材料,其中,至少一种材料是导体。至少一种硬化材料可在暴露于爆炸状况时用于耐腐蚀的目的,其中,可与硬化材料接触地或紧邻地发生爆炸。高度导电材料可通过未引爆固体燃料隔离爆炸。至少两种类型的材料的布置提供非选择区域上方的所选择区域的选择性压缩和选择性起电中的至少一种。在示例性实施方式中,齿轮的叉指形成沙漏或夹紧形状。可通过可以是绝缘体(诸如,陶瓷)的高度稳定或硬化的材料来形成沙漏的颈部或腰部。齿轮的非腕部或球状部分可包括诸如金属(诸如,过渡、内过渡、稀土、13族、14族和15族金属或至少两种这样的金属或诸如TiC或WC的碳化钨的合金中的至少一种)的导体。腰部部分可压缩所选择区域并且电流可穿过非腰部或球状区域之间,集中在腰部区域中。由此,在包括腰部的所选择区域中的电流密度增大,使得实现了引爆阈值。通过使包括硬化材料的腰部材料抗腐蚀,保护腰部免受爆炸带来的损害。包括导体的非腰部或球状区域接触未选择的燃料区域,其中,介入爆炸和这些对应齿轮表面之间的燃料保护这些表面免于因爆炸而腐蚀。
还可用作启动功率源的点燃电源4包括至少一个电容器(诸如,供应实现点燃所必需的低电压、高电流的低电压、高电容的电容器组)。电容器电路可被设计成避免在放电期间有波纹或振铃,以增加电容器的寿命。寿命可以长(诸如,在大约1至20年的范围内)。电容器组电源可包括电路,电路避免了放电期间的趋肤效应,趋肤效应将会阻碍电流穿透进入固体燃料的块体中。功率电路可包括用于电容器放电以点燃固体燃料的LRC电路,其中,时间常数长得足以防止高频振荡或包括高频分量的脉冲放电,这些高频分量防止电流流过样本将其点燃。
为了抑制任何间歇,一些功率可被存储在电容器和可选地高电流变压器、电池、或其他储能器件中。在另一个实施方式中,来自一个单元的电输出可传递点燃另一个单元的燃料的低电压、高电流电能的短脉冲。还可通过用功率连接器8和8a连接的输出功率调节器7来调节输出电功率。输出功率调节器7可包括诸如功率存储器(诸如,电池或超级电容器、DC至AC(DC/AC)转换器或逆变器和变压器)的元件。DC功率可被转换成另一种形式的DC功率(诸如,具有较高电压的DC功率);功率可被转换成AC、或DC和AC的混合物。输出功率可以是被调节成所期望波形(诸如,60Hz AC功率)并且通过输出端子9供应到负载的功率。在实施方式中,输出功率调节器7将来自光伏转换器或热-电转换器的功率转换成所期望频率和波形(诸如,不同于分别作为美国和欧洲标准的60或50Hz的AC频率)。可施加不同的频率来匹配被设计用于不同频率的诸如电机(诸如,用于动力、航空、海事、电器、工具、和机械、电加热和空间调节、电信、和电子应用的电机)的负载。功率输出端子9处的输出功率的一部分可用于为电源4供电(诸如,大约5-10V,10,000-40,000A DC功率)。PDC功率转换器可输出非常适于为电极2重新供电以致使后续供应燃料被点燃的低电压、高电流的DC功率。低电压、高电流的输出可被供应到DC负载。可用DC/DC转换器来调节DC。示例性的DC负载包括诸如电子换向电机(诸如,用于动力、航空、海事、电器、工具、和机械、DC电加热和空间调节、DC电信、和DC电子应用的电子换向电机)的DC电机。
点燃生成输出等离子体和热动力。等离子体动力可被光伏动力转换器6直接转换成电力。电池可进行操作,通向大气。在实施方式中,电池1能够保持低于大气的真空或压力。可通过真空泵13a保持低于大气的真空或压力,以允许固体燃料3的点燃的膨胀等离子体的离子不与大气气体碰撞。在实施方式中,在包括等离子体生成电池1和相连接的光伏转换器6的系统中保持低于大气的真空或压力。
可通过冷却剂流过其电极冷却剂入口管线11和电极冷却剂窗口管线12的电极热交换器10和冷却剂流过其PDC冷却剂入口管线19和PDC冷却剂出口管线20的PDC热交换器18中的至少一个来提取热动力。可使用其他热交换器从分数氢反应接收热动力(诸如,还可施加到容器1的至少一个壁、PDC转换器的至少一个其他壁、和PDC转换器的电极17的背部上的水墙型设计)。在实施方式中,热交换器和热交换器的组件中的至少一个可包括热管。热管流体可包括熔盐或金属。示例性金属是铯、NaK、钾、锂和银。用于有效且有成本效益地从反应中带走热的这些和其他热交换器设计是本领域的技术人员已知的。热可被传递到热负载。因此,动力系统可包括加热器,被通向热负载或将热传递到热负载的热交换器的冷却剂出口管线12和20中的至少一个供应的热。冷却后的冷却剂可通过冷却剂入口管线11和19中的至少一个返回。冷却剂出口管线12和20中的至少一个供应的热可流向热力发动机、蒸汽发动机、蒸汽涡轮机、气体涡轮机、Rankine循环发动机、Brayton循环发动机和Stirling发动机,以被转换成机械动力(诸如,快速旋转轴、轮、发电机、涡轮风扇或涡轮推进器、船用螺旋桨、叶轮和旋转轴机械中的至少一个的机械动力)。另选地,热动力可从冷却剂出口管线12和20中的至少一个流向热-电功率转换器(诸如,本公开的热-电功率转换器)。合适的示例性热-电转换器包括热力发动机、蒸汽发动机、蒸汽涡轮机和发电机、气体涡轮机和发电机、Rankine循环发动机、Brayton循环发动机、Stirling发动机、热离子功率转换器和热电功率转换器的组中的至少一种。可使用来自热-电转换器的输出功率为负载供电,并且一部分可为SF-CIHT电池动力生成器的组件(诸如,电源4)供电。
燃料3的反应物的点燃产生功率和产物,其中,功率可以是产物的等离子体形式。在实施方式中,燃料3被基本上部分蒸发成气态物理状态(诸如,分数氢反应爆炸事件期间的等离子体)。等离子体穿过通向电功率转换器6的等离子体。另选地,等离子体向光伏转换器6发光,并且复合后的等离子体形成气态原子和化合物。这些被蒸汽冷凝器15冷凝并且收集,被产物去除器-燃料装载器13传送到再生系统14,这包括传送器与再生系统14连接并且还包括将传送器与储料器5连接。蒸汽冷凝器15和产物去除器-燃料装载器13可包括诸如静电收集系统和至少一个螺旋钻、传送器或气动系统(诸如,用于收集和移动材料的真空或吸入系统)中的至少一个的系统。来自再生系统14的等离子体产物和再生燃料可在带静电传送带13上运输,燃料和产物颗粒粘附在传送带13上并且被运输。由于颗粒与传送带的强静电吸附,导致再生的燃料颗粒可从再生腔室14抽吸到再生腔室上方的管13中。适宜的系统是本领域的技术人员已知的。
再生系统14可包括能具有比大气大的压力的闭合容器或腔室和再生腔室中的热交换器。再生热交换器可与热源(诸如,电极热交换器10和PDC热交换器18中的至少一个)连接。在实施方式中,来自罐源14a的水滴到再生热交换器上,形成对等离子体产物进行蒸汽处理的蒸汽,以将它水合。蒸汽可在水冷凝器22的作用下反流,水冷凝器22具有从再生腔室14到水罐14a的管线21。可进行水合作为批量再生,之后进行冷却蒸汽和冷凝的步骤,将H2O再循环至水罐14a,借助产物去除器/燃料装载器13将再生的固体燃料到储料器5,并且借助产物去除器/燃料装载器13用等离子体产物重新填充再生腔室14,以开始另一个周期。
在实施方式中,等离子体-电转换器6(诸如,包括光伏转换器6的等离子体动力学转换器或发电机系统)包括用于待传送到产物去除器/燃料装载器13中的产物的斜槽或通道6a。PDC转换器6、斜槽6a、和PDC电极17的底部中的至少一个可倾斜,使得产物流可至少部分是由于重力流。PDC转换器6、斜槽6a、和PDC电极17的至少一个底部可机械颤抖或振动,以辅助流动。该流动可得到通过点燃固体燃料而形成的冲击波的辅助。在实施方式中,PDC转换器6、斜槽6a、和PDC电极17的至少一个底部包括机械刮刀或传送器,以将产物从对应表面移至产物去除器-燃料装载器13。
储料器5可被产物去除器-燃料装载器13用来自再生系统14的再生燃料重新填充。诸如在形成分数氢时消耗的任何H或H2O可由来自H2O源14a的H2O组成。本文中,可用由来自H2O源14a的H2O组成的诸如在形成分数氢时消耗的任何H或H2O,在原始反应物或燃料中再生所耗费的燃料。水源可包括可包含体相或气态H2O、或包括H2O的材料或化合物或形成H2O的一种或更多种反应物(诸如,H2+O2)中的至少一个的罐、单元、或容器14a。另选地,源可包括大气水蒸气、或从大气中提取H2O的装置(诸如,诸如溴化锂、氯化钙、氯化镁、氯化锌、碳酸钾、磷酸钾、诸如KMgCl3·6(H2O)的光卤石、柠檬酸铁铵、氢氧化钾和氢氧化钠和浓硫酸和磷酸、纤维素纤维(诸如,棉和纸)、糖、焦糖、蜂蜜、甘油、乙醇、甲醇、柴油燃料、甲基苯丙胺、许多肥料化学品、盐(包括食盐)和本领域的技术人员已知的各种各样的其他物质以及诸如二氧化硅、活性炭、硫酸钙、氯化钙、和分子筛(典型地,沸石)的解离剂或诸如氯化锌、氯化钙、氢氧化钾、氢氧化钠的潮解材料和本领域的技术人员已知的许多不同潮解盐的吸湿材料)。
在实施方式中,SF-CIHT电池动力生成器还包括真空泵13a,真空泵13a可去除任何产物氧和分子分数氢气体。在实施方式中,氧和分子分数氢中的至少一个被作为商用产物收集在罐中。泵还可包括选择性隔膜、阀、筛网、低温过滤器、或本领域的技术人员已知的用于分离氧和分数氢气体的其他装置并且可另外收集H2O蒸气,并且将H2O供应到再生系统14,以被再循环到再生固体燃料中。可在容器腔室中添加H2气,以抑制生成器组件(诸如,齿轮或PDC或MHD电极)的任何氧化。
在实施方式中,燃料3包括通过对再生或重新处理后的固体燃料进行球磨可形成的细小粉末,其中,再生系统14还可包括球磨机、研磨机、或用较大粒子形成较小粒子的其他装置(诸如,本领域中已知的那些研磨或铣削装置)。示例性固体燃料混合物包括诸如导电金属粉末(诸如,过渡金属、银、或铝的粉末)的导体、其氧化物和H2O。在另一个实施方式中,燃料3可包括可在再生系统14中被施压的固体燃料的小球。固体燃料小球还可包括粉末状金属或包封金属氧化物和H2O的另一种金属的薄箔和可选地金属粉末。在这种情况下,再生系统14通过诸如真空中加热、还原氢气氛下加热和用电解液(诸如,熔盐电解液)进行的电解中的至少一种的手段来再生金属箔。再生系统14还包括金属处理系统(诸如,轧制或铣削机),用于用再生的箔金属簧片来形成箔。可通过压制机或施压器来形成护套,其中被包封的固体燃料可被压制或压缩在护套内部。
在示例性实施方式中,通过诸如本公开中给出的手段(诸如,添加H2、添加H2O、热再生和电解再生中的至少一个)来再生固体燃料。由于相对于用于启动反应的输入能量的分数氢反应的非常大的能量增益(诸如,是NiOOH情况下的100倍)(相比于46输入的3.22kJ输出,如示例性SF-CIHT电池测试结果部分中给出的),导致诸如Ni2O3和NiO的产物可通过本公开中给出的并且另外由本领域的技术人员已知的电化学反应以及化学反应被转换成氢氧化物,然后转换成氢化化合物。在其他实施方式中,诸如Ti、Gd、Co、In、Fe、Ga、Al、Cr、Mo、Cu、Mn、Zn和Sm的其他金属和对应的氧化物、氢氧化物和氢氧化合物(诸如,本公开的氧化物、氢氧化物和氢氧化合物)可取代Ni。在另一个实施方式中,固体燃料包括金属氧化物和H2O、和对应的金属作为导电基质。产物可以是金属氧化物。可通过对金属氧化物的一部分氢还原成随后与已经再水合的氧化物混合的金属来再生固体燃料。其氧化物可容易在轻微热(诸如,低于1000℃)的情况下被氢还原成金属的合适金属是Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In。在另一个实施方式中,固体燃料包括(1)不容易在轻微热的情况下用H2还原的氧化物(诸如,氧化铝、碱土金属氧化物和稀土氧化物中的至少一种)、(2)其氧化物能够在中等温度(诸如,低于1000℃)的情况下用H2还原成金属的金属、(3)H2O。示例性的燃料是MgO+Cu+H2O。然后,H2能还原和不能还原的氧化物的产物混合物可被用H2进行处理并且在温和状况下加热,使得只有能还原的金属氧化物被转换成金属。此混合物可被水合,以包括再生的固体燃料。示例性燃料是MgO+Cu+H2O;其中,产物MgO+CuO经历H2还原处理,以产生被水合成固体燃料的MgO+Cu。
在另一个实施方式中,通过在真空和惰性气体流体中的至少一个下加热来再生诸如CuO或AgO的氧化物产物。温度可以在大约100℃至3000℃、300℃至2000℃、500℃至1200℃和500℃至1000℃中的至少一个的范围内。在实施方式中,再生系统14还可包括铣削机(诸如,球磨机和切碎/研磨铣削机中的至少一种),用于将体相氧化物和金属中的至少一个铣削成诸如细小粉末(诸如,粒径在大约10nm至1cm、100nm至10mm、0.1μm至1mm和1μm至100μm(μ=微米)中的至少一个范围内的细小粉末)的粉末。
在另一个实施方式中,再生系统可包括诸如熔盐电解池的包括金属离子的电解池,其中,可使用本领域中熟知的系统和方法,通过电沉积将金属氧化物产物的金属镀到电解池阴极上。系统还包括铣削机或研磨机,用于用电镀金属来形成所期望大小的金属粒子。可在反应混合物的其他组分(诸如,H2O)中添加金属,以形成再生的固体燃料。
在实施方式中,图1的电池1能够保持低于大气的真空或压力。可通过泵13a在电池1中保持低于大气的真空或压力,也可在连接从等离子体源(电池1)接收含能等离子体离子的等离子体-电转换器6中保持低于大气的真空或压力。在实施方式中,固态燃料包括金属,金属基本上热力学稳定地趋于与H2O反应,变成氧化金属。在这种情况下,在形成产物的反应期间,固体燃料的金属没有被氧化。示例性的固体燃料包括金属、氧化的金属和H2O的混合物。然后,诸如初始金属和金属氧化物的混合物的产物可被产物去除器-燃料装载器13去除并且通过添加H2O来再生。可在Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的组中选择就与H2O反应而言热力学基本上不利的合适金属。在其他实施方式中,固体燃料包括H2O不反应金属和H2O、金属氧化物、氢氧化物和氢氧化合物中的至少一种(可包括相同或至少一种不同金属)。
在实施方式中,为了尽可能迅速地、有效地且有成本效益地再生固体燃料,进行H2还原、真空下的还原和再水合的方法。
在实施方式中,固体燃料包括包括水的吸湿材料和导体的混合物。示例性燃料是诸如MgX2(X=F,Cl,Br,I)的水合碱土金属卤化物和诸如过渡金属(诸如,Co、Ni、Fe、或Cu)的导体。
固体燃料可包括诸如元素或化合物(诸如,具有低熔点、高导电率和低逸出功中的至少一个的金属)的物质组成,其中,高温下的逸出功会非常低,并且固体燃料还包括H2O的源和H2O中的至少一个。在实施方式中,固体燃料包括诸如熔融金属的导体;来自电源4的高电流熔融诸如金属的导体,引起热离子发射,以形成低电压电弧等离子体,并且电弧等离子体致使H2O点燃。在实施方式中,固体燃料是高度导电的并且包括至少一个低熔点金属,该低熔点金属在高温下具有低逸出功,在没有燃料中的H2O的情况下引起低电压电弧等离子体,其中,燃料因此点燃。
在实施方式中,固体燃料包括用于形成分数氢的H的源(诸如,可以是根据等式(6-9)的mH催化剂的源的碳氢化合物)。固体燃料可包括导体、用于约束氢的源的材料(诸如,碳或其他疏水基质)、和诸如碳氢化合物的氢的源。固体燃料可由导致形成用作催化剂的高浓度H和用于形成分数氢的反应物的高电流表示。
动力生成器还包括用于可变功率输出的装置和方法。在实施方式中,通过用电源4控制进入电极2或辊或齿轮2a的燃料3的可变或可中断流速和可变或可中断燃料点燃速率来控制动力生成器的功率输出。还可控制辊或齿轮的旋转速速来控制燃料点燃速率。在实施方式中,输出功率调节器7包括用于控制可以是DC的输出的功率控制器7。功率控制器可通过控制旋转传动齿轮2c并且转动齿轮2a的齿轮传动电机2d来控制燃料流速(齿轮的旋转速度)。基于燃料消耗速率或点火速率中的至少一个的机械或电控制的响应时间可非常快(诸如,在10ms至1μs)的范围内。还可通过控制等离子体的转换器电极与电转换器的连接来控制功率。例如,串联连接PDC电极使电压增大,并联连接转换器电极使电流增大。以相对于磁场方向中的至少一个的不同角度来改变PDC电极的角度或选择性连接到PDC电极17的组改变了通过改变电压和电流中的至少一个而收集的功率。
在图2A中示出的实施方式中,功率转换器6包括光伏或太阳能电池系统。在实施方式中,输出功率控制器/调节器7从光伏动力转换器6接收功率并且将功率中的一些以适于为源4供电的形式传递到电源4,以致使以所期望的重复速率点燃固体燃料3。通过输出功率控制器/调节器7接收和调节的额外功率可被输出传递到电负载。可用本领域的技术人员已知的太阳能行业中使用的输出功率控制器/调节器7实现光伏输出与燃料点燃电系统、电源4、和负载的源的功率需求的适宜整合。适宜的太阳能功率调节器以适于电网的电压(诸如,120V及其倍数)的范围来输出AC功率。
功率控制器7还包括诸如电压、电流和功率的输入和输出参数的传感器。来自传感器的信号可被供给到控制动力生成器的处理器。可控制斜坡上升时间、斜坡下降时间、电压、电流、功率、波形和频率中的至少一个。动力生成器可包括诸如分流电阻器的电阻器,超出功率负载所需或所期望功率可通过该电阻器耗散。分流电阻器可连接到输出功率调节器或功率控制器7。动力生成器可包括用于提供远程监测的内置处理器和系统,远程监测还可具有禁用动力生成器的能力。
在实施方式中,端子9处的电功率输出的一部分被供应到电源4、齿轮(辊)传动电机2d、产物去除器-燃料装载器13、泵13a和再生系统14中的至少一个,以提供电功率和能量,传播化学反应,用反应产物再生原始固体燃料。在实施方式中,来自电极热交换器10和PDC热交换器18中的至少一个的热的一部分利用通过冷却剂出口管线12和20中的至少一个利用通过冷却剂输入管线11和19中的至少一个的冷却剂返回循环被输入固体燃料再生系统,提供热动力和能量,以传播化学反应,用反应产物再生原始固体燃料。来自热-电转换器6的输出功率的一部分还可用于为再生系统以及SF-CIHT电池生成器的其他系统供电。
G.等离子体动力学等离子体-电功率转换器
可使用基于磁空间电荷分离的等离子体动力学功率转换器6将等离子体功率转换成电。由于它们相对于正离子的较低质量,导致电子优先受磁化PDC电极(诸如,圆柱形PDC电极或磁场中的PDC电极)的磁通线约束。因此,电极的移动性受限制;然而,正离子相对自由地与固有或非固有磁化PDC电极碰撞。电极和正离子都与未磁化PDC电极充分碰撞。等离子体动力学从等离子体的热和电势能直接提取功率,并不依赖于等离子体流。替代地,PDC进行的功率提取采用浸没在等离子体中的磁化和未磁化PDC电极之间的电势差驱动外部负载中的电流,由此从存储的等离子体热能直接提取电功率。通过将至少两个悬浮导体插入高温等离子体体相中的来实现热等离子体能量-电的等离子体转换(PDC)。这些导体中的一个被外部电磁场或永磁体磁化,或者它是固有磁性的。其他未被磁化。由于重正离子与轻电子的电荷迁移率的差异巨大,导致引起电势差。这个电压被施加在电负载两端。
在实施方式中,图1中示出的动力系统包括额外的内部或外部电磁体或永磁体或者包括多个本征磁化和未磁化PDC电极(诸如,诸如棒PDC电极的圆柱PDC电极)。可通过电磁体(诸如,通过Helmholtz线圈6d)提供与各PDC棒电极6b平行的均匀磁场B的源。这些磁体可以是永磁体(诸如,Halbach阵列磁体)和未冷却的水冷超导电磁体中的至少一个。示例性的超导磁体可包括NbTi、NbSn、或高温超导材料。来自多个阳极棒电极6b的负电压被阳极或负PDC电极17收集。在实施方式中,至少一个磁化PDC棒电极6b平行于施加的磁场B;然而,至少一个对应的对向PDC棒电极6c垂直于磁场B,使得由于其相对于B方向的取向,而导致其未被磁化。来自多个阴极棒电极6c的正电压被阴极或正PDC电极17a收集。功率可通过负电极功率连接器8和正电极功率连接器8a传递到功率调节器/控制器。在实施方式中,电池壁可用作PDC电极。在实施方式中,PDC电极包括在高温气氛环境中是稳定的难熔金属(诸如,高温不锈钢)和本领域的其他技术人员已知的其他材料。在实施方式中,等离子体动力学转换器还包括等离子体约束结构(诸如,磁瓶或诸如Helmholtz线圈6d的螺旋管场的源),用于约束等离子体并且提取含能离子的功率中的更多作为电。
在功率转换器的其他实施方式中,v||>>v⊥时沿着z轴的离子流可随后进入包括增大的轴向磁场梯度的压缩部分,其中,由于绝热不变量=常数,导致平行z轴方向的电子运动的分量v||至少部分被转换成垂直运动v⊥。由于v⊥而导致的方位电流围绕z轴形成。电流在轴向磁场的作用下在运动平面中径向偏转,以在盘生成器磁流体动力学功率转换器的内环和外环MHD电极之间生成霍尔电压。该电压可驱动电流通过电负载。还可使用直接转换器或通向本公开的电装置的其他等离子体将等离子体功率转换成电。在另一个实施方式中,磁场(诸如,Helmholtz线圈6d的磁场)约束等离子体,使得它可被通向电转换器6的等离子体转换成电,电转换器6可以是等离子体动力学功率转换器。在实施方式中,Helmholtz线圈包括磁瓶。PDC转换器6可接近相对于如图1中所示的Helmholtz线圈的等离子体源。对于包括位于单元容器外的磁体的等离子体-电转换器组件,分离壁可包括诸如不锈钢的不含铁材料。例如,将Helmholtz线圈6与包含等离子体的容器1分离的壁或PDC转换器或MHD转换器的侧壁可包括磁通容易穿透的诸如不锈钢的材料。在这个实施方式中,磁体设置在外部,以提供与磁横向取向PDC棒电极横切或与MHD转换器的等离子体膨胀方向横切的磁通。
各单元还输出可分别通过冷却剂入口和出口管线11和12从电极热交换器10并且通过冷却剂入口和出口管线19和20从PDC热交换器18提取的热动力。可直接使用热动力作为热或将热动力转换成电。在实施方式中,动力系统还包括热-电转换器。可使用传统Rankine或Brayton电站(诸如,包括锅炉、蒸汽涡轮机和发电机的蒸汽厂或包括诸如外部加热型气体涡轮机的气体涡轮机和发电机的蒸汽厂)来实现转换。适宜的反应物、再生反应和系统和电站可包括本公开的那些,在全部内容以引用方式并入本文中的本申请人的现有US专利申请(诸如,“Hydrogen Catalyst Reactor”,PCT/US08/61455,2008年4月24日提交的PCT;“Heterogeneous Hydrogen Catalyst Reactor”,PCT/US09/052072,2009年7月29日条的PCT;“Heterogeneous Hydrogen Catalyst Power System”,PCT/US10/27828,2010年3月18日提交的PCT;“Electrochemical Hydrogen Catalyst Power System”,PCT/US11/28889,2011年3月17日提交的PCT;“H2O-Based Electrochemical Hydrogen-Catalyst Power System”,2012年3月30日提交的PCT/US12/31369;“CIHT Power System”,13年5月21日提交的PCT/US13/041938(“Mills的现有申请”))和本申请人的现有公开文献(诸如,R.L.Mills,M.Nansteel,W.Good,G.Zhao,“Design for a BlackLight Power Multi-Cell Thermally Coupled Reactor Based on Hydrogen Catalyst Systems”,Int.J.Energy Research,第36卷,(2012),778-788;doi:10.1002/er.1834;R.L.Mills,G.Zhao,W.Good,“Continuous Thermal Power System”,Applied Energy,第88卷,(2011)789–798,doi:10.1016/j.apenergy.2010.08.024和R.L.Mills,G.Zhao,K.Akhtar,Z.Chang,J.He,X.Hu,G.Wu,J.Lotoski,G.Chu,“Thermally Reversible Hydrino Catalyst Systems as a New Power Source”,Int.J.Green Energy,第8卷,(2011),429–473(“Mills现有热动力转换公开文献”))中。在其他实施方式中,动力系统包括本领域中已知的其他热-电功率转换器(诸如,诸如热离子和热电功率转换器的直接功率转换器和诸如Stirling发动机的其他热力发动机)中的一种。
在实施方式中,10MW动力生成器经历以下步骤:
1.燃料从储料器流入叉指区域中的高度导电固体燃料的大约0.5g部分的一对齿轮和/或支承构件中,其中,低电压、高电流流过燃料,以致使它点燃。点燃释放每部分大约10kJ的能量。齿轮包括60个齿并且以1000RPM旋转,使得点火速率是对应于10MW功率的1kHz。在实施方式中,齿轮被设计成,使得与齿轮直接接触的燃料粉末层没有携带用于引爆的临界电流密度,然而体相区域这样,使得保护齿轮免受因燃料点燃带来的爆炸而腐蚀。
2.基本上完全电离的等离子体在垂直于齿轮的轴上膨胀到齿轮外部并且进入磁流体动力学或等离子体动力学转换器,其中,等离子体流体被转换成电力。另选地,从使用光伏动力转换器被转换成电力的等离子体发出明亮的光。
3.电力的一部分使电源为电极供电并且剩余的可供应到外部负载之后由对应单元进行功率调节。电极热交换器从齿轮毂带走的热流向再生系统热交换器,剩余的流向外部热负载。
4.等离子体气体冷凝成包括不带H2O的固体燃料的产物。
5.螺旋钻(诸如,制药或食品行业中使用的螺旋钻)将产物粉末传送到再生系统,在再生系统中与蒸汽水合,其中,因H2O贮存器中的H2O在再生系统热交换器的热线圈上方流动,形成蒸汽。
6.通过螺旋钻将再生的固体燃料传送到储料器,只要添加回H2O就允许连续使用燃料。
假设0.5克固体燃料产生1kJ的能量。假设燃料的密度是Cu的密度(8.96g/cm3),然后叉指区域中的各齿的燃料体积是0.056cm3。如果实现通过燃料的高度导电性的导电深度是2mm,则通过各齿轮的三角形齿的叉指间隙所限定的燃料基体是4mm,并且齿轮宽度是0.11cm3/(0.2)(0.4)=1.39cm。在另一个实施方式中,如下给出示例性的10MW发电机的H2O消耗:
H2O→H2(1/4)+1/2O2(50MJ/摩尔H2O);10MJ/s/50MJ/mole H2O=0.2moles(3.6g)H2O/s或13kg/h=13升/小时。考虑其中1分钟内因点燃和再生而重新循环的0.5g固体燃料产生10kJ的示例性情况下,如下给出固体燃料的存量:10MJ/s×0.5g/10kJ=500g/s(30kg/分)并且固体燃料存量是30kg或大约3升。
H.具有光功率的光伏转换的电弧和高DC、AC、和DC-AC混合物电流分数氢等离子体电池
在本公开的示例性实施方式中,具有光功率的光伏转换的动力系统可包括相对于SF-CIHT电池在本文中公开的组件中的任一个。例如,某些实施方式包括以下中的一个或更多个:容器能够具有大气压、高于大气压和低于大气压中的至少一个的压力;反应物可包括用于形成催化剂的源、催化剂、原子氢的源和原子氢中的至少一个的H2O的源和导电基质;反应物可包括包括H2O的源,包括体相H2O、除了体相H2O外的状态、经历用于形成H2O和释放结合H2O的反应中的至少一个的化合物(一种或多种);结合H2O可包括与H2O相互作用的化合物,其中,H2O处于吸附H2O、结合H2O、物理吸附H2O、和水合水中的至少一个的状态;反应物可包括导体和一种或更多种化合物或材料,这些化合物或材料经历释放体相H2O、吸附H2O、结合H2O、物理吸附H2O和水合水中的至少一个并且其反应产物具有H2O;新生H2O催化剂的源和原子氢的源中的至少一个可包括a)至少一个H2O的源、b)至少一个氧的源和c)至少一个氢的源中的至少一个;反应物可形成催化剂的源、催化剂、原子氢的源和原子氢中的至少一个,可包括a)H2O和H2O的源、b)O2、H2O、HOOH、OOH-、过氧离子、超氧离子、氢化物、H2、卤化物、氧化物、氢氧化合物、氢氧化物、含氧化合物、水合化合物、选自卤化物、氧化物、氢氧化合物、氢氧化物、含氧化合物中的至少一个的组的水合化合物和c)导电基质中的至少一个;氢氧化合物可包括TiOOH、GdOOH、CoOOH、InOOH、FeOOH、GaOOH、NiOOH、AlOOH、CrOOH、MoOOH、CuOOH、MnOOH、ZnOOH、和SmOOH的组中的至少一个,氧化物可包括CuO、Cu2O、CoO、Co2O3、Co3O4、FeO、Fe2O3、NiO、和Ni2O3的组中的至少一个;氢氧化物可包括Cu(OH)2、Co(OH)2、Co(OH)3、Fe(OH)2、Fe(OH)3、和Ni(OH)2的组中的至少一个,含氧化合物可包括硫酸盐、磷酸盐、硝酸盐、碳酸盐、碳酸氢盐、铬酸盐、焦磷酸盐、过硫酸盐、高氯酸盐、过溴酸盐、和高碘酸盐、MXO3、MXO4(M=诸如碱金属(诸如,Li、Na、K、Rb、Cs)的金属;X=F、Br、Cl、I)、钴镁氧化物、镍镁氧化物、铜镁氧化物、Li2O、碱金属氧化物、碱土金属氧化物、CuO、CrO4、ZnO、MgO、CaO、MoO2、TiO2、ZrO2、SiO2、Al2O3、NiO、FeO、Fe2O3、TaO2、Ta2O5、VO、VO2、V2O3、V2O5、P2O3、P2O5、B2O3、NbO、NbO2、Nb2O5、SeO2、SeO3、TeO2、TeO3、WO2、WO3、Cr3O4、Cr2O3、CrO2、CrO3、CoO、Co2O3、Co3O4、FeO、Fe2O3、NiO、Ni2O3、稀土氧化物、CeO2、La2O3、氢氧化合物、TiOOH、GdOOH、CoOOH、InOOH、FeOOH、GaOOH、NiOOH、AlOOH、CrOOH、MoOOH、CuOOH、MnOOH、ZnOOH、和SmOOH的组中的至少一个,导电基质可包括金属粉末、碳、碳化物、硼化物、氮化物、诸如TiCN的甲腈、或腈的组中的至少一个。
在本公开的其他实施方式中,动力系统可包括以下中的一个或更多个:反应物可包括金属、其金属氧化物和H2O的混合物,其中,金属与H2O的反应就热力学而言是不利的;反应物可包括过渡金属、碱土金属卤化物和H2O的混合物,其中,金属与H2O的反应就热力学而言是不利的;反应物可包括导体、吸湿材料和H2O的混合物;导体可包括金属粉末或碳粉末,其中,金属或碳与H2O的反应就热力学而言是不利的;吸湿材料可包括溴化锂、氯化钙、氯化镁、氯化锌、碳酸钾、磷酸钾、诸如KMgCl3·6(H2O)的光卤石、柠檬酸铁铵、氢氧化钾和氢氧化钠和浓硫酸和磷酸、纤维素纤维、糖、焦糖、蜂蜜、甘油、乙醇、甲醇、柴油燃料、甲基苯丙胺、肥料化学品、盐、干燥剂、二氧化硅、活性炭、硫酸钙、氯化钙、分子筛、沸石、潮解材料、氯化锌、氯化钙、氢氧化钾、氢氧化钠和潮解盐的组中的至少一个;动力系统可包括导体、吸湿材料和H2O的混合物,其中,(金属)、(吸湿材料)、(H2O)的相对摩尔量的范围是大约(0.000001至100000)、(0.000001至100000)、(0.000001至100000);(0.00001至10000)、(0.00001至10000)、(0.00001至10000);(0.0001至1000)、(0.0001至1000)、(0.0001至1000);(0.001至100)、(0.001至100)、(0.001至100);(0.01至100)、(0.01至100)、(0.01至100);(0.1至10)、(0.1至10)、(0.1至10);(0.5至1)、(0.5至1)、(0.5至1)中的至少一个;与H2O的反应就热力学而言不利的金属可以是Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的组中的至少一个;可通过添加H2O来再生反应物;反应物可包括金属、其金属氧化物和H2O的混合物,其中,金属氧化物能够在低于1000℃的温度下进行H2还原;反应物可包括不容易在轻微热的情况下被H2还原的氧化物、其氧化物在低于1000℃的温度下能够被H2还原成金属的金属、和H2O的混合物;其氧化物可在低于1000℃的温度下能够被H2还原成金属的金属是Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的组中的至少一个;可能不容易在轻微热的情况下被H2还原的金属氧化物包括氧化铝、碱土氧化物和稀土氧化物中的至少一个;固体燃料可包括碳或活性碳和H2O,其中,通过在添加H2O的情况下进行再水合来再生混合物;反应物可包括浆液、溶液、乳液、复合物和化合物中的至少一个;H2O摩尔%含量可在大约0.000001%至100%、0.00001%至100%、0.0001%至100%、0.001%至100%、0.01%至100%、0.1%至100%、1%至100%、10%至100%、0.1%至50%、1%至25%、和1%至10%的至少一个范围内;可传递高电流电能的短脉冲的电源的电流充分大,足以致使分数氢反应物经历非常高速的形成分数氢的反应。
在本公开的一些实施方式中,动力系统可包括以下中的一个或更多个:可传递高电流电能的短脉冲的电源包括被选择成致使100A至1,000,000A、1kA至1,00,000A、10kA至50kA中的至少一个的范围内的电流的高AC、DC、或AC-DC混合的电压;在100A/cm2至1,000,000A/cm2、1000A/cm2至100,000A/cm2、和2000A/cm2至50,000A/cm2中的至少一个的范围内的DC或峰值AC电流密度中的至少一个,通过固体燃料或含能材料的导电性确定电压,其中,通过所期望电流乘以固体燃料或含能材料样本的电阻来给出电压;DC或峰值AC电压可以在从大约0.1V至500kV、0.1V至100kV和1V至50kV中选择的至少一个范围内,并且AC频率可以在大约0.1Hz至10GHz、1Hz至1MHz、10Hz至100kHz、和100Hz至10kHz的范围内;固体燃料或含能材料样本的电阻可在从0.001毫欧至100兆欧、0.1欧姆至1兆欧和10欧姆至1千欧中选择的至少一个范围内,并且有效用于形成分数氢的每电极面积的合适负载的导电率可在从大约10-10ohm-1cm-2至106ohm-1cm-2、10-5ohm-1cm-2至106ohm-1cm-2、10-4ohm-1cm-2至105ohm-1cm-2、10-3ohm-1cm-2至104ohm-1cm-2、10-2ohm-1cm-2至103ohm-1cm-2、10-1ohm-1cm-2至102ohm-1cm-2、和1ohm-1cm-2至10ohm-1cm-2中选择的至少一个范围内;再生系统可包括水合、热、化学和电化学系统中的至少一个;光伏动力转换器可包括光子-电功率转换器;动力系统可包括光分配系统或聚光光伏装置;光伏动力转换器可包括光子-热动力转换器;动力系统可包括热-电功率转换器、聚光太阳能发电装置、跟踪器、或能量存储装置;动力系统可以可操作地连接到电网;动力系统可包括独立系统;光伏动力转换器可包括多个多结光伏电池;多结光伏电池可以是三结光伏电池;光伏动力转换器可位于真空单元内;光伏动力转换器可包括抗反射涂层、光阻匹配涂层、或保护涂层中的至少一个;光伏动力转换器可以可操作地联接到被构造成清洁光伏动力转换器的至少一部分的清洁系统;动力系统可包括光滤波器;光伏动力转换器可包括单晶电池、多晶电池、非晶电池、串/带硅电池、多结电池、同质结电池、异质结电池、p-i-n器件、薄膜电池、染料敏化电池和有机光伏电池中的至少一个;光伏动力转换器可包括多结电池,其中,多结电池包括倒置电池、直立电池、晶格失配电池、晶格匹配电池、包括III-V族半导体材料的电池中的至少一个;动力系统可包括能操作联接到光伏动力转换器的输出功率调节器和能操作联接到输出功率调节器的输出功率端子;动力系统可包括逆变器或能量存储装置;从输出功率端子输出的功率的一部分可被导向能量存储装置或动力生成系统的组件或多个电极或外部负载或电网。
在实施方式中,CIHT电池包括被称为分数氢等离子体电池的分数氢形成等离子体电池,其中,光功率的至少一部分被光伏转换器转换成电力。高电流可以是DC、AC、或其组合。等离子体气体可包括H的源或HOH催化剂(诸如,H2O)的源中的至少一个。另外合适的等离子体气体是H2O、H的源、H2、氧的源、O2和诸如稀有气体的惰性气体中的至少一个的混合物。气体压力可在大约0.001托至100atm、1托至50atm、和100托至10atm中的至少一个的范围内。电压可以高(诸如,在大约50V至100kV、1kV至50kV和1kV至30kV中的至少一个的范围内)。电流可在大约0.1mA至100A、1mA至50A和1mA至10A中的至少一个的范围内。等离子体可包括电弧,这些电弧具有高得多的电流(诸如,在大约1A至100kA、100A至50kA和1kA至20kA中的至少一个的范围内的电流)。在实施方式中,高电流使分数氢反应速率加速。在实施方式中,电压和电流是AC。驱动频率可以是射频(诸如,在3kHz至15kHz的范围内)。在实施方式中,频率在大约0.1Hz至100GHz、100Hz至10GHz、1kHz至10GHz、1MHz至1GHz和10MHz至1GHz中的至少一个的范围内。暴露于等离子体气体的至少一个电极的导体可提供支持电弧等离子体的电子热离子和场发射。
在实施方式中,电池包括施加的在包括H的源和HOH催化剂的源的等离子体气体中实现击穿的高电压功率源。等离子体气体可包括水蒸气、氢、氧的源和诸如稀有气体(诸如,氩气)的惰性气体中的至少一个。高电压功率可包括直流(DC)、交流(AC)及其混合物。等离子体气体中的击穿致使导电率大幅增加。功率源能够具有高电流。施加比击穿电压低的较低电压下的高电流,以致使HOH催化剂以高速率将H催化成分数氢。高电流可包括直流(DC)、交流(AC)及其混合物。
高电流等离子体电池的实施方式包括能够形成HOH催化剂和H的等离子体气体。等离子体气体包括HOH的源和H的源(诸如,H2O和H2气体)。等离子体气体还可包括允许、增强、或保持HOH催化剂和H的另外气体。其他合适的气体是稀有气体。电池包括至少一组电极、至少一个天线、至少一个RF线圈和至少一个微波腔室中的至少一个,微波腔室可包括天线并且还包括至少一个击穿功率源(诸如,能够产生足以致使等离子体气体被电击穿的电压或电子或离子能量的击穿功率源)。电压可以在大约10V至100kV、100V至50kV和1kV至20kV中的至少一个的范围内。等离子体气体可初始地处于液体状态以及气态状态。在作为液体H2O或包括液体H2O的介质中可形成等离子体。气体压力可以在大约0.001托至100atm、0.01托至760托、和0.1托至100托中的至少一个的范围内。电池可包括一旦实现了击穿就提供高电流的至少一个辅助功率源。还可由击穿电源提供高电流。功率源中的每个可以是DC或AC。任一个的频率范围可在至少大约0.1Hz至100GHz、100Hz至10GHz、1kHz至10GHz、1MHz至1GHz和10MHz至1GHz中的至少一个的范围内。高电流可在大约1A至100kA、10A至100kA、1000A至100kA、10kA至50kA中的至少一个的范围内。高放电电流密度可在0.1A/cm2至1,000,000A/cm2、1A/cm2至1,000,000A/cm2、10A/cm2至1,000,000A/cm2、100A/cm2至1,000,000A/cm2和1kA/cm2至1,000,000A/cm2中的至少一个的范围内。在实施方式中,可间歇性施加击穿和辅助高电流功率源中的至少一个。间歇频率可在大约0.001Hz至1GHz、0.01Hz至100MHz、0.1Hz至10MHz、1Hz至1MHz和10Hz至100kHz中的至少一个的范围内。占空比可在大约0.001%至99.9%、1%至99%和10%至90%中的至少一个的范围内。在实施方式中,因包括诸如RF功率源和DC功率源的AC,DC功率源与AC功率源隔开至少一个电容器。在实施方式中,用于形成分数氢的H的源(诸如,H2和H2O中的至少一个)以保持给出所期望电池增益(诸如,其中分数氢功率分量超过输入电功率的电池增益)的分数氢分量-输出功率的速率供应到电池。
在实施方式中,等离子体气体被液体H2O取代,液体H2O可以是纯的或包括诸如浓盐水的盐的水溶液。溶液可伴随发生AC激发(诸如,诸如RF的高频辐射)或微波激发。包括诸如浓盐水的H2O的激发介质可放置在RF发送器和接收器之间。RF发送器或天线从RF发生器接收RF功率,RF发生器能够生成其频率和功率能够被包括H2O的介质吸收的RF信号。电池和激发参数可以是本公开的电池和激发参数中的一个。在实施方式中,RF频率可在大约1MHz至20MHz的范围内。RF激发源还可包括将负载阻抗与发送器匹配的调谐电路或匹配网络。金属颗粒可悬浮在H2O或盐溶液中。入射的功率可以高(诸如,在0.1W/cm2至100kW/cm2、0.5W/cm2至10kW/cm2和0.5W/cm2至1kW/cm2中的至少一个的范围内),以致使由于入射辐射与金属颗粒相互作用而造成等离子体中的电弧。可调节金属颗粒的大小使电弧形成最佳。合适的颗粒大小在大约0.1μm至10mm的范围内。电弧带有高电流,高电流造成伴随高动能出现的分数氢反应。在另一个实施方式中,等离子体气体包括诸如H2O蒸气的H2O,电池包括还伴随发生高频辐射(诸如,RF或微波)的金属物体。集中在金属物体的尖锐点的场造成含H2O的等离子体气体中的电弧,使分数氢反应速率大大增强。
在实施方式中,高电流等离子体包括电弧。电弧等离子体可具有优于辉光放电等离子体的分辨特征。在前一种情况下,电子和离子温度可近似,而在后一种情况下,电子热能可比离子热能大得多。在实施方式中,电弧等离子体电池包括箍缩等离子体。等离子体气体(诸如,含H2O的等离子体气体)保持在足以形成电弧等离子体的压力下。压力可以高(诸如,在大约100托至100atm的范围内)。在实施方式中,击穿和高电流功率供应可以是相同的。可通过包括多个电容器的功率源在含液体H2O的高压H2O中形成电弧,这多个电容器包括能够供应高电压(诸如,在大约1kV至50kV的范围内的电压)和高电流(诸如,可随电阻和电压因电弧形成和保持减小而增大的高电流)的电容器的组,其中,电流可在大约0.1mA至100,000A的范围内。可通过将电容器串联连接来增大电压并且可通过将电容器并联连接来增大电容,以实现所期望的高电压和电流。电容可足以将等离子体保持长持续时间(诸如,0.1s至超过24小时)。功率电路可具有一旦形成电弧就予以保持的另外元件(诸如,辅助高电流功率源)。在实施方式中,电源包括可顺序向电弧供应功率的多个电容器组,其中,当给定的充电后的电容器组被放电时,可通过充电源对放电后的各电容器组进行重新充电。这多个组可足以保持稳态的电弧等离子体。在另一个实施方式中,用于将等离子体击穿和高电流中的至少一个提供到电弧等离子体的功率源包括至少一个变压器。在实施方式中,在高DC重复频率(诸如,在大约0.01Hz至1MHz的范围内)下创建电弧。在实施方式中,阴极和阳极的作用可周期性互换。互换的频率可以低,以保持电弧等离子体。交替电流的周期频率可以是大约0Hz至1000Hz、0Hz至500Hz和0Hz至100Hz中的至少一个。功率源可具有以所期望频率保持分数氢反应速率的最大电流极限。在实施方式中,高电流可用于控制分数氢产生功率来提供可变功率输出。通过功率源控制的高电流极限可在大约1kA至100kA、2kA至50kA和10kA至30kA中的至少一个的范围内。电弧等离子体可具有包括电压行为随电流增大而减小的负电阻。等离子体弧电池功率电路可包括正阻抗形式(诸如,以所期望大小创建稳定电流的电爆炸)。电极可具有所期望几何形状,以在二者之间提供电场。合适的几何形状是中心圆柱电极和外部同心电极、平行板电极和对向棒或圆柱体中的至少一个。电极可提供阴极处的电子热离子和场发射中的至少一个,以支持电弧等离子体。可形成高电流密度(诸如,高达大约106A/cm2的高电流密度)。电极可包含具有高熔点的材料(诸如,诸如W或Mo的难熔金属的组中的材料)和与水的反应率低的材料(诸如,Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的组中的材料)中的至少一个。在实施方式中,电极可以是能移动的。电极可被放置成彼此接近或直接接触,然后被机械分离,以引发和保持电弧等离子体。在这种情况下,击穿电压可比其中电极以固定间隙永久分离的情况下小得多。用可移动的或间隙可调节的电极施加的形成弧的电压可在大约0.1V至20kV、1V至10kV和10V至1kV的范围内。可调节电极分离,从而以期望电流或电流密度保持稳态的电弧。
在实施方式中,在水-电弧等离子体中,生成包括OH、HOH、O2、nO和nH中的至少一个(n是整数)的催化剂。在图2B中示出H2O电弧等离子体电池动力生成器100的示意图。电弧等离子体电池109包括诸如外圆柱电极106和中轴电极103(诸如,中心杆)的两个电极连同电池顶盖111和绝缘体基底102,电池顶盖111和绝缘体基底102可限定电池109的能够具有真空、大气压和大于大气的压力中的至少一个的电弧等离子体腔室。电池109被供应电弧等离子体气体或液体(诸如,H2O)。另选地,电极103和106被浸没在容器109中包含的电弧等离子体气体或液体(诸如,H2O)中。可通过添加离子源(诸如,可溶解诸如盐的离子化合物),使H2O更具导电性,以实现较低电压下的电弧击穿。盐可包括氢氧化物或卤化物(诸如,碱氢氧化物或卤化物)或本公开的其他盐。供应可来自诸如罐107的源,罐107具有阀108和气体或液体通过其流入电池109中的管线110,并且排放气体通过具有至少一个压力计115和阀116的出口管线126流出电池,其中,泵117去除电池109中的气体,以保持所期望流速和压力中的至少一个。在实施方式中,等离子体气体保持高流速状况(诸如,诸如大气压和更高的高压下的超声速流速),以向分数氢反应提供足够大量的反应物流量,以所期望水平产生基于分数氢的功率。合适的示例性流速实现了超过输入功率的基于分数氢的功率。另选地,液体水可在电池109中(诸如,以电极为边界的贮存器中)。电极103和106通过电池功率连接器124连接到高电压-高电流功率供应123。可通过基底板101进行与中心电极103的连接。在实施方式中,可由另一个功率源(诸如,充电源121)通过连接器122供应功率源123。高电压-高电流功率源123可包括电容器组,电容器可串联以提供高电压并且平行以提供高电容和高电流,并且功率源123可包括多个这样的电容器组,其中,各组可被暂时放电和充电,以提供可接近连续输出的功率输出。可通过充电源121对电容器组(一个或多个)进行充电。
在实施方式中,可通过AC功率源123为电极(诸如,103)提供功率,AC功率源123可以是高频率并且可以是高功率(诸如,由诸如Tesla线圈的RF发生器提供的高功率)。在另一个实施方式中,电极103包括微波等离子体炬的天线。功率和频率可以是本公开的功率和频率(诸如,分别地在每升大约100kHz至100MHz或100MHz至10GHz和100W至500kW的范围内)。在实施方式中,圆柱电极可包括仅一个电池壁并且可包括绝缘体(诸如,石英、陶瓷、或氧化铝)。电池间隙111还可包括电极(诸如,接地或未接地电极)。电池可进行操作,以形成至少部分覆盖电弧等离子体电池109内的电极103的等离子体弧或H2O电子流。电弧或电子流大大增强分数氢反应速率。
在实施方式中,电弧等离子体电池109被关闭,以约束热能释放。随后密封的电池内部的水根据本领域的技术人员已知的所期望操作温度和压力下的H2O相图而处于液体和气态混合物的标准状况。操作温度可在大约25℃至1000℃的范围内。操作压力可在大约0.001atm至200atm、0.01atm至200atm、和0.1atm至100atm中的至少一个的范围内。电池109可包括汽化器,在汽化器中,包括热水、超高温水、蒸汽、和超高温蒸汽的至少一个相流出蒸汽出口114并且供应到热或机械负载(诸如,蒸汽涡轮)以发电。出口流体的冷却和蒸汽的冷凝中的至少一个处理伴随着向着负载的热动力传递发生,冷却后的蒸汽或水通过回路112返回电池。另选地,返回补给的蒸汽或水。系统可闭合并且还可包括泵113(诸如,H2O循环或回流泵)以循环用作冷却剂的处于其物理状态的H2O。电池还可包括热交换器119,热交换器119可以在内部或外部电池壁上,将热能带到冷却剂中,冷却剂进入冷却剂入口118时是冷的,在离开冷却剂出口120时是热的。此后,热冷却剂流向热负载(诸如,纯热负载)或热-机械动力转换器或热-电功率转换器(诸如,蒸汽或气体涡轮机或诸如蒸汽发动机和可选地发电机的热力发动机)。将热转换成的机械或电功率的其他示例性转换器是Rankine或Brayton循环发动机、Stirling发动机、热离子和热电转换器和本领域中已知的其他系统。在其全部内容以引用方式并入本文中的Mills现有申请中还公开了热-机械和电转换中的至少一个的系统和方法。
在实施方式中,诸如碳的电极103和106或诸如钨或铜电极的金属电极可被供给到电池109,因为它们由于等离子体而腐蚀。当被连续充分腐蚀或更换时,可更换电极。可从电池收集诸如沉淀物的腐蚀产物并且将其再循环到新电极。因此,电弧等离子体电池动力生成器还包括电极腐蚀产物复原系统105、电极再生系统104和再生电极连续供给装置125。在实施方式中,可通过本公开的系统和方法再生往往大部分会腐蚀的至少一个电极(诸如,诸如中心电极103的阴极)。例如,电极可包括选自其对应的氧化物可通过H2处理、加热和真空下加热被还原的Cu、Ni、Pb、Sb、Bi、Co、Cd、Ge、Au、Ir、Fe、Hg、Mo、Os、Pd、Re、Rh、Ru、Se、Ag、Tc、Te、Tl、Sn、W、Al、V、Zr、Ti、Mn、Zn、Cr和In的一种金属。再生系统104可包括用于熔融氧化物和金属中的至少一个并且用再生金属浇铸或挤压出电极的炉子。用于金属冶炼和成型或铣削的系统和方法是本领域的技术人员熟知的。在另一个实施方式中,再生系统104可包括电解电池(诸如,含金属离子的熔融盐电解电池),其中,可使用本领域熟知的系统和方法通过电沉积将电极金属镀到电极上。
在图2B中示出的等离子体电池(诸如,电弧等离子体电池109)的实施方式中,H2O电弧等离子体电池输出高光功率,通过光伏动力转换器将光转换成电。在实施方式中,电池顶盖111包括用于接收高光功率并且将其转换成电的光伏动力转换器。在另一个实施方式中,电极103和106中的至少一个包括对于光而言至少部分透明的栅网电极。透明可以是由于电极的导电部分之间的间隙。光伏转换器设置在栅网电极后方,将光功率转换成电。在另一个实施方式中,电极103和106包括平行板。平行板电极可被约束在可被密封的电池109中。可通过横切电极所形成的平面的光伏转换器106a接收高光功率。光伏转换器可包括光伏电池并且还可包括对于光功率而言透明的窗口,以保护电池免受因电弧等离子体的压力波而受损。支持等离子体和电弧等离子体(诸如,含H2O的等离子体)中的至少一个并且包括便于光渗透到光伏转换器(诸如,本领域的技术人员已知的光伏转换器)的至少一个区域的电极和电极构造和设计的其他实施方式在本公开的范围内。
在实施方式中,分数氢电池包括用于形成分数氢连续发射的箍缩等离子体源。电池包括阴极、阳极、功率源、和用于形成箍缩等离子体的氢的源和HOH催化剂的源中的至少一个。等离子体系统可包括稠密等离子体焦点源(诸如,本领域的技术人员已知的稠密等离子体焦点源)。等离子体电流可非常高(诸如,大于1kA)。等离子体可以是电弧等离子体。辨别特征是等离子体气体包括H和HOH或H催化剂中的至少一个并且可优化等离子体条件以给出氢连续发射。在实施方式中,用光电转换器106a或111将光功率转换成电。
I.光伏光学-电功率转换器
在图2A中示出的SF-CIHT电池动力生成器的替代等离子体功率转换器6中,通过点燃固体燃料3而生成的等离子体被高度电离。分数氢催化反应(诸如,通过等式(6-9)和(44-47)给出的分数氢催化反应)以及形成分数氢时释放的能量导致燃料电离。离子与自由电子复合,发射光。因激发态的原子、离子、分子、化合物和材料衰退,发射另外的光。光入射到光伏转换器6上。光伏动力转换器6包括阴极6c和阳极6b,阴极6c和阳极6b均分别通过阴极和阳极输出功率连接器8a和8连接到输出功率控制器/调节器7。光可被光子-电转换器6(诸如,真空容器1内部的光伏瓦片)接收。光伏动力转换器可被至少一个热交换器18冷却,热交换器18通过光伏冷却剂入口管线19接收冷的冷却剂并且通过光伏冷却剂出口管线20排出热的冷却剂。本文中给出的关于SF-CIHT电池的光功率转换成电的光伏转换的公开内容也应用于具有光功率的光伏转换的电弧和高DC、AC和DC-AC混合物电流分数氢等离子体电池。
光伏转换器6可包括用于诸如一氧化硅的抗反射层或涂层、光学阻抗匹配、和用于免受等离子体或动能材料而腐蚀或受损进行保护中的至少一个的涂层。膜可包括窗口。窗口还可包括用于清洁爆炸产物的系统,爆炸产物覆盖窗口并且至少部分阻挡了光伏转换器的透光。在实施方式中,光学窗口被清洁。清洁可包括化学清洁或蚀刻和等离子体清洁或蚀刻的至少一种系统和方法。该窗口可包括多个窗口,各窗口可被移除,使得用一个更换另一个并且用于将光透射到转换器,而清洁至少一个其他窗口上的爆炸产物。在实施方式中,清洁光学窗口。清洁可包括化学清洁或蚀刻和等离子体清洁或蚀刻的至少一种系统和方法。在实施方式中,诸如惰性气体的气体的蒸汽在与膨胀的点燃等离子体相反的方向上流动,以防止产物覆盖保护窗口、光收集系统(诸如,光纤电缆和反射镜中的至少一个)和光伏转换器中的至少一个。
SF-CIHT动力生成器(图2A)的光伏动力转换器还可包括光分配系统,用于将SF-CIHT电池的光功率提供到可布置成紧凑设计的多个光伏电池。在光伏转换器6的实施方式中,光输出(光功率)被导向多个光伏转换器6。可通过光学分配系统(诸如,包括反射镜和透镜中的至少一个的光学分配系统)来分配光输出。在一个实施方式中,用抛物面反射镜的焦点处的透镜,将光形成为光束,并且将其导向输出入射到光伏电池6上的平行光线的另一个抛物面反射镜的焦点处的透镜。系统包括多个这种抛物面反射镜、透镜和光伏电池。还可使用分束器、棱镜、光栅、漫射器和本领域的技术人员已知的其他光学元件来引导和分配光。诸如棱镜或光栅的元件可将光输出的多个波长范围或带分开,使得其可被导向在各带的波长范围内光-电转换具有最大效率的光伏电池。在另一个实施方式中,光功率被收集在光纤电缆束中。可用至少一个或更多个透镜和一个或更多个光学阻抗匹配板(诸如,四分之一波长板)来实现收集。光分配系统还可包括至少一个反射镜,用于将被光纤电缆反射回电缆入口、光收集系统和阻抗匹配板中的至少一个的任何光向电缆反射。反射镜可处于点燃的中心,其中,光充当距离反射镜中心的点源。反射镜可处于图1和图2的齿轮电极的平面处。反射镜可包括一对反射镜,这对反射镜将光在相反方向上向对向匹配的光伏转换器反射(如图2A中所示)。对向反射镜可将光反射回光分配系统(诸如,包括光纤电缆的光分配系统)中。反射镜可具有优化将背反射光向光分配系统反射的形状。可针对波长带来选择光纤电缆的光纤电缆元件,以可将光选择性导向在带的波长范围内具有最大光-电转换效率的多个匹配的光伏电池。在另一个实施方式中,光分配系统和光伏动力转换器包括布置成叠堆的多个透明或半透明的光伏电池,使得随着光渗透到堆叠中,点燃带来的光功率被转换成堆叠中的成员处的电。在实施方式中,在黑体通过诸如膨胀的机制冷却之前,收集点燃带来的光。等离子体可被保持在磁瓶(诸如,Helmholtz线圈所生成的磁瓶)中,以防止膨胀或碰撞损失,使得可通过辐射提取最大功率。
在实施方式中,光伏转换器可包括热光电转换器。电池1可包括吸收因燃料点燃带来的热的至少一个壁并且升温的壁向光伏转换器6发射光。光伏转换器6可在被密封电池1的外部。诸如光伏热交换器18的热交换器具有能够进行高热动力传递的冷却剂。冷却剂可包括水或其他液体(诸如,本领域的技术人员已知的溶剂或液体金属或盐)。在实施方式中,热交换器和热交换器的组件中的至少一个可包括热管。热管流体可包括熔融盐或金属。示例性金属是铯、NaK、钾、钠、锂和银。
在另一个实施方式中,通过磁或电场约束中的至少一种来约束等离子体,使等离子体与光子-电转换器的接触最小。磁约束可包括磁瓶。可通过Helmholtz线圈6d提供磁约束。在其他实施方式中,转换器将来自等离子体中的带电或中性物种(诸如,含能电子、离子和氢原子)的动能转换成电。这个转换器可与等离子体接触,以接收含能物种。
在实施方式中,SF-CHIT生成器包括氢催化剂电池,氢催化剂电池生成具有等式(1)所给出的键能的原子和电激发状态的高粒子数的原子和离子(诸如,燃料材料中的原子和离子)中的至少一个。用自发发射或受激发射将功率作为光子发射。使用本公开的光子-电转换器(诸如,光电或光伏电池)将光转换成电。在实施方式中,功率电池还包括本公开的氢激光器。
在实施方式中,光子执行传播至并且变成入射到光伏电池上和从激光器腔体的半透明反射镜射出和照射光伏电池中的至少一个动作。可使用按全部内容以引用方式并入本文中的用于将激光功率转换成电功率的光伏电池的以下参考文献中描述的光伏电池,将固有功率和激光功率转换成电:L.C.Olsen,D.A.Huber,G.Dunham,F.W.Addis,“High efficiency monochromatic GaAs solar cells”,in Conf.Rec.22nd IEEE Photovoltaic Specialists Conf.,Las Vegas,NV,第I卷,1991年10月,第419-424页;R.A.Lowe,G.A.Landis,P.Jenkins,“Response of photovoltaic cells to pulsed laser illumination”,IEEE Transactions on Electron Devices,第42卷第4期,1995年,第744-751页;R.K.Jain,G.A.Landis,“Transient response of gallium arsenide and silicon solar cells under laser pulse”,Solid-State Electronics,第4卷第11期,1998年,第1981-1983页;P.A.Iles,“Non-solar photovoltaic cells”,in Conf.Rec.21st IEEE Photovoltaic Specialists Conf.,Kissimmee,FL,第I卷,1990年5月,第420-423页。
在光学和激光功率转换器中的至少一个的实施方式中,使用束形成光学器件,光束和激光束中的至少一个减少并且遍布较大面积,如L.C.Olsen,D.A.Huber,G.Dunham,F.W.Addis,“High efficiency monochromatic GaAs solar cells”,in Conf.Rec.22nd IEEE Photovoltaic Specialists Conf.,Las Vegas,NV,第I卷,1991年10月,第419-424页中描述的,全部内容以引用方式并入本文。束形成光学器件可以是透镜或漫射器。电池1还可包括将光引导到光伏器件上的反射镜或透镜。反射镜还可存在于电池壁上,用于增加诸如氢Lyman系发射(hydrogen Lyman series emission)的路径长度,以保持进一步可因碰撞或光子受激发的激发态。
在另一个实施方式中,使用光伏器件将来自基于水的燃料等离子体的自发或受激发射转换成电功率。可使用带隙与波长匹配的现有光伏(PV)电池,以显著的功率密度和效率来实现自发和受激发射中的至少一个转换成电。响应于紫外和极紫外光的本公开的功率转换器的光电池包括抗辐射加固的传统电池。由于光子的能量较高,因此相比于转换较低能量光子的那些,能实现可能更高的效率。可通过保护涂层(诸如,铂或其他贵金属的原子层)来实现加固。在实施方式中,光伏器件具有高带隙(诸如,光伏器件含氮化镓)。
在使用光伏器件进行功率转换的实施方式中,可通过荧光体将高能光转换成低能光。在实施方式中,荧光体是将电池的短波长光有效转换成长波长光的气体,光伏器件对长波长光更具响应性。荧光气体百分比可在任何所期望范围内(诸如,在大约0.1%至99.9%、0.1%至50%、1%至25%和1%至5%中的至少一个范围内)。荧光气体可以是惰性气体(诸如,稀有气体)或因引爆而成为气态的元素或化合物(诸如,诸如碱、碱土、或过渡金属)的气体。在实施方式中,氩包括爆炸物中使用的氩烛光(candle),以在可见范围内发射用于光伏转换成电的亮光。在实施方式中,将荧光体涂覆在电池1的透明壁上,使得受激荧光体所发射的光子更接近地匹配可环绕荧光体涂覆壁的光伏器件的峰值波长效率。在实施方式中,在等离子体中添加形成受激准分子的物种,以吸收因形成分数氢带来的功率并且有助于形成受激态的大粒子数和反转粒子数中的至少一个。在实施方式中,固体燃料或添加的气体可包括卤素。可添加诸如氦、氖和氩的至少一种贵金属,使得形成受激准分子。可通过受激准分子自发或激光发射来提取功率。光功率被入射到光伏转换器6上并且被转换成电。
在这个示例性实施方式中,SF-CIHT电池动力生成系统包括光伏动力转换器,光伏动力转换器被构造成采集燃料点燃反应所生成的等离子体光子并且将它们转换成可使用的能量。在一些实施方式中,可期望高转换效率。反应器可在多个方向上(例如,至少两个方向上)排出等离子体,并且反应半径可以是大致几毫米至几米(例如,大约1mm至大约25cm)的级别。另外,因燃料点燃而生成的等离子体的光谱可类似于太阳所生成的等离子体的光谱和/或可包括另外的短波长辐射。
根据Wien位移定律[A.Beiser,Concepts of Modern Physics,第四版,McGraw-Hill Book Company,New York,1978年,第329-340页],T=6000K下具有黑体最大能量密度的波长λmax是
Stefan-Boltzmann定律[A.Beiser,Concepts of Modern Physics,第四版,McGraw-Hill Book Company,New York,1978年,第329-340页]使物体每单位面积辐射的功率R等于发射率e乘以Stefan-Boltzmann常数σ乘以温度的四次幂T4。
R=eσT4 (197)
对于包括黑体σ=5.67X 10-8Wm-2K-4的光学厚等离子体,发射率e=1,并且测得的黑体温度是6000K。因此,点燃的固体燃料每单位面积辐射的功率是
R=(1)(σ=5.67X 10-8Wm-2K-4)(6000K)4=7.34X107Wm-2 (198)
可用R和通过1000J的爆炸能量Eblast与20X10-6s的爆炸时间τ的商给出爆炸的典型功率Pblast
因此,在6000K的平均黑体温度下,膨胀等离子体球体的平均半径是23cm。根据Beiser[A.Beiser,Concepts of Modern Physics,第四版,McGraw-Hill Book Company,New York,1978年,第329-340页],半径23cm的体积内的光子总数N是
根据Beiser[1],光子的平均能量是
另外的等离子体温度、等离子体发射率、每单位面积辐射的功率、等离子体半径、光子的总数、和光子的平均能量在本公开的范围内。在实施方式中,等离子体温度在大约500K至100,000K、1000K至10,000K、和5000K至10,000K中的至少一个范围内。在实施方式中,等离子体发射率是大约0.01至1、0.1至1、和0.5至1中的至少一个范围内。在实施方式中,根据等式(198)的每单位面积辐射的功率在大约103Wm-2至1010Wm-2、104Wm-2至109Wm-2、和105Wm-2至108Wm-2的至少一个范围内。在实施方式中,根据每单位面积辐射的功率R和通过爆炸能量Eblast与爆炸时间τ的商而给出的爆炸功率Pblast,分别通过等式(199)和(200)给出光子的半径和总数。在实施方式中,能量在大约10J至1GJ、100J至100MJ、200J至10MJ、300J至1MJ、400J至100kJ、500J至10kJ、和1kJ至5kJ中的至少一个范围内。在实施方式中,时间在至少大约100ns至100s、1μs至10s、10μs至1s、100μs至100ms、100μs至10ms、和100μs至1ms中的至少一个范围内。在实施方式中,功率在大约100W至100GW、1kW至10GW,10kW至1GW,10kW至100MW、和100kW至100MW中的至少一个范围内。在实施方式中,半径在大约100m至10m、1mm至1m、10mm至100cm、和10cm至50cm中的至少一个范围内。在实施方式中,根据等式(200)的光子的总数在大约107至1025、1010至1022、1013至1021、1014至1018中的至少一个范围内。在实施方式中,根据等式(201)的光子的平均能量在大约0.1eV至100eV、0.5eV至10eV和0.5eV和3eV中的至少一个范围内。
如图2A中所示,一个或更多个光伏动力转换器6可相对于等离子体反应取向(例如,成角度或间隔开),以接收该反应所生成的光子。例如,光伏动力转换器6可被放置在流动路径中,用于接收等离子体光子。在不同的轴向方向上射入两个或更多个等离子体流的实施方式中,光伏动力转换器6可被放置在各光子流的流动路径中,以增加所采集的光子的数量。在一些实施方式中,光伏动力转换器6可直接将光子转换成电能,而在其他实施方式中,光伏动力转换器6可将光子转换成热能,然后,热-电功率转换器可将热能转换成电能。
光伏动力转换器6包括多个光伏电池,这多个光伏电池被构造成在等离子体反应期间接收、采集并且转换光子。这多个光伏电池可被布置在一个或更多个模块中。多个模块可被封装并且例如串联地、并联地、或以其任何组合地相互互连。在一些实施方式中,多个光伏模块可互连,形成光伏模块的阵列(即,光伏阵列)。例如,光伏阵列可包括连接成光伏模块串的多个光伏模块,光伏模块串可被进一步分组为光伏模块子阵列。虽然个体光伏电池可生成仅几瓦的功率或小于1瓦的功率,但将个体电池连接成模块可生成更大功率,形成甚至更大的单元(如同阵列)可允许生成甚至更大的功率。
光伏阵列和/或模块可安装在支承结构上,用于将单元在排出等离子体光子的方向上取向。示例性的光伏动力转换器6还可包括跟踪器,用于调节阵列,以减小所排出等离子体和光伏电池之间的入射角度,从而优化光子采集。这些跟踪器可响应于所排出等离子体光子的路径中的任何移位,以保持效率。在一些实施方式中,光伏动力转换器6可包括一个或更多个最大功率点跟踪(MPPT)装置,用于对光伏电池的输出进行取样并且应用正确的电阻,以基于变化的等离子体发射条件得到最大功率。
晶体硅光伏电池是一种常见类型的光伏电池。晶体硅电池可包括例如单晶电池、多晶电池、和边缘限定膜供给带硅和硅片限定膜生长电池。它们包括彼此键合形成晶格的硅原子。光伏半导体包括n层和p层,其间具有结(被称为p/n结)。n型硅层具有过量电子,而p型硅层具有过量空穴,它们接合处的p/n结形成电场。当光子被光伏电池吸收时,电子在晶格结构内可以是自由的。过量电子可从n型侧移动到p型侧,从而形成沿着n层的正电荷和沿着p型的负电荷。这些自由电子分离,在p/n结处产生电场。
在晶体硅光伏电池中,使用掺杂将另一个元素的原子引入硅晶体中,以改变其电特性并且形成p层和n层。引入的元素(“掺杂物”)典型地要么具有比基底材料多1的价电子(以形成n层)要么具有比基底材料少1的价电子(以形成p层)。例如,在基于硅的电池中,掺杂物典型地具有三价或五价的电子(比硅具有的四价电子多1价或少1价)。一般,向衬底顶部区域和底部区域上的薄层施加掺杂物,从而以特定的带隙能量产生p/n结。例如,硅衬底可在顶侧掺杂有磷(具有五价电子)以形成n层,并且在底侧掺杂有硼(具有三价电子)以形成p层。
撞击光伏电池的等离子体光子可被反射,可被吸收,或可从中穿过。只有被吸收的光子产生电力。带隙能量是使电子脱离晶格所需能量的量。如果光子具有小于带隙的能量,则光子可不被收集。另选地,如果光子具有大于带隙的能量,则可因可将额外能量转变成热的弛豫,失去额外能量,从而使黑体损失增加。晶体硅具有大致1.1eV的带隙能量,一般光伏材料可具有从大致1.0eV至大致2.0eV的带隙能量。例如,砷化镓具有大致1.43eV的带隙,砷化镓铝具有大致1.7eV的带隙。
因此,一些光伏电池可由多种类型的材料形成。由多种材料制成的电池可具有多个带隙,因此可响应于多个光波长。因此,由多种不同材料构成的电池(即,多结电池)可更有效,因为它们能够在多个波长下产生电流,采集并且转换原本会失去的能量。光伏电池可由多种不同的材料或材料的组合形成,可基于材料的特性和/或给定应用的效率要求来选择和/或组合材料。不同的材料可具有不同的结晶度、吸收特性、少数载流子寿命、迁移率和/或制造考虑因素。例如,强吸收系数、高少数载流子寿命、和/或高迁移率可提供更好的性能特性。
示例性的材料可包括例如硅,包括单晶硅、多晶硅、或非晶硅。可使用多晶薄膜层,包括例如二硒化铜铟、碲化镉、或薄膜硅。还可使用单晶薄膜,包括例如砷化镓、锗、或磷化铟晶圆、硅、或其合金。结晶度指示晶体结构的原子是如何排序的,材料可导致多种类型的结晶度,包括例如单晶、多晶和非晶。
如上所述,光伏电池可由单种材料构成,或可由多种材料构成。同质结器件包括单种材料或具有类似特性的材料。如果使用具有类似特性的不同材料,则材料可具有基本上相等的带隙。因为不同材料的价电子的数量有可能不同,所以出于上述原因,可针对各材料的n型和p型,使用不同的掺杂物。以上讨论的晶体硅实施方式是同质结器件的示例。为了增大同质结光伏电池的效率,可变化所使用材料的p/n结的深度、掺杂物的量、掺杂物的分布、结晶度、和/或纯度。
异质结器件包括具有带隙不相等的不同材料,例如,结晶度半导体不近似的两个层。在异质结器件中,顶层是窗口,即,具有高带隙的透明材料,而下层具有吸收光的低带隙。因为可针对不同材料的p层和n层使用不同的材料,所以可使用更多种多样的掺杂物来形成异质结器件,从而有可能使优化光伏电池的能力增加。示例性的异质结器件包括其中通过硫化镉和二硒化铜铟接触形成p/n结的二硒化铜铟电池。
p-i-n器件或n-i-p器件包括夹在p层和n层之间的中间未掺杂(本征或i型)层,沿着p/n结形成的电场可遍及较广区域。示例性的p-i-n器件包括由硅p层、本征硅中间层和硅n层组成的非晶硅光伏电池。
多结器件包括由不同半导体材料制成的p/n结。这些可包括串联、三结、四结、五结、六结、或n结电池。多结器件由彼此一个压一个叠堆的带隙不同的个体电池形成。各带隙响应于不同波长的光,产生电流。光子首先粘附的顶层具有最大的间隙。没有被顶层吸收的光子被发送到下一层,以此类推,直到剩余的光子到达具有最小带隙的底层。多结器件可包括一个或更多个p/n结、窗口层(用于减小表面复合速率)、隧道结(用于提供低电阻和可选地子电池之间的低损失连接)、背面场层(用于减少载流子向着隧道结的散射)、抗辐射涂层、金属接触件(例如,铝)、或其任何组合。
为了形成多结光伏电池,个体电池可被独立地制造并随后被机械地一个压一个叠堆。另选地,可首先制造一个电池,然后,可在该第一层上生长(借助外延,例如,液相、有机金属气相、分子束、金属有机分子束、原子层、氢化物气相、化学气相沉积)或沉积第二电池的层。多结光伏电池通常使用III-V族半导体材料,III-V族半导体材料包括例如砷化铝镓、砷化铟镓、磷化铟镓、砷化铝铟、锑化铝铟、氮化镓砷、磷化镓砷、锑化镓砷、氮化铝镓、磷化锂镓、氮化铟镓、锑化铟砷、锑化铟镓、磷化铝镓铟、磷化铝镓砷、磷化铟镓砷、锑化铟镓砷、磷化铟砷锑、磷化铝铟砷、氮化铝镓砷、氮化铟镓砷、氮化铟铝砷、氮化锑化镓砷、锑化砷氮化镓铟、和磷化锑化镓铟砷。另选地或另外地,可使用II-IV族合金、IV、II-IV和/或III-V族晶体、多晶、或非晶半导体的多晶组合。例如,多结器件材料可包括例如非晶硅、二硒化铜铟、二硒化铜铟镓、砷化镓、磷化镓铟、硫化镉、锑化镉、或锑化锌。示例性的多结电池是具有硫化镉p层、锑化镉i层和锑化锌n层的锑化镉电池。另一个示例性的多结电池可包括GaInP、GaInAs和Ge的叠堆。例如,合适的多结器件可包括晶格匹配、直立变形和倒置变形多结器件。
在多结光伏电池中,还可基于晶格匹配和/或电流匹配来选择材料。为了最佳生长和晶体质量,不同材料的晶格常数可相同或可紧密配合。失配的晶格结构越多,可出现的生长瑕疵和晶体缺陷越多,从而由于电特性劣化而导致效率降低。因为根据带隙减小将材料分层,所以可选择合适的带隙(进而合适的材料),使得设计光谱平衡了各子电池中的电流生成,以实现电流匹配。用于实现晶格匹配的合适制造技术可包括例如金属-有机化学气相沉积或分子束外延。晶格匹配结构常常由单晶半导体(例如,III-V族半导体)的超薄层形成。然而,在一些实施方式中,晶格失配的器件还可实现高效率。例如,一些失配的光伏电池可包括步级层和缓冲层,相比于晶格匹配的器件,这些层形成了展现了类似效率或更高效率的III-V光伏器件。示例性的失配的光伏电池包括机械叠堆在电独立硅电池和Ga/InP/CaInAs/Ge电池的顶部上的InGaP/GaAs PV电池。
三结光伏电池已经被证明提供所有三个子电池的电流匹配,从而导致具有更有效带隙组合的布置。例如,还可通过提高晶格失配层的材料质量和/或在基底和中间电池之间形成高度弛豫的缓冲结构(诸如,Ga1-yInyAs缓冲结构)来增加效率。示例性的多结光伏电池包括:三结光伏电池(诸如,具有结构GaInP/GaInAs/Ge的三结光伏电池);四结光伏电池(诸如,具有结构GaInP/AlGaInAs/GaInAs/Ge的四结光伏电池);五结光伏电池(诸如,具有结构AlGaInP/GaInP/AlGaInAs/GaInAs/Ge或AlGaInP/AlGaInAs/GaInAs/GaInAs/Ge的五结光伏电池);六结光伏电池(诸如,具有结构GaInP/GaInP/AlGaInAs/GaInAs/GaInAs/Ge的六结光伏电池)。可使用任何合适数量和/或类型的材料来生成本公开的示例性光伏电池。
通过相对于基底以晶格失配的升序来生长结,形成倒置变形多结电池(IMM电池或倒置的晶格失配电池)。这样减少了应变诱发的缺陷在器件结构中的传播。因此,首先生长最高带隙材料,从而留下基本上无应变和缺陷的表面,下一个最高带隙材料可在该表面上生长。最后生长最低带隙材料,使得其应变诱发的缺陷对其他结的影响较小。从最高到最低带隙地生长结是标准多结电池(或直立电池)的倒序。为了以这个倒序生长结,必须去除基底,以允许光子进入最高带隙层。步级缓冲层还可包括在失配的结之间,以减轻应变并且约束位错。
合适的光伏电池可包括通过在基底上沉积一个或更多个薄层(例如,几纳米至几十纳米)而制成的薄膜电池。合适的基底可含例如玻璃、聚合物、金属、或其组合。这些材料的结构可以不是晶体。一些常见的薄膜电池可含非晶和微晶叠层硅、原晶硅、纳米晶硅、黑硅、锑化镉、硒化铜铟、硒化铜铟镓、染料敏化、或其他有机光伏电池。示例性的非晶硅太阳能电池是多结薄膜硅电池,可包括具有施用于衬底的硅层和微晶硅层的硅电池。染料敏化电池使用由夹在光敏化阳极和电解液之间的半导体结构形成的光-电化学太阳能电池。有机光伏电池可包括有机或聚合物材料,例如,有机聚合物或小有机分子。示例性的光伏电池还可包括串/带硅,包括与以上讨论的晶体硅电池类似的材料。这些电池可源自熔融硅,这样可产生比一些实施方式中浇铸硅更高的转换效率。
在一些实施方式中,动力生成系统可包括等离子反应和光伏电池之间的一个或更多个棱镜或光滤波器,以将光的波长改变成更接近地匹配光伏材料的带隙。过滤器的类型可包括长通、短通、或带通过滤器。示例性的光滤波器可包括吸收性过滤器、二向色滤光器、陷波滤波器、单色滤光器、红外滤光器、导光模态共振滤波器、或金属筛网过滤器、或其任何合适的组合。
本公开的示例性光伏动力生成系统可包括多个其他合适的组件,例如,AC-DC功率转换器(诸如,逆变器或微型逆变器)、功率调节单元、温度传感器、电池、充电器、系统和或电池控制器、散热器、热交换器、汇流条、用于测量能量产生的智能仪表、单向和/或双向仪表、(例如,针对频率或电压的)监测器、聚光器(例如,如同菲涅尔透镜的折射透镜、如同抛物镜或卡塞格伦望远镜的反射碟、或导光光学器件)、或其任何合适的组合中的一个或多个。光伏系统还可包括平衡系统(BOS)硬件、包括例如布线、熔断器、过电流、浪涌保护和断开器件、和/或其他合适的功率处理设备。
可用存储器件(诸如,电池)来存储和/或缓冲光伏动力转换器6所生成的功率。其他存储器件可包括例如电容器、高电流变压器、电池、飞轮、或任何其他合适的功率存储器件或其组合。动力生成系统还可包括充电控制器,例如,以避免因过量充电或放电而导致的电池受损,或优化通过MPPT制作电池或模块。动力生成系统中可包括电池,以存储光伏动力转换器6所生成的电能和/或根据需要将能量供应到电负载。还可包括一个或更多个电池,以操作接近其最大功率点的光伏阵列,以稳定电压为电负载供电,和/或将浪涌电流供应到电负载和逆变器。还可使用电池充电控制器,以保护电池免受过度充电和/或过度放电的影响。
在一些实施方式中,光伏动力转换器6可包括监测系统。这些系统可检测光伏电池击穿和/或优化光伏电池的操作。监测系统还可被构造成检测系统中的异常或所生成的功率和负载需求之间的失配。监测系统可提供指示可能问题的警告信号和/或可以可操作地联接到控制器,控制器可被构造成如果检测到的条件落入特定阈值水平之上或之下,则减少动力生成或关闭光伏动力转换器6,或整个等离子体动力生成系统。这些监测系统可包括用于检测光伏动力转换器6的一个或更多个参数的一个或更多个传感器。所检测到的示例性参数可包括温度、压力、电流、频率、瓦特输出、亮度、效率、或其任何合适组合。
动力生成系统还可包括一个或更多个聚光器,以将排出的光子聚焦在光伏电池的较小区域上。通过将光子聚焦到较小区域上,配备聚光光伏(CPV)技术的系统可以能够减小光伏电池的大小。聚光器可包括被取向成用于聚集光子的一个或更多个光学组件(例如,反射镜和/或透镜)并且还可包括用于实现所期望聚光水平的一个或更多个跟踪器。在一些实施方式中,有源或无源冷却系统可与CPV器件一起使用,而在其他实施方式中,可不需要冷却系统。配备CPV技术的光伏系统可以能够实现比标准光伏系统更高的效率。在一些实施方式中,CPV系统可结合多结光伏电池使用。
在其他实施方式中,可使用聚光太阳能发电(CSP)技术将光子聚焦到光伏电池的较小区域上,以将聚集的光子转换成热。聚光器可包括相对于彼此以合适布置(例如,抛物面反射槽或碟)取向的一个或更多个光学组件(例如,反射镜和/或透镜)和用于生热的中心接收器。经常是蒸汽形式的热可被直接使用或可使用可连接到电动力生成器的任何合适转换器或转换器组合(包括例如诸如蒸汽发动机或蒸汽或气体涡轮机和发电机、Rankine或Brayton循环发动机、Stirling发动机的热力发动机)被转换成机械或电功率。另选地或另外地,可使用热为热化学反应提供功率。在一些示例性实施方式中,抛物面反射槽可使用长、矩形、弯曲反射镜聚焦光子,以将光子聚焦到顺着槽中心延伸的管上。管可包含当被加热时转变成蒸汽的容易升温的流体。利用CSP技术的实施方式还可包括用于实现所期望聚光水平的一个或更多个跟踪器。
应该注意,可通过点燃燃料产生等离子体来生成热以及等离子体。在利用CSP技术的实施方式中,除了光伏电池所生成的热之外,这个热可被直接使用或可使用任何合适转换器或转换器组合(包括例如诸如蒸汽发动机或蒸汽或气体涡轮机和发电机、Rankine或Brayton循环发动机、或Stirling发动机的热力发动机)被转换成机械或电功率。在光子能量被直接转换成电能的实施方式中,这个热可例如通过使用冷却系统被消散,或可与发生光子-电转换并行地,被转换成电能。例如,动力生成系统可包括光子-电功率转换器和热-电转换器。为了进行功率转换,各电池可与热能或等离子体-机械或电功率的任何转换器(诸如,例如,热力发动机、蒸汽或气体涡轮系统、Stirling发动机、或热离子或热电转换器)相互作用。
如以上讨论的,动力生成系统还可包括温度调节系统。例如,冷却系统可带走通过光伏系统和/或通过点燃燃料形成等离子体而生成的热。示例性的冷却系统可包括热交换器或散热器。在一些实施方式中,热的一部分可被传递到动力生成系统中的其他组件(诸如,例如,再生系统14、去除系统、被构造成传播用等离子体反应产物再生燃料所需的化学反应、和/或用于为点燃燃料形成等离子体提供功率的电极)。
一旦直接从光伏电池生成电功率或首先生成热能然后生成电能,就可调节电能。动力生成系统可包括一个或更多个输出功率控制器/调节器7,输出功率控制器/调节器7可操作地联接到光伏动力转换器6,以改变所生成功率的质量,使得它与正作为功率传递目的地的内部或外部电负载设备和/或存储装置兼容。所生成功率的质量可包括例如电流、电压、频率、噪声/相干性、或任何其他合适质量。输出功率控制器/调节器7可以是可调节的,以变化功率的调节,例如,从而反映电负载设备中的改变或系统所生成的功率。调节器可执行一个或更多个功能,包括例如电压调节、功率因子校正、噪声抑制、或瞬态脉冲保护。在示例性实施方式中,输出功率调节器可将动力生成系统所生成的功率调节成所期望波形(例如,60Hz AC功率),以保持不同负载的更恒定电压。
一旦被调节,所生成功率可从控制器/调节器7通过输出端子9传递到负载和/或存储装置。任何合适数量和布置的控制器/调节器和输出功率端子可被装入动力生成系统中。
在一些实施方式中,如以上讨论的,可使用功率输出端子9处的功率输出的一部分为电源提供功率,例如,从而提供大约5-10V、10,000-40,000A DC电力。光伏动力转换器可输出低电压、高电流DC电力。在一些实施方式中,可使用超级电容器或电池通过供应用于启动点燃的电力来开始点燃燃料生成等离子体,使得用于后续点燃的电力通过输出功率调节器来提供,进而可由光伏动力转换器6来提供电力。光伏系统的特定组件和布置将至少部分取决于一旦被转换将如何使用能量。
光伏动力转换器6和动力生成系统可以是独立的、效用互动的,或可连接到电网。光伏系统可与公用电网相互连接地或独立于公用电网进行操作,并且可与其他能量源和/或能量存储系统连接。例如,在一些实施方式中,光伏动力转换器6可连接到电网或其他负载,但还可能够存储能量或积极将能量供应到等离子体反应系统。本公开的光伏系统可被设计成提供DC和/或AC功率服务。
连接电网的光伏系统通常包括逆变器,以将光伏阵列所生成的DC功率转换并且调节成与电网的电压和功率质量要求一致的AC功率。光伏模块和/或阵列的正负端子可电连接到逆变器,以便与电网形成一体。逆变器还可被构造成当公用电网没有被供应能量时自动停止功率向着电网流动。在这个布置中,例如,在分配面板处,可在光伏系统的AC输出电路和电公用网络之间存在双向接口,如图3中所示的。例如,这样可允许当光伏系统输出大于现场负载需求时,光伏系统所生成的AC电力供应现场电负载或回馈电网。当电负载大于光伏系统输出时,可从电网接收负载所需的功率平衡。在许多连接电网的光伏系统中,需要此安全特征,以防止当电网关闭(例如,进行维护或维修)时光伏系统继续操作并且回馈到电网。
在连接电网的实施方式中,光子可被转换成电能,如以上讨论的。所生成的所有电功率可被供应到电网,或功率可被供应到电网或外部负载、动力生成系统内的存储器件、动力生成系统内的其他有源组件、或其任何合适组件中的一个或更多个。另外,可根据多个因素(例如,操作条件、功率需求、环境条件等)将电力供应到不同地点。
在一些实施方式中,连接电网的系统可包括能量存储装置,而在其他实施方式中,连接电网的系统可不包括能量存储装置。如果被包括在电网系统中,则存储器件可以是例如电容器、高电流变压器、电池、飞轮、或任何其他合适的功率存储器件或其组合。可在例如动力生成系统中包括存储器件,以存储光伏动力转换器6所生成的功率,供系统后续使用,供另一个装置(例如,外部负载)后续使用,或抑制任何间歇。动力生成系统和光伏动力转换器6可被构造成对存储器件进行重新充电或填充,随后一旦被充满,就取下存储器件并且将其连接到单独的装置来提供功率。动力生成系统可以可选地包括存储器件,存储器件被构造成接受并且存储供例如动力生成系统后续使用的功率中的一些作为备用功率源。另外,在连接电网的实施方式中,动力生成系统可从电网接收功率,作为向电网提供功率的辅助或替代,如图4中示出的一样。
在独立实施方式中,光伏动力生成系统可被设计成独立于电网进行操作。这些系统可被设计并且构造成将AC、DC、或AC和DC功率二者供应到电负载。独立实施方式可仅仅由光伏阵列提供功率,或可以辅助功率源作为补充,以形成光伏混合系统,如图4中示出的。对于独立系统,作为连接到电网的替代,混合系统可包括动力生成器(例如,发动机生成器)作为辅助功率源。在直接联接系统中,光伏模块或阵列的DC输出可直接联接到DC负载。因此,一些直接联接的系统可不包括电能存储器件(例如,电池),如图5中示出的。另选地,如图6A中示出的,直接联接的系统可包括电能存储器件,例如,以存储光伏动力转换器6所生成的功率,供系统,供外部负载后续使用,或抑制任何间歇。在直接联接的系统中,电负载的阻抗可需要与光伏阵列的最大功率输出匹配以得到最佳性能并且可包括合适的调节组件。在一些实施方式中,可在阵列和负载之间使用MPPT,以促使更好地利用可用的阵列最大功率输出。在DC和AC负载被提供功率或只有AC负载被提供功率的其他实施方式中,独立系统可包括能量存储装置(例如,电池),如图6A和图6B中示出的。
在独立实施方式中,等离子体光子可被转换成电能,如以上讨论的。所生成的所有电功率可被供应到其示例性实施方式在图7和图8中描绘的存储器件、外部负载、动力生成系统内的其他组件、或其任何合适组合中的一个或更多个。
示例性的存储器件可包括例如电容器、高电流变压器、电池、飞轮、或任何合适的功率存储器件或其组合。可在例如动力生成系统中包括存储器件,以存储光伏动力转换器6所生成的功率,供系统后续使用,供另一个装置(例如,外部负载)后续使用,或抑制任何间歇。动力生成系统和光伏动力转换器6可被构造成对存储器件进行重新充电或填充,随后一旦被充满,就取下存储器件并且将其连接到单独的装置来提供功率。动力生成系统可以可选地包括存储器件,存储器件被构造成接受并且存储供例如动力生成系统后续使用的系统所生成功率中的一些作为备用功率源。
任何合适的用于将光子转换成电或热能的光伏动力转换器(诸如,上述的光伏动力转换器)可与本文中描述的合适的等离子体生成动力生成系统中的任一个结合使用。例如,可在本公开的示例性等离子体动力生成系统中包括任何合适的单晶、多晶、非晶、串/带硅、多结(包括例如倒置、直立、晶格失配、晶格匹配、III-V族)、同质结、异质结、p-i-n、薄膜、染料敏化、或有机光伏电池、或光伏电池的组合。
例如,动力生成系统可包括:多个电极1002,其被构造成将功率传递到燃料1003,以点燃燃料,生成等离子体;电源1004,其被构造成将电能传递到多个电极1002,;至少一个光伏动力转换器1006,其被设置成接收至少多个等离子体光子,如图9的实施方式中示出的。这个系统还可包括:输出功率调节器1007,其(借助图12的功率连接器1008)可操作地联接到光伏动力转换器1006;输出功率端子1009,其能联接到输出功率调节器1007,如图10的实施方式中示出的。
另一个示例性的动力生成系统可包括至少大约2,000A/cm2或至少大约5,000kW的电源1004和与电源1004电联接的多个电极1002。系统还可包括被构造成接收固体燃料1003的燃料装载区域1017,多个电极1002可被构造成将电功率传递到固体燃料1003,以生成等离子体。系统还可包括被设置成接收多个等离子体光子的光伏动力转换器1006。
在一个实施方式中,动力生成系统1020可包括被构造成传递至少大约5,000kW或至少大约2,000A/cm2的电力的电源1004。多个电极1002可被构造成至少部分包围燃料1003,电极1002可电连接到电源1004并且被构造成接收用于点燃燃料1003的电流。多个电极中的至少一个可以是能移动的。动力生成系统还可包括用于移动燃料的传递机构1005和被构造成将通过点燃燃料而产生的光子转换成不同形式的动力的光伏动力转换器1006,如图11和图12的示例性实施方式中示出的一样。
在另一个示例性实施方式中,动力生成系统1020可包括被构造成传递至少大约5,000kW或至少大约2,000A/cm2的电力的电源1004。功率源可电连接到多个电极1002,多个电极1002中的至少一个可包括压缩机构1002a,如图9和图10的实施方式中示出的。多个电极1002可包围燃料装载区域1017,燃料装载区域1017被构造成接收燃料,使得至少一个电极的压缩机构向着燃料装载区域取向。电极1002a可被构造成将电力供应到燃料装载区域1017中接收的燃料1003,以点燃燃料。动力生成系统1020还可包括用于将燃料1003移入燃料装载区域1017中的传递机构1005(图10)和被构造成将通过点燃燃料而产生的光子转换成非光子形式的动力的光伏动力转换器1006。
在一个实施方式中,动力生成系统1020可包括包围燃料装载区域1017的多个电极1002。电极1002可被构造成点燃位于燃料装载区域1017中的燃料1003。动力生成系统还可包括:传递机构1005,其用于将燃料1003移入燃料装载区域1017中;光伏动力转换器1006,其被构造成将通过点燃燃料而产生的光子转换成非光子形式的动力;去除系统1013,其用于去除被点燃燃料的副产物;再生系统1014,其可操作地联接到去除系统1013,用于将去除的点燃燃料的副产物再循环到被再循环燃料,如图11和图12的实施方式中示出的。
根据本公开的其他示例性动力生成系统可包括被构造成传递至少大约5,000kW或至少大约2,000A/cm2的功率的电源1004。间隔开的多个电极1002可电连接到电源1004并且可包围燃料装载区域1017。燃料装载区域1017可被构造成接收燃料1003,多个电极1002可被构造成将电力供应到燃料,以在燃料被接收在燃料装载区域1017中时点燃燃料1003。动力生成系统还可包括:传递机构1005,其用于将燃料移入燃料装载区域1017中;光伏动力转换器1006,其被构造成将通过点燃燃料而产生的多个光子转换成非光子形式的动力;传感器1025,其被构造成测量与动力生成系统关联的至少一个参数;控制器1030,其被构造成控制至少与动力生成系统关联的处理,如图11和图12中示出的。
在另一个实施方式中,动力生成系统可包括被构造成传递至少大约5,000kW或至少大约2,000A/cm2的功率的电源1004和与电源1004电连接的间隔开的多个电极1002。多个电极1002可包围燃料装载区域1017并且可被构造成将电力供应到燃料1003,以在燃料被接收在燃料装载区域1017中时点燃燃料1003。燃料装载区域1017中的压力可以是部分真空。动力生成系统还可包括:传递机构1005,其用于将燃料1003移入燃料装载区域1017中;光伏动力转换器1006,其被构造成将通过点燃燃料而产生的多个光子转换成非光子形式的动力。
本文中描述的示例性光伏动力生成系统可与公用电网互连地或独立于公用电网进行操作,并且可与其他能量源和/或能量存储系统连接。它们还可包括任何合适的组件,包括例如AC-DC功率转换器(诸如,逆变器或微型逆变器)、功率调节单元、温度传感器、电池、充电器、系统和/或电池控制器、冷凝器、冷却系统1011/1012(例如,散热器、热交换器1010)、汇流条、用于测量能量产生的智能仪表、单向和/或双向仪表、(例如,针对频率或电压的)监测器、聚光器(例如,如同菲涅尔透镜的折射透镜、如同抛物镜或卡塞格伦望远镜的反射碟、或导光光学器件)、或其任何合适的组合中的一个或多个。光伏系统还可包括平衡系统(BOS)硬件、包括例如布线、熔断器、过电流、浪涌保护和断开器件、和/或其他合适的功率处理设备。
另外,光伏动力生成系统将光伏电池放置在等离子体产生点燃反应附近。因此,示例性的动力生成系统可包括如上所述的任何合适清洁系统,以去除可累积在光伏电池和/或可阻碍光子中的一些被光伏器件吸收或可损坏光伏器件的其他组件上的任何碎屑或残留物。
另外,光伏动力转换器可被安装成捕获发射的光子,同时减少在等离子产生爆炸期间可排出的任何冲击波或粒子的效果。例如,光伏器件可放置在被构造成使冲击波散开的挡板的上面或周围。薄膜光伏电池可被施用于更能复原的基底(例如,玻璃、聚合物、金属、或其组合)。在一些实施方式中,光伏动力转换器可以能移动地安装并且跟踪器或其他传感器可根据爆炸参数来调节光伏器件的角度和/或定位,以减小因反应造成的损坏。在一些实施方式中,透明的面板或筛网片可放置在光伏器件前方,以充当缓冲器和/或挡板。光伏器件可包括保护涂层。冷却系统可消散和/或重新引导反应期间生成的热。因此,光伏动力转换器可布置在动力生成系统内,以促成光子捕获,同时保护光伏电池免受燃料点燃和等离子体反应的影响。另选地,在一些实施方式中,可包含反应,使得爆炸不对光伏电池产生负面影响。例如,可在单独的透明容器1001(诸如,在真空容器中,处于大气压、高于大气压、低于大气压下)中发生反应,光伏电池1006可被施用于容器的外壁和/或可恰好安装在容器1001外部。光伏动力转换器1006可按任何合适方式布置在所公开的合适动力生成系统中的任一个中并且可与任何合适的组件和组件构造整合。图13A描绘了燃料装载区域1017被设置成与光伏动力转换器1006分开并且在与光伏动力转换器1006分离的区域中发生反应的实施方式,而图13B的实施方式示出了在与反应相同的区域中(例如,在容器1001的内部或外部)发生反应。
在功率转换器的实施方式中,等离子体光子入射到响应于自发发射或激光的波长的光电材料上,使得电子被射出,在电网或电极处被收集。诸如钡、钨、纯金属(例如,Cu、Sm)、Ba、Cs2Te、K2CsSb、LaB6、Sb-碱、GaAs的光电材料用作光电阴极(正电极),如其全部内容以引用方式并入的以下参考文献中给出的:M.D.Van Loy,“Measurements of barium photocathode quantum yields at four excimer wavelengths”,Appl.Phys.Letts.,第63卷第4期,1993年,第476-478页;S.D.Moustaizis,C.Fotakis,J.P.Girardeau-Montaut,“Laser photocathode development for high-current electron source”,Proc.SPIE,第1552卷,第50-56页,Short-wavelength radiation sources,Phillip Sprangle,Ed.;D.H.Dowell,S.Z.Bethel,K.D.Friddell,“Results from the average power laser experiment photocathode injector test”,Nuclear Instruments and Methods in Physics Research A,第356卷,1995年,第167-176页;A.T.Young,B.D'Etat,G.C.Stutzin,K.N.Leung,W.B.Kunkel,“Nanosecond-length electron pulses from a laser-excited photocathode”,Rev.Sci.Instrum.,第61卷第1期,1990年,第650-652页;Q.Minquan等人,“Investigation of photocathode driven by a laser”,Qiangjiguang Yu Lizishu/High Power Laser and Particle Beams",Nucl.Soc.China,第9卷第2期,1997年5月,第185-191页。电子收集器可用作阳极(负电极)。通过负载在这些电极之间完成的电子电路使得在电极之间形成的电压驱动电流。因此,电功率被传递到负载并且在负载中消散。
当前公开的另一个应用是光源。光功率是来自本公开的固体燃料点燃。光源包括图1和图2中示出的电池1的至少一个透明或半透明的壁。透明或半透明的壁可被涂覆荧光体,以将包括光的能量转换成所期望的波长带。点燃可按足够大的频率发生,使得光恒定地出现。在实施方式中,通过点燃固体燃料而形成的等离子体生成短波长的高输出。显著的光功率可以在EUV和软X射线区域中。短波长光源可用于光刻。
J.齿轮部分
参照图2A中示出的SF-CIHT电池,传统的齿轮组通常被设计成将机械能从一个齿轮传递到另一个。虽然这些齿轮包括一系列构造,但它们通常不被设计成吸收冲击波或热。诸如例如如上所述的一些应用需要移动并且还维持高冲击和热传递的齿轮。下述的齿轮和方法克服了现有技术的极限中的至少一个并且适于用于上述的系统和方法。
本公开的齿轮被构造用于涉及导电、压力波或热传递的处理。例如,范围从大约2,000安至100,000安的电流和范围从大约1伏至大约100,000伏的电压可被施加到一个或更多个齿轮,如上所述。可生成压力波、热传递、和离子和/或等离子体生成。在一些实施方式中,本公开的齿轮可被构造成用固体燃料(诸如,固体燃料粉末)进行操作。
如图14中所示,系统10可被构造成如上所述生成能量。系统10可包括燃料源20,燃料源20被构造成将燃料30供应到一个或更多个齿轮40,如代表燃料流体50的箭头所指示的。一个或更多个齿轮40还可联接到被构造成将功率提供到一个或更多个齿轮40的一个或更多个功率源60。
如以上说明的,与将电力供应到一个或更多个齿轮40相结合地,可将燃料30供应到一个或更多个齿轮40。可发生反应,由此生成大量的至少包括热和光70、压力80、或离子90的光子。虽然反应产物中的一些后续可被转换成电能,但齿轮40必须被构造成导通功率源60所供应的电力并且耐受因反应而生成的热和光70、压力80、或离子90。本文中描述的齿轮40和方法可用系统10进行操作。
如图14中所示,系统10可包括两个齿轮40。在其他实施方式中,可使用一个或不止两个齿轮40。齿轮40还被表现为同时旋转。在其他实施方式中,可使用齿轮齿条构造。此外,齿轮40可包括支柱、螺旋、斜角、涡轮、或其他类型的齿轮。
齿轮40可用一系列燃料30和一系列燃料流体50进行操作。例如,燃料30可包括固体、液体、或气态形式。如以上说明的,这些燃料可包括水或基于水的燃料源。
齿轮40还可由一种或更多个合适材料形成,这些材料包括导电和非导电组件。例如,齿轮40中的至少部分可包括纯金属、金属合金、或陶瓷材料。各种材料和构造可允许齿轮40用压力、热和周围环境的波动进行操作。
如图15中所示,齿轮40可包括一个或更多个齿100。可在两个相邻齿100之间存在间隙110。齿100和间隙110可以是任何合适的形状或尺寸,如以下更详细说明的。齿轮40还可包括一个或更多个孔隙120,孔隙120被构造成接纳被构造成提供或输出旋转移动的轴(未示出)。另外,齿轮40可包括用于提供、监测、或控制旋转移动的一个或更多个其他元件(未示出)。例如,齿轮40可包括各种轴承、衬套、或其他机械元件。
如图16中所示,齿轮40可包括一种或更多个材料。尽管表明齿100和间隙110二者都具有第一材料130和第二材料140,但一个或更多个齿100或间隙100可或不可包括两种或更多种材料。可用于至少部分形成齿轮40的各种材料包括Cu、Ag、Ti、W、Mo、TiC、WC,其他合适的元素具有适宜的导电率、硬度、韧性、或其他所期望特性。
在一些实施方式中,第一材料130可比第二材料更导电。例如,第一材料130可具有比第二材料140低的电阻值。第一材料130可包括与第二材料140不同的材料或可使用与第二材料140不同的处理来形成。第一材料130可以是导电的,而第二材料140可以是绝缘的。材料130、140的其他构造是可能的。
在操作中,应该理解,图17中示出的齿轮40、40'可均相对于彼此旋转。此旋转可将燃料30陷于齿轮40的间隙110和齿轮40'的齿100'之间。施加到齿轮40、40'的电功率可经过间隙110的第一材料130,经过燃料30,并且经过齿100'的第一材料130'。因为第一材料130和周围的第二材料140之间有导电率差异,所以电流将优先流过燃料30的一小部分。此优先流体将造成局部化反应,其中,所释放的任何产物将源自由第一材料130、130'所限定的区域。
在其他实施方式中,材料130、140可具有不同特性。例如,一种材料可相比于另一种材料更硬,对压力脉冲的抵抗性更大,对腐蚀的抵抗性更大等。
在一些方面,齿100、间隙110或这二者的几何形状可被构造成提供局部化反应。例如,如图18A至图21B中所示,齿100可具有各种构造。还要理解,间隙110可被类似地构造成提供局部化反应特有的几何形状。
图18A、图19A、图20A和图21A示出根据各种实施方式的齿100的侧轮廓视图。图18B、图19B、图20B和图21B示出图18A、图19A、图20A和图21A中示出的对应齿100的横向视图。特别地,图18A示出齿100,齿100具有上表面150、两个侧表面170、和位于上表面150和侧表面170之间的两个倾斜表面160。图18B示出完全从齿100的第一面180延伸到齿100的第二面190的表面150、160、170。
图19A示出齿100,齿100具有上表面200和从中间表面220延伸的侧表面210。类似于上表面150,上表面200与相邻表面(未示出的)的接触面积减小。上表面200在一个维度上的侧壁170之间的区域的部分延伸并且完全在第一表面180和第二表面190之间延伸。在图19B中示出该构造,类似于图18B中示出的横向视图。
虽然图20A类似于图18A,但图20B中示出的横向视图不同于图18B中示出的横向视图。具体地,表面150'没有完全从第一表面180延伸到第二表面190,倾斜表面160'的部分从第一表面180延伸到第二表面190,侧表面170'完全从第一表面180延伸到第二表面190。同样地,图21A示出其中上表面200'只部分从第一面180延伸到第二面180的实施方式。
图18A至图21B中示出的表面是平坦和线性的,但可以是弓形的并且包括其他表面特征。这些表面也可被涂覆,并且可包括突起、凹口、或偏差。
在图22A中示出的实施方式中,齿100包括位置相对于法向平面240成角度θ的倾斜表面220。间隙110'还可包括位置相对于法向平面240成角度的倾斜表面230。尽管被示出为具有两个表面220、230,但一个表面可基本上平行于法向平面240。
表面220、230可通过在齿100和间隙110'之间的特定位置提供燃料30(未示出)的另外压缩或集中进行操作。如图22A中所示,间隙110'左侧的第一或选择区域250可具有更高浓度的燃料或燃料可经历相比于间隙110'右侧的第二区域260更大的压缩。在其他实施方式中,第一区域250可按各种方式围绕齿100、间隙110'、或齿100和间隙110'二者的组合进行设置。例如,如图22B中所示,齿100可包括弓形表面270并且间隙110'可包括弓形表面280。弓形表面270、280可被构造成为大致中心位于间隙110'内的选择区域250提供位于任一侧的第二区域260。此外,表面270、280中的至少一个可遍布齿100和间隙110',如参照图18至图19B中的不同表面示出的。在其他实施方式中,表面270、280中的至少一个可部分遍布齿100和间隙110',如用图20A至图21B中的不同表面示出的。
如图22B中所示,齿轮40、40'的叉指可形成沙漏或夹紧形状。可通过可以是绝缘体(诸如,陶瓷)的高度稳定或硬化材料来形成与沙漏的颈部或腰部(区域280)紧邻的材料。例如,表面270、280的中心区域可被稳定或硬化。与齿轮40、40'的非腰部或球状部分相邻的材料可包括具有更具导电特性的材料(诸如,诸如过渡、内部过渡、稀土、13族、14族和15族金属或至少两种这样金属的合金的金属)。表面270、280的腰部部分可压缩选择区域280并且电流可经过非腰部或球状区域,被集中在腰部区域中。由此,包括腰部的选择区域280中的电流密度可增大,使得实现了引爆阈值。可通过使包括硬化材料的腰部材料抗腐蚀,保护腰部免受反应带来的损害。包括导体的非腰部或球状区域接触未选择的燃料区域,其中,介入反应产物和这些对应齿轮表面之间的燃料可保护这些表面免受因反应及其产物而腐蚀。
沙漏构造的其他变型包括图22C中示出的实施方式。如所示出的,齿轮40包括被导电材料282(诸如,金属)包围的腔室286。齿轮40还包括被构造成耐受等离子体形成的表面材料284。在一些实施方式中,材料284可包括陶瓷。同样地,齿轮40'可包括被导电材料282'包围并且包括表面材料284'的腔室286'。
在操作中,图22C中的齿轮40、40'可移动,如所示出地基本上对准。然后,用压缩在腔室286、286'内的燃料(未示出),电流可通过腔室286、286'纵向从齿轮40施加到齿轮40'。特别地,电流可流过腔室286中的燃料,经过表面材料284,经过表面材料284',进入腔室286'中。未反应的燃料可保留在腔室286、286'内,以至少部分保护导电材料282、282'免受反应产物的影响。另外,表面材料284、284'可被构造成比材料282、282'更有效地耐受反应产物。因此,图22C中示出的齿轮40、40'可具有比由仅仅材料282、282'形成的齿轮40、40'更长的工作寿命。
在一些实施方式中,齿轮40可需要进行冷却,以消散通过反应所生成的热。因此,齿轮40可包括被构造成接纳冷却剂的一个或更多个导管。冷却剂可包括水或本领域的技术人员已知的其他液体(诸如,溶剂或液体金属)。这些导管可被构造用于进行高热传递。例如,导管290可包括用于辅助热传递的大表面面积,如图23A中示出的。在其他实施方式中,可在齿轮40的内部结构内形成多个导管300、310,如图23B中示出的。
一个或更多个齿轮40、40'还可包括运动系统320、320',如图24中所示的。运动系统320、320'可被构造成移动一个或更多个齿轮40、40'。例如,运动系统320可将齿轮40左或右移,如图24中所示。这种朝向齿轮40'或背离齿轮40'的移动可压缩或集中位于齿轮40和齿轮40'之间的燃料30(未示出)。还料想到,运动系统320可包括被构造成吸收该反应所生成的冲击中的一些的阻尼器(诸如,弹簧)。其他装置和系统还可被构造成改进齿轮功能或寿命。
在另一个实施方式中,一个或更多个齿轮40能在紧固机构的作用下移动(诸如,例如往复连接被曲轴附接和致动的杆)。这可类似于内燃发动机的活塞系统的系统和方法。例如,随着齿轮40、40'的对向电极部分旋转成对向配合位置,对向电极在被压缩时一起驱动。它们可在点燃之后在紧固构件的作用下移动开。对向电极可以是任何所期望形状并且可被选择性起电,以致使燃料30中的至少一些在所选择区域中经受更大的压缩或在所选择区域中更大的电流密度。对向电极可形成压缩燃料使中心的压缩最大的半球状壳(参见图22B)。最高电流密度还可处于中心,以选择性实现用于在中心区域引爆的阈值。膨胀的等离子体可流出到半球状壳的敞开部分之外。在另一个实施方式中,对向电极可形成沙漏形状,其中,所选择区域可包括沙漏的腰部或颈部(参见图22C)。
还料想到,系统10可包括以与齿轮40类似的方式发挥作用的其他组件。例如,在一些实施方式中,系统10可包括一个或更多个支承构件400(图25)。还料想到,一个或更多个齿轮40、构件400、或类似组件可组合地用于单个系统中,或系统内使用的各组件的部分中。
如图25中所示,第一支承构件410可总体上与第二支承构件420相邻地设置,使轴430与轴440共轴地对准。另外通过图25中的箭头示出的,当从上方观察到的,第一支承构件410可在逆时针方向上旋转并且第二支承构件420可在顺时针方向上旋转。另外,第一支承构件410可联接到第一轴430并且第二支承构件420可联接到第二轴440。一个或更多个支承构件400可按各种方式联接,以允许进行旋转移动。例如,一个支承构件400可在另一个可保持静止的同时进行旋转。一个或更多个支承构件400还可以周期为基础、连续地移动,或受到控制,从而以一个或更多个不同速度进行移动。
类似于上述的齿轮40,支承构件400可被构造成允许如本文中提供地发生反应。支承构件400可包括下述被构造成允许发生反应的一个或更多个接触元件。可借助施加高电流来启动反应。例如,电流可施加到彼此紧邻的两个接触元件两端。这种“接触”可不包括元件之间的物理接触,但应该足够靠近,以允许电流从一个接触元件流向另一个。该电流可流过本文中描述的燃料(诸如,例如,包括金属和金属氧化物的粉末)。类似于上述的齿轮40,支承构件400的至少部分可以是导电的。
图26示出根据示例性实施方式的轴430、440。在这个实施方式中,轴430共轴地对准并且延伸通过轴440的至少部分。这种构造可允许支承构件410、420之间相对旋转。图26还示出具有一个或更多个接触元件450的支承构件410、420。如上所述,接触元件450可被构造成彼此相互作用,或与另一种结构相互作用,以提供其中可发生本文中描述的反应的区域。相互作用可包括物理接触,紧密接触,或一个元件与另一个隔开被构造成允许电流从一个元件流向另一个的距离。例如,第一接触元件452可处于第二接触元件454的附近,可在元件452、454两端施加足以使电流经过燃料以形成含能反应的电压。从这种反应释放的能量可偏转支承构件410和/或支承构件420,如图26中的箭头所指示的。这种偏转可提供吸收通过该反应释放的能量中的一些的能量吸收机制。
图27示出根据包括一个或更多个联接件460的另一个示例性实施方式的支承构件400。联接器460可包括一系列装置或系统,这些装置或系统被构造成允许一个或更多个支承构件400移动。例如,联接件460可包括齿轮、滑轮、或被构造成将旋转移动传输到轴430的其他装置。特别地,联接件460可联接到电机(未示出)(诸如,被构造成生成移动的电、机械、或其他类型的电机)。联接件460还可包括抓持器、断路器、或用于控制支承构件400旋转移动的类似机构。联接件462还可包括有源或无源阻尼器,以吸收施加到支承构件410、轴430、或第一接触元件452的力中的至少一些。施加到第一支承构件410或第一轴430的力可导致任一个组件如箭头432所示出地移动。如果接触元件450之间的含能反应向支承构件410施加明显的力,则可发生此垂直移动。有源阻尼系统可包括处理器(未示出),处理器被构造成允许此移动或提供抵消力,以部分减少此移动。无源阻尼系统可包括弹簧、弹性体、或被构造成吸收所施加力中的一些的其他装置。
如所示出的,第一联接件462被机械联接到第一轴430并且第二联接件464被机械联接到第二轴440。一个或不止两个联接器460可与支承构件400一起使用。还料想到,一个或更多个联接件460可设置在轴430、440和对应的支承构件410、420之间。另外,第三联接件466可位于支承构件400之间。第三联接件466可包括止推轴承或被构造成允许一个或更多个支承构件400在高压缩负载下旋转移动的类似装置。如果发生高度含能的反应,则支承构件400可在高压缩负载下进行放置,以对抗施加到支承构件400的大力的效果。因此,联接件462、464可将压缩负载传输到轴430、440和支承构件410、420。
图28示出支承构件400的另一个实施方式,由此轴430、440是偏离轴。如所示出的,支承构件410、420彼此不平行,但被设置成使得接触元件之间的距离在右侧较小而在左侧较大的角度。出于在右侧形成反应而允许左侧区域大体没有任何类似反应的目的,这种不对称允许接触元件(未示出)更容易彼此相互作用。
在另一个实施方式中,可如图29中所示地布置支承构件410、420。这里,轴430、440是偏离轴并且彼此平行。此布置可允许支承构件410、420重叠,如中心区域444中示出的。可在区域444内发生反应,同样伴随着高能量释放。可通过挠曲支承构件410、420和/或以上图27中描述的机构,部分吸收该反应所生成的力。如图29中所示结合轴430、440使用的联接件(未示出)可包括用在轴430、440上生成的横向力进行操作的径向止推轴承。
如图30中所示,使用一种或更多个燃料源20用燃料供应支承构件400。如上所述,燃料源20可将本文中描述的各种类型的燃料提供到一个或更多个支承构件400的选择区域。还可设置一个或更多个操作元件470。操作元件470可被构造成对支承构件400进行监测、清洁、控制、或至少部分再生中的至少一种。例如,操作元件470可包括在可视、红外、超声、或其他波长下进行操作以检查支承构件400的相机。此检查可向警告系统10提供预警系统,警告支承构件400没有适宜地操作,需要维修,或有可能失效。元件470还可包括刷子、喷嘴、刮刀、或被构造成至少部分清洁支承构件400的其他装置。操作元件470可控制支承构件400的速度或施加到支承构件400的力或像制动器一样操作。元件470还可包括至少部分再生支承构件400的装置。例如,元件470可包括用于将表面重新施用于支承构件400,或使支承构件400经受加热或冷却以允许支承构件400被部分修理的装置。元件470可被构造成在构件400上施用保护涂层,之后可通过加热或冷却步骤来固定并且安置涂层。还可使用操作元件470进行日常维修。
一个或更多个支承构件400的操作需要以下详细描述的一个或更多个接触元件450的存在和操作。类似于齿轮40的齿100和间隙110,如上所述,接触元件450被构造成相互作用,以提供用于涉及燃料30的反应的区域。类似于以上,一个或更多个支承构件400还可联接到被构造成将功率提供到一个或更多个支承构件400的一个或更多个功率源60。
在一些实施方式中,如图31A中所示,支承构件400可以是大体圆形的,图31A示出支承构件410的下侧表面480。构件400还可以任何合适的形状或尺寸。表面480可包括一个或更多个第一接触元件452。如所示出的,接触元件452可大体围绕表面480的周缘设置。在其他实施方式中,一个或更多个接触元件452可按各种方式跨表面480设置。在其他实施方式中,如图31B中所示,支承构件410可包括大体从轴430延伸的一个或更多个支承元件490。支承元件490可以是用于为一个或更多个第一接触元件452提供支承的任何合适的形状、大小、或构造。在其他实施方式中,接触元件450可位于静止表面上。
图32A至D示出相对于彼此移动的根据一个实施方式的接触元件452、454的剖视侧视图。如所示出的,联接到支承构件410(未示出)的接触元件452右移并且联接到支承构件420(未示出)的接触元件454左移。在其他实施方式中,只有一个接触元件450可移动而另一个可保持静止。初始地,如图32A中所示,第一接触元件452位于第二接触元件454的上方和左边。第一接触元件452右移动而第二接触元件454左移,使得第一接触元件452的下部区域紧邻或物理接触第二接触元件454的上部区域。如以下说明的,此紧邻(例如,紧密接触)或物理接触可允许发生反应。在另一个实施方式中,一个或更多个接触元件452、454可彼此同时相互作用,如图33中示出的。
图34示出接触元件450的放大剖视图。如上所述,接触元件450可按各种方式联接到支承构件400或形成支承构件400的部分。接触元件450可包括一个或更多个腔500。一个或更多个腔500可向接触元件450提供冷却,传递燃料,或减轻接触元件450的重量。如以上针对导管290描述的,一个或更多个腔500可包括用于辅助热传递的大表面面积。接触元件450还可包括一个或更多个接触区域510。接触区域510可包含与接触元件450的材料不同的材料。还可借助与接触元件450的处理不同的处理,形成接触区域510。尽管未示出,但接触元件450的其他部分可包括一个或更多个接触区域510。
接触元件450还可包括前沿512和后沿514。尽管被示出是弯曲的,但元件450的一个或更多个边缘可以线性的(例如,参见图36)。接触元件450可以是取决于例如反应条件所必须结构要求的任何合适的形状和大小。另外,接触元件450可按各种方式联接到支承构件400(未示出)。联接可以是借助物理联接(例如,焊接、粘合剂)、机械联接(例如,铆钉、螺栓等)、或其他联接机构进行的。还料想到,一个或更多个接触元件与一个或更多个支承构件400形成一体。类似于涡轮机中的叶片,这种一件式构造可提供制造优点、重量优点、对反应条件的容忍度增强和减少维修要求。混合、复合、和其他构造也是可能的。类似于以上针对齿轮40描述的,接触元件450可以是导电的并且可包括一种或更多种导电材料(未示出)。这种导电性可包括总体导电性,或元件450的特定路径或区域可以是导电的。元件450的不同部分还可具有不同的导电性。
在一些实施方式中,诸如,用如图25中所示的支承构件400,可需要偏转一个或更多个接触元件450。例如,允许在一个或更多个接触元件450之间的选择区域内发生反应。为了偏转接触元件450,可使用偏转构件520。偏转构件520可被设置成至少部分偏转一个或更多个接触元件450。例如,如图35A至D中所示,偏转构件520可被设置成改变接触元件452的移动。如图35A中所示,接触元件452可右移。然后,当与偏转构件520接触(图35B)时,接触元件452还可在向下方向上移动,使得接触元件452接触接触元件454。一旦两个元件452、454接触(图35C),就可通过在元件452、454两端施加电流,发生反应。在反应之后,接触元件452可移动经过偏转构件520并且在向上方向上移动,如图35D中所示。
现在,将详细描述根据一些实施方式的与接触元件452、454和燃料反应。如图36A至C中所示,燃料层530可大体位于第一接触元件452和第二接触元件454之间。燃料层530可至少部分跨第一接触元件452和/或第二接触元件454的接触区域510延伸。燃料层530可包括各种材料(包括燃料20),并且可使用各种装置和方法进行沉积,如本文中描述的。燃料层530还可大体位于接触元件452、454之间,因为可不需要与任一个或两个元件进行物理接触(图36A)。
在将燃料层530适宜地设置在接触元件452、454之间之后,可在接触元件452、454两端施加电流。接触元件452、454的部分或全部可以是导电的,类似于以上针对齿轮40描述的。例如,可在接触元件452、454的内部或周围设置一种或更多种导电材料。所施加的电压和电流在本文中进行描述,并且可取决于与燃料层530包含在一起的燃料20的类型。在当前施加之后,可发生高能量反应,从而将接触元件452、454移开(图36B)。任何移动的范围将取决于多种因素,包括例如反应所释放的能量和功率、接触元件的形状、大小和材料和任何支承结构。
如图36C中所示,在反应之后,接触元件452、454可向着彼此移动。如以上针对图27说明的,根据关联的结构和装置,可高度抑制移动。在一些方面,可发生一些振荡移动。
虽然上述实施方式包括接触元件450之间的旋转移动,但还料想到,可使用其他类型的移动。例如,可使用往复移动。图37A至C示出其中接触元件452联接到钟摆540的往复移动的示例。在操作中,钟摆540在接触元件454上方来回移动。在接触元件452、454彼此相互作用之前,燃料层530可大体位于元件452、454之间(图37A)。当第一接触元件452大致被设置成与第二接触元件454相邻或在其上方(图37B)时,电流可施加到接触元件452、454两端。所得的能量释放可迫使第一接触元件452摆动离开第二接触元件454(图37C),其中,所释放能量中的一些被钟摆540和接触元件452的移动吸收。钟摆540然后可再次摆回,并且可重复循环。
在另一个实施方式中,接触元件可相对于彼此在线性方向上移动。例如,如图38A至C中所示的,第一接触元件452可位于被构造成接纳第一接触元件452的通道550内。通道550的孔隙552可被设置成与第二接触元件454相邻,使得接触元件452、454可通过大体线性运动向着或背离彼此移动。如图38A中所示,接触元件452可向着位于第二接触元件454上的燃料层530移动。电流可借助通道550的壁554,或借助另一个机构被施加到第一接触元件452,以与燃料层530相互作用(图38B)。随后,该反应可推动第一接触元件452远离第二接触元件454并且向上进入通道550内(图38C)。
用于接触元件450之间的不同移动的各种系统可与上述的一个或更多个特征相组合。例如,上述的盘、钟摆、或通道实施方式可包括图27中描述和示出的一个或更多个特征。例如,弹簧(未示出)可放置在通道实施方式(图38A至C)的通道550内,以向第一接触元件452提供阻尼力。在另一个示例中,联接件(未示出)可放置在钟摆540的上端,以至少部分控制该实施方式中的第一接触元件452上的移动、速率、接收到的力、或施加到的力(图37A至C)。
本文中描述的各种实施方式还可与如本文中描述的一个或更多个光伏电池相组合。为了提高光伏电池570或类似装置的性能,可使用各种组件来减少本文中描述的反应所释放的能量的影响或效果。例如,如图39中所示,保护隔膜560可至少部分设置在一个或两个接触元件452、454和光伏电池570之间。隔膜560可被构造成部分扩散冲击波,偏转该反应所形成的一些粒子,或提供至少部分屏障,为电池570提供另外的保护。隔膜560可由连续材料形成,并且可以是透明的。在一些实施方式中,隔膜560可过滤出一个或更多个波长。隔膜560可直接联接到电池570,或被设置成与电池570隔开一定距离。
在其他实施方式中,可设置一系列屏障580。屏障可大体位于元件452、454的反应部位和电池570之间。屏障580可按各种方式布置,并且可沿着类似半径设置或设置在不同半径的层,以辅助或提供针对电池570进行保护。例如,屏障580可包括一系列挡板、栅网构件或用于引导或扩散冲击波以保护电池570的其他物体。在又一个实施方式中,隔膜570或屏障580的一个或更多个操作或结构可被整合到单个结构中,或被形成为电池570的部分。
K.SF-CIHT电池供电的轴向风扇应用
从分数氢反应输出的光功率的光伏转换代表已为大家接受的太阳能行业的新市场。包括重要行业的可更新能量的另外源涉及风力,其中,使用风车来产生电力。风电场的决定因素之一是,它们通过改变风模式来改变重要环境区域的气候。风电场可改变本地气候。在SF-CIHT生成器的实施方式中,使用风车以所期望方式改变气候。在实施方式中,多个风车均由SF-CIHT生成器来驱动,以将潮湿的近海空气吹到陆地上,凝聚并且沉淀在干燥陆地上,以使其不干燥。
包括重要行业的可更新能量的另外源涉及风力,其中,使用风车来产生电力。风电场的决定因素之一是,它们通过改变风模式来改变重要环境区域的气候。风电场可改变本地气候。在SF-CIHT生成器的实施方式中,使用风车以所期望方式改变气候。在实施方式中,多个风车均由SF-CIHT生成器来驱动,以将潮湿的近海空气吹到陆地上,凝聚并且沉淀在干燥陆地上,以使其不干燥。可根据风轮机的功率方程来计算可移动到陆地上的水量。风通过风车的动态功率P通过下式给出
P=1/2ρAv3 (202)
其中,ρ是空气密度(1.3kg/m3),A是叶片扫过的面积,v是当将风轮机通电时风的速率。速率v还是风轮机当因SF-CIHT生成器所施加的功率P供电时在面积A内产生的风速,其中,进行数量级估计时,对应轴向风扇的性能因素被当作1/2。当前,产生7MW功率的具有164m直径叶片的商用风车。因此,风速是
各时间移动的空气质量通过下式给出:
H2O的量是所吹动空气的质量的3%或陆地的英亩是43,560平方英尺或4×107cm2。1cm深度的雨需要4×107cm3或4×104kg的H2O。在给定H2O移动速率的情况下,可每供应这个水量。因此,在一周内,可激增100,000英亩。包括150个风车的风力场将灌溉1千五百万英亩。作为飓风频发区域中的替代有益的应用,斯坦福大学进行的研究[http://www.youtube.com/watch?v=M7uRtxl8j2U]已经表明无源(发电)风车可减少飓风的大风并且在暴风形成之前消散暴风。因用SF-CIHT生成器为风车供电而致使风在相反方向上吹动,可使该应用大大突出。因此,本应用中使用的风力场的容量可大幅降低。
XI.实验
A.针对能量和固体燃料再生的示例性SF-CIHT电池测试结果
在实验测试中,样本包括涂覆有NiOOH的薄(<1mm厚)带铸造涂层、11重量%的碳和27重量%的Ni粉末的1cm2镍筛网导体。该材料被约束在Taylor-Winfield model ND-24-75点焊机的两个铜电极之间并且经受低电压、高电流电能的短脉冲。所施加的60Hz电压是大约8V峰,并且峰值电流是大约20,000A。在大约46J的能量输入大约0.14ms之后,材料在大约1ms内蒸发。测试布线的几个标准尺寸,以确定8V是否足以造成用短路的高能、多千伏充电、高电容电容器观察到爆丝现象。观察到仅仅已知的在0.25mm直径的Au线的情况下致红的电阻加热并且致熔融的加热。
用于蒸发恰好350mg的NiOOH和50mg的Ni金属的热力学上计算出的能量是3.22kJ或9.20kJ/g的NiOOH。由于NiOOH分解能量基本上是0,因此这个实验证实了大能量释放。施加在40J的不可忽略总能量之后启动的爆炸。爆炸造成对应于1,100,000W(1.1MW)的热动力在3ms内释放3.22kJ的热能造成的爆炸。在给定1cm2面积和<1mm厚度的样本尺寸的情况下,体积功率密度超出11×109W/l的热。根据用Ocean Optics可见分光光度计记录的可见光谱与黑体辐射曲线的拟合,气体温度是5500K。
考虑到,计算出的用于实现观察到的恰好反应混合物的350mg的NiOOH和50mg的Ni网片组件的蒸发的热能是3.22kJ。350mg的NiOOH中的H2的摩尔数是2毫摩尔。基于H2的分数氢反应的H2(1/4)到从化学计量学上说H的2/3变成HOH催化剂且1/3变成分数氢H2(1/4)的H2(1/4)的计算出的50MJ/摩尔的H2(1/4)的焓,形成H2(1/4)带来的对应最大理论能量是33kJ;所以,可用氢中的大约10%被转换成H2(1/4)。对应的分数氢反应产量是64.4微摩尔的H2(1/4)。
固体燃料的另一个实施方式包括100mg的Co粉末和水合的20mg的MgCl2。反应物被压缩成小球并且用Taylor-Winfield model ND-24-75点焊机使小球经受低电压、高电流电能的短脉冲进行点燃。所施加的60Hz电压是大约8V峰,峰值电流是大约20,000A。在填充氩气的气密隔离保护罩中发生爆炸并且释放估计的3kJ的等离子体能量。等离子体的粒子被浓缩为纳米粉末。用10mg的H2O来水合产物,并且重复进行点燃。再生固体燃料的重复爆炸比第一次更强有力,从而释放大约5kJ的能量。在另一个实施方式中,Ag取代Co。
B.SF-CIHT电池的固体燃料的热量测定
使用带有Parr 6774热量仪温度计选项的Parr 1341平夹套热量仪对固体燃料小球执行热量仪。改造热量仪的Parr 1108氧燃烧腔室,以允许用高电流启动化学反应。通过包括石墨小球(~1000mg,L×W×H=0.18”×0.6”×0.3”)作为控制电阻负载的密封腔室,供给包括1/2”外径(OD)12”长度的铜圆柱体的铜杆点燃电极,控制电阻负载用于校准热量仪或固体燃料小球的热容量,其中,端部具有紧紧约束各样本的铜夹具。热量仪水浴装载有2,000g的DI水(根据Parr手册)。用于校准和点燃固体燃料小球的功率源是Taylor-Winfield model ND-24-75点焊机,该点焊机供应大约8V RMS的60Hz低电压和大约15,000至20,000A的高电流形式的电能的短脉冲。固体燃料的校准和点燃的输入能量被给定为在输入时间内积分的电压和电流的乘积。通过包括PC的数据采集系统(DAS)测量电压,该PC带有National Instruments USB-6210数据采集模块和Labview VI。还通过与信号源相同的使用精确至0.3%的Rogowski线圈(具有700mm电缆的Model CWT600LF)的DAS来测量电流。以10KS/s得到V和I输入数据并且使用电压衰减器使模拟输入电压在USB-6210的+/-10V范围内。
通过点焊机使用能量输入是995J的石墨小球确定热量仪和电极设备的校准后的热容量是12,000J/℃。用施加的3V的峰值60Hz电压和大约11,220A的峰值电流来点燃密封在铝DSC盘(70mg)(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、密封(Setaram,S08/HBB37409))中的包括Cu(45mg)+CuO(15mg)+H2O(15mg)的固体燃料的样本。根据随时间推移的电压和电流测得的输入能量是46J,用与点焊机的功率脉冲所输入的总共899J如波形中的破坏尖峰所指示地点燃样本,并且使用校准的热容量针对对点燃的固体燃料所释放的能量的热量仪热响应计算出的总输出能量是3,035.7J。通过减去输入能量,对于0.075g的样本,净能量是2,136.7J。在用H2O进行的对照实验中,氧化铝盘没有经受除了在爆炸中变成蒸发外的反应。XRD还表明没有形成氧化铝。因此,理论上的化学反应能量是0,并且固体燃料在形成分数氢时生成28,500J/g的过量能量。
C.光伏功率转换
用施加的3-6V的峰值60Hz电压和大约10,000-15,000A的峰值电流来点燃密封在铝DSC盘(70mg)(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、密封(Setaram,S08/HBB37409))中的包括Cu(45mg)+CuO(15mg)+H2O(15mg)的固体燃料的样本。用Ocean Optics可见分光光度计(Ocean Optics Jaz,带有ILX511b检测器,OFLV-3滤波器,L2透镜,5μm隙缝,350–1000nm)来记录可见光谱。光谱拟合大约6000K的黑体。太阳的黑体温度是5800K。由于太阳和SF-CIHT等离子体均处于5800K-6000K(图40)并且太阳是地球处的1000W/m2的标准黑体,因此太阳能电池用作功率仪表。基于相对于太阳的对于等离子体源的相对太阳能电池功率密度响应,计算给定从点燃中心到太阳能电池的距离的情况下的等离子体的光功率密度。然后,通过将功率密度与被确定密度的球状壳的固体角度区域相乘,计算等离子体源的总光功率。
以1000W/m2的阳光功率作为标准光源,确定单晶太阳能面板的效率。使用记录在单晶太阳能面板上的能量及其面积和通过每秒150,000帧的高速视频确定的20μs的点燃事件持续时间,确定等离子体的功率密度是6×106W/m2。用Ocean Optics分光光度计来确认等离子体的光功率。确定从导致光谱强度匹配标准点源功率光源的等离子体中心到光纤电缆入口的分离距离。然后,通过用被求平方的分离距离校正标准功率,给出等离子体源的功率。典型的分离距离大(诸如,700cm)。
通过将功率密度乘以10英寸半径(点燃中心和太阳能面板之间的距离)的实心角度球形区域,确定等离子体的总光功率是0.8m2×6×106W/m2=4.8×106W光功率。通过总功率乘以20μm的爆炸持续时间而给出的总能量是(4.8×106W)(20×10-6s)=96J。通常用热量仪测量的固体燃料引爆而释放的能量是大约1000J。由于对于快速点燃发射不利的单晶太阳能电池的缓慢响应时间,导致考虑记录的光学能量的量减小。GaAs电池可能更合适。
太阳的5800K黑体温度和点燃等离子体的黑体温度大致相同,因为在两种情况(H催化成分数氢)下的加热机构相同。高爆炸的温度也如预期地高达5500K,因为高温源是形成分数氢。由于太阳能电池已经优化,将5800K的黑体辐射转换成电,因此使用太阳能电池进行光伏转换是得到这些测试确认的SF-CIHT生成器的合适功率转换手段。
对均包括密封在铝DSC盘(75mg)(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、密封(Setaram,S08/HBB37409))中的包括100mg的Cu+30mg的去离子水的固体燃料小球执行一系列点燃。将小球以1.9cm间隔粘附于铜金属带,并且包围National Electric Welding machines缝焊机(100kVA Model#100AOPT SPCT 24)的辊盘形成带并且用施加的大约4-8V的峰值60Hz电压和大约10,000-35,000A的峰值电流进行点燃。调节旋转速度,使得当辊将各小球移动到缝焊机的顶部不工作重心位置时以1Hz的引爆频率发生引爆。用光伏转换器将光的明亮闪光转换成电并且在发光二极管(LED)阵列中耗散电。
附带Lexan壁的三面金属框架被设置为包围缝焊机盘,使得矩形外壳的壁与焊机盘最近的分离距离是大约15cm。将30W、12V太阳能面板附接到外壳的三个壁中的每个。各面板包括高效6”多晶电池、低铁钢化玻璃和带有TPT背片的EVA膜,用阳极化铝合金框架(Type 6063-T5)(UL Solar,http://www.ulsolar.com/30_Watt_12_Volt_multicrystalline_solar_panel_p/stp030p.htm)包封电池。其他太阳能面板规格是:电池(多晶硅):156mm×39mm;电池和连接件的数量:36(4×9);模块的尺寸:26.2×16.2×0.98英寸;重量:8磅。电特征是STC处的功率是:30瓦;最大功率电压(Vpm):17.3伏;最大功率电流(Ipm):1.77安;开路电压(Voc):21.9伏;短路电流(Isc):1.93安;容差:±5%;标准测试条件:温度25℃,辐射量1000W/M2,AM=1.5;最大系统电压:600V DC;系列熔断丝额定:10安;温度系数Isc:0.06%/K,Voc:-0.36%/K,Pmax:-0.5%/K;操作温度-40℃至+85℃;存储湿度:90%;输出端子的类型:接线盒;电缆:9英寸,3000mm。
太阳能面板连接到LED阵列。LED阵列包括Genssi LED Off Road Light 4×4Work Light Waterproof 27W 12V 6000K(30Degree Spot)http://www.amazon.com/Genssi-Light-Waterproof-6000K-Degree/dp/B005WWLQ8G/ref=sr_1_1?ie=UTF8&qid=1396219947&sr=8-1&keywords=B005WWLQ8G,LEDwholesalers 16.4Feet(5Meter)Flexible LED Light Strip with300xSMD3528and Adhesive Back,12Volt,White,2026WH(24W total),http://www.amazon.com/LEDwholesalers-Flexible-LED-Strip-300xSMD3528/dp/B002Q8V8DM/ref=sr_1_1?ie=UTF8&qid=1396220045&sr=8-1&keywords=B002Q8V8DM,9W12V Underwater LED Light Landscape Fountain Pond Lamp Bulb White http://www.amazon.com/Underwater-Light-Landscape-Fountain-White/dp/B00AQWVHJ U/ref=sr_1_1?ie=UTF8&qid=1396220111&sr=8-1&keywords=B00AQWVHJU。在LED的额定电压和瓦特数下输出的估计的总功率输出是27W+24W+9W=60W。三个太阳能面板的集合输出功率在1个太阳的稳态条件下是90W。
1Hz下的一系列顺序引爆将LED阵列保持在全光输出下的基本连续操作。考虑来自固体-燃料-小球引爆中的每个的三个太阳能面板收集的能量平衡。LED在大约1s内输出大约60W,即便爆炸甚至短得多(100μs)。多晶光伏材料具有没有非常适于多兆瓦短脉冲的响应时间和最大功率。但是,电池用作1s时间间隔内的大约60J能量的整合器。经确定,Lexan处的光反射是50%并且多晶电池将5800K光转换成电时是大约10%的效率。针对反射和10%效率来校正60J对应于1200J。100μs事件内的对应光功率是12MW。引爆各小球而释放的用独立燃烧弹热量仪检测方法测得的能量是大约1000J。通过用光电二极管进行快速检测,确定引爆时间是100μs。因此,确定功率是大约10MW。通过可见光分光光度计确定的光功率的功率密度在大于大约200cm的距离处超过1MW/m2。根据Stefan-Boltzmann定律,确定光功率密度与所预期的6000K下的黑体辐射一致。相比于热量仪和分光镜功率结果,光伏转换器给出合理的能量平衡。
D.等离子体动力学功率转换
在密封在铝DSC盘(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、密封(Setaram,S08/HBB37409))中的20mg的Co3O4或CuO中添加0.05ml(50mg)的H2O。使用Taylor-Winfield model ND-24-75点焊机,用施加到点燃电极的大约8V RVS下的15,000至25,000A之间的电流来点燃各样本,点燃电极包括5/8”外径(OD)3”长度的铜圆柱体,其中,平坦端约束样本。观察到大功率脉冲,该脉冲将各样本蒸发成为含能、高电离、膨胀等离子体。PDC电极包括两个1/16”OD铜线。磁化PDC电极被成形为在燃料样本的平面上围绕点燃电极周向放置的直径1”的开环。由于电流是轴向的,因此来自高电流的磁场是径向的,平行于开环PDC电极的轮廓。对向未磁化PDC电极平行于点燃电极和高电流的方向;因此,径向磁场线垂直于这个PDC电极。对向PDC电极在样本平面的上方和下方延伸2.5”。在标准0.1欧姆的电阻器两端测量PDC电压。对应点燃之后的PDC电极的电压是25V。
E.固体燃料的差示扫描量热法(DCS)
使用利用涂覆Au的坩埚进行的Setaram DSC 131差示扫描量热仪,针对超过最大理论值的过多能量测试固体燃料,在表7中示出代表性的结果。
表7.示例性DSC测试结果。
F.分子分数氢的分光识别
在密封在铝DSC盘(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、密封(Setaram,S08/HBB37409))中的20mg的Co3O4或CuO中添加0.05ml(50mg)的H2O并且使用Taylor-Winfield model ND-24-75点焊机用大约8V RVS下的15,000至25,000A之间的电流来点燃。观察到大功率脉冲,该脉冲将各样本蒸发成为含能、高电离、膨胀等离子体。MoCu箔验证板(50-50原子%,AMETEK,0.020”厚度)放置在与点燃样本的中心相距3.5英寸,使得膨胀等离子体入射到表面上,以将H2(1/4)分子嵌入该表面中。
使用宏模式下的具有780nm二极管激光的Thermo Scientific DXR SmartRaman,观察暴露于含H2(1/4)等离子体之后的MoCu箔上的40cm-1宽吸收峰。在原始合金中没有观察到该峰,峰强度随等离子体强度和激光强度增大而增大。由于已知没有其他元素或化合物可吸收1.33eV(780nm激光的能量减去1950cm-1)处的红外线附近的单个40cm-1(0.005eV),因此考虑有H2(1/4)。始于1950cm-1的吸收峰将H2(1/4)的自由空间旋转能量(0.2414eV)匹配四个有效数字,40cm-1的宽度匹配轨道-原子核联接能量劈裂[Mills GUTCP]。
匹配H2(1/4)旋转能量的吸收峰是真实峰,不可通过任何已知的物种来说明。激发分数氢旋转可通过逆Raman效应(IRE)来造成吸收峰。这里,激光造成的连续谱被吸收并且转变成激光频率,其中,连续谱强得足以保持旋转激发态粒子数,从而允许antiStokes能量贡献。通常,对于IRE,激光功率非常高,但发现MoCu表面造成表面增强型Raman散射(SERS)。针对J′=1至J″=0的转变,向H2(1/4)旋转能量的逆Raman效应(IRE)指派吸收。这个结果表明,H2(1/4)是自由转子,这是硅基质中的H2的情况。暴露于等离子体的MoCu箔上的结果匹配之前在CIHT电池上观察到的结果,如Mill现有公开文献中报告的:其全部内容以引用方式并入本文中的R.Mills,J.Lotoski,J.Kong,G Chu,J.He,J.Trevey,High-Power-Density Catalyst Induced Hydrino Transition(CIHT)Electrochemical Cell(2014)。
对反应产物的样本执行MAS 1H NMR、电子束激发发射光谱、Raman光谱、和光致发光发射光谱,反应产物包括放置在关闭CIHT电池的密封容器中的CIHT电解液、CIHT电极和无机化合物吸气剂KCl-KOH混合物。
捕获在质子基质中的分子分数氢的MAS NMR代表借助其与基质相互作用采用分子分数氢的特有特性进行其识别的手段。关于NMR光谱的特有考虑是可能的分子分数氢量子状态。类似于H2激发态,分子分数氢H2(1/p)具有时的状态。即使量子状态也具有相对大的四极矩,另外,状态的对应轨道角动量引起可造成往高磁场位移的磁矩[Mills GUT]。当基质包括可交换H(诸如,具有水合水的基质或碱性氢氧化物固体基质)时,这种效果是尤其有利的,其中,与H2(1/p)的局部相互作用由于快速交换而影响较大粒子数。在暴露于密封CIHT电池内部的大气之后,CIHT电池吸气剂KOH-KCl表明基质(KOH)的MAS NMAR有源组件从+4.4ppm移位至大约-4至-5ppm。例如,初始KOH-KCl(1:1)吸气剂的MAS NMR光谱、来自包括分别输出2.5Wh、80mA、125%的增益和6.49Wh、150mA、185%的增益的[MoNi/LiOH-LiBr/NiO]和[CoCu(H perm)/LiOH-LiBr/NiO]的相同KOH-KCl(1:1)表明OH基质的已知低磁场峰从大约+4ppm移位为大约-4ppm的高磁场区域。CIHT电池所生成的分子分数氢将基质从正位移到明显高磁场。对于p=4状态而言可能的不同量子数可引起与-4ppm的区域中的多个这些峰的观察一致的不同高电场基质位移。与之前观察一致地,当往高磁场移位的氢氧离子(OH-)充当自由转子时,通过与可猛烈的分子分数氢形成络合物,HOH基质的MAS NMR峰往高电场位移。MAS NMR结果与之前正离子ToF-SIMS光谱一致,ToF-SIMS光谱表明以二分数氢作为结构部分M:H2(M=KOH or K2CO3)的基质化合物的多体集群。具体地,包括(诸如,K2CO3-KCl(30:70重量%)的)KOH和K2CO3的之前CIHT单元吸气剂的正离子光谱表明与作为结构中络合物的H2(1/p)一致的K+(H2:KOH)n和K+(H2:K2CO3)n[R.Mills,X Yu,Y.Lu,G Chu,J.He,J.Lotoski,“Catalyst induced hydrino transition(CIHT)electrochemical cell”,(2014),International Journal of Energy Research]。
使用Raman光谱,通过分子分数氢的特征性的异常高的振转能量来直接识别分子分数氢。另一种分辨特征是,分子分数氢的选择规则不同于普通分子氢的选择规则。类似于H2激发态,分子分数氢具有时的状态,其中,长圆球形光子场H2(1/p);p=1,2,3,...,137具有相对于半主轴的量子数的球谐角分量[Mills GUT]。这些长圆球形谐波状态许可针对H2激发态的在没有电子转变的情况下纯振动转变期间进行ΔJ=0,±1的旋转转变。角状态的寿命足够长,使得H2(1/p)可特有地经受具有选择规则ΔJ=0,±1的纯振转转变。
发射振转分子分数氢状态可由高能量电子碰撞或通过激光来激发,其中,由于的p2(J+1)0.01509eV的旋转能量[Mills GUT],激发旋转状态不可增加粒子数成为环境温度下的统计学热力学上的粒子数,因为对应的热能小于0.02eV。因此,振转状态粒子数分布影响了外部源的激发概率。此外,由于振动能量p20.515eV比旋转能量高35倍,导致只预期第一水平υ=1被外部源激发。分子分数氢状态可经受环境温度下的量子数改变,并且随着功率被热化,J量子状态可在电子束或激光辐射期间改变。因此,初始状态可以是中的任一个,独立于J量子数。因此,旋转和振转转变是允许以R、Q、P分支的Raman和IR活性,其中,在旋转和电子状态改变之间保存角动量。通过量子数的改变所允许的,伴随旋转能量上转换(J′-J″=-1)、下转换(J′-J″=+1)和不变(J′-J″=0)进行的去激发振动转变υ=1→υ=0分别引起P、R和Q分支。Q分支峰值对应于纯振动转变υ=1→υ=0;经预测,ΔJ=0是伴随较高级的转变峰值的P和R系列的强度快速减小的最大强度,其中,由于内部转换的可用能量,导致预期相对于R分支,P分支有具有较高强度的更多峰值。预期基质的影响造成振动能量从自由振子的能量位移,并且预料基质旋转能量障壁引起向着P和R分支峰值中的每个的大致相同的能量位移表现为系列旋转峰值的线性能量分离的非零截距。
之前报告了[R.Mills,X Yu,Y.Lu,G Chu,J.He,J.Lotoski,“Catalyst induced hydrino transition(CIHT)electrochemical cell”,(2014),International Journal or Energy Research]捕获在CIHT电池气体的吸气剂的晶格中的H2(1/4)的振转发射被入射的6keV电子枪在5X 10-6托的压力范围内用8μA的束电流激发并且被无窗口UV光谱来记录。通过相同的方法,通过电子束激发发射光谱,观察捕获在MoCu的金属晶格中的H2(1/4)。用输出5.97Wh、80mA、190%增益的CIHT电池[MoCu(50/50)(H渗透)/LiOH+LiBr/NiO]的MoCu阳极记录的H2(1/4)的分辨的振转光谱(所谓的260nm带)的示例表现出258nm处具有峰值最大值,其代表性峰值位置在具有相等间隔0.2491eV的227、238、250、263、277和293nm处。这些结果非常好地符合分别的用于转变基质位移振动的转变和自由转子旋转转变υ=1→υ=0和Q(0)、R(0)、R(1)、P(1)、P(2)和P(3)的H2(1/4)的预测值,其中,Q(0)能识别为系列的最强峰。峰宽度(FWHM)是4nm。预期相对于晶格中的普通H2的H2(1/4)的振转转变展宽,因为所涉及的能量是异常的,高16倍,并且明显联接到晶格的光子带,从而导致谐振展宽。在MoCu起始材料上没有观察到260nm的带。260nm的带被观察为来自KOH-KCl晶体的二级Raman荧光光谱,KOH-KCl晶体用作当密封在CIHT电池中时H2(1/4)的吸气剂,如之前描述的[R.Mills,X Yu,Y.Lu,G Chu,J.He,J.Lotoski,“Catalyst induced hydrino transition(CIHT)electrochemical cell”,(2014),International Journal or Energy Research]。在CoCu阳极上也观察到260nm的带。
还使用Raman光谱来确认H2(1/4),其中,由于邻和对之间的能量差异大,因此预期后者支配粒子数。在给定对是偶数的情况下,对于偶数,纯旋转转变的典型选择规则是ΔJ=±2。然而,轨道-旋转角动量联接在保存了激发旋转水平的光子的角动量的情况下,引起量子数改变,其中,在没有量子数改变的情况下,谐振光子能量的频率相对于转变通过轨道-原子核超精细能量有位移。此外,对于原子核沿着核间轴对准,如参考文献[Mills GUT]的第12章中给出的。被定义为初始状态减去最终状态的针对Stokes光谱的旋转选择规则是ΔJ=J′-J″=-1,轨道小动量选择规则是转变变得通过在旋转和轨道角动量激发联接期间的角动量保存被允许[Mills GUT]。并且,预期强度并不依赖于核自旋。
使用宏模式下的具有780nm二极管激光的Thermo Scientific DXR SmartRaman,观察在产生过量电力之后的MoCu氢渗透阳极上的40cm-1宽吸收峰。在原始合金中没有观察到该峰,峰强度随过量能量和激光强度增大而增大。此外,通过预先和后期超声处理表现出,将被视为源的唯一可能元素是Mo、Cu、H和O,如通过SEM-EDX确认的。对照化合物的序列没有再生峰。还在具有Mo、CoCu和MoNiAl阳极的电池(诸如,输出6.49Wh、150mA、186%增益的电池[CoCu(H渗透)/LiOH-LiBr/NiO]和输出2.40Wh、80mA、176%增益的电池[MoNiAl(45.5/45.5/9重量%)/LiOH-LiBr/NiO])上观察到峰。在单独的实验中,来自这些电池的KOH-KCl被吸气气体给出了被指派给H2(1/4)振转的非常强的荧光或光致发光系列。由于已知没有其他元素或化合物可吸收1.33eV(780nm激光的能量减去2000cm-1)处的红外线附近的单个40cm-1(0.005eV),因此考虑有H2(1/4)。始于1950cm-1的吸收峰将H2(1/4)的自由空间旋转能量(0.2414eV)匹配四个有效数字,40cm-1的宽度匹配轨道-原子核联接能量劈裂[Mills GUTCP]。
匹配H2(1/4)旋转能量的吸收峰是真实峰,不可通过任何已知的物种来说明。激发分数氢旋转可通过两种机制来造成吸收峰。首先,由于作为晶格包括的旋转分数氢的强相互作用,导致Stokes光被晶格吸收。这类似于用260nm电子束带观察到的谐振展宽。其次包括已知的逆Raman效应。这里,激光造成的连续谱被吸收并且转变成激光频率,其中,连续谱强得足以保持旋转激发态粒子数,从而允许antiStokes能量贡献。通常,对于IRE,激光功率非常高,但由于其非零量子数和对应的选择规则,导致分子分数氢可以是特定例。此外,预料由于金属混合物的Mo和Cu晶粒边界的小尺寸,导致MoCu造成表面增强型Raman散射(SERS)。所以,根据后一种机制的背景来讨论结果。
针对J′=1至J″=0的转变,向H2(1/4)旋转能量的逆Raman效应(IRE)指派吸收[Mills GUT]。这个结果表明,H2(1/4)是自由转子,这是硅基质中的H2的情况。此外,由于H2(1/4)可与氢氧化物形成络合物(如MAS NMR和ToF-SIM所表明的)并且由于晶格中H2(1/4)部位处的本地环境影响而导致用电子束激发发射光谱和光致发光光谱观察到基质位移,因此预料IRE同样地在不同基质中并且还随压力有位移[R.Mills,X Yu,Y.Lu,G Chu,J.He,J.Lotoski,“Catalyst induced hydrino transition(CIHT)electrochemical cell”,(2014),International Journal or Energy Research]。同样地,作为基质包括的H2的Raman峰随压力而位移。通过对金属和无机化合物进行Raman光谱筛选,观察到许多实例。Ti和Nb表现出始于1950cm-1的大约20个计数的小吸收峰。Al表现出大得多的峰。无机化合物的实例包括分别表现出2308cm-1和2608cm-1的峰的LiOH和LiOH-LiBr。球磨LiOH-LiBr造成使IRE峰的大幅增强并且将其位移使其中心在2308cm-1(如同LiOH)以及形成中心在1990cm-1的反应。用形成H2O的Ca(OH)2观察到2447cm-1的特别强的吸收峰。在Ca(OH)2在512℃下脱水时或通过与CO2反应,Ca(OH)2可用作形成H2(1/4)的催化剂。这些是用于形成分数氢的固体燃料型反应,如之前报告的[R.Mills,X Yu,Y.Lu,G Chu,J.He,J.Lotoski,“Catalyst induced hydrino transition(CIHT)electrochemical cell”,(2014),International Journal or Energy Research]。LiOH和Ca(OH)2二者都表现出H2(1/4)IRE峰,并且在商业上是用Ca(OH)2与Li2CO3反应而形成的。因此,通过球磨致使Ca(OH)2+Li2CO3混合物反应,观察到非常强的H2(1/4)IRE峰的中心在1997cm-1。
在进行一系列固体燃料小球点燃中的每次点燃之后,将铟箔暴露于产物气体1分钟。在氩气气氛中顺序地点燃50个固体燃料小球,这些小球均包括密封在铝DSC盘(70mg)(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、密封(Setaram,S08/HBB37409))中的100mg的Cu+30mg的去离子水。使用供应大约8V RMS下的60Hz低电压和大约15,000至25,000A的高电流的形式的电能的短脉冲的Taylor-Winfield model ND-24-75点焊机执行固体燃料小球的每次点燃。使用宏模式下的具有780nm二极管激光的Thermo Scientific DXR SmartRaman,观察1950cm-1IRE峰。在原始样本中没有观察到的峰被指派给H2(1/4)旋转。
之前报告了作为固体燃料反应的产物的H2(1/4)[R.Mills,X Yu,Y.Lu,G Chu,J.He,J.Lotoski,“Catalyst induced hydrino transition(CIHT)electrochemical cell”,(2014),International Journal of Energy Research;R.Mills,J.Lotoski,W.Good,J.He,“Solid Fuels that Form HOH Catalyst”,(2014)]。通过根据等式(6-9)形成分数氢而释放的能量被表明引起了高动能H-。使用可通过分解Al(OH)3和Li与H2O和LiNH2的反应形成H和HOH催化剂的固体燃料Li+LiNH2+解离剂Ru-Al2O3,通过确认等式(9)的能量释放被表现为高动能H-的ToF-SIMS观察在m/e=1之前到达的离子。诸如氧的其他离子(m/e=16)没有表现出早期峰。飞行时间T、质量m和加速电压V之间的关系是
其中,A是取决于离子飞行距离的常数。根据观察到的加速电压为3kV时m/e=0.968的早期峰,从分数氢反应赋予H物种的动能是大约与通过等式(6-9)给出的HOH催化剂反应匹配的204eV。在对应于H+的正模式下观察到相同的早期光谱,但强度较低。
对固体燃料执行XPS。通过Li、LiBr、LiNH2、解离剂R-Ni(包括大约2重量%的Al(OH)3)和1atm的H2而形成的LiHBr的XPS表明不可被指派给任何已知元素的两种不同系列的反应产物的XPS光谱的494.5eV和495.6eV处的峰。唯一可能的Na、Sn和Zn容易基于不存在这些元素的任何其他对应峰而被排除,因为只观察到Li、Br、C和O峰。峰匹配理论上被允许分子分数氢H2(1/4)的双电离的能量[R.Mills,X Yu,Y.Lu,G Chu,J.He,J.Lotoski,“Catalyst induced hydrino transition(CIHT)electrochemical cell,”(2014),International Journal or Energy Research]。通过Raman和FTIR光谱将分子分数氢进一步确认为产物。固体燃料产物LiHBr的Rama光谱表明中心在1994cm-1的H2(1/4)逆Raman效应吸收峰。固体燃料产物LiHBr的FTIR光谱表明与H2(1/4)的自由转子能量密切匹配的1988cm-1的新尖锐峰。此外,MAS NMR表明与针对其他CIHT电池KOH-KCl(1:1)吸气剂样本(诸如,包括表现出-4.04和-4.38ppm的往高电场基质峰的输出2.5Wh、80mA、125%增益的[Mo/LiOH-LiBr/NiO]的CIHT电池的样本和包括表现出-4.09和-4.34ppm的往高电场基质峰的输出6.49Wh、150mA、186%增益的[CoCu(H渗透)/LiOH-LiBr/NiO]的CIHT电池的样本)表现出的峰一致的强往高电场位移峰。
还对诸如[MoCu(H渗透)/LiOH-LiBr/NiO](1.56Wh,50mA,189%增益)和[MoNi(H渗透)/LiOH-LiBr/NiO](1.53Wh,50mA,190%)的CIHT电池的阳极执行XPS。也观察到496eV峰。因为排除了其他可能性,所以峰被指派给H2(1/4)。具体地,在各情况下,496eV峰可不与Mo 1s关联,因为其强度将比Mo 3p峰小得多并且能量将比观察到的能量高,并且它没有被指派给Na KLL,因为光谱中没有Na1s。
使用Scienta 300XPS光谱仪,在Lehigh University对在暴露于来自固体燃料点燃的气体之后表现出强1940cm-1IRE峰的铟金属吸气剂执行XPS,固体燃料包括密封在铝DSC盘(70mg)(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、密封(Setaram,S08/HBB37409))中的包括100mg的Cu+30mg的去离子水。观察被指派给H2(1/4)而不可被指派给任何已知元素的496eV峰。
搜索分数氢谱的另一种成功的交叉确认技术涉及使用Raman光谱仪,其中,观察到作为二级荧光的匹配260nm电子束带的H2(1/4)的振转。用KOH-KCl(50-50原子%)和[CoCu(H渗透)/LiOH-LiBr/NiO](6.49Wh,150mA,186%增益)对来自电池[Mo,10双极性板/LiOH-LiBr-MgO/NiO](2550.5Wh,1.7A,9.5V,234%增益)、[MoCu/LiOH-LiBr/NiO](3.5Wh,80mA,120%增益),[MoNi/LiOH-LiBr/NiO](1.8Wh,80mA,140%)进行吸气,使用放大倍数是40X的显微镜模式下的具有HeCd 325nm激光的Horiba Jobin Yvon LabRAM Aramis Raman光谱仪记录吸气剂上的Raman光谱。在各情况下,在8000cm-1至18,000cm-1区域中观察到一系列强1000cm-1(0.1234eV)等能量间隔Raman峰。将Raman光谱转换成荧光或光致发光光谱揭示了作为通过电子束激发首先观察到的对应于260m带的H2(1/4)的二级振转光谱的匹配[R.Mills,X Yu,Y.Lu,G Chu,J.He,J.Lotoski,“Catalyst induced hydrino transition(CIHT)electrochemical cell”,(2014),International Journal or Energy Research]。对于光谱的Q、R和P分支的峰支配是分别在12,199、11,207、10,191、9141、8100、13,183、14,168、15,121、16,064、16,993和17,892cm-1观察到的Q(0)、R(0)、R(1)、R(2)、R(3)、R(4)、P(1)、P(2)、P(3)、P(4)、P(5)和P(6)。认为是通过激光的高能UV和EUV He和Cd发射进行激发,其中,激光光学器件对于至少170nm是透明的并且光栅(带有1024×26μm2个像素CCD的Labram Aramis 2400g/mm 460mm焦距系统)是分散的并且其最大效率在光谱范围(与260nm带相同的范围)的较短波长侧。例如,镉具有基于电子束激发数据的与KCl基质中H2(1/4)的振转激发能量匹配的214.4nm(5.8eV)的强谱线。CCD在500nm最具响应性,260nm带的二级区域的中心在520m。
光致发光带还与往高电场位移的NMR峰相关。例如,来自包括在-4.04和-4.38ppm具有往高电场位移的基质峰的[MoNi/LiOH-LiBr/NiO]的MoNi阳极CIHT电池的KOH-KCl(1:1)吸气剂和来自包括在-4.09和-4.34ppm具有往高电场位移的基质峰的[CoCu(H渗透)/LiOH-LiBr/NiO]的CoCu H渗透阳极CIHT电池的KOH-KCl(1:1)吸气剂表现出对应于260nm电子束的一系列光致发光峰。
对1g的KOH-KCl(1:1)吸气剂样本执行Raman光谱法,该样本保持与单独的固体燃料小球的15个连续启动的中心距离2”,固体燃料小球均包括密封在铝DSC盘(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、密封(Setaram,S08/HBB37409))中的CuO(30mg)+Cu(10mg)+H2O(14.5mg)。用供应低电压、高电流电能的短脉冲的Taylor-Winfield model ND-24-75点焊机点燃固体燃料的各样本。所施加的60Hz电压是大约8V峰,峰值电流是大约20,000A。吸气剂样本被容纳在被聚合物网线覆盖的铝坩埚中,聚合物网线绕着坩埚系上。网片防止任何固体反应产物进入样本,同时允许气体从中穿过。第十五个单独的固体燃料样本被快速接连点燃,累积15次暴露的吸气剂样本被传递到Ar气密隔离保护罩,在Ar气密隔离保护罩中,使用研钵和杵将其均匀混合。使用放大倍数是40X的显微镜模式下的具有HeCd 325nm激光的Horiba Jobin Yvon LabRAM Aramis Raman光谱仪,观察与υ=1→υ=0转变内的H2(1/4)的二级旋转发射匹配的一系列1000cm-1等能量间隔Raman峰。具体地,分别在12,194、11,239、10,147、13,268、14,189、15,127、16,065、17,020和17,907cm-1观察到Q、R和P分支峰Q(0)、R(0)、R(1)、R(2)、P(1)、P(2)、P(3)、P(4)和P(5),确认的分子分数氢H2(1/4)是点燃的固体燃料的含能爆炸的源。
将分数氢吸气剂KOH:KCl(1:1)在250℃下加热15分钟并且进行冷却(对照),然后将其放置在坩埚中并且在室温下的氩气氛中暴露于固体燃料小球的50次连续点燃。在氩气气氛中顺序地点燃50个固体燃料小球,这些小球均包括密封在铝DSC盘(70mg)(铝坩埚30μl,D:6.7×3(Setaram,S08/HBB37408)和铝盖D:6、7、压制、密封(Setaram,S08/HBB37409))中的100mg的Cu+30mg的去离子水。使用供应大约8V RMS下的60Hz低电压和大约15,000至25,000A的高电流的形式的电能的短脉冲的Taylor-Winfield model ND-24-75点焊机执行固体燃料小球的每次点燃。使用放大倍数是40X的显微镜模式下的具有HeCd 325nm激光的Horiba Jobin Yvon LabRAM Aramis Raman光谱仪记录吸气剂上的Raman光谱。在被指派给H2(1/4)的二级振转光谱8000cm-1至18,000cm-1区域中观察到一系列强1000cm-1(0.1234eV)等能量间隔Raman峰中的强度增大。
总体上,Raman结果(诸如,观察到0.241eV(1940cm-1)的Raman逆Raman效应峰和匹配260nm电子束光谱的0.2414eV间隔的Raman光致发光带)是核间距离是H2的核间距离的1/4的分子分数氢的强有力确认。后一种情况的证据是通过处于没有已知一级峰或与理论预测相符的四个有效数字的基质峰的可能指派的区域中来证实的。
对容纳在被抽真空至5×10-4托的真空腔室中的固体燃料样本执行EUV光谱法,固体燃料样本包括涂覆有NiOOH的薄(<1mm厚)带铸造涂层、11重量%的碳和27重量%的Ni粉末的0.08cm2镍筛网导体。该材料被约束在Acme Electric Welder Company model 3-42-75,75KVA点焊机的两个铜电极之间,使得样本的水平平面与EUV光谱仪的光学器件对准,如对准激光所确认的。样本经受低电压、高电流电能的短脉冲。所施加的60Hz电压是大约8V峰,并且峰值电流是大约20,000A。使用配备用于阻挡可见光的涂覆铂的600g/mm光栅和铝(Al)(800nm厚,Luxel Corporation)过滤器的McPherson掠入射EUV光谱仪(Model 248/310G)记录EUV光谱。入射角是87°。入射隙缝跨度为100μm时波长分辨率在CCD中心是大约0.15nm并且在50nm的CCD波长范围的极限处是0.5nm。从作为点燃的固体燃料的等离子体源到光谱仪入射口的距离是70cm。通过冷却至-60℃的CCD检测器检测EUV光。CCD检测器的中心在35nm。观察到10至40nm的区域中的连续谱辐射。在记录爆炸光谱之后,确认Al窗口完好。通过使可见光经过而阻断任何EUV光的石英窗口之外的爆炸表现出确认短波长连续谱光谱不是由于经过Al过滤器的散射可见光导致的平光谱。高电压氦箍缩放电光谱表现出仅仅用于对光谱进行波长校正的He原子和离子线。因此,高能量光确认是真实信号。由于最大所施加电压小于8V,因此由于场加速,导致不可以辐射大约125eV的能量;此外,未知化学反应可释放不止几eV。新生H2O分子可通过接受81.6eV(m=3)用作催化剂,形成随具有92·13.6eV=122.4eV的能量截断和(等式(32-33))的短波长截断的连续谱带的发射而衰减的中间物。根据等式(43-47),在10nm区域内并且达到较长波长的连续谱辐射带匹配理论上预测的H至分数氢状态H(1/4)的转变。
G.基于通过HOH催化剂催化H的水电弧等离子体功率源
H2O电弧等离子体系统包括连接在铜基板-杆电极和容纳水的同心外部铜圆柱电极之间的能量存储电容器,其中,基板-杆电极的杆低于水体积。杆被内置于圆柱电极部分中Nylon绝缘体套管和基板和圆柱体之间的Nylon障碍物中。一定体积的自然水直立于中心杆电极和外圆柱和周向电极之间。包括六个电容器(115nF,±10%20kV DC,model M104A203B000)的电容器组通过两个铜板并联连接,这两个铜板的一条引线连接到地而另一条引线连接到水弧电池的基板。电容器组通过具有1兆欧电阻的连接被高电压功率源(Universal Voltronics,20kV DC,Model 1650R2)充电并且被包括不锈钢电极的大气-空气开关放电。高电压在大约-8kV至-14kV的范围内。接受测试的开放电池中的4ml H2O的示例性参数是大约0.68μF的电容、大约0.3Ω的本征电阻、圆柱电极分别0.5英寸和2.5英寸的内径(ID)和深度、1/4英寸的杆外径(OD)、圆柱电极和1/8”的中心杆之间的距离、大约-8kV至-14kV的充电电压、和大约0.2μs的电路时间常数。通过触发水弧放电,实现用于高速形成分数氢的H2O点燃,其中,弧造成形成原子氢和HOH催化剂,反应形成分数氢,溢出高功率。通过生成将10英寸高的整个H2O内容物超声弹射到实验室中,高功率是明显的,其中,弹射的羽撞击屋顶。
使用带有Parr 6775A数据记录双通道数字热力计和Parr 1108氧燃烧腔室的Parr1341平夹套热量仪执行热量测定,Parr 1108氧燃烧腔室被改造,以允许用高电流启动化学反应。通过密封腔室供给包括1/4”外径(OD)12”铜圆柱体的铜杆点燃电极并且将其连接到弧电池电极。H2O电弧等离子体电池放置在浸没在带有被填充空气的体积的剩余物的内部添加的200g水下的Parr爆炸电池内。热量仪水浴装载有1,800g的自然水(根据Parr手册,总H2O是2,000),并且将爆炸电池浸没在这个水贮存器中。通过高电压探针(校准成在NIST参考探针的0.02%内的CPS HVP-2520252-00-0012)测量并且通过NIST可溯源校准Fluke 45数字多用表显示电容器的充电电压。通过高电压探针(Tektronix 6015)确认并且通过示波器显示用Fluke测量的电容器的充电电压。通过计算水弧电池等离子体的输入能量,其中,C是电容器组的电容并且V是电容器放电之前的电压。通过浸没在水中的热敏探针测量浴的温度。
通过用电阻器(10欧)和DC恒定功率源加热浴来校准热量仪的热容量。还用相同的电阻器和来自电容器组的放电电流来校准热量仪的热容量。
经确定,热量仪的热容量是10300J/K。在本申请人的实验中,输入能量是用于10次放电的大约500J,其中,C=0.68μF和V=-12kV。对应的输出能量是大约800J。
- 还没有人留言评论。精彩留言会获得点赞!