一种斑马鱼类过敏检测模型的建立及其应用的制作方法
本发明涉及一种体内检测模型,具体的说,涉及一种用于简单、快速和高效体内检测类过敏反应的斑马鱼模型构建方法及其应用。
背景技术:
许多临床所使用的药物既不是抗原也不是半抗原,这些药物进入人体内,不经过潜伏期,无抗原与抗体的结合过程,迅速发生与Ⅰ型变态反应相同的临床表现。由于这种反应只发生于极少数接受治疗剂量药物的个体,没有致敏过程,患者血清IgE浓度也未见升高,但表现为典型的速发性变态反应症状,因此Dukor[1]称之为假药物变态反应,或类过敏反应(anaphylactoid reactions)。
迄今为止,关于类过敏反应的认识很多是从临床病例中得到的,由于临床应用的新药不断增多、临床中用药复杂化、不适当的药物混合等原因,类过敏反应有增多趋势。最新调查研究表明77%的急性过敏反应为类过敏反应,类过敏反应发生率远高于Ⅰ型变态反应。目前,对类过敏反应在过敏反应中的定位仍未明确,但研究者们趋向于认为它和Ⅰ型变态反应为急性过敏反应的两个亚类[2]。
动物实验和体外实验研究在阐明类过敏反应的发生机制、建立检测类过敏反应的试验方法用于注射剂的安全性评价上具有重要意义,但是由于类过敏反应发病快、病情急、病程转归迅速,迄今未见有成熟的动物模型,体外试验的检测指标和方法也有待于进一步优化。因此,建立一种高效、快速的体内类过敏检测模型具有重要意义。
斑马鱼是一种新颖的模式生物。与传统的体内和体外筛选模型相比较,活体斑马鱼筛选模型具有诸多优势,克服了原有体外模型在吸收、分布、代谢和排泄环节验证的欠缺及传统体内筛选模型实验周期长、操作复杂、成本高的弊端。斑马鱼是一种脊椎动物,与人类基因的相似度高达85%左右,实验结果可比性强。与鼠类等哺乳动物相比,斑马鱼胚胎透明,可同时观察分析多个器官,实验周期短,样本容量大,结果可信度高,所需费用低[3]。更重要的是,斑马鱼模型具有与生俱来的优点[3-4]:①饲养成本低,性成熟周期短;②繁殖能力强,一尾雌鱼每次可产200~300枚卵;③生长发育速度快,在受精24h后,斑马鱼主要的组织器官原基已形成,可为研究提供大量的样本和较短的实验周期;④胚胎及幼鱼透明,体外受精,体外发育,可直接观察,并可同时分析多个器官系统;⑤胚胎有可以提供营养的卵黄,第一周内不需喂食,可避免化合物处理时化合物与食物成份的相互作用;⑥胚胎体积小,幼鱼体长只有1-4 mm,能够在一个标准的6、12、24、48或96孔板内进行分析;⑦给药方式简单:溶于水的小分子物质可直接经皮肤、鳃及消化系统进入斑马鱼体内;不溶于水的物质、大分子物质及蛋白质可进行显微注射。因此斑马鱼可作为很好的疾病模型研究材料。
肥大细胞是类过敏反应的主要效应细胞,激活的肥大细胞数量与过敏程度相关,激活的肥大细胞越多,过敏程度越严重。类胰蛋白酶(Tryptase)是肥大细胞内预先合成的中性蛋白酶,是含量最多的介质,经肥大细胞脱颗粒释放到细胞外,其在肥大细胞中的储存和表达有高度的选择性,可作为肥大细胞的激活和脱颗粒的标志。Tryptase通常只少量地分泌到体液中,当过敏引起肥大细胞脱颗粒时大量进入体液。类胰蛋白酶的急性过敏反应阳性反应和阴性反应的预测准确率分别为92.6%和54.3%,而且Tryptase的半衰期为2小时,因此,Tryptase的表达水平常作为类过敏反应的检测标志物之一[5]。
斑马鱼的肥大细胞,其结构与功能与哺乳类动物相似,参与机体的免疫反应和过敏反应[6]。N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(BAPNA)是Tryptase特异性底物,可以检测斑马鱼体内的Tryptase表达水平[6]。检测某物质诱导斑马鱼体内24小时内的Tryptase表达水平,可以定量分析此物质的致敏性。
本发明提供的斑马鱼类过敏检测模型的有利于高效、快速检测注射剂(包括辅料)的致敏性,对注射剂(包括辅料)的安全性评价有重要意义。与以往的模型相比,本发明具有如下优点:
1)活体内—实验材料为活体斑马鱼,作为一种脊椎动物,其筛选模型属体内模型,能够真实反映药物在体内的吸收、分布、代谢与排泄,真正反映药物的整体生物活性。
2)高通量—斑马鱼幼鱼很小,只有1-4毫米,能够在一个标准的6,12,24,48,96或384孔板内进行分析和实验周期短使斑马鱼成为一种能进行高通量自动化体内药物致敏性评价的理想模型。
3)经济—所需费用低,以犬为实验载体的筛选实验每只每天耗费大于10美元,以豚鼠为实验载体的筛选实验每只每天耗费大于1美元,而以斑马鱼为实验载体的筛选实验每只每天耗费小于0.01美元。
4)化合物用量少—检测化合物用量少,通常只需几毫克,而传统的筛选实验则需几毫克以上的化合物。
5)简便—实验过程操作简单,斑马鱼经药物处理可进行定量分析此药物的致敏性,而传统动物实验操作过程复杂,判断指标主观,容易产生假阳性结果。
6)快速—实验周期短,可在1天内完成;而豚鼠常需要数周到数月的时间,犬常需要数月至数年的时间。斑马鱼在第一个72小时以内完成胚胎发育。多数的内部器官,包括心血管系统、肠、肝脏和肾,在24-48小时内快速成型,传统的实验载体老鼠和猴子则分别需要21天和9个月方可完成胚胎发育。
7)可靠的预测性—斑马鱼的基因与人类基因的相似度高达85%左右,其生物学功能与哺乳动物及人类高度相似,实验结果可比性强,预测性好。
8)敏感性高—N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(BAPNA)是Tryptase特异性底物,可以快速检测斑马鱼体内的Tryptase表达水平。
9)稳定性高、重复性好—本发明重复实验十几次,所获实验结果基本相同。
本发明应用价值
应用活体斑马鱼模型进行注射剂(包括辅料)的致敏性评价具有可靠、快速、高效、低廉、高性价比等优点,可实现体内高通量评价注射剂(包括辅料)的致敏性。本发明对注射剂(包括辅料)的安全性评价有重要意义。
试剂及仪器
N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(BAPNA)(911-77-3,阿拉丁);Compound 48/80(C48/80)(120M4040V,SIGMA);Tween-80(#20080616,中国食品药品检定研究院包装材料与药用辅料检定所);乳糖蛋白A和乳糖蛋白B(中国食品药品检定研究院包装材料与药用辅料检定所);其他试剂均由北京鼎国昌盛科技有限公司提供。
多功能微孔板分析仪(Mithras LB940,Berthold Technologies)、96孔板(Nest Biotech)。
技术实现要素:
本发明的目的在于提供一种斑马鱼类过敏检测模型的建立方法,同时提供一种利用该模型评价注射剂(包括辅料)致敏性方法。本发明提供的方法具有简便、快速、经济、高效、高通量等优点。
内容一:本发明提供一种斑马鱼类过敏检测模型的建立方法,设计方案为:
1 斑马鱼选取
取4~5对斑马鱼亲本交配,按照Westerfield[7]的方法孵化胚胎。将处于最佳处理阶段的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼移入96孔微孔板中。
2 斑马鱼类过敏检测模型建立条件的确定
(1)Tryptase检测底物BAPNA的反应浓度的确定。
(2)斑马鱼的发育阶段的确定。
(3)检测用斑马鱼数量的确定。
(4)阳性对照化合物Compoud48/80的浓度的确定。
本发明的实施例一中,对上述的建模条件进行确定。其中,BAPNA的反应浓度确定为30 mg/ml,斑马鱼的发育阶段为3 dpf,检测用斑马鱼数量为2尾,C48/80浓度为100 μg/ml。
内容二:本发明提供一种利用斑马鱼类过敏检测模型评价溶解给药的注射剂(包括辅料)的致敏性,设计方案为:
1 斑马鱼选取
取4~5对斑马鱼亲本交配,按照Westerfield[7]的方法孵化胚胎。将处于最佳处理阶段的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼移入96孔微孔板中。
2注射剂处理
注射剂设计3个检测浓度,分别为1、10和100 μg/ml,或者为0.01‰、0.1‰和1‰;以BAPNA处理的斑马鱼作为溶剂对照组,以BAPNA处理含有100 μg/ml C48/80的斑马鱼作为阳性对照组;实验在96孔板中进行,每孔2尾斑马鱼,100 μl反应液,每个实验组处理6个孔,均含有30 mg/ml的BAPNA。
3 酶标仪分析:
各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各实验组的吸光值(OD405值)。Tryptase表达水平公式如下:
统计学处理结果以±SE表示,多组间比较采用方差分析(ANOVA),以溶剂对照组作为标准,比较各实验组Tryptase的表达水平,确定此批次Tween-80的致敏性。
内容三:本发明提供一种利用斑马鱼类过敏检测模型评价血管注射给药的注射剂的致敏性,设计方案为:
1 斑马鱼选取
取4~5对斑马鱼亲本交配,按照Westerfield[7]的方法孵化胚胎。将处于最佳处理阶段的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼移入96孔微孔板中。
2注射剂处理
注射剂以超纯水或DMSO配制成浓度10 mg/ml作为样品检测组, 超纯水配制浓度为10 mg/ml的C 48/80作为阳性对照组,超纯水或DMSO作为溶剂对照组。各实验组进行斑马鱼血管显微注射,每尾斑马鱼注射10 nl(相当于0.1 μg/尾)。注射完成后,将斑马鱼转移到96孔板中,每孔2尾斑马鱼,100 μl反应液(30 mg/ml BAPNA),每个实验组处理6个孔。
3 酶标仪分析:
各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各实验组的吸光值(OD405值)。Tryptase表达水平公式如下:
统计学处理结果以±SE表示,多组间比较采用方差分析(ANOVA),以溶剂对照组作为标准,比较各实验组Tryptase的表达水平,确定注射剂的致敏性。
附图说明
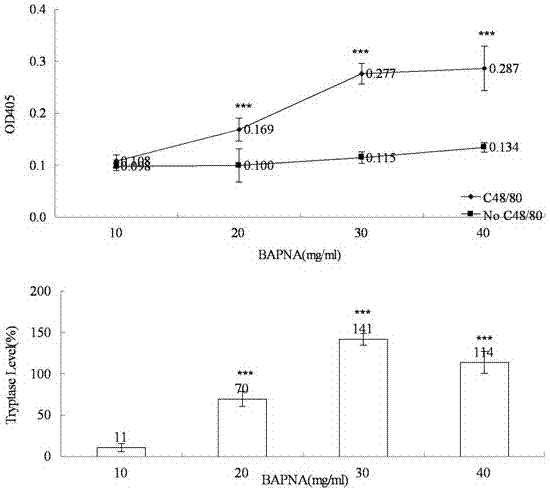
图1、Tryptase检测底物BAPNA的反应浓度的确定
图2、斑马鱼的发育阶段的确定
图3、检测用斑马鱼数量的确定
图4、阳性对照化合物Compoud48/80的浓度的确定
图5、#20080709 Tween-80诱导的斑马鱼类过敏反应
图6、#20091019 Tween-80诱导的斑马鱼类过敏反应
图7、氯乙醇诱导的斑马鱼类过敏反应
图8、乙二醇诱导的斑马鱼类过敏反应
图9、双氧水(H2O2)诱导的斑马鱼类过敏反应
图10、乳糖蛋白A和乳糖蛋白B诱导的斑马鱼类过敏反应
具体实施方式
以下实施例为进一步说明本发明提供的斑马鱼类过敏检测模型的建立方法及用途。实施是为了解释而不是以任何方式限制本发明的范围,本领域技术人员在权力要求的范围内所作的某些改变和调整也应认为属于本发明的范围。
实施例一、斑马鱼类过敏检测模型的建立
1 斑马鱼选取
取4~5对斑马鱼亲本交配,按照Westerfield[7]的方法孵化胚胎。将处于最佳处理阶段的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼移入96孔微孔板中。
2 斑马鱼类过敏检测模型建立条件的确定。
(1)Tryptase检测底物BAPNA的反应浓度的确定。
BAPNA是Tryptase的特异性底物,使用10、20、30和40 mg/ml的BAPNA分别处理含有100 μg/ml C48/80的3 dpf斑马鱼,对照组BAPNA处理不含C48/80的3 dpf斑马鱼。实验在96孔板中进行,每孔2尾斑马鱼,100 μl反应液,每个浓度处理6个孔;各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各组的OD405值。统计学处理结果以±SE表示,多组间比较采用方差分析(ANOVA),通过比较不同浓度BAPNA的OD405值,确定BAPNA的最佳检测浓度。
结果显示,BAPNA浓度为10 mg/ml时,加C48/80组与不加C48/80组的OD405值相比,没有有显著性差异(p>0.05);BAPNA浓度为20、30和40 mg/ml时,加C48/80组与不加C48/80组的OD405值相比,均有显著性差异(p<0.001);说明斑马鱼的Tryptase能够被C48/80诱导表达,并且能被BAPNA检测出来。BAPNA的浓度在10-40 mg/ml的范围内,检测出的Tryptase表达水平呈浓度相关性;浓度为30 mg/ml时,检测的OD405较高,而且检测的Tryptase表达水平达到141%,信噪比为2.4,符合检测的灵敏度要求,所以选择30 mg/ml作为检测斑马鱼体内Tryptase的BAPNA反应浓度(图1)
(2)斑马鱼的发育阶段的确定。
以30 mg/ml的BAPNA分别处理1、2、3、4、5和6 dpf的斑马鱼,对照组为不含斑马鱼的反应液;实验在96孔板中进行,每孔2尾斑马鱼,100 μl反应液,每个实验组处理6个孔;各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各组的OD405值。统计学处理结果以±SE表示,多组间比较采用方差分析(ANOVA),通过比较不同阶段的斑马鱼表达Tryptase的量,确定类过敏检测实验最佳阶段的斑马鱼。
结果显示,不同阶段斑马鱼本底表达Tryptase的量不同,在1-6 dpf阶段的斑马鱼表达的Tryptase的量呈线性增加(R2=0.9757)。1dpf组与溶剂组的OD405值相比没有显著性差异(p>0.05),而且Tryptase的表达水平为6%,则认为1 dpf的斑马鱼几乎不表达Tryptase;2 dpf组Tryptase的表达水平为26%,说明2 dpf的斑马鱼开始本底表达Tryptase,但与溶剂组的OD405值相比没有显著性差异(p>0.05),不适合作为类过敏检测模型;3-6 dpf组与溶剂组相比均有显著性差异(p<0.01,p<0.001),3 dpf的斑马鱼本底Tryptase表达水平达40%,说明3 dpf的斑马鱼肥大细胞的活性满足类致敏性试验的要求,所以选择3 dpf的斑马鱼作为类过敏检测模型的斑马鱼(图2)。
(3)检测用斑马鱼数量的确定。
以30 mg/ml的BAPNA分别处理1、2和4尾3 dpf的斑马鱼,对照组为不含斑马鱼的反应液;实验在96孔板中进行,每孔 100 μl反应液,每个实验组处理6个孔;各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各组的OD405值。统计学处理结果以±SE表示,多组间比较采用方差分析(ANOVA),通过比较不同数量的斑马表达Tryptase的量,确定类过敏检测实验最佳的斑马鱼数量。
结果显示,不同数量的斑马鱼表达的Tryptase的量不同,在1-4尾的范围内OD405值呈线性增加(R2=0.9763),斑马鱼的数量与表达Tryptase的量呈线性相关,说明每尾斑马鱼本底表达Tryptase的量相当;1尾实验组的OD405值与溶剂对照组相比没有显著性差异(p>0.05),故1尾斑马鱼不适合作为类过敏检测模型的斑马鱼实验数量。2尾与4尾实验组的OD405值与溶剂对照组相比均有显著性差异(p<0.001),为了节省斑马鱼的使用和实验操作上的方便,选择2尾斑马鱼作为类过敏检测模型的斑马鱼实验数量(图3)。
(4)阳性对照化合物Compoud48/80浓度的确定。
以30 mg/ml的BAPNA分别处理含有1、10和100 μg/ml C48/80的3 dpf斑马鱼,对照组为BAPNA处理不含C48/80的斑马鱼;实验在96孔板中进行,每孔2尾斑马鱼,100 μl反应液,每个浓度的C48/80处理6个孔;各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各组的OD405值。统计学处理结果以±SE表示,多组间比较采用方差分析(ANOVA),通过比较不同浓度C48/80处理的斑马鱼表达Tryptase的量,确定类过敏检测实验阳性对照化合物C48/80的最佳浓度。
结果显示,C48/80在浓度为1-100 μg/ml的范围内,诱导斑马鱼表达的Tryptase的量呈现浓度依赖性。浓度为1和10 μg/ml时,C48/80诱导的斑马鱼表达Tryptase的量与溶剂对照组相比没有显著性差异(p>0.05),浓度为100 μg/ml时,C48/80诱导的斑马鱼表达Tryptase的量与溶剂对照组相比有显著性差异(p<0.001),所以选择100 μg/ml作为斑马鱼类过敏检测模型的阳性对照C48/80的反应浓度(图4)。
综上所述,以30 mg/ml的BAPNA作为检测底物,100 μg/ml C48/80作为阳性对照,处理3 dpf的斑马鱼24小时,检测OD405的值,可以建立斑马鱼类过敏检测模型。
实施例二、斑马鱼类过敏检测模型评价不同批次Tween-80的致敏性。
1 斑马鱼选取
取4~5对斑马鱼亲本交配,按照Westerfield[7]的方法孵化胚胎。将处于最佳处理阶段的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼移入96孔微孔板中。
2 Tween-80处理
Tween-80(#20080709和#20091019)由中国食品药品检定研究院包装材料与药用辅料检定所提供。Tween-80以ddH2O配制成100 mg/ml作为母液,每个批次的Tween-80设计3个检测浓度,分别为1、10和100 μg/ml;以BAPNA处理的斑马鱼作为溶剂对照组,以BAPNA处理含有100 μg/ml C48/80的斑马鱼作为阳性对照组;实验在96孔板中进行,每孔2尾斑马鱼,100 μl反应液,每个实验组处理6个孔,均含有30 mg/ml的BAPNA。
3 酶标仪分析:
各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各实验组的吸光值(OD405值)。Tryptase表达水平公式如下:
统计学处理结果以±SE表示,多组间比较采用方差分析(ANOVA),以溶剂对照组作为标准,比较各实验组Tryptase的表达水平,确定此批次Tween-80的致敏性。
根据结果,#20080709 Tween-80在浓度为1、10和100 μg/ml时,诱导Tryptase的表达水平分别为-3%、4%和47%,与溶剂组相比,只有浓度为100 μg/ml时有显著性差异(p<0.01)(图5)。#20091019 Tween-80在浓度为1、10和100 μg/ml时,诱导Tryptase的表达水平分别为0%、1%和18%,与溶剂组相比均没有显著性差异(p>0.05)(图6)。所以,#20080709可以诱导类过敏反应,#20091019不能诱导类过敏反应。
实施例三、斑马鱼类过敏检测模型评价Tween-80部分杂质的致敏性。
1 斑马鱼选取
取4~5对斑马鱼亲本交配,按照Westerfield[7]的方法孵化胚胎。将处于最佳处理阶段的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼移入96孔微孔板中。
2 Tween-80的杂质处理
Tween-80的杂质氯乙醇、乙二醇和30% H2O2由中国食品药品检定研究院包装材料与药用辅料检定所提供。各杂质设计3个检测浓度,分别为0.01‰、0.1‰和1‰;以BAPNA处理的斑马鱼作为溶剂对照组,以BAPNA处理含有100 μg/ml C48/80的斑马鱼作为阳性对照组;实验在96孔板中进行,每孔2尾斑马鱼,100 μl反应液(30 mg/ml BAPNA),每个实验组处理6个孔。
3 酶标仪分析:
各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各实验组的吸光值(OD405值)。Tryptase表达水平公式如下:
统计学处理结果以±SE表示,多组间比较采用方差分析(ANOVA),以溶剂对照组作为标准,比较各实验组Tryptase的表达水平,确定Tween-80杂质的致敏性。
根据结果,氯乙醇在浓度为0.01‰、0.1‰和1‰时,诱导Tryptase的表达水平分别为-4%、1%和5%,与溶剂组相比均没有显著性差异(p>0.05)(图7)。乙二醇在浓度为0.01‰、0.1‰和1‰时,诱导Tryptase的表达水平分别为-19%、-12%和-12%,与溶剂组相比均没有显著性差异(p>0.05)(图8)。H2O2在浓度为0.003和0.03‰时,诱导Tryptase的表达水平分别为-16%和-14%,与溶剂组相比均没有显著性差异(p>0.05)。浓度为0. 3‰时诱导Tryptase的表达水平为23%,与溶剂组相比均有显著性差异(p<0.01)。H2O2的致敏性有浓度依赖性,浓度越高,致敏性越强(图9)。综上所述,吐温-80的杂质中,氯乙醇和乙二醇的含量与吐温-80的致敏性无关;H2O2的含量与吐温-80的致敏性相关,H2O2的含量越高,吐温-80的致敏性越强。
实施例四、斑马鱼类过敏检测模型评价乳糖蛋白A和乳糖蛋白B的致敏性。
1 斑马鱼选取
取4~5对斑马鱼亲本交配,按照Westerfield[7]的方法孵化胚胎。将处于最佳处理阶段的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼移入96孔微孔板中。
2乳糖蛋白A和乳糖蛋白B处理
乳糖蛋白A和乳糖蛋白B用超纯水配制成浓度10 mg/ml作为样品检测组, 超纯水配制浓度为10 mg/ml的C 48/80作为阳性对照组,超纯水作为溶剂对照组。各实验组进行斑马鱼血管显微注射,每尾斑马鱼注射10 nl(相当于0.1 μg/尾)。注射完成后,将斑马鱼转移到96孔板中,每孔2尾斑马鱼,100 μl反应液(30 mg/ml BAPNA),每个实验组处理6个孔。
3 酶标仪分析:
各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各实验组的吸光值(OD405值)。Tryptase表达水平公式如下:
统计学处理结果以±SE表示,多组间比较采用方差分析(ANOVA),以溶剂对照组作为标准,比较各实验组Tryptase的表达水平,确定乳糖蛋白A和乳糖蛋白B致敏性。
结果显示,血管注射0.1 μg的C 48/80诱导斑马鱼产生Tryptase的表达水平为48 %,与溶剂组相比有统计学意义(p<0.01),C 48/80能诱导类过敏反应。血管注射0.1 μg的乳糖蛋白A和乳糖蛋白B诱导斑马鱼产生Tryptase的表达水平分别为11 %和1%,与溶剂组相比没有统计学意义(p>0.05),乳糖蛋白A和乳糖蛋白B均不能诱导类过敏反应(图10)。
参考文献:
[1] Dukor P, Kallos P,Schlumberger HD, et al.Pseudo-allergic reaction. Genetic Aspects and Anaphylactic Reactions. Basel:Karger,1980. [2] Szebeni J.Complement activation-related pseudoallergy: a new class of drug-induced acute immune toxicity.Toxicology,2005,216(2-3):106-121.
[3]McGrath P, Li CQ. Zebrafish: a predictive model for assessing drug-induced toxicity[J]. Drug Discover Today, 2008, 13(9): 394-401.
[4]殷梧,邹苏琪,王光辉,等.模式动物斑马鱼在神经系统疾病研究中的应用[J].生命科学,2008,20(5):773-777.
[5]William A. Anaesth Intensive Care, 2007, 8(9): 358-360.
[6]Dobson, J.T., Seibert, J., Teh, E.M., Da’as, S., Fraser, R.B., Paw, B.H., Lin, T.J., Berman, J.N.,2008. Carboxypeptidase A5 identifies a novel mast cell lineage in the zebrafish providing new insight into mast cell fate determination. Blood 112, 2969–2972.
[7] Westerfield M.. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish. Eugene, Oregon: The University of Oregon Press, 1993.。
- 还没有人留言评论。精彩留言会获得点赞!