用于供体肺的离体机器灌注的器官护理溶液的制作方法
相关申请的交叉引用
本申请根据美国法典第35篇第119条(e)款要求于2011年4月14日提交的名称为“ORGAN CARE SOLUTION FOR EX-VIVO MACHINE PERFUSION OF DONOR LUNGS”的临时申请美国序列号61/475,524的权益,所述申请的全部主题以引用的方式并入本文。本申请还以引用的方式并入于2008年4月8日提交的名称为“SYSTEMS AND METHODS FOR EX VIVO LUNG CARE”的美国申请序列号12/099,715的全部内容。
技术领域
本公开总体上涉及一种用于离体器官护理的灌注溶液。更具体地说,本公开涉及一种用于在生理或接近生理条件下在器官护理系统(“OCS”)上机器灌注供体肺的溶液。
背景
当前器官保存技术通常涉及器官在化学灌注溶液中的低温储存。在肺的情况下,肺通常用冷保存溶液如PerfadexTM进行冲洗并且然后浸没在所述相同冷溶液中直到它被移植。这些技术利用多种冷保存溶液,所述保存溶液都不足以保护肺免于局部缺血所导致的组织损伤。当意图将器官如肺从供体移植到受体中时,所述损伤是特别不希望的。
使用常规方法,组织损伤根据离体维持器官的时间长度增加。例如,在肺的情况下,通常肺可以在它变得不可用于移植之前离体保存仅约6至约8小时。因此,可以从给定供体部位到达的受体的数量受限制,从而限制用于收获的肺的受体库。复合冷局部缺血的作用,当前冷保存技术排除评价和评估离体器官的能力。因为这一点,不是最佳的器官可能被移植,从而导致移植后器官功能障碍或其它损伤,或可复苏的器官可能被停止。
长期的和可靠的离体器官护理还将提供器官移植的上下文之外的益处。例如,患者的身体作为整体通常可以忍受比许多特定器官更低水平的化学、生物以及放射治疗。离体器官护理系统将允许从身体摘除器官并且对所述器官进行隔离治疗,从而降低对身体的其它部分造成损伤的风险。因此,需要发展不要求器官的低温储存并且延长器官可以以健康状态离体保存的时间的技术和灌注溶液。所述技术将改善移植结果并且扩大潜在供体和受体库。
概述
本公开提供涉及离体器官护理的改进的方法、溶液、以及系统。一般来说,一方面,本公开的特征在于一种用于在接近生理条件下在OCS上机器灌注供体肺的肺OCS溶液。另一方面,本公开包括一种用于在接近生理条件下以功能和存活的状态维持方式离体灌注一个或多个肺持续延长的一段时间的系统和方法。另一方面,本公开包括一种用于产生用以在接近生理条件下离体灌注供体肺的溶液的方法。
本公开描述一种可以用于在OCS上机器灌注供体肺的OCS肺灌注溶液。所述溶液可以包含用于减少水肿并且提供对所述肺的内皮支持的富含能量的灌注营养物、以及治疗剂、血管舒张剂、内皮稳定剂、和/或防腐剂的供给。在优选实施方案中,所述溶液包含:葡聚糖40;氯化钠;氯化钾;无水硫酸镁;无水磷酸氢二钠;磷酸二氢钾;一水合葡萄糖;米力农(milrinone);硝化甘油;胰岛素;多维生素(M.V.I.或等效物);碳酸氢钠;甲基强的松龙(methylprednisolone)(或等效物);头孢唑林(cefazolin);环丙沙星(Ciprofloxacin);伏立康唑(voriconazole)。所述溶液与全血或压积的红血细胞进行混合以便形成OCS肺灌注溶液。所述溶液提供用于在接近生理条件下离体维持功能(例如,在呼吸下)和存活肺的组分。
根据某些实施方案,选择并且分配具有特定溶质和浓度的溶液以便提供用于器官在生理或接近生理条件下起作用。例如,所述条件包括在或接近生理温度下维持器官功能和/或以允许正常细胞代谢(如蛋白质合成)的状态保存器官以及增加胶体压力、最小化肺水肿和细胞肿胀。
在另一个实施方案中,特征在于一种灌注肺的方法。所述方法包括:将肺放置在离体灌注环路中;使专门用于在OCS上机器灌注供体肺的OCS肺溶液循环通过所述肺,所述流体通过肺动脉接口进入所述肺并且通过左心房接口离开所述肺;通过使通气气体流动通过气管接口来使肺通气;使灌注溶液脱氧直到达到所述灌注溶液中的氧含量的预定第一值;通过用氧合气体使肺通气来使灌注溶液复氧直到达到所述灌注溶液中的氧含量的预定第二值;以及基于肺的引起所述灌注溶液中的氧含量水平从氧含量的第一值变化为氧含量的第二值所用的时间来测定肺的状况。灌注方式可以是顺序方式或连续方式。
在另一个实施方案中,特征在于一种产生用于在接近生理条件下灌注肺的溶液的方法。所述方法包括将预先称重的原材料包括营养物、胶体、激素、类固醇、缓冲剂以及血管舒张剂与注射用水(“WFI”)进行组合并且在加热下进行混合直到完全溶解,监测所得到的溶液的pH水平,使所述溶液冷却,过滤所冷却的溶液,将所述溶液分配至主容器中并且对所填充的容器进行灭菌。
另一方面,特征在于一种肺护理系统。所述肺系统包括:单次使用一次性模块,其包括被适配来将所述单次使用一次性模块与多次使用模块联接用于与所述多次使用模块机械协作的接口;肺腔室组件,其任选地具有用于允许肺OCS灌注溶液流动至肺中的第一接口、用于允许用通气气体使肺通气的第二接口、以及用于允许所述灌注溶液流动离开肺的第三接口,所述肺腔室组件包括用于携带所述灌注溶液流离开肺的双排放口系统,所述双排放口系统包括用于将一部分灌注溶液流引导至灌注溶液气体含量的传感器的测量排放口,和用于接收灌注溶液流的剩余部分的主排放口;以及专门用于在OCS上机器灌注供体肺的OCS肺灌注溶液。
附图简述
以下图描绘示例性实施方案,其中相同参考号是指相同元件。这些描绘的实施方案可能不是按比例示出的并且被认为是示例性的而不是限制性的。
图1是所描述的实施方案的肺灌注环路的示意图。
图2是根据所描述的实施方案的从前视图从45度角度绘制的器官护理系统的图示。
图3是根据所描述的实施方案的肺灌注模块的图示。
图4是根据所描述的实施方案的肺动脉插管的图示。
图5是根据所描述的实施方案的气管插管的图示。
图6是根据所描述的实施方案的肺腔室的分解图示。
图7是便携式器官护理系统的所描述的实施方案的示意图,包括示出肺灌注模块的气体相关组件。
详述
以下描述和附图充分地说明实施方案以便使本领域技术人员能实践它们。其它实施方案可以并入结构、逻辑、电、方法以及其它变化。实例仅代表可能的变型。除非明确地要求,单独组件和功能是任选的,并且操作的顺序可以改变。一些实施方案的部分和特征可以包括于或被其它的那些替代。实施方案的范围涵盖权利要求的全部范围和那些权利要求的所有可用的等效物。
提供了对于离体器官护理的改进的方法。更具体地说,不同实施方案是针对涉及在离体环境中在或接近正常生理条件下维持肺的改进的方法和溶液。如本文所用,“生理温度”被称为在约25℃与约37℃之间的温度。优选的实施方案包括肺OCS灌注溶液,所述溶液可以结合器官护理系统施用以便通过使灌注溶液循环通过肺血管系统来将肺维持在平衡状态中,同时使肺重新呼吸具有足以满足肺的代谢需求的氧含量的气体。
所述实施方案允许肺离体维持延长的一段时间,例如像,3-24小时或更多个小时。所述延长的离体维持时间扩大了用于供体肺的潜在受体库,从而使供体与受体之间的地理距离不那么重要。延长的离体维持时间还提供供体器官与器官受体之间的更好基因和HLA匹配所需的时间,从而增加有利结果的可能性。在接近生理功能条件下维持器官的能力还允许临床医师离体评价器官的功能并且鉴别受损伤的器官。这在肺的情况下是尤其有价值的,因为肺经常直接或间接因为供体的死亡的原因而受损。因此即使是新收获的肺也可能被损伤。进行收获的器官的迅速评估的能力允许外科医生确定肺的质量并且(如果存在损伤那么)确定问题的性质。外科医生可以然后决定是丢弃肺还是对所述肺施加治疗。治疗可以包括复原过程、去除或缝合肺的损伤区域、抽吸分泌物、烧灼出血血管、以及给予放射治疗。在收获至移植的几个阶段对肺进行评估并且如果需要提供治疗的能力大大地改进肺移植成功的整体可能性并且增加可供用于移植的器官的数量。在一些情况下,改进的评估能力和延长的维持时间有助于医疗操作员对具有微小缺陷的供体器官进行物理修复。还可以提供增加的离体器官维持时间用于从患者摘除器官、离体隔离治疗、并且然后放回至患者的身体中。所述治疗可以包括,但不限于,药物治疗、气体疗法、手术治疗、化学、生物、基因和/或放射疗法。
OCS灌注溶液的综述
根据某些实施方案,通过供应富含能量的营养物、氧气递送、最佳渗透压、pH以及器官代谢,具有某些溶质的肺OCS灌注溶液提供肺在生理或接近生理条件和温度下起作用。所述灌注溶液还可以包括治疗组分以便帮助维持肺并且保护它们免于局部缺血、再灌注损伤以及在灌注过程中的其它不良作用。治疗剂还可以帮助减轻水肿,对肺提供一般内皮组织支持,并且以其它方式提供对肺的防护性或预防性治疗。
所提供的溶质的量说明溶液中相对于其它组分的优选量并且可以按比例以便提供足够量的组合物。
在一个实施方案中,所述溶液可以包含磷酸二酯酶抑制剂。为了改善气体交换并且减少白细胞增多,可以添加腺苷-3′,5′-环单磷酸酯(cAMP)选择性磷酸二酯酶III型(PDE III)抑制剂如米力农、氨吡酮(amrinone)、阿那格雷(anagrelide)、布拉地新(bucladesine)、西洛酰胺(cilostamide)、西洛他唑(cilostazol)、依诺昔酮(enoximone)、KMUP-1、喹齐酮(quazinone)、RPL-554、氰胍佐旦(siguazodan)、曲喹辛(trequinsin)、维司力农(vesnarinone)、扎达维林(zardaverine)。在优选实施方案中,添加米力农。米力农具有后继于改善的钙摄取至肌质网中的血管舒张作用、由于cAMP介导的反式-肌纤维膜钙流的变力性(inotropy)(肌细胞收缩)、以及可能由于改善的肌球蛋白复合物解离的变松性(lusitropy)(肌细胞松弛)。在优选的实施方案中,米力农在每1L溶液中以约3400mcg至约4600的量存在。在特别优选的实施方案中,米力农在每1L溶液中以约4000mcg的量存在。
在某些实施方案中,所述溶液可以包含在氮循环中有用的硝酸盐。硝化甘油是可以添加至灌注溶液以便促进肺血液动力学的稳定并且在移植之后改善动脉氧合作用的硝酸盐。当从身体摘除肺时,一氧化氮水平快速下降,因为它被在再灌注过程中所产生的超氧化物淬灭,从而导致对肺组织的损伤。硝化甘油可以用于通过细胞内S-亚硝基硫醇中间体来促进离体肺中的一氧化氮水平以便直接地刺激鸟苷酸环化酶或释放位于效应细胞中的一氧化氮。为此,硝化甘油通过在移植之后提供更好动脉氧合作用来改进血管内环境稳定并且改进器官功能。在优选实施方案中,硝化甘油在每1L溶液中以约10mg至约50mg的量存在。
在一个其它实施方案中,可以将无水硫酸镁添加至所述溶液。肺动脉血压低于身体的其余部分中的血压并且在肺高血压的情况下,硫酸镁通过调节平滑肌细胞中的钙摄取、结合以及分布促进肺动脉的收缩肌肉中的血管舒张,从而降低平滑肌的去极化的频率并且因此促进血管舒张。无水硫酸镁在每1L溶液中以约0.083g至约0.1127g的量存在。在特别优选的实施方案中,无水硫酸镁在每1L溶液中以约0.098g的量存在。
在优选实施方案中,胶体的添加提供许多益处,包括改善红细胞变形性、防止红细胞聚集(包括已经聚集的细胞的解散)以及保存内皮-上皮膜。胶体还通过能够涂覆内皮表面和血小板而具有抗血栓形成作用。在这个实施方案中,葡聚糖40在每1L溶液中以约42.5g至约57.5g的量存在。在特别优选的实施方案中,葡聚糖40在每1L溶液中以约50g的量存在。
所述溶液还可以包含电解质,如钠、钾、氯化物、硫酸盐、镁以及其它无机和有机带电荷的物质、或其组合。合适的组分可以是其中允许化合价和稳定性、呈离子形式、呈质子化的或未质子化的形式、呈盐或游离碱形式、或作为水解并且使组分可供用于水溶液中的与其它组分组合的离子或共价取代基的那些。在这个实施方案中,氯化钠在每1L溶液中以约6.8g至约9.2g的量存在。在特别优选的实施方案中,氯化钠在每1L溶液中以约8g的量存在。
在优选实施方案中,所述溶液可以具有低钾浓度。低水平的钾导致改进的肺功能。低钾水平还可以在高流量再灌注过程中保护肺并且导致较低的PA压力和PVR、动态气道顺应性的较低百分比减少、以及较低的湿干比。在这个实施方案中,氯化钾在每1L溶液中以约0.34g至约0.46g的量存在。在特别优选的实施方案中,氯化钾在每1L溶液中以约0.4g的量存在。
所述溶液可以包含一种或多种富含能量的组分以便帮助器官进行它的正常生理功能。这些组分可包括为可代谢的富含能量的材料和/或器官可以用于在灌注过程中合成能源的所述材料的组分。富含能量的分子的示例性来源包括,例如,一种或多种碳水化合物。碳水化合物的实例包括一水合葡萄糖、单糖、二糖、低聚糖、多糖、或其组合、或其前体或代谢物。虽然不意味着限制,但是适合用于所述溶液的单糖的实例包括辛糖;庚糖;己糖,如果糖、阿洛糖、阿卓糖、葡萄糖、甘露糖、古洛糖、艾杜糖、半乳糖、以及塔罗糖;戊糖如核糖、阿拉伯糖、木糖、以及来苏糖;丁糖如赤藓糖和苏糖;以及丙糖如甘油醛。在优选实施方案中,一水合葡萄糖在每1L溶液中以约1.7g至约2.3g的量存在。在特别优选的实施方案中,一水合葡萄糖在每1L溶液中以约2g的量存在。
所述溶液可以包含其它组分以便帮助维持器官并且保护它免于局部缺血、再灌注损伤以及在灌注过程中的其它不良作用。在某些示例性实施方案中,这些组分可以包含激素以便促进并且调节碳水化合物和脂肪代谢。胰岛素用于通过促进最优葡萄糖和糖原摄取至细胞中来改进所述细胞功能。在这个优选实施方案中,每1L溶液可以包含约17IU胰岛素至约23IU胰岛素。在特别优选的实施方案中,每1L溶液可以包含约约20IU胰岛素。
此外,所述溶液可以包含提供抗氧化剂和辅酶并且帮助维持身体的正常抵抗力和修复过程的多维生素。多维生素可以包含某些脂溶性维生素如维生素A、D、E、以及K、和水溶性维生素如维生素C、烟酰胺、维生素B2、B1、B6、以及右泛醇、以及稳定剂和防腐剂。在优选实施方案中,每1L溶液包含一单位小瓶的M.V.I.多维生素。M.V.I.包含脂溶性维生素如维生素A、D、E、以及K、和水溶性维生素如维生素C、烟酰胺、维生素B2、B1、B6、以及右泛醇、以及在水溶液中的稳定剂和防腐剂。
所述溶液还可以包含抗炎剂如糖皮质激素类固醇。糖皮质激素类固醇通过激活细胞的糖皮质激素受体用作抗炎剂,所述糖皮质激素受体进而上调细胞核中的抗炎蛋白质的表达并且减少促炎蛋白质的表达。糖皮质激素类固醇包括甲基强的松龙、氢化可的松(hydrocortisone)、醋酸可的松(cortisone acetate)、强的松(prednisone)、地塞米松(dexamethasone)、倍他米松(betamethasone)、曲安西龙(triamcinolone)、倍氯米松(beclometasone)、醋酸氟氢可的松(fludrocortisone acetate)以及醛固酮(aldosterone)。在这个优选实施方案中,每1L溶液可以包含约0.85g mg至约1.15g甲基强的松龙(或等效物)。在特别优选的实施方案中,每1L溶液可以包含约1g甲基强的松龙(或等效物)。
此外,所述溶液可以包含缓冲剂以便将溶液维持在最佳pH下。这些可以包括无水磷酸氢二钠、生理平衡缓冲剂或磷酸二氢钾以便在肺组织灌注过程中维持溶液的平均pH。在这个实施方案中,无水磷酸氢二钠在每1L溶液中以约0.039g至约0.052g的量存在,和/或磷酸二氢钾以约0.053g至约0.072g的量存在。在特别优选的实施方案中,无水磷酸氢二钠是以约0.046g的量存在,和/或磷酸二氢钾以0.063g的量存在。在一些实施方案中,所述溶液包含碳酸氢钠、磷酸钾、或TRIS缓冲剂。在优选实施方案中,碳酸氢钠在每1L溶液中以约12.75mEq至约17.25mEq的量存在。在特别优选的实施方案中,每1L溶液可以初始包含约15mEq碳酸氢钠(每500mL瓶5mEq并且使用2-3个瓶),并且可以基于临床判断在整个保存过程中添加另外量。例如,可以将20-40mEq添加至系统作为引发的部分。
其它合适的缓冲剂包括2-吗啉代乙磺酸一水合物(MES)、卡可基酸(cacodylic acid)、H2CO3/NaHCO3(pKal)、柠檬酸(pKa3)、双(2-羟乙基)-亚氨基-三-(羟甲基)-甲烷(Bis-Tris)、N-氨基甲酰基甲基亚脒基乙酸(ADA)、3-双[三(羟甲基)甲基氨基]丙烷(双-三丙烷)(pKa1)、哌嗪-1,4-双(2-乙磺酸)(PIPES)、N-(2-乙酰胺基)-2-氨基乙磺酸(ACES)、咪唑、N,N-双(2-羟乙基)-2-氨基乙磺酸(BES)、3-(N-吗啉代)丙磺酸(MOPS)、NaH.sub.2PO.sub.4/Na.sub.2HPO.sub.4(pK.sub.a2)、N-三(羟甲基)甲基-2-氨基乙磺酸(TES)、N-(2-羟乙基)-哌嗪-N′-2-乙磺酸(HEPES)、N-(2-羟乙基)哌嗪-N′-(2-羟基丙磺酸)(HEPPSO)、三乙醇胺、N-[三(羟甲基)甲基]甘氨酸(Tricine)、三羟甲基氨基乙烷(Tris)、甘氨酰胺、N,N-双(2-羟乙基)甘氨酸(Bicine)、甘氨酰甘氨酸(pKa2)、N-三(羟甲基)甲基-3-氨基丙磺酸(TAPS)、或其组合。
所述溶液可以包含抗微生物剂或抗真菌剂以便防止感染。这些可以包括提供保护免于革兰氏阴性和革兰氏阳性细菌的细菌和真菌抗微生物剂。合适的抗微生物或抗真菌剂包括头孢唑林、环丙沙星、以及伏立康唑或等效物。在优选实施方案中,头孢唑林在每1L溶液中以约0.85g至约1.15g的量存在,环丙沙星在每1L溶液中以约0.17g至约2.3g的量存在,并且伏立康唑在每1L溶液中以约0.17g至约2.3g的量存在。在特别优选的实施方案中,头孢唑林在每1L溶液中以约1g的量存在,环丙沙星在每1L溶液中以约0.2g的量存在,并且伏立康唑在每1L溶液中以约0.2g的量存在。或者所述溶液可以包含任何有效的抗微生物或抗真菌剂。
所述溶液优选地在生理温度下提供并且在整个灌注和再循环过程中维持在生理温度左右。
在优选的实施方案中,OCS肺灌注溶液包含营养物、胶体、血管舒张剂、激素以及类固醇。
在另一个优选实施方案中,所述溶液包含营养物,包括一水合葡萄糖、氯化钠、氯化钾;多维生素,包括脂溶性和水溶性维生素;胶体,包括葡聚糖40;激素,包括胰岛素;类固醇,包括甲基强的松龙;缓冲剂,包括无水磷酸氢二钠、磷酸二氢钾以及碳酸氢钠;血管舒张剂,包括米力农、硝化甘油以及无水硫酸镁;抗微生物或抗真菌剂,包括头孢唑林、环丙沙星以及伏立康唑。
在另一个优选实施方案中,所述溶液包含有效量的葡聚糖40;氯化钠;氯化钾;无水硫酸镁;无水磷酸氢二钠;磷酸二氢钾;一水合葡萄糖;米力农;硝化甘油;胰岛素;多维生素(M.V.I.或等效物);碳酸氢钠;甲基强的松龙(或等效物);头孢唑林;环丙沙星;伏立康唑。
在OCS肺灌注溶液的优选实施方案中,每1L溶液包含约4000mcg的量的米力农;约10-50mg的量的硝化甘油;约50g的量的葡聚糖40;约8g的量的氯化钠;约0.4g的量的氯化钾;约0.098g的量的无水硫酸镁;约0.046g的量的无水磷酸氢二钠;约0.063g的量的磷酸二氢钾;约2g的量的一水合葡萄糖;约20IU的量的胰岛素;约1单位小瓶的量的多维生素(M.V.I.或等效物);碳酸氢钠以约15mEq的量初始存在;约1g的量的甲基强的松龙。
在OCS肺灌注溶液的特别优选的实施方案中,每1L溶液包含约4000mcg的量的米力农;约10-50mg的量的硝化甘油;约50g的量的葡聚糖40;约8g的量的氯化钠;约0.4g的量的氯化钾;约0.098g的量的无水硫酸镁;约0.046的量的无水磷酸氢二钠;约0.063g的量的磷酸二氢钾;约2g的量的一水合葡萄糖;约20IU的量的胰岛素;约1单位小瓶的量的多维生素(M.V.I.或等效物);碳酸氢钠以约15mEq的量初始存在;约1g的量的甲基强的松龙;约1g的量的头孢唑林;约0.2g的量的环丙沙星;约0.2g的量的伏立康唑。
在某些实施方案中,所述灌注溶液在接近生理温度下维持并且提供至肺。根据一个实施方案,所述灌注溶液采用基于血液制品的灌注溶液以便更准确地模仿正常生理条件。所述灌注溶液可以补充有细胞介质。所述细胞介质可以包含血液制品,如全血或压积的红血细胞;白细胞耗竭/减少的同种异体压积的红血细胞;白细胞和血小板耗竭/减少的供体的全血;和/或人血浆以便实现15-30%的循环血细胞比容。
产生用于在接近生理温度下灌注肺的溶液的方法的综述
另一方面,提供一种产生用于在接近生理温度下灌注肺的溶液的方法。在优选方法中,将预先称重的原材料和WFI添加至不锈钢混合槽中并且在加热下进行混合直到完全溶解。在所述混合过程中监测并且用1M盐酸(HCl)调整所得到的溶液的pH。将溶液冷却并且然后过滤通过0.2μm过滤器并且最终分配至主容器中。将填充的容器最终使用已被证实实现10-6的无菌保证水平的灭菌周期在加热下进行灭菌。在优选的实施方案中的原材料包含营养物、胶体、血管舒张剂、激素以及类固醇用于在接近生理条件下灌注肺。
在另一个优选的实施方案中,所述原材料包含营养物,包括一水合葡萄糖、氯化钠、氯化钾;多维生素,包括M.V.I.或等效物;胶体,包括葡聚糖40;激素,包括胰岛素;类固醇,包括甲基强的松龙;缓冲剂,包括无水磷酸氢二钠、磷酸二氢钾以及碳酸氢钠;血管舒张剂,包括米力农、硝化甘油以及无水硫酸镁;抗微生物或抗真菌剂。
在另一个优选的实施方案中,所述原材料包含葡聚糖40;氯化钠;氯化钾;无水硫酸镁;无水磷酸氢二钠;磷酸二氢钾;一水合葡萄糖;米力农;硝化甘油;胰岛素;多维生素(M.V.I.或等效物);碳酸氢钠;甲基强的松龙(或等效物);抗微生物或抗真菌剂,包括头孢唑林、环丙沙星、以及伏立康唑用于在接近生理条件下灌注肺。
在优选的实施方案中,对于每1L溶液来说,所述原材料包含约4000mcg的量的米力农;约10-50mg的量的硝化甘油;约50g的量的葡聚糖40;约8g的量的氯化钠;约0.4g的量的氯化钾;约0.098g的量的无水硫酸镁;约0.046的量的无水磷酸氢二钠;约0.063g的量的磷酸二氢钾;约2g的量的一水合葡萄糖;约20IU的量的胰岛素;约1单位小瓶的量的多维生素(M.V.I.或等效物);碳酸氢钠以约15mEq的量初始存在;约1g的量的甲基强的松龙;抗微生物或抗真菌剂。
在另一个特别优选的实施方案中,对于每1L溶液来说,所述原材料包含约4000mcg的量的米力农;约10-50mg的量的硝化甘油;约50g的量的葡聚糖40;约8g的量的氯化钠;约0.4g的量的氯化钾;约0.098g的量的无水硫酸镁;约0.046的量的无水磷酸氢二钠;约0.063g的量的磷酸二氢钾;约2g的量的一水合葡萄糖;约20IU的量的胰岛素;约1单位小瓶的量的多维生素(M.V.I.或等效物);碳酸氢钠以约15mEq的量初始存在;约1g的量的甲基强的松龙;约1g的量的头孢唑林;约0.2g的量的环丙沙星;约0.2g的量的伏立康唑。
在从供体切除与在OCS上使用仪器之间用溶液冲洗器官的方法的综述
另一方面,提供一种在从身体切除与在OCS上使用仪器之间用溶液冲洗器官的方法。在这个实施方案中,为了准备用于从供体的胸部手术切除的供体肺并且从所述肺去除所有旧的供体血液,将所述供体肺用溶液使用肺动脉进行顺行冲洗直到所述供体肺的温度是在约0℃至约30℃的范围中。此外,所述溶液可以用于在从供体的胸部手术切除肺之前使用肺静脉逆行冲洗肺以便去除所述供体肺中残留的任何任何血液凝块,并且确保冲洗溶液充分均匀分布至所有肺部段。将肺在顺行和逆行冲洗过程中使用呼吸器进行通气以便允许所述溶液的均匀分布并且增加供体肺肺泡中的氧浓度以便最小化局部缺血/再灌注损伤对供体肺的影响。一旦完成供体肺的顺行和逆行冲洗,所述肺将进行手术去除同时充气以便最小化肺泡的萎陷。一旦供体肺从供体身体完全去除,它准备好用于OCS灌注的下一阶段。
在一个实施方案中,所述溶液包含富含能量的灌注营养物、胶体、激素、缓冲剂、无水硫酸镁、以及硝酸盐。在另一个实施方案中,所述溶液包含葡聚糖40;氯化钠;氯化钾;无水硫酸镁;无水磷酸氢二钠;磷酸二氢钾;一水合葡萄糖;硝化甘油。
在特别优选的实施方案中,每1L用于顺行冲洗的溶液包含约50g的量的葡聚糖40;约8g的量的氯化钠;约0.4g的量的氯化钾;约0.098g的量的无水硫酸镁;约0.046g的量的无水磷酸氢二钠;约0.063g的量的磷酸二氢钾;约2g的量的一水合葡萄糖;约50mg的量的硝化甘油。
在另一个特别优选的实施方案中,每1L用于逆行冲洗的溶液包含约50g的量的葡聚糖40;约8g的量的氯化钠;约0.4g的量的氯化钾;约0.098g的量的无水硫酸镁;约0.046g的量的无水磷酸氢二钠;约0.063g的量的磷酸二氢钾;约2g的量的一水合葡萄糖;约10mg的量的硝化甘油。
使用肺OCS灌注溶液机器灌注的方法的综述
另一方面,提供一种用于供体肺的机器灌注的方法。所述方法包括用OCS肺灌注溶液灌注所述供体肺,所述OCS肺灌注溶液包含:葡聚糖40;氯化钠;氯化钾;无水硫酸镁;无水磷酸氢二钠;磷酸二氢钾;一水合葡萄糖;米力农;硝化甘油;胰岛素;至少两种维生素;碳酸氢钠;甲基强的松龙(或等效物);抗微生物或抗真菌剂。
其它方面,所述方法包括用特别优选的OCS肺灌注溶液灌注所述供体肺,对于1L每溶液,所述OCS肺灌注溶液包含:约4000mcg的量的米力农;约10-50mg的量的硝化甘油;约50g的量的葡聚糖40;约8g的量的氯化钠;约0.4g的量的氯化钾;约0.098g的量的无水硫酸镁;约0.046的量的无水磷酸氢二钠;约0.063g的量的磷酸二氢钾;约2g的量的一水合葡萄糖;约20IU的量的胰岛素;约1单位小瓶的量的多维生素(M.V.I.或等效物);碳酸氢钠以约15mEq的量初始存在;约1g的量的甲基强的松龙;约1g的量的头孢唑林;约0.2g的量的环丙沙星;约0.2g的量的伏立康唑。
肺灌注环路的综述
图1示出可以用于使以上所提到的灌注溶液循环的示例性肺灌注环路。所述环路完全容纳在肺灌注模块内,并且所有它的组件可以是一次性的。器官护理系统(OCS)公开、美国申请序列号12/099,715包括肺灌注环路的示例性实施方案并且以引用的方式整体并入。肺OCS灌注溶液250放置在储器中并且然后在灌注环路内循环,在通过肺404的血管系统之前通过肺灌注模块的多个组件。泵226引起灌注溶液250围绕肺灌注环路流动。它接收来自储器224的灌注溶液250,并且将所述溶液泵送通过顺应腔室228至加热器230。顺应腔室228是用于改进泵226的流动特征性质的管子的柔性部分。加热器230替代在流体的循环过程中通过灌注溶液250损失到环境中的热量。在所描述的实施方案中,所述加热器将灌注溶液250维持在或接近30-37℃的生理温度下,并且优选地在约34-37℃下。用于肺的当前临床模型是37℃。在通过加热器230之后,灌注溶液250流动至气体交换器402中。气体交换器402允许气体经由气体可渗透的中空纤维薄膜在气体与灌注溶液250之间进行交换。然而,所述气体交换器具有约1平方米的有效气体交换表面面积,所述面积是肺的50-100平方米有效交换面积的仅一小部分。因此气体交换器402具有与肺相比仅有限的气体交换能力。血液气体螺线管阀204调节进入气体交换器402中的气体的供给。采样/注射端口236有助于就在灌注溶液250到达肺之前去除样本或注射化学品。灌注溶液然后通过插管的肺动脉232进入肺404.流量探针114测量通过所述系统的灌注流体250的流速。在所描述的实施方案中,流量探针114放置在灌注液管线上,因为它通向肺动脉。压力传感器115测量在灌注流体250进入肺中的点处的肺动脉压。在所描述的实施方案中,灌注溶液250是上述所描述的肺OCS溶液。
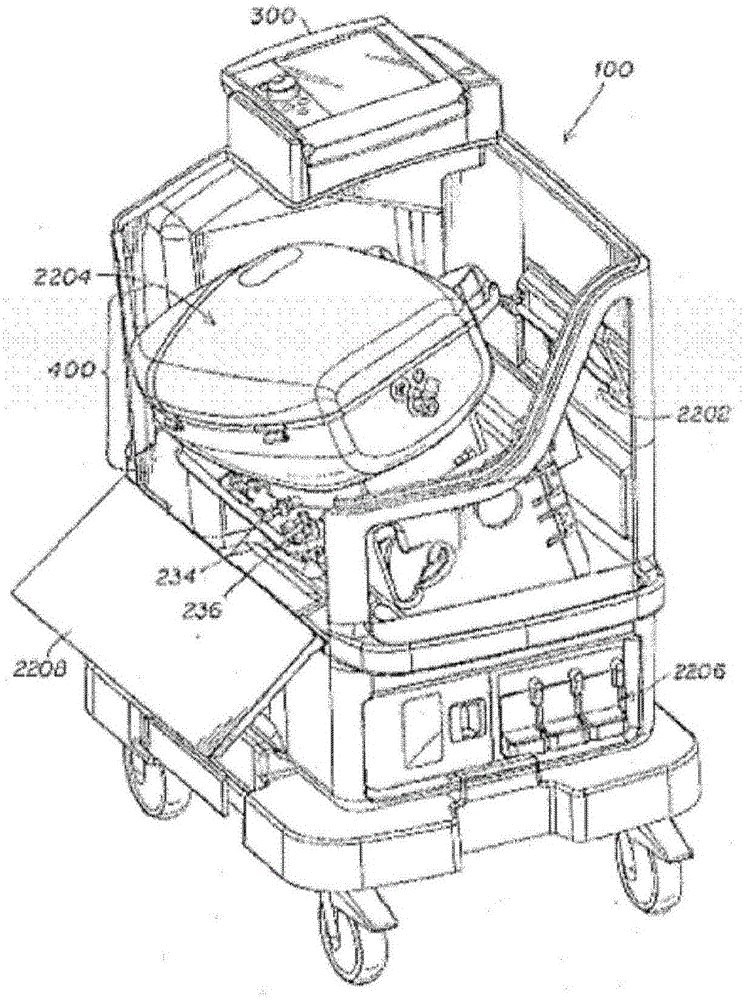
图2是示出在半安装位置中的单次使用一次性肺灌注模块的OCS控制台100的全视图。如在图2中概括性地指示的,单次使用一次性肺灌注模块被设置大小和成形以便安装至OCS控制台100中,并且与它联接。总体上,所述单元具有与美国专利申请号11/788,865中所描述的器官护理系统类似的形式。可去除的肺灌注模块400通过枢转机制可插入至OCS控制台100中,所述枢转机制允许模块400如图2中所示从前端滑动至所述器官控制台模块中,并且然后朝向所述单元的后部枢转。卡环装置2202将肺灌注模块400固定在适当位置中。在替代实施方案中,肺灌注模块400的其它结构和接口用于将所述模块与OCS100联接。当固定在适当位置中时,电和光学连接(未图示)提供功率和OCS控制台100与肺灌注模块400之间的连通。电和光学连接的细节描述于于2005年10月7日提交的美国专利申请序列号11/246,013中,所述申请的规格以引用的方式整体并入本文。肺灌注模块400的关键组件是器官腔室2204,所述器官腔室在以下进行详细描述。电池室2206和维持气瓶220(未图示)位于OCS控制台100的底部。OCS控制台100由可去除的面板保护,如前面板2208。刚好在肺灌注模块下面的是灌注溶液采样端口234和236。安装在OCS控制台100的顶端上的是OCS监测器300。
图3是肺灌注模块400的前视图。器官腔室2204包括可去除的盖2820和壳体2802。采样端口,包括LA采样端口234和PA采样端口236是在器官腔室2802下面可见的。气体交换器402、波纹管418、以及波纹管板2502在图中也是可见的。
最初关于图2所描述的灌注溶液的循环通路,现在就肺灌注模块400的组件而言进行论述。安装在器官腔室2204下面的是灌注溶液储器224,其储存灌注溶液250。灌注溶液通过单向流入阀2306、管线2702、以及泵圆顶2704引出至泵226(未图示)中。灌注溶液被泵送通过灌注溶液管线2404通过顺应腔室228,并且然后至灌注溶液加热器230。在通过加热器230之后,灌注溶液通过连接管线2706至气体交换器402。
肺动脉(PA)插管连接灌注环路与肺404的血管系统。肺动脉(PA)插管的示例性实施方案在图4中示出。参见图4,单个PA插管802具有用于插入至单个PA中的单个插入管804,并且用于在它分支至两个肺之前在一个点处将PA进行插管。为了将所述插管连接至肺动脉,将插入管804插入至所述PA中,并且将所述PA用缝合线固定至所述管上。气管插管700被插入至气管中以便提供肺灌注模块400气体环路与所述肺之间的连接装置。图5示出示例性气管插管。插管700包括气管插入部分704,气管用束线带或通过其它装置固定至所述气管插入部分。所述气管插管可以在仪器检测之前夹持在柔性部分706处以便密封流进和流出肺404的空气。还示出的是任选的锁定螺母708。
灌注溶液通过连接管线2708引出气体交换器402至与肺动脉的接口。通过肺并且经由肺静脉和左心房引出之后,灌注溶液从器官腔室2204的底部排出,如以下所描述。这些排出将灌注溶液进料至储器224,其中循环再次开始。
已经描述了OCS控制台100和肺灌注模块400,现在描述器官腔室2204。图6示出器官腔室2204的组件的分解视图。腔室2204的底部2802被成形并且放置在肺灌注模块400内以便有助于灌注溶液的排放。器官腔室2204具有两个排放口,测量排放口2804和主排放口2806,所述主排放口从所述测量排放口接收溢流。测量排放口2804在约0.5l/分钟的速度下排放灌注溶液,显著小于在1.5l/分钟与4l/分钟之间的通过肺404的灌注溶液250流速。测量排放口通向氧探针118,所述氧探针测量SaO2值,并且然后引导至储器224。主排放口2806直接通向储器224而无氧测量。为所描述的实施方案中的脉冲式量氧计的氧探针118不能获得灌注溶液氧水平的精确测量,除非灌注溶液250基本上不含气泡。为了实现灌注溶液的不含气泡的柱,底部2802被成形以便收集在排放口2804上面收集的从肺404排出至池中的灌注溶液250。所述灌注溶液池允许气泡在灌注溶液进入排放口2804之前消散。在排放口2804上面的池的形成由壁2808促进,所述壁部分地阻塞从测量排放口2804至主排放口2806的灌注溶液的流动直到灌注溶液池足够大至确保来自所述流动的气泡的消散。主排放口2806低于测量排放口2804,因此一旦灌注溶液溢出围绕排放口2804的凹部,它在壁2808周围流动,以便从主排放口2806排出。在双排放系统的替代实施方案中,另一系统用于收集进入供给测量排放口的池中的灌注溶液。在一些实施方案中,来自肺的流量引导至容器,如小杯,所述容器供给测量排放口。所述杯填充有灌注溶液,并且过量血液溢出所述杯并且引导至主排放口并且因此至储器池。在这个实施方案中,所述杯通过形成灌注溶液的小池执行与在以上所描述的实施方案中的壁2808的功能类似的功能,气泡可以在灌注溶液至氧传感器过程中流动至测量排放口中之前从所述小池消散。
肺404由支持表面2810支持。所述表面被设计成支持肺404而无需施加过度压力,同时使肺404略微向下朝向较低凸角倾斜以便促进灌注溶液的容易排放。支持表面包括排放通道2812以收集并且引导从肺404流出的灌注溶液,并且引导所述灌注溶液朝向排放口2814,所述排放口将灌注溶液直接地供给至血液池用于测量排放口2804。为了对肺提供另外支持,当放置在支持表面2810上时,肺404用聚氨酯包裹物(未示出)进行包裹。所述聚氨酯包裹物固定肺404,帮助将肺保持在生理构型中,并且防止支气管扭结并且限制充气的总体积。所述包裹物提供用于肺的外部与器官腔室2204相接触的光滑表面,从而减少所述腔室对肺404的任何部分施加过度压力(这可能引起不希望的出血)的风险。
图7是包括肺灌注模块的气体相关的组件的便携式器官护理系统的所描述的实施方案的示意图。控制器202通过控制阀、气体选择器开关216、以及呼吸器214来管理维持和评估气体(还被称为“保存”和“监测”气体)的释放,从而实现肺在维持方式中的保存,或肺在评估方式之一中的评估。血液气体螺线管阀204控制流入血液气体交换器402中的气体的量。滴流螺线管阀212控制流入通气环路中的气体的量。气道压力传感器206采样肺404的气道中的压力,如通过隔离膜(未图示)感测。所述隔离膜在申请号12/099,715中由参考号408标记,所述申请已经以引用的方式整体并入。安全阀致动器207是气动控制的,并且控制安全阀(未图示)。所述安全阀在申请号12/099,715中由参考号412标记,所述申请已经以引用的方式整体并入。所述气动控制是通过使阻塞或解除阻塞被控制的空气通路的孔口限流器充气或放气来进行。这种控制方法允许肺控制台模块200中的控制系统与肺灌注模块400中的通气气体环路之间的完全分离。气动控制208控制安全阀207和波纹管阀致动器210。呼吸器214是具有引起波纹管418收缩和膨胀的致动器臂的机械装置,其引起气体吸入和呼出肺404。
使用模型
在以下描述用于在器官护理系统中使用以上所描述的溶液的示例性模型。
制备用于仪器装备的OCS灌注模块400的方法开始于通过由如上述所描述的在接近生理温度下产生用于灌注肺的溶液的方法产生所述溶液。然后将约800ml至约2000ml的OCS肺灌注溶液添加至器官护理系统(OCS)无菌灌注模块400中。然后将所述溶液补充约500ml至约1000ml的细胞介质。所述细胞介质可以包含以下中的一种或组合以便实现在15-30%之间的总循环血细胞比容浓度:白细胞耗竭/减少的类型化同种异体压积的红血细胞(pRBC);白细胞和血小板耗竭/减少的供体的全血;和/或人血浆以便实现15-30%的循环血细胞比容。所述OCS装置操作以便使所述溶液和细胞介质循环并且混合,同时使用内置流体温热器和气体交换器402使所述溶液温热并且氧合。一旦溶液完全混合、加热并且充氧,将根据需要使用碳酸氢钠或其它可供使用的缓冲溶液调整所述溶液的pH。一旦所述溶液的血细胞比容、温度以及pH水平达到可接受的状态,供体肺将在OCS上仪器使用。
一旦所述溶液完全混合,pH被调整至7.35-7.45并且血细胞比容被调整至15-30%,供体肺将在OCS上仪器使用。为了开始使用仪器,首先将OCS泵226的流速设置至适当的流速(其在当前涵盖的实施方案中是约0.05L/分钟)以便确保灌注溶液不会在连接至气管插管700之前引出PA管线233。将肺放置在OCS的器官腔室224中并且将气管插管700连接至OCS气管连接器710并且在段706处松开所述气管插管。然后将具有压力传感器115的PA压力监测管线连接至PA插管802。修整OCS的PA插管802并且准备连接至OCS PA管线连接器231。接着,增加OCS的泵226流量以使得低流量柱的溶液引出PA管线233。在本发明的当前涵盖的实施方案中,所述流速是约0.3至约0.4L/分钟。然后通过将肺PA插管802连接至OCS PA管线连接器231并且逐渐将PA插管802充满灌注溶液来从肺去除任何空气。一旦不含空气的柱的溶液到达PA插管802内部,密封PA插管802与OCS PA管线连接器231之间的连接。
接着,逐渐将OCS流体温热器230温度升高至37℃,并且将灌注溶液温度从约32℃升至约37℃。然后开始逐渐增加泵流量,从而确保肺动脉压(“PAP”)保持在20mmHg以下,知道肺流速达到至少1.5L/分钟的目标流速。当肺达到约30℃至约32℃的温度时,通过将OCS呼吸器214变成“保存”模式来开始OCS通气。用于使用仪器和保存的呼吸器设置在表1中具体指定。
表1-呼吸器设置(使用仪器和保存)
接着,逐渐增加灌注和通气速率持续长达约30分钟直到达到完全充气和灌注并且使通气参数稳定化。一旦OCS上的供体肺的通气参数已经稳定,包裹所述肺以便避免对离体供体肺的过度充气损伤。所述肺还可以在开始通气之前的“暂停保存”过程中进行包裹。在肺在OCS上保存过程中,如表1中所描述的维持通气设置,平均PAP维持在约20mmHg下,并且泵流维持在不小于约1.5L/分钟。监测并且通过另外注射在正常生理范围内调整血糖、电解质以及pH水平。肺氧合功能还有肺顺应性可以使用OCS肺系统进行评估。在一些情况下,希望如上述所描述的对肺提供治疗。可以在OCS装置上离体进行供体肺的纤维支气管镜检查。一旦供体肺在OCS系统上的保存和评估完成,将肺冷却并且从所述OCS系统去除以便被移植到受体中。
供体肺冷却可以通过首先关掉OCS脉动泵226并且在约0℃至约15℃下用约3升灌注溶液冲洗所述供体肺同时在OCS系统上继续通气来实现。一旦所述冲洗完成,气管700和肺动脉802插管可以从OCS断开并且肺将被浸入冷藏溶液中直到它被手术附接至所述受体(移植)。或者,可以在肺在OCS上进行通气时使用热交换器和冷却装置将整个系统循环OCS溶液冷却到0℃至约15℃。一旦实现约0℃至约15℃的目标温度,气管700和肺动脉802插管将从OCS断开并且肺将被浸入冷藏溶液中直到它被手术附接至所述受体(移植)。
所描述的系统可以利用肺OCS灌注溶液的任何实施方案。在优选实施方案中,将所述溶液与红血细胞进行混合并且放置到系统储器中用于在所述系统中使用。
应理解虽然已经结合不同示意性实施方案描述了本发明,但是前述描述意图说明而不限制本发明的范围,本发明的范围由所附权利要求的范围界定。例如,多种系统和/或方法可以基于本公开进行实施并且仍然在本发明的范围内。其它方面、优点、以及修改是在以下权利要求的范围内。本文所引用的所有参考文献以引用的方式整体并入并且成为本申请的一部分。
- 还没有人留言评论。精彩留言会获得点赞!