一种利用RNA干扰防治红火蚁的方法及降低红火蚁抗药性的应用与流程
本发明涉及红火蚁的防治技术,具体涉及一种利用RNA干扰防治红火蚁的方法及降低红火蚁抗药性的应用。
背景技术:
RNA干扰(RNA interference,RNAi)是近年来发现的一种新的基因调控方法(Matzke,2001)。即利用外源或内源的双链RNA(dsRNA)特异性地引起基因表达沉默的现象。它利用RNA序列匹配,专一地识别靶基因,在转录水平、转录后水平或翻译水平抑制靶基因表达,已被广泛用于基因功能研究、疾病治疗和农业应(Waterhouse,2003;Matthew,2004),目前,RNAi技术已被应用于鳞翅目、直翅目、膜翅目(意大利蜜蜂)、同翅目、双翅目瞪昆虫。昆虫RNAi的方法主要有注射、浸泡、喂食、转基因和病毒介导等方法。比较常用的是注射和饲喂两种方法。注射dsRNA到昆虫中以抑制基因表达,这种方法的主要优点是效率高,但也有一些缺点。通过喂食dsRNA操作简单方便,容易实现。通过饲喂dsRNA已在半翅目、鞘翅目和鳞翅目昆虫取得成功(Baum et al.,2007;Mao et al.,2007)。
红火蚁(S.invicta)是最具有入侵性的社会性昆虫,已经被国际上列为最具入侵性和破坏性的百种外来有害生物之一。红火蚁食性复杂、习性凶猛、繁殖迅速、竞争力强,能造成重大经济损失、社会危害和环境影响,红火蚁的杂食性和攻击性使其不仅是一种经济害虫,还威胁到公众健康。化学防治措施仍然是防治红火蚁有效措施,但仍然不能根除红火蚁。而且长期用化学药剂对红火蚁进行控制,会导致意想不到的反弹。
技术实现要素:
为了解决现有技术的不足,本发明利用饲喂dsRNA方法分别干扰红火蚁工蚁CYP6A1-like和CYP4C1-like两个P450基因,并检测红火蚁工蚁对外源化合物的的敏感度和酶活性的变化,进一步明确CYP6A1和CYP4C1的解毒代谢功能。
本发明的技术方案是:一种利用RNA干扰防治红火蚁的方法,向红火蚁饲喂制得的dsRNA。
本发明的进一步改进包括:
向饲喂过dsRNA的红火蚁施用氟虫腈和/或毒死蜱。
所述的dsRNA是dsCYP6A1-like和/或dsCYP4C1-like。
本发明的另一目的在于提供一种制备上述dsRNA的方法,通过dsCYP6A1-like和dsCYP4C1-like的CDs区域来设计合成dsRNA。
本发明还提供了dsCYP6A1-like在降低红火蚁对氟虫腈抗药性中的应用。
附图说明
图1是以dsGFP(288bp),dsCYP6A1-like(376bp)和dsCYP4C1-like(419bp)为靶基因的dsRNA合图。
图2a是RNAi介导的dsCYP6A1-like对CYP6A1-like和CYP4C1-like mRNA的沉默效果检测。
图2b是RNAi介导的dsCYP4C1-like对CYP6A1-like和CYP4C1-like mRNA的沉默效果检测。
图3a是RNAi介导的dsCYP6A1-like对其它P450mRNA的影响检测。
图3b是RNAi介导的dsCYP4C1-like对其它P450mRNA的影响检测。
具体实施方式
下面结合附图对本发明做详细说明。
1 材料与方法
1.1 供试虫源和饲养
供试红火蚁采自广东广州五山。参照Kuriachan等方法,用大塑料桶从田间采回红火蚁蚁群,放置1-2d,待蚁群在桶内建立了新的群落后,将自来水缓慢滴入桶内,令红火蚁从群落中自动上移、浮出。用40目的捞网将蚁群转入盆口涂以爽身粉的塑料盆(7.0L)中,在室内(室温25℃,RH 65%-80%)用人工饲料饲养一周后供试验用。工蚁、兵蚁、有翅雄蚁、有翅雌蚁和蚁后和幼蚁的判断标准参考曾玲等(2005)方法。
1.2 主要试剂
TRIzol Reagent,Platinum SYBR Green qPCR SuperMix-UDG Kit。
La Taq聚合酶,PrimeScript 1st strand cDNA synthesize kit,DNase I(Takara)。
QIAquick PCR产物回收试剂盒。
RNAi试剂盒。
1.3 主要仪器
5417R冷冻离心机,Nanodrop 2000微量紫外分光光度计,Mastercycler Personal PCR仪,mini-sub cell GT型电泳槽,power/PAC 3000型电泳仪,Kodak电泳凝胶成像仪,荧光定量PCR仪ABI 7500System,微量操作系统Nanoliter 2000/B203XVB。
1.4 含T7启动子的模板DNA制备
1.4.1 T7启动子引物设计
根据NCBI报道EST设计特异性引物(Table4-1),采用5’-RACE和3’-RACE技术,克隆获得4条红火蚁P450全长cDNA序列,克隆的红火蚁核苷酸序列和推导的氨基酸序列已经提交GenBank分别命名为CYP6A1(Accession No:KF547037),CYP6A14(Accession No:KF547038),CYP4C1(Accession No:KM006494)(附表1-1),和CYP4G15(Accession No:KM006495)(附表1-2)。CYP6A1的全长cDNA序列2064bp,包含一个1497bp的开放阅读框(ORF),一个238bp的5’非编码区(5’UTR)和一个293bp的带有加尾信号的3’非编码区(3’UTR)。开放阅读框从239个核苷酸开始,终止于第1771个核苷酸,由其推导的氨基酸序列以甲硫氨酸为起始氨基酸,长为499个氨基酸。该基因的氨基酸残基中均含有昆虫P450蛋白的5个保守结构域(Feyereisen,2005),wxxxR(螺旋C,127-131),AGxE/DT(螺旋I,302-307),ExxR(螺旋K,360-383),PxxFxPxRF(PERF,411-419),PFxxGxRxCxG(血红素结合区,434-445),而且这些保守结构域,特别是与分子氧结合的功能活性位点螺旋I和P450蛋白特有的血红素结合区。
CYP6A14的全长cDNA序列有1950bp,包含一个1500bp的开放阅读框(ORF),一个211bp的5’非编码区(5’UTR)和一个176bp的带有加尾信号的3’非编码区(3’UTR)。开放阅读框从212个核苷酸开始,终止于第1774个核苷酸,由其推导的氨基酸序列以甲硫氨酸为起始氨基酸,长为500个氨基酸。该基因的氨基酸残基中均含有昆虫P450蛋白的5个保守结构域(Feyereisen,2005),wxxxR(螺旋C,128-132),AGxE/DT(螺旋I,303-308),ExxR(螺旋K,361-384),PxxFxPxRF(PERF,412-420),PFxxGxRxCxG(血红素结合区,435-446),而且这些保守结构域,特别是与分子氧结合的功能活性位点螺旋I和P450蛋白特有的血红素结合区。该基因还在N端具有由脯氨酸,甘氨酸富集而成的高度疏水性质保守结构域(P/I)PGPx(P/G)xP,而这是微粒体P450基因的代表性特征(Bassett et a1.,1997),预测认为CYP6A1和CYP6A14是一类稳定蛋白家族一员,这些为CYP6A1和CYP6A14蛋白的表达和纯化和植物介导的RNAi研究提供了基础数据。
附表1.红火蚁CYP4C1与CYP4G15碱基和推测氨基酸序列图
1.1 红火蚁CYP4C1碱基和推测氨基酸序列
附表1-11
附表1-11.红火蚁CYP6A1(Accession No:KF547037)核酸和推导的氨基酸序列。方格部分表示昆虫P450蛋白的5个保守域,依次为螺旋C,螺旋I,螺旋K,PDVF和血红素结合域。起始密码子用下划线标出和“*”表示终止密码子。下划线表示跨膜区位置。
1.2 红火蚁CYP4G15碱基和推测氨基酸序列
附表1-22
附表1-22.红火蚁CYP6A14(Accession No:KF547038)核酸和推导的氨基酸序列。方格部分表示昆虫P450蛋白的5个保守域,依次为螺旋C,螺旋I,螺旋K,PDVF和血红素结合域。起始密码子用下划线标出和“*”表示终止密码子。下划线表示跨膜区位置。
得到的两个P450基因CYP6A1-like和CYP4C1-like,利用在线primer3设计引物,引物名称分别为T7CYP6A1-like和T7CYP4C1-like。引物5’端添加T7启动子序列,引物序列尽量避开P450同源基因保守区。
dsRNA的DNA模板扩增引物
合成dsRNA模板的制备
在0.25ml PCR管中建立总体积为50μl的RT-PCR反应体系(USP扩增用):
在0.25ml PCR管中建立总体积为50μl的RT-PCR反应体系(EcR扩增用):
PCR扩增条件:94℃预变性3min后,5个循环:94℃变性30sec,58℃退火40sec,72℃延伸40sec;之后再35个循环:94℃变性30sec,68℃退火40sec,72℃延伸40sec。最后72℃延伸10min。电泳检测确认所扩增条带是否为设计的目的条带,有无特异性扩增。
1.4.4 PCR产物纯化
确认目的条带大小正确,无特异性扩增。采用QIAquick PCR产物回收试剂盒按照说明书纯化PCR产物。获得的DNA作为dsRNA合成的模板。
1.5 dsRNA的制备
1.5.1 洗脱液准备
在2×Wash Solution中加12ml 100%乙醇(化学分析纯),充分混匀,室温贮存。
1.5.2 体外转录反应
冰上溶解含有T7的酶混合溶液,待用;室温溶解10×T7反应缓冲液和4种核苷酸溶液(ATP,CTP,GTP,和UTP),前者置于室温待用,后者则置于冰上待用。
建立20μl的转录反应体系如下:
轻弹使其充分混匀,而后轻微离心。37℃恒温水浴过夜。
1.5.3 核酸酶消化去除模板DNA和ssRNA
冰上操作,建立以下反应体系:
37℃恒温水浴1h。
1.5.4 dsRNA的纯化
按以下体系准备dsRNA结合混合液:
将上述500μl dsRNA混合液吸入一个事先放置在收集管中的Filter Cartridge过滤柱中,以最大速度离心2min。
弃去废液,将Filter Cartridge过滤柱重新置于原来的收集管中。
向Filter Cartridge过滤柱中加入500μl事先配制好的2×Washing Solution,最大速度离心2min。重复4次)。弃去废液,再以最大速度离心10-30sec,干燥柱子。
将Filter Cartridge过滤柱置于一新的收集管中,加入100μl事先煮沸(>95℃)的Nuclease-free Water,最大速度离心2min。重复7次)。
1.5.5 dsRNA质量和浓度检测
Nanodrop 2000检测dsRNA浓度,并取稀释100倍后的dsRNA于1.0%的琼脂糖凝胶电泳检测dsRNA的质量;-80℃保存备用。
1.6 实验设计
1.6.1 红火蚁工蚁饲喂方法
选取大小一致的工蚁饲喂(1.26mg/头)。试虫放置于正常条件下饲养,放置12h后开始饲喂dsRNA,每隔24h重新饲喂。饲喂后,每隔24h取样,通过qTRT-PCR技术检测试虫mRNA表达,检测沉默效率。
表3.RNAi处理设置
注:dsRNA溶液用含0.1%蜂蜜水配制。”--“代表1ml各自dsRNA溶液。
1.6.2 dsRNA处理后试虫对氟虫腈和毒死蜱的敏感度测定
选择大小一致的红火蚁饲喂dsRNA24h后开始毒力测定试验,试虫按表3设置进行敏感度测定。敏感度测定同样采用药膜法,药剂浓度为LC50,氟虫腈LC50为0.05μg/ml(小工蚁)。对照组饲喂dsGFP蜂蜜水溶液,处理组饲喂相应的dsRNA的蜂蜜水溶液,对照组和处理组均用氟虫腈和毒死蜱分别处理。每个处理15头试虫,共三次重复。之后均喂食含0.1%蜂蜜水溶液。试虫每隔24h调查死亡率。运用GraphPad InStat软件对数据进行统计分析(one-wayANOVAand Tukey’s test,P<0.05)。
表4.dsRNA处理后试虫的敏感度测定
注:处理后用含0.1%蜂蜜水溶液喂食。”--“代表15头各自dsRNA处理试虫。
1.7 检测干扰效率
饲喂后每隔24h取样,检测RNAi的沉默效率。样品总RNA提取和cDNA第一链合成方法如下:
总RNA提取和纯化
RNA提取所用的匀浆器、枪头、镊子、离心管、PCR管用1‰DEPC水37℃浸泡处理过夜,高压灭菌干燥后备用;所有试剂以DEPC处理过的ddH2O配制;实验过程中需勤换手套。条件具备的情况下,最好直接购买RNase-Free耗材。。
总RNA提取试剂盒购自Invitrogen公司,据Reagent说明书改进成棉铃虫总RNA提取方法,具体步骤如下:
1)称取组织50-100mg于洗净烘干匀浆器中,加入1ml TRIzol,充分匀浆,室温静置5min,4℃,12,000rpm,离心5min,弃沉淀;
2)加入200μl氯仿/1ml TRIzol,混匀20sec,室温静置5min;4℃,12,000rpm,离心15min;
3)吸取上清液400μl于一新的RNases-Free离心管,加入800μl异丙醇,室温静置片刻(视沉淀量大小而定);4℃,12,000rpm,离心15-20min,弃上清;
4)向沉淀中加入用RNases-Free H2O配制的75%乙醇500μl,颠倒洗涤沉淀,4℃,7,500rpm,离心10min;
5)弃上清,沉淀室温干燥5-10min;
6)加入30-50μl RNase-free H2O;亦可55-60℃水浴,助溶10min;
7)紫外分光光度计检测RNA的浓度和纯度,记录OD 260/280值和RNA浓度值;
8)0.7%琼脂糖,凝胶电泳检测RNA完整性;
RNA样品保存于-80℃备用(用于荧光定量PCR的RNA还需进行DNA的消化)。
cDNA第一链的合成
按TaKaRa公司反转录试剂盒(PrimeScriptTM 1st Strand cDNA Synthesis Kit)说明进行反转录,合成RT-PCR cDNA模板,具体步骤如下:
1)按表4-2,建立总体积为12μl的反转录反应体系。
表4-2.反转录体系(1)
Table 4-2.Reverse transcription system(1)
70℃水浴10min,冰上急冷2min以上,低速离心数秒,使反应混合液聚集管底;
2)按表4-3,向上述反应液中加入以下预混物,建立20μl反应体系。
表4-3.反转录体系(2)
Table 4-3.Reverse transcription system(2)
3)混匀,PCR仪中按下列条件进行反转录反应:
42℃60min;70℃15min;4℃10min。
反应完成后,将反转录产物cDNA置于-20℃中保存备用。
以18S rRNA为内参基因,荧光定量条件和数据分析同第五章。
2结果与分析
2.1 dsRNA的合成
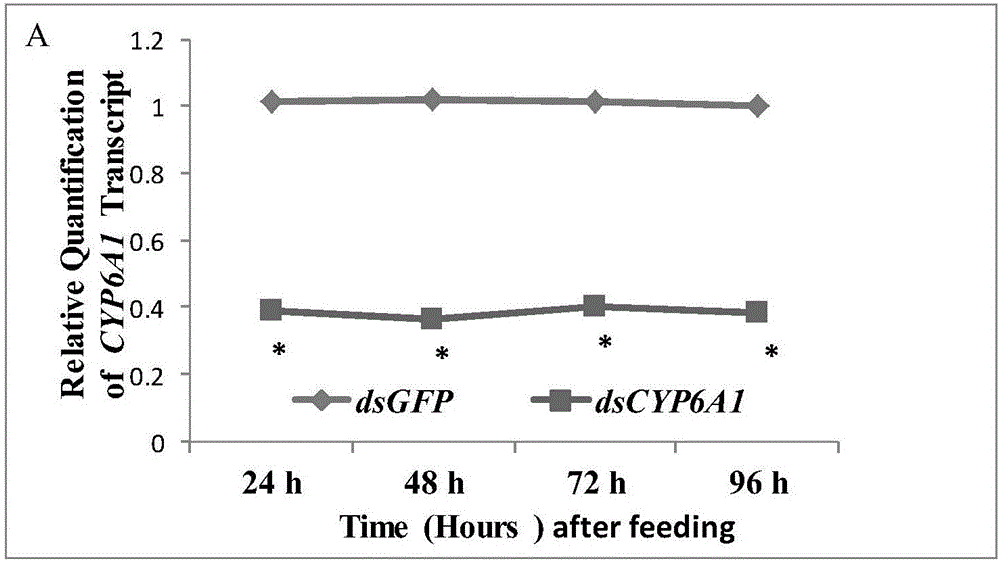
取稀释后的dsRNA合成产物3μl在1.0%的琼脂糖凝胶中进行电泳检测,在预期位置处均出现了一条清晰鲜亮的条带,说明dsRNA与我们设计的大小一致,且质量较好,并没有出现其它非特异性扩增条带(图1)。图1.以dsGFP(288bp),dsCYP6A1-like(376bp)和dsCYP4C1-like(419bp)为靶基因的dsRNA合图。其中:M:DL2000;1:dsGFP(288bp);2:dsCYP6A1-like(376bp);3:dsCYP4C1-like(419bp)
2.2 红火蚁RNAi介导的CYP6A1和CYP4C1mRNA的沉默效果
根据CYP6A1-like和CYP4C1-like的CDs区分别针对CYP6A1-like和CYP4C1-like设计的特异性dsRNA引物,避免同源基因的保守区。按表1设置的浓度,饲喂红火蚁工蚁,每隔24h取样检测mRNA表达量。图2中A和B分别显示饲喂dsRNA后不同时间CYP6A1-like和CYP4C1-like的相对表达量。饲喂dsCYP6A1-like和dsCYP4C1-like 24h后,CYP6A1-like和CYP4C1-like mRNA表达量均显著下降;饲喂dsCYP6A1-like和dsCYP4C1-like 48h后,CYP6A1-like和CYP4C1-like mRNA表达量下降达到最低值,与对照组相比,沉默效率分别达到64.6%和77.1%,随着时间的推移,CYP6A1-like和CYP4C1-like mRNA表达量仍然保持下调水平(图2A,B)。从总体上看,CYP6A1-like和CYP4C1-like的均取得理想的干扰效果而且CYP6A1-like下调水平更为平稳。
图2.RNAi介导的dsCYP6A1-like和dsCYP4C1-like分别对CYP6A1-like和CYP4C1-likemRNA的沉默效果检测。图下方的*表示同一时间段内对照组与处理组差异显著(P<0.05)。注:A:dsCYP6A1-like,B:dsCYP4C1-like.
2.3 RNAi介导的dsCYP6A1-like和dsCYP4C1-like对其它同源P450基因的影响
RNAi介导的dsCYP6A1-like和dsCYP4C1-like分别对CYP6A1-like和CYP4C1-like mRNA的沉默效果较为理想。因此,本文也验证RNAi介导的dsCYP6A1-like和dsCYP4C1-like对其它同源P450基因表达的影响。结果显示,饲喂红火蚁dsCYP6A1-like 36h后,RNAi介导的dsCYP6A1-like处理组对CYP4C1-like、CYP4AB1、CYP4AB2和CYP4G15-like mRNA均没有显著的干扰,分别为对照组(dsGFP)的0.97、1.23、1.24和0.98倍;其中,只有CYP6A14-like有显著性升高,为对照组(dsGFP)的1.27倍(图3.A)。饲喂红火蚁dsCYP4C1-like 36h后,RNAi介导的dsCYP4C1-like处理组对CYP6A1-like、CYP4AB2和CYP4G15-like mRNA均没有显著的干扰,分别为对照组(dsGFP)的1.1、1.1、1.2倍;其中,CYP6A14-like和CYP4AB1和有显著性升高,为对照组(dsGFP)的1.3倍和1.9倍(图3.B)。
图3.RNAi介导的dsCYP6A1-like和dsCYP4C1-like分别对其它P450mRNA的影响检测。
注:不同字母表示同一基因对照组与处理组差异显著(P<0.05)。A:dsCYP6A1-like,B:dsCYP4C1-like。
2.4 饲喂dsCYP6A1-like和dsCYP4C1-like后红火蚁工蚁对氟虫腈敏感度的变化
饲喂红火蚁工蚁dsCYP6A1-like和dsCYP4C1-like后,分别用氟虫腈LC50(0.05μg/ml)处理,检测其对药剂的敏感度。如表5所示,分别饲喂红火蚁工蚁两种dsRNA 12h后,处理组(dsCYP6A1-like)死亡率在12、24、36、48和60h显著高于对照组,分别为对照组(dsGFP)的3.2、3.89、1.65、1.23和1.16倍,其中饲喂24h时,处理组(dsCYP6A1-like)与对照组(dsGFP)死亡率比值达到最高(3.89倍),之后显著降低;而处理组(dsCYP4C1-like)死亡率在12、24、36、48和60h均稍微低于对照组。分别是对照组(dsGFP)的0.6、0.78、0.63、0.83和0.95倍。其中饲喂60h时,处理组与对照组死亡率比值达到最高。
表5.饲喂dsRNACYP6A1和dsCYP4C1后红火蚁工蚁对氟虫腈的毒力测定
注:数据为平均数±标准误,不同小写字母表示同一时间内不同处理差异显著(ANOVA,P<0.05)。括号内为处理组与对照的比值。
2.5 RNAi对红火蚁P450酶活性的影响
采用饲喂dsRNA方式处理红火蚁后,测定细胞色素P450酶活性结果见表6。结果显示,处理组(dsCYP6A1-like)P450活性在12、24、48和72h均低于对照组(dsGFP),分别为对照组(dsGFP)的0.85、0.56、0.33和0.45倍,48-72h达到最低值,之后稍微回升。而处理组(dsCYP4C1)P450酶活性在12、24、48和72h P450酶活性均高于对照组(dsGFP),分别为对照组的1.22、1.50、1.48和1.32倍,48-72h达到最大值,之后稍微降低。
表6 dsRNA处理后的红火蚁工蚁P450O-脱甲基活性
注:表中数值为平均值±标准误,不同小写字母表示同一时间点不同处理差异显著(ANOVA,P<0.05),P450脱甲基活性(μmol p-nitrophenol/mg/30min protein),括号内数值为同一时间点处理组与对照组的比值。
RNA干扰(RNA interference)是近年来迅速发展的一项新兴基因阻断技术。RNA干扰的干扰方法很多,但最常用的是饲喂和注射两种方法。通过喂食的方法实现RNA干扰,是指昆虫肠道细胞吸收体外dsRNA后,对周围的肠道细胞起到干扰沉默的效果即非系统性RNA干扰(environmental RNAi)。饲喂dsRNA与注射的方法相比,喂食的方法不会损害生物体,通过转基因到植物体,使害虫取食转基因植物后抗药性相关基因沉默而死亡。通过喂食的方法在鳞翅目的研究中取到了很大的进展。
本发明通过dsCYP6A1-like和dsCYP4C1-like的CDs区域来设计合成dsRNA,通过饲喂方法测定靶标基因和其它同源P450基因沉默效果,和对外源化合物的敏感度测定,明确红火蚁P450对外源化合物的解毒代谢作用。本发明通过qRT-PCR技术检测沉默效果,结果表明,饲喂dsRNA 24h后,RNAi介导的dsCYP6A-like 1和dsCYP4C1-like分别对CYP6A1-like和CYP4C1-like mRNA的沉默效果显著,与对照组相比,达到沉默效率分别达到64.6和77.1%。RNAi介导的dsCYP6A1和dsCYP4C1对其它同源P450基因表达的影响显示,饲喂红火蚁dsCYP6A1-like 36h后,RNAi介导的dsCYP6A1-like处理组对CYP4C1-like、CYP4AB1、CYP4AB2和CYP4G15-like mRNA均没有显著的干扰,分别为对照组(dsGFP)的0.97、1.23、1.24和0.98倍;其中,只有CYP6A14-like有显著性升高,为对照组(dsGFP)的1.27倍。饲喂红火蚁dsCYP4C1-like 36h后,RNAi介导的dsCYP4C1-like处理组对CYP6A1-like、CYP4AB2和CYP4G15-like mRNA均没有显著的干扰,分别为对照组(dsGFP)的1.1、1.1和1.2倍;其中,只有CYP6A14-like有显著性升高,为对照组(dsGFP)的1.3和1.9倍。从敏感度测定结果看,分别饲喂两种dsRNA 12h后,分别用氟虫腈LC10(0.05μg/ml)处理,检测其对药剂的敏感度。
分别饲喂红火蚁工蚁两种dsRNA 12h后,处理组(dsCYP6A1-like)死亡率在12、24、36、48和60h显著高于对照组,分别为对照组(dsGFP)的3.2、3.89、1.65、1.23和1.16倍,其中饲喂24h时,处理组(dsCYP6A1-like)与对照组(dsGFP)死亡率比值达到最高(3.89倍),之后显著降低;而处理组(dsCYP4C1-like)死亡率在12-、24、36、48和60h均稍微低于对照组。分别是对照组(dsGFP)的0.6、0.78、0.63、0.83和0.95倍。其中饲喂60h时,处理组与对照组死亡率比值达到最高。从P450酶活性分析,处理组(dsCYP6A1-like)P450活性在12、24、48和72h均低于对照组(dsGFP),分别为对照组(dsGFP)的0.85、0.56、0.33和0.45倍,48-72h达到最低值,之后稍微回升。而处理组(dsCYP4C1-like)P450酶活性在12、24、48和72h P450酶活性均高于对照组(dsGFP),分别为对照组的1.22、1.50、1.48和1.32倍,48-72h达到最大值,之后稍微降低。这充分表明CYP6A1-like对氟虫腈有较强解毒代谢作用,而非CYP4C1-like,反而间接表明CYP6A14-like和CYP4AB2有可能参与氟虫腈解毒,致使处理组(dsCYP4C1-like)死亡率低于对照组(dsGFP),以和P450酶活性升高。Bautista(2009)研究表明小菜蛾CYP6BG1的敲除,降低了幼虫对苄氯菊酯(permethrin)的抗药性。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!