一种植骨材料皮下异位成骨动物模型的构建、评估方法及其应用与流程
本发明涉及一种动物评估模型,尤其涉及一种皮下异位评估植骨材料成骨性能的动物模型的构建和应用。
背景技术:
全世界每年需要进行植骨手术的患者多达220万。市场调查报告显示,植骨材料的市场价值将以4.5%的复合增长率,从2014年的23.5亿美元增长至2023年的34.8亿美元。巨大的临床需求及市场价值使得新型植骨材料的研发成为研究热点。新型植骨材料在应用于临床前,必须先在动物模型内证实其有效性及安全性。大鼠骨缺损模型(如颅骨缺损、股骨头缺损、长骨节段性骨缺损及颌骨缺损等)和皮下异位成骨模型是最常用的评估模型,然而它们在实际应用中仍存在许多问题。
模型大小是限制大鼠等小动物骨缺损评估模型的主要问题:成年大鼠平均颅骨厚度不足0.8mm,当植骨材料的颗粒大小超过此数值,术后极容易发生材料的移位,导致最后评估效果失实;长骨节段性骨缺损因难以使植入的颗粒型材料固定于原位,因此不适用于评估此形态的植骨材料;而股骨头缺损因所在部位的血供丰富、自愈能力强,因此不能准确判断植骨材料的成骨效果。大鼠皮下异位成骨评估模型因其造模操作简便,实验位点多可减少动物使用量以及皮下组织松弛可以容纳各种形状大小的植骨材料;大鼠皮下异位成骨评估模型由于其造模简易、可植入位点多、节省动物使用量和松弛的皮下组织可容纳各种形状大小的植骨材料等原因,因此也常常用于评估植骨材料的性能,但由于皮下环境对成骨相对苛刻,无成骨相关因子及原位成骨相关细胞参与,使得材料植入后很难或者需要很长时间才能观察到有新生骨或类骨质的形成,因此,往往需要添加昂贵的细胞因子(如bmp-2)和细胞(如骨髓间充质干细胞)等。
技术实现要素:
本发明的目的在于克服现有骨缺损评估模型的缺陷而提供一种植骨材料皮下异位成骨动物模型的构建方法。
本发明的另一个目的在于提供一种植骨材料皮下异位成骨动物模型的评估方法。
本发明的另一个目的在于提供一种植骨材料皮下异位成骨动物模型的应用。
为实现上述目的,本发明采取的技术方案如下:
一种植骨材料皮下异位成骨动物模型的构建方法,包括以下步骤:
(1)实验动物准备:6-8周健康大鼠;
(2)抽取大鼠自体血;
(3)混合自体血和植骨材料,待自体血凝固,得到自体血和植骨材料的混合物;
(4)在大鼠背部选取植入位点,做皮肤切口,并将步骤(3)中制备的混合物植入皮下,即可得到植骨材料皮下异位成骨动物模型。
上述技术方案中将植骨材料和自体血在体外混合,自体血凝固后,将凝固的混合物植入大鼠皮下,血凝块具有稳定材料的作用,减少术中和术后可能出现的植骨材料移位情况,使得定量分析更加准确;自体血为皮下异位成骨带入自体来源的细胞因子和细胞,从而在皮下环境中提供成骨相关的细胞因子和干细胞,使得皮下异位成骨模型可更好地用于评估植骨材料的成骨性能。
作为本发明所述植骨材料皮下异位成骨动物模型的构建方法的优选实施方式,所述步骤(3)中,将自体血和植骨材料按1:1μl/mg的比例混合,静置至自体血完全凝固。
作为本发明所述植骨材料皮下异位成骨动物模型的构建方法的优选实施方式,所述步骤(4)中,在同一只大鼠上的植入位点为4~6个。
作为本发明所述植骨材料皮下异位成骨动物模型的构建方法的优选实施方式,所述植骨材料选用颗粒型或块状植骨材料。
上述技术方案中,颗粒型植骨颗粒与自体血混合,血凝块能够稳定颗粒型植骨材料,凝固的混合物能够很好的保存于动物皮下,不易发生移位。
作为本发明所述植骨材料皮下异位成骨动物模型的构建方法的优选实施方式,所述颗粒型植骨材料的尺寸不超过4mm。
本发明还提供一种植骨材料皮下异位成骨动物模型的评估方法,采用以上所述方法构建植骨材料皮下异位成骨动物模型,植入后按设定的时间点将植骨材料取出,对植骨材料进行成骨性能表征。
作为本发明所述植骨材料皮下混血的异位成骨动物模型的评估方法的优选实施方式,所述成骨性能表征为新骨或类骨质形成的量与组织形态、成骨相关基因的表达水平中的至少一种。
上述技术方案中通过多角度检测及评价手段评估材料的成骨性能,使得评估结果更为准确可靠。
本发明还提供利用以上发明方法构建的植骨材料皮下异位成骨动物模型在植骨材料成骨性能研究的应用。
与现有技术相比,本发明的有益效果为:
本发明将植骨材料和自体血在体外混合,自体血凝固后,将凝固的混合物植入大鼠皮下,血凝块具有稳定材料的作用,减少术中和术后可能出现的植骨材料移位情况,使得定量分析更加准确;自体血为皮下异位成骨带入自体来源的细胞因子和干细胞,使得皮下异位成骨模型可更好地用于评估植骨材料的成骨性能,无需额外加昂贵的细胞因子和干细胞;本发明不受植骨材料颗粒大小的影响,植骨颗粒与自体血混合,凝固的混合物能够很好的保存于动物皮下;本发明皮下植入手术简单、经济,对动物的伤害小;本发明通过多角度检测及评价手段评估材料的成骨性能,使得评估结果更为准确可靠。
附图说明
图1是植骨材料不与自体血混合或与自体血混合条件下,分别植入颅骨缺损模型或皮下模型中及植骨材料植入1周后micro-ct重建结果。
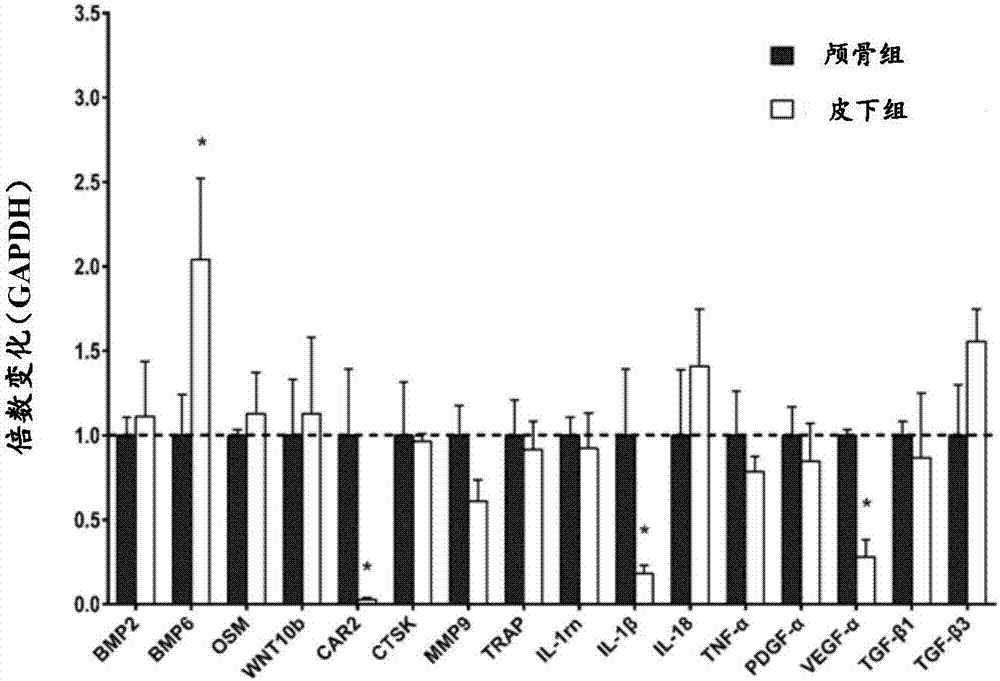
图2是植骨材料植入48小时后pcr定量结果。
图3是植骨材料植入5周后的h&e(a和b)和碱性磷酸酶免疫组化(c和d)染色结果。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例
实验材料准备:各种规格注射器;手术器械如刀片、刀柄、剪刀、血管钳、缝线、镊子等;水合氯醛、10%多聚甲醛、trizol、反转录试剂盒、荧光实时定量试剂盒、相关基因引物、相关蛋白抗体、nanodrop、pcr仪、荧光定量pcr仪、包埋蜡块、包埋机、切片机、摊片机、盖玻片、防脱载玻片、h&e染色试剂盒、免疫组化染色试剂盒、碱性磷酸酶抗体和正置相差显微镜等。
(1)实验动物准备
选择6-8周sd大鼠作为本实施例的模型动物。
(2)抽取自体血
用大剪刀剪去1ml注射器前端;利用酒精消毒sd大鼠尾部,再用剪刀或刀片剪去尾尖1-2mm,用被剪去前端的1ml注射器收集从sd大鼠尾部流出的血20μl。
(3)混合自体血和植骨材料
在抽取的20μl自体血中迅速加入20mg待评价的植骨材料,充分混匀,等待20min至血液和植骨材料完全凝固,得到凝固的混合物。
(4)在sd大鼠颅骨处制备双侧5mm的临界值颅骨缺损模型,左侧颅骨缺损植入颗粒型植骨材料,右侧颅骨缺损植入步骤(3)中制备的自体血和植骨材料的混合物,植入混合物后,严密缝合切口,关闭创面。
(5)背部选取植入位点,做皮肤切口,并分别将颗粒型植骨材料和步骤(3)中制备的自体血和植骨材料的混合物植入皮下,植入混合物后,严密缝合切口,关闭创面。
(6)植骨材料成骨性能表征
1)micro-ct扫描及三维重建
植入后1周,处死动物,将动物的颅骨及皮下植入位点的组织取出,4%多聚甲醛固定后,进行micro-ct扫描及三维重建,观察植入混合自体血的植骨材料是否可保留于原位以及颗粒型材料是否有散开。图1是颗粒型植骨材料(左侧)以及自体血和植骨材料混合物(右侧)植入颅骨缺损(a、b)以及植入颅骨缺损1周后micro-ct重建结果(c、d);颗粒型植骨材料植入皮下模型(e、f)以及植入皮下模型1周后micro-ct重建结果(g、h);自体血和植骨材料混合物植入皮下模型(i、j)以及植入皮下模型1周后micro-ct重建结果(k、l)。由图1可知,未混合自体血的颗粒型材料植入大鼠颅骨缺损后,容易发生材料的移位导致颗粒散落,颅骨缺损内仅剩余少量的植骨材料,而混合自体血后的颗粒型材料则可完整的保持在颅骨缺损中,未见有明显的颗粒散落;在皮下也可以观察到相似的结果,未混合自体血的颗粒型材料发生散落,而混合自体血后的植骨材料则相对完整的凝结成一团,未见明显的颗粒散落。
2)pcr检测
植入48小时后,处死动物,切开包膜,将皮下组和颅骨组植骨材料取出,并提取其中的rna,进行荧光定量pcr,检测调控成骨(bmp2、bmp6、osm、wnt10b)、破骨(car2、ctsk、mmp9、trap)、炎症(il-1rn、il-1β、il-18、tnf-α)、成血管(pdgf-α、vegf-α)和转化生长因子(tgf-β1、tgf-β3)相关基因的表达水平。图2为皮下组和颅骨组植骨材料的pcr结果(以磷酸甘油醛脱氢酶(gapdh)为内参)。由图2可知,皮下组和颅骨组调控炎症免疫反应(il-1rn、il-1β、il-18、tnf-α)、调控成骨(bmp2、bmp6、osm、wnt10b)、调控破骨(car2、ctsk、mmp9、trap)、调控成血管(pdgf-α、vegf-α)、调控成纤维(tgf-β1、tgf-β3)的相关基因表达基本无明显差异,表明本发明植入皮下后的反应与植入颅骨缺损后的反应相似。
3)组织学检测
植入后5周,处死动物,将皮下组和颅骨组材料(连同包膜,以防混合物散开)取出,进行下一步固定、脱水、包埋、切片、h&e染色和免疫组化染色,观察新生骨、类骨质和成骨相关蛋白在体内的表达情况。图3a和图3b分别是植骨材料植入皮下和颅骨5周后的h&e染色结果,图3c和图3d分别为植骨材料植入皮下和颅骨缺损5周后碱性磷酸酶免疫组化染色结果。图3结果表明,皮下组及颅骨组的组织反应类似,均可见材料被波浪形结缔组织包绕和并可见少量成纤维细胞;结缔组织可见大量圆形单核细胞浸润,环绕支架分布;虽均未见明显新生骨质形成,但成骨标志物碱性磷酸酶的表达情况类似。
由以上结果可知,本实施例中将植骨材料与自体血混合,形成自体血和植骨材料的混合物,能够稳定植骨材料,防止移位;自体血为皮下异位成骨带入自体来源的细胞因子及干细胞,无需额外加昂贵的细胞因子和干细胞;植入皮下后的反应与植入颅骨缺损后的反应相似,因此,本发明构建的植骨材料皮下异位成骨动物模型可一定程度上代替颅骨缺损模型,或者作为初步筛选工具,选择反应良好的材料进一步进行颅骨缺损的实验。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!