种子处理系统、装置和方法与流程
本申请要求于2016年8月22日提交的美国临时申请62/377,909的权益,该临时申请通过引用以其全文并入本文。
背景技术:
存在着重要的社会和商业推动力来寻找以安全且可持续的方式提高主要用于人类消费的作物的产量和质量的方法。目标是弃用化学剂或农药。用uv-b照射来处理用于播种的种子被描述为改善植物性能(performance)的有效方法。
附图说明
通过参考以下对利用本发明原理的说明性实施方式加以阐述的详细描述和附图,将会获得对本公开内容的特征和优点的更好的理解。
图1描绘了uv-b施用的示意图。
图2描绘了uv-b处理后种子中的黄酮类化合物水平的分析。
图3a图示了在uv-b施用之后20天,ezmina生菜植物叶中的黄酮类化合物水平的分析。
图3b描绘了uv-b施用后(通过幼苗(shoot)鲜重测量的)植物生产力的分析。
图4a-4b描绘了经受干旱胁迫的羽衣甘蓝秧苗的生长增加的图。
图5a-5h描绘了在施用13kjm-2剂量和100kjm-2剂量的uv-b之后,玉米种子中的黄酮类化合物水平的分析。
图6a-6d图示了在施用13kjm-2剂量和100kjm-2剂量的uv-b之后,玉米种子中的花色素苷的分析。
图7图示了在使用或不使用uv-b(uv)处理的情况下,在不同程度的可见光辐照度之后,秧苗干重(dw)的分析。
图8a-8g描绘了在uv-b处理之后,玉米种子生产力的分析。
图9描绘了在为引发做准备时清洗种子的方法。
图10图示了种子在种子托盘上的排列。
图11描绘了用于放置种子托盘的发光二极管(led)面板的布置。
图12描绘了施用对照、低(40uwcm-2)、中等(100uwcm-2)和高(200uwcm-2)uv-b辐照度的生菜种子的幼苗鲜重(g/植物)的图。uv-b的处理持续时间包括0小时、8小时、21小时和27小时。“np”是指未引发的种子。
图13描绘了施用对照、低(40uwcm-2)、中等(100uwcm-2)和高(200uwcm-2)uv-b辐照度的生菜种子的叶绿素水平(相对单位)的图。uv-b的处理持续时间包括0小时、8小时、21小时和27小时。“np”是指未引发的种子。
图14描绘了施用对照、低(40uwcm-2)、中等(100uwcm-2)和高(200uwcm-2)uv-b辐照度的生菜种子的黄酮类化合物水平(相对单位)的图。uv-b的处理持续时间包括0小时、8小时、21小时和27小时。“np”是指未引发的种子。
图15描绘了在蒸馏水(“水”)或溶解在水中的-1.25bar聚乙二醇(“渗透”)中引发,随后未施用uv-b(“对照”)或施用uv-b(“uv”)的青花菜种子的幼苗鲜重(g/植物)的图。吸收的持续时间包括8小时、18小时、19.5小时、24小时、27小时和44小时。
图16描绘了在蒸馏水(“水”)或溶解在水中的-1.25bar聚乙二醇(“渗透”)中引发,随后未施用uv-b(“对照”)或施用uv-b(“uv”)的青花菜种子的幼苗干重(g/植物)的图。吸收的持续时间包括8小时、18小时、19.5小时、24小时、27小时和44小时。
图17描绘了在蒸馏水(“水”)或溶解在水中的-1.25bar聚乙二醇(“渗透”)中引发,随后未施用uv-b(“对照”)或施用uv-b(“uv”)的青花菜种子的根干重(g/植物)的图。吸收的持续时间包括8小时、18小时、19.5小时、24小时、27小时和44小时。
图18描绘了在蒸馏水(“水”)或溶解在水中的-1.25bar聚乙二醇(“渗透”)中引发,随后未施用uv-b(“对照”)或施用uv-b(“uv”)的青花菜种子的叶绿素水平(相对单位)的图。吸收的持续时间包括8小时、18小时、19.5小时、24小时、27小时和44小时。
图19描绘了在蒸馏水(“水”)或溶解在水中的-1.25bar聚乙二醇(“渗透”)中引发,随后未施用uv-b(“对照”)或施用uv-b(“uv”)的青花菜种子的黄酮类化合物水平(相对单位)的图。吸收的持续时间包括8小时、18小时、19.5小时、24小时、27小时和44小时。
图20描绘了在未施用uv-b(“对照”)或施用uv-b(“uv”)期间,放置在潮湿的滤纸上(“漂浮”)或浸没(“浸没”)在引发介质(primingmedium)中的青花菜种子的幼苗鲜重(g/植物)的图。uv-b的处理持续时间包括18小时、20小时、21小时、24小时、27小时和28小时。
图21描绘了在未施用uv-b(“对照”)或施用uv-b(“uv”)期间,放置在潮湿的滤纸上(“漂浮”)或浸没(“浸没”)在引发介质中的青花菜种子的幼苗干重(g/植物)的图。uv-b的处理持续时间包括18小时、20小时、21小时、24小时、27小时和28小时。
图22描绘了在未施用uv-b(“对照”)或施用uv-b(“uv”)期间,放置在潮湿的滤纸上(“漂浮”)或浸没(“浸没”)在引发介质中的青花菜种子的根干重(g/植物)的图。uv-b的处理持续时间包括18小时、20小时、21小时、24小时、27小时和28小时。
图23描绘了在未施用uv-b(“对照”)或施用uv-b(“uv”)期间,放置在潮湿的滤纸上(“漂浮”)或浸没(“浸没”)在引发介质中的青花菜种子的叶绿素水平(相对单位)的图。uv-b的处理持续时间包括18小时、20小时、21小时、24小时、27小时和28小时。
图24描绘了在未施用uv-b(“对照”)或施用uv-b(“uv”)期间,放置在潮湿的滤纸上(“漂浮”)或浸没(“浸没”)在引发介质中的青花菜种子的黄酮类化合物水平(相对单位)的图。uv-b的处理持续时间包括18小时、20小时、21小时、24小时、27小时和28小时。
图25描绘了施用对照、低(40uwcm-2)、中等(100uwcm-2)和高(200uwcm-2)uv-b辐照度的青花菜种子的幼苗鲜重(g/植物)的图。uv-b的处理持续时间包括0小时、8小时、21小时和27小时。“np”是指未引发的种子。
图26描绘了施用对照、低(40uwcm-2)、中等(100uwcm-2)和高(200uwcm-2)uv-b辐照度的青花菜种子的下胚轴长度的图。uv-b的处理持续时间包括0小时、8小时、21小时和27小时。“np”是指未引发的种子。
图27描绘了施用对照、低(40uwcm-2)、中等(100uwcm-2)和高(200uwcm-2)uv-b辐照度的青花菜种子的叶片面积(cm2/植物)的图。uv-b的处理持续时间包括0小时、8小时、21小时和27小时。“np”是指未引发的种子。
图28描绘了施用对照、低(40uwcm-2)、中等(100uwcm-2)和高(200uwcm-2)uv-b辐照度的青花菜种子的叶绿素水平(相对单位)的图。uv-b的处理持续时间包括0小时、8小时、21小时和27小时。“np”是指未引发的种子。
图29描绘了施用对照、低(40uwcm-2)、中等(100uwcm-2)和高(200uwcm-2)uv-b辐照度的青花菜种子的黄酮类化合物水平(相对单位)的图。uv-b的处理持续时间包括0小时、8小时、21小时和27小时。“np”是指未引发的种子。
图30描绘了来自未引发的种子、对照种子和施用uv-b的种子的生菜叶中的黄酮类化合物水平的图。
图31描绘了来自未引发的种子、对照种子和施用uv-b的种子的青花菜植物中的下胚轴长度的图。
图32描绘了来自未引发的种子、对照种子和施用uv-b的种子的生菜植物生物量的图。
图33a-33b描绘了来自对照种子和施用uv-b的种子的玉米秧苗生长的图。
图34描绘了来自经受充分浇水或干旱条件的对照种子和施用uv-b的种子的生菜秧苗中的气孔阻力的图。
图35描绘了用于施用uv-b的示例性装置。
图36描绘了与本文的公开内容一致的计算机系统。
具体实施方式
本技术涉及用uv-b照射来处理用于播种的种子。本文描述了用于向用于播种的种子施用uv-b照射的方法、组合物和装置。在一些情况下,这些方法、组合物和装置通过同时增加从经处理的种子发芽的植物的抗逆性(hardiness)和生长来允许改善作物的产量和质量。
通过实施本文中的方法,用至少一种uv-b剂量处理种子,以便引发抗逆性增加(表现出对生物或非生物胁迫的耐受性增加)和在没有这类胁迫的情况下的生长增加,使得相对于从有可比性的未经处理的种子生长的植物,在存在和不存在非生物胁迫的情况下的总产量均增加。
用于施用uv-b的方法和组合物
本文提供了用于改善植物性能和植物物质的抗逆性的方法和装置。在一些情况下,方法和装置包括向植物物质施用uv-b照射。该植物物质可包括用于播种的种子、秧苗或植物。本文考虑了用于uv-b施用的各种条件。
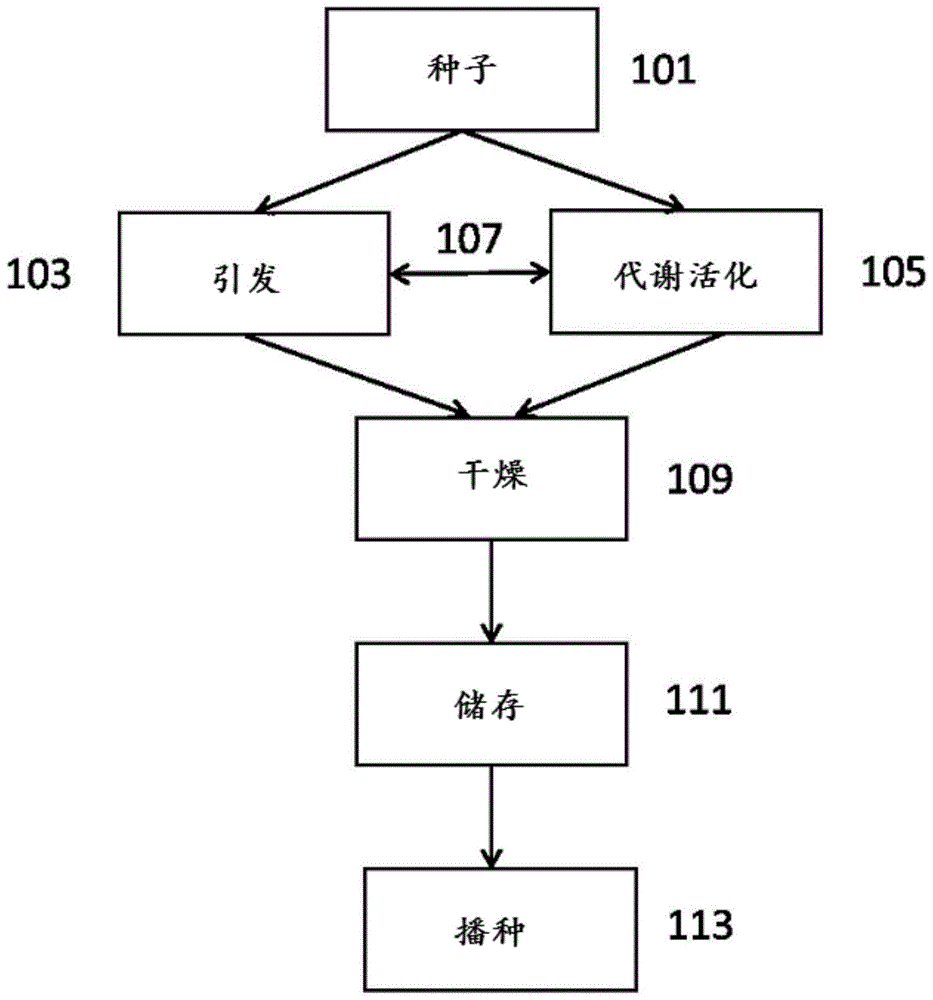
在图1中描绘了用于施用uv-b的示例性过程。种子101经历引发(priming)103和代谢活化(metabolicactivation)105。在一些情况下,引发103和代谢活化105同时进行107。在一些情况下,引发103在代谢活化105之前进行。可通过施用富含uv-b的光进行代谢活化105。可以向种子101施用各种剂量和辐照度的uv-b。在一些情况下,引发和施用uv-b中的至少一种的持续时间有所不同。在引发103和代谢活化105之后,对种子101进行干燥109并储存111。在一些情况下,干燥109包括减少种子的内部水分。在一些情况下,储存111包括将种子101装袋。在一些情况下,将种子101装袋以供出售。在一些情况下,袋装的种子储存至少1、2、3、4周或超过4周,或至少1、2、3、4、5、6个月或超过6个月,或至少1年。然后将种子101播种113,例如在田地中播种。
通常,uv-b辐射以约280nm至约320nm范围内的uv-b波段来施用。在一些情况下,施用280nm(±5nm)、286nm(±5nm)、294nm(±5nm)或约317nm的uv-b。该uv-b可为约280nm、约281nm、约282nm、约283nm、约284nm、约285nm、约286nm、约287nm、约288nm、约289nm、约290nm、约291nm、约292nm、约293nm、约294nm、约295nm、约296nm、约297nm、约298nm、约299nm、约300nm、约301nm、约302nm、约303nm、约304nm、约305nm、约306nm、约307nm、约308nm、约309nm、约310nm、约311nm、约312nm、约313nm、约314nm、约315nm、约316nm、约317nm、约318nm、约319nm或约320nm。
uv-b施用持续时间的长度与本文的公开内容一致。例如,uv-b照射的时间长度为至多72小时、至多60小时、至多48小时、至多36小时、至多24小时、至多23小时、至多22小时、至多21小时、至多20小时、至多19小时、至多18小时、至多17小时、至多16小时、至多15小时、至多14小时、至多13小时、至多12小时、至多11小时、至多10小时、至多9小时、至多8小时、至多7小时、至多6小时、至多5小时、至多4小时、至多3小时、至多2小时、至多1小时或少于一小时。在一些情况下,使用uv-b照射约40分钟或恰好40分钟。在一些情况下,uv-b处理为9小时。通常,uv-b处理为约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、14小时、16小时、18小时、20小时、24小时、30小时、32小时、50小时、72小时或超过72小时。一些处理持续少于约或至少1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟、11分钟、12分钟、13分钟、14分钟、15分钟、16分钟、17分钟、18分钟、19分钟、20分钟、21分钟、22分钟、23分钟、24分钟、25分钟、26分钟、27分钟、28分钟、29分钟、30分钟、31分钟、32分钟、33分钟、34分钟、35分钟、36分钟、37分钟、38分钟、39分钟、40分钟、41分钟、42分钟、43分钟、44分钟、45分钟、46分钟、47分钟、48分钟、49分钟、50分钟、51分钟、52分钟、53分钟、54分钟、55分钟、56分钟、57分钟、58分钟、59分钟、60分钟或超过60分钟。在一些情况下,uv-b施用持续时间在约0小时至约60小时或约5小时至约30小时的范围内。在一些情况下,uv-b施用持续时间为约18小时。在一些情况下,uv-b施用持续时间为约20小时。在一些情况下,uv-b施用持续时间为约21小时。在一些情况下,uv-b施用持续时间为约24小时。在一些情况下,uv-b施用持续时间为约27小时。在一些情况下,uv-b施用持续时间为约28小时。
uv-b施用可以以单次剂量完成。在一些实施方式中,uv-b施用是单个或多个时间点处理。在多个时间点处理的情况下,uv-b施用可以以任何适当的间隔分开。在一些情况下,uv-b施用以少于、约、恰好或至少1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟、11分钟、12分钟、13分钟、14分钟、15分钟、16分钟、17分钟、18分钟、19分钟、20分钟、21分钟、22分钟、23分钟、24分钟、25分钟、26分钟、27分钟、28分钟、29分钟、30分钟、31分钟、32分钟、33分钟、34分钟、35分钟、36分钟、37分钟、38分钟、39分钟、40分钟、41分钟、42分钟、43分钟、44分钟、45分钟、46分钟、47分钟、48分钟、49分钟、50分钟、51分钟、52分钟、53分钟、54分钟、55分钟、56分钟、57分钟、58分钟、59分钟或60分钟的间隔分开。在一些情况下,uv-b施用以少于、约、恰好或至少1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时、31小时、32小时、33小时、34小时、35小时、36小时、37小时、38小时、39小时、40小时、41小时、42小时、43小时、44小时、45小时、46小时、47小时、48小时、49小时、50小时、51小时、52小时、53小时、54小时、55小时、56小时、57小时、58小时、59小时、60小时或超过60小时的间隔分开。
施用uv-b可导致代谢活化。在一些情况下,uv-b诱导的代谢活化在用于播种的种子中。在一些情况下,uv-b诱导的代谢活化导致多个种子中的发芽增加。在一些情况下,uv-b诱导的代谢活化导致植物性能改善和用于播种的种子以及所得秧苗或作物的抗逆性改善中的至少一种。本文考虑了用于诱导代谢活化的其他方法。在一些情况下,使用外源性施用的光、激素、化学物质、类固醇或维生素来诱导代谢活化。用于诱导代谢活化的示例性激素包括但不限于植物生长素、细胞分裂素、脱落酸和赤霉素。
uv-b可单独施用或与另一波长的光联合施用。在一些情况下,uv-b与可见光共同施用。在一些情况下,该可见光包括或仅仅是蓝光或红光中的至少一种。在一些情况下,可见光以约或至多500umolm-2s-1施用。在一些情况下,可见光以约或至多400umolm-2s-1、约或至多300umolm-2s-1、约或至多200umolm-2s-1、约或至多100umolm-2s-1、约或至多50umolm-2s-1或者约或小于50umolm-2s-1施用。通常,可见光以约50umolm-2s-1施用。在一些情况下,施用约20umolm-2s-1的可见光。通常,该可见光可具有10m-2s-1-550m-2s-1、20m-2s-1-500m-2s-1、40m-2s-1-450m-2s-1、45m-2s-1-400m-2s-1、50m-2s-1-350m-2s-1、100m-2s-1-300m-2s-1或100m-2s-1-200umolm-2s-1的范围内的光子数。
uv-b可以单独或与可见光施用联合与uv-a处理共同施用。
光施用如可见光和uv-a的持续时间可能有所不同。例如,光施用的持续时间为至多72小时、至多60小时、至多48小时、至多36小时、至多24小时、至多23小时、至多22小时、至多21小时、至多20小时、至多19小时、至多18小时、至多17小时、至多16小时、至多15小时、至多14小时、至多13小时、至多12小时、至多11小时、至多10小时、至多9小时、至多8小时、至多7小时、至多6小时、至多5小时、至多4小时、至多3小时、至多2小时、至多1小时或少于一小时。在一些情况下,使用光施用持续时间约40分钟或恰好40分钟。在一些情况下,光施用的持续时间为9小时。在一些情况下,光施用的持续时间为约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、14小时、16小时、18小时、20小时、24小时、30小时、32小时、50小时、72小时或超过72小时。一些处理持续少于约或至少1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟、11分钟、12分钟、13分钟、14分钟、15分钟、16分钟、17分钟、18分钟、19分钟、20分钟、21分钟、22分钟、23分钟、24分钟、25分钟、26分钟、27分钟、28分钟、29分钟、30分钟、31分钟、32分钟、33分钟、34分钟、35分钟、36分钟、37分钟、38分钟、39分钟、40分钟、41分钟、42分钟、43分钟、44分钟、45分钟、46分钟、47分钟、48分钟、49分钟、50分钟、51分钟、52分钟、53分钟、54分钟、55分钟、56分钟、57分钟、58分钟、59分钟、60分钟或超过60分钟。在一些情况下,光施用的持续时间在约0小时至约60小时或约5小时至约30小时的范围内。在一些情况下,光施用的持续时间为约18小时。在一些情况下,光施用的持续时间为约20小时。在一些情况下,光施用的持续时间为约21小时。在一些情况下,光施用的持续时间为约24小时。在一些情况下,光施用的持续时间为约27小时。在一些情况下,光施用的持续时间为约28小时。
在一些情况下,当uv-b与另一波长的光共同施用时,uv-b与另一波长的光相比得到富集。在一些情况下,uv-b被富集成比另一波长的光多至少或约15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%、100%、125%、150%、175%、200%、225%、250%、275%、300%或超过300%。在一些情况下,补充uv-b。在一些情况下,uv-b是光施用期间的主要波长。在一些情况下,uv-b占用于光施用的光的至少或约15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%、100%。
本文提供了涉及uv-b施用的方法和装置,其中uv-b在种子引发过程后或种子引发过程期间施用。在一些情况下,uv-b在种子引发过程期间施用,例如与种子引发过程同时施用。在一些情况下,该种子引发过程包括用于改善后续种子发芽的方法。在一些情况下,引发是水引发、渗透引发、氧化还原引发、化学引发和激素引发中的至少一种。在一些情况下,引发包括用于影响种子环境的渗透势或水势的方法。在一些情况下,影响渗透势或水势的方法包括引发介质。在一些情况下,该引发介质是水。在一些情况下,该引发介质是蒸馏水。在一些情况下,引发包括影响渗透势的化学物质。例如,聚乙二醇用作引发介质。引发介质的非限制性实例包括但不限于甘油、甘露醇、盐水和水。在一些情况下,该种子引发过程包括用渗压剂处理,其有助于管理种子水合过程。
在一些情况下,种子在完全浸没时引发。种子通常在种子托盘中引发或分层,该托盘的水位保持在完全浸没的种子上方约1-2mm处。在一些情况下,任何漂浮的种子均被轻敲下直至完全浸没。
引发持续时间可能有所不同。在一些情况下,引发持续时间为至少或约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时、31小时、32小时、33小时、34小时、35小时、36小时、37小时、38小时、39小时、40小时、41小时、42小时、43小时、44小时、45小时、46小时、47小时、48小时、49小时、50小时、51小时、52小时、53小时、54小时、55小时、56小时、57小时、58小时、59小时、60小时或超过60小时。在一些情况下,引发持续时间在约8小时至约44小时的范围内。在一些情况下,引发持续时间为约8小时。在一些情况下,引发持续时间为约18小时。在一些情况下,引发持续时间为约19.5小时。在一些情况下,引发持续时间为约20小时。在一些情况下,引发持续时间为约24小时。在一些情况下,引发持续时间为约27小时。在一些情况下,引发持续时间为约44小时。
在一些情况下,所述种子在黑暗、光和可见光中的至少一种下引发。
通常,所述种子在植物生长室中在所需温度下引发。在一些情况下,该种子在约25℃下引发。在一些情况下,该种子在约22℃下引发。在一些情况下,该种子在约10℃下引发。该种子可在至少或约10℃、12℃、15℃、18℃、20℃、22℃、25℃、27℃、30℃、35℃、40℃、50℃或大于50℃下引发。该种子可在至多10℃、12℃、15℃、18℃、20℃、22℃、25℃、27℃、30℃、35℃、40℃或50℃下引发。该种子可在约10℃-50℃、15℃-30℃、18℃-25℃或20℃-30℃的温度范围下引发。
所述种子可在合适的相对湿度下引发。在一些情况下,该种子在约95%的相对湿度下引发。该种子可在至少或约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、99%或更大的相对湿度下引发。或者,该种子可在至多10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、99%或100%的相对湿度下引发。该种子可在约10%-100%、15%-90%、20%-80%、30%-70%、40%-60%、45%-75%、50%-60%、70%-90%、85%-95%或95%-99%的相对湿度范围下引发。
在一些情况下,在初始水合过程之后施用所述uv-b照射,其在处理方案期间可以对不同程度的水合作用或引发介质进行微调。通常,在处理之前在冷水下清洗种子以便去除红色杀真菌剂包衣并准备用于引发或以其他方式分层的种子。
本文提供了与uv-b施用相关的方法和装置,其中在uv-b施用期间排列植物物质以增加uv-b照射效果。在一些情况下,该植物物质包括种子。在一些情况下,对该种子进行排列,其中将胚芽定位以增加uv-b照射效果。在一些情况下,该种子以胚芽侧向上进行排列,以便增加uv-b照射效果。在一些情况下,在uv-b施用期间,将种子定位在潮湿表面上。例如,最表面是潮湿的滤纸。在一些情况下,在uv-b施用期间,将种子浸没在介质中。
在一些情况下,在uv-b照射期间,将种子排列在托盘中。可将该种子分开到许多托盘上以便减少伪重复。在一些情况下,将该种子排列在托盘上以便使uv-b照射的效果最大化或增加。
与此一致,公开了具有凹槽的托盘,使得分布在托盘中的种子群体被定向,以便使uv-b照射的效果最大化。在一些情况下,托盘凹槽引导种子,使得例如在对托盘温和地施加搅拌时,该种子落入使得它们被定位以使uv-b施用效果最大化或增加的定向。在多个实施方式中,托盘被不同地配置为容纳来自多种植物作物如玉米、生菜、水稻、高粱、棉花、苜蓿、小麦或本文公开的任何其他作物或观赏种子植物的种子。
在引发之后或在处理期间的任何时间,可以储存所述种子。在一些情况下,将该种子在约4℃或恰好4℃下储存在容器中。在一些情况下,随后将种子储存超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、15小时、20小时、24小时或大于24小时。该种子可在冰箱中保存超过24小时。该种子不同地在约15℃-40℃、18℃-25℃、20℃-22℃或24℃-28℃或其各种排列的温度范围下保存。该种子可在室温下保存。该种子可在室温或上述温度下保存超过1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、15小时、20小时、24小时或大于24小时。该种子可在冰箱中保存超过24小时。该种子可在室温或上述温度下保存超过24小时。该种子可在约30%-100%、40%-95%、50%-90%、60%-85%、65%-75%、70%-80%或45%-55%的相对湿度范围下保存。在一些情况下,将该种子储存在袋中。在一些情况下,在播种之前将该种子储存在袋中。在播种之前将该种子储存在袋中任何合适的时间。在多个实施方式中,将该种子储存至少1小时、10小时、24小时、1天、2天、3天、4天、5天、6天、7天、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、2年或超过2年。
本文提供了涉及施用uv-b的方法和装置,其中使用光源来施用光。该光源可施用不同波长的光。例如,该光源被配置为发射约300nm至约800nm范围内的一种或多种波长的光。在一些情况下,该光源发射约280nm至约320nm范围内的一种或多种波长。在一些情况下,使用一种或多种光源来发射一种或多种波长的光。该光源可选自发光二极管(led)、激光器、白炽灯泡和气体放电灯泡。
在一些情况下,所述光源是led。通常,led灯被配置为施用光的峰值照射波长,例如在约280nm(280nm加减10nm、9nm、8nm、7nm、6nm、5nm、4nm、3nm、2nm或1nm的范围)或恰好280nm处,在约286nm(286nm加减10nm、9nm、8nm、7nm、6nm、5nm、4nm、3nm、2nm或1nm的范围)或恰好286nm处。或者,led灯被配置为施用标准白光光谱处的光,该光由uv-b范围内的光补充,该uv-b范围内的光例如在约280nm(280nm加减10nm、9nm、8nm、7nm、6nm、5nm、4nm、3nm、2nm或1nm的范围)或恰好280nm处,在约286nm(286nm加减10nm、9nm、8nm、7nm、6nm、5nm、4nm、3nm、2nm或1nm的范围)或恰好286nm处。
如本文所用的led可适当地被配置用于uv-b施用。在一些情况下,led面板被配置在高度为约80mm处。led面板可布置在一排种子上方,高度为约20mm、40mm、60mm、80mm、100mm、120mm、150mm或200mm。该led面板可布置在约20mm-200mm、40mm-150mm、60mm-120mm或80mm-100mm的范围内。通常,uv面板之间的距离为约10mm。在一些情况下,uv面板之间的距离为约1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、12mm、15mm或20mm。或者,uv面板之间的距离在约1mm-20mm、2mm-15mm、3mm-10mm或4mm-9mm的范围内。通常,uv与对照面板之间的最小距离为约400mm。在一些情况下,uv与中心面板之间的最小距离为约50mm、100mm、150mm、200mm、250mm、300mm、350mm、400mm、450mm、500mm、600mm、700mm或800mm。或者,uv与中心面板之间的距离在约50mm-800mm、100mm-700mm、150mm-600mm、200mm-500mm或250mm-400mm的范围内。
在一些情况下,所述种子托盘直接放置在led面板下方,高度为约8cm,或在7cm、6cm、5cm、4cm、3cm、2cm和1cm的范围内,并且每个处理之间为约或至少20cm,以便防止来自相邻处理的直接照射并在处理开始前覆盖。在一些情况下,每个处理之间的距离在约20cm-200cm、30cm-100cm或40cm-90cm的范围内。通常,更换蒸发的水,并在光处理之前移除盖子。多种led配置与本文的公开内容一致,并且如本领域技术人员已知的,光强度和距种子的距离可以一致地变化,使得uv-b光的总剂量或平均剂量保持恒定。
在光处理后,通常使用纸巾干燥所述种子以去除过量的水,然后风干72小时。该种子可以用纸巾干燥,然后风干少于、约、恰好或至少12小时、24小时、36小时、48小时、60小时、72小时、84小时、96小时或更多小时。在一些情况下,随后将种子储存并覆盖。
在一些情况下,在引发并同时施用uv-b后干燥种子。在一些情况下,干燥该种子以减少种子的内部水分。在一些情况下,使用空气、降低湿度、调节温度或使用干燥剂如硅胶来干燥该种子。在一些情况下,将该种子干燥至确定的内部水分。例如,将该种子干燥至至多或约2%、3%、4%、5%、6%、7%、8%、9%、10%、12%、15%、18%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或大于70%的内部水分。干燥该种子可在引发并同时向所述种子施用uv-b之后的任何时间进行。在一些情况下,在播种之前干燥该种子。在一些情况下,在发芽之前干燥该种子。可在播种或发芽之前将该种子干燥至少或约5分钟、10分钟、20分钟、30分钟、45分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、24小时、36小时、48小时、60小时、72小时、84小时、96小时或大于96小时。
在干燥种子或减少该种子的内部水分之后,可以储存该种子。在一些情况下,将该种子储存并装袋。在一些情况下,将该种子装袋以供出售。可将该种子储存并装袋任何合适的一段时间。例如,将该种子储存并装袋至少1小时、10小时、24小时、1天、2天、3天、4天、5天、6天、7天、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、2年或大于2年。
uv-b处理可在不同的时间点或持续时间开始。例如,将uv-b处理不同地应用于种子水合之前、种子发芽之前、初始发芽期间(例如,为了种子发芽而施加水分之后)和引发处理期间中的至少一种。在一些情况下,在种子引发期间施用uv-b。
在一些实施方式中,发芽温度可能有所不同。
本文考虑了uv-b的不同剂量。在一些情况下,剂量在约0.01kjm-2至约368kjm-2的范围内。在一些情况下,剂量为约0.01kjm2-368kjm-2、0.1kjm-2-300kjm-2、1kjm-2-250kjm-2、10kjm-2-200kjm-2、100kjm-2-150kjm-2、200kjm-2-300kjm-2、250kjm-2-350kjm-2或300kjm-2-368kjm-2。在一些情况下,剂量在约0.1至约12kjm-2的范围内。在一些情况下,剂量为约13kjm-2。光处理的剂量可为约13kjm-2、恰好13kjm-2或至少13kjm-2。在一些情况下,剂量为约37kjm-2。在一些情况下,剂量为约69kjm-2。在一些情况下,剂量为约78kjm-2。在一些情况下,剂量为约98kjm-2。在一些情况下,剂量为约100kjm-2。光处理的剂量可为约100kjm-2、恰好100kjm-2或大于100kjm-2。在一些情况下,剂量为约125kjm-2。在一些情况下,剂量为约204kjm-2。光处理的剂量范围可为约13kjm-2至100kjm-2。uv-b的剂量可在约1kjm-2-1000kjm-2、10kjm-2-800kjm-2、20kjm-2-600kjm-2、30kjm-2-400kjm-2、50kjm-2-200kjm-2、100kjm-2-150kjm-2、30kjm-2-60kjm-2或150kjm-2-250kjm-2的范围内。在一些情况下,uv-b在0kjm-2-20kjm-2、20kjm-2-40kjm-2、40kjm-2-60kjm-2、60kjm-2-80kjm-2或80kjm-2-100kjm-2的范围内。
可以使用不同辐照度的uv-b。在一些情况下,辐照度在约4x10-5wcm-2s-1至约1.3x10-4wcm-2s-1的范围内。辐照度范围可为约4x10-5wcm-2s-1、恰好4x10-5wcm-2s-1或至少4x10-5wcm-2s-1。在一些情况下,辐照度在约1.3x10-4wcm-2s-1、恰好1.3x10-4wcm-2s-1或大于1.3x10-4wcm-2s-1的范围内。辐照度范围可为约4x10-5wcm-2s-1-6x10-5wcm-2s-1、6x10-5wcm-2s-1-8x10-5wcm-2s-1、8x10-5wcm-2s-1-1x10-4wcm-2s-1或1x10-4wcm-2s-1-1.5x10-5wcm-2s-1。剂量可相对于处理方案如水合方案而变化。
在一些情况下,uv半带宽尺寸有所不同。
在一些情况下,在从随后要用于播种的植物收获种子之前将uv-b施用于植物。由于生理学差异,生长的植物的有效剂量可能与收获的种子的有效剂量不同。或者,在从植物收获种子之前将uv-b处理施加于植物,其用于后续植物育种应用,而不是用于植物/作物性能。
可以使用先前描述的各种处理条件和处理的组合。处理条件可包括但不限于引发方法、温度、uv-b剂量、uv-b辐照度和uv-b施用期间的植物物质位置。在一些情况下,处理条件可包括1种条件、2种条件、3种条件、4种条件、多于4种条件及其排列和组合。在一些情况下,引发方法有所不同。例如,在水中或在聚乙二醇中引发种子。在一些情况下,生长室的温度有所不同。在一些情况下,生长室的温度为至少或约10℃、12℃、14℃、16℃、18℃、20℃、22℃、24℃、26℃、28℃或30℃。可在约22℃或约10℃的生长室中施用uv-b。在一些情况下,uv-b的剂量有所不同。在一些情况下,剂量在约30kjm-2至约250kjm-2的范围内。在一些情况下,uv-b辐照度有所不同。例如,施用约40uwcm-2至约200uwcm-2范围内的辐照度。例如,施用约1.5umolm-1s-1至约8umolm-1s-1范围内的辐照度。在一些情况下,施用至少或约1.5umolm-1s-1、2umolm-1s-1、2.5umolm-1s-1、3umolm-1s-1、3.5umolm-1s-1、4umolm-1s-1、4.5umolm-1s-1、5umolm-1s-1、5.5umolm-1s-1、6umolm-1s-1、6.5umolm-1s-1、7umolm-1s-1、7.5umolm-1s-1、8umolm-1s-1、8.5umolm-1s-1、9umolm-1s-1、9.5umolm-1s-1、10umolm-1s-1或大于10umolm-1s-1的辐照度。在一些情况下,uv-b施用的持续时间有所不同。uv-b施用的持续时间可包括至少或约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时或大于30小时。在一些情况下,uv-b持续时间为约8小时、约18小时、约20小时、约21小时、约24小时、约27小时或约28小时。在uv-b施用期间种子的位置可能有所不同。在一些情况下,在uv-b施用期间,将种子放置在潮湿表面。在一些情况下,在uv-b施用期间,将种子浸没在引发介质中。
在一个实施方式中,处理条件包括在蒸馏水中引发种子,并在约22℃的生长室中在施用uv-b约8小时至约44小时范围内的持续时间期间将种子浸没在该引发介质中。在一个实施方式中,处理条件包括在蒸馏水中引发种子,并在约10℃的生长室中施用uv-b约8小时至约44小时范围内的持续时间,同时将种子放置在潮湿的滤纸上。在一个实施方式中,处理条件包括在蒸馏水中引发种子,并在约10℃的生长室中在施用uv-b约8小时至约44小时范围内的持续时间期间将种子浸没在该引发介质中。在一个实施方式中,处理条件包括在聚乙二醇中引发种子,并在约22℃的生长室中施用uv-b约8小时至约44小时范围内的持续时间期间将种子浸没在该引发介质中。在一个实施方式中,处理条件包括在聚乙二醇中引发种子,并在约10℃的生长室中施用uv-b约8小时至约44小时范围内的持续时间期间并且使用约40uwcm-2至约200uwcm-2范围内的辐照度将种子浸没在该引发介质中。在一个实施方式中,处理条件包括在聚乙二醇中引发种子,并在约10℃的生长室中施用uv-b约8小时至约44小时范围内的持续时间期间将种子浸没在该引发介质中。
本文所述方法中的任何一种方法可在合适的环境中进行。本文所述的方法包括但不限于引发植物物质和施用uv-b。例如,所述方法中的任何一种方法均可在室内进行,例如温室。在一些情况下,uv-b在室内施用。在一些情况下,uv-b在户外施用。在一些情况下,uv-b在田地中在户外施用。在一些情况下,植物物质在室内引发,然后移植到室外以用于后续生长。
与未经处理的对应植物物质相比,使用如本文所述的方法处理的植物物质中的植物性能可导致改善的植物性能。在一些情况下,使用如本文所述的方法改善植物物质的抗逆性。在一些情况下,该植物物质是种子。在一些情况下,在对如本文所述的种子进行uv-b处理之后,所得秧苗或植物显示出改善的植物性能。
在一些情况下,改善了来自使用uv-b照射的种子的所得秧苗中的植物性能。在一些情况下,改善了来自用本文所述uv-b照射的种子的秧苗中的所得秧苗的植物性能,包括黄酮类化合物水平、花色素苷水平、尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸、下胚轴长度、叶绿素水平、叶片面积和根干重中的至少一种。在一些情况下,秧苗中改善的植物性能是黄酮类化合物水平和花色素苷水平中的至少一种的水平升高。可以在播种之前测量来自用本文所述uv-b照射的种子的秧苗的植物性能。
在一些情况下,改善了来自使用uv-b照射的种子的所得秧苗的抗逆性。该秧苗可具有改善的在热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种之后的恢复力。在一些情况下,来自uv-b照射的种子的秧苗中改善的恢复力包括尽管暴露于胁迫但仍发芽的能力。在一些情况下,在热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种之后检查该秧苗。
与来自未用本文公开的uv-b方案照射的种子的对应秧苗相比,来自uv-b照射的种子的所得秧苗中的植物性能和抗逆性中的至少一种可增加显著的百分比。植物性能和抗逆性中的至少一种可增加约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%。植物性能和抗逆性中的至少一种可增加至少约4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%。植物性能和抗逆性中的至少一种可增加至少5%。植物性能和抗逆性中的至少一种可增加至少10%。植物性能或抗逆性可增加至少30%。植物性能和抗逆性中的至少一种可增加至少50%。
可以改善来自使用uv-b照射的种子的所得植物或作物中的植物性能。在uv-b处理种子之后,可以种植秧苗并且可以测量所得植物或作物中的植物性能。在一些情况下,植物性能被测量为在黄酮类化合物水平、花色素苷水平、尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸、下胚轴长度、叶绿素水平、叶片面积和根干重中的至少一种的改善。在一些情况下,所得植物或作物中的植物性能被测量为改善的质量,包括更长的保质期、对擦伤或收获后处理的抗性、增加的营养价值、改善的味道、改善的形状、改善的颜色、改善的尺寸和改善的质地中的至少一种。可以在播种期间或之后测量来自用本文所述uv-b照射的种子的所得植物或作物中的植物性能。
在一些情况下,改善了来自使用uv-b照射的种子的所得植物或作物中的抗逆性。该植物或作物可具有改善的在热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种之后的恢复力。在一些情况下,改善的恢复力包括尽管暴露于胁迫但生长和存活未受影响或得到改善。在一些情况下,改善的恢复力包括与来自未经uv-b照射的种子的植物或作物相比,尽管暴露于胁迫但生长和存活得到改善。在某些情况下,改善的恢复力包括尽管暴露于胁迫但仍结出果实的能力。在一些情况下,改善的恢复力包括与来自未经uv-b照射的种子的植物或作物相比,尽管暴露于胁迫但仍结出果实的能力。在一些情况下,在热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种之后检查所得植物或作物。
与来自未用本文公开的uv-b方案照射的种子的对应植物或作物相比,来自uv-b照射的种子的所得植物或作物中的植物性能和抗逆性中的至少一种可增加显著的百分比。植物性能和抗逆性中的至少一种可增加约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%。植物性能和抗逆性中的至少一种可增加至少约4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%。植物性能和抗逆性中的至少一种可增加至少5%。植物性能和抗逆性中的至少一种可增加至少10%。植物性能和抗逆性中的至少一种可增加至少30%。植物性能和抗逆性中的至少一种可增加至少50%。
在一些实施方式中,将从uv-b照射的种子种植的作物暴露于胁迫。在一些情况下,该胁迫是热、洪水、干旱、霜冻、异常气候事件、盐胁迫或高可见光胁迫的结果。
在暴露于胁迫之前,可以在uv-b照射之前准备uv-b照射的种子。在一些情况下,在冷水中清洗用于播种的种子。在一些情况下,在生长室中引发种子。例如,该生长室处于约25℃和95%湿度下。在一些情况下,该生长室的温度为至少或约10℃、12℃、14℃、16℃、18℃、20℃、22℃、24℃、26℃、28℃或30℃。在一些情况下,将种子在引发介质中引发一段合适的时间。该引发介质可以是水或聚乙二醇。在一些情况下,引发进行约16小时。引发可持续约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、14小时、16小时、18小时、20小时或24小时。在引发之后或引发期间,使用uv-b和共同施用的可见光照射所述种子,而在其他情况下,单独施用uv-b。通常,uv-b波段以约280nm至约320nm的uv-b波段来施用。在一些情况下,施用280nm(±5nm)处的uv-b。uv-b可为约280nm、281nm、282nm、283nm、284nm、285nm、286nm、287nm、288nm、289nm、290nm、291nm、292nm、293nm、294nm、295nm、296nm、297nm、298nm、299nm、300nm、301nm、302nm、303nm、304nm、305nm、306nm、307nm、308nm、309nm、310nm、311nm、312nm、313nm、314nm、315nm、316nm、317nm、318nm、319nm或320nm。uv-b施用的剂量可能有所不同。在一些情况下,uv-b剂量以约13kjm-2施用9小时。在一些情况下,uv-b以约100kjm-2施用21小时。在一些情况下,uv-b剂量在约0kjm-2-100kjm-2、10kjm-2-90kjm-2、20kjm-2-80kjm-2、30kjm-2-70kjm-2和40kjm-2-50kjm-2的范围内。通常,可见光可具有约10umolm-2s-1-550umolm-2s-1、20umolm-2s-1-500umolm-2s-1、40umolm-2s-1-450umolm-2s-1、45umolm-2s-1-400umolm-2s-1、50umolm-2s-1-350umolm-2s-1、100umolm-2s-1-300umolm-2s-1或100umolm-2s-1-200umolm-2s-1的范围内的光子数。uv-b处理可以是单次或多次。在uv-b处理之后,种子通常干燥72小时。种子可干燥至多72小时、至多60小时、至多48小时、至多36小时、至多24小时、至多12和至多6小时。在一些情况下,在合适的时间之后,种植秧苗。在一些情况下,在1天、2天、3天、4天、5天、6天、1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月或超过8个月后种植秧苗。在一些情况下,在4周后种植秧苗。在种植之后,可将所得作物暴露于诸如热等胁迫。
在一些情况下,在胁迫之后,测量植物性能,包括黄酮类化合物水平、花色素苷水平、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量、抗逆性或种子发芽率中的至少一种。在一些情况下,植物性能被测量为改善的质量,包括更长的保质期、对擦伤或收获后处理的抗性、增加的营养价值以及改善的味道、形状、颜色、尺寸和质地中的至少一种。通常在热胁迫之后,与从未经uv-b照射的种子生长的植物相比,从经uv-b照射的种子生长的植物显示出植物性能提高。在备选的实施方式中,将植物暴露于洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫。
或者,将植物暴露于感染。感染可由包括但不限于真菌、卵菌、细菌、病毒、类病毒、病毒样生物体、植原体、原生动物、线虫和寄生植物的生物体引起。在一些情况下,在如本文方法中所述对种子进行uv-b处理之后,尽管由这样的生物体引起感染,但植物性能未受影响或得到改善。在一些情况下,在如本文方法中所述对种子进行uv-b处理之后,与未经uv-b照射的种子相比,尽管由这样的生物体引起感染,但植物性能得到改善。在一些情况下,检查植物性能是否有由这样的生物体引起的感染。通常,检植物性能是否有叶病、穗腐病、茎腐病以及播种和根病中的至少一种。
在一些情况下,根据在不影响作物产量的情况下肥料、除草剂、杀虫剂和农药使用的减少中的至少一种来测量植物性能。肥料、除草剂、杀虫剂或农药使用的减少可通过与十年以上的作物的工业应用、全州平均值或全国平均值进行比较来确定。肥料使用的减少可为至少5%。在一些情况下,肥料的减少在约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%的范围内。在一些情况下,除草剂使用的减少为至少5%。在一些情况下,除草剂的减少在约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%的范围内。在一些情况下,杀虫剂使用的减少为至少5%。在一些情况下,杀虫剂的减少在约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%的范围内。在一些情况下,农药使用的减少为至少5%。在一些情况下,农药的减少在约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%的范围内。
在一个实施方式中,与从未经uv-b照射的种子生长的植物相比,从经uv-b照射的种子生长的植物需要更少的农药。在uv-b照射之前,可以准备种子。在一些情况下,在冷水中清洗用于播种的种子。在一些情况下,在生长室中引发种子。例如,该生长室处于约25℃和95%湿度下。在一些情况下,该生长室的温度为至少或约10℃、12℃、14℃、16℃、18℃、20℃、22℃、24℃、26℃、28℃或30℃。在一些情况下,将种子在引发介质中引发一段合适的时间。该引发介质可以是水或聚乙二醇。在一些情况下,引发进行约16小时。引发可持续约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、12小时、14小时、16小时、18小时、20小时或24小时。在引发之后或引发期间,使用uv-b和共同施用的可见光照射所述种子,而在其他情况下,单独施用uv-b。通常,uv-b波段以约280nm至约320nm的uv-b波段来施用。在一些情况下,施用280nm(±5nm)处的uv-b。uv-b可为约280nm、281nm、282nm、283nm、284nm、285nm、286nm、287nm、288nm、289nm、290nm、291nm、292nm、293nm、294nm、295nm、296nm、297nm、298nm、299nm、300nm、301nm、302nm、303nm、304nm、305nm、306nm、307nm、308nm、309nm、310nm、311nm、312nm、313nm、314nm、315nm、316nm、317nm、318nm、319nm或320nm。uv-b施用的剂量可能有所不同。在一些情况下,uv-b剂量以约13kjm-2施用9小时。在一些情况下,uv-b以约100kjm-2施用21小时。在一些情况下,uv-b剂量在约0.1kjm-2-100kjm-2、10kjm-2-90kjm-2、20kjm-2-80kjm-2、30kjm-2-70kjm-2和40kjm-2-50kjm-2的范围内。通常,可见光可具有约10umolm-2s-1-550umolm-2s-1、20umolm-2s-1-500umolm-2s-1、40umolm-2s-1-450umolm-2s-1、45umolm-2s-1-400umolm-2s-1、50umolm-2s-1-350umolm-2s-1、100umolm-2s-1-300umolm-2s-1或100umolm-2s-1-200umolm-2s-1的范围内的光子数。uv-b处理可以是单次或多次。在uv-b处理之后,种子通常干燥72小时。种子可干燥至多72小时、至多60小时、至多48小时、至多36小时、至多24小时、至多12和至多6小时。在一些情况下,干燥该种子以减少种子的内部水分。在一些情况下,将种子储存。在一些情况下,将种子储存并装袋。可将种子储存并装袋任何合适的时间。在一些情况下,在储存后,种植种子。在一些情况下,在1天、2天、3天、4天、5天、6天、1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月或超过8个月后种植种子。在一些情况下,在4周后种植种子。在种植之后,所得作物可需要较少的肥料。在一些情况下,肥料的减少为至少或约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或大于50%。
可以测量需要较少肥料的所得作物中的植物性能。在一些情况下,在播种作物时或在播种作物之前一次或多次测量植物性能。植物性能包括但不限于黄酮类化合物水平、花色素苷水平、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量、抗逆性或种子发芽率。在一些情况下,植物性能被测量为改善的质量,包括更长的保质期、对擦伤或收获后处理的抗性、增加的营养价值以及改善的味道、形状、颜色、尺寸和质地中的至少一种。通常,与从未经uv-b照射的种子生长的植物相比,从经uv-b照射的种子生长的植物需要较少的肥料而没有任何伴随的植物性能降低。在备选的实施方式中,从经uv-b照射的种子生长的植物需要较少的除草剂、杀真菌剂和杀虫剂中的至少一种。在一些情况下,所得植物在除草剂、杀虫剂和农药中的至少一种减少的情况下生长,从而使得有机作物能够用于动物或人类消耗。
在本文所述的多个实施方式中,以多种方式测量植物性能。例如,性能被测量为产量、营养价值、黄酮类化合物产量、花色素苷产量、对昆虫攻击的抗性、对细菌或真菌攻击的抗性、对诸如干旱、热、冷或营养胁迫等非生物胁迫的抗性。备选地或组合地,植物性能被确定为除草剂、农药、杀虫剂或肥料施加的减少。在一些情况下,提高的植物性能可导致更快地收获作物。植物性能的替代定义与本文的公开内容一致。值得注意的是,在通过如本文公开的uv-b补充来处理种子时,所得植物通常表现出抗逆性增强和在不存在环境胁迫的情况下的生长增加。也就是说,从经处理的种子(例如通过280nmuv-b补充来处理的种子)生长的植物表现出对生物胁迫如细菌、昆虫或真菌病原体胁迫的抗性增加,对非生物胁迫如热、冷、干旱、盐、光、营养或风的抗性增加,并且令人惊讶地,相对于从未经处理的种子生长的植物,在不存在这样的胁迫的情况下生长速率增加。因此,相对于从未经处理的种子生长的植物,在存在和不存在胁迫的情况下,从经处理的种子生长的植物表现出产量增加。备选地或组合地,尽管例如相对于从未经处理的种子生长的植物,从经处理的种子生长的植物的肥料施用减少、浇水减少、除草剂减少或土壤质量下降,但其相对于从未经处理的种子生长的植物获得相当或改善的产量。
因此,uv-b补充使得生长作物的方法能够进行,从而相对于从未经处理种子生长的植物,农药使用、除草剂使用、肥料施用或水施用减少,而没有任何伴随的产量降低。在一些情况下,uv-b补充能够在不降低作物产量的情况下显著降低总体环境影响。
与根据本文所述的方法施用uv-b的种子相比,未经处理的种子可用于确定抗逆性和植物物质中至少一种的改善。在一些情况下,未经处理的种子是未根据本文所述的方法施用uv-b的种子。在一些情况下,未经处理的种子被类似地处理但不施用uv-b。在一些情况下,未经处理的种子包括由于本文所述的至少1、2、3、4、5种或超过5种处理条件而有所不同的种子。
可以确定来自使用本文所述方法施用uv-b的种子的所得秧苗或作物的抗逆性和植物性能中的至少一种的改善。例如,将来自uv-b照射的种子的秧苗与来自未通过本文所述方法使用uv-b照射的种子的秧苗进行比较。在一些情况下,将所得作物中的改善与在类似条件下生长但来自不使用本文所述方法施用uv-b的种子的作物进行比较。类似的条件可能是类似的环境或类似的生长条件。环境因素包括但不限于日照暴露、温度、土壤组成、土壤水分、风、湿度和土壤ph。生长条件包括但不限于浇水量、农药量、除草剂量、杀虫剂量、引发持续时间、发芽持续时间和播种时间。在一些情况下,将所得作物与同时生长的作物进行比较。例如,同时生长的作物生长在邻近或附近的田地上。在一些情况下,将所得作物与先前生长季节的作物进行比较。在一些情况下,将所得作物的产量与有可比性的作物进行比较。产量可包括植物性能和抗逆性中的至少一种的改善。在一些情况下,来自可比较作物的产量是指标准产量。在一些情况下,有可比性的作物是同时生长或经受类似生长条件的作物。
在一些情况下,用如本文所述的uv-b方案照射秧苗。与未经处理的对应秧苗相比,秧苗中的植物性能可导致改善的植物性能。在一些情况下,使用如本文所述的方法改善秧苗的抗逆性。
在一些情况下,改善了使用uv-b照射的秧苗中的植物性能。在一些情况下,改善了用如本文所述的uv-b照射的秧苗中的植物性能,包括黄酮类化合物水平、花色素苷水平、尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸、下胚轴长度、叶绿素水平、叶片面积和根干重中的至少一种。在一些情况下,秧苗中的植物性能是黄酮类化合物水平和花色素苷水平中的至少一种的水平升高。在播种之前,可以测量用如本文所述的uv-b照射的秧苗中的植物性能。
在一些情况下,改善了使用uv-b照射的秧苗中的抗逆性。该秧苗可具有改善的在热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种之后的恢复力。在一些情况下,在热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种之后检查该秧苗。
与未用本文公开的uv-b方案照射的对应秧苗相比,用uv-b照射的秧苗中的植物性能和抗逆性中的至少一种可增加显著的百分比。植物性能和抗逆性中的至少一种可增加约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%。植物性能和抗逆性中的至少一种可增加至少约4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%。植物性能和抗逆性中的至少一种可增加至少5%。植物性能和抗逆性中的至少一种可增加至少10%。植物性能和抗逆性中的至少一种可增加至少30%。植物性能和抗逆性中的至少一种可增加至少50%。
在一些情况下,改善了来自使用uv-b照射的秧苗的所得植物或作物中的植物性能。在一些情况下,改善了来自用本文所述uv-b照射的秧苗的所得植物或作物中的植物性能,包括黄酮类化合物水平、花色素苷水平、尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸、下胚轴长度、叶绿素水平、叶片面积和根干重中的至少一种。在一些情况下,所得植物或作物中的植物性能被测量为改善的质量,包括更长的保质期、对擦伤或收获后处理的抗性、增加的营养价值、改善的味道、改善的形状、改善的颜色、改善的尺寸和改善的质地中的至少一种。可以在播种期间或之后测量来自用本文所述uv-b照射的秧苗的所得植物或作物中的植物性能。在一些情况下,在热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种之后检查所得植物或作物。
在一些情况下,改善了来自使用uv-b照射的秧苗的所得植物或作物中的抗逆性。该植物或作物可具有改善的在热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种之后的恢复力。
与来自未用本文公开的uv-b方案照射的秧苗的对应植物或作物相比,来自uv-b照射的秧苗的所得植物或作物中的植物性能和抗逆性中的至少一种可增加显著的百分比。植物性能和抗逆性中的至少一种可增加约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%。植物性能和抗逆性中的至少一种可增加至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%。植物性能和抗逆性中的至少一种可增加至少5%。植物性能和抗逆性中的至少一种可增加至少10%。植物性能和抗逆性中的至少一种可增加至少30%。植物性能和抗逆性中的至少一种可增加至少50%。
在某些实施方式中,本文提供了用uv-b处理植物或作物的方法。在一些情况下,与未经处理的对应植物或作物相比,如本文所述的方法导致植物或作物中的植物性能改善。植物性能包括但不限于黄酮类化合物水平、花色素苷水平、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量、抗逆性、种子发芽率、更长的保质期、对擦伤或收获后处理的抗性、增加的营养价值、改善的味道、改善的形状、改善的颜色、改善的尺寸和改善的质地。植物性能的改善可增加约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%。在一些情况下,植物性能增加至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%。在一些情况下,植物性能增加至少5%。在一些情况下,植物性能增加至少10%。在一些情况下,植物性能增加至少30%。在一些情况下,植物性能增加至少50%。备选地或组合地,对胁迫的抗逆性或恢复力有所改善。在一些情况下,植物或作物的uv-b照射导致改善的抗逆性或在热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种之后的恢复力。抗逆性的改善可增加约5%-100%、10%-90%、20%-80%、30%-70%、40%-60%、50%-95%、65%-85%或75%-95%。在一些情况下,抗逆性增加至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%。在一些情况下,抗逆性增加至少5%。在一些情况下,抗逆性增加至少10%。在一些情况下,抗逆性增加至少30%。在一些情况下,抗逆性增加至少50%。
用于施用uv-b的装置
在某些实施方式中,本文提供了用于将uv-b施用于植物物质的装置和系统。在一些情况下,该植物物质是种子。在一些情况下,该装置被配置为向种子提供uv-b施用方案。
图35中示出了示例性装置。装置3500包含用于将光施用于目标区域3509的光源3503。在一些情况下,该光源施用富含uv-b的光。在一些情况下,该光源仅施用uv-b。在一些情况下,该光源施用uv-b与其他光的组合。该光源可保持固定或者可以在x、y或z方向中的任何一个方向上移动。该装置进一步包含处理器3505,以用于向光源3503或照明控制器提供信息。该装置进一步包含传感器3507。传感器3507被配置为在uv-b施用期间检测光源的方向性、光源的位置、湿度、压力、温度、剂量、强度或辐照度中的至少一种。
用于施用光的装置和系统可包含至少一个光源。在一些情况下,所述至少一个光源施用不同波长的光。例如,所述至少一个光源被配置为施用uv-b和另一种波长的光,包括但不限于可见光和uv-a。在一些情况下,所述至少一个光源单独施用uv-b。所述至少一个光源可选自发光二极管(led)、激光器、白炽灯泡、气体放电灯泡及其组合。在一些情况下,所述至少一个光源包含一个或多个led。
如本文所述的装置和系统可包含至少一个在uv-b施用期间移动位置的光源。例如,所述至少一个光源可通过在植物物质上方移动来提供uv-b。在一些情况下,该植物物质是种子。在一些情况下,所述至少一个光源在uv-b施用期间改变方向性。在一些情况下,所述至少一个光源在uv-b施用期间改变沿x轴、y轴或z轴的方向。在一些情况下,所述至少一个光源的高度是可调节的。所述至少一个光源的高度可以在种子上方约20mm、40mm、60mm、80mm、100mm、120mm、150mm或200mm处。在一些情况下,该高度在种子上方约20mm-200mm、40mm-150mm、60mm-120mm或80mm-100mm的范围内。在一些情况下,根据种子类型或处理方案调节至少一个光发射器的方向性或位置。
备选地或组合地,装置和系统包含至少一个在uv-b施用期间保持固定的光源。在这样的系统中,包含诸如种子等植物物质的输送机在所述至少一个光源下行进。在一些情况下,该输送机以确定的速率或在确定的持续时间内行进。在一些情况下,该输送机与所述至少一个光源之间的高度为约20mm、40mm、60mm、80mm、100mm、120mm、150mm或200mm。在一些情况下,该高度在约20mm-200mm、40mm-150mm、60mm-120mm或80mm-100mm的范围内。
在一些情况下,本文所述的装置和系统施用确定波长的光。在一些情况下,该装置和系统提供约280nm至约320nm范围内的uv-b。在一些情况下,该装置和系统提供约280nm至约290nm范围内的uv-b。在一些情况下,该装置和系统提供约280nm、约281nm、约282nm、约283nm、约284nm、约285nm、约286nm、约287nm、约288nm、约289nm、约290nm、约291nm、约292nm、约293nm、约294nm、约295nm、约296nm、约297nm、约298nm、约299nm、约300nm、约301nm、约302nm、约303nm、约304nm、约305nm、约306nm、约307nm、约308nm、约309nm、约310nm、约311nm、约312nm、约313nm、约314nm、约315nm、约316nm、约317nm、约318nm、约319nm或约320nm波长处的uv-b。在一些情况下,该装置和系统提供可见光。在一些情况下,该装置和系统提供uv-a。
如本文所述的装置和系统可提供确定剂量的光。例如,该装置和系统提供剂量在约0.1kjm-2-100kjm-2、10kjm-2-90kjm-2、20kjm-2-80kjm-2、30kjm-2-70kjm-2和40kjm-2-50kjm-2范围内的uv-b。在一些情况下,该装置和系统提供具有约10umolm-2s-1-550umolm-2s-1、20umolm-2s-1-500umolm-2s-1、40umolm-2s-1-450umolm-2s-1、45umolm-2s-1-400umolm-2s-1、50umolm-2s-1-350umolm-2s-1、100umolm-2s-1-300umolm-2s-1或100umolm-2s-1-200umolm-2s-1范围内的光子数的可见光。
在一些情况下,装置和系统控制uv-b辐照度。例如,该装置和系统施用约40uwcm-2至约200uwcm-2范围内的uv-b辐照度。在一些情况下,该装置和系统施用至少或约1.5umolm-1s-1、2umolm-1s-1、2.5umolm-1s-1、3umolm-1s-1、3.5umolm-1s-1、4umolm-1s-1、4.5umolm-1s-1、5umolm-1s-1、5.5umolm-1s-1、6umolm-1s-1、6.5umolm-1s-1、7umolm-1s-1、7.5umolm-1s-1、8umolm-1s-1、8.5umolm-1s-1、9umolm-1s-1、9.5umolm-1s-1、10umolm-1s-1或大于10umolm-1s-1的uv-b辐照度。
如本文所述的装置和系统可被配置为提供规定的持续时间的光。uv-b施用的持续时间可包括至少或约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、25小时、26小时、27小时、28小时、29小时、30小时或大于30小时。
在一些情况下,装置和系统被配置为引发并同时将uv-b施用于植物物质。例如,该装置和系统包含用于引发并同时将uv-b施用于植物物质的表面。在一些情况下,用于引发并同时将uv-b施用于植物物质的表面定位于距至少一个光源的一定距离处。在一些情况下,所述至少一个光源在该表面上方至少或约20mm、40mm、60mm、80mm、100mm、120mm、150mm或200mm处。在一些情况下,该表面与所述至少一个光源之间的距离是可调节的。在一些情况下,该距离可根据引发介质的量来调节。在一些情况下,基于引发介质调节处理方案的其他特征,包括但不限于所述至少一个光源的方向性、所述至少一个光源的位置、湿度、压力、温度、剂量、强度和辐照度。
在一些情况下,用于施用光的装置和系统包含照明控制器。该照明控制器可被配置为以确定的方案施用光。例如,该照明控制器控制所发射的光的波长、光的剂量、光施用的持续时间、光的强度、光的辐照度和所发射的光的方向性。在一些情况下,该照明控制器被配置为以规定的剂量、持续时间、强度、辐照度和方向性提供uv-b。在一些情况下,该照明控制器在处理方案期间调节uv-b剂量、持续时间、强度或辐照度。
在一些情况下,装置和系统包括计算机处理器或其使用。在一些情况下,该计算机处理器向照明控制器提供信息。在一些情况下,该计算机处理器包含计算机程序。在一些情况下,该计算机程序包括可在数字处理设备的cpu中执行的一系列指令,该指令被编写以向种子提供uv-b方案。在一些情况下,计算机可读指令被实现为程序模块如功能、特征、应用程序编程接口(api)、数据结构等,用于向种子施用uv-b。
图36中示出了示例性计算机系统。计算机系统3600可被理解为可从介质3611和/或网络端口3605读取指令的逻辑设备,其可以任选地连接至具有固定介质3612的服务器3609。该系统可包括cpu3601、磁盘驱动器3603、可选的输入设备如键盘3615和/或鼠标3616以及可选的监视器3607。可通过示出的通信媒介来实现与本地或远程位置的服务器的数据通信。通信媒介可包括发送和/或接收数据的任何手段。例如,通信媒介可以是网络连接、无线连接或因特网连接。这样的连接可提供经由万维网的通信。可以想到,有关本公开内容的数据可经过这样的网络或连接而传输,以便由用户3622接收和/或查看,如图36中所示。
如本文所述的装置或系统可进一步包含传感器。在一些情况下,该传感器在uv-b施用期间检测光源的方向性、光源的位置、湿度、压力、温度、剂量、强度或辐照度。在一些情况下,该传感器向照明控制器提供信息,使得可以调节光源的方向性、光源的位置、湿度、压力、温度、剂量、强度或辐照度。
转向附图,人们观察到以下内容:
图1描绘了uv-b施用的示意图。
图2描绘了光施用后的黄酮类化合物水平。在种子中于300nm的吸光度下测量uv-b吸收化合物,该种子仅施用可见光(“vis”)或施用286nm的uv-b(“uv”)。在吸水0小时(“t0”)后或吸水后24小时(“t24”)施加可见光或uv-b处理。x轴显示不同的种子处理条件:吸水0小时后的可见光(“vist0”)、吸水24小时后的可见光(“vist24”)和吸水24小时后的uv-b施用(“uvt24”)。y轴显示uv吸收化合物(abs300nmfw-1),并且具有60至180的数值范围。与vist24种子相比,uvt24种子中的黄酮类化合物高18%。与vist0种子相比,uvt24种子中的黄酮类化合物高60%。该图示出了uv-b施用后黄酮类化合物水平的提高。
图3a描绘了光施用后ezmina生菜植物叶中的黄酮类化合物水平。在种子处理之后20天测量每种处理条件下的11-14株植物叶的黄酮类化合物水平。将种子保持在黑暗箔包裹条件下(“对照”),仅施用可见光(“vis”)或施用286nm的uv-b处理(“uv”)。在吸水0小时(“t0”)后或吸水后24小时(“t24”)施加可见光或uv-b处理。x轴显示不同的处理条件:黑暗(“对照”)、吸水0小时后的可见光(“vist0”)、吸水24小时后的可见光(“vist24”)和吸水24小时后的uv-b施用(“uvt24”)。y轴显示黄酮类化合物(任意单位),并且具有1.0至1.4的数值范围。与来自vist0种子的叶片和来自vist24种子的叶片相比,来自uvt24种子的叶片中的黄酮类化合物水平显著更高。该图示出了来自施用uv-b的种子的所得植物物质的黄酮类化合物水平的提高。
图3b描绘了光施用对鲜重的影响。在种子处理后30天测量legacy生菜植物的幼苗鲜重。种子仅施用可见光(“vis”)或施用286nm的uv-b(“uv”)。在吸水0小时(“t0”)后或吸水后24小时(“t24”)施加可见光或uv-b处理。x轴显示不同的种子处理条件:吸水0小时后的可见光(“vist0”)、吸水24小时后的可见光(“vist24”)和吸水24小时后的uv-b施用(“uvt24”)。y轴显示以克(g)为单位的鲜重,并且具有1.0至2.6的数值范围。与vist0种子的植物相比,uvt24种子的植物的鲜重增加17%。该图示出了uv-b施用后植物性能如作物产量的增加。
图4a-4b描绘了uv-b施用对经受干旱胁迫的羽衣甘蓝秧苗的生长的影响。将羽衣甘蓝(brassicaoleraceavar.regal)种子引发并施用uv-b。uv-b施用后,种子在发芽期间经受干旱胁迫。“对照”和“uv-b”种子在水或peg8000中发芽。在72小时的胁迫后,对秧苗重量和胚根长度进行定量。图4a-4b的x轴显示以下种子处理条件:“对照”和“uv-b”。参照图4a,与对照相比,uv-b施用导致秧苗胚根长度增加20%。图4a的y轴显示秧苗胚根长度(mm),并且具有5.0至10.0的数值范围。参照图4b,与对照相比,uv-b施用导致秧苗生物量增加15%。图4b的y轴显示秧苗生物量(g),并且具有10.0至16.0的数值范围。这些图示出了由于uv-b施用导致的秧苗生长的增加。
图5a-5h描绘了uv-b剂量对黄酮类化合物水平的影响。将种子在水中引发16小时,然后施用具有uv-b的可见光(“uv”)或没有uv-b的可见光(“无uv”)。使用13kjm-2或100kjm-2辐照度的剂量。uv-b光由led光源提供,其透射率在280nm处达到峰值。图5a-5h的x轴显示以下种子处理条件:未暴露于uv且未浸入水中的对照样品(“未引发,无uv”)、剂量为13kjm-2的具有uv-b的可见光(“uv13kjm-2”)、没有uv-b的可见光(“无uv13kjm-2”)、剂量为100kjm-2的具有uv-b的可见光(“uv100kjm-2”)以及剂量为100kjm-2的没有uv-b的可见光(“无uv100kjm-2”)。图5a的y轴显示黄酮类化合物(任意单位),并且具有0.80至0.96的数值范围。参照图5a,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别显著提高黄酮类化合物水平。图5b的y轴显示黄酮类化合物(任意单位),并且具有0.78至0.96的数值范围。参照图5b,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别显著提高黄酮类化合物水平。图5c的y轴显示黄酮类化合物(任意单位),并且具有0.89至0.98的数值范围。参照图5c,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别显著提高黄酮类化合物水平。图5d的y轴显示黄酮类化合物(任意单位),并且具有0.94至0.99的数值范围。参照图5d,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别提高黄酮类化合物水平。图5e的y轴显示黄酮类化合物(任意单位),并且具有0.40至0.75的数值范围。参照图5e,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别提高黄酮类化合物水平。图5f的y轴显示黄酮类化合物(任意单位),并且具有0.60至0.95的数值范围。参照图5f,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别提高黄酮类化合物水平。图5g的y轴显示黄酮类化合物(任意单位),并且具有0.60至1.00的数值范围。参照图5g,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别提高黄酮类化合物水平。图5h的y轴显示黄酮类化合物(任意单位),并且具有0.60至1.00的数值范围。参照图5h,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别提高黄酮类化合物水平。这些图证明了uv-b施用剂量后黄酮类化合物水平的提高。
图6a-6d示出了uv-b剂量对花色素苷水平的影响。将种子在水中引发16小时,然后施用具有uv-b的可见光(“uv”)或没有uv-b的可见光(“无uv”)。使用13kjm-2或100kjm-2辐照度的剂量。13kjm-2剂量的种子处理持续时间为9小时。100kjm-2剂量的种子处理持续时间为21小时。uv-b光由led光源提供,其透射率在280nm处达到峰值。图6a-6d的x轴显示不同的种子处理条件:未暴露于uv且未浸入水中的对照样品(“未引发,无uv”)、剂量为13kjm-2的具有uv-b的可见光(“uv13kjm-2”)、没有uv-b的可见光(“无uv13kjm-2”)、剂量为100kjm-2的具有uv-b的可见光(“uv100kjm-2”)以及剂量为100kjm-2的没有uv-b的可见光(“无uv100kjm-2”)。图6a的y轴显示花色素苷(任意单位),并且具有0.094至0.114的数值范围。参照图6a,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别提高花色素苷水平。图6b的y轴显示花色素苷(任意单位),并且具有0.060至0.095的数值范围。参照图6b,与无uv13kjm-2种子相比,13kjm-2uv-b剂量提高花色素苷水平。图6c的y轴显示花色素苷(任意单位),并且具有0.060至0.085的数值范围。参照图6c,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2uv-b剂量分别提高花色素苷水平。图6d的y轴显示花色素苷(任意单位),并且具有0.060至0.085的数值范围。参照图6d,与无uv100kjm-2种子相比,100kjm-2uv-b剂量提高花色素苷水平。这些图证明了uv-b施用剂量后花色素苷水平的提高。
图7示出了光施用对秧苗干重的影响。将种子在水中引发16小时,然后使用其中透射率在280nm处达到峰值的led光源在没有uv-b(“无uv”,黑条)或具有uv-b(“uv,”散列条)的情况下处理9小时。使用多种可见光辐照度,包括:20umolm-2s-1、50umolm-2s-1和400umolm-2s-1。x轴显示以下处理条件:其中种子未浸入水中但用可见光和uv-b处理的未引发的种子(“np”)、保持在无可见光下的种子(“黑暗”)、可见光辐照度为20umolm-2s-1(“20umolm-2s-1”)、可见光辐照度为50umolm-2s-1(“50umolm-2s-1”)以及可见光辐照度为400umolm-2s-1(“400umolm-2s-1”)。y轴显示秧苗干重(dw),并且具有0至0.5的数值范围。该图示出了uv-b与可见光的共同施用导致秧苗干重的增加。
图8a-8g示出了光施用后对玉米种子(zeamays)的植物性能的影响。图8a-8g的x轴显示以下种子处理:无uv(“对照”)和uv-b施用(“uv-b”)。图8a的y轴显示以克(g)为单位的整个穗轴干重,并且具有160至220的数值范围。参照图8a,uv-b照射使以克为单位的整个穗轴干重显著增加12%。图8b的y轴显示以克(g)为单位的每个穗轴的籽粒总干重,并且具有130至180的数值范围。参照图8b,uv-b照射使以克为单位的每个穗轴的籽粒总干重显著增加9%。图8c的y轴显示以克(g)为单位的根干重,并且具有15至35的数值范围。参照图8c,uv-b照射使根干重显著增加43%。图8d的y轴显示以克(g)为单位的秸秆鲜重,并且具有220至380的数值范围。参照图8d,uv-b照射使秸秆鲜重显著增加24%。图8e的y轴显示每个穗轴的籽粒数目,并且具有415至475的数值范围。参照图8e,uv-b照射使每个穗轴的籽粒数目显著增加4%。图8f的y轴显示每个穗轴的籽粒行数,并且具有24至29的数值范围。参照图8f,uv-b照射使每个穗轴的籽粒行数增加2.5%。图8g的y轴显示以克(g)为单位的单个籽粒干重,并且具有0.30至0.40的数值范围。参照图8g,uv-b照射使单个籽粒干重显著增加6%。这些图证明uv-b施用提高了植物生产力。
图9描绘了在准备光施用时清洗种子的方法。
图10描绘了种子在托盘上的定位以用于光施用。
图11示出了用于放置种子托盘的发光二极管(led)面板的布置。
图12示出了处理条件对生菜的幼苗鲜重的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将球生菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)中引发。将uv-b在10℃下的生长室中施用0小时、8小时、21小时或27小时。uv-b辐照度以40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)施用。“对照”(黑条)是指无uv-b。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。在uv-b施用期间,将种子定位在潮湿的滤纸上。x轴显示uv-b处理持续时间:0小时、8小时、21小时和27小时。y轴显示幼苗鲜重(g/植物),并且具有0.2至0.6的数值范围。与对照相比,高uv-b辐照度施用8小时导致幼苗鲜重显著增加约19%。与对照相比,中等uv-b辐照度施用21小时导致幼苗鲜重显著增加约42%。与对照相比,高uv-b辐照度施用21小时导致幼苗鲜重显著增加约38%。该图证明了包括引发以及施用多种辐照度和持续时间的uv-b的处理条件改善了植物性能,如幼苗鲜重。
图13示出了处理条件对生菜中的叶绿素水平的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将球生菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)中引发。将uv-b在10℃下的生长室中施用0小时、8小时、21小时或27小时。uv-b辐照度以40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)施用。“对照”(黑条)是指无uv-b处理,其中种子浸入引发介质中但未接受uv。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。在uv-b施用期间,将种子定位在潮湿的滤纸上。x轴显示uv-b处理持续时间:0小时、8小时、21小时和27小时。y轴显示叶绿素(相对单位),并且具有15至27的数值范围。该图证明了包括引发以及施用多种辐照度和持续时间的uv-b的处理条件可改善植物性能,如叶绿素水平。
图14示出了处理条件对生菜中的黄酮类化合物水平的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将球生菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)中引发。将uv-b在10℃下的生长室中施用0小时、8小时、21小时或27小时。uv-b辐照度以40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)施用。“对照”(黑条)是指无uv-b处理,其中种子浸入引发介质中但未接受uv。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。在uv-b施用期间,将种子定位在潮湿的滤纸上。x轴显示uv-b处理持续时间:0小时、8小时、21小时和27小时。y轴显示黄酮类化合物(相对单位),并且具有0.4至0.65的数值范围。与对照相比,低uv-b辐照度施用8小时导致黄酮类化合物水平显著增加约14%。该图证明了包括引发以及施用多种辐照度和持续时间的uv-b的处理条件可改善植物性能,如黄酮类化合物水平。
图15描绘了处理条件对青花菜的幼苗鲜重的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将第一组青花菜种子在蒸馏水(“水”)中引发。将第二组青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)(“渗透”)中引发。两组青花菜种子均引发8小时、18小时、19.5小时、24小时、27小时或44小时。两组青花菜种子均在22℃下的生长室中施用100uwcm-2uv-b辐照度。在uv-b施用期间,将种子浸没在引发介质中。x轴显示吸收或引发持续时间:8小时、18小时、19.5小时、24小时、27小时和44小时。处理条件包括以下:种子在peg中引发且无uv-b(“渗透-对照”,白条)、种子在peg中引发且施用uv-b(“渗透-uv”,黑条)、种子在蒸馏水中引发且无uv-b(“水-对照”,方格条)以及种子在蒸馏水中引发且施用uv-b(“水-uv”,水平散列条)。y轴显示幼苗鲜重(g/植物),并且具有0至200的数值范围。与渗透-对照相比,渗透-uv种子引发8小时表现出幼苗鲜重减少约34%的显著性差异。渗透-对照与水-对照之间存在显著性差异。该图证明了包括多种引发条件以及施用uv-b的处理条件影响植物性能,如幼苗鲜重。
图16描绘了处理条件对青花菜的幼苗干重的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将第一组青花菜种子在蒸馏水(“水”)中引发。将第二组青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)(“渗透”)中引发。两组青花菜种子均引发8小时、18小时、19.5小时、24小时、27小时或44小时。两组青花菜种子均在22℃下的生长室中施用100uwcm-2uv-b辐照度。在uv-b施用期间,将种子浸没在引发介质中。x轴显示吸收持续时间:8小时、18小时、19.5小时、24小时、27小时和44小时。处理条件包括以下:种子在peg中引发且无uv-b(“渗透-对照”,白条)、种子在peg中引发且施用uv-b(“渗透-uv”,黑条)、种子在蒸馏水中引发且无uv-b(“水-对照”,方格条)以及种子在蒸馏水中引发且施用uv-b(“水-uv”,水平散列条)。y轴显示幼苗干重(g/植物),并且具有0至15的数值范围。与渗透-对照相比,渗透-uv种子引发8小时表现出幼苗干重减少约31%的差异。渗透-对照与水-对照之间存在显著性差异。该图证明了包括多种引发条件以及施用uv-b的处理条件影响植物性能,如幼苗干重。
图17描绘了处理条件对青花菜的根干重的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将第一组青花菜种子在蒸馏水(“水”)中引发。将第二组青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)(“渗透”)中引发。两组青花菜种子均引发8小时、18小时、19.5小时、24小时、27小时或44小时。两组青花菜种子均在22℃下的生长室中施用100uwcm-2uv-b辐照度。在uv-b施用期间,将种子浸没在引发介质中。x轴显示吸收持续时间:8小时、18小时、19.5小时、24小时、27小时和44小时。处理条件包括以下:种子在peg中引发且无uv-b(“渗透-对照”,白条)、种子在peg中引发且施用uv-b(“渗透-uv”,黑条)、种子在蒸馏水中引发且无uv-b(“水-对照”,方格条)以及种子在蒸馏水中引发且施用uv-b(“水-uv”,水平散列条)。y轴显示根干重(g/植物),并且具有0至0.6的数值范围。与渗透-对照相比,渗透-uv种子引发8小时表现出根干重减少约27%的差异。渗透-对照与水-对照之间也存在显著性差异。该图证明了包括多种引发条件以及施用uv-b的处理条件影响植物性能,如根干重。
图18描绘了处理条件对青花菜中的叶绿素水平的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将第一组青花菜种子在蒸馏水(“水”)中引发。将第二组青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)(“渗透”)中引发。两组青花菜种子均引发8小时、18小时、19.5小时、24小时、27小时或44小时。两组青花菜种子均在22℃下的生长室中施用100uwcm-2uv-b辐照度。在uv-b施用期间,将种子浸没在引发介质中。x轴显示吸收持续时间:8小时、18小时、19.5小时、24小时、27小时和44小时。处理条件包括以下:种子在peg中引发且无uv-b(“渗透-对照”,白条)、种子在peg中引发且施用uv-b(“渗透-uv”,黑条)、种子在蒸馏水中引发且无uv-b(“水-对照”,方格条)以及种子在蒸馏水中引发且施用uv-b(“水-uv”,水平散列条)。y轴显示叶绿素(相对单位),并且具有36至44的数值范围。在8小时,渗透-对照的叶绿素水平比水-对照或水-uv显著更高。该图证明了包括多种引发条件以及施用uv-b的处理条件影响植物性能,如叶绿素水平。
图19描绘了处理条件对青花菜中的黄酮类化合物水平的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将第一组青花菜种子在蒸馏水(“水”)中引发。将第二组青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)(“渗透”)中引发。两组青花菜种子均引发8小时、18小时、19.5小时、24小时、27小时或44小时。两组青花菜种子均在22℃下的生长室中施用100uwcm-2uv-b辐照度。在uv-b施用期间,将种子浸没在引发介质中。x轴显示吸收持续时间:8小时、18小时、19.5小时、24小时、27小时和44小时。处理条件包括以下:种子在peg中引发且无uv-b(“渗透-对照”,白条)、种子在peg中引发且施用uv-b(“渗透-uv”,黑条)、种子在蒸馏水中引发且无uv-b(“水-对照”,方格条)以及种子在蒸馏水中引发且施用uv-b(“水-uv”,水平散列条)。y轴显示黄酮类化合物(相对单位),并且具有0至0.8的数值范围。与渗透引发相比,水引发之间的黄酮类化合物水平存在显著性差异。该图证明了包括多种引发条件以及施用uv-b的处理条件改善了植物性能,如黄酮类化合物水平。
图20描绘了处理条件对青花菜的幼苗鲜重的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在蒸馏水中引发,然后在10℃下的生长室中施用uv-b18小时、20小时、21小时、24小时、27小时或28小时。在uv-b施用期间,将第一组种子放置在潮湿的滤纸上(“漂浮”)。在uv-b施用期间,将第二组种子完全浸没在引发介质中(“浸没”)。uv-b以100uwcm-2uv-b辐照度施用。x轴显示多种uv-b处理持续时间:18小时、20小时、21小时、24小时、27小时或28小时。处理条件包括以下:种子放置在潮湿的滤纸上然后无uv-b(“漂浮-对照”,白条)、种子放置在潮湿的滤纸上然后施用uv-b(“漂浮-uv”,黑条)、种子浸没在引发介质中然后无uv-b(“浸没-对照”,方格条)以及种子浸没在引发介质中然后施用uv-b(“浸没-uv”,水平散列条)。y轴显示幼苗鲜重(g/植物),并且具有0至140的数值范围。与漂浮-对照种子相比,施用uv-b达20小时的漂浮-uv种子表现出幼苗鲜重显著增加约56%。与浸没-对照种子相比,施用uv-b达21小时的浸没-uv种子表现出幼苗鲜重显著增加约30%。在28小时,漂浮-对照与浸没-对照之间存在差异。该图示出了包括多种种子定位以及施用uv-b的处理条件改善了植物性能,如幼苗鲜重。
图21描绘了处理条件对青花菜的幼苗干重的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在蒸馏水中引发,然后在10℃下的生长室中施用uv-b18小时、20小时、21小时、24小时、27小时或28小时。在uv-b施用期间,将第一组种子放置在潮湿的滤纸上(“漂浮”)。在uv-b施用期间,将第二组种子完全浸没在引发介质中(“浸没”)。uv-b以100uwcm-2uv-b辐照度施用。x轴显示多种uv-b处理持续时间:18小时、20小时、21小时、24小时、27小时或28小时。处理条件包括以下:种子放置在潮湿的滤纸上然后无uv-b(“漂浮-对照”,白条)、种子放置在潮湿的滤纸上然后施用uv-b(“漂浮-uv”,黑条)、种子浸没在引发介质中然后无uv-b(“浸没-对照”,水平散列条)以及种子浸没在引发介质中然后施用uv-b(“浸没-uv”,方格条)。y轴显示幼苗干重(g/植物),并且具有0至12的数值范围。与漂浮-对照种子相比,施用uv-b达20小时的漂浮-uv种子表现出幼苗干重显著增加约56%。与浸没-对照种子相比,施用uv-b达21小时的浸没-uv种子表现出幼苗干重显著增加约41%。在28小时,浸没-uv与漂浮-对照之间存在显著性差异。该图示出了包括多种种子定位以及施用uv-b的处理条件改善了植物性能,如幼苗干重。
图22描绘了处理条件对青花菜的根干重的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在蒸馏水中引发,然后在10℃下的生长室中施用uv-b18小时、20小时、21小时、24小时、27小时或28小时。在uv-b施用期间,将第一组种子放置在潮湿的滤纸上(“漂浮”)。在uv-b施用期间,将第二组种子完全浸没在引发介质中(“浸没”)。uv-b以100uwcm-2uv-b辐照度施用。x轴显示多种uv-b处理持续时间:18小时、20小时、21小时、24小时、27小时或28小时。处理条件包括以下:种子放置在潮湿的滤纸上且未施用uv-b(“漂浮-对照”,白条)、种子放置在潮湿的滤纸上并施用uv-b(“漂浮-uv”,黑条)、种子浸没在引发介质中且未施用uv-b(“浸没-对照”,方格条)以及种子在蒸馏水中引发并施用uv-b(“浸没-uv”,水平散列条)。y轴显示根干重(g/植物),并且具有0.00至0.50的数值范围。与漂浮-对照相比,施用uv-b达20小时的漂浮-uv种子表现出根干重增加约50%。与浸没-对照相比,施用uv-b达21小时的浸没-uv种子表现出根干重显著增加约32%。该图示出了包括多种种子位置以及施用uv-b的处理条件改善了植物性能,如根干重。
图23描绘了处理条件对青花菜中的叶绿素水平的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在蒸馏水中引发,然后在10℃下的生长室中施用uv-b18小时、20小时、21小时、24小时、27小时或28小时。在uv-b施用期间,将第一组种子放置在潮湿的滤纸上(“漂浮”)。在uv-b施用期间,将第二组种子完全浸没在引发介质中(“浸没”)。uv-b以100uwcm-2uv-b辐照度施用。x轴显示多种uv-b处理持续时间:18小时、20小时、21小时、24小时、27小时或28小时。处理条件包括以下:种子放置在潮湿的滤纸上且未施用uv-b(“漂浮-对照”,白条)、种子放置在潮湿的滤纸上并施用uv-b(“漂浮-uv”,黑条)、种子浸没在引发介质中且未施用uv-b(“浸没-对照”,方格条)以及种子在蒸馏水中引发并施用uv-b(“浸没-uv”,水平散列条)。y轴显示叶绿素(相对单位),并且具有32至44的数值范围。与漂浮-对照相比,施用uv-b达20小时的漂浮-uv种子表现出叶绿素水平显著增加约8%。浸没-uv与漂浮-对照之间也存在显著差异。该图示出了包括多种种子定位以及施用uv-b的处理条件改善了植物性能,如叶绿素水平。
图24描绘了处理条件对青花菜中的黄酮类化合物水平的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在蒸馏水中引发,然后在10℃下的生长室中施用uv-b18小时、20小时、21小时、24小时、27小时或28小时。在uv-b施用期间,将第一组种子放置在潮湿的滤纸上(“漂浮”)。在uv-b施用期间,将第二组种子完全浸没在引发介质中(“浸没”)。uv-b以100uwcm-2uv-b辐照度施用。x轴显示多种uv-b处理持续时间:18小时、20小时、21小时、24小时、27小时或28小时。处理条件包括以下:种子放置在潮湿的滤纸上且未施用uv-b(“漂浮-对照”,白条)、种子放置在潮湿的滤纸上并施用uv-b(“漂浮-uv”,黑条)、种子浸没在引发介质中且未施用uv-b(“浸没-对照”,方格条)以及种子在蒸馏水中引发并施用uv-b(“浸没-uv”,水平散列条)。y轴显示黄酮类化合物(相对单位),并且具有0.30至0.55的数值范围。与漂浮-对照相比,施用uv-b达24小时的漂浮-uv种子表现出黄酮类化合物水平增加约14%。该图示出了包括多种种子定位以及施用uv-b的处理条件改善了植物性能,如黄酮类化合物水平。
图25描绘了处理条件对青花菜的幼苗鲜重的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)中引发。种子在10℃下的生长室中施用uv-b0小时、8小时、21小时或27小时。uv-b辐照度以40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)施用。“对照”(黑条)是指无uv-b处理,其中种子浸入引发介质中但未接受uv。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。在uv-b施用期间,将种子放置在潮湿的滤纸上。x轴显示uv-b处理持续时间:0小时、8小时、21小时和27小时。y轴显示幼苗鲜重(g/植物),并且具有0.0至0.4的数值范围。与对照相比,中等uv-b辐照度施用21小时导致幼苗鲜重显著增加约22%。与对照相比,高uv-b辐照度施用21小时导致幼苗鲜重显著增加约56%。与对照相比,高uv-b辐照度施用27小时导致幼苗鲜重显著增加约27%。该图图示了来自被引发并施用uv-b照射的种子的植物性能如幼苗鲜重得到改善。
图26描绘了处理条件对青花菜的下胚轴长度(mm/植物)的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)中引发。种子在10℃下的生长室中施用uv-b0小时、8小时、21小时或27小时。uv-b辐照度以40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)施用。“对照”(黑条)是指无uv-b处理,其中种子浸入引发介质中但未接受uv。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。在uv-b施用期间,将种子放置在潮湿的滤纸上。x轴显示uv-b处理持续时间:0小时、8小时、21小时和27小时。y轴显示下胚轴长度,并且具有11至15的数值范围。与对照相比,中等uv-b辐照度施用8小时导致下胚轴长度减少约13%的显著性差异。与对照相比,高uv-b辐照度施用21小时导致下胚轴长度显著增加约10%。与对照相比,中等uv-b辐照度施用27小时导致下胚轴长度显著增加约6%。与对照相比,高uv-b辐照度施用27小时导致下胚轴长度显著增加约17%。该图图示了来自被引发并施用uv-b照射的种子的植物性能如下胚轴长度得到改善。
图27描绘了处理条件对青花菜的叶片面积(cm2/植物)的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)中引发。种子在10℃下的生长室中施用uv-b0小时、8小时、21小时或27小时。uv-b辐照度以40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)施用。“对照”(黑条)是指无uv-b处理,其中种子浸入引发介质中但未接受uv。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。在uv-b施用期间,将种子放置在潮湿的滤纸上。x轴显示uv-b处理持续时间:0小时、8小时、21小时和27小时。y轴显示叶片面积(cm2/植物),并且具有0至12的数值范围。与对照相比,中等uv-b辐照度施用21小时导致叶片面积显著增加约27%。与对照相比,高uv-b辐照度施用21小时导致叶片面积显著增加约67%。与对照相比,高uv-b辐照度施用27小时导致叶片面积显著增加约26%。该图图示了来自被引发并施用uv-b照射的种子的植物性能如叶片面积得到改善。
图28描绘了处理条件对青花菜的叶绿素水平的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在蒸馏水中的-1.25bar聚乙二醇(peg)中引发。种子在10℃下的生长室中施用uv-b0小时、8小时、21小时或27小时。uv-b辐照度以40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)施用。“对照”(黑条)是指无uv-b处理,其中种子浸入引发介质中但未接受uv。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。在uv-b施用期间,将种子放置在潮湿的滤纸上。x轴显示uv-b处理持续时间:0小时、8小时、21小时和27小时。y轴显示叶绿素(相对单位),并且具有19至34的数值范围。与对照相比,高uv-b辐照度施用27小时导致叶绿素减少约13%。该图图示了来自被引发并施用uv-b照射的种子的植物性能如叶绿素得到改善。
图29描绘了处理条件对青花菜的黄酮类化合物水平的影响,该处理条件包括引发、温度、uv-b剂量、uv-b施用的持续时间和种子位置。将青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)中引发。种子在10℃下的生长室中施用uv-b0小时、8小时、21小时或27小时。uv-b辐照度以40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)施用。“对照”(黑条)是指无uv-b处理,其中种子浸入引发介质中但未接受uv。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。在uv-b施用期间,将种子放置在潮湿的滤纸上。x轴显示uv-b处理持续时间:0小时、8小时、21小时和27小时。y轴显示黄酮类化合物(相对单位),并且具有1.2至1.7的数值范围。与对照相比,高uv-b辐照度施用8小时导致黄酮类化合物减少约15%的显著性差异。该图图示了来自被引发并施用uv-b照射的种子的植物性能如黄酮类化合物水平得到改善。
图30描绘了uv-b施用对生菜叶中次级代谢物水平的影响。将生菜种子引发并施用uv-b(“uv-b”,黑条)。对照种子是被引发但未施用uv-b的种子(“对照”,白条)。未引发的种子是从同一种子批次生长但未被引发且未施用uv-b的种子(“未引发”,水平散列条)。在播种后45天对2-3真叶期的叶片进行取样,以使用dualex光学传感器测定叶的黄酮类化合物水平(相对单位)。图30的y轴描绘了黄酮类化合物(相对单位),并且具有0.46至0.64的数值范围。参照图30,与来自未经uv-b处理的种子(“对照”,白条)的植物和来自无uv-b且未引发的种子(“未引发”,水平散列条)的植物相比,来自施用uv-b的种子(“uv-b”,黑条)的植物表现出黄酮类化合物显著增加。该图示出了种子的uv-b施用导致所得植物中保护性次级代谢物增加。
图31描绘了uv-b施用对青花菜茎伸长的影响。将青花菜种子引发并施用uv-b(“uv-b”,黑条)。对照种子是被引发但未施用uv-b的种子(“对照”,白条)。未引发的种子是从同一种子批次生长但未被引发且未施用uv-b的种子(“未引发”,水平散列条)。在播种后45天对植物下胚轴进行评估。图31的y轴显示下胚轴长度(mm/植物),并且具有8至15的数值范围。参照图31,与来自未经uv-b处理的种子(“对照”,白条)的植物和来自无uv-b且未引发的种子(“未引发”,水平散列条)的植物相比,来自施用uv-b的种子(“uv-b”,黑条)的青花菜植物表现出下胚轴长度显著减小。该图示出了种子的uv-b施用的结果影响下胚轴伸长。
图32示出了uv-b施用后的生菜植物生物量。将生菜种子引发并施用uv-b(“uv-b”,黑条)。对照种子是被引发但未施用uv-b的种子(“对照”,白条)。未引发的种子是从同一种子批次生长但未被引发且未施用uv-b的种子(“未引发,水平散列条”)。在播种后45天收获植物,以测量幼苗鲜重。图32的y轴显示植物鲜重,并且具有0至0.6的数值范围。参照图32,与来自未经uv-b处理的种子(“对照”,白条)的植物和来自无uv-b且未引发的种子(“未引发”,水平散列条)的植物相比,从施用uv-b的种子(“uv-b”,黑条)生长的生菜植物的植物鲜重显著增加。该图示出了种子的uv-b施用导致所得植物中植物生物量增加。
图33a-33b描绘了uv-b施用对玉米秧苗生长的影响。将玉米种子(zeamays)引发并施用uv-b(“uv-b”,黑条)。对照种子是被引发但未施用uv-b的种子(“对照”,白条)。在4周龄时收获秧苗。图33a的y轴描绘了秧苗干重,并且具有0.0至0.2的数值范围。参照图33a,与来自未经uv-b处理的种子(“对照”,白条)的植物相比,来自施用uv-b的玉米种子(“uv-b”,黑条)的秧苗干重增加26%。图33b的y轴描绘了根干重,并且具有0.0至0.2的数值范围。参照图33b,与来自未经uv-b处理的种子(“对照”,白条)的植物相比,来自施用uv-b的玉米种子(“uv-b”,黑条)的根干重(克,y轴)增加28%。该图示出了种子的uv-b施用导致所得秧苗的生长增加。
图34描绘了uv-b施用对生菜秧苗中的气孔阻力的影响。将生菜种子引发并施用uv-b(“uv-b”,黑条)。对照种子是被引发但未施用uv-b的种子(“对照”,白条)。在4周时,来自施用uv-b的种子和对照种子的秧苗经受11天的充分浇水或干旱条件。图34的y轴显示气孔阻力(s.cm-1),并且具有0.0至7.0的数值范围。参照图34,来自施用uv-b的种子(“uv-b”,黑条)的秧苗在充分浇水的条件下表现出增加的气孔阻力。该图示出了uv-b施用导致水分利用效率提高。
图35描绘了用于施用uv-b的示例性装置。
图36描绘了计算机系统。
定义
除非另有定义,否则本文使用的所有技术和科学术语均具有与本公开内容所属领域的技术人员通常理解的含义相同的含义。本文提及的所有专利和出版物均通过引用并入本文。
如本说明书和权利要求书中所用,除非上下文另有明确说明,否则单数形式“一个”、“一种”和“该”包括复数指代。
术语“包括”用于表示“包括但不限于”。“包括”和“包括但不限于”可互换使用。
如本文所用的术语“包含”旨在指开放式集合,使得‘包含’某元素的权利要求或列表不排除未列出的另外的元素。
如本文所用的术语“用于播种的种子”是指旨在用于种植来生长任何形式的植物生命或作物以供随后使用(通常但不仅仅是用于人类和动物消耗)和/或在此之前的任何胚性植物。根据本公开内容,可以使用基本上任何类型的种子,其中如美国专利号8,001,722中所指出的,目前全球已知有约35,000种。结果表明种子的uv-b处理改善了可扩展至任何植物物种的植物性能。
种子的一些非限制性实例是农业或观赏植物的种子,如生菜、豆类、青花菜、卷心菜、胡萝卜、花椰菜、黄瓜、甜瓜、洋葱、豌豆、胡椒、南瓜、菠菜、西葫芦、甜玉米、番茄、西瓜、苜蓿、油菜、玉米、棉花、高粱、大豆、甜菜、小麦、薄荷、向日葵或其他农业或观赏植物相关的植物物种。
术语“植物物质”是指种子、秧苗、整株植物、果实、叶、根、插条、纤匐枝或任何其他的植物物质及其后代。
术语“种子”是指封闭在保护性外层覆盖物中的胚性植物。种子的形成是种子植物(种子植物类,包括裸子植物和被子植物)的繁殖过程的一部分。种子是在花粉受精和在母株内部一定程度生长后,成熟胚珠的产物。胚芽由合子发育而成,并且种皮由胚珠的珠被发育而成。
术语“种子发芽”是指种子胚芽发育成秧苗的过程。它涉及导致生长的代谢途径的激活,以及胚根或种子根和胚芽或幼苗的出现。一般而言,种子发芽通过分层启动,分层根据其原始生态环境在植物物种之间有所不同。通常,但并非一致地,通过涉及吸水、滞后期和胚根出现的三阶段过程来触发种子发芽。种子发芽可受环境条件的影响,包括但不限于水、氧气、温度和光。
如本文所用的术语“植物性能”是指恢复力和生长中的至少一种的改善。如本文所用,恢复力涉及生物或非生物环境胁迫,其可在收获之前或之后影响种子、秧苗、所得植物、所得作物。“生长”通常是指在没有非生物或生物胁迫的情况下的性能,例如在健康或“最佳情况”生长条件下的性能。人们观察到,根据生长条件,提高恢复力和改善生长均可导致产量增加,这取决于生长条件。人们观察到,相对于由未经处理的种子产生的不依赖生长条件的植物,生长和恢复力的改善具有提高可收获作物物质的产量的效果。在一些情况下,植物性能还指提高可收获作物物质的质量,使得即使更粗略定义的产量不受影响,每单位产量的植物价值提高。改善的胁迫恢复力的一些非限制性实例是改善的抗旱性、盐胁迫、移植效应(transplantationshock)、长期抗逆性、高可见光胁迫、害虫胁迫、真菌或细菌胁迫,或其他疾病相关胁迫。在一些情况下,术语“作物生产力”可与“植物性能”互换使用。
如本文所用的术语“长期抗逆性”是指植物在作物生产期间承受一种或多种胁迫以及允许在收获时有期望的植物产量和/或质量的能力。如何测量提高的产量的一些非限制性实例包括与其中未用uv-b处理用于播种的种子的可收获作物物质相比,可收获作物物质如生菜叶、大豆、番茄果实的重量。如何测量提高的产量的其他实例包括幼苗鲜重或整株植物干重,由处理方法产生的种子的发芽的改善,以及所得植物的水分利用效率的提高。在一些情况下,提高的质量被评估为对作物上瑕疵(内部或表面上,通常来自虫类)的缺乏,改善的保质期,提高的对擦伤或其他收获后处理的抗性,畸形的缺乏,不规则形状的缺乏,不规则尺寸的缺乏,改善的味道、尺寸、形状、颜色和质地中的至少一种的定量或定性评估。本公开内容的优点在于观察到胁迫抗性和植物产量两者(通常这些性状可以以相反的关系起作用,其中以产量为代价实现抗性——如用uv-c处理所看到的)。
如本文所用的术语“紫外(uv)照射”是指波长比可见光短但比x射线长并且在10nm至400nm(对应于3ev至124ev)范围之间的电磁辐射。uv辐射光谱被认为是人类不可见的,因此有别于在约400nm至700nm的光谱中的可见光。
如本文所用的术语“uv-b辐射”是指尤其是在320nm至280nm的波段内(本文描述为uv-b范围)的辐射。这区别于uv-c波段(280nm至100nm)和uv-a波段(400nm至320nm)。它也应该区别于自然光,该自然光尽管提供uv-b辐射,但还包括其他uv辐射。在一些情况下,uv-b辐射通过led灯进行施用。
如本文所用的术语“可收获作物物质”是指可以被收获以用于后续目的或者人类或动物消耗的来自植物的任何物质。通常,作物物质是收获的种子,其作为食物被消耗或用于后续种植或育种目的。收获的物质包括但不限于水果、蔬菜、树、灌木、草、草本植物以及上述作物物质中的任何一种的提取物或组分。在一些情况下,本公开内容包括实际收获的物质,或用于构建植物性能而不进行任何收获的物质。并非意图耕种的物质的非限制性实例是森林再生。可收获作物物质的一些非限制性实例是生菜、豆类、青花菜、卷心菜、胡萝卜、花椰菜、黄瓜、甜瓜、洋葱、豌豆、胡椒、南瓜、菠菜、西葫芦、甜玉米、番茄、西瓜、苜蓿、油菜、玉米、棉花、高粱、大豆、甜菜、小麦及其组合。
“果实”是指植物的任何含有种子的器官。
如本文所用的术语“黄酮类化合物”是指一类植物次级代谢物,其具有由两个苯环和杂环(c6-c3-c6)组成的15碳骨架的一般结构。在一些情况下,黄酮类化合物与胁迫抗性有关,使得其积累水平的增加与植物胁迫抗性的增加相对应。
术语“分层”、“吸收”、“引发”或语法等同语在本文中可互换使用。这些术语是指采取步骤在休眠种子上引发发芽,例如通过将种子浸入水中以使胚芽吸收或摄取水,其使得胚芽很好地分裂种皮。种皮的性质可决定水能够多快地渗透并随后引发发芽。吸收速率可取决于种皮的渗透性、环境中的水量以及种子与水源的接触面积。
术语“改善的作物产量”、“改善的生长”或“改善的植物性能”在本文中可互换使用。它们是指可具有更大的果实、更大的茎、更大的叶、更大的花或上述任何组合的植物。扩大的植物的组织比野生型植物的组织大至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%、40%、50%、60%、70%、80%、90%、99%或更大。
术语“光强度”在本文中是指对本文所述的光的度量,
包括但不限于辐射强度、发光强度、辐照度、辐亮度、强度、亮度(brightness)、光亮度(luminance)、光度测定和辐射测量。
术语“辐照度”是指以瓦/平方米(w/m2)或微瓦/平方厘米(uw/cm2)测量的辐射量。
术语“辐射亮度”是指强度(w·sr-1·m-2)。
术语“标准方案”是指行业标准。
如本文所用的术语“约”意指跨越低于数字的10%至高于数字的10%的范围。
如本文关于范围所用的术语“约”是指低于所列范围的最低值的10%至高于所列范围的最高值的10%。
如本文关于波长所用的术语“约”是指低于数字的1%至高于数字的1%。
编号的实施方式
编号实施方式1包括一种用于改善植物性能和抗逆性中的至少一种的方法,其包括:(a)使用引发介质引发种子;以及(b)同时施用富含uv-b的光。编号实施方式2包括编号实施方式1所述的方法,其中所述引发介质是水。编号实施方式3包括编号实施方式1-2所述的方法,其中所述引发介质是聚乙二醇。编号实施方式4包括编号实施方式1-3所述的方法,其中将所述种子浸没在所述引发介质中。编号实施方式5包括编号实施方式1-4所述的方法,其中施用光在生长室中进行。编号实施方式6包括编号实施方式1-5所述的方法,其中所述生长室保持在至多40℃。编号实施方式7包括编号实施方式1-6所述的方法,其中所述生长室保持在约22℃。编号实施方式8包括编号实施方式1-7所述的方法,其中所述生长室保持在约10℃。编号实施方式9包括编号实施方式1-8所述的方法,其中uv-b的辐照度为至多300uwcm-2。编号实施方式10包括编号实施方式1-9所述的方法,其中uv-b的辐照度在约40uwcm-2至约200uwcm-2的范围内。编号实施方式11包括编号实施方式1-10所述的方法,其中uv-b的辐照度为约40uwcm-2。编号实施方式12包括编号实施方式1-11所述的方法,其中uv-b的辐照度为约100uwcm-2。编号实施方式13包括编号实施方式1-12所述的方法,其中uv-b的辐照度为约200uwcm-2。编号实施方式14包括编号实施方式1-13所述的方法,其中引发所述种子并同时施用uv-b的持续时间在约1小时至约30小时、约2小时至约27小时、约3小时至约25小时、约4小时至约24小时、约5小时至约22小时或约6小时至约21小时的范围内。编号实施方式15包括编号实施方式1-14所述的方法,其中引发所述种子并同时施用uv-b的持续时间为约20小时。编号实施方式16包括编号实施方式1-15所述的方法,其中引发所述种子并同时施用uv-b的持续时间为约24小时。编号实施方式17包括编号实施方式1-16所述的方法,其中引发所述种子并同时施用uv-b的持续时间为约27小时。编号实施方式18包括编号实施方式1-17所述的方法,其中所述uv-b的波长在约280nm至约290nm的范围内。编号实施方式19包括编号实施方式1-18所述的方法,其中所述uv-b的波长为280nm。编号实施方式20包括编号实施方式1-19所述的方法,其中所述uv-b的波长为290nm。编号实施方式21包括编号实施方式1-20所述的方法,其中所述富含uv-b的光包含至少50%的uv-b。编号实施方式22包括编号实施方式1-21所述的方法,其中所述富含uv-b的光包含比任何其他波长至少多50%的uv-b。编号实施方式23包括编号实施方式1-22所述的方法,其中所述光包含蓝光。编号实施方式24包括编号实施方式1-23所述的方法,其中所述光包含红光。编号实施方式25包括编号实施方式1-24所述的方法,其中所述光包含可见光。编号实施方式26包括编号实施方式1-25所述的方法,其中所述可见光以不超过400umolm-2s-1施用。编号实施方式27包括编号实施方式1-26所述的方法,其中所述可见光在0.1m-2s-1-20umolm-2s-1、20m-2s-1-50umolm-2s-1和50m-2s-1-400umolm-2s-1中的至少一种的范围内施用。编号实施方式28包括编号实施方式1-27所述的方法,其中所述可见光以约400umolm-2s-1施用。编号实施方式29包括编号实施方式1-28所述的方法,其中所述可见光以约50umolm-2s-1施用。编号实施方式30包括编号实施方式1-29所述的方法,其中所述可见光以约20umolm-2s-1施用。编号实施方式31包括编号实施方式1-30所述的方法,其中所述uv-b以不超过100kjm-2施用。编号实施方式32包括编号实施方式1-31所述的方法,其中所述uv-b在0.1-13kjm-2、13-50kjm-2和50-100kjm-2中的至少一种的范围内施用。编号实施方式33包括编号实施方式1-32所述的方法,其中所述uv-b以约100kjm-2施用。编号实施方式34包括编号实施方式1-33所述的方法,其中所述uv-b以约13kjm-2施用。编号实施方式35包括编号实施方式1-34所述的方法,其中施用不超过1.3x10-4wcm-2s-1的uv-b辐照度。编号实施方式36包括编号实施方式1-35所述的方法,其中uv-b辐照度在约4x10-5wcm-2s-1至1.3x10-4wcm-2s-1的范围内。编号实施方式37包括编号实施方式1-36所述的方法,其中uv-b辐照度为约4x10-5wcm-2s-1。编号实施方式38包括编号实施方式1-37所述的方法,其中uv-b辐照度为约1.3x10-4wcm-2s-1。编号实施方式39包括编号实施方式1-38所述的方法,其中所述uv-b通过led灯进行施用。编号实施方式40包括编号实施方式1-39所述的方法,其中所述led灯的一个或多个面板处于所述种子上方约80mm的高度处。编号实施方式41包括编号实施方式1-40所述的方法,其中将所述种子直接放置在所述一个或多个面板下方的托盘中,以便定位所述种子以接受照射。编号实施方式42包括编号实施方式1-41所述的方法,其中将所述种子定位在所述面板下方的托盘中提高uv-b照射的效果。编号实施方式43包括编号实施方式1-42所述的方法,其中将所述种子定位在所述面板下方的托盘中使uv-b照射最大化。编号实施方式44包括编号实施方式1-43所述的方法,其中所述光包含uv-a光。编号实施方式45包括编号实施方式1-44所述的方法,其中所述种子包括蔬菜、水果或花的作物物种。编号实施方式46包括编号实施方式1-45所述的方法,其中所述作物选自生菜、豆类、青花菜、卷心菜、胡萝卜、花椰菜、黄瓜、甜瓜、洋葱、豌豆、胡椒、南瓜、菠菜、西葫芦、甜玉米、番茄、西瓜、苜蓿、油菜、玉米、棉花、高粱、大豆、甜菜和小麦中的至少一种。编号实施方式47包括编号实施方式1-46所述的方法,其中所述作物是商业种植的作物。编号实施方式48包括编号实施方式1-47所述的方法,其中所述植物性能的改善选自果实鲜重、收获的果实数目、白利糖度(brix)含量、果实宽度、果实长度、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量增加、抗逆性和种子发芽率。编号实施方式49包括编号实施方式1-48所述的方法,其中所述抗逆性选自改善的对由天气损害引起的胁迫的抗性、改善的对由日照暴露引起的胁迫的抗性、改善的对由疾病引起的胁迫的抗性以及改善的对由昆虫引起的胁迫的抗性。编号实施方式50包括编号实施方式1-49所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约8%。编号实施方式51包括编号实施方式1-50所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约10%。编号实施方式52包括编号实施方式1-51所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约12%。编号实施方式53包括编号实施方式1-52所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约15%。编号实施方式54包括编号实施方式1-53所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约18%。编号实施方式55包括编号实施方式1-54所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约20%。编号实施方式56包括一种用于改善植物性能和抗逆性中的至少一种的方法,其包括:(a)使用引发介质引发种子;(b)同时诱导所述种子中的代谢活化;以及(c)随后减少所述种子的内部水分。编号实施方式57包括编号实施方式1-56所述的方法,其中所述引发介质是水。编号实施方式58包括编号实施方式1-57所述的方法,其中所述引发介质是聚乙二醇。编号实施方式59包括编号实施方式1-58所述的方法,其中将所述种子浸没在所述引发介质中。编号实施方式60包括编号实施方式1-59所述的方法,其中减少所述内部水分包括使用空气、降低湿度、调节温度或使用干燥剂。编号实施方式61包括编号实施方式1-60所述的方法,其中诱导代谢活化包括施用光、激素、化学物质、类固醇或维生素。编号实施方式62包括编号实施方式1-61所述的方法,其中所述光富含uv-b。编号实施方式63包括编号实施方式1-62所述的方法,其中所述uv-b的波长在约280nm至约290nm的范围内。编号实施方式64包括编号实施方式1-63所述的方法,其中所述uv-b的波长为280nm。编号实施方式65包括编号实施方式1-64所述的方法,其中所述uv-b的波长为290nm。编号实施方式66包括编号实施方式1-65所述的方法,其中uv-b的辐照度为至多300uwcm-2。编号实施方式67包括编号实施方式1-66所述的方法,其中施用不超过1.3x10-4wcm-2s-1的uv-b辐照度。编号实施方式68包括编号实施方式1-67所述的方法,其中所述富含uv-b的光包含至少50%的uv-b。编号实施方式69包括编号实施方式1-68所述的方法,其中所述富含uv-b的光包含比任何其他波长至少多50%的uv-b。编号实施方式70包括编号实施方式1-69所述的方法,其中所述光包含蓝光。编号实施方式71包括编号实施方式1-70所述的方法,其中所述光包含红光。编号实施方式72包括编号实施方式1-71所述的方法,其中所述光包含可见光。编号实施方式73包括编号实施方式1-72所述的方法,其中所述可见光以不超过400umolm-2s-1施用。编号实施方式74包括编号实施方式1-73所述的方法,其中所述uv-b以不超过100kjm-2施用。编号实施方式75包括编号实施方式1-74所述的方法,其中引发所述种子并同时施用uv-b的持续时间在约1小时至约30小时、约2小时至约27小时、约3小时至约25小时、约4小时至约24小时、约5小时至约22小时或约6小时至约21小时的范围内。编号实施方式76包括编号实施方式1-75所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约10%。编号实施方式77包括一种用于改善植物性能和抗逆性中的至少一种的方法,其包括:(a)引发种子;以及(b)施用富含波长为约280nm至约290nm的uv-b的光至少8小时,并使用至少40uwcm-2的辐照度。编号实施方式78包括编号实施方式1-77所述的方法,其中施用光约8小时。编号实施方式79包括编号实施方式1-78所述的方法,其中施用光至少19小时。编号实施方式80包括编号实施方式1-79所述的方法,其中施用光21小时。编号实施方式81包括编号实施方式1-80所述的方法,其中施用光至少27小时。编号实施方式82包括编号实施方式1-81所述的方法,其中施用光27小时。编号实施方式83包括编号实施方式1-82所述的方法,其中所述辐照度为约40uwcm-2。编号实施方式84包括编号实施方式1-83所述的方法,其中所述辐照度为至少100uwcm-2。编号实施方式85包括编号实施方式1-84所述的方法,其中步骤(a)和步骤(b)同时进行。编号实施方式86包括编号实施方式1-85所述的方法,其中引发包括使用引发介质。编号实施方式87包括编号实施方式1-86所述的方法,其中所述引发介质是水。编号实施方式88包括编号实施方式1-87所述的方法,其中所述引发介质是聚乙二醇。编号实施方式89包括编号实施方式1-88所述的方法,其中将所述种子浸没在所述引发介质中。编号实施方式90包括编号实施方式1-89所述的方法,其中施用光在生长室中进行。编号实施方式91包括编号实施方式1-90所述的方法,其中所述生长室保持在至多40℃。编号实施方式92包括编号实施方式1-91所述的方法,其中所述生长室保持在约22℃。编号实施方式93包括编号实施方式1-92所述的方法,其中所述生长室保持在约10℃。编号实施方式94包括编号实施方式1-93所述的方法,其中引发所述种子的持续时间在约1小时至约30小时、约2小时至约27小时、约3小时至约25小时、约4小时至约24小时、约5小时至约22小时或约6小时至约21小时的范围内。编号实施方式95包括编号实施方式1-94所述的方法,其中引发的持续时间为约20小时。编号实施方式96包括编号实施方式1-95所述的方法,其中引发的持续时间为约24小时。编号实施方式97包括编号实施方式1-96所述的方法,其中引发的持续时间为约27小时。编号实施方式98包括编号实施方式1-97所述的方法,其中所述uv-b的波长为280nm。编号实施方式99包括编号实施方式1-98所述的方法,其中所述uv-b的波长为290nm。编号实施方式100包括编号实施方式1-99所述的方法,其中所述富含uv-b的光包含至少50%的uv-b。编号实施方式101包括编号实施方式1-100所述的方法,其中所述富含uv-b的光包含比任何其他波长至少多50%的uv-b。编号实施方式102包括编号实施方式1-101所述的方法,其中所述光包含蓝光。编号实施方式103包括编号实施方式1-102所述的方法,其中所述光包含红光。编号实施方式104包括编号实施方式1-103所述的方法,其中所述植物性能的改善选自果实鲜重、收获的果实数目、白利糖度含量、果实宽度、果实长度、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量增加、抗逆性和种子发芽率。编号实施方式105包括编号实施方式1-104所述的方法,其中所述抗逆性选自改善的对由天气损害引起的胁迫的抗性、改善的对由日照暴露引起的胁迫的抗性、改善的对由疾病引起的胁迫的抗性以及改善的对由昆虫引起的胁迫的抗性。编号实施方式106包括编号实施方式1-105所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约8%。编号实施方式107包括编号实施方式1-106所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约10%。编号实施方式108包括编号实施方式1-107所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约12%。编号实施方式109包括编号实施方式1-108所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约15%。编号实施方式110包括编号实施方式1-109所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约18%。编号实施方式111包括编号实施方式1-110所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约20%。编号实施方式112包括一种用于改善植物性能和抗逆性中的至少一种的方法,其包括:(a)引发种子;以及(b)施用富含波长为约280nm至约290nm的uv-b的光至少19小时,并使用至少100uwcm-2的辐照度。编号实施方式113包括编号实施方式1-112所述的方法,其中施用光21小时。编号实施方式114包括编号实施方式1-113所述的方法,其中施用光27小时。编号实施方式115包括编号实施方式1-114所述的方法,其中所述辐照度为约100uwcm-2。编号实施方式116包括编号实施方式1-115所述的方法,其中所述辐照度为至少200uwcm-2。编号实施方式117包括编号实施方式1-116所述的方法,其中所述辐照度为约200uwcm-2。编号实施方式118包括编号实施方式1-117所述的方法,其中步骤(a)和步骤(b)同时进行。编号实施方式119包括编号实施方式1-118所述的方法,其中引发包括使用引发介质。编号实施方式120包括编号实施方式1-119所述的方法,其中所述引发介质是水。编号实施方式121包括编号实施方式1-120所述的方法,其中所述引发介质是聚乙二醇。编号实施方式122包括编号实施方式1-121所述的方法,其中将所述种子浸没在所述引发介质中。编号实施方式123包括编号实施方式1-122所述的方法,其中施用光在生长室中进行。编号实施方式124包括编号实施方式1-122所述的方法,其中所述生长室保持在至多40℃。编号实施方式125包括编号实施方式1-124所述的方法,其中所述生长室保持在约22℃。编号实施方式126包括编号实施方式1-125所述的方法,其中所述生长室保持在约10℃。编号实施方式127包括编号实施方式1-126所述的方法,其中引发所述种子的持续时间在约1小时至约30小时、约2小时至约27小时、约3小时至约25小时、约4小时至约24小时、约5小时至约22小时或约6小时至约21小时的范围内。编号实施方式128包括编号实施方式1-127所述的方法,其中引发的持续时间为约20小时。编号实施方式129包括编号实施方式1-128所述的方法,其中引发的持续时间为约24小时。编号实施方式130包括编号实施方式1-129所述的方法,其中引发的持续时间为约27小时。编号实施方式131包括编号实施方式1-130所述的方法,其中所述uv-b的波长为280nm。编号实施方式132包括编号实施方式1-131所述的方法,其中所述uv-b的波长为290nm。编号实施方式133包括编号实施方式1-132所述的方法,其中所述富含uv-b的光包含至少50%的uv-b。编号实施方式134包括编号实施方式1-133所述的方法,其中所述富含uv-b的光包含比任何其他波长至少多50%的uv-b。编号实施方式135包括编号实施方式1-134所述的方法,其中所述光包含蓝光。编号实施方式136包括编号实施方式1-135所述的方法,其中所述光包含红光。编号实施方式137包括编号实施方式1-136所述的方法,其中所述植物性能的改善选自果实鲜重、收获的果实数目、白利糖度含量、果实宽度、果实长度、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量增加、抗逆性和种子发芽率。编号实施方式138包括编号实施方式1-137所述的方法,其中所述抗逆性选自改善的对由天气损害引起的胁迫的抗性、改善的对由日照暴露引起的胁迫的抗性、改善的对由疾病引起的胁迫的抗性以及改善的对由昆虫引起的胁迫的抗性。编号实施方式139包括编号实施方式1-138所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约8%。编号实施方式140包括编号实施方式1-139所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约10%。编号实施方式141包括编号实施方式1-140所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约12%。编号实施方式142包括编号实施方式1-141所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约15%。编号实施方式143包括编号实施方式1-142所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约18%。编号实施方式144包括编号实施方式1-143所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约20%。编号实施方式145包括一种用于改善植物性能和抗逆性中的至少一种的方法,其包括:(a)使用引发介质引发种子不超过50小时的持续时间;以及(b)在至少约10℃的生长室中施用富含波长为约280nm至约290nm的uv-b的光,其中使用不超过约270kjm-2的剂量和不超过约200uwcm-2的辐照度来施用所述uv-b不超过约30小时。编号实施方式146包括编号实施方式1-145所述的方法,其中所述引发介质是水。编号实施方式147包括编号实施方式1-146所述的方法,其中所述引发介质是聚乙二醇。编号实施方式148包括编号实施方式1-147所述的方法,其中步骤(a)和步骤(b)同时进行。编号实施方式149包括编号实施方式1-148所述的方法,其中所述生长室保持在约10℃。编号实施方式150包括编号实施方式1-149所述的方法,其中所述生长室保持在约20℃。编号实施方式151包括编号实施方式1-150所述的方法,其中所述uv-b以约100kjm-2施用。编号实施方式152包括编号实施方式1-151所述的方法,其中所述uv-b以约13kjm-2施用。编号实施方式153包括编号实施方式1-152所述的方法,其中所述uv-b的辐照度为约40uwcm-2。编号实施方式154包括编号实施方式1-153所述的方法,其中所述uv-b的辐照度为约100uwcm-2。编号实施方式155包括编号实施方式1-154所述的方法,其中施用所述uv-b约20小时。编号实施方式156包括编号实施方式1-155所述的方法,其中施用所述uv-b约24小时。编号实施方式157包括编号实施方式1-156所述的方法,其中施用所述uv-b约27小时。编号实施方式158包括编号实施方式1-157所述的方法,其中所述引发的持续时间为约44小时。编号实施方式159包括编号实施方式1-158所述的方法,其中所述引发的持续时间为约27小时。编号实施方式160包括编号实施方式1-159所述的方法,其中所述引发的持续时间为约24小时。编号实施方式161包括编号实施方式1-160所述的方法,其中所述引发的持续时间为约20小时。编号实施方式162包括编号实施方式1-161所述的方法,其中所述引发的持续时间为约8小时。编号实施方式163包括编号实施方式1-162所述的方法,其进一步包括在步骤(b)之前将所述种子放置在潮湿的表面上。编号实施方式164包括编号实施方式1-163所述的方法,其中所述潮湿的表面包括潮湿的滤纸。编号实施方式165包括编号实施方式1-164所述的方法,其进一步包括在步骤(b)之前将所述种子浸没。编号实施方式166包括编号实施方式1-165所述的方法,其中所述uv-b的波长为280nm。编号实施方式167包括编号实施方式1-166所述的方法,其中所述uv-b的波长为290nm。编号实施方式168包括编号实施方式1-167所述的方法,其中所述富含uv-b的光包含至少50%的uv-b。编号实施方式169包括编号实施方式1-168所述的方法,其中所述富含uv-b的光包含比任何其他波长至少多50%的uv-b。编号实施方式170包括编号实施方式1-169所述的方法,其中使用可见光共同施用所述uv-b。编号实施方式171包括编号实施方式1-170所述的方法,其中所述可见光为蓝光和红光中的至少一种。编号实施方式172包括编号实施方式1-171所述的方法,其中所述可见光以不超过400umolm-2s-1施用。编号实施方式173包括编号实施方式1-172所述的方法,其中所述可见光在0m-2s-1-20umolm-2s-1、20m-2s-1-50umolm-2s-1和50m-2s-1-400umolm-2s-1中的至少一种的范围内施用。编号实施方式174包括编号实施方式1-173所述的方法,其中所述可见光以约400umolm-2s-1施用。编号的实施方式175包括编号的实施方式1-174所述的方法,其中所述可见光以约50umolm-2s-1施用。编号的实施方式176包括编号的实施方式1-175所述的方法,其中所述可见光以约20umolm-2s-1施用。编号实施方式177包括编号实施方式1-176所述的方法,其中所述可见光包含蓝光。编号实施方式178包括编号实施方式1-177所述的方法,其中所述可见光包含红光。编号实施方式179包括编号实施方式1-178所述的方法,其中所述植物性能的改善选自果实鲜重、收获的果实数目、白利糖度含量、果实宽度、果实长度、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量增加、抗逆性和种子发芽率。编号实施方式180包括编号实施方式1-179所述的方法,其中所述抗逆性选自改善的对由天气损害引起的胁迫的抗性、改善的对由日照暴露引起的胁迫的抗性、改善的对由疾病引起的胁迫的抗性以及改善的对由昆虫引起的胁迫的抗性。编号实施方式181包括编号实施方式1-180所述的方法,其中所述植物性能改善至少约8%。编号实施方式182包括编号实施方式1-181所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约10%。编号实施方式183包括编号实施方式1-182所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约12%。编号实施方式184包括编号实施方式1-183所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约15%。编号实施方式185包括编号实施方式1-184所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约18%。编号实施方式186包括编号实施方式1-185所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约20%。编号实施方式187包括一种用于改善植物性能和抗逆性中的至少一种的方法,其包括:(a)引发种子;(b)向所述种子施用富含波长为约280nm至约290nm的uv-b的光;以及(c)测量植物性能的改善,其中植物性能改善至少5%。编号实施方式188包括编号实施方式1-187所述的方法,其中引发所述种子包括使用引发介质。编号实施方式189包括编号实施方式1-188所述的方法,其中所述引发介质是水。编号实施方式190包括编号实施方式1-189所述的方法,其中所述引发介质是聚乙二醇。编号实施方式191包括编号实施方式1-190所述的方法,其进一步包括在步骤(b)之前将所述种子放置在潮湿的表面上。编号实施方式192包括编号实施方式1-191所述的方法,其中所述潮湿的表面包括潮湿的滤纸。编号实施方式193包括编号实施方式1-192所述的方法,其进一步包括在步骤(b)之前将所述种子浸没在引发介质中。编号实施方式194包括编号实施方式1-193所述的方法,其中所述引发介质是水。编号实施方式195包括编号实施方式1-194所述的方法,其中所述引发介质是聚乙二醇。编号实施方式196包括编号实施方式1-195所述的方法,其中步骤(a)和步骤(b)同时进行。编号实施方式197包括编号实施方式1-196所述的方法,其中施用光在生长室中进行。编号实施方式198包括编号实施方式1-197所述的方法,其中所述生长室保持在至多40℃。编号实施方式199包括编号实施方式1-198所述的方法,其中所述生长室保持在约22℃。编号实施方式200包括编号实施方式1-199所述的方法,其中所述生长室保持在约10℃。编号实施方式201包括编号实施方式1-200所述的方法,其中uv-b的辐照度为至多300uwcm-2。编号实施方式202包括编号的实施方式1-201所述的方法,其中uv-b的辐照度在约40uwcm-2至约200uwcm-2的范围内。编号实施方式203包括编号实施方式1-202所述的方法,其中uv-b的辐照度为约40uwcm-2。编号实施方式204包括编号实施方式1-203所述的方法,其中uv-b的辐照度为约100uwcm-2。编号实施方式205包括编号实施方式1-204所述的方法,其中uv-b的辐照度为约200uwcm-2。编号实施方式206包括编号实施方式1-205所述的方法,其中施用uv-b的持续时间在约1小时至约30小时、约2小时至约27小时、约3小时至约25小时、约4小时至约24小时、约5小时至约22小时或约6小时至约21小时的范围内。编号实施方式207包括编号实施方式1-206所述的方法,其中施用uv-b的持续时间为约20小时。编号实施方式208包括编号实施方式1-207所述的方法,其中施用uv-b的持续时间为约24小时。编号实施方式209包括编号实施方式1-208所述的方法,其中施用uv-b的持续时间为约27小时。编号实施方式210包括编号实施方式1-209所述的方法,其中引发的持续时间为至多50小时。编号实施方式211包括编号实施方式1-210所述的方法,其中引发的持续时间在约1小时至约50小时、约2小时至约48小时、约3小时至约44小时、约4小时至约40小时、约5小时至约35小时、约6小时至约32小时、约7小时至约30小时或约8小时至约27小时的范围内。编号实施方式212包括编号实施方式1-211所述的方法,其中引发的持续时间为约44小时。编号实施方式213包括编号实施方式1-212所述的方法,其中引发的持续时间为约27小时。编号实施方式214包括编号实施方式1-213所述的方法,其中引发的持续时间为约24小时。编号实施方式215包括编号实施方式1-214所述的方法,其中引发的持续时间为约20小时。编号实施方式216包括编号实施方式1-215所述的方法,其中引发的持续时间为约8小时。编号实施方式217包括编号实施方式1-216所述的方法,其中所述uv-b的波长为280nm。编号实施方式218包括编号实施方式1-217所述的方法,其中所述uv-b的波长为290nm。编号实施方式219包括编号实施方式1-218所述的方法,其中所述富含uv-b的光包含至少50%的uv-b。编号实施方式220包括编号实施方式1-219所述的方法,其中所述富含uv-b的光包含比任何其他波长至少多50%的uv-b。编号实施方式221包括编号实施方式1-220所述的方法,其中所述光包含蓝光。编号实施方式222包括编号实施方式1-221所述的方法,其中所述光包含红光。编号实施方式223包括编号实施方式1-222所述的方法,其中所述植物性能的改善选自果实鲜重、收获的果实数目、白利糖度含量、果实宽度、果实长度、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量增加、抗逆性和种子发芽率。编号实施方式224包括编号实施方式1-223所述的方法,其中所述抗逆性选自改善的对由天气损害引起的胁迫的抗性、改善的对由日照暴露引起的胁迫的抗性、改善的对由疾病引起的胁迫的抗性以及改善的对由昆虫引起的胁迫抗性。编号实施方式225包括编号实施方式1-224所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约8%。编号实施方式226包括编号实施方式1-225所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约10%。编号实施方式227包括编号实施方式1-226所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约12%。编号实施方式228包括编号实施方式1-227所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约15%。编号实施方式229包括编号实施方式1-228所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约18%。编号实施方式230包括编号实施方式1-229所述的方法,其中所述植物性能和抗逆性中的至少一种改善至少约20%。编号实施方式231包括一种处理用于播种的种子以提高植物性能的方法,所述方法包括:(a)引发所述种子;(b)定位所述种子,使得所述种子的胚芽不被阻挡接受照射;以及(c)使用富含uv-b的光处理种子。编号实施方式232包括编号实施方式1-231所述的方法,其中定位所述种子使得所述种子的胚定位成接受照射增加了uv-b照射的效果。编号实施方式233包括编号实施方式1-232所述的方法,其中定位所述种子使uv-b照射最大化。编号实施方式234包括一种减少生长作物的环境影响的方法,其包括以下步骤:(a)引发种子;(b)使用富含uv-b的光处理所述种子;(c)播种所述种子;(d)提供标准肥料方案、标准农药方案、标准除草剂方案和标准杀虫剂方案中的不超过至少一种;以及(e)从所述种子收获所述作物,其中来自所述种子的所述作物的作物产量比标准产量高至少5%。编号实施方式235包括一种与标准肥料使用相比减少肥料使用而不降低作物产量的方法,其包括以下步骤:(a)引发种子;(b)使用富含uv-b的光处理所述种子;(c)播种所述种子;(d)提供标准肥料方案的不超过95%;以及(e)从所述种子收获作物,其中所述作物比来自未经uv-b照射的种子的作物需要更少的肥料。编号实施方式236包括编号实施方式1-235所述的方法,其中所述作物产量增加。编号实施方式237包括编号实施方式1-236所述的方法,其中与来自未经uv-b照射的种子的作物相比,所述作物收获更快。编号实施方式238包括一种通过减少农药使用而不影响由于害虫损害造成的损失来生长作物的方法,其包括以下步骤:(a)引发种子;(b)使用富含uv-b的光处理所述种子;(c)播种所述种子;(d)提供标准农药方案的不超过95%;以及(e)从所述种子收获所述作物,其中所述作物比来自未经uv-b照射的种子的作物需要更少的农药。编号实施方式239包括编号实施方式1-238所述的方法,其中所述作物产量增加。编号实施方式240包括编号实施方式1-239所述的方法,其中与来自未经uv-b照射的种子的作物相比,所述作物收获更快。编号实施方式241包括编号实施方式1-240所述的方法,其中将所述有机作物喂给动物。编号实施方式242包括一种提高作物的抗病性的方法,其包括以下步骤:(a)引发种子;(b)使用富含uv-b的光处理所述种子;(c)播种所述种子;以及(d)收获所述作物,其中所述作物比来自未经uv-b照射的种子的作物具有提高的抗病性。编号实施方式243包括编号实施方式1-242所述的方法,其中所述疾病由真菌病原体、细菌、卵菌、病毒、类病毒、病毒样生物体、植原体、原生动物、线虫和寄生植物中的至少一种引起。编号实施方式244包括编号实施方式1-243所述的方法,其中作物产量增加。编号实施方式245包括编号实施方式1-244所述的方法,其中与来自未经uv-b照射的种子的作物相比,所述作物收获更快。编号实施方式246包括一种提高作物的损害抗性的方法,其包括以下步骤:(a)引发种子;(b)使用富含uv-b的光处理所述种子;(c)播种所述种子;以及(d)从所述种子收获所述作物,其中所述作物比来自未经uv-b照射的种子的作物具有提高的损害抗性。编号实施方式247包括编号实施方式1-246所述的方法,其中所述损害包括热、洪水、干旱、霜冻、异常气候事件、盐胁迫和高可见光胁迫中的至少一种。编号实施方式248包括编号实施方式1-247所述的方法,其中作物产量增加。编号实施方式249包括编号实施方式1-248所述的方法,其中与来自未经uv-b照射的种子的作物相比,所述作物收获更快。编号实施方式250包括一种通过减少杀虫剂使用而不影响由于害虫损害造成的损失来生长作物的方法,其包括以下步骤:(a)引发种子;(b)使用富含uv-b的光处理所述种子;(c)播种所述种子;(d)提供标准杀虫剂方案的不超过95%;以及(e)从所述种子收获所述作物,其中所述作物比来自未经uv-b照射的种子的作物需要更少的杀虫剂。编号实施方式251包括编号实施方式1-250所述的方法,其中作物产量增加。编号实施方式252包括编号实施方式1-251所述的方法,其中与来自未经uv-b照射的种子的作物相比,所述作物收获更快。编号实施方式253包括一种与来自未经uv-b照射的种子相比生长改善的质量的作物的方法,其包括以下步骤:(a)引发种子;(b)使用富含uv-b的光处理所述种子;(c)播种所述种子;以及(d)从所述种子收获所述作物,其中与来自未经uv-b照射的种子的作物相比,所述作物的质量得到改善。编号实施方式254包括编号实施方式1-253所述的方法,其中所述改善的质量包括更长的保质期、对擦伤或收获后处理的抗性、增加的营养价值以及改善的味道、形状、颜色、尺寸和质地中的至少一种。编号实施方式255包括编号实施方式1-254所述的方法,其中作物产量增加。编号实施方式256包括编号实施方式1-255所述的方法,其中与来自未经uv-b照射的种子的作物相比,所述作物收获更快。编号实施方式257包括以编号实施方式1-256所述的方法为特征的种子。编号实施方式258包括以编号实施方式1-257所述的方法为特征的种子,其中与未经照射的种子相比,所述种子具有增加的黄酮类化合物水平和增加的花色素苷水平中的至少一种。编号实施方式259包括以编号实施方式1-258所述的方法为特征的种子,其中多数所述种子具有改善的发芽。编号实施方式260包括来源于根据编号实施方式1-256中任一项的方法的作物。编号实施方式261包括来源于根据编号实施方式1-256中任一项的方法的作物,其中与未经uv-b照射的种子相比,所述作物具有增加的黄酮类化合物水平和增加的花色素苷水平中的至少一种。编号实施方式262包括来源于根据编号实施方式1-256中任一项的方法的作物,其中所述作物具有改善的产量。编号实施方式263包括来源于根据编号实施方式1-256中任一项的方法的作物,其中植物性能的改善选自果实鲜重、收获的果实数目、白利糖度含量、果实宽度、果实长度、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量增加、抗逆性和种子发芽率。编号实施方式264包括来源于根据编号实施方式1-256中任一项的方法的作物,其中所述作物是商业种植的作物。编号实施方式265包括来源于根据编号实施方式1-256中任一项的方法的作物,其中所述改善的产量是改善的水分利用。编号实施方式266包括从施用富含约波长为280nm至约290nm的uv-b照射的光的种子生长的作物。编号实施方式267包括以根据实施方式1-266中任一项的方法为特征的托盘,其中所述托盘用于定位种子以增加uv-b照射效果。编号实施方式268包括一种用于引发并同时向种子施用uv-b的系统,其包含:(a)具有可读输入文件以生成关于施用富含uv-b的光的指令的计算机;(b)用于接收关于施用富含uv-b的光的指令的照明控制器;以及(c)用于引发并同时施用富含uv-b的光的表面。编号实施方式269包括根据任何编号实施方式1-268的系统,其中所述指令涉及引发并同时施用富含uv-b的光的剂量、辐照度或持续时间。编号实施方式270包括根据任何编号实施方式1-269的系统,其中所述uv-b的辐照度在约40uwcm-2至约200uwcm-2的范围内。编号实施方式271包括根据任何编号实施方式1-270的系统,其中所述uv-b的辐照度为约40uwcm-2。编号实施方式272包括根据任何编号实施方式1-271的系统,其中所述uv-b的辐照度为约100uwcm-2。编号实施方式273包括根据任何编号实施方式1-272的系统,其中所述uv-b的辐照度为约200uwcm-2。编号实施方式274包括根据任何编号实施方式1-273的系统,其中引发并同时施用富含uv-b的光的持续时间在约1小时至约30小时、约2小时至约27小时、约3小时至约25小时、约4小时至约24小时、约5小时至约22小时或约6小时至约21小时的范围内。编号实施方式275包括根据任何编号实施方式1-274的系统,其中引发并同时施用富含uv-b的光的持续时间为约20小时。编号实施方式276包括根据任何编号实施方式1-275的系统,其中引发并同时施用富含uv-b的光的持续时间为约24小时。编号实施方式277包括根据任何编号实施方式1-276的系统,其中引发并同时施用富含uv-b的光的持续时间为约27小时。编号实施方式278包括根据任何编号实施方式1-277的系统,其中所述uv-b的波长在约280nm至约290nm的范围内。编号实施方式279包括根据任何编号实施方式1-278的系统,其中所述uv-b的波长为280nm。编号实施方式280包括根据任何编号实施方式1-279的系统,其中所述uv-b的波长为290nm。编号实施方式281包括根据任何编号实施方式1-280系统,其中所述富含uv-b的光包含至少50%的uv-b。编号实施方式282包括根据任何编号实施方式1-281的系统,其中所述富含uv-b的光包含比任何其他波长至少多50%的uv-b。编号实施方式283包括根据任何编号实施方式1-282的系统,其中所述表面包括引发介质。编号实施方式284包括根据任何编号实施方式1-283的系统,其中所述引发介质是水。编号实施方式285包括根据任何编号实施方式1-284的系统,其中所述引发介质是聚乙二醇。编号实施方式286包括根据任何编号实施方式1-285的系统,其中所述光包含蓝光。编号实施方式287包括根据任何编号实施方式1-286的系统,其中所述光包含红光。编号实施方式288包括根据任何编号实施方式1-287的系统,其中所述光包含可见光。编号实施方式289包括根据任何编号实施方式1-288的系统,其中所述可见光以不超过400umolm-2s-1施用。编号实施方式290包括根据任何编号实施方式1-289的系统,其中所述可见光在0.1m-2s-1-20umolm-2s-1、20m-2s-1-50umolm-2s-1和50m-2s-1-400umolm-2s-1中的至少一种的范围内施用。编号实施方式290包括根据任何编号实施方式1-290的系统,其中所述可见光以约400umolm-2s-1施用。编号实施方式292包括根据任何编号实施方式1-291的系统,其中所述可见光以约50umolm-2s-1施用。编号实施方式293包括根据任何编号实施方式1-292的系统,其中所述可见光以约20umolm-2s-1施用。编号实施方式294包括根据任何编号实施方式1-293的系统,其中施用的uv-b的剂量不超过100kjm-2。编号实施方式295包括根据任何编号实施方式1-294的系统,其中施用的uv-b的剂量在0.1-13kjm-2、13-50kjm-2和50-100kjm-2中的至少一种的范围内。编号实施方式296包括根据任何编号实施方式1-295的系统,其中施用的uv-b的剂量为约100kjm-2。编号实施方式297包括根据任何编号实施方式1-296系统,其中施用的uv-b的剂量为约13kjm-2。编号实施方式298包括根据任何编号实施方式1-297的系统,其中所述uv-b辐照度以不超过1.3x10-4wcm-2s-1施用。编号实施方式299包括根据任何编号实施方式1-298的系统,其中所述uv-b辐照度在约4x10-5wcm-2s-1至1.3x10-4wcm-2s-1的范围内。编号实施方式300包括根据任何编号实施方式1-299的系统,其中所述uv-b辐照度为约4x10-5wcm-2s-1。编号实施方式301包括根据任何编号实施方式1-300的系统,其中所述uv-b辐照度为约1.3x10-4wcm-2s-1。编号实施方式302包括一种用于向种子施用富含uv-b的光的装置,其包含:(a)用于施用富含uv-b的光的至少一个光源;(b)照明控制器;以及(c)用于同时引发和施用富含uv-b的光的平台。编号实施方式303包括根据任何编号实施方式1-302的装置,其中所述至少一个光源是固定的。编号实施方式304包括根据任何编号实施方式1-303的装置,其中所述至少一个光源在uv-b施用期间调整位置。编号实施方式305包括根据任何编号实施方式1-304的装置,其进一步包括计算机处理器。编号实施方式306包括一种用于改善植物性能和抗逆性中的至少一种的方法,其包括:(a)使用引发介质引发种子;(b)同时诱导所述种子中的代谢活化;以及(c)随后减少所述种子的内部水分。编号实施方式307包括根据任何编号实施方式1-306的方法,其进一步包括储存所述种子。编号实施方式308包括根据任何编号实施方式1-307的方法,其进一步包括将所述种子装袋以供出售。编号实施方式309包括根据任何编号实施方式1-308的方法,其中所述引发介质是水。编号实施方式310包括根据任何编号实施方式1-309的方法,其中所述引发介质是聚乙二醇。编号实施方式311包括根据任何编号实施方式1-310中任一项的方法,其中减少所述内部水分包括使用空气、降低湿度、调节温度或使用干燥剂。编号实施方式312包括根据编号实施方式1-311的方法,其中诱导代谢活化包括施用光、激素、化学物质、类固醇或维生素。编号实施方式313包括根据编号实施方式1-312的方法,其中所述光富含uv-b。编号实施方式314包括根据任何编号实施方式1-313的方法,其中所述uv-b的波长在约280nm至约290nm的范围内。编号实施方式315包括根据任何编号实施方式1-314的方法,其中所述uv-b的辐照度为至多300uwcm-2。编号实施方式316包括根据任何编号实施方式1-315的方法,其中所述uv-b的辐照度不超过1.3x10-4wcm-2s-1。编号实施方式317包括根据任何编号实施方式1-316的方法,其中所述富含uv-b的光包含至少50%的uv-b。编号实施方式318包括根据任何编号实施方式1-317的方法,其中所述富含uv-b的光包含比任何其他波长至少多50%的uv-b。编号实施方式319包括根据任何编号实施方式1-318的方法,其中所述光包含可见光。编号实施方式320包括根据任何编号实施方式1-319的方法,其中所述可见光以不超过400umolm-2s-1施用。编号实施方式321包括根据任何编号实施方式1-320的方法,其中所述uv-b以不超过100kjm-2施用。编号实施方式322包括根据任何编号实施方式1-321的方法,其中引发所述种子并同时诱导代谢活化的持续时间在约1小时至约30小时、约2小时至约27小时、约3小时至约25小时、约4小时至约24小时、约5小时至约22小时或约6小时至约21小时的范围内。编号实施方式323包括根据任何编号实施方式1-322的方法,其中所述植物性能和抗逆性中的至少一种改善至少约8%。编号实施方式324包括一种用于改善植物性能和抗逆性中的至少一种的方法,其包括:(a)使用引发介质引发种子;以及(b)同时施用富含uv-b的光。编号实施方式325包括根据任何编号实施方式1-324的方法,其进一步包括储存所述种子。编号实施方式326包括根据任何编号实施方式1-325的方法,其进一步包括将所述种子装袋以供出售。编号实施方式327包括根据任何编号实施方式1-326的方法,其中所述引发介质是水。编号实施方式328包括根据任何编号实施方式1-327的方法,其中所述引发介质是聚乙二醇。编号实施方式329包括根据任何编号实施方式1-328的方法,其中将所述种子浸没在所述引发介质中。编号实施方式330包括根据任何编号实施方式1-329的方法,其中uv-b的辐照度为至多300uwcm-2。编号实施方式331包括根据任何编号实施方式1-330的方法,其中引发所述种子并同时施用uv-b的持续时间在约1小时至约30小时、约2小时至约27小时、约3小时至约25小时、约4小时至约24小时、约5小时至约22小时或约6小时至约21小时的范围内。编号实施方式332包括根据任何编号实施方式1-330的方法,其中引发所述种子并同时施用uv-b的持续时间为约20小时。编号实施方式333包括根据任何编号实施方式1-332的方法,其中所述uv-b的波长在约280nm至约290nm的范围内。编号实施方式334包括根据任何编号实施方式1-333的方法,其中所述富含uv-b的光包含至少50%的uv-b。编号实施方式335包括根据任何编号实施方式1-334的方法,其中所述富含uv-b的光包含比任何其他波长至少多50%的uv-b。编号实施方式336包括根据任何编号实施方式1-335中任一项的方法,其中所述光包含可见光。编号实施方式337包括根据任何编号实施方式1-336的方法,其中所述可见光以不超过400umolm-2s-1施用。编号实施方式338包括根据任何编号实施方式1-337的方法,其中所述uv-b以不超过100kjm-2施用。编号实施方式339包括根据任何编号实施方式1-338的方法,其中所述uv-b辐照度以不超过1.3x10-4wcm-2s-1施用。编号实施方式340包括根据任何编号实施方式1-339的方法,其中所述植物性能的改善选自果实鲜重、收获的果实数目、白利糖度含量、果实宽度、果实长度、叶片尺寸、叶片表面积、干重、氮含量、幼苗干重、幼苗鲜重、根干重、蔬菜发育、结实部分的产量、结实部分的重量增加、抗逆性和种子发芽率。编号实施方式341包括根据任何编号实施方式1-340的方法,其中所述抗逆性选自改善的对由天气损害引起的胁迫的抗性、改善的对由日照暴露引起的胁迫的抗性、改善的对由疾病引起的胁迫的抗性以及改善的对由昆虫引起的胁迫的抗性。编号实施方式342包括根据任何编号实施方式1-341的方法,其中所述植物性能和抗逆性中的至少一种改善至少约8%。编号实施方式343包括一种减少生长作物的环境影响的方法,其包括以下步骤:(a)引发种子;(b)使用富含uv-b的光处理所述种子;(c)播种所述种子;(d)提供标准肥料方案、标准农药方案、标准除草剂方案和标准杀虫剂方案中的不超过至少一种;以及(e)从所述种子收获所述作物,其中来自所述种子的所述作物的作物产量比标准产量高至少5%。编号实施方式344包括一种与标准肥料使用相比减少肥料使用而不降低作物产量的方法,其包括以下步骤:(a)引发种子;(b)使用富含uv-b的光处理所述种子;(c)播种所述种子;(d)提供标准肥料方案的不超过95%;以及(e)从所述种子收获作物,其中所述作物比来自未经uv-b照射的种子的作物需要更少的肥料。编号实施方式345包括一种用于改善作物产量的方法,其包括:(a)引发种子;(b)向所述种子施用富含波长为约280nm至约290nm的uv-b的光;以及(c)测量植物性能的改善,其中与有可比性的作物相比,所述植物性能改善至少5%。编号实施方式346包括根据任何编号实施方式1-345的方法,其中步骤(a)和步骤(b)同时进行。编号实施方式347包括根据任何编号实施方式1-346的方法,其进一步包括在步骤(b)后储存所述种子。编号实施方式348包括根据任何编号实施方式1-347的方法,其进一步包括在步骤(b)后将所述种子装袋以供出售。编号实施方式349包括一种用于改善植物性能和抗逆性中的至少一种的方法,其包括:(a)引发种子;(b)向所述种子施用富含波长为约280nm至约290nm的uv-b的光;以及(c)测量植物性能的改善,其中植物性能改善至少5%。编号实施方式350包括一种用于引发并同时向种子施用uv-b的系统,其包括:(a)具有可读输入文件以生成关于施用富含uv-b的光的指令的计算机;(b)用于接收关于施用富含uv-b的光的指令的照明控制器;以及(c)用于引发并同时施用富含uv-b的光的表面。编号实施方式351包括根据任何编号实施方式1-350的方法,其中所述指令涉及引发并同时施用富含uv-b的光的剂量、辐照度或持续时间。编号实施方式352包括一种用于向种子施用富含ub-b的光的装置,其包括:(a)用于施用富含uv-b的光的至少一个光源;(b)照明控制器;以及(c)用于同时引发和施用富含uv-b的光的平台。编号实施方式353包括根据任何编号实施方式1-352的方法,其中所述至少一个光源是固定的。编号实施方式354包括根据任何编号实施方式1-353的方法,其中所述至少一个光源在uv-b施用期间调整位置。
实施例
实施例1–uv-b处理后种子中的黄酮类化合物水平的分析
在本实施例中,将种子暴露于uv-b处理,然后冷冻以分析种子中uv-b吸收次级代谢物本身。
将品种legacy的种子(egmontseeds,newzealand)铺在水浸泡的滤纸上。然后使用led(发光二极管)阵列将种子暴露于286nm处的窄带uv-b剂量峰(“uv”)40分钟。作为对照,将种子暴露于仅由蓝光和红光led组成的可见光剂量(“vis”)40分钟。在种子初始吸水0小时(“t0”)或24小时(“t24”)后的不同时间点,使种子暴露于光剂量。当种子在液氮中冷冻以用于uv-b吸收化合物分析时,使种子在处理之间保持在16℃,直到48小时结束试验。通过在酸化甲醇中的种子均质化、离心以及通过分光光度计在300nm处上清液吸光度的测量来进行uv-b吸收化合物(推定的黄酮类化合物,y-轴)的分析。
结果如图2所示。图2示出了每种处理的推定的黄酮类化合物,每次处理包括三个重复批次/处理,并且每批包括80个单独的种子。可以看出,uv-b处理和可见光处理的样品在处理后24小时之后,看到(在300nm处检测到的)推定的黄酮类化合物增加。与在相同的24小时时间点处的可见光处理的样品相比,uv-b处理的样品中黄酮类化合物的水平显著增加。与吸水后24小时用可见光处理的种子(“vist24”)相比,在吸水后24小时用uv-b处理的种子(“uvt24”)中的黄酮类化合物高18%。与吸水后0小时用可见光处理的种子(“vist24”)相比,uvt24中的黄酮类化合物高60%。
实施例2–在uv-b种子处理之后20天的ezmina生菜植物叶中的黄酮类化合物水平的分析
在本实施例中,在评估叶多酚之前,将种子暴露于uv-b处理,然后使其发芽,移植到土壤上,并生长至一定年龄。
将品种ezmina的生菜种子(enzazaden,netherlands)铺在水浸泡的滤纸上。然后使用led(发光二极管)阵列将植物暴露于286nm处的窄带uv-b剂量峰(“uv”)40分钟。作为一个对照,将种子暴露于仅由蓝光和红光led组成的可见光剂量(“vis”)40分钟。在种子初始吸水0小时(“t0”)或24小时(“t24”)后的不同时间点,使种子暴露于光剂量。第二种形式的对照由包裹在铝箔中的种子组成,不暴露于任何光(“对照”)。
然后将发芽种子转移到土壤上,并且在秧苗繁殖后,将植物在外部环境条件下保持10天。在这段时间之后,用dualexscientific多酚测定仪(force-a,paris)进行叶黄酮类化合物水平的非侵入性测量。
结果如图3a所示,其中在种子处理后20天测量黄酮类化合物水平。提供的值是根据个体处理的11-14株植物的平均值,±标准误差(s.e)。无论在吸水后24小时还是在0小时处理,与20天可见光样品相比,uv-b处理的样品在20天时均显示显著更高的黄酮类化合物水平。有趣的是,在吸水后24小时用可见光处理的样品中20天时的黄酮类化合物水平实际上比在零时间点处理的水平低。
本研究说明了种子中所见的uv-b诱导的黄酮类化合物浓度与所得植物物质之间的关系。
实施例3–uv-b处理后(通过鲜幼苗鲜重测量的)植物生产力的分析
在本实施例中,在评估作为种子处理后的植物产量的指示的植物幼苗鲜重之前,将种子暴露于uv-b处理,然后使其发芽,移植到土壤上,并生长至一定年龄。
将品种legacy的种子(egmontseeds,newzealand)铺在水浸泡的滤纸上。然后使用led(发光二极管)阵列将种子暴露于286nm处的窄带uv-b剂量峰40分钟。作为对照,将种子暴露于仅由蓝光和红光led组成的可见光剂量40分钟。在种子初始吸水后(0小时,24小时)的不同时间点,使种子暴露于光剂量。处理之后,将种子转移到土壤上、并生长30天。然后评估作为植物产量指示的植物幼苗鲜重(即地上生物量)。
结果如图3b所示。如在uv-b处理的样品(“uvt24”)中所观察到的,与对照植物(“vist0”)相比,植物中的平均鲜重增加了17%。该结果说明了提高植物性能、特别是作物产量的优点。
实施例4–羽衣甘蓝(芸苔属饲料作物)中的叶黄酮类化合物的分析
在本实施例中,在播种之前用uv-b处理羽衣甘蓝秧苗,并且未用uv-b处理从种子生长的另一组秧苗。
首先将羽衣甘蓝(brassicaoleraceavar.regal)种子通过浸入peg8000溶液(-1.25mpa)中而进行引发并在黑暗中保持在16℃。在20小时之后,用500μmolm-2s-1的连续红光/蓝光照射种子。用uv-led光源提供的3.19×10-5wcm-2s-1的uv-b光(其透射率在286nm处达到峰值)另外处理这些种子的50%。在持续处理28小时(总引发持续时间48小时)之后,将种子取出并在16℃风干72小时。然后将种子播种并在peg8000(-1.25mpa,400ml)中生长以诱导干旱胁迫。在3周的持续干旱胁迫后,使用dualexscientific+叶绿素多酚测定仪(force-a,orsay,france)测定叶黄酮类化合物浓度。
结果如以下表1所示。“s.e.”表示标准误差。与从播种之前未经uv处理的种子生长的秧苗相比,在播种之前用uv处理种子的羽衣甘蓝秧苗的叶黄酮类化合物增加了12%。
这支持了以下结论:uv-b种子处理后的所得植物与未处理的种子相比具有增加的黄酮类化合物水平。
表1.
*p<0.05时统计学显著的增加
实施例5–干旱胁迫分析
在本实施例中,从种子发芽的点对羽衣甘蓝植物施加干旱胁迫。一组种子经uv-b处理,而另一组未经uv-b处理。
将羽衣甘蓝(brassicaoleraceavar.regal)种子浸入水中并在黑暗中保持在16℃。在4小时之后,用500μmolm-2s-1的连续红光/蓝光照射种子。用uv-led光源提供的1.42×10-4wcm-2的uv-b光(其透射率在286nm处达到峰值)另外处理这些种子的50%。在处理30小时之后,将种子在16℃下风干72小时。
然后使种子在发芽期间经受干旱胁迫。使uv引发的种子和对照种子在2种浓度的peg8000(-1mpa“干旱”、-1.5mpa“严重干旱”)之一或水中发芽。在72小时之后,对秧苗重量和胚根长度进行定量。
结果如以下表2所示。“s.e.”表示标准误差。在干旱胁迫之后,与从播种前未经uv处理的(“对照”)种子所播种的秧苗相比,从进行uv-b处理的(“经uv处理的”)种子形成的羽衣甘蓝秧苗在播种之后72小时积累了更多的生物质并呈现更长的胚根长度。参见图4a-4b。
本试验支持了以下结论:uv-b种子处理提供对生长环境中遇到的产量限制胁迫,如干旱或盐胁迫的防护。
表2
**p<0.001时统计学显著的增加
实施例6–秧苗尺寸、叶片叶绿素水平和氮指数的分析
在本实施例中,使羽衣甘蓝种子经受uv-b处理,然后对生长的植物的秧苗尺寸、叶片叶绿素水平和相对氮指数都进行评估,所有这些都是良好植物性能的关键指标。
将羽衣甘蓝(brassicaoleraceavar.regal)种子浸入水中并在黑暗中保持在16℃。在4小时之后,用500μmolm-2s-1的连续红光/蓝光照射种子。用uv-led光源提供的1.01×10-4wcm-2s-1的uv-b光(其透射率在286nm处达到峰值)另外处理这些种子的50%。在处理6小时之后,将种子在16℃下风干72小时,然后播种。在10日龄时,对植物的子叶叶片尺寸进行评估,并且在21日龄时,评估植物的相对叶片叶绿素指数和氮指数(其使用dualexscientific+测定仪(force-a,orsay,france)进行测定)。
结果在以下表3中示出。“s.e.”表示标准误差。与从播种之前未经uv-b处理的(“对照”)种子生长的秧苗相比,在播种之前经uv-b处理的(“经uv处理的”)种子的羽衣甘蓝秧苗生长和植物性能明显提高。表3
实施例7–秧苗重量分析
按照实施例6,与未处理的羽衣甘蓝秧苗相比,测量经uv-b处理的种子的羽衣甘蓝秧苗重量。
根据上述实施例6所述的方法处理种子并使植物精确地生长。在8周龄时,收获植物并对叶片面积和鲜重进行定量。
如表4中所示,与从未经uv-b处理的(“对照”)种子生长的秧苗相比,从经uv-b处理的(“经uv处理的”)种子生长的羽衣甘蓝植物显示出5%的植物重量增加。此外,如通过uv处理的所得植物中的标准误差(s.e.)值降低所显示的,在uv种子处理的植物中,群体内鲜重的变化性降低了36%。这进一步支持了以下结论:用uv-b辐射处理用于播种的种子改善了后续植物性能。
表4
实施例8–第一片完全伸展叶片的尺寸分析
在本实施例中,评估了经uv-b处理和未经处理的样品的生菜秧苗的第4片完全伸展的叶片面积。幼小秧苗的真叶生长紧束(growthcompaction)可以成为针对生长环境中未来胁迫的抗逆性的良好指标。
将生菜(lactucasativavar.legacy)种子浸入水中并在黑暗中保持在16℃。6小时后,用500μmolm-2s-1的连续红光/蓝光照射种子。用uv-led光源提供的3.19×10-5wcm-2s-1的uv-b光(其透射率在286nm处达到峰值)另外处理这些种子的50%。在处理1小时、3小时、6小时(表5中分别为种子处理1、2和3)之后,将种子取出并在16℃下风干72小时,然后播种。在33日龄时,对第4片完全伸展的叶片面积进行评估。
结果如表5所示。观察到,与从播种之前未经uv处理的(“对照”)种子生长的秧苗相比,在播种之前经uv-b处理的(“经uv处理的”)种子的生菜秧苗的第4片完全伸展叶片的尺寸平均减少最大31%。“s.e.”表示标准误差。
这种初始生长紧束支持了对在移植生菜秧苗和其他作物中对抗生长环境中遇到的未来胁迫的抗逆性的诱导。
表5
**p<0.001时统计学显著的增加
实施例9–玉米植物的干重分析
在本实施例中,用uv-b辐射处理玉米种子,并将所得植物的性能参数范围与播种之前种子未经uv-b处理的植物进行比较。
将玉米(zeamaysvar.nzyellowflhybrid)种子浸入水中并在黑暗中保持在16℃。在16小时之后,用500μmolm-2s-1的连续红光/蓝光照射种子。用uv-led光源提供的3.19×10-5wcm-2s-1的uv-b光(其透射率在286nm处达到峰值)另外处理这些种子的50%。在处理9小时之后,将种子在16℃下风干72小时,然后播种。在4周龄时收获秧苗,并对幼苗和根的鲜重和干重进行定量。使用dualexscientific+叶绿素多酚测定仪(force-a,orsay,france)评估叶片叶绿素、黄酮类化合物的指数和氮指数。
结果如表6所示。观察到,与从播种之前未经uv-b处理的(“对照”)种子生长的秧苗相比,播种之前用uv-b处理的(“经uv处理的”)种子的玉米植物的整株植物干重增加。在作为对照的经uv处理的种子中观察到叶片黄酮类化合物水平和叶片氮指数的增加。“s.e.”表示标准误差。
这进一步支持了以下结论:用uv-b辐射处理用于播种的种子改善了后续植物性能。
表6
实施例10–生菜植物的耐旱性和水分利用效率
在与实施例5中看到的类似的研究中,评估了在播种之前种子经uv-b处理后11天对生菜植物施加的干旱胁迫的生理耐受性的增加。
将生菜(lactucasativavar.legacy)种子浸入水中并在黑暗中保持在16℃。在4小时之后,用500μmolm-2s-1的连续红光/蓝光照射种子。用uv-led光源提供的1.42×10-4wcm-2s-1的uv-b光(其透射率在286nm处达到峰值)另外处理这些种子的50%。在处理10小时之后,将种子在16℃下风干72小时,然后播种。4周后,将秧苗移植到单独的种植小室中,每个种植小室包含250ml的盆栽混合物,其最大持水量为130ml。对于一半经uv处理的秧苗和一半的对照秧苗,每个小室的盆栽混合物的水含量保持在130ml。使剩余的植物经受干旱胁迫——通过将每个小室的盆栽混合物的水含量保持在40ml来实现。在11天的干旱胁迫之后,使用delta-t气孔仪(delta-tdevices,cambridge,uk)评估气孔阻力,并使用dualexscientific+测定仪(force-a,orsay,france)计算叶片叶绿素、黄酮类化合物和氮含量的指数。
结果如表7所示。与未经uv-b处理的(“对照”)种子相比,源自在播种之前经uv-b处理的(“经uv处理的”)种子的生菜植物中,观察到对干旱胁迫的生理耐受性增加(由气孔阻力增加所指示的)。与对照相比,在经uv处理的充分浇水的植物中也观察到气孔阻力的增加,从而指示了不论干旱胁迫是否存在,从经uv处理的种子培育的植物均显示出增加的水分利用效率(wue)的潜力。“s.e.”表示标准误差。
这进一步支持了以下结论:uv-b种子处理提供针对在生长环境中遇到的产量限制胁迫如干旱或盐胁迫的防护。这些数据还支持以下结论:uv-b种子处理可以在从经uv处理的种子培育的植物中提供增加水分利用效率的能力。
表7
实施例11–对羽衣甘蓝和生菜植物的盐胁迫
在另一个测试中,使羽衣甘蓝植物(来自经uv-b处理的种子和未经处理的种子二者)经受盐胁迫。
将生菜(lactucasativavar.legacy)和羽衣甘蓝(brassicaoleraceavar.regal)种子浸入水中并在黑暗中保持在16℃。在4小时之后,用500μmolm-2s-1的连续红光/蓝光照射种子。用uv-led光源提供的1.42×10-2wcm-2s-1的uv-b光(其透射率在286nm处达到峰值)另外处理这些种子的50%。在生菜和羽衣甘蓝分别8小时和72小时之后,停止处理,将种子在16℃下风干72小时,然后播种。在4周后,将秧苗移植到250ml盆栽混合物中,该盆栽混合物的最大持水量为130ml。然后使一半的经uv引发的秧苗和一半的对照秧苗经受盐胁迫(150mm的nacl;每7天施用100ml;每3天加满水),并将剩余的秧苗用h2o浇灌。在盐胁迫25天之后,收获植物并评估幼苗重量。
结果如表8所示。与从播种之前未用uv-b处理的(“对照”)种子生长的植物相比,在播种之前种子经uv-b处理的(“经uv处理的”)羽衣甘蓝和生菜植物二者中对盐胁迫的敏感性降低了13%(在植物鲜重的盐度诱导的减少方面)。
这进一步表明uv-b种子处理提供了针对生长环境中遇到的产量限制胁迫,如干旱或盐胁迫的防护。
表8
实施例12–通过生菜的叶基色素测量的作物品质的分析
为了评估作物品质(例如颜色、味道、保质期),在播种之前对种子进行uv-b处理之后评估生菜的红色栽培品种中的叶基色素。这样的红色色素如花色素苷的增加与作物质量、味道和保质期的增加相关。zhang等人anthocyaninsdoubletheshelflifeoftomatoesbydelayingoverripeningandreducingsusceptibilitytograymold.currentbiology.23(12):1094-1100(2013)。
将生菜(lactucasativavar.redoak)种子浸入水中并在黑暗中保持在16℃。在3小时之后,使种子经受500μmolm-2s-1的连续红光/蓝光,其中这些种子的50%另外接收由uv-led光源提供的1.42×10-4wcm-2s-1的uv-b光(其透射率在286nm处达到峰值)。在初始吸收过程后12小时,从水中取出种子并进行uv-b处理。将种子在16℃下风干72小时,然后播种。在35天后,使用dualexscientific+叶绿素多酚测定仪(force-a,orsay,france)在秧苗中评估花色素苷(红叶色素)的指数。然后将秧苗干燥至恒定质量,以便表示每单位(g)植物干重的花色素苷。
结果如以下表9所示。观察到,与从播种之前未经uv处理的(“对照”)种子生长的植物相比,来自播种之前经uv-b处理的(“经uv处理的”)种子的生菜的红色栽培品种中的叶基色素增加。“s.e.”表示标准误差。
这些数据支持以下结论:uv种子处理可以提升从经处理的种子生长的植物的诸如颜色、味道、保质期等的作物品质特性。
表9
实施例13–经处理的种子的种子发芽增加
在本实施例中,用uv-b处理或不用uv-b处理玉米种子,随后评估种子发芽。
将玉米(zeamaysvar.nzyellowflhybrid)种子浸入水中并在黑暗中保持在16℃。在20小时之后,用500μmolm-2s-1的连续红光/蓝光照射种子。用uv-led光源提供的3.19×10-5wcm-2s-1的uv-b光(其透射率在286nm处达到峰值)另外处理这些种子的50%。在处理8小时、24小时、32小时(表10中分别为种子处理1、2和3)之后,将种子在16℃下风干72小时,然后播种,随后评估发芽成功。
结果如表10所示。可以看出,与播种之前未用uv-b处理的(“对照”)种子相比,在润湿发芽之前用uv-b处理(“经uv处理的”)种子的情况下种子的发芽提高。
这支持使用uv-b处理种子来提高种子的发芽能力。
表10
实施例14–使用另一uv-b峰值波长来提高干旱胁迫下的秧苗发芽
在与实施例5中所见的类似的研究中,评估了在播种之前对这些种子进行uv-b处理后对种子发芽期间施加的干旱胁迫的生理耐受性的增加。在本实施例中,使用uv-b波段内的不同峰值波长。
将羽衣甘蓝(brassicaoleraceavar.regal)种子浸入水中并在黑暗中保持在16℃。在4小时之后,用500μmolm-2s-1的连续红光/蓝光照射种子。这些种子的50%如前所述只用红光/蓝光进行处理,而剩余的50%用uv-led光源提供的1.64×10-5wcm-2s-1的uv-b光(其透射率在317nm处达到峰值)另外处理。在处理30小时之后,将种子在16℃下风干72小时。
然后使种子在发芽期间经受干旱胁迫。使uv引发的种子和对照种子在水或两种浓度的peg8000(-1、-1.5mpa)之一中发芽。在72小时之后,对秧苗重量和胚根长度进行定量。
结果如以下表11所示。在干旱胁迫之后,与从播种前未经uv处理的(“对照”)种子所播种的秧苗相比,从进行uv-b处理的(“经uv处理的”)种子形成的羽衣甘蓝秧苗在播种之后72小时积累了更多的生物质并呈现更长的胚根长度。“s.e.”表示标准误差。
本实施例支持了以下结论:uv种子处理提供对生长环境中遇到的产量限制胁迫,如干旱或盐胁迫的防护,并且本公开内容的优点可以通过使用在uv-b波段内的不同波长的处理来实现。
表11
实施例15–采用不同剂量的uv-b照射持续不同长度的时间后,种子中黄酮类化合物水平的提高
评估了uv-b照射的剂量和时间长度对黄酮类化合物水平的影响。
将储存在4℃的种子在冷水下清洗以去除红色杀菌剂包衣。将种子在植物生长室中引发,然后浸水16小时。然后用具有uv-b(“uv”)或没有uv-b(“无uv”)的可见光处理种子。使用13kjm-2或100kjm-2的辐照度剂量。uv-b光由led光源提供,其透射率在280nm处达到峰值。“未引发,无uv”是未暴露于uv且未浸入水中的对照样品。
如图5a所示,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2的uv-b剂量分别显著提高了黄酮类化合物水平。在图5b中,与无uv13kjm-2种子或无uv100kjm-2种子相比,13kjm-2和100kjm-2的uv-b剂量分别显著提高了黄酮类化合物水平,尤其是100kjm-2辐照度剂量。与无uv13kjm-2种子或无uv100kjm-2种子相比,用13kjm-2和100kjm-2剂量的uv-b处理的种子也分别表现出提高的黄酮类化合物水平,如图5c所示。图5d显示黄酮类化合物水平的提高。图5e显示在13kjm-2或100kjm-2的uv-b照射后的黄酮类化合物水平的提高。如图5f所示,uv-b照射提高了黄酮类化合物水平。如图5g所示,13kjm-2或100kjm-2uv-b照射的剂量提高了黄酮类化合物水平。图5h描绘了响应于13kjm-2或100kjm-2的uv-b处理的提高的黄酮类化合物水平。通常,与未用uv-b处理的样品相比,uv补充被显示为提高黄酮类化合物水平,特别是如图5a-5c所示。图5a-5c图示了特别有效的剂量参数,其中种子用13kjm-2或100kjm-2的uv-b照射进行处理。
实施例16–采用不同剂量的uv-b照射持续不同长度的时间后,种子中花色素苷水平的提高
在种子中测定了uv-b照射的剂量和时间长短对花色素苷水平的影响。
将储存在4℃的种子在冷水下清洗以去除红色杀菌剂包衣。将种子在植物生长室中引发,然后浸水16小时。然后用具有uv-b(uv)或没有uv-b(无uv)的可见光处理种子。使用13kjm-2或100kjm-2的辐照度剂量。uv-b光由led光源提供,其透射率在280nm处达到峰值。对于13kjm-2,光处理9小时,对于100kjm-2,光处理21小时。“未引发,无uv”样品是未暴露于uv且未浸入水中的对照样品。
如图6a所示,13kjm-2和100kjm-2的uv-b照射剂量提高了花色素苷水平。参照图6b,13kjm-2提高了花色素苷水平。参照图6c,13kjm-2和100kjm-2的uv-b照射剂量提高了花色素苷水平。参照图6d,用100kjm-2的uv-b照射处理的种子表现出提高的花色素苷水平。如图6a-6d所示,13kjm-2或100kjm-2剂量的uv-b处理提高了花色素苷水平。
实施例17–uv-b与可见光共同施用对秧苗重量的影响
测量了可见光与uv-b处理的组合对秧苗重量的影响。
将储存在4℃的种子在冷水下清洗以去除红色杀菌剂包衣。将种子在植物生长室中引发,然后浸水16小时。然后用可见光和uv-b(“uv”)或没有uv-b的可见光(“无uv”)处理种子9小时。uv-b光由led光源提供,其透射率在280nm处达到峰值。“np”是指未引发的种子,其中种子未浸入水中但用可见光和uv-b处理。黑暗是指种子在无可见光的情况下进行。使用的可见光辐照度为20umolm-2s-1、50umolm-2s-1和400umolm-2s-1。
如图7所示,在无uv种子(黑条,在给定柱对的左侧)或经uv-b处理的种子(散列条,在给定柱对的右侧)中评估20umolm-2s-1、50umolm-2s-1和400umolm-2s-1的可见光辐照度对秧苗干重的影响。与未引发的细胞和黑暗对照相比,uv-b与可见光的共同施用导致秧苗干重增加。
本实施例显示了在uv-b与可见光共同施用后秧苗干重的增加。
实施例18–uv-b照射对玉米种子生产力的影响
测量了uv-b照射的长期影响。
将储存在4℃的玉米种子(zeamays)在冷水下清洗以去除红色杀菌剂包衣。类似于先前的实施例对种子进行处理。种子处理包括无uv(“对照”)和uv-b施用(“uv-b”)。
使用两个田地场所来播种经处理的种子。一个场所由粉砂壤土类型组成。另一个场所由砂壤土类型组成。两个试验场所均为四行宽,每行间隔30英寸,间隔5.1英寸播种种子,并且行位于大规模商业玉米群体中。该播种密度提供了40,000粒种子/英亩的等效密度。一个场所的试验区长度为50英尺,并且另一个场所的试验区长度为150英尺。两个试验场所的结果一起进行分析。
图8a-8g描绘了使用本文所述的方法的uv-b照射对玉米种子生产力的示例性效果。如图8a所示,uv-b照射使以克为单位的整个穗轴干重显著增加12%。如图8b所示,在uv-b照射处理之后每个穗轴的籽粒总干重显著增加9%。如图8c所示,在uv-b照射的情况下根干重增加43%。如图8d所示,秸秆鲜重显著增加24%。如图8e所示,每个穗轴的籽粒数目增加4%,并且如图8f所示,在uv-b照射处理的情况下,每个穗轴的籽粒行数显著提高2.5%。如图8g所示,uv-b照射使单个籽粒干重显著增加6%。
图8a-8g表明施加uv-b照射增加了玉米种子生产力的数个参数。
实施例19–用于引发的种子的准备
为了准备用于引发的种子,将在4℃下储存的玉米种子(zeamays)在冷水下清洗。在清洗种子以去除红色杀菌剂包衣后,将种子干燥。然后将种子胚侧向上排列在种子盘上。通常,将种子在多个盘之间分开以减少伪重复。然后将种子在4℃下放置过夜。
然后将种子在25℃和相对95%湿度的植物生长室中在黑暗中引发。组装led面板,其中高度为80mm,uv面板之间的距离为10mm,并且uv与控制面板之间的最小距离为400mm。向种子托盘中装入50ml水以用于种子吸收,使得完全浸没的种子的水位为1-2mm左右。任何漂浮的种子均被轻敲下直至完全浸没。
将种子托盘直接布置在面板下方。将阵列放置在8cm的高度处并且在每个处理之间间隔20cm,以防止来自相邻处理的直接照射。在面板上放置盖子以避免蒸发,但在处理开始时移除。监测水位,并更换蒸发的水。
将种子在水中吸收16小时,然后进行光处理。将uv设置为具有4x10-5至1.3x10-4wcm-2s-1的范围内的辐照度。uv-b波长为约2280±5nm。uv-b的剂量可在约0kjm-2至100kjm-2的范围内。uv-b剂量通常为13kjm-2或100kjm-2。
在处理9小时之后,关闭光处理和生长室。然后将种子风干72小时。
然后播种种子并分析不同的性能参数。
一旦子叶足够大(通常是第5天),就收获秧苗。使用dualexscientific+测定仪(force-a,orsay,france)计算叶片叶绿素、黄酮类化合物和氮含量的指数。
当秧苗在21日龄、阶段v2时,也收获种子。采集幼苗鲜重、叶片面积以及幼苗干重。
实施例20–生菜中的uv施用
采用组合条件处理球生菜种子,然后分析幼苗鲜重、叶片叶绿素水平和黄酮类化合物水平。
将生菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)中引发。种子在10℃的生长室中施用uv-b达0小时、8小时、21小时或27小时。所施用的uv-b照射剂量为40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)。在uv-b施用期间将种子放置在潮湿的滤纸上方。“对照”是指无uv-b处理,其中将种子浸入引发介质中但不接受uv。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。
然后播种种子并针对不同的性能参数进行分析。收获秧苗,并评估幼苗鲜重(图12)、叶绿素水平(图13)和黄酮类化合物水平(图14)。
参照图12,与对照(黑条)相比,高uv-b辐照度施用8小时导致幼苗鲜重(g/植物,y轴)的显著增加。与对照(黑条)相比,中等uv-b辐照度施用21小时导致幼苗鲜重显著增加约42%。与对照(黑条)相比,高uv-b辐照度施用21小时导致幼苗鲜重显著增加约38%。
参照图14,与对照(黑条)相比,低uv-b辐照度施用8小时导致黄酮类化合物水平显著增加约14%。
本实施例显示,包括引发以及施用多种辐照度和持续时间的uv-b的处理条件提高了植物性能。
实施例21–青花菜中的引发和uv施用
用多种引发条件处理青花菜种子,然后分析幼苗鲜重、幼苗干重、根干重、叶片叶绿素水平和黄酮类化合物水平。
测试不同的引发方法。将第一组青花菜种子在蒸馏水(“水”)中引发。将第二组青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)(“渗透”)中引发。两组青花菜种子均引发8、18、19.5、24、27或44小时。两组青花菜种子均在22℃的生长室中施用100uwcm-2uv-b辐照度。在uv-b施用期间,将种子浸没在引发介质中。
然后播种种子并对不同的性能参数进行分析。收获秧苗,并评估幼苗鲜重(图15)、幼苗干重(图16)、根干重(图17)、叶绿素水平(图18)和黄酮类化合物水平(图19)。“*”指示显著性差异,p<0.05。
参照图15,测量在peg中引发然后未施用uv-b的种子(“渗透-对照”,白条)和在peg中引发然后施用uv-b的种子(“渗透-uv”,黑条)中的幼苗鲜重(g/植物,y轴)。还测量在蒸馏水中引发然后未施用uv-b的种子(“水-对照”,方格条)和在蒸馏水中引发然后施用uv-b的种子(“水-uv”,水平散列条)中的幼苗鲜重。与渗透-对照相比,渗透-uv种子引发8小时表现出幼苗鲜重减少约34%的差异。渗透-对照与水-对照之间也存在显著性差异。
参照图16,测量在peg中引发然后未施用uv-b的种子(“渗透-对照”,白条)和在peg中引发然后施用uv-b的种子(“渗透-uv”,黑条)中的幼苗干重(g/植物,y轴)。还测量在蒸馏水中引发然后未施用uv-b的种子(“水-对照”,方格条)和在蒸馏水中引发然后施用uv-b的种子(“水-uv”,水平散列条)中的幼苗干重。与渗透-对照相比,渗透-uv种子引发8小时表现出幼苗干重减少约31%的差异。渗透-对照与水-对照之间也存在显著性差异。
参照图17,测量在peg中引发然后未施用uv-b的种子(“渗透-对照”,白条)和在peg中引发然后施用uv-b的种子(“渗透-uv”,黑条)中的根干重(g/植物,y轴)。还测量在蒸馏水中引发然后未施用uv-b的种子(“水-对照”,方格条)和在蒸馏水中引发然后施用uv-b的种子(“水-uv”,水平散列条)中的根干重。与渗透-对照相比,渗透-uv种子引发8小时表现出根干重减少约27%的差异。渗透-对照与水-对照之间也存在显著性差异。
参照图18,测量在peg中引发然后未施用uv-b的种子(“渗透-对照”,白条)和在peg中引发然后施用uv-b的种子(“渗透-uv”,黑条)中的叶绿素水平(相对单位,y轴)。还测量在蒸馏水中引发然后未施用uv-b的种子(“水-对照”,方格条)和在蒸馏水中引发然后施用uv-b的种子(“水-uv”,水平散列条)中的叶绿素水平。在8小时,渗透-对照的叶绿素水平比水-对照或水-uv显著更高。
参照图19,测量在peg中引发然后未施用uv-b的种子(“渗透-对照”,白条)和在peg中引发然后施用uv-b的种子(“渗透-uv”,黑条)中的黄酮类化合物水平(相对单位,y轴)。还测量在蒸馏水中引发然后未施用uv-b的种子(“水-对照”,方格条)和在蒸馏水中引发然后施用uv-b的种子(“水-uv”,水平散列条)中的黄酮类化合物水平。与渗透引发相比,水引发之间黄酮类化合物水平存在显著性差异。
本实施例显示了使用不同条件的引发方法和uv-b施用的植物性能的改善。
实施例22–青花菜中的种子定位和uv施用
在青花菜种子中评估在uv-b施用期间种子定位的影响。评估幼苗鲜重、幼苗干重、根干重、叶片叶绿素水平和黄酮类化合物水平。
在蒸馏水中引发青花菜种子。然后将种子在10℃的生长室中施用uv-b达18小时、20小时、21小时、24小时、27小时或28小时。在uv-b施用期间,将第一组种子放置在潮湿的滤纸上(“漂浮”)。在uv-b施用期间,将第二组种子完全浸没在引发介质中(“浸没”)。uv-b以100uwcm-2uv-b辐照度进行施用。
然后播种种子并对不同的性能参数进行分析。收获秧苗,并评估幼苗鲜重(图20)、幼苗干重(图21)、根干重(图22)、叶绿素水平(图23)和黄酮类化合物水平(图24)。“*”指示显著性差异,p<0.05。“+”指示p=0.06。
参照图20,测量放置在潮湿的滤纸上的未施用uv-b(“漂浮-对照”,白条)或施用uv-b(“漂浮-uv”,黑条)的种子的幼苗鲜重(g/植物,y轴)。还测量完全浸没在引发介质中的未施用uv-b(“浸没-对照”,方格条)或施用uv-b(“浸没-uv”,水平散列条)的种子的幼苗鲜重。与漂浮-对照种子相比,施用uv-b达20小时的漂浮-uv种子表现出幼苗鲜重显著增加约56%。与浸没-对照种子相比,施用uv-b达21小时的浸没-uv种子表现出幼苗鲜重显著增加约30%。在28小时,漂浮-对照与浸没-uv之间存在差异。
参照图21,测量放置在潮湿的滤纸上的未施用uv-b(“漂浮-对照”,白条)或施用uv-b(“漂浮-uv”,黑条)的种子的幼苗干重(g/植物,y轴)。还测量完全浸没在引发介质中的未施用uv-b(“浸没-对照”,水平散列条)或施用uv-b(“浸没-uv”,方格条)的种子的幼苗干重。与漂浮-对照种子相比,施用uv-b达20小时的漂浮-uv种子表现出幼苗干重显著增加约56%。与浸没-对照种子相比,施用uv-b达21小时的浸没-uv种子表现出幼苗干重显著增加约41%。在28小时,浸没-uv与漂浮-对照之间也存在显著性差异。
参照图22,测量放置在潮湿的滤纸上的未施用uv-b(“漂浮-对照”,白条)或施用uv-b(“漂浮-uv”,黑条)的种子的根干重(g/植物,y轴)。还测量完全浸没在引发介质中的未施用uv-b(“浸没-对照”,方格条)或施用uv-b(“浸没-uv”,水平散列条)的种子的根干重。与漂浮-对照相比,施用uv-b达20小时的漂浮-uv种子表现出根干重增加约50%。与浸没-对照相比,施用uv-b达21小时的浸没-uv种子表现出根干重增加约32%。
参照图23,测量放置在潮湿的滤纸上的未施用uv-b(“漂浮-对照”,白条)或施用uv-b(“漂浮-uv”,黑条)的种子的叶绿素水平(相对单位,y轴)。还测量完全浸没在引发介质中的未施用uv-b(“浸没-对照”,方格条)或施用uv-b(“浸没-uv”,水平散列条)的种子的叶绿素水平。与漂浮-对照相比,施用uv-b达20小时的漂浮-uv种子表现出显著增加约8%。浸没-uv与漂浮-对照之间也存在显著性差异。
参照图24,测量放置在潮湿的滤纸上的未施用uv-b(“漂浮-对照”,白条)或施用uv-b(“漂浮-uv”,黑条)的种子的黄酮类化合物水平(相对单位,y轴)。还测量完全浸没在引发介质中的未施用uv-b(“浸没-对照”,方格条)或施用uv-b(“浸没-uv”,水平散列条)的种子的黄酮类化合物水平。与漂浮-对照相比,施用uv-b达24小时的漂浮-uv种子表现出黄酮类化合物水平增加14%。
本实施例显示了种子定位随后uv-b施用而导致的植物性能的改善。
实施例23–青花菜中的uv-b照射
采用组合条件处理青花菜种子,然后分析幼苗鲜重、下胚轴长度、叶片面积、叶片叶绿素水平和黄酮类化合物水平。
将青花菜种子在溶解于蒸馏水中的-1.25bar聚乙二醇(peg)中引发。种子在10℃的生长室中施用uv-b达0、8、21或27小时。所施用的uv-b照射剂量为40uwcm-2(“低”,斜散列条)、100uwcm-2(“中等”,水平散列条)和200uwcm-2(“高”,方格条)。“对照”(黑条)是指无uv-b处理,其中种子浸入引发介质中但未接受uv。“np”是指未引发的种子,其中种子未浸入peg中也未接受uv处理。在uv-b施用期间将种子放置在潮湿的滤纸上。
然后播种种子并对不同的性能参数进行分析。收获秧苗,并评估幼苗鲜重(图25)、下胚轴长度(图26)、叶片面积(图27)、叶绿素水平(图28)和黄酮类化合物水平(图29)。
参照图25,与对照(黑条)相比,中等uv-b辐照度施用21小时导致幼苗鲜重(g/植物,y轴)显著增加约22%。与对照(黑条)相比,高uv-b辐照度施用21小时导致幼苗鲜重(g/植物,y轴)显著增加约56%。与对照(黑条)相比,高uv-b辐照度施用27小时导致幼苗鲜重(g/植物,y轴)显著增加约27%。
参照图26,与对照相比,中等uv-b辐照度施用8小时导致下胚轴长度减少约13%的显著性差异。与对照(黑条)相比,高uv-b辐照度施用21小时导致下胚轴长度显著增加约10%。与对照(黑条)相比,中等uv-b辐照度施用27小时导致下胚轴长度显著增加约6%。与对照(黑条)相比,高uv-b辐照度施用27小时导致下胚轴长度显著增加约17%。
参照图27,与对照(黑条)相比,中等uv-b辐照度施用21小时导致叶片面积(cm2/植物)显著增加约27%。与对照(黑条)相比,高uv-b辐照度施用21小时导致叶片面积(cm2/植物)显著增加约67%。与对照(黑条)相比,高uv-b辐照度施用27小时导致叶片面积(cm2/植物)显著增加约26%。
参照图28,与对照(黑条)相比,高uv-b辐照度施用27小时导致叶绿素(相对单位)减少约13%。
参照图29,与对照(黑条)相比,高uv-b辐照度施用8小时导致黄酮类化合物(相对单位)减少约15%的显著性差异。
本实施例说明,包括引发方法以及多种uv-b辐照度和持续时间的处理条件影响植物性能。
实施例24–uv-b施用对生菜叶中保护性次级代谢物的影响
测定了uv-b施用对生菜叶中黄酮类化合物水平的影响。
将生菜种子引发并施用uv-b。对照种子是被引发但未施用uv-b的种子。未引发的种子是从相同种子批次生长但未引发且未施用uv-b的种子。在播种后45天对2-3真叶期的叶子进行取样,以使用dualex光学传感器测定叶的黄酮类化合物水平(相对单位)。进行了两次独立的实验。分析来自uv-b施用的种子的总计34株植物、来自未经uv-b处理的种子的总计35株植物和来自无uv-b且未引发的种子的总计64株植物。
参照图30,与来自未经uv-b处理的种子(“对照”,白条)的植物和来自无uv-b且未引发的种子(“未引发”,水平散列条)的植物相比,来自施用uv-b的种子(“uv-b”,黑条)的植物表现出以相对单位计的黄酮类化合物(y轴)的显著增加。
该图显示,种子的uv-b施用导致所得植物中保护性次级代谢物增加。
实施例25–uv-b施用对青花菜茎伸长的影响
测定了uv-b施用对青花菜茎伸长的影响。
将青花菜种子引发并施用uv-b。对照种子是被引发但未施用uv-b的种子。未引发的种子是从相同种子批次生长但未引发且未施用uv-b的种子。在播种后45天对植物下胚轴进行评估。进行了三次独立的实验。分析来自uv-b施用的种子的总计27株植物、来自未经uv-b处理的种子的总计35株植物和来自无uv-b且未引发的种子的总计39株植物。
参照图31,与来自未经uv-b处理的种子(“对照”,白条)的植物和来自无uv-b且未引发的种子(“未引发”,水平散列条)的植物相比,来自施用uv-b的种子(“uv-b”,黑条)的青花菜植物表现出下胚轴长度(mm,y轴)显著减小。
该图显示了种子的uv-b施用影响下胚轴伸长。
实施例26–uv-b施用对生菜植物生物量的影响
uv-b施用后测定生菜植物生物量。
将生菜种子引发并施用uv-b。对照种子是被引发但未施用uv-b的种子。未引发的种子是从相同种子批次生长但未引发且未施用uv-b的种子。在播种后45天收获植物以测量幼苗鲜重。分析来自uv-b施用的种子的总计66株植物、来自未经uv-b处理的种子的总计60株植物和来自无uv-b且未引发的种子的总计64株植物。
参照图32,与来自未经uv-b处理的种子(“对照”,白条)的植物和来自无uv-b且未引发的种子(“未引发”,水平散列条)的植物相比,从施用uv-b的种子(“uv-b”,黑条)生长的生菜植物的植物鲜重(克,y轴)显著增加。
该图显示了种子的uv-b施用导致所得植物中植物生物量增加。
实施例27–uv-b施用对玉米秧苗生长的影响
测定了uv-b施用对玉米秧苗生长的影响。
将玉米种子(zeamays)引发并施用uv-b。对照种子是被引发但未施用uv-b的种子。在4周龄时收获秧苗。
参照图33a,与来自未经uv-b处理的种子(“对照”,白条)的植物相比,来自施用uv-b的玉米种子(“uv-b”,黑条)的秧苗干重(克,y轴)增加26%。
参照图33b,与来自未经uv-b处理的种子(“对照”,白条)的植物相比,来自施用uv-b的玉米种子(“uv-b”,黑条)的根干重(克,y轴)增加28%。
该图显示了种子的uv-b施用导致所得秧苗中的生长增加。
实施例28-uv-b施用后生菜秧苗中的气孔阻力
测定生菜秧苗中的气孔阻力。
将生菜种子引发并施用uv-b。对照种子是被引发但未施用uv-b的种子。在4周时,使来自uv-b照射的种子和对照种子的秧苗经受11天的充分浇水或干旱条件。
参照图34,来自施用uv-b的种子(“uv-b”,黑条)的秧苗在充分浇水的条件下表现出增加的气孔阻力。
该图显示了uv-b施用导致水分利用效率提高。
实施例29–采用不同剂量的uv-b的种子中黄酮类化合物和花色素苷水平的改善
测量用280nm的uv-b照射后的种子中黄酮类化合物和花色素苷的水平。
将储存在4℃的种子在冷水下清洗以去除红色杀菌剂包衣。将种子在植物生长室中引发,然后浸水16小时。然后用具有uv-b(uv)或没有uv-b(无uv)的可见光处理种子9小时。uv-b光由led光源提供,其透射率在280nm处达到峰值。将uv设置为具有在4x10-5至1.3x10-4wcm-2s-1的范围内的辐照度。uv-b的剂量可在约0kjm-2和100kjm-2的范围内。uv-b剂量通常为约13kjm-2或约100kjm-2。
在处理9小时之后,关闭光处理和生长室。然后将种子风干72小时。
通过种子在酸化甲醇中的均质化、离心以及通过分光光度计在300nm处测量上清液吸光度来进行uv-b吸收化合物如黄酮类化合物的分析。使用dualexscientific+叶绿素多酚测定仪(force-a,orsay,france)评估种子中的花色素苷。
本实施例说明了不同剂量的uv-b对种子中黄酮类化合物和花色素苷水平的影响。
实施例30–采用不同剂量的uv-b的植物性能的改善
评估280nm剂量的uv-b对植物性能的影响。
将储存在4℃的种子在冷水下清洗以去除红色杀菌剂包衣。将种子在植物生长室中引发,然后浸水16小时。然后用具有uv-b(uv)或没有uv-b(无uv)的可见光处理种子9小时。uv-b光由led光源提供,其透射率在280nm处达到峰值。将uv设置为具有在4x10-5至1.3x10-4wcm-2s-1的范围内的辐照度。uv-b的剂量可在约0kjm-2和100kjm-2的范围内。uv-b剂量通常为约13kjm-2或约100kjm-2。在处理9小时之后,关闭光处理和生长室。然后将种子风干72小时。
在4周龄时收获秧苗。使用dualexscientific+测定仪(force-a,orsay,france)计算叶片叶绿素、黄酮类化合物和氮含量的指数。还测量了尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸和根干重。
相比于未用uv-b处理的种子,在播种前用uv-b处理的种子中的黄酮类化合物水平、花色素苷水平、尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸和根干重中的至少一种有所增加。
本实施例说明了从用280nm剂量的uv-b照射的种子种植的秧苗中的植物性能得到改善。
实施例31–采用不同剂量的uv-b、响应于胁迫的植物性能的改善
评估了280nmuv-b剂量对响应于胁迫的用uv-b照射的种子中植物性能的影响。
将储存在4℃的种子在冷水下清洗以去除红色杀菌剂包衣。将种子在植物生长室中引发,然后浸水16小时。然后用具有uv-b(uv)或没有uv-b(无uv)的可见光处理种子9小时。uv-b光由led光源提供,其透射率在280nm处达到峰值。将uv设置为具有在4x10-5至1.3x10-4wcm-2s-1的范围内的辐照度。uv-b的剂量可在约0kjm-2和100kjm-2的范围内。uv-b剂量通常为约13kjm-2或约100kjm-2。在处理9小时之后,关闭光处理和生长室。然后将种子风干72小时。
4周后,将秧苗移植到单独的种植室。对于一半的经uv-b处理的室和一半的未经uv-b处理的室,这些室经受热、洪水、霜冻或高可见光胁迫中的一种。将暴露于热的室保持在37℃。将暴露于霜冻的室保持在4℃。将暴露于洪水胁迫的室浸没在水中。将其他室暴露于400-500nm的高可见光胁迫。
在热、洪水、霜冻或高可见光胁迫的11天后,使用dualexscientific+测定仪(force-a,orsay,france)计算叶片叶绿素、黄酮类化合物和氮含量的指数。还测量了尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸和根干重。
相比于未用uv-b处理的种子,在播种前用uv-b处理的种子中的黄酮类化合物水平、花色素苷水平、尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸和根干重中的至少一种有所增加。此外,与来自未经uv-b照射的种子的植物相比,来自用uv-b照射的种子的植物显示出改善的响应于胁迫的植物性能。
本实施例说明了从用uv-b照射的种子种植的秧苗响应于胁迫的植物性能改善。
实施例32–采用不同剂量的uv-b、响应于疾病的植物性能的改善
测试了280nmuv-b剂量对用uv-b照射的种子在疾病胁迫后的植物性能的影响。
将储存在4℃的种子在冷水下清洗以去除红色杀菌剂包衣。将种子在植物生长室中引发,然后浸水16小时。然后用具有uv-b(uv)或没有uv-b(无uv)的可见光处理种子9小时。uv-b光由led光源提供,其透射率在280nm处达到峰值。将uv设置为具有在4x10-5至1.3x10-4wcm-2s-1的范围内的辐照度。uv-b的剂量可在约0kjm-2和100kjm-2的范围内。uv-b剂量通常为约13kjm-2或约100kjm-2。在处理9小时之后,关闭光处理和生长室。然后将种子风干72小时。
4周后,将秧苗移植到单独的种植室。对于一半的经uv-b处理的室和一半的未经uv-b处理的室,这些室接种真菌病原体、细菌、卵菌、病毒、类病毒、病毒样生物体、植原体、原生动物、线虫和寄生虫的任一疾病。
4天后,使用dualexscientific+测定仪(force-a,orsay,france),计算叶片叶绿素、黄酮类化合物和氮含量的指数。还测量了尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸和根干重。
相比于未用uv-b处理的种子,在播种前用uv-b处理的种子中的黄酮类化合物水平、花色素苷水平、尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸和根干重中的至少一种有所增加。此外,在疾病接种后,与来自未经uv-b照射的植物的植物相比,来自经uv-b照射的种子的植物显示出改善的植物性能。
本实施例说明了从用uv-b照射的种子种植的秧苗响应于疾病的植物性能改善。
实施例33–来自用uv-b照射的种子的植物的环境影响减少
将储存在4℃的种子在冷水下清洗以去除红色杀菌剂包衣。将种子在植物生长室中引发,然后浸水16小时。然后用具有uv-b(uv)或没有uv-b(无uv)的可见光处理种子9小时。uv-b光由led光源提供,其透射率在280nm处达到峰值。将uv设置为具有在4x10-5至1.3x10-4wcm-2s-1的范围内的辐照度。uv-b的剂量可在约0kjm-2和100kjm-2的范围内。uv-b剂量通常为约13kjm-2或约100kjm-2。在处理9小时之后,关闭光处理和生长室。然后将种子风干72小时。
4周后,将秧苗移植到单独的种植室。对于一半的经uv-b处理的室和一半的未经uv-b处理的室,与标准方案相比,这些室含有肥料减少20%的土壤。在另一组中,对于一半的经uv-b处理的室和一半的未经uv-b处理的室,施加比对照植物减少20%的杀虫剂、除草剂或农药中的任何一种,每周施用一次。
在另外的四周后,使用dualexscientific+测定仪(force-a,orsay,france)计算叶片叶绿素、黄酮类化合物和氮含量的指数。还测量了尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸和根干重。
相比于未用uv-b处理的种子,在播种前用uv-b处理的种子中的黄酮类化合物水平、花色素苷水平、尺寸、干重、氮指数、幼苗干重、幼苗鲜重、幼苗长度、根长度、色素产量、叶片尺寸和根干重中的至少一种有所增加。此外,与来自用肥料生长或暴露于杀虫剂、除草剂或农药的未经uv-b处理的种子的那些植物相比,来自经uv-b处理的种子的植物表现出相等或甚至改善的植物性能。数据表明,与对照植物相比,来自经uv-b照射的种子的植物需要更少的肥料、杀虫剂、除草剂或农药。
本实施例说明了来自uv-b照射的种子的生长的植物的环境影响,以肥料、除草剂、杀虫剂或农药的使用减少来衡量。
虽然本文已经示出并描述了本公开内容的优选实施方式,但对于本领域技术人员显而易见的是,这些实施方式仅以示例的方式提供。本领域技术人员在不脱离本公开内容的情况下现将会想到多种变化、改变和替换。应当理解,本文中描述的本公开内容实施方式的各种替代方案可用于实施本发明。旨在以所附权利要求限定本公开内容的范围,并由此涵盖这些权利要求范围内的方法和结构及其等同项。
- 还没有人留言评论。精彩留言会获得点赞!