角膜新生血管动物模型及其构建方法
1.本发明属于动物模型技术领域,具体涉及一种角膜新生血管动物模型及其构建方法。
背景技术:
2.角膜新生血管动物模型是研究角膜新生血管的调控机制、探索和评价其防治方法的重要手段。通过物理、化学、生物、手术等各种不同的手段造模,人为地诱发角膜新生血管增生,产生类似于人类疾病的模型。目前诱导角膜新生血管模型的主要方法有:(1)角膜囊袋法:角膜囊袋法通过在角膜层间制造一个囊袋,并将诱导剂放入囊袋内,通过不断释放诱导剂从而诱生角膜新生血管的一种动物模型,该模型创伤小,成模后易于定量分析的优点
[1-3]
。(2)化学方法:采用碱性化学药品氢氧化钠、硝酸银、硝酸钾等,化学试剂在角膜内的作用持续时间较长,且可能会与抑制剂共同作用于角膜新生血管,干扰实验结果。(3)物理方法:包括热烙术和角膜缝线术,这类造模方法难度大、创伤大、效率低,对角膜造成一定程度的损失,干扰试验结果。(4)免疫原性cnv动物模型:主要采用异种角膜移植或角膜基质内注射牛白蛋白,用于探索免疫原性cnv的调控机制、评价cnv和移植排斥反应的治疗方法。角膜移植创伤大,且术后恢复时间长,影响和干扰实验观察。
[0003]
角膜囊袋法,常采用诱导剂在角膜基质层间植入,既往有使用明胶海棉蘸取500ng碱性成纤维细胞生长因子(bfgf)后,再用2%的琼脂糖包裹,将干燥后的小丸植入家兔角膜基质层,制作角膜新生血管模型,该方法一方面制备的明胶海绵-bfgf-琼脂糖缓释药丸较大,不适用于小鼠角膜囊袋植入,且制备缓释药丸需要4-5天,时间较长,增加了科研周期。另一方面明胶海绵长期以来一直应用于外科临床,用来止血和促进伤口愈合,其对角膜新生血管还是存在一些自身的刺激因素,干扰了实验结果。因此存在造模时间长、成本高、造模难度大的缺点,容易造模失败,增加了科研经费的投入。
技术实现要素:
[0004]
针对现有技术中的不足,本发明的首要目的是提供一种角膜新生血管动物模型。该模型是在角膜囊袋术的思路基础上,结合滤纸植入,既避免了角膜缝线模型的造模难度大、创伤大、效率低等问题,也可简单、有效、可控,通过在角膜层间植入经促血管生长因子浸润后的大小一致的滤纸诱导角膜新生血管,造模时间短、成本低、创伤小,且可重复性高为研究角膜新生血管抑制剂提供稳定、可靠的模型体系。
[0005]
本发明的次要目的是提供上述角膜新生血管动物模型的构建方法。
[0006]
为达到上述首要目的,本发明的解决方案是:
[0007]
一种角膜新生血管动物模型,其包括在小鼠的角膜中央切口,并在角膜缘的正前方做潜行隧道,将含血管内皮生长因子的滤纸植入隧道顶端,构建得到角膜新生血管动物模型。
[0008]
作为本发明的优选实施例,在小鼠的角膜中央切口之前,用戊巴比妥钠溶液注射
小鼠的腹腔,爱尔凯因滴眼液麻醉小鼠的双眼表面。
[0009]
作为本发明的优选实施例,滤纸的厚度为0.3-0.6mm,优选为0.5mm。
[0010]
作为本发明的优选实施例,潜行隧道的过程:用巩膜隧道刀向角膜缘的正前方做潜行隧道,隧道顶端距离角膜缘1-3mm。
[0011]
作为本发明的优选实施例,隧道的长度为1.5-2mm,宽度为1-1.5m。
[0012]
为达到上述次要目的,本发明的解决方案是:
[0013]
一种如上述的角膜新生血管动物模型的构建方法,其包括如下步骤:
[0014]
(1)、将滤纸浸润在血管内皮生长因子中,得到含血管内皮生长因子的滤纸;
[0015]
(2)、用戊巴比妥钠溶液注射麻醉小鼠的腹腔,爱尔凯因滴眼液麻醉小鼠的双眼表面,在小鼠的角膜中央做切口,角膜缘的正前方做潜行隧道;
[0016]
(3)、将含血管内皮生长因子的滤纸植入隧道顶端,然后在小鼠的眼裂处涂抹抗生素眼膏。
[0017]
作为本发明的优选实施例,步骤(1)中,血管内皮生长因子的浓度为0.05-02μg/μl。
[0018]
作为本发明的优选实施例,步骤(1)中,浸润的温度为2-6℃,浸润的时间为1-3h。
[0019]
作为本发明的优选实施例,步骤(1)中,滤纸的厚度为0.3-0.6mm,优选为0.5mm。
[0020]
作为本发明的优选实施例,步骤(2)中,戊巴比妥钠溶液的质量含量为1-3%。
[0021]
作为本发明的优选实施例,步骤(3)中,隧道顶端和角膜缘的距离为1-3mm。
[0022]
作为本发明的优选实施例,步骤(3)中,隧道的长度为1.5-2mm,宽度为1-1.5mm。
[0023]
由于采用上述方案,本发明的有益效果是:
[0024]
第一、本发明的滤纸制作仅需2h即可进行角膜植入,大大缩短了造模时间;另外,滤纸的厚度比现有技术中琼脂糖小丸薄,并且比较软,易于手术过程中植入,造模成功率高,降低造模难度从而增加了造模的可重复性,大大降低了成本的投入。
[0025]
第二、本发明提供了制作大小一致、厚度一致的滤纸片,通过一致的滤纸片以及简单的手术操作,进行角膜新生血管动物模型的构建,且造模周期短,即用滤纸结合血管生长因子植入小鼠角膜层间,诱导小鼠角膜新生血管模型,可用于小鼠角膜,具有造模时间短、成本低、创伤小、一致性、可重复性高的特点,为研究角膜新生血管抑制剂提供稳定、可靠的模型体系。
附图说明
[0026]
图1为本发明的滤纸制备及植入小鼠角膜层间的示意图。
[0027]
图2为本发明的含vegf滤纸、含pbs的滤纸分别浸润在小鼠的角膜的示意图。
[0028]
图3为本发明的含vegf滤纸植入小鼠角膜后出现新生血管的示意图。
[0029]
图4为本发明的含vegf滤纸、含pbs的滤纸分别浸润小鼠角膜后,角膜新生血管数量示意图。
[0030]
附图标记:1-滤纸、2-角膜、3-角膜缘、4-隧道、5-瞳孔、6-新生血管。
具体实施方式
[0031]
本发明提供了一种角膜新生血管动物模型及其构建方法。
[0032]
《角膜新生血管动物模型》
[0033]
本发明的角膜新生血管动物模型包括:用戊巴比妥钠溶液注射实验动物c57bl/6小鼠(8周龄)的腹腔,爱尔凯因滴眼液麻醉小鼠的双眼表面,在小鼠的角膜2距离瞳孔5缘1mm处做切口,用巩膜隧道刀向角膜缘3的正前方做潜行隧道4,隧道4顶端距离角膜缘3为1-3mm,隧道4底端和瞳孔5缘的距离为0.5-1mm,将含血管内皮生长因子(vegf)的滤纸1(厚度为0.3-0.6mm)植入隧道4顶端,构建得到角膜新生血管动物模型。
[0034]
《角膜新生血管动物模型的构建方法》
[0035]
如图1所示,本发明的角膜新生血管动物模型的构建方法包括如下步骤:
[0036]
(1)、将滤纸浸润在vegf中,得到含vegf的滤纸;
[0037]
(2)、用戊巴比妥钠溶液注射麻醉实验动物c57bl/6小鼠(8周龄)的腹腔,爱尔凯因滴眼液麻醉小鼠的双眼表面,在小鼠的角膜中央做切口,角膜缘的正前方(12点方向)做潜行隧道;
[0038]
(3)、将含vegf的滤纸植入隧道顶端,然后在小鼠的眼裂处涂抹抗生素眼膏。
[0039]
其中,在步骤(1)中,vegf的浓度可以为0.05-0.2μg/μl,优选为0.1μg/μl。
[0040]
在步骤(1)中,浸润的温度可以为2-6℃,优选为4℃;所述浸润的时间可以为1-3h,优选为2h。
[0041]
在步骤(1)中,滤纸的厚度可以为0.3-0.6mm,优选为0.5mm。
[0042]
在步骤(1)中,含vegf(作为诱导剂)的滤纸的制备过程为:切割0.5mm
×
0.5mm正方形滤纸(whatman 3级,英国),再沿对角线切成面积为0.125mm2三角形,然后将其浸润在0.1μg/μl的vegf融合蛋白中,4℃环境中放置2h即可。由于滤纸的厚度比现有技术中琼脂糖小丸薄,并且比较软,易于手术过程中植入,缩短了造模的难度和时间。
[0043]
实际上,将滤纸作为诱导剂的载体,whatman 3级滤纸对于小鼠角膜来说厚度适中,负载力好,用高质量的棉纤维制造,且具有高吸附性能,同时进行了一定的折叠,增加了负载力,可以高效吸附诱导剂并缓慢释放,在小鼠角膜层间植入后可有效诱导小鼠角膜新生血管模型。现有技术中明胶海绵-bfgf-琼脂糖缓释药丸通过琼脂包裹后比较硬且大,无法在比较小的小鼠角膜上植入,whatman 3级滤纸软硬适中,易于植入小鼠角膜,在基础实验中,小鼠是最常用的实验动物,且费用较低,一只实验兔子的成本远高于一只小鼠,从实验经费的角度考虑,小鼠更易于基础实验。
[0044]
在步骤(2)中,戊巴比妥钠溶液的质量含量可以为1-3%,优选为2%。
[0045]
在步骤(3)中,隧道顶端和角膜缘的距离可以为1-3mm,优选为2mm。
[0046]
下面结合实施例和对比例对本发明的技术内容做进一步的说明。下述实施例是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0047]
滤纸的制备:
[0048]
切割0.5mm
×
0.5mm正方形滤纸1(whatman 3级,英国),再沿对角线切成面积为0.125mm2三角形,然后将其分别浸润在0.1μg/μl的vegf融合蛋白和磷酸缓冲盐溶液(pbs)中,4℃环境中放置2h制备完毕。
[0049]
滤纸的植入:
[0050]
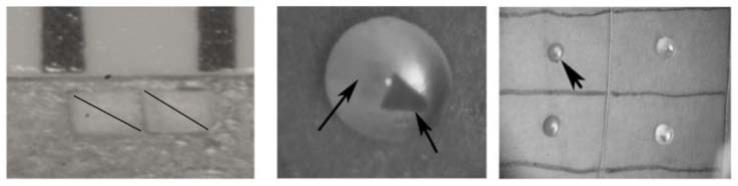
c57bl/6小鼠(8周龄)用质量含量2%戊巴比妥钠腹腔注射全身麻醉,爱尔凯因滴眼液双眼表面麻醉。如图2至图4所示,实验组植入含vegf的三角形滤纸1到小鼠的角膜2层间,对照组植入含pbs的滤纸,其中,右眼为实验组,左眼为对照组。滤纸1植入操作所有步骤均在无菌条件下进行。小鼠的角膜2距离瞳孔5缘1mm处做长约2mm厚的切口,用2mm宽巩膜隧道刀向12点角膜缘3做潜行隧道4,隧道4顶端距离角膜缘3为2mm,隧道4底端和瞳孔5缘的距离为0.5mm,用显微镊将滤纸1植入隧道4顶端,术毕眼裂涂抗生素眼膏。实验组平均4d可见新生血管6开始从角膜缘3长出,并向植入物方向伸展,且血管成束生长,逐渐包绕植入物,新生血管6范围局限,术后6天后使用裂隙灯显微镜照相观察角膜的新生血管6,vegf组的角膜新生血管数与pbs组比较有统计学差异(p《0.01)。约术后10天时为角膜新生血管生长最为密集的时间,观察至第4周仍无自行消退的趋势。
[0051]
参考文献:
[0052]
1.micheal s rogers,amyebirsner&robertjd’amato.the mouse cornea micropocket angiogenesis assay.nature protocols.2007,2(10):2545-2550.
[0053]
2.sbinataro nakao,souskazandi,nuria lara-castillo,et al.larger therapeutic window for steroid versus vegf-a inhibitor in inflammatory angiogenesis:surprisingly similar impact on leukocyte infiltration.iovs,2012,53(7):3296-3302.
[0054]
3.birsner ae,benny o,d’amato rj.the corneal micropocket assay:a model of angiogenesis in the mouse eye.j vis exp,2014,16;(90):1-7.
[0055]
上述对实施例的描述是为了便于该技术领域的普通技术人员能理解和使用本发明。熟悉本领域技术人员显然可以容易的对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1