身体结构成像的制作方法
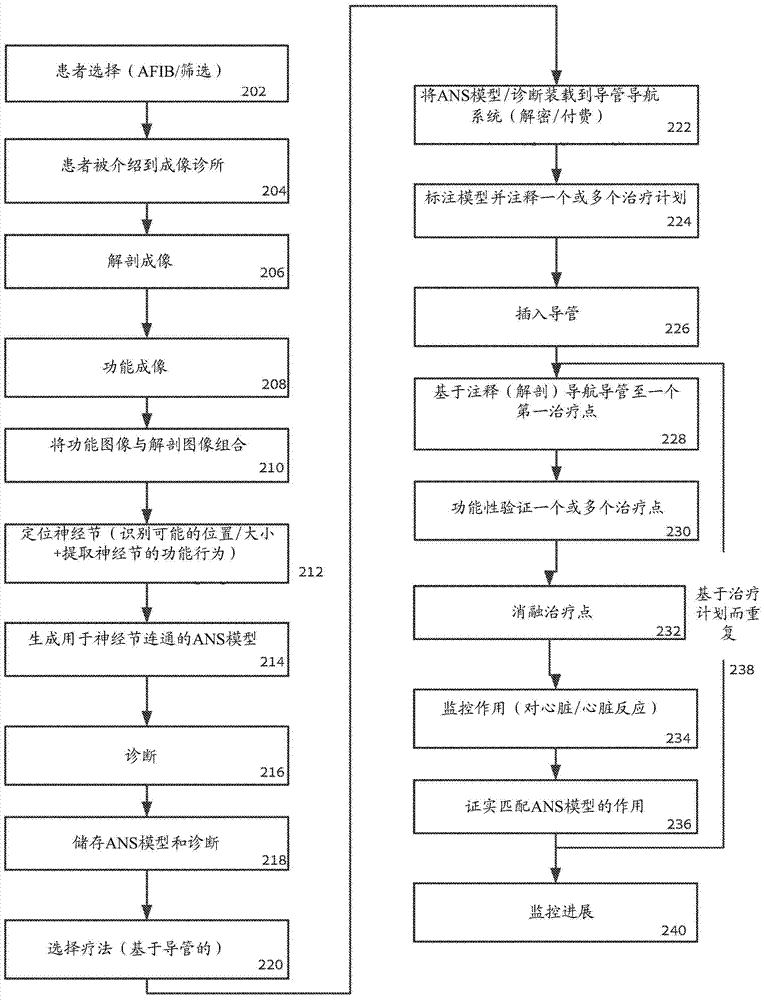
身体结构成像相关申请本申请要求以下申请的优先权:2013年1月24日提交的美国临时专利申请号61/756,112,2013年3月11日提交的美国临时专利申请号61/776,599,2013年3月20日提交的美国临时专利申请号61/803,611,2013年6月6日提交的美国临时专利申请号61/831,664,2013年9月8目提交的美国临时专利申请号61/875,069,2013年9月8目提交的美国临时专利申请号61/875,070,2013年9月8目提交的美国临时专利申请号61/875,074它们的披露内容通过引用以其全部内容结合在此。本申请是包括以下PCT申请的一组申请之一:“身体结构成像(BODYSTRUCTUREIMAGING)”(代理人案号58457);“身体结构成像”(代理人案号58459);“神经成像和治疗(NERVEIMAGINGANDTREATMENT)”(代理人案号58463);“身体结构成像”(代理人案号58465);所有这些申请与本申请在同一日共同提交。技术领域本发明在其一些实施例中涉及成像的方法和系统,并且更具体地说但并不排他地涉及医学定位和监控的方法和系统,以及涉及使用功能成像模态例如单光子发射计算机断层成像(SPECT)和/或正电子发射断层成像(PET)的成像。发明背景通常使用体积扫描,特别是在医学工业中,如CAT扫描、正电子发射断层成像(PET)扫描、计算机断层成像(CT)扫描、磁共振成像(MRI)扫描、超声扫描、激光三维(3D)扫描器等,以观察在一个结构内以其他方式不能观察到的目标。这些扫描极大地提升了专家们如医生们的能力。常见体积扫描旨在以高分辨率产生身体的大体积的体积图像。以高分辨率进行体积扫描的能力需要大量检测器、一个微动控制和丰富的处理资源,以允许在一个适合的时间采集高分辨率体积图像。另外,当体积扫描使一个相对大的面积如躯干成像时,患者辐射剂量是相对高的,例如当体积扫描是一种CT扫描时。通常,一个身体结构的体积成像是一个多阶段过程。首先,可以给予生物化学剂、放射剂和/或造影剂。然后,在预定位置、取向和持续时间在一组预定视图中获取测量值。随后,对数据进行分析以重构身体结构的体积图像并形成身体结构的一个图像。成像过程是连续的,并且在测量过程完成之后不存在重构的图像的质量的评定。在获得一个不良质量的图像的情况下,必须重复测量,从而导致对患者的不便和成像过程的低效率。体积扫描通常是通过从多个方向转绕检测器来进行的,以便提供足够的信息来借助于计算机断层成像重构辐射源的三维图像。这些检测器典型地被安装在一个构台,以提供结构支撑并且在感兴趣的目标周围转绕检测器。如果该检测器是一种核医学检测器如闪烁检测器或CZT检测器,例如单光子发射计算机断层成像(SPECT)和正电子发射断层成像(PET)系统检测器,则用于限制辐射接收量或射线行进方向的一种瞄准仪被放置于该检测器与所成像的目标之间。典型地,此瞄准仪被构建为在一个密集的高原子序数材料如铅或钨中提供大量小孔。如果这些射线在与孔对齐的一个方向上行进,则它们将穿过这些孔,但是如果它们在不与这些孔对齐的方向上行进,则它们将倾向于被瞄准仪材料吸收。发明概述根据本发明的一些实施例,提供了用于基于从患者身体内部体积的一种功能成像模态中获得的一个功能图像来定位所希望的形状的目标(例如,组织、神经、癌症)的方法和系统。任选地,该功能图像与一个解剖图像组合,并且该神经组织是基于该组合的图像来定位的。任选地,所希望的形状的目标是使用邻近组织的一个模型检测的。根据本发明的一些实施例的一个方面,提供了一种用于使身体结构成像的医学图像处理方法,该方法包括:接收解剖数据以重构一位患者的身体的一个区域的一个解剖图像,所述区域包括与一个靶组织邻接或与其隔开的至少一个体内部分的一个部份;从一种功能成像模态接收功能数据,该功能成像模态使该患者身体的区域的至少所述部分成像;处理所述解剖图像以生成与所述至少一个体内部分的壁外区域相对应的至少一个图像掩模;使该至少一个生成的图像掩模与功能数据相关,以用于指导描绘所述靶组织的一个功能图像的重构;以及提供所重构的功能图像。任选地,该靶组织是一种神经组织。任选地,该解剖数据是由一种解剖成像模态采集的。任选地,该至少一个图像掩模是基于该至少一个体内部分的预选解剖考虑因素来生成的,该至少一个体内部分包含具有在功能数据内配准的活动强度的靶神经组织。任选地,该至少一个图像掩模是基于在该至少一个体内部分内和/或在其附近限定靶神经组织位置的模板来生成的。任选地,该方法进一步包括基于来自相应解剖数据的功能数据读数来调整图像掩模的形状,该相应解剖数据并不包括靶神经组织。任选地,这些图像掩模是基于对一种放射性试剂具有不同水平的功能敏感性的靶神经结构的解剖位置来生成的。任选地,该方法进一步包括基于表示靶神经组织活动的测量值使功能数据归一化。任选地,该方法进一步包括基于不包含靶神经组织的区域的解剖数据去除表示来自不包含靶神经组织的这些解剖区域的噪声的功能数据。任选地,该重构的功能图像包含其中靶神经结构定位的区域和/或靶神经结构的精确坐标。任选地,存在两个图像切取部,一个针对身体结构的壁并且另一个针对身体结构壁外部,两个图像切取部是彼此不同的。任选地,该方法进一步包括使靶神经与组织类型相关。任选地,该方法进一步包括基于至少一种预定的规则鉴别靶神经结构。任选地,该至少一种预定的规则包括大于一个2D或3D大小。任选地,该至少一种预定的规则包括将一个放射性标记的分子活动水平与穿过以下各项中的至少一个的分子活动水平的一个平均值和/或标准偏差相比较:该器官体积、在该图像掩模内。任选地,该放射性标记的分子是间碘苯甲胍(mIBG)。任选地,该方法进一步包括计算这些鉴别的靶神经结构的至少一个参数。任选地,该图像掩模是一个3D体积或2D面积的映射,以用于使解剖图像的一个体积或一个面积与相应功能图像相关。任选地,该功能成像模态是一种单光子发射计算机断层成像(SPECT)模态。任选地,该解剖成像模态是选自下组,该组包括:计算机断层成像(CT)、3D超声(US)、2DUS、磁共振成象(MRI)。任选地,该方法进一步包括将该图像掩模应用于该解剖图像与该功能图像的一个配准。任选地,该方法进一步包括将该解剖图像分割成不同的区域,以生成用于检测该分割的区域内的不同GP的这些图像掩模。任选地,该方法进一步包括基于这些分割段生成至少一个图像掩模。任选地,多组不同的图像掩模被生成为与包含神经的体内部分的结构的不同部分相对应。任选地,多个图像掩模被生成为检测不同类型和/或在不同位置处的不同神经结构。任选地,该方法进一步包括计算在与功能数据相关的该至少一个生成的图像掩模内的功能活动并且使所计算的功能活动归一化。任选地,该方法进一步包括使用一种用于治疗和诊断之一或二者的导航系统配准重构的功能图像。任选地,该方法进一步包括生成鉴别的神经结构的一个空间连接映射,该空间连接映射示出了神经结构之间的相对空间关系。任选地,该方法进一步包括将基于不同图像掩模鉴别的神经结构组合为至少一些鉴别的神经结构的一个单一数据集。任选地,该解剖图像表示由神经支配的组织的结构。任选地,该功能图像表示支配一个组织结构的这些神经的功能活动。任选地,这些图像掩模的大小和形状被生成为包含支配一个神经结构的靶神经。任选地,使相关联进一步包括定位该至少一个图像掩模,以与功能图像内的靶神经组织的区域相对应。任选地,该方法被针对不同时间帧进行重复并且生成一个单一重构的图像。任选地,这些解剖图像是在一个循环生理过程中获得的,其中不同的时空图像掩模被生成用于在生理过程的不同阶段中获得的图像,不同的时空图像掩模是与生理过程同步的,以与这些组织的相同位置相对应。任选地,在一个循环生理过程中获得的这些解剖图像被配准、变形,并且生成单一的一组图像掩模。任选地,一个中空器官的图像掩模的大小是基于基于器官壁的厚度来选择的。任选地,该方法是在消融治疗该组织之前进行的,以鉴别该组织的位置。根据本发明的一些实施例的一个方面,提供了一种用于使心脏的ANS的神经组织成像的医学图像处理方法,该方法包括:接收解剖图像数据以重构由ANS支配的心脏结构的解剖图像;从一种功能成像模态接收一个功能数据,该功能成像模态使至少这些由ANS支配的心脏结构成像;通过处理该解剖图像来选择至少一个图像掩模,该至少一个图像掩模与包含神经组织的心腔壁的尺寸相对应;应用该至少一个选择的图像掩模连同该功能数据,以用于指导描绘GP的一个功能图像的重构;以及提供所重构的功能图像。任选地,这些神经组织是GP。任选地,该至少一个图像掩模与心壁室相比是过大的。任选地,该至少一个图像掩模是基于心脏的预选解剖区域来生成的,该心脏包含具有在功能数据内配准的活动强度的靶神经组织。任选地,该至少一个图像掩模是基于限定GP接近于心腔壁的位置的模板来生成的。任选地,该至少一个图像掩模是基于限定GP在心腔壁内的位置的模板来生成的。任选地,该至少一个图像掩模是基于限定GP的位置的模板来生成的,这些GP位于距离心腔壁超过约2mm处。任选地,该方法进一步包括基于来自不包括GP的血室和/或血管的相应解剖数据的功能数据读数来调整图像掩模的形状。任选地,该方法进一步包括基于解剖数据消除表示来自心脏的满血室(bloodfilledchamber)和/或血管内的噪声的功能数据。任选地,该功能成像模态是SPECT并且该解剖成像模态是CT和MRI中的至少一种。任选地,这些解剖图像是在一个心脏循环过程中获得的,其中不同的时空图像掩模被选择用于在心脏循环过程中获得的至少一些图像,不同的时空图像掩模是与心脏循环同步的,以与心脏的相同位置相对应。任选地,该解剖图像是由舒张末期容积图像和收缩末期容积图像组成的一个平均图像。任选地,该方法进一步包括将该解剖图像分割成这些心腔的多个壁。任选地,该方法进一步包括基于这些心腔壁分割段选择至少一个图像掩模。任选地,第一组图像掩模被选择为与一个心外膜和心肌层外的组织相对应,并且第二组图像掩模被选择为与心肌层相对应。任选地,该方法进一步包括计算相关图像掩模内的功能活动并且使所计算的活动归一化以鉴别这些GP。任选地,针对心脏体积内的所有图像掩模来计算该功能活动。任选地,该方法进一步包括基于至少一个预定的规则鉴别GP,该至少一个预定的规则包括该GP大于一个预定的大小。任选地,这些预定的大小对于位于一个心外膜内的心外膜GP和位于一个心肌层内的心肌GP是不同的。任选地,该方法进一步包括基于至少一个预定的规则鉴别GP,该至少一个预定的规则包括计算的活动超过一个预定的阈值。任选地,该预定的阈值是基于一个预定的系数乘以在该图像掩模内的活动大于该图像掩模内计算的平均活动的一个计算的标准偏差,并且在一个活动区域周围的计算的相邻活动是低于该活动区域的活动的一半。任选地,该方法进一步包括计算所鉴别的GP的至少一个参数。任选地,该至少一个参数是选自以下各项中的一种或更多种:平均大小、比活度、功率谱、归一化功率谱和GP连接映射、每一预定面积的GP数目。任选地,针对心脏循环的至少一个图像来计算该至少一个参数。任选地,该方法进一步包括鉴别该至少一个参数随着时间的变化。任选地,该方法进一步包括在一个心脏循环的多个帧的至少一个图像中展示这些鉴别的GP。任选地,该方法进一步包括使用一种用于治疗的导航系统使这些鉴别的GP配准。根据本发明的一些实施例的一个方面,提供了一种用于使一种或更多种ANS组分成像的医学图像处理方法,该方法是通过程序化进行该方法的这些步骤的至少一个模块来进行的,该方法包括:从一种解剖成像模态接收解剖数据以重构一位患者的身体的一个区域的解剖图像,所述区域包括与ANS组分邻接或包含ANS组分的至少一个体内部分的一个部份;从一种功能成像模态接收功能数据,该功能成像模态使该患者身体的该区域的至少所述部分成像;处理所述解剖图像,以生成具有与所述至少一个体内部分的尺寸相对应的尺寸的至少一个图像掩模;应用该至少一个生成的图像掩模连同该功能数据,以用于重构描绘所述ANS组分的一个功能图像;以及鉴别功能图像中的一种或更多种ANS组分。根据本发明的一些实施例的一个方面,提供了一种用于使心脏的ANS的GP成像的医学图像处理方法,该方法是通过程序化进行该方法的这些步骤的至少一个模块进行的,该方法包括:从一种解剖成像模态接收解剖图像数据以重构由ANS支配的心脏结构的解剖图像;从一种功能成像模态接收一个功能数据,该功能成像模态使至少这些由ANS支配的心脏结构成像;通过处理该解剖图像来生成至少一个图像掩模,该至少一个图像掩模与含有GP的心腔壁的尺寸相对应;应用该至少一个选择的图像掩模连同该功能数据,以用于定位一个心脏的一个ANS的一个或更多个GP。根据本发明的一些实施例的一个方面,提供了一种使用功能成像模态指导心脏治疗的方法,该方法包括:从一种功能成像模态提供功能成像模态数据,该功能成像模态使患者的具有心脏的一个体内体积成像,该患者被注射通过该心脏的一个自主神经系统(ANS)进行神经组织摄取的一种成像剂,该ANS包含至少一个GP;基于功能成像模态数据定位支配心脏的该至少一个GP;以及提供定位的至少一个GP。任选地,该ANS包含至少一个GP,该GP包括以下各项中的一种或更多种:左上GP(SLGP)、左下GP(ILGP)、右前GP(ARGP)、右下GP(IRGP)以及马歇尔(Marshall)GP。任选地,该ANS包含两个、三个或更多个GP,这些GP是来自以下各项中的两种或三种或更多种:左上GP(SLGP)、左下GP(ILGP)、右前GP(ARGP)、右下GP(IRGP)以及马歇尔GP。任选地,该方法进一步包括设置一种用于消融定位的至少一个GP的系统,以治疗基于所定位的至少一个GP的不适当活动的心脏疾病。任选地,心脏疾病包括心房颤动。任选地,定位的GP的坐标被装载到用于展示GP相对于治疗或其他诊断EP导管的位置的一种体内导航系统中。任选地,定位的GP的坐标被装载到用于展示GP相对于系统的治疗导管的位置的一种系统中。任选地,该方法进一步包括基于该系统在该患者内导航一个导管。任选地,该方法进一步包括基于该系统功能验证用于GP消融的治疗点。任选地,该方法进一步包括使用系统消融这些定位的GP。任选地,该方法进一步包括使用系统证实这些GP的消融。任选地,定位包括基于功能成像模态数据在心脏的一个脂肪垫或周围组织中定位至少一个GP。任选地,设置该系统包括设置用于消融该脂肪垫内的至少一个GP而不会消融大部分周围的脂肪垫的系统。任选地,该方法进一步包括从一种解剖图像模态采集解剖成像模态数据,该解剖图像模态使包含该心脏的患者的体内体积成像,并且其中定位包括基于功能成像模态数据和解剖成像模态数据的配准在心脏的体内体积中或体内体积附近定位至少一个GP。任选地,该方法进一步包括在解剖成像模态数据上标记所定位的至少一个GP。任选地,该解剖成像模态数据是通过荧光检查法在一个治疗程序过程中实时采集的,定位是通过CT在该治疗程序之前和/或在此过程中实时地进行的,并且该至少一个GP的位置被提供给进行该治疗程序的一位操作者。任选地,该方法进一步包括生成具有ANS突触和GP之一或二者的一个分布和/或活动的一个ANS映射,并提供ANS映射用于展示。任选地,该ANS映射被叠加于在该心脏内含有一个治疗探针或成像探针的心脏的一个重构解剖图像上,在与该重构的解剖图像和映射图像相同的空间内。任选地,该定位包括鉴别在一个心房复杂碎裂电位(CFAE)位点与一个收缩力(CF)位点之间的一个交叉,该指导包括指导该交叉消融。任选地,该定位包括鉴别在一个心房复杂碎裂电位(CFAE)位点与一个主频率(DF)位点之间的一个交叉,该指导包括指导该交叉消融。任选地,该定位包括鉴别在一个心房复杂碎裂电位(CFAE)位点与至少一个GP之间的一个交叉,该指导包括指导该交叉消融。任选地,该定位包括鉴别在一个心房复杂碎裂电位(CFAE)位点、一个主频率(DF)与至少一个GP之间的一个交叉,该指导包括指导该交叉消融。任选地,该定位包括鉴别在一个心房复杂碎裂电位(CFAE)位点、一个收缩力(CF)位点与至少一个GP之间的一个交叉,该指导包括指导该交叉消融。任选地,该定位包括使至少一个GP成像并在所定位的GP周围映射以验证该GP的位置。任选地,该方法进一步包括基于一个假设选择一位患者,该假设是该患者罹患心脏ANS的不适当活动。任选地,该采集包括在至少一个心脏循环过程中采集包含多个帧的数据并且重构一个单一图像。任选地,该方法进一步包括监控消融对于心脏的作用。任选地,该方法进一步包括基于一个生成的ANS模型证实消融的作用。根据本发明的一些实施例的一个方面,提供了用于在患者心脏图像内鉴别ANS组织的系统,该系统包括:用于从一种功能成像模态中接收功能成像模态数据的一个模块,该功能成像模态使包含心脏的一位患者的一个体内体积成像,该患者被注射通过该心脏的一个自主神经系统(ANS)进行神经组织摄取的一种成像剂,该ANS包含至少一个GP;用于从一种解剖成像模态中接收解剖成像模态数据的一个模块,该解剖成像模块使包含该心脏的一位患者的一个体内体积成像;用于基于功能成像模态数据定位支配该心脏的至少一个GP的一个模块;以及用于在该解剖成像数据上设置该定位的至少一个GP。任选地,该ANS包含至少一个GP,该GP包括以下各项中的一种或更多种:左上GP(SLGP)、左下GP(ILGP)、右前GP(ARGP)、右下GP(IRGP)以及马歇尔(Marshall)GP。任选地,该ANS包含两个、三个或更多个GP,这些GP是来自以下各项中的两种或三种或更多种:左上GP(SLGP)、左下GP(ILGP)、右前GP(ARGP)、右下GP(IRGP)以及马歇尔GP。任选地,该解剖成像模态数据是在一个治疗程序之前和/或过程中接收的。任选地,该系统进一步包括一个心脏导管导航系统,该心脏导管导航系统接收并展示所定位的神经系统,以在心脏内指导体内治疗探针消融该神经组织。任选地,该心脏导管导航系统是任选地,该心脏导管导航系统是一种3D电生理学(EP)系统。任选地,该系统进一步包括用于消融心脏内的神经组织的一种体内治疗探针。任选地,该体内治疗探针是以下各项中的至少一种:射频(RF)治疗探针、低温手术治疗探针、以及注射毒素或药物的探针。任选地,该系统进一步包括用于比较成像的神经组织分布与一组或更多组预期分布并且基于该比较检测异常突触分布和/或活动的一个诊断模块。任选地,该系统进一步包括用于追踪成像的神经组织分布随着时间的变化的一个追踪模块。任选地,该系统进一步包括用于存储所生成的ANS模型和诊断中的至少一种的一个储存器。任选地,该系统进一步包括用于基于测量的功能图像的摄取来评估一个消融程序的预测成功性的一个模块。任选地,该系统进一步包括用于从使用者接收手动输入的一个使用者输入元件和用于基于所接收的手动输入注释所定位的神经组织的一个治疗计划模块。任选地,该系统进一步包括用于以下各项中的至少一种的一个功能验证模块:刺激某一体内面积内的一个神经组织并响应于该刺激鉴别一个或更多个神经响应。任选地,该系统进一步包括用于基于一个生成的ANS模块比较在治疗之后的神经组织刺激作用与在治疗之前的神经组织刺激作用以证实治疗的一个模块。任选地,该系统的这些模块是分布式的。根据本发明的一些实施例的一个方面,提供了一种用于鉴别患者心脏的图像内的ANS组分的系统,该系统包括:用于以下各项的至少一个模块:从一种功能成像模态接收功能成像模态数据,该功能成像模态使一位患者的包含心脏的一个体内体积成像,该患者已被注射通过该心脏的一个自主神经系统(ANS)进行神经组织摄取的一种成像剂,该ANS包含至少一个GP,该GP包括以下各项中的一种或更多种:左上GP(SLGP)、左下GP(ILGP)、右前GP(ARGP)、右下GP(IRGP)以及马歇尔GP;从一种解剖成像模态接收解剖成像模态数据,该解剖成像模态使包含该心脏的一位患者的一个体内体积成像;以及基于该功能成像模态数据和解剖成像模态数据在该心脏的体内体积中定位该至少一个GP。根据本发明的一些实施例的一个方面,提供了一种使神经组织成像的方法,该方法包括:从一种功能成像模态采集功能成像模态数据,该功能成像模态使一位患者的具有一个身体部分的一个体内体积成像,该患者已被注射通过该心脏的一个自主神经系统(ANS)进行神经组织摄取的一种成像剂;以及基于该功能成像模态数据在体内体积中定位该神经组织。任选地,该方法进一步包括基于具有活动水平的定位的神经组织生成该ANS的一个图像。任选地,该图像指示所定位的神经组织的活动水平。任选地,该方法进一步包括设置一种用于处理定位的神经组织的系统,以治疗基于所定位的神经组织的不适当活动的疾病。任选地,该方法进一步包括从一种解剖图像模态采集解剖成像模态数据,该解剖图像模态使包含该心脏的患者的一个体内体积成像,并且其中定位包括基于该功能成像模态数据和解剖成像模态数据在心脏的体内体积中定位该神经组织。任选地,该方法进一步包括在解剖成像模态数据上设置所定位的神经组织。任选地,该解剖成像模态数据是在一个治疗程序过程中实时采集的,定位是在该治疗程序之前和/或在此过程中实时地进行的,并且该神经组织的位置被提供给进行该治疗程序的一位操作者。任选地,定位包括定位该ANS的至少一个神经节丛(GP),其最大直径的大小是在1与20mm之间。任选地,定位包括定位该ANS的至少两个神经节丛(GP),其最大直径的大小是在1与20mm之间。任选地,该方法进一步包括生成具有ANS突触和GP之一或二者的一个分布和/或活动的一个ANS映射,并提供ANS映射用于展示。任选地,该方法进一步包括叠加ANS映射与代表包含神经组织的一个器官的一个图像。任选地,该方法进一步包括诊断该患者,该诊断包括基于突触和/或神经节相对于一个器官的活动和分布中的之一或两者来评估该ANS对该器官的作用。任选地,该方法进一步包括刺激该ANS连同进行其一个成像并且基于该刺激和该成像区分传入和传出活动。任选地,该方法进一步包括在治疗之前、在此过程中和/或在此之后基于突触和/或神经节相对于一个器官的活动和分布中的之一或两者来评估一个自主神经系统和/或器官的作用或作用变化和/或反应。任选地,该方法进一步包括根据一个器官的一个结构的一个模型将功能成像模态数据分配到多个空间位置,从而基于与该器官相关的数据鉴别神经组织突触和/或神经支配。任选地,该方法进一步包括提供对于一种参考动力学行为的体内体积中的至少一个区域进行映射的一个映射函数并且将该映射函数应用于功能数据以在体内体积中定位该神经组织。任选地,该方法进一步包括刺激一位患者的一个体内体积中的一个神经组织,以触发与一个参考摄取值有关的一个神经反应;在该神经反应过程中从使该体内体积成像的该功能模态采集功能数据;以及根据该参考摄取值在该体内体积中定位该神经组织。任选地,该方法进一步包括从使患者的体内体积成像的一种解剖成像模态采集解剖数据并且基于该功能数据和解剖数据在该体内体积中定位靶神经组织。任选地,该方法进一步包括根据与表示一个器官的一个参考摄取率的一个参考值的一个匹配鉴别在一个体内面积内的至少一个感兴趣区域(ROI)。任选地,定位包括基于与一个参考值的匹配来过滤该功能数据内的该体内体积的至少部分表示。任选地,定位包括分析来自功能数据的数据以鉴别体内体积中的至少一个感兴趣区域(ROI),该分析是基于该体内体积的解剖学三维(3D)模型。任选地,定位包括基于功能数据的各对应部份的一个分析鉴别至少一个解剖标志,以与一个解剖图像配准。任选地,定位包括在体内面积的至少一个区域内鉴别该成像剂的动态行为的一种预定模式。任选地,该方法进一步包括靶向体内面积中的一个子区域,该子区域作为一种医学治疗的一个靶标。任选地,功能数据是在向该患者给予的一种治疗之前、在此过程中、在此之后和/或在该治疗之后捕获的。任选地,该方法进一步包括采集一种体内治疗探针在体内体积中的一个位置并且在医疗程序过程中向一位操作者提供功能数据和探针位置二者。任选地,该方法进一步包括基于该功能数据指导用于消融的一个导管插入程序,其中该指导是根据该体内面积的该功能数据与一个解剖数据之间的一个组合来进行的。任选地,该方法进一步包括基于神经组织在体内体积中的位置,应用一个力来将一个消融元件设置于一个导管上和/或选择一个水平的消融能量。任选地,该神经组织是选自下组,该组由以下各项组成:颈动脉体神经组织、主动脉弓神经组织、肺神经组织、肾神经组织、脾神经组织、肝神经组织、下肠系膜神经组织、上肠系膜神经组织、肌肉神经组织、胃、以及阴茎神经组织。任选地,该解剖成像模态数据是在一个治疗程序之前和/或过程中接收的。根据本发明的一些实施例的一个方面,提供了一种用于鉴别在患者体内体积的图像内的ANS组分的系统,该系统包括:用于从一种功能成像模态接收功能成像模态数据的一个模块,该功能成像模态使具有包含神经组织的一个身体部分的患者的一个体内体积成像,该患者已被注射通过一个自主神经系统(ANS)进行神经组织摄取的一种成像剂;用于从一种解剖图像模态采集解剖成像模态数据的一个模块,该解剖图像模态使包含该身体部分的患者的一个体内体积成像;以及用于基于功能成像模态数据在该体内体积中定位该神经组织的一个模块。任选地,该系统进一步包括用于在解剖成像模态数据上设置所定位的神经组织的一个模块。任选地,该功能成像模态是选自下组,该组由以下各项组成:心电图门控SPECT(GSPECT)模态、SPECT-CT模态和D-SPECT模态、和/或A-SPECT。任选地,该系统进一步包括用于从使包含神经系统的患者的一个体内体积成像的一种解剖成像模态接收一个解剖图像的一个模块和用于将该解剖图像与该功能图像组合的一个模块。任选地,该解剖成像模态是选自下组,该组由以下各项组成:正电子发射断层成像(PET)模态、计算机断层成像(CT)模态、磁共振成像(MRI)模态、以及超声模态。任选地,该系统进一步包括用于生成一个ANS映射的一个模块,该ANS映射包括ANS突触和GP之一或二者的一个分布和/或活动。任选地,成像剂是间碘苯甲胍(mIBG)。任选地,该神经组织是一种神经纤维。任选地,该神经组织是由突触组成。任选地,该神经组织是一个外周神经组织的一部分。任选地,该神经组织是副交感神经组织和交感神经组织中的至少一种的一部分。任选地,该神经组织包含至少一个神经节丛(GP)。任选地,该神经组织是选自下组,该组由以下各项组成:颈动脉体神经组织、主动脉弓神经组织、肺神经组织、肾神经组织、脾神经组织、肝神经组织、下肠系膜神经组织、上肠系膜神经组织、肌肉神经组织、胃、以及阴茎神经组织。任选地,该系统进一步包括用于手术中消融神经组织的一种体内治疗探针。任选地,该系统进一步包括用于该体内治疗探针的一个导航系统,该导航系统被适配用于展示所定位的神经组织。任选地,该系统进一步包括程序化控制注射、采集和/或重构中的一个或更多个以便鉴别在受支配组织中的神经节和突触密度之一或二者的成像装置。任选地,该系统进一步包括程序化地基于成像数据展示突触和/或神经节相对于一个组织体积或一个器官的分布的一个2D或3D或更高维度的映射的一个输出元件。任选地,该系统进一步包括评估一个自主神经系统对于一个器官的作用的一个模块。任选地,该系统进一步包括成像装置,该成像装置程序化地选择性鉴别和/或测量和/或展示交感神经组织、受支配组织、传入路径、传出途径以及副交感神经组织中的一者或更多者。任选地,鉴别2-6个GP。任选地,鉴别的GP的大小范围是从约2×2×2mm至约4×4×4mm。任选地,该系统进一步包括用于存储鉴别的神经组织的一个重构的图像的一个存储单元。任选地,该系统进一步包括用于展示一个解剖图像上的一个个人化GP映射的一个模块。任选地,在该解剖图像上展示了活动水平。根据本发明的一些实施例的一个方面,提供了一种用于鉴别患者体内体积的图像内的ANS组分的系统,该系统包括:用于以下各项的至少一个模块:从一种功能成像模态接收功能成像模态数据,该功能成像模态使一位患者的具有包含神经组织的一个身体部分的一个体内体积成像,该患者被注射通过一个自主神经系统(ANS)进行神经组织摄取的一种成像剂;从一种解剖图像模态接收解剖成像模态数据,该解剖图像模态使包含该身体部分的患者的一个体内体积成像;以及基于该功能成像模态数据和解剖成像模态数据在该体内体积中定位该神经组织。除非另外定义,在此所使用的所有技术性和/或科学性术语具有与本发明所属领域的普通技术人员通常所理解的相同的含义。虽然类似或等同于在此所述的那些的方法和材料可以用于本发明的实施例的实践或测试中,但下文描述了示例性方法和/或材料。在冲突的情况下,本发明说明书,包括定义,将占据主导。此外,这些材料、方法和实例仅是说明性的,并且不意在是必然限制性的。本发明的实施例的方法和/或系统的实现方式可以涉及手动地、自动地或以其组合进行或完成选择的任务。此外,根据本发明的方法和/或系统的实施例的实际仪器和设备,若干选择的任务可以通过硬件、通过软件或通过固件或通过其组合使用一个操作系统来实现。例如,用于根据本发明的实施例进行选择的任务的硬件可以被实施为一个芯片或一个电路。作为软件,根据本发明的实施例的选择的任务可以被实施为通过计算机使用任何适合的操作系统来执行的多个软件指令。在本发明的一些示例性实施例中,根据在此所述的方法和/或系统的示例性实施例的一个或更多个任务是通过用于执行多个指令的一个数据处理器如一个计算平台来进行的。任选地,该数据处理器包括用于存储指令和/或数据的一个易失性存储器,和/或一个非易失性存储器,例如用于存储指令和/数据的磁性硬盘和/或可移动介质。任选地,还提供一种网络连接。还任选地提供了一种显示器和/或一种使用者输入装置如键盘或鼠标或触屏。附图简要说明在此参考附图,仅通过举例来描述本发明的一些实施例。现在详细地具体参考附图,应当强调的是通过举例并且出于本发明的实施例的说明性讨论的目的显示细节。在这点上,结合附图进行的说明使得对本领域的技术人员来说,可以如何实践本发明的实施例将是显而易见的。在附图中:图1是一个自主神经系统的示意图,它帮助理解本发明的一些实施例;图2A根据本发明的一些实施例是一种基于体内体积的解剖数据和功能数据的组合定位神经组织的方法的流程图;图2B根据本发明的一些实施例是一种用于组合功能图像和解剖图像和/或定位这些GP的计算机实施方法的流程图;图3根据本发明的一些实施例是一种用于基于体内体积的解剖数据和功能数据的组合定位神经组织的系统的示意性框图;图4根据本发明的一些实施例是其中一位患者用放射性标记的间碘苯甲胍注射的一种临床方案的流程图;图5是一个人的心脏和一组四个神经节丛及其轴突的示意图;图6根据本发明的一些实施例是一种用于通过将作为治疗如消融的靶区域的心房内的心房复杂碎裂电位、收缩力位点和/或主频率位点映射来进行消融治疗的方法的流程图;图7A-7D、图8A-8D、图9A-9D、图10A-10D以及图11A-11D是根据本发明的一些实施例描绘心脏内的活动部位(设定为用于消融的区域)的几组图,其中每组图包括四个视图(顺时针方向):右前斜位(RAO)、后前(PA)视图、右侧位视图(左侧)和后面视图(右侧);图12根据本发明的一些实施例是一种基于SPECT图像中的不同区域与不同器官和/或组织的缔合、基于映射函数来定位神经组织的方法的流程图;图13根据本发明的示例性实施例示出了左心房和左心室的图像,其中该左心房是按照一种一种放射性标记的间碘苯甲胍(mIBG)分子活动进行染色的,这示出了在左下肺静脉中的最大活动水平;图14根据本发明的示例性实施例示出了右心室和左心室的图像,其中该右心室是按照mIBG活动进行染色的,这示出了在内心室间隔中的最大活动水平;图15根据本发明的示例性实施例示出了按照mIBG活动进行染色的左心房的图像;图16、图17、图18、图19、图20根据本发明的一些实施例示出了在GP位点的治疗中的步骤。图21A、图21B和图21C根据本发明的示例性实施例示出了所定位的GP位点,其中这些图中的每一张图从左至右包括横向切割图像、冠状切割图像和矢状切割图像;图22A和图22B示出了在评估的位置上与心脏内的典型解剖GP位置的映射相关之后图21A、图21B和图21C的GP位点;图22C示出了在评估的位置已被叠加在交感神经突触密度映射中之后的图21A、图21B和图21C的GP位点;图23A、图23B、图23C和图23D根据本发明的示例性实施例示出了所定位的GP位点,其中这些图中的每一张图从左至右包括横向切割图像、冠状切割图像和矢状切割图像;图24根据本发明的一些实施例示出了整合到一种用于消融指导的Carto系统中的定位的GP位点的位置;图25描绘了在一位患者心脏的一个3D模拟上并根据本发明的一些实施例定位的HFS应用位点(用具有虚线图案的一个圆圈标记);图26描绘了对于在图25所描绘的应用位点中的HFS的器具(appliance)的一个负面响应;图27A和图27B描绘了在一位患者心脏的一个3D模拟上并根据本发明的一些实施例定位的HFS应用位点(用具有虚线图案的一个圆圈标记);图28描绘了对于在图27A和图27B所描绘的应用位点中的HFS的器具的一个正面响应;图29和图30描绘了重复在图27A和图27B中所描绘的GP位点处的HFS应用;图31描绘了对于在图29和图30所描绘的应用位点中的HFS的器具的一个正面响应;图32和图33描绘了在一位患者心脏的一个3D模拟上并根据本发明的一些实施例定位的HFS应用位点(用具有虚线图案的一个圆圈标记);图34描绘了对于在图35和图36所描绘的应用位点中的HFS的器具的一个正面响应;图35和图36描绘了在一位患者心脏的一个3D模拟上并根据本发明的一些实施例定位的消融位点(用具有虚线图案的一个圆圈标记);图37和图38描绘了在一个消融后测量中的负面HFS响应;图39描绘了在一位患者心脏的一个3D模拟上并根据本发明的一些实施例定位的一个消融位点(用具有虚线图案的一个圆圈标记);图40和图41描绘了在一个消融后测量中的一个负面HFS响应;图42和图43描绘了在一位患者心脏的一个3D模拟上并根据本发明的一些实施例定位的一个消融位点(用具有虚线图案的一个圆圈标记);图44A、图44B、图44C和图44D根据本发明的示例性实施例示出了所定位的GP位点,其中这些图中的每一张图从左至右包括横向切割图像、冠状切割图像和矢状切割图像;图45根据本发明的一些实施例示出了整合到一种用于消融指导的Carto系统中的定位的GP位点的位置;图46A、图46B和图46C根据本发明的示例性实施例示出了所定位的GP位点,其中这些图中的每一张图从左至右包括横向切割图像、冠状切割图像和矢状切割图像;以及图47根据本发明的一些实施例示出了整合到一种用于消融指导的Carto系统中的定位的GP位点的位置。本发明的实施方式的描述本发明在其一些实施例中涉及成像的方法和系统,并且更具体地说但并不排他地涉及使用一种功能成像模态进行医学定位和/或监控和/或成像和/或映射的方法和系统,例如单光子发射计算机断层成像(SPECT)。如在此所用的,短语功能成像模态意指被设计为或以其他方式被配置为产生基于功能的数据和/或图像(例如,一个体内器官或其一个部分的数据和/或图像)的一种成像模态,例如一种基于核的模态,如单光子发射计算机断层成像(SPECT)、正电子发射断层成像(PET)、功能性磁共振成像(fMRI)、或其他模态。这些图像可以是基于组织内的变化,例如化学组成(例如,在神经突触处)、释放的化学物(例如,在突触处)、代谢、血流、吸收或其他变化。这些图像可以提供生理功能数据,例如神经系统组织的活动。如在此所用的,短语解剖成像模态意指被设计为产生基于结构的数据和/或图像(例如,解剖图像)的一种成像模态,例如X-射线、超声(US)、计算机断层成像(CT)(如X-射线或γ-射线)、磁共振成象(MRI)或其他模态。器官、组织和/或其他结构可以是通过解剖图像检测的。本发明在其一些实施例中涉及放射性标记的示踪剂(也称为放射性示踪剂或放射性试剂或示踪剂)和/或放射性药物例如间碘苯甲胍(mIBG)示踪剂或另一种成像剂的用途,它们用于自主神经系统的成像和/或定位(例如,医学定位)和/或监控和/或映射(例如,以获得一个器官中的突触分布)(并且更确切地说用于鉴别神经组织、GP或其他结构)以及其诊断和/或治疗。任选地,该放射性标记的示踪剂是例如表示神经传导物质如去甲肾上腺素(NE)的一种神经活动组织标记物。如在此所用的,术语标记物、成像剂和放射性示踪剂以及放射性标记的示踪剂全部是可互换的。任选地,检测神经组织,例如在非显著性神经组织(例如,支配其他器官的GP)上检测显著性神经组织的存在(例如,支配感兴趣器官的GP)。本发明的一些实施例的一个方面涉及通过输入或包含自主神经系统(ANS)可以引起、加重或维持、或以其他方式影响的疾病、医学病状和/或疾病病状。此类疾病病状的实例包括高血压、心律失常、糖尿病以及肠易激综合征。在本发明的一些实施例中,此类疾病病状可以被诊断和/或监控。在一些实施例中,此类疾病病状可以是通过输入或包含自主神经系统,例如通过GP消融来进行治疗的。本发明的一些实施例涉及用于例如基于功能成像数据和任选地解剖成像数据来检测自主神经系统与受到自主神经系统的不适当活化影响的器官(例如,受支配的器官)之间的连接的装置和/或用于使用此类装置的方法。本发明的一些实施例涉及用于例如比较所采集的功能成像数据或源于它的信息与一组参考数据(例如,参考图像-例如:同一位患者或一个健康的人的参考图像)来诊断ANS的干扰和/或不适当活化的装置和/或用于使用此类装置的方法。本发明的一些实施例涉及用于例如通过提供重构的功能成像数据来确定和/或指导疾病的疗法的装置和/或用于使用此类装置的方法,该功能成像数据鉴别了用于与解剖图像配准的神经组织的位置(例如,提供给一种治疗导航系统,如CartoMergeTM模块)。根据本发明的一些实施例还提供了用于监控或指导该疗法和/或跟进所治疗的患者的装置和/或方法(例如,每几天、几周、几月和/或几年和/或根据疾病进展和/或治疗方案变化)。例如,跟进可以包括监控神经组织,例如随着时间定位并追踪以检测变化。任选地,该疗法可以基于在跟进中所获得的数据进行修改,例如停止、继续、增加和/或改变。本发明的一些实施例的一个方面涉及鉴别神经组织,例如心脏相关神经组织、胃肠相关神经组织、平滑肌相关神经组织、和/或与其他器官和/或组织有关的神经组织。在本发明的一些示例性实施例中,所检测和/或鉴别的神经组织包括突触和/或支配一个靶组织的神经组织,该靶组织如心脏、膀胱、眼、胃肠道器官(例如胃、肠)、呼吸相关组织、肌肉、腺体、肝、胰腺、肾上腺、肾、性器官、膀胱、或其他器官和/或组织。参考图1提供了受支配组织的额外实例。在本发明的一些示例性实施例中,该支配组织是自动鉴别和/或以其他方式在视觉上呈现的和/或通过注射由神经组织选择性摄取的一种标志物(例如,mIBG)来进行测量的。任选地,解剖分解用于区分支配神经组织(例如,通向一个靶器官)与单独的神经组织(例如,未通向该靶器官),和/或区分它们之一或二者与其他组织(非神经组织,例如,脂肪、肌肉、结缔组织、腺体)。任选地,示出两种类型的神经组织。任选地或者可替代地,在单独的神经组织上的结构和/或功能限制如大小、位置和/或形状用于区分支配神经组织、单独的神经组织和其他组织。在本发明的一些示例性实施例中,支配神经组织的神经支配和/或活动的相对量可以是通过计算在所述组织的不同部分中的活动相对于所注射的放射性同位素(例如,神经活动组织标志物)的相对量来确定的。在本发明的一些示例性实施例中,可以展示一个图像,该图像示出了器官(例如,心脏)和神经系统(例如,支配该器官的神经)的功能详情和结构详情二者。在本发明的一些示例性实施例中,该神经系统的功能详情包括突触和神经节。任选地或者可替代地,该心脏的功能详情包括代谢(例如,基于例如甲氧基异丁基异腈(Sestamibi)的摄取)。本发明的一些实施例的一个方面涉及区分传入神经活动与传出神经活动。在本发明的一些实施例中,提供了在沿着一个神经系统的传导通路的两个点处的神经组织(如突触和/或神经节)成像,而没有刺激在这两点之间的神经系统的一部份。两个成像的点受到刺激影响的顺序和/或强度可以指示传入神经或传出神经是否受到刺激和/或其特定通路(例如,沿着刺激点的连接网络)和/或位置(例如,证实神经在刺激点处的位置和/或定位连接至该刺激点的神经)。例如,传入神经当刺激器官例如心脏、肠、眼睛、膀胱、平滑肌或其他器官时与基线状态(例如,在刺激之前的状态)相比将在突触中点亮(显示增加的放射性示踪剂摄取)。任选地,神经回路和/或传导通路可以是通过注意神经组织的激发顺序和/或其相对于刺激物位置(例如,中枢或外周)的离散位置来鉴别的。传入神经与传出神经之间的区分可以是基于合并的解剖成像数据和功能成像数据,和/或可以基于用于定位神经结构的位置的方法,如在此所述的。例如,在一个解剖图像上可以展示所刺激的神经的位置。本发明的一些实施例可以包括使用单光子发射计算机断层成像(SPECT)使突触分布成像和/或在此类成像中使用放射性标记的间碘苯甲胍(mIBG)示踪剂或另一种成像剂。本发明的一些实施例的一个方面涉及基于一个器官(例如,心脏)内的突触分布的诊断和/或疗法控制。在本发明的一些示例性实施例中,异常突触分布和/或活动可以是通过比较所成像的分布与一组或更多组预期的或“正常的”分布来确定的。任选地,不同的预期的分布可以被提供用于在不同情况下进行比较,例如按照性别、年龄、国籍、疾病状态、药物、压力、锻炼、刺激或刺激物。任选地,一种疾病可以是基于所成像的分布和/或活动与一组或更多组表征疾病和/或病状的分布之间的一个匹配来鉴别的。任选地,可以对一个范围的患者采集表征疾病和/或病状的参考组的突触分布。类似地,可以对一个范围的健康人员采集表征健康人员的参考组的突触分布。由一个特定患者成像的一组分布可以与一个或更多个参考组相比较,以用于诊断该特定患者的状态。此类比较可以是基于例如通过热点的相对强度、位置和/或大小(例如相对较高强度的面积,它指示神经的活动)和/或冷点的强度、位置和/或大小(例如较低强度的面积,它指示缺乏神经活动或较低的神经活动)对这些参考组和由该特定患者成像的组进行的表征。在一些情况下,突触分布(例如,密度)可以教授关于一个疾病过程和/或关于该神经系统可以经受或进行的任何重塑。重要的是注意到,在很多患者中,神经系统本质上是高度动态的并且该系统的密度和活动和这些系统组成(例如,神经节、突触、交感神经、副交感神经、传出神经以及传入神经)响应于该疾病并且响应于身体由于疾病或一种疗法而发生的反应。在一些实施例中,该疾病和/或状态可以是基于在两个成像期之间的神经组织变化和/或考虑到在其间提供的治疗。在本发明的一些实施例中,诊断可以考虑到突触在所成像的区域内的分布和活动二者。例如,突触分布可以指示受支配组织的潜在反应性,并且突触活动可以显示该潜在性的利用度。分布和活动的组合也可以显示支配的均匀性和/或神经对组织的刺激/控制,例如神经系统的成像部份对心脏的刺激/控制。在本发明的一些实施例中,诊断可以用于评估心肌梗塞的损害和/或愈合预后。例如,有时情况是对神经组织的损害是不同于对心肌的损害和/或神经再生在不同组织中和/或对于不同神经类型是不同的。心脏的成像可以例如指示未适当地支配并因此可能引起心腔重塑、二尖瓣回流、心力衰竭和/或心脏不同步的心脏部份。在本发明的一些实施例中,用于影响神经组织的一种治疗(如β阻断剂和/或肾(或其他)去神经)的作用可以是任选地通过比较神经活动与器官(例如,对于心脏:壁移动的量和/或速度)的反应(例如,机械反应、电反应、化学反应)来测量和/或追踪的。任选地,该治疗可以基于这些测量值进行修改,例如停止、继续、增加和/或改变。在本发明的一些实施例中,一种慢性病状例如像高血压、糖尿病和/或应激的作用可以是通过追踪突触分布和/或活动之一或二者、任选地连同追踪神经节活动和/或心脏反应来追踪的。在本发明的一些实施例中,在此所述的功能性测量和/或诊断可以用于选择起搏器或其他心电控制器电极的布置。例如,用于心律失常治疗的电极可以任选地布置,其中它们可以减轻、抑制和/或捕获更多高度活化的组织。在另一个实例中,起搏器电极可以是根据在电刺激对于神经活动和/或传导的预期作用来布置的。在另一个实例中,可以布置电极以便阻断刺激物从一个区域传导到另一个区域和/或以便根据神经组织的过度活动减小心脏组织的反应性。在其他实例中,功能测量值可以用于指导消融神经纤维、神经节和/或器官(例如,心脏)的外表面。任选地,可以在消融之后(可能在消融程序过程中)应用测量以确定消融的作用,并且在需要时任选地重复或改变。在本发明的一些实施例中,功能测量值可以用于选择用于药物洗脱小片的位置,该药物洗脱小片洗脱至心脏和/或神经组织(例如,刺激或抑制化学剂)和/或洗脱促进神经组织生长的材料。在本发明的一些实施例中,诊断可以包括例如基于减小的活动和/或减小的机械反应来鉴别在对器官的需求增加时并未按需要反应的一个器官(例如,心脏)的部分。在本发明的一些实施例中,示出活化时间和/或传导速度延迟的映射可以与神经活化相关。这个相关性映射可以用于鉴别例如在一次尝试中由心脏过度活化以补偿延迟的活化和/或传导问题的位置。在本发明的一些实施例中,一种疗法可以包括例如通过调整神经组织输入和/或影响潜在或相关心脏病状来平衡(或者以一种希望的方式改变该平衡)某些区域的活动。在本发明的一些实施例中,此类功能测量值可以用于评定在一些或所有受支配器官内的肥大和/或生长不足的原因。例如,患有右心室心力衰竭的患者可以呈现较虚弱组织的补偿的神经活化,在一些情况下这将对正常组织具有一种溢出效应。超过某一水平的神经活动将引起心脏活动减少,这可以是通过局部阻断补偿的神经刺激的不适当增加。这样的溢出还可以牵涉于例如心律失常中。本发明的一些实施例的一个方面涉及一种以功能(例如,SPECT)数据检测或定位神经节的方法。该方法可以包括在多个分辨率(例如,如以下所述的图像掩模的不同大小)和/或目标过滤器大小(例如,选择大于最小大小阈值的目标)下查看和/或分析(例如,通过一个处理器)功能数据并鉴别为神经节,这些神经节是出现在多个大小的过滤器中的那些目标。该方法的一个或更多个部分可以是通过硬件和/或软件自动地进行的。本发明的一些实施例涉及一种通过使用成像剂例如放射性标记试剂(例如间碘苯甲胍(mIBG)示踪剂)或其他适合的成像剂检测神经节的方法。根据本发明的一些实施例,提供了例如在治疗程序(例如,心脏治疗程序)之前和/或过程中和/或之后基于功能成像模态数据(例如,功能图像)、任选地连同解剖成像数据(例如,解剖数据)定位或检测神经组织例如神经节的多种方法和系统。神经组织面积如神经节是相对小的并且相对于周围组织具有有限的成像剂摄取。功能(例如,SPECT)数据与解剖数据的组合可以允许选择感兴趣区域(ROI),这些感兴趣区域限制了可以由用于重构的数据(例如,用于定位或检测神经组织的数据)推测的面积。可以基于解剖数据选择这些ROI。这个选择可以在过滤掉来自周围组织的噪声之后增加信噪比(SNR)。使用其他成像模态任选地获得该解剖数据,如CT、MRI、荧光检查模态、超声和/或类似模态。另外地或者可替代地,一个或更多个解剖标志可以例如基于成像剂的摄取和/或摄取速率来由SPECT数据的分析进行检测,该成像剂被设定为通过神经组织吞没和/或一种成像剂并不通过神经组织吞没。所检测的解剖标志可以用于与一个解剖图像配准。任选地,在一个监控时段过程中成像剂的动态行为可以用作神经组织的位置的一个区分者(differentiator)。在一些实施例中,功能数据(例如,SPECT数据)可以包括在一个监控时段过程中例如在一个靶向体内体积的一个或更多个ROI中指示摄取速率的动力学数据。例如,该SPECT数据可以包括通过监控成像剂如放射性标记的间碘苯甲胍或包含放射性标记的间碘苯甲胍的混合物的摄取速率来获取的功能数据。任选地,该功能(例如,SPECT)数据可以与在一个消融程序过程中,例如在接近于患者心房的神经节丛的去神经、肾去神经、肝治疗、脾治疗和/或肠治疗的过程中捕获的解剖数据组合。任选地,该功能数据可以与解剖数据组合,以用于诊断,例如用于确定是否进行心脏治疗如神经调制或消融以治疗不同疾病状态,这些疾病状态包括心脏心律失常、充血性心力衰竭和缺血性心脏病。任选地,功能(例如,SPECT)数据可以提前捕获并且转发到一个工作站,以例如在一个治疗程序(例如,心脏治疗程序)过程和/或在此之前与解剖数据组合。例如,可以使用一个CartoMergeTM模块来进行该组合。任选地,SPECT数据和解剖数据如荧光检查数据被组合,以用于进行一个导管插入程序,从而允许一位操作者鉴别和/或定位靶神经组织并且任选地导航和/或指导一个治疗探针接近靶神经组织(例如,接触该靶神经组织)。该治疗探针可以例如是一种消融装置,例如手术间消融装置、非侵入式消融装置和/或最小侵入式消融装置。可替代地或者另外地,该治疗装置可以包括一个RF探针、基于磁的导管和/或一个低温手术探针。在一些实施例中,功能数据和解剖数据可以被组合以用于进行一个导管插入程序,从而允许一位操作者导航一个治疗探针或一个成像探针。在一些实施例中,功能数据可以允许定位不能通过单独的解剖成像定位的组织(例如,神经结构)。例如,一个器官的隐藏的功能部份可以是通过目视检查其功能性来定位的。在一些实施例中,这可以与增加功能成像的分辨率组合,该增加例如是通过将功能成像集中于预期包括解剖成像隐藏功能部份的区域中来进行的。在一些实施例中,这些区域可以基于结构成像来鉴别。任选地,解剖数据用于以一种方式指导功能(例如,mIBG)活动映射函数图像的重构,该方式使得其中定位神经结构(例如,GP、神经节)的区域的分辨率增加。任选地,使用解剖学上改变的门控,例如解剖学上改变的图像掩模进行重构。例如,在心房内的神经组织如个别神经节通常被与心外膜肌紧密相邻的脂肪结缔组织围绕。在心房内的其他神经节是嵌入在叠加于左心房背侧面的脂肪垫中和/或房室沟中。这些神经节与一个脂肪层的紧密相邻可以防止一位操作者(手动地)或一个处理模块(自动地)基于解剖数据定位这些神经节。然而,与通过SPECT数据(例如)提供的功能数据的组合可以允许基于成像剂的摄取速率、动力学数据和/或动态行为分开神经节与周围组织。任选地,鉴别神经结构(例如,GP)而不是脂肪垫。任选地,鉴别在该脂肪垫内的该神经结构本身,而不是鉴别垫周围的脂肪。可替代地或者另外地,该脂肪垫被用作一种解剖指导,以用于例如参考以下所述的图像掩模方法(例如,图2B)检测该脂肪垫内的GP,图像掩模可以是使用与脂肪垫相对应的解剖图像来生成的。然后基于图像掩模对于GP的应用在功能数据内鉴别脂肪垫内的或者在脂肪垫附近的这些GP。任选地,在消融过程中,该脂肪垫内的GP被靶向用于消融。任选地,该消融被选择来消融该GP而不是周围的脂肪垫。周围的脂肪垫可以不被完全去除,例如可以保留大部分脂肪垫或一些脂肪垫,例如,不超过约25%、或约50%、或约70%、或约90%的脂肪垫。根据要求可以进行脂肪垫消融,以消融脂肪垫内和/或附近的GP。可以去除整个脂肪垫,例如作为消融该GP的继发效应,而不是初始靶标。本发明的一些实施例的一个方面涉及一种处理功能图像以在组织(例如,心脏、胃、肠、肾、主动脉、或其他器官或结构)内鉴别和/或定位神经(例如,GP)的方法。任选地,用于重构功能图像和/或处理功能数据的解剖图像与这些功能图像组合,所组合的图像可以用作定位GP的基础。该方法可以包括生成与含有GP和/或器官神经支配的解剖图像区域相对应的图像掩模。这些GP在解剖图像上是不可见,例如心脏GP在包括心脏的一个CT扫描上是不可见。例如,通过配准过程而将所选图像掩模施加至功能图像上的对应位置上。在功能图像内的GP特征被重构,通过所应用的掩模指示。在应用于功能图像的所选择的图像掩模内的GP可以是基于预定的规则,例如活性点的大小和/或活性点相对于周围强度(例如相对于一个平均值)的强度来鉴别的。以这种方式,解剖信息被用于重构功能图像内的GP的活动。掩模形式的解剖信息可以用于指导对功能图像的某些区域的处理,以帮助定位感兴趣的GP。所鉴别的GP可以被展示在解剖图像或一个组合的功能和解剖图像中,和/或可以使用一种用于患者治疗的导航系统、例如用于治疗疾病(例如,心脏病症如心律失常)的一种电生理导管导航系统进行配准。以这种方式,该解剖图像可以用作一个指南,以在功能数据内寻找鉴别相关神经结构的位置,其中神经结构在身体内的大致位置是预先已知的,例如基于一个预定解剖图谱。任选地,该图像掩模方法可以用于决定在何处定位受支配器官和/或限定何处寻找感兴趣的目标。这些图像掩模的大小和/或形状可以是例如通过软件分割解剖图像的能力、通过分辨解剖图像和/或功能图像、通过所鉴别的结构的大小、或者其他方法来限定的。图像掩模方法并不限于检测神经结构(例如,GP)。图像掩模方法可以用于检测其他小结构,例如,小癌症肿瘤和/或淋巴结附近组织。任选地,图像掩模被生成用于具有一个或更多个内腔、流体和/或空气填充的和/或可能的间隔的一种器官(例如,膀胱、心脏、胃、肠、主动脉)。任选地,这些图像掩模被生成来鉴别组织本身的结构,而不是空腔和/或间隔内的结构。任选地,该器官和/或组织的轮廓是基于解剖图像来鉴别的,例如,心腔、胃、膀胱、主动脉、或其他器官的内壁。任选地,这些图像掩模是基于解剖图像来生成的,以指导在功能数据内的检索,从而鉴别神经结构。出于更好地理解本发明的一些实施例的目的,如附图中的图2-图47所示出的,首先参考如图1所示的一种哺乳动物(例如,人)的一个自主神经系统(ANS)的解剖和功能。图1示出了示意形式的一个ANS1000的组分。如可以看出,该ANS包括一个神经节网络,该神经节网络也称为神经节丛(GP)。神经纤维在这些神经节处相遇并释放突触。人体具有若干种控制系统,包括激素系统、中枢神经系统和自主神经系统(ANS)。如在传统上描绘的,自主神经系统(大部分)并未处于意识控制下并且用于调节不同身体功能,包括维持生命的功能。例如,基础心率、呼吸和消化是通过自主神经系统控制的。在一些分类中,与消化有关的自主神经系统部份被称为肠神经系统(ENS)。脊柱102提供了交感神经衰弱和副交感神经衰弱。如所示的,副交感神经衰弱106可以直接进行到器官114和/或次级神经节110。交感神经衰弱可以是通过一个脊神经节调整的并且然后送入到次级神经节110或器官114。在很多情况下,交感神经衰弱和副交感神经衰弱在次级神经节110(例如,纤毛的、腹部的等)处相互作用。次级神经节110可以直接连接在一个器官(例如,114)的神经末梢。在一些情况下,也存在一个中间神经节网络或神经节链(未示出)。该ANS通常被认为包括两个主要功能层,即交感神经系统(SNS),它通常负责兴奋和增加的响应和控制;和副交感神经系统(PNS),它通常负责阻尼响应和控制。例如,心率是通过增加SNS活动来增加的并且是通过增加PNS活动来减小的。在一些器官如心脏内,SNS的神经纤维和PNS的神经纤维在某些神经节处相遇。包含SNS纤维和PNS纤维的神经节利用SNS与PNS的激发之间的一个平衡,以确定其行为。该ANS包括传入纤维(指导朝向受支配组织)和传出纤维(指导远离受支配纤维)。从诊断的观点来看,认为ANS的发作活动(malactivity)可以引起身体功能障碍,例如心房颤动。另外,一般ANS张力(tone)被认为与一些疾病如高血压有关。有时可能出现对于ANS的损害,从而引起器官功能障碍,例如在移植的器官内。从治疗的观点来看,已提议通过消融一部分ANS来治疗不希望的病状的一些实例。注意,贯穿该申请,术语GP和/或神经节也可以是指涵盖除神经节之外的区域(例如其中一个神经遇到一个器官)的一个突触中心,因为可能难以区域一个神经节与一个GP。在一些情况下,单独的神经节与包含多个神经节的突触中心(例如,神经节丛)之间的差异仅仅是语义上的(例如,其中本领域的不同人员使用不同术语)和/或不具有显著的医学重要性。在详细解释本发明的至少一个实施例之前,应理解的是,本发明在其应用上并不一定局限于在以下说明中所阐述和/或在附图和/或实例中所示的组件和/或方法的构造和安排的细节。本发明能够具有其他实施例或能够以不同方式实践或进行。现在参考图2A,它根据本发明的一些实施例是一种通过组合功能数据(例如,SPECT数据)和任选地解剖数据来在体内体积中定位和/或检测和/或鉴别神经组织、例如使其成像和/或映射的方法的流程图。注意,在一些情况下,例如当提及生成表示神经结构位置的数据时,定位、检测和鉴别是可互换使用的。在其他情况下,例如,参考图2B,在生成神经结构位置的数据的过程中,定位、检测和鉴别是可互换使用的,在此情况下这些术语可以表示该过程的不同阶段。任选地,方法200包括一种基于所定位和/或检测的神经组织治疗患者的方法。任选地,方法200的至少一些区块是计算机实施的。任选地,通过一位操作者手动进行至少一些区块。还参考图3,它根据本发明的一些实施例是一种用于通过组合功能数据和解剖数据来在体内体积中定位和/或检测神经组织和/或其他ANS组分的系统500。可以通过图3的系统500,例如与图2A的方法的各部分相对应的一个或更多个模块502来进行该方法的一个或更多个区块。任选地,系统500或系统500的一个或更多个组件是一个图像数据处理单元。任选地,该方法和/或系统是与一种导航系统整合的,该导航系统例如通过Biosense制造的系统和/或通过St.JudeMedicalTM制造的MediGuideTM系统。该导航系统可以执行以下功能中的一种或更多种:映射心脏内的电活动、示出所执行消融的位置、允许导航到该映射所指向到达的位置(例如,治疗导管的导航)以便消融、在垫上所指示的点周围导航以进一步精确定位该GP。任选地,通过导航系统(例如,系统)驱动图2A的方法的(例如,与该治疗相关的)一个或更多个区块。可以使用该导航系统进行该治疗,以消融使用在此所述的系统和/或方法鉴别的神经结构。例如,通过在此所述的系统和/或方法提供在系统空间内的与靶神经结构相对应的坐标。或者,在显示功能和/或解剖的荧光检查成像(或其他成像)和映射下进行导航。系统500可以包括具有用于通过一个处理器504执行的指令的一个或更多个模块502。在一些实施例中,一个或更多个模块502可以被整合在处理器504中。模块502可以包含用于执行图2的方法的一个或更多个区块或在此所述的其他方法的程序指令。模块502可以被存储在一种永久性计算机可读介质如存储器506。如在此所用的,术语“处理器”或“模块”可以包括对一次或更多次输入进行逻辑操作的一个电路。例如,这个处理器/模块可以包括一个或更多个集成电路、微芯片、微控制器、微处理器、所有或部分的中央处理器(CPU)、图形处理单元(GPU)、数字信号处理器(DSP)、现场可编程门阵列(FPGA)或适用于执行指令或进行逻辑操作的其他电路。由该处理器/模块执行的指令可以例如预置到该处理器中,或者可以存储在一个分开的存储器单元中,该存储器单元例如RAM、ROM、硬盘、光盘、磁介质、快闪存储器、其他永久性的、固定的或易失的存储器、或能够存储用于该处理器/模块的指令的任何其他机构(例如,存储器506)。该或这些该处理器/模块可以进行定制以用于一个特定用途,或可以被配置用于一般目的用途,并且可以通过执行不同的软件而执行不同的功能。如果使用超过一个处理器,则它们全部可以具有类似的构造,或者它们可以具有彼此电连接或断开的不同构造。它们可以是分开的电路或者被整合在一个单一电路中。当使用超过一个处理器时,它们可以被配置为独立地或协作地运行。它们可以是电耦合、磁耦合、光耦合、声耦合、机械耦合或通过允许它们相互作用的其他方式耦合的。任选地,一个或更多个处理器504是与一种功能成像模态508电连通的。任选地,处理器504是与一种解剖成像模态510连通的。任选地,处理器504是与一个数据储存库512,例如用于存储所检测的神经组织的数据和/或其他处理结果的数据储存器电连通的。任选地,处理器504是与一种导航系统514,例如用于在患者脉管系统内导航一个导管的导航系统电连通的。导航系统514的操作员可以基于所检测的神经组织导航该导管。任选地,导航系统514是用于心脏的一种电生理(EP)导航系统或者用于身体的其他区域的另一种导航系统。任选地,处理器504是与一个或更多个输出元件516,例如图形用户接口(GUI)、用于展示图像的屏幕、打印机或其他输出装置电连通的。任选地,处理器504是与一个或更多个输入元件518,例如键盘、鼠标、图形用户接口(GUI)、触屏、用于语音识别的麦克风或其他输入装置电连通的。输入元件可以被配置为从系统500操作者例如一位医生接收输入。任选地,处理器504是与一个网络520,例如互联网、当地医院网络、分布的诊所网络或其他网络电连通的。一个或更多个远程服务器可以进行一些或所有处理,可以存储数据,可以提供升级,和/或可以通过远程操作者使用。系统500的组件可以一起销售和/或分成几部分销售。例如,模块502可以作为用于安装在一个现有工作站上的软件销售,该软件从网络520下载和/或被提供在存储器506上。在另一个实例中,处理器504、存储器506和模块502是一起销售的,例如作为一个工作站一起销售。在另一个实例,完整系统是销售的。在一些实施例中,系统500的组件可以被提供在不同位置处和/或作为单独的装置提供,例如所检测的神经组织的数据可以是通过一个或更多个模块502获得的,被存储在数据储存器512中并且发送到导航系统514。所检测的神经组织的数据可以在治疗开始之前获得。如在此所用的,功能数据(例如,SPECT数据)可以是通过一种适合的SPECT模态,例如心电图门控SPECT(GSPECT)模态、A-SPECT、SPECT-CT、和/或D-SPECTTM光谱动力学模态捕获的一个SPECT图像。这些模态的说明书通过引用结合在此。如在此所用的,短语神经组织意指神经节(即,神经节丛,GP)、神经纤维、神经突触、神经子系统、和/或器官特异性神经组织。神经子系统的实例包括外周子系统和/或自主子系统,如交感神经自主子系统和副交感神经自主子系统。器官特异性神经组织的实例可以包括颈动脉体、主动脉弓、肺、肾、脾、肝、下肠系膜、上肠系膜、肌肉和/或阴茎神经组织。应注意,可以在基于功能数据重构一个图像的情况下和/或不在该情况下进行定位或检测。例如,可以通过在功能数据内鉴别一个成像剂信号而不是重构该功能数据以形成一个空间图像来进行定位或检测。然而,可以分析由该功能数据重构的一个图像,以定位和/或检测该神经组织。在这些实施例中,可以处理该功能数据以鉴别一个靶神经组织的一个成像剂信号。靶组织信号可以指示靶神经组织的位置。成像剂信号可以包括动力学信息、一种或更多种成像剂的摄取信息、一种或更多种成像剂的排空信息、和/或其一个或更多个组合。靶神经组织信号可以是相对于一个体内体积中的背景(例如,如通过一个图像掩模提供的)和/或使用最可能的位置、数量、大小和/或类似数据的先前捕获的功能数据来测量的。返回参考图2A,任选地,在202处,基于神经组织的鉴别选择一位患者以进行疾病筛选、评价和/或治疗。任选地,基于一个假设选择该患者,该假设是该患者罹患ANS的不适当活动,例如,过度活化和/或不适当活化。任选地,基于一个假设选择该患者,该假设是该患者可以通过消融或注射的一种疗法和/或鉴别的ANS部份的其他疗法来进行治疗。例如,该患者可能罹患继发于支配心脏的ANS的不适当活动的心房颤动(AFIB)。该患者可以是例如通过一位医生手动选择的和/或通过软件自动选择的,例如,该软件在患者的电子病历内检测一个或更多个入选标准。任选地,在204处,所选择的患者被介绍到一个成像诊所中,以获得图像或用于检测神经系统的其他数据(例如,用于鉴别ANS的一种或更多种组分,如GP)。任选地,在206处,可以例如通过使用一种解剖成像模态(例如,模态510)如荧光检查模态、CT和/或其他解剖成像模态来捕获在一个患者表面和/或体积上的一位患者(例如,一个患者器官)的体内体积的解剖数据,该解剖数据任选地包括解剖图像,例如荧光检查图像。为了简便,术语解剖数据可以包括体内治疗探针的位置数据和/或使用一个体内治疗探针聚集的位置数据。在此类实施例中,数据的组合可以用于实时指导一个治疗。任选地,采集解剖图像以包含在一个动态循环过程中,例如在心脏循环过程中的多个帧。任选地,收集与动态循环相关的额外同步数据,例如心电图(ECG)。任选地,与动态循环相关的收集的同步数据被用于使功能数据的强度读数与组织结构(例如,与心脏壁)更好地匹配。任选地,图2B的图像掩模方法可以与同步数据一起使用。任选地,在一个单一解剖数据(在该循环过程的一些点处获得的)的情况下,该模型允许所检测的强度点迁移到相关的组织点(例如,附近的心脏壁)。例如,心脏壁在心脏循环过程中移动。功能数据可以出现在心腔内,即使该强度实际上与附近的壁内的GP相关。例如,可以迁移甲氧基异丁基异腈数据。可以迁移与甲氧基异丁基异腈数据共同配准的mIBG数据。该迁移可以提供数据配准和图像构造二者。任选地,在208处,通过一种功能成像模态,例如功能成像模态508从该患者中收集功能数据。解剖成像(区块206)和功能成像(区块208)可以出现在不同的时间或者可以在相同的时间同时进行。任选地,采集功能图像和/或解剖图像以包含在一个动态循环过程中,例如在心脏循环过程中的多个帧。任选地,收集与动态循环相关的额外同步数据,例如心电图(ECG)。一位患者可以用一种成像剂注射,例如一种放射性示踪剂和/或放射示踪剂如放射性标记的间碘苯甲胍(mIBG)和/或其与一种或更多种其他放射性示踪剂的一个组合,如TC与mIBG和TL与mIBG。例如,用于同时进行同位素采集的一种混合物具有I-123mIBG、I-124mIBG、和/或Tc-99m锝(99mTc)甲氧基异丁基异腈(Mibi)示踪剂。成像剂可以被一个特异性靶向病理组织例如癌细胞吞没。该mIBG与其他放射性示踪剂的组合可以给出一个定位的或监控的或成像的信息。具有一个或更多个辐射检测器的一种功能模态(例如,SPECT)可以用于采集体内体积的功能数据(例如,SPECT数据),例如一个SPECT图像。成像剂可以允许根据所成像的摄取率定位特异性位点。例如,mIBG对于肾上腺素能神经,例如对于GP具有亲和力,参见尚卡尔瓦力汗苏垃(ShankarVallabhajosula)等人,PhD,放射性碘化的间碘苯甲胍(MIBG):放射化学、生物学和药理学(RadioiodinatedMetaiodobenzylguanidine(MIBG):Radiochemistry,Biology,andPharmacology),核医学研究(SeminNuclMed)41:324-333,该文献通过引用结合在此。任选地,可以使用一种SPECT模态采集体内体积的功能数据如SPECT数据。可以使用一个示例性SPECT模态获取该SPECT数据,该模态包括一组瞄准仪,例如标度分隔(SD)瞄准仪。任选地,使用10与20个之间准直器,例如14个。任选地,该SPECT模态扫描模式包括在360度周围的约360个位置。任选地,所使用的重构算法是有序最大期望值法(OSEM)和/或深度依赖性分辨率恢复(RR)。任选地,像素大小是在约2.5mm3与约4.9mm3之间。在一些实施例,功能或解剖数据或图像是在一个侵入式医学程序开始之前,例如在该患者进入一个导管插入实验室(CathLab)之前采集的。例如,在该导管插入过程之前将一个SPECT数据或图像引入到一个工作站中。功能数据或解剖数据可以是在一个医学程序过程中,例如诊断程序或治疗程序、例如导管插入过程中采集的,例如如在此所述的。任选地,功能数据提供了以下各项中的一种或更多种的指示物:个别示踪剂摄取、总示踪剂摄取、示踪剂摄取率、血流、血管内的血流储备分数、示踪剂排空、超过预定阈值(例如,静态和/或动态阈值)如超过周围平均值的区域、和/或类似数据。任选地,功能数据是按尺寸为几厘米的分割段来产生的。任选地,用沿着该壁,例如沿着腔室内表面的某个分辨率重构功能数据。可替代地或者另外地,用沿着该壁厚度的某一分辨率重构功能数据。两个分辨率可以是相似或不同的。任选地,以约1cm×1cm×1cm或更好的、例如7mm×7mm×7mm或更好的、5mm×5mm×5mm或更好的质量分辨率重构该功能数据。任选地,以一个非立体体素结构重构该功能数据。任选地,该功能数据是以与所成像目标(如心肌壁几何结构)的模型对齐的体素和/或其一个组合来重构的。任选地,在该功能数据中鉴别一个或更多个ROI,这是例如基于所隐含和/或指示的mIBG摄取、功能数据中的分割段的大小和/或形状,例如基于与一个或更多个参考项目例如这个或这些对应ROI的预定模型的匹配,和/或通过一种或更多种已知器官如心室的过滤。在此例如参考图2B描述了鉴别ROI的额外详情。任选地,通过解剖图像,例如通过限定一个或更多个图像掩模鉴别了一个或更多个ROI。任选地,参考对应的ROI测量并分析放射性示踪剂(例如,mIBG)的摄取率,其中例如基于解剖成像数据定位了一个GP,例如如以下所述的。当该ROI指示包括神经节的位置时,该摄取任选地被用作关于神经节生理状况的一个指示。在一些实施例中,在心房区域内的ROI的解剖分割可以允许分别分析不同的心房摄取获得、区分心房内的不同ROI的活动,并且总体来说不仅心房的摄取活动。例如,来自一个解剖成像来源的解剖输入可以用于使一个SPECT图像的不同分割段与不同器官或组织相关联,例如,该SPECT图像的一个分割段可以与心房肌壁(例如,子宫肌层)相关联,并且该SPECT图像的另一个分割段可以与心房心外膜相关联。根据本发明的一些实施例,这个或这些ROI包括一个或更多个神经节。任选地,分析在ROI中在一个监控时段过程中成像剂的一个动态行为,以鉴别用于将一个靶位置与周围组织分开的一个或更多个区分者。动态形式任选地与一个或更多个预定模式和/或一组规则相匹配,以鉴别用于治疗、例如用于消融的一个靶位点。任选地,在210处,可以组合该解剖数据与该功能数据,以允许例如通过一个组合模块502A定位或检测该神经组织。GP的检测是任选的。任选地,当对神经系统和/或其他结构成像时不能找到GP。例如,可以组合解剖数据和功能数据以获得一个组合的解剖-功能图像,例如该图像可以包含两层,即解剖层和功能层。该图像可以具有整个器官或其一部分。组合的解剖-功能图像或数据可以例如通过输出元件516呈现给该操作者。组合的解剖-功能图像或数据可以被发送给处理器504,以进行进一步处理,例如以鉴别器一个或更多个ANS组分。任选地,在212处,例如通过一个定位模块502C定位神经节。可能的位置可以被鉴别。神经节的功能行为可以被提取。任选地,生成靶器官的一个ANS映射和/或图像。该ANS映射可以包括一个或更多个ANS组分的位置和任选地大小和活动水平。所鉴别的神经组织可以被呈现在一个解剖图像上,以示出可能的位置,例如该GP的实际位置可能是不确定的,反而示出了若干种替代方案和/或一个密度图。例如,在一个黑白图像上染色。可以参考一个导航工具(例如,导管)提供坐标。任选地,例如基于大于一个预定阈值,基于局部功能活动和/或其他预定规则来鉴别和/或定位所选择的神经组织部分。在一些实施例中,并未生成一个图像本身,而是可以生成所鉴别的神经组织的ANS数据,例如文件包含所鉴别的神经组织信息,如:位置、大小和/或活动水平。所鉴别的GP的数目例如是1、2、3、5、8、10或其他中间的或更大的数目,或者2-6、或3-8、或4-10、或其他范围。所鉴别的GP的大小例如是约2mm×2mm×2mm至约4mm×4mm×4mm、或约1mm×1mm×1mm至约3mm×3mm×3mm、或其他更小的、中间的或更大的大小。该ANS图像或数据可以具有整个器官或其一部分。该ANS图像或数据可以例如通过输出元件516呈现给(或以其他方式提供给)该操作者。该ANS图像或数据可以被发送给导航系统514和/或储存在存储器506上以用于进一步使用。根据本发明的一些实施例,功能数据可以与解剖数据组合以用于定位神经节丛(GP),例如:在心房内。这可以允许指导一个医学程序,例如以使用解剖来说明该导管所定位的地方并且使用该功能数据鉴别靶标。例如,该定位可以允许指导一位操作者操作位于一个导管顶端的一个消融单元。现在参考图2B,它根据本发明的一些实施例是一种用于处理功能图像以鉴别和/或定位一种或更多种ANS组分(例如,神经节)(可以与区块212相对应)的方法的流程图。应注意,图2B的方法不限于一种或更多种ANS组分的鉴别和/或定位,例如:它可以用于基于图像掩模的应用从功能和解剖图像或数据中提取其他信息,例如,如以下将讨论的。任选地,该方法可以组合该功能图像和解剖图像(可以与区块210相对应)。或者,该解剖图像可以为重构包含这些GP的功能图像的所选择的部分提供一个基础。该方法可以是例如通过图3的数据组合模块502A和/或处理器504、一个图像数据处理单元或其他模块和/或系统来进行的。该方法可以使用来自解剖成像模块(它示出了器官结构,但未足够详细示出GP或完全未示出GP),以由功能成像模态重构图像(它可以示出ANS组分,例如GP或活动水平,但并未足够详细地示出器官结构或完全未示出器官结构)。重构的功能图像可以示出叠加在器官结构上的这些GP。任选地,该方法提供了(作为一个输出)其中定位GP的一般区域。可替代地或者另外地,该方法提供了其中并未定位GP的区域。GP的精确位置在不同患者之间在解剖学上可能是不同的。在一个消融程序过程中,例如使用高频刺激(HFS)可以鉴别该GP的特定位置。可替代地或者另外地,该方法例如使用一个坐标系统提供了该GP的精确位置。在一些实施例中,可能存在从GP实际位置(例如,由于图像中的噪声、配准)到通过该方法提供的GP位置的微小偏差,该微小偏差在消融程序过程中可以通过该操作者校正。任选地,在预选组织区域内鉴别功能活动(例如,mIBG活动)。这些图像掩模是基于解剖图像内的预选组织区域来限定的,这些预选组织区域与所检测的功能活动相对应。例如,在心脏内,GP被定位在心脏壁内或附近和/或在脂肪垫内。任选地,脂肪垫大小和/或形状用于限定搜索窗口和/或图像掩模。mIBG在一个脂肪垫内的分布可能是有利的,其中检测到或未检测到GP。图像掩模被限定用于解剖图像,以寻找心脏壁或附近的这些GP。所生成的图像掩模然后被应用于功能数据,以基于掩模内(例如,在心脏壁内或附近)的活动来鉴别这些GP。任选地,该重构是针对其中预期功能活动(例如,来自GP)的解剖区域,这是例如基于一个预定的解剖图谱,例如基于GP在正常解剖内的位置。此类数据可以是例如通过成像和/或尸体解剖从若干位患者中收集的。任选地,这些图像掩模被定义为鉴别一些或所有的神经活动,例如GP、突触、轴突、神经体、或其他神经结构和/或不同类型的神经。图像掩模可以是不同和/或相同的。以此方式,这些图像掩模可以用作用于指导在功能图像和/或数据内的某些区域内鉴别神经结构的一个指导件。在功能数据内可以存在很多强度区域,仅一个小子集功能数据可能与鉴别ANS组分位置相关,例如:用于消融。由于神经结构相对于身体器官和/或组织的大致位置可能是已知的(例如,通过图谱)但是在解剖图像上是不可见的,所以对于这些神经结构的搜索可以是针对功能图像内的相应区域。该搜索可以是集中于具有大百分比强度读数的区域,这些强度读数表示相关神经结构。该方法可以用于检测在不同身体位置(组织、器官)处的不同GP类型,例如,如在此所述的。该方法可以通过在感兴趣区域内进行计算来鉴别神经组织,从而提高系统性能。在没有神经组织的区域内可能不需要进行计算。该方法可以减少对于患者的辐射暴露。额外辐射可以被应用于包含神经组织的区域,以用于成像,从而在这些区域内提供更高的分辨率。较少辐射可以被应用于不含神经组织的区域。该方法可以改进分析结果和/或图像。可以对所选择区域内的神经组织进行分析和/或成像。可以不对这些所选择区域外的神经组织进行分析和/或成像。可以减少或防止来自这些所选择区域外的神经组织的干扰和/或图像复杂性。以这种方式,不利于患者医学病状的神经组织和并不是消融疗法的靶标的神经组织可以从进一步分析中排除。或者,非靶向神经组织可以与靶向用于消融的神经组织分开地鉴别。任选地,在4802处,接收功能成像模态数据和/或图像,例如一个D-SPECT图像或其他图像。这些图像可以具有一个身体部分,例如躯干、腹部、心脏或其他身体部分(例如,基于扫描协议)。该身体部分包括有待成像的神经组织和/或受支配器官,例如心脏、肠或其他器官的GP。任选地,这些功能图像包括表示神经组织(例如,GP)的活动区域,例如,通过摄取放射性示踪剂(例如,mIBG)。任选地,功能数据是从一个身体部分收集的,该身体部分具有其中预期有神经活动的区域和其中并不预期有神经活动的区域。例如,在心脏成像过程中,预期表示神经活动的数据是来自心脏壁和/或周围组织,预期无神经活动是来自空心室(包含血液)内。噪声可以是从与心腔内相对应的区域接收的,即使预期没有活动。任选地,基于对应的解剖图像(例如,图像配准之后)将该噪音从功能数据中去除。任选地,去除表示在填充空腔和/或血管的血液(或其他流体)内的噪声的强度。例如,例如通过将一个或更多个图像掩模应用于功能图像来去除与心腔和/或周围血管相对应的功能数据的强度读数。任选地,在4804,从该图像中提取一个解剖学区域。任选地,该组织(该组织可以包含神经结构)与中空空间(该中空空间不包含神经结构,但可能包含液体)分开。例如,为了对心脏成像,可以提取左心室(LV)壁。可替代地或另外地,可以提取LV内的中空空间。应指出的是,被提取的区域可以是一层组织,如形成LV壁的组织层,而不是,例如,包括LV内部的空腔的LV。例如,为了使肾成像,可以提取动脉壁和/或可以提取该动脉内部。当对其他器官成像时,可以选择该器官的优势部份。任选地,在4806,从该图像中提取一个或更多个配准线索。这些配准线索可以来自感兴趣的器官和/或周围解剖学结构,例如,LV轴、肝、心间隔、RV、躯干。配准线索可以用于使解剖图像与功能图像匹配和/或用于在一个生理循环(例如,心脏循环)过程中匹配解剖图像。任选地,在4808处,从一种CT、MRI、3DUS、2DUS或其他模态接收解剖图像模态数据和/或图像。该解剖图像表示由神经组织(例如,GP)支配的组织和/或器官的结构。解剖图像表示与神经组织(例如,GP)的位置相对应的组织和/或器官结构。这些解剖图像可以包含有待成像的相同神经组织和/或相同受支配器官。或者,例如从一个一般解剖模型中接收并未使患者个性化的解剖图像。任选地,从一种解剖成像模态接收解剖数据,以重构患者身体的一个区域的解剖图像。任选地,该区域包括与一个靶神经组织邻接的至少一个体内部分的一个部份。解剖图像和功能图像表示包含用于鉴别和/或定位的GP的身体的相应区域。例如,两种模态可以获取心脏、肾或其他器官的图片。例如,为了对心脏的GP成像,获得心脏的解剖和/或功能图像。例如,为了使肾的GP成像,应获得肾脏肾动脉和/或主动脉的解剖图像和/或功能图像。任选地,在4810处,提取和/或采集在一个动态循环过程中与不同时间相对应的图像。例如,对于心脏而言,沿着心动周期提取图像,例如,舒张期末容积(EDV)和/或收缩期末容积(ESV)。在另一个实例中,对于膀胱,可以提取一个完整膀胱和一个空膀胱的图像。可以计算平均图像,例如,(EDV+ESV)/2。任选地,在4812,将一个或更多个图像分段。分段可以是全自动的和/或可能需要使用者手动干预。任选地,在4814,提取一个解剖学区域。任选地,该解剖学区域对应于在4804提取的解剖学区域。任选地,从区块4812的分段图像中提取该解剖学区域。任选地,在4816,从该图像中提取一个或更多个配准线索。这些配准线索可以来自感兴趣的器官和/或周围解剖学结构,例如,LV轴、肝、心间隔、RV、躯干。任选地,在4818处,配准功能图像或数据与解剖图像或数据。任选地,基于区块4804和4814的提取的解剖区域的比对配准这些图像。配准可以是手动进行、自动进行和/或半自动进行的。任选地,进行配准以考虑器官的动力学,例如,心脏的移动。例如,在该动态循环过程中的解剖图像可以一起对齐,和/或功能数据可以被校正用于动态移动,例如,心腔内的强度读数可以被校正至附近的移动的心脏壁。任选地,在4820处,基于解剖图像和/或数据生成图像掩模。任选地,这些图像掩模将神经组织的处理和/或可视化显示指向位于这些图像掩模内的图像的特定位置。例如,在一个应用的图像掩模的体积内展示和/或处理GP。可以不处理和/或展示在该图像掩模的体外之外的GP。可以与图像掩模内部的那些GP不同地处理和/或展示图像掩模体积之外的GP。任选地,处理这些解剖图像,以生成对应于至少一个体内部分(例如,心室壁)的尺寸的图像掩模。例如,特定患者的体内部分的大小可以被计算并用于限定该掩模。任选地,针对围绕空腔的组织选择和/或定义这些图像掩模,例如,基于心腔壁的形状定义这些图像掩模并且不包括这些室内的中空区域,基于动脉壁的形状定义这些图像掩模并且不包括动脉内的中空区域,基于膀胱壁的形状定义这些图像掩模并且不包括膀胱内的中空区域。应注意,这些神经结构可以出现在由这些图像掩模限定的组织内,但是不可以出现在中空空间内(该中空空间可以填充有流体,如血液、尿液或其他流体)。这些图像掩模可以包括围绕感兴趣的器官的组织。例如,基于图像分段(例如,根据该系统将该图像分段的能力)、基于组织类型(例如,肌肉对结缔组织)、基于器官大小、基于器官内的子结构(例如,心腔、肝叶、肾部分)或其他方法定义这些图像掩模。对于不同组织类型和/或对于在该器官内的不同位置的GP,可以生成不同的图像掩模。例如,对于心外膜内的GP,生成一组图像掩模。对于心肌层内的GP,可以生成另一组图像掩模。对于脂肪垫,可以生成图像掩模。该图像掩模可以是具有基于解剖图像内的组织和/或器官部分选择的形状和/或大小的一个2D和/或3D体积。该图像掩模可以与被认为包含用于成像的神经组织(例如,GP)的解剖部分相对应,例如与四个心腔的壁相对应,与肠壁、膀胱壁、肾动脉、肾动脉的主动脉分支区域、肾或其他结构相对应。在一些实例中,可以生成图像掩模,以包含在心脏的心外膜组织和/或心肌组织内的GP。在另一个实例中,可以生成这些图像掩模,以包含支配在主动脉-肾动脉结点处的GP。应注意,可以基于这些GP的评估的位置(例如,正常患者解剖)来生成这些图像掩模,因为这些GP可能在该解剖图像上是不可见的。可以基于这些GP的评估的位置并且基于体内部分的尺寸来生成这些图像掩模,该尺寸可以是从解剖图像推断的。任选地,这些生成图像掩模对应于该解剖图像的分段。例如,该心脏被分割成一些腔室壁(例如,具有用于消融的GP),并且所生成的图像掩模与感兴趣的腔室壁相对应。例如,针对心脏的每个室壁生成一个第一图像掩模。应指出的是,较小的室的厚度在某些图像(例如,CT)中可能难于测量。在这样的情况下,每个室的第一图像掩模的厚度可以基于可测量的解剖学区域(如LV)。或者,使用另一种成像模态(例如,US、MRI)测量该腔室的厚度和/或进行评估。可以使用该解剖图像进行测量,例如,图像掩模的厚度可以基于如在CT图像上测量的LV的厚度。然后可以基于LV测量评估这些腔室的示例性图像掩模厚度,例如:对于LV、右心室(RV)、右心房(RA)和左心房(LA)的图像掩模,厚度是0.3至0.5×LV。或者,例如,倍增系数可以是0.3、0.7、1.2、1.5、2.0、或其他更小值、中间值或更大值。搜索GP的区域可以是远离该壁的LV厚度的函数,和/或是以mm计的。不同的壁具有不同的掩模。图像掩模可以被设置来包含这些GP和/或周围组织。该图像掩模可以是以该壁为中心,或者可以朝向该壁的一端设置。例如,为了搜索心外膜GP,该掩模可以是处于该壁的外缘。为了搜索心肌GP,该掩模可以是处于中间。任选地,基于模板生成和/或施加这些图像掩模。这些模板可以限定:受支配器官(或组织)的位置和/或在该受支配器官内和/或在其附近、在该器官外的这些GP的位置。可以例如基于针对身体的组织和/或器官描绘神经结构的预定义解剖图集生成这些模板。任选地,这些生成的图像掩模彼此相邻。可替代地或另外地,这些生成的图像掩模彼此叠加。可替代地或另外地,这些生成的图像掩模相对于彼此隔开。该模板可以限定这些GP在距离心脏壁大于约1mm、或约2mm、或约3mm或更大的距离处的位置。任选地,这些生成的图像掩模彼此相邻。例如,在搜索GP时覆盖一个大面积。可替代地或者另外地,所生成的图像掩模彼此叠加,例如,以提高GP与组织类型的匹配,和/或在鉴别一个移动器官如心脏内的GP时。可替代地或另外地,这些生成的图像掩模相对于彼此隔开。例如,当在不同面积内搜索GP时,例如,防止这些面积之间的错误鉴别。任选地,在4822处,将这些图像掩模应该于功能图像。可替代地或者另外地,将这些图像掩模应用于功能数据。可替代地或另外地,将这些图像掩模施加至组合的功能和解剖图像和/或数据(例如,叠加的图像)上。任选地,基于配准过程(区块4818)施加这些图像掩模。该解剖信息用作一个指南,使用所选择的图像掩模,以用于选择性重构在该功能图像内的GP相关的数据。这些图像掩模可以与包含具有神经组织的解剖结构的图像相关。施加可以是基于图像配准,例如,基于常用的坐标系而施加。这些图像掩模可以应用于某一种类型的包含神经组织的组织。例如,可以将这些图像掩模施加至心脏的心外膜上。可以使其内表面与室壁的心外膜表面对齐而施加这些图像掩模,这样使得该图像掩模包含涵盖该室的心外膜空间。任选地,所生成的图像掩模与用于指导重构描绘靶神经组织的一个功能图像的功能数据相关。任选地,在4824处,计算在所应用的图像掩模空间内的功能活动。任选地,计算平均功能活动。任选地,计算功能活动的标准偏差。对于心脏实例,计算每个单独的腔室周围和整个心脏周围的功能活动。这些腔室的平均活动可以是由A1LV、A1RV、A1LA、A1RA表示的。该心脏的平均活动可以是A1H表示的。该活动的标准差可以由SD1LV、SD1RV、SD1LA、SD1RA、SD1H表示。任选地,可以计算整个功能图像或数据的平均活动和/或标准偏差。任选地,可以例如基于同一位患者的先前的成像、基于“正常”患者活动等预先设定平均活动和/或标准偏差。任选地,在4826,重复4820、4822和/或4824中的一个或更多个。可替代地,重复4820、4822、4824、4828、4830、4832、4834、4836和/或4838中的一个或更多个。或者,重复图2B中的所有区块中的一个或更多个。任选地,生成用于不同解剖部分(例如,用于不同心脏室、用于不同组织层)、任选用于包含神经组织的不同组织类型的额外图像掩模。任选地,针对在早先的分析的解剖学部分附近和/或与其邻近的解剖学组织和/或解剖学部分生成另外的图像掩模。可以生成不同图像掩模,并且然后一起应用于鉴别支配该器官的这些GP。例如,不同类型的GP可以支配不同的组织。或者,单独地处理不同的图像掩模,例如以区分不同的GP(例如,位于该器官的不同组织内)。可替代地或另外地,针对不同时帧,任选地在动态周期(例如,心动周期)的每个图像上生成图像掩模。该掩模可以是动态的。该掩模可以在时间配准后随时间变化。任选地,该掩模是一种时空掩模。该动态图像掩模在周期过程中可以与感兴趣的解剖区域相关。例如,该图像掩模可以在心动周期过程中随心脏移动,但是维持相同的相对位置。例如,当心脏收缩和舒张时,施加至LV壁上的图像掩模来回移动(和/或变小和变大),但是维持与LV壁的相对位置。可替代地或另外地,针对解剖和功能图像两者生成图像掩模。例如,基于可以形成单个图像或两个分开的图像(任选地连接的图像)的组合的和/或配准的图像生成图像掩模。任选地,在循环生理过程(例如,心动周期、膀胱排空、肠蠕动)期间获得这些解剖图像。任选地,针对在生理过程期间获得的不同图像选择不同的时空图像掩模。任选地,与生理过程同步不同的时空图像掩模,以对应于这些组织的同一位置。以此方式,在生理过程期间,可以随这些组织移动而维持这些组织的位置。例如,在4820处(重复),生成额外图像掩模以检测心肌层内的神经组织。心肌掩模的大小和/或形状可以不同于心外膜掩模的大小和/或形状并且可以与该心脏内的不同区域相对应。例如,心外膜图像掩模可以与腔室壁的心外膜表面对齐,以使得它将包含涵盖该腔室的心外膜空间。心肌图像掩模可以涵盖每个腔室的壁。示例性心肌图像掩模厚度包括:对于该LV的图像掩模是1.2×LV厚度、对于该RV是0.7×LV厚度、对于该RA是0.4×LV厚度、对于该LA是0.4×LV厚度、或者其他倍增系数(对于每个厚度),例如0.4、0.7、1.0、1.2、1.5或其他更小值、中间值或更大值。在另一个实例中,鉴别隔膜内的神经结构。创建该隔膜的图像掩模。例如,在4822(重复的),将这些图像掩模施加至该图像上,以与心肌相关和/或包含心肌。例如,在4824(重复的),可以针对心肌图像掩模计算功能活动的平均值和/或标准差。这些室的平均活动可以由A2LV、A2RV、A2LA、A2RA表示。心脏的平均活动可以由A2H表示。该活动的标准差可以由SD2LV、SD2RV、SD2LA、SD2RA、SD2H表示。任选地,例如针对体内的点或体积、针对图像掩模空间内的点或体积或其他方法标准化计算的活动水平。归一化可以允许鉴别例如纵隔膜内的这些GP。任选地,在4828处,鉴别在所应用的图像掩模空间内的GP。应注意,‘GP’术语用于方便讨论并且该方法可以应用于鉴别一种或更多种ANS组分或者用于提取或鉴别与神经活动或其他组织有关的其他信息。可替代地或者另外地,鉴别在器官体积和/或相邻组织内的GP。任选地,在多个不同图像掩模内鉴别的GP被组合为所有鉴别的GP的一个单一图像,例如,在该器官内的鉴别的GP。可替代地或者另外地,将随着时间在多个帧的相应图像掩模(例如,在心脏循环过程中该LV心肌层的所有图像掩模)内鉴别的GP组合。任选地,通过调整该图像掩模的位置和/或大小和/或形状来鉴别这些GP。任选地,基于对应的解剖图像调节图像掩模。任选地,调整该图像掩模以排除可以在生理上不包含GP的区域。任选地,代替调节的图像掩模和/或除其之外和/或基于其来调节功能数据。例如,由可以不包括神经结构的解剖区域获得功能强度数据,例如在中空(例如,流体填充的)空间内,如心脏室和/或血管。该腔室本身可以包含神经。当在该室(例如,靠近心壁)中检测强度读数时,可以调节图像数据和/或图像掩模,以反映强度读数的估计位置。例如当解剖图像数据与功能图像数据之间的配准不精确和/或不完整时,可能需要掩模调整。例如,在不同的角度获得解剖图像数据和功能图像数据。任选地,定位在图像掩模和/或器官体积内的这些GP。例如在2D和/或3D中可以计算一个GP相对于另一个的相对位置。任选地,这些GP被一起组合为一个ANS映射或ANS数据。任选地,确定GP之间的连接性。连通的GP可以是处于同一个图像掩模内、处于在不同空间位置处的不同图像掩模内、和/或处于在不同时间点(但在相同的相应位置)的不同图像掩模内。任选地,确定GP之间的空间关系。例如,一个第一GP相对于一个第二GP的位置之间的相对位置。任选地,鉴别剧烈活动的区域。例如,基于剧烈的mIBG活动鉴别心外膜GP(EGP)和/或心肌GP(MGP)。任选地,基于一个或更多个预定义阈值和/或规则鉴定GP。任选地,基于大小鉴别GP。可替代地或者另外地,基于相对于平均活动和/或周围活动的活动水平鉴别GP。可替代地或者另外地,基于GP之间的连接性鉴别GP。任选地,该GP可以被鉴别为具有至少约4×4×4毫米(mm)(例如,对于EGP)或者约2×2×2mm(例如,对于MGP)的大小的一个目标物。可替代地或者另外地,该GP可以是通过比较某一区域的计算的活动(例如,图像强度)与同一图像掩模内的周围的活动来鉴别的。可替代地或者另外地,该GP可以是通过比较该图像掩模内的计算的活动(例如,图像强度)与另一个图像掩模内的活动来鉴别的。例如,可以将EGP鉴定为满足以下规则,即EGP的总活动是预定义因子乘以高于平均活动(A1和/或A2)的标准差(SD1和/或SD2)和/或它周围的活动低于EGP活动的一半(例如,与体积相关)。任选地,使用者可以选择和/或修饰预定义因子。例如,可以将MGP鉴定为满足以下规则,即MGP的总活动是另一个预定义因子乘以高于平均活动(A1和/或A2)的标准差(SD1和/或SD2)和/或它周围的活动低于MGP活动的一半(例如,与体积相关)。任选地,使用者可以选择和/或修饰预定义因子。任选地,对每一帧、任选地对动态循环(例如,心脏循环)的每一帧进行GP鉴别。任选地,所鉴别的GP是与一种组织类型自动地相关。任选地,基于所应用的图像掩模,所鉴别的GP是与该组织类型相关的。可替代地或者另外地,基于强度读数的特征,所鉴别的GP与该组织类型相关,例如较大的大小(表示大的GP)仅可以见于某些组织中。任选地,不同类型的GP是与不同的组织相关的。例如,心肌GP与心肌相关和/或心外膜GP与心外膜相关。任选地,在4830处,计算所鉴别的GP的一个或更多个参数(在此也称为GP参数)。参数的实例包括:平均大小、比活度(例如,每GP体素的计数/在相应图像掩模体积内的平均计数)、功率谱(例如,低于1Hz的功率、1-5Hz之间的功率、高频率与低频率之比)、归一化功率谱、GP连接映射(例如,不同GP之间的连通性和相互作用)、每一预定面积的GP数目(例如,GP密度数/平方厘米)。例如,对于所鉴别的EGP,可以计算以下参数中的一个或更多个:EGP大小、EGP比活度、EPG功率谱图、EGP归一化功率谱(即,在不同频率下的EGP功率减去来自心肌图像掩模空间的总计数的功率之间的差值)、EGP连接映射。例如,对于所鉴别的MGP,可以计算以下参数中的一个或更多个:一个面积内的MGP数目和对于每个预定面积(马歇尔韧带(Marshalligament)、左下LA壁、右下LA壁、其他面积)的平均大小、MGP比活度、MGP功率谱、MGP归一化功率谱(即,在不同频率下的MGP功率减去来自心肌图像掩模空间的总计数的功率之间的差值)。任选地,对每一帧、任选地对动态循环(例如,心脏循环)的每一帧进行GP参数计算。任选地,在4832,可以标准化计算和/或其他参数。在该方法的一个或更多个区块内,例如在采集功能图像和/或解剖图像的过程中和/或在此之后、在计算功能活动时、在鉴别GP时、在计算GP的参数时、在比较随着时间变化的数据时、或者在其他区块下,可以进行归一化。一种或更多种标准化技术的实例包括:原始数据、原始数据除以大概在同一时间获取的已知的固定解剖学位置中的原始数据值(例如,患者纵隔中的示踪剂活性)、标准化至正常的患者数据集、标准化至来自一系列获取的第一个或最后一个图像获取处的活性值、标准化至不同生理状态(例如,静息、应激)下获取的值、以上一些或全部的组合和/或其他方法。或者,替代该方法的一个不同区块和/或除此之外,在此之前,例如在区块4828中鉴别GP之前,进行4832的归一化。归一化可以有助于鉴别这些GP。例如,将一个局部区域内的活动水平(例如,mIBG水平)与图像掩模空间内的和/或相对于一个预定阈值的穿过该器官体积的一个平均值和/或标准偏差相比较。可替代地或者另外地,对于灵敏度,校正所计算的数据(例如,区块4824、4828、4830)和/或所测量的功能强度。任选地,在每个图像掩模内和/或在相关图像掩模中进行灵敏度校正。例如,一些面积对于放射性试剂的摄取可能具有相对较高的灵敏度,并且一些对于该放射性试剂可能具有相对较低的灵敏度。任选地,该解剖数据与该灵敏度相关联。任选地,基于不同的灵敏度水平生成这些图像掩模(区块4820),例如,较高灵敏度神经结构的一组图像掩模和较低灵敏度神经结构的另一组图像掩模。任选地,将不同灵敏度标准化至共用基线。可替代地或者另外地,使功能数据的测量值归一化,例如,使放射性试剂的摄取的测量值归一化至患者中的相应化学剂的水平。任选地,根据所鉴别的GP的活动水平使强度测量值归一化。任选地,获取表示这些GP的活动的测量值。例如,在mIBG的情况下,可以使测量值归一化至患者中的去甲肾上腺素(NE)(和/或肾上腺素(adrenaline)和/或肾上腺素(epinephrine))水平。例如,测量血液(例如,通过血液样品)、尿或其他体液中的NE水平。基于所测量的NE使mIBG摄取的强度归一化。另外地或者可替代地,mIBG测量值可以被归一化至mIBG随着时间的衰减函数(例如,通过注射mIBG)。在另一个实例中,通过非化学方法测量活动水平。基于在一个心脏负荷测试过程中获取的测量值(例如,基于ECG测量值、心率、心输出量或其他测量值)进行mIBG的归一化。这些测量值可能与所鉴别的GP的活动水平相关(例如,通过一个表格、数学方程式或其他方法)。任选地,在4834处,比较随着时间变化的数据。任选,确定GP参数随着时间的变化。任选地,确定不同获取时间之间的计算的参数的动态变化。例如,可以从注射直到注射后6小时,通过在此时间窗过程中重复图像采集若干次数来计算GP(例如,EGP)活动随着时间的变化。可以在注射该示踪剂后超过一次获取该功能图像。任选地,在4836,基于施加至该功能数据和/或图像上的掩模重构功能图像。可替代地或另外地,基于施加至组合的功能和解剖数据和/或图像上的掩模重构图像。所重构的图像可以包含所鉴别的GP,例如,作为强度增加的区域。所重构的图像可以被叠加在解剖图像上,从而示出了这些GP的身体位置。可替代地或者另外地,重构该功能图像内的这些GP的特征。通过图像掩模指导重构。任选地,在4838处,提供所计算的结果(例如,区块4828、4830、4832、4834)和/或所重构的图像(区块4836)以呈现给操作者,或者以其他方式将它们提供给操作者。例如,在监测器上呈递给内科医师。另外地或者可替代地,可以将所计算的结果和/或所重构的图像储存在一个存储器中,以用于进一步使用(例如,诊断)。所计算的结果可以有助于诊断该患者(例如,参考区块216描述的)和/或有助于指导治疗(例如,参考区块228描述的)。任选地,提供这些结果用于呈递在某一帧(例如,收缩末期帧)上。可替代地,提供结果用于呈递在多帧(例如,心动周期的视频)上。任选地,所重构的功能图像或组合的功能和解剖图像被提供用于在一个治疗程序过程中进行配准。所重构的功能图像可以被叠加于在治疗程序过程中获得的解剖图像上和/或与该解剖图像配准。可以通过操作者使用所叠加和/或配准的图像,以在治疗过程中在身体上确定这些GP的位置。已参考该心脏描述了图2B的方法。该方法不限于心脏,并且可以用于其他器官/空心流体填充器官(例如,胃部、主动脉、膀胱)和/或实心器官(例如,肾、肝)。可以在其他器官内鉴别GP和/或神经末梢。例如,可以基于周围结构(骨、肌肉、分支动脉)分割主动脉并且因此生成图像掩模。例如,可以基于解剖的肝叶部分分割肝。现在返回参考图2A,可替代地或者另外地,根据一种或更多种映射函数定位这些神经节,该映射函数对成像的体内体积的一个或更多个区域的一种参考动力学行为和/或一个摄取率进行映射。例如,可以通过一种相关矩阵进行配准,该相关矩阵可以被提取计算为功能数据和解剖数据内成像的特定体内体积。在一些实施例中,该神经组织可以是通过确定以下各项中的一种或更多种独特特征来定位的:摄取和/或动力学信息和/或与周围组织和/或器官的摄取和/或动力学信息的关系。例如,形成一个分层的图像,其中功能数据作为一个额外层添加在一个解剖图像如一个荧光检查图像的顶部,从而任选地形成该ANS映射。该组合可以是通过呈现与解剖数据并行的、与该解剖数据配准的和/或叠加在该解剖数据上的功能数据来进行的。应注意,将该解剖数据与该功能数据组合可以增加功能数据的SNR。配准该功能数据与该解剖数据(例如,至一个单一坐标系统)可以指示其中可以示出不同摄取指示的一个解剖区域。这可以允许根据解剖数据内的一个评估的体积过滤该功能数据,在该评估的体积内定位一个靶神经组织(例如,通过使用参考图2B讨论的图像掩模)。任选地,可以在注射成像剂之前和/或同时开始定位和/或成像和/或鉴别。在另一个实例中,在注射成像剂之后立即开始成像。在一个实例中,在注射之后延迟约多至5分钟、约10分钟、约30分钟、约1小时、约1分钟与约10分钟之间、约5分钟与约20分钟之间、约10分钟与约30分钟之间、约15分钟与约60分钟之间、约30分钟与约120分钟之间、约1小时与约6小时之间或者约5小时与约48小时之间开始成像。任选地,可以提供超过2个成像步骤,以进行定位。任选地,该定位包括采集动态生理过程,如动态灌注、动态示踪剂摄取、动态示踪剂排空等。任选地,在214处,例如通过一个ANS生成模块502D来生成神经节连接性的一个ANS模型。该模型可以是基于所鉴别的和/或定位的神经节(区块212),例如基于ANS映射或数据来生成的。任选地,该ANS模型是该ANS映射或ANS数据。例如可以如在此所述地生成该模型。该模型可以是通过在所鉴别的神经节之间连接来生成的。任选地,该模型在空间定位的GP之间连接。可替代地或者另外地,生成一个映射。该映射和/或所重构的图像可以包含例如GP、组织内的神经末梢密度、组织功能性、组织解剖、这些神经周围的组织(例如,脂肪垫)、解剖数据、其他数据如电活动、基于MRI的功能性、基于CT的物理数据和/或其他数据。该图像可以是例如2D、3D、具有解剖配准标志、图像块、核医学数据和/或其他数据的3D。所生成的映射可以被展示,可以被用于导航治疗,可以进行进一步分析,和/或可以被转移(例如,使用物理介质和/或下载)。任选地,该ANS模型可以由一个或更多个重构的图像所组成(例如,图参考4836所讨论的)。在一些实例中,所重构的图像具有某一个组织区域或者一个感兴趣的体积或一个选择的感兴趣区域。在一些实例中,基于体素、分割段、或基于模型的或其一个组合进行重构。在一些实例中,该图像重构可以提供一种或更多种放射性示踪剂的摄取强度、或与成像剂在受支配组织、神经组织和/或血管内的动态行为相对应的动力学参数。任选地,在216处,进行诊断和/或将诊断分配给患者。任选地,该诊断包括被认为有助于和/或引起患者症状和/或疾病的潜在神经解剖结构。可替代地或者另外地,排除神经组织对于患者病状的贡献,例如,成像分析可以指示正常的神经组织。该诊断可以是通过医生手动地进行的和/或通过软件自动地进行的。例如,软件可以比较所成像组织的生成的分布与一组或更多组预期的分布(例如,‘正常’患者的分布和/或同一位患者的先前的分布)之间。异常活动可以是基于该比较来检测的。任选地,在218处,例如在数据储存器512上存储所生成的ANS模型(区块214)。任选地,存储该诊断(区块216)。还可以存储其他数据,例如,功能和/或解剖原始图像。任选地,在220处,选择疗法来治疗该患者。任选地,基于该诊断(区块216)来选择该疗法。任选地,基于功能数据和解剖数据的组合的一种或更多种ANS组分的定位可以用于选择和/或指导一个医学治疗(仪器指导可以是基于该定位),例如去神经程序(如肾去神经或心房内的去神经节)、肌肉消融程序(例如心房和/或心室壁的消融程序)、神经支配调整程序、血液治疗和/或支架植入程序(在血管内),例如如在此所述的。例如,该定位可以用于任选地基于SPECT数据和解剖数据的组合来指导在心房内的神经节的消融,例如作为治疗心房颤动(AF)的一个成像,例如在一个导管插入程序的过程中。任选地,所指导的导管是一个心腔内超声心动图(ICE)导管。在这些实施例中,来自ICE导管的成像数据可以包括解剖数据,该解剖数据可以与该SPECT数据或图像和/或重构的图像组合。任选地,例如基于所测量的摄取给出一个消融程序的评估的成功预测,其中例如失败的评估可以指示出现心律不齐并且一个成功的评估意指心律不齐减轻和/或消除。在此类实施例中,对于其中测量摄取率的这个或这些位置可以存在一个值。例如,该ROI可以处于左心室(LV)和/或心房内。任选地,ROI是通过使用图像掩模来获得的。应注意,对于mIBG,总心房摄取远小于LV中的摄取。例如,在某些位置的GP可以表示相关高的消融成功率,而其他位置的GP可以表示相对低的消融成功率。其他实例包括基于GP的映射(ANS映射)进行的预测,例如,高度互连的GP的消融的成功率可以低于低互连的GP的消融。任选地,一个评估模块自动地计算评估的成功预测。任选地,在222处,将该ANS模型和/或映射(例如,连接至解剖标志的数据表面,如2D和/或3D)和/或诊断装载到一个导管导航系统(例如,导航系统314)中。任选地,该导航系统是一种3D电生理学(EP)系统。任选地,该导航系统被设计用于GP消融指导。任选地,导航系统514是系统。任选地,GP的坐标和/或GP之间的连接的映射被装载到用于展示这些GP和/或映射相对于系统的治疗导管的位置的该系统中。任选地,该模型被发送到一个与该导航系统(例如,系统)合并的一个服务器。任选地,例如基于一个按使用付费的模型,按使用进行计费。可替代地或者另外地,将该模型装载到具有储存在介质(例如,存储卡、CD)上的数据的便携式介质中,例如在该CD上该患者被提供有模型,以发送给下一位提供者。任选地,基于装载的诊断和/或计划的治疗,对诊断和/或疗法自动进行计费。例如,该按使用付费方法、按所生成的映射付费方法或其他方法。任选地,在装载到该导管导航系统中时解密数据。该数据可能已被加密以帮助确保患者隐私。解密的数据可以例如作为一个图像展示。该功能数据可以是在医学程序开始之前,例如在该治疗程序(例如,心脏治疗程序)之前的几个小时和/或一天进行采集的。例如,一个SPECT数据可以例如使用一个CartoMergeTM模块(例如,通过数据组合模块502A)来与一个电解剖映射配准。将该ANS模型装载到该导管导航系统中可以在一个治疗过程中(如,以消融程序)为操作者提供一个准确的指导。装载到该导管导航系统中可以帮助操作者在插入该导管之前规划治疗。任选地,在224处,该ANS模型是例如通过输入数据的一位使用者使用输入元件518手动标注的和/或通过软件自动标注的。任选地,该治疗计划是基于使用者所输入的数据和/或自动生成的数据来注释的。标注和/或注释可以帮助操作者在插入该导管之前规划治疗。任选地,这些映射和/或数据被简单叠加在该系统上,并且通过该系统作为任何其他覆盖进行治疗。医生可以理解叠加的映射意味着什么。任选地,治疗医生基于该GP图像标记用于消融的点和/或区域。任选地,(或其他系统)理解该数据和/或映射,并且追踪该GP的消融。任选地,该导航系统可以追踪、指导和/或提醒操作者,例如追踪消融的GP、在消融之前和之后提醒测试消融点(自动标记的治疗点)、或其他功能。任选地,追踪所应用的收缩压和参数,以指示该消融应用于该组织的多深处。任选地,该导航系统(例如,)遵循现有医疗实践,例如提醒和/或追踪肺静脉(PV)周围除这些GP本身之外的消融。任选地,可以追踪所述的一种或更多种,以评估操作者管理对GP的消融(该GP在距离该壁的一个距离处或不在该处)的可能性(或提供是/否)。任选地,例如基于该GP的位置、该消融方法、该组织类型或其他因素,建议应用参数和/或门控消融来消融这些GP。任选地,追踪距离心脏、动脉和/或操作者需要消融以到达靶组织(例如,GP)的其他腔室的内表面的深度。任选地,所述追踪程序可以在其他上下文中用于例如消融在心室壁中间的肝组织。任选地,收集电学数据,并且用该电学数据标注该模型。例如,心脏的电映射。可以收集电学数据,和/或使用该系统进行标注。任选地,基于所重构的功能图像(例如,图2B的方法)规划治疗,该功能图像示出了叠加在所获得的解剖图像上的这些GP和/或ANS连接映射。可替代地或者另外地,基于单独的重构的功能图像规划治疗。可以在治疗过程中实时地进行在一个解剖图像上的叠加,例如将该功能图像叠加在一个荧光检查图像上。任选地,对于所定位的GP的消融设定该系统。例如,可以选择该治疗导管、可以选择和/或设定用于所应用的治疗的功率水平,或者可以选择和/或设定其他参数。当SPECT数据被转发到作为导航系统的一部分的一个工作站时,该工作站可以合并一个实时电解剖映射(在治疗之前和/或过程中获得的)与如以上所述地采集的SPECT数据。例如,该工作站可以合并ANS映射(例如,具有SPECT数据的示出一种或更多种ANS组分的一个CT映射)与电解剖映射,以标注该ANS模型。这些结果可以作为电解剖映射上(例如,在输出元件516上)的彩色靶标的注释呈现给该操作者。例如,对于心脏治疗,通过比对在来自不同信息来源的图像中的左心室(LV)进行图像配准,以使得来自大量斑点的SPECTmIBG斑点下落到心房壁中(每个照分割的解剖图像)。根据本发明的一些实施例,功能数据例如SPECT图像的不同区域是与不同器官或组织,例如与根据一种或更多种映射函数进行映射的一个神经组织和周围组织相关联的。这些映射函数可以是例如通过多变量分析SPECT数据、例如动态SPECT数据和血管造影数据来提前限定的。该映射可以允许基于动力学行为和/或摄取率区分所成像的体内体积的不同区域。例如,图12根据本发明的一些实施例是一种基于功能(例如,SPECT)图像或数据中的不同区域与不同器官和/或组织的缔合、基于映射函数来定位神经组织的方法100的流程图。102’、103’是以上参考图2A的区块208描述的。在311中,可以例如从一种计算装置的存储器(例如,储存在存储器506上的一个映射模块502B)来提供一个映射函数。如312处所示的,该映射函数可以用于使功能(例如,SPECT)图像中的一个或更多个区域与一种或更多种器官和/或组织相关联。如在313处所示的,该映射可以允许相对于周围组织定位一个靶组织,例如允许分开一个神经组织(例如,神经节)与一个周围区域。返回参考图2A。任选地,在226处,将一个导管插入到患者的身体内。该导管可以被插入通过血管(例如,通向心脏的股骨动脉)。可以插入一个单一导管(例如,双功能)或两个导管,例如一个导管用于验证治疗点(例如,电刺激)和/或另一个导管用于消融。任选地,该消融治疗导管是可与系统相兼容的,或者被提供有系统。任选地,在228处,基于这些注释,例如基于解剖注释,将该导管导航到第一治疗点。例如,该操作者被提供有与该ANS映射叠加的实时荧光检查图像,以使得该导管可以被实时导航到正确位置(例如,一个特定的GP处)。任选地,基于该系统在该患者内导航该导管。任选地,定位该导管以朝向使用系统展示的这些GP进行消融。任选地,基于预先叠加在解剖图像上的重构的功能图像导航该导管,例如配准的和/或叠加的图像已被装载到该导航系统中。可替代地或者另外地,基于叠加在一个实时的解剖图像(例如,荧光检查图像)上的重构的功能图像,例如装载到该导航系统中的重构的功能图像来导航该导管,该导航系统获得该实时解剖图像。可替代地或者另外地,基于单独的重构的功能图像导航该导管,例如导航可以是基于位置传感器。任选地,该导管的导航是基于位置传感器。这些位置传感器可以与重构的功能图像和/或ANS映射相关。或者,该导管的导航并不是基于位置传感器。例如,导航可以是基于视觉图像,如叠加在靶向受支配组织内的导管的实时图像上的重构的功能图像。任选地,该导管被导航到定位的治疗位点处。任选地,定位可以是一个实时定位,它是基于在一个治疗时段的同时或基本上同时和/或在此过程中,例如在一个医学治疗过程中捕获的功能数据和/或解剖数据。任选地,在230处,功能性验证导管在这个或这些治疗点处的位置。功能验证可以是通过操作者手动地进行和/或通过程序化进行验证过程中的一个或更多个的一个验证模块自动进行的。例如,该操作者应用刺激并且该模块分析这些结果。在另一个实例中,该模块自动应用刺激并分析这些结果。在另一个实例中,该模块应用刺激并且使用者分析这些结果。任选地,通过该系统功能性验证这些治疗点。例如,可以通过向这些点应用高频率刺激并测量响应来证实该点。任选地,高频率刺激是应用于这些点和其周围,例如以补偿ANS映射中的任何微小误差(例如,由于噪声或配准)。根据本发明的一些实施例中,一个或更多个神经组织可以是通过刺激某一体内面积内的一个神经组织并响应于该刺激鉴别一个或更多个神经反应来定位的。该刺激可以是药理学刺激、机械刺激、热刺激和/或电刺激,例如高频率刺激(HFS)。在此类实施例中,在刺激一位患者的体内体积中的一个神经组织以触发与某一参考摄取值相关联的一个神经响应之后,可以采集来自一种功能模态的一个功能数据,例如如以上所述的。然后可以分析该功能数据以根据该参考摄取值在该体内体积中定位神经组织。任选地,使用所重构的图像,以获得一个区域。在该区域中对一个或更多个点进行测试,例如以测定对于HFS、DF或其他测试方法的响应。任选地,在232处,例如使用该导管,例如使用电消融、化学消融、冷沉淀消融和/或其他消融方法来消融所鉴别和/或定位的治疗点(例如,GP)。消融可以是不可逆的(例如,组织坏死)或可逆的(例如,使用肉毒杆菌)。可以从附近组织,例如从心腔内部到心脏壁内的一个GP进行消融。可以在该GP自身内或邻近该GP处,例如通过将一个针穿过心脏壁插入该GP自身内或附近来进行消融。该GP自身内的消融可以不伤害周围组织。任选地,使用该系统消融这些GP。例如,使用系统递送和/或控制能量。任选地,消融GP。任选地,消融含有GP的区域。任选地,消融心脏壁内的区域和/或周围的脉管系统。任选地,消融肺静脉内的区域。任选地,该导管包含一个消融元件,例如在导管尖端处。任选地,该导管被设计用于应用一个力来朝向靶组织和/或靶组织内部推动该消融元件。例如,该消融元件是插入心脏壁的一个针,或者穿过该壁到达一个脂肪垫,以注射化学剂如永久性毒物(例如,醇类)或暂时性毒物(例如,肉毒杆菌毒素)和/或抵靠着心脏壁定位的一个电极。任选地,基于所鉴别的GP的位置定位和/或指导消融元件。任选地,应用一个力(例如,通过一个机器人自动应用和/或通过一位使用者手动应用)。任选地,应用消融能量。所应用的力和/或消融能量的量任选地与有待消融的鉴别的GP的位置有关和/或例如通过一个表格、数学关系式或其他方法测量的(例如,通过导管尖端)。例如,定位在距离心腔内表面0.5cm处的一个GP可以是通过定位在应用某些能量的内心脏壁的表面上的消融元件来消融的。定位在距离内壁1cm或其他距离处的另一个GP可以是通过较高的应用能量和/或通过将消融元件的较强的力应用于内壁来消融的。在另一个实例中,消融可以是通过由该导管聚焦的高功率超声阿狸进行的,从而基于深度改变焦点。任选地,在234处,监控消融的作用。可以监控对于立即靶器官的作用。可以监控对于其他身体器官的作用。例如,可以监控对于心脏的作用和/或心脏对于GP消融的响应。任选地,通过重复ANS成像中的至少一些来进行监控。可替代地或者另外地,通过重复至少一些刺激来进行监控。刺激消融后的结果可以与刺激消融前的作用相比较。消融的作用可以是通过该比较来监控的。任选地,在临床上和/或使用设备,例如通过临床观察患者、通过进行测量(例如,血液、心输出量、ECG)、和/或其他方法来进行监控。根据本发明的一些实施例,功能数据(也称为SPECT数据)可以与解剖数据组合,以用于一个消融程序,例如用于消融在心房附近的一个神经组织,例如如以下所述的。例如,现在还参考图4,该图4是根据本发明的一些实施例用于神经调节心房内的一个或更多个GP的临床协议的流程图。首先,如以上所述的,该患者可以用I-123标记的mIBG注射,例如剂量是在约3mCi与8mCi之间或者约2mCi与12mCi之间,例如约5mCi。具有高灵敏度的mIBG示踪剂的数据或图像(使用高分辨率扫描器,例如D-SPECT)可以允许以一种可区分的方式定位活动GP例如在心房的ROI中的位置。该患者还可以用一种支持的放射性药剂如Tc-99m标记的示踪剂注射,以用于心脏灌注映射,例如基于一种示踪剂如甲氧基异丁基异腈-Tc-99m、替曲膦-Tc-99m和替肟锝(Teboroxime)-Tc-99m。例如,Tc-99m标记的示踪剂的剂量是在约6mCi与12mCi之间、约3mCi与10mCi之间或者约2mCi与15mCi之间、例如约10mCi、约8mCi和约5mCi。在一些实例中,在静止时和/或应激时出现GP定位。可以在放射性示踪剂(I-123标记和Tc-99m标记)摄取时进行定位,例如,首先注射I-123标记的mIBG,然后成像,然后注射Tc-99m标记的示踪剂,然后成像。在另一个实例中,可以对两种放射性示踪剂(I-123标记和Tc-99m标记)同时进行定位,从而允许获得这些示踪剂的完全配准的图像并且在较短的时间帧内。在一些实例中,以Tc-99m标记的示踪剂与I-123标记的示踪剂的约2:1的剂量比注射两种示踪剂。例如,约10mCiTc-99m(如甲氧基异丁基异腈-Tc99m)与约5mCimIBG-I-123同时注射。在其他实例中,使用约1:1至3:1之间的比率,或者使用约1.5:1至2.5:1之间的比率。任选地,功能成像(例如,用于GP定位)和/或同时多种示踪剂的定位可以包括在以下时间段内的光子采集:约10分钟、约5分钟、约3分钟、约多至2分钟、约8分钟、约2至8分钟、约多至10分钟、约多至15分钟、和/或约多至20分钟。任选地,在236处,证实匹配ANS模型的治疗作用。治疗可以在证实之后继续,或者如果已治疗所有的点和/或已实现所希望的作用(全部或部分),则结束。或者,这些作用并不匹配该ANS模型,在此情况下,例如,操作者可以决定停止治疗或重新评价下一个治疗点。任选地,使用系统证实消融治疗的作用。任选地,通过系统将HFS应用于治疗区域。一个负面响应可以指示GP的成功消融。任选地,基于重复ANS成像中的至少一些来测定这些作用。可替代地或者另外地,基于重复至少一些刺激来测定这些作用。成像和/或刺激消融后的结果可以与成像和/或刺激消融前的作用相比较。消融的作用可以是通过该比较来监控的。任选地,在238处,基于治疗计划和/或基于监控的作用消融额外的位置。或者,在同一点继续治疗。任选地,重复该方法的一些区块,任选地,将该导管移动或旋转到另一个位置(228)或者保留在同一个位置;验证该点(230)或维持同一点;消融该点(232)、监控这些作用(234)和/或证实这些作用(236)。任选地,在240处,在已完成治疗阶段之后监控进展。可以在门诊患者的基础上例如通过临床检查、血液测试、ECG或其他方法监控患者。可以通过重复的功能和/或解剖图像监控患者。可以安排患者进行一个或更多个额外治疗阶段。任选地,定位可以用于监控神经组织,例如在一个治疗时段过程中进行的多个治疗阶段中,例如:在一天、一周、一月、一年或任何中间值或更短时间的一个治疗时段过程中。在此所述的方法和/或系统适用于鉴别和/或治疗患者身体内的神经结构。这些方法和/或系统可以用于消融身体内的其他结构。这些其他结构使用解剖成像模态可能是不可见的(例如,太小、分辨率不够高、与周围组织类似),例如淋巴结、癌转移瘤或其他结构。例如,为了检测转移性甲状腺癌,可以使用采用血清甲状腺球蛋白、通过标准LT4去除或rhTSHF刺激进行的TSH-刺激的低剂量131I全身扫描。例如,为了检测血清甲状腺球蛋白,可以使用99mTc亚甲基二磷酸盐(MDP)。例如,为了使淋巴结成像,可以使用18F-FDG。任选地,这些系统和/或方法可以用于鉴别具有预期的大小和/或形状和/或活动、定位在相对于解剖标志的一个窗口内的目标,这些解剖标志可以使用功能模态和/或解剖模态来成像,它们可以与另一个图像如核医学图像配准。应注意,可以进行组合的CT和核医学成像以获得解剖配准,并且然后应用参考图2B所述的方法。现在另外详细讨论图2A的方法200的区块中的一个或更多个。参考区块212,任选地,如图4所描绘的,定位可以发生在多个治疗阶段,例如,以提供一个早期图像和一个晚期图像(重复区块206、208和/或210)。例如,在约10分钟的一个第一定位步骤之后是一个等待时间,在此之后是约10分钟的一个第二成像步骤。在一些实例中,成像步骤之间的等待时间是约5分钟、约10分钟、约20分钟、约30分钟、约45分钟、约60分钟、约90分钟、以及约120分钟或任何中间值或更长的时段。例如,等待时间是在约5分钟与约30分钟之间、约20分钟与约60分钟之间、约30分钟与约120分钟之间、约1小时与约5小时之间、或者约2小时与约48小时之间。参考区块228,该操作者可以导航一个导管到心脏中,以用于治疗。例如,现在参考图5,该图5是人心脏300和一组四个神经节丛(GP)301-304以及其分别在人心脏300的左上GP(SLGP)、左下GP(ILGP)、右前GP(ARGP)、以及右下GP(IRGP)中的轴突的示意图。该图像还描绘了一个冠状窦306,该冠状窦306被已连接至心房的肌肉纤维和马歇尔305的静脉和韧带包围,该静脉和韧带从冠状窦行进到左上肺静脉(LSPV)与左心耳(LAA)之间的区域中并且包括马歇尔GP。在脂肪垫内定位这些GP。一个GP定位在位于右心房与右肺静脉的结点处的右肺静脉(RPV)脂肪垫并且提供窦房(SA)结的直接迷走神经抑制。另一个GP定位于在IVC与ILA的结点处的下腔静脉和左下心房(IVC-ILA)脂肪垫中,它选择性地支配房室(AV)结区域并且调节AV传导。另一个GP定位于在上腔静脉内侧(SVC)和右肺动脉上方的主动脉根之间的SVC-AO脂肪垫中,迷走神经纤维的“总站”投影到心房和IVC-ILA与PV脂肪垫中。心脏神经结构中的一种或更多个可以被展现给操作者以进行导航和/或治疗。功能数据与解剖数据之间的组合可以允许指导消融过程(例如,通过创建ANS映射或数据),例如通过指示操作者这些GP定位在何处(区块224),从而允许操作者通过操作如以上所述的消融单元来消融一些或所有的它们(区块232)。当指导至与一些或所有以上GP接近处和/或另一个神经节区域处时,该消融单元任选地被用于高频率刺激。任选地,使用预先采集的分割的图像,例如来自一个模型的指示一些或所有以上GP的位置的解剖成像数据,例如通过一个图像整合模块如CartoMergeTM模块输入的(区块222)。任选地,采集与治疗的GP有关的数据并且将其用于成像和/或指导治疗过程,例如在周围区域中,例如在其中定位该GP的脂肪垫的心外膜脂肪的空间分布和/或厚度。例如,GP的消融可以是用于治疗患有阵发性或持久性心房颤动的患者的一个选项(区块220)。参考区块210,任选地,该功能数据在其与解剖数据组合之前分割。例如,肺静脉(PV)切片、左心房(LA)切片和/或GP是例如基于与一个模型的匹配来分割的。现在参考图6,该图6根据本发明的一些实施例是另一种用于通过使心房内的心房复杂碎裂电位(CFAE)位点、收缩力(CF)位点、和/或主频率(DF)位点作为靶区域映射来进行消融治疗的方法800的流程图。图2A的方法可以根据图6的方法进行修改。首先,如在801处所示的,可以对CFAE、CF和DF位点进行映射,例如可以生成一个ANS模型(区块214),和/或可以在该模型上展示这些位点(区块224)。然后,如在802处所示的,可以计算在CFAE、CF和DF和/或CFAE、CF和DF与GP之间的交叉。这些交叉可以与解剖上已知的GP、例如以上所述的GP的预期位点的交叉,与预先采集的定位的GP、例如在SPECT数据中鉴别的GP的交叉,和/或与通过高频率刺激实时定位的GP的交叉。然后,如在803处所示的,这些交叉可以被选择为用于消融的靶区域(例如,区块224)。例如,现在参考图7A-7D、图8A-8D、图9A-9D、图10A-10D以及图11A-11D。具有一个常见数字的每组图根据本发明的一些实施例包括在以下四个视图(顺时针方向)中的CFAE、CF、和/或DF位点和/或CFAE、CF、和/或DF位点的交叉:右前斜位(RAO)、后前(PA)视图、右侧位视图(左侧)和后面视图(右侧),它们可以例如使用图6所述的方法来鉴别。图7A-7D描绘了CFAE区域707的映射。图8A-8D描绘了CFAE区域909以及其与ARGP911、SLGP912、ILBP913和IRGP914的交叉的映射。图9A-9D描绘了CFAE区域909以及其与ARGP911、SLGP912、ILBP913和IRGP914以及与DF位点、例如位点920的交叉的映射。图10A-10D描绘了CFAE区域909以及其与CF位点921的交叉的映射。任选地,在CFAE区域、DF位点与GP之间的交叉被鉴别为用于消融的一个靶位置,例如参见在图11A-11D中描绘的完整点,它们是RAO、PA、右侧位视图和后面视图,例如完整点950。任选地,完全相交对部分相交而言是优选的。除GP检测本身之外或者替代GP检测本身,该神经组织典型地由神经元、轴突和突触组成并且典型地包含高脂肪组合物和/或定位在脂肪组织内和/或接近脂肪组织。因此,神经组织的结构成像至少是具有挑战性的。以上描述了用于检测或定位神经组织的神经节的方法。在本发明的一些示例性实施例中,此类方法被延伸和/或补充来检测突触和/或支配靶组织如心脏、GI道或如在此所述的其他组织和/或末梢器官的其他神经组织。在本发明的一些实施例中,功能成像器(例如,SPECT或PET)可以使用对于自主神经组织相关的这些功能(例如,去甲肾上腺素产生、分泌或加工、乙酰胆碱产生、分泌或加工和/或多巴胺产生、分泌或加工)之一具有亲和力的一种组织特异性示踪剂(例如mIBG或另一种示踪剂)。适合的示踪剂的额外详情可以可见于例如题为“神经成像和治疗(NERVEIMAGINGANDTREATMENT)”的PCT申请(代理人案号58463),该申请与本申请共同提交。在本发明的一些实施例中,特异性示踪剂被靶神经组织选择性摄取并且可以采集功能信息(例如,作为辐射计数)。在一些情况下,采集被定时至神经系统的刺激或其他调节,例如药物提供、电刺激、机械刺激、身体相互作用(例如,在手上或脸上的冷水)和/或运动,以使得所采集的数据不仅可以反映身体的稳定状态,而且或者反而反映对刺激物的反应。本领域已知注射这些示踪剂以接收其体内摄取的图像的不同方法。然而,与造影机的低分辨率和灵敏度偶合的这些示踪剂的信噪比被认为(在可能性增加的程度,这并不清楚)是鉴别并定位小靶标例如组织去神经和/或神经节的一个障碍。在本发明的一些示例性实施例中,如在此所述的,鉴别例如具有小于例如20mm、10mm、5mm、3mm和/或2mm的最大长度的神经组织。任选地或者可替代地,鉴别例如具有小于例如10cmsq、5cmsq、4cmsq或更小的表面大小的受支配组织。在本发明的一些实施例中,鉴别和/或定位自主神经系统(ANS)的活动,例如使用足够好的分辨率鉴别神经节(例如,<10mm、<5mm)和/或突触,例如,该ANS的组织内突触的分布。在本发明的一些示例性实施例中,可以使用一种解剖模型(例如,结构或解剖成像器,例如:X射线CT图像)来分割功能数据。在本发明的一些实施例中,使用通过结构成像器(例如,CT)提供的结构模型来进行该功能数据的重构。在本发明的一些实施例中,功能数据根据该分割来分配给组织。在本发明的一些实施例中,根据一个假设的神经再支配来分析器官内的活动组织。例如,以分辨率为代价,优化处理以用于灵敏度。在强调分辨率的情况下任选地处理器官外的组织,例如以检测匹配神经节的解剖预期的目标的大小、形状和/或位置。在本发明的一些实施例中,这些位置是相对于该器官上的解剖标志和/或是根据距离该器官边界的距离。在心脏的一些实例中,解剖数据如来自CT成像器的解剖数据可以与功能数据(例如,mIBG数据和/或来自心脏示踪剂的数据)组合并且不同算法(例如,如在美国专利8000773和相关申请中所述的算法)可以用于检测心脏的4个腔室和/或相关结构的心肌层的边界。然后可以进行来自不同模态的不同图像的配准并且可以将其用于区分在相应心肌层体积内的相关mIBG活动。在本发明的一些实施例中,使用以上所述的方法/例如使用图2B的方法鉴别或检测或定位一种或更多种ANS组分(例如,神经节)。任选地或者可替代地,可以使用以下方法。mIBG的一般(例如,平均)活动可以是在一个区域(以不同的大小重复应用)内测量的并且与一个阈值比较,该阈值可以是在该区域内的mIBG活动的功能变化(2、3、4、或区域活动的中间标准偏差)。任选地或者可替代地,多次(例如,2、3或更多次)出现的例如1、2、3、4、5、6、7、8、9mm或更大或中间的大小的躯体大小(例如,具有不同的区域大小和/或位置)可以被鉴别为神经节。在本发明的一些实施例中,需要在一个大小的区域中至少两次发现同一个躯体位置,该大小在体积上比发现的怀疑的神经节大至少2、4、6、8、10、20或中间的数值的系数。在本发明的一些实施例中,副交感神经和交感神经的神经节和突触可以是通过用仅影响一种神经的一种刺激物进行刺激并且检测受影响的神经节和/或突触来区分的。例如,此类刺激可以与一种示踪剂的注射同时提供并且将该示踪剂的摄取与标准速度相比较。在本发明的一些实施例中,传入和传出神经导管可以是通过在一点处选择性刺激并且比较在沿着该导管的上游和/或下游的作用和/或确定这两点处的活化顺序或其他作用来区分。例如,在传出导管中,预期首先示出活动和/或在神经节中更强烈。例如使用适合的电刺激和/或药物刺激阻断这些神经节可以防止和/或减少突触活动。在副神经组织中,相反的作用是预期的。图13-15根据本发明的示例性实施例示出了对人患者成像时交感神经突触在心脏上的分布,该人患者的心脏使用x-射线CT成像进行分割。通常,在这些图像中,根据相对mIBG活动校准这些颜色,其中红色是高度活动的并且绿色是低活动的。在这些图像中并未示出神经节。图13根据本发明的一个示例性实施例示出了左心房1304和左心室1302的图像,其中该左心房是按照mIBG活动进行染色的,这示出了在左下肺静脉1306中的最大活动水平;图14根据本发明的一个示例性实施例示出了右心室1704和左心室1302的图像,其中该右心室是按照mIBG活动进行染色的,这示出了在内心室间隔1706中的最大活动水平,它是中隔内热点。在1706处的消融可以治疗肥厚型心肌病(HCM)和/或肥厚型梗阻性心肌病(HOCM);以及图15根据本发明的一个示例性实施例示出了按照mIBG活动染色1906的左心房1304的图像。特别感兴趣的是在室间隔膜附近的活动的一个热点,它显然在本领域并不已知并且并不用于规划治疗和/或诊断。在本发明的一些实施例中,活化区域的分辨率在线性分辨率中是1与10mm之间(例如3mm、5mm、7mm或中间的分辨率),以用于在mIBG活动的直方图中以不同的几十个百分比分开各位置,如通过计数测量的。应注意,在脂肪垫位置与突触位置之间可以存在一些相关性并且这可以用于指导图像重构,例如以优先分配mIBG计数给那些区域时,这些脂肪垫并不需要指示突触密度的精确图案。现在参考根据本发明的一些实施例的一组成像阶段和消融,它们被进行来使靶区域(具有神经节丛的心脏位点)成像并治疗该靶区。这些靶区域是根据以上方法,例如根据基于图2描绘的一个体内体积的解剖数据和功能数据(例如,SPECT数据)的组合定位神经组织的方法和/或使用图3所描绘的系统来鉴别。在本发明的一些实施例中,可以使用以下程序:可以采集心脏及其周围组织的一个CT解剖图像和心脏及其周围组织的一个mIBG核医学(NM)图像。任选地,在该CT图像中鉴别的心脏的形状被用于重构一个NM图像。在本发明的一些实施例中,在心脏外的热区域可以被鉴别为神经节。具有神经节指示的所重构的组合的图像可以用于一个图像导航系统,如Biosense公司的Carto系统,该系统允许在心脏内导航一个导管并且允许该导管位置叠加在一个先前采集的图像上。这个系统任选地被用于指导一个消融导管到心脏(例如,心房)相邻的神经节部分。为了证实神经节的存在,可以使用高频刺激(HFS)刺激(或其他类型的刺激)。一旦证实或者可能在没有HFS刺激的情况下,以下表明的这些结果可以是多余的,可以在一个鉴别的神经节处或附近进行消融。任选地,精确导航的使用允许使用较低的功率和/或较低数目的消融。例如,每个心脏和/或神经节可以应用小于20、10、5或中间的数目的消融。任选地,使用较低功率,如40瓦特(例如,用于RF消融)、30W、20W、10W、5W或中间的或更小的功率水平。任选地或者可替代地,使用较短的时段,例如每次消融60秒、50秒、30秒、20秒、10秒或中间的数目或更少。在一个第一实例中,定位一位60岁的男性,他具有BMI22(176cm/69kg)并且具有室性心律失常、胸闷、低EF(LVEF35%)和非缺血性心肌病的病史,即进行一个CT扫描并具有一组心脏位点,这些位点在此被称为根据以上参考图2-图3描述的方法和/或系统鉴别的GP1、GP2和GP3。在图21A、图21B和图21C中描绘了GP1、GP2和GP3,其中这些图中的每一张图从左至右包括横向切割图像、冠状切割图像和矢状切割图像。在图22A和图22B还定位了在评估的位置已与心脏内的典型解剖GP位置的映射相关之后的GP1、GP2和GP3。当叠加在交感神经突触密度映射上时,在图22C中还定位了GP1、GP2和GP3。这些红点代表主要GP(相对较大的大小)并且在心肌层上的红色区域代表微小GP位点(相对较小的大小)。在一个第二实例中,定位一位47岁的男性,他具有对于PVI和CVI的阵发性心房颤动导管消融的病史并具有正常LV收缩、LVEF=60%、LDDd=47和LAD(左心房尺寸)=36,即进行一个CT扫描并具有一组心脏位点,这些位点在此被称为根据以上参考图2-图3描述的方法和/或系统鉴别的GP1、GP2、GP3和GP4。在图23A图23B、图23B、图23C以及图23D中描绘了GP1、GP2、GP3、以及GP4,其中这些图中的每一张图从左至右包括横向切割图像、冠状切割图像和矢状切割图像。在图23A、图23B、图23C和图23D中的图像是将根据以上参考图2-图3描述的方法和/或系统描述的图像与一个对应的CT图像组合的图像。所定位的GP位点的位置被整合到用于消融指导的一个Carto系统中,例如如图24所示的。该图示出了GP位点在一个描绘的解剖图像上的位置。一位操作者可以基于该描绘的解剖图像导航用于消融这些GP位点的一个导管。现在参考在一位患者的心脏的一个3D模拟上的一组呈现的成像心脏GP位点。通过在这些映射的GP位点中的每一个位点处测量靶位点对于一个HFS的反应来验证该GP位点,该靶位点例如具有直径小于10毫米(mm)、例如5mm、例如3mm的一个体积,其中该消融本身是通过多至30瓦特(W)、例如多至20W、例如10W的一个低功率来进行的,在少于20次应用中,例如约3次重复应用中有例如5个阶段和例如3个阶段,持续约20-30秒。在此程序中,监控碎片变化和心房颤动的终止。图25描绘了在一位患者心脏的一个3D模拟上的HFS应用位点(用具有虚线图案的一个圆圈标记)。该应用位点是一个非GP位点。在图26中证明了对于此器具的负面响应。图27A和图27B描绘了在一位患者心脏的一个3D模拟上的HFS应用位点(用具有虚线图案的一个圆圈标记)。该应用位点是RIPVGP位点。在图28中证明了对于此器具的正面响应。图29和图30描绘了在RIPVGP位点处重复该HFS应用。在图31中证明了对于此重复的正面响应。图32和图33描绘了在一位患者心脏的一个3D模拟上的HFS应用位点(用具有虚线图案的一个圆圈标记)。该应用位点是LIPVGP位点。此位点是通过使用如上所述的导管应用低功率应用(多至20W)的五个阶段来消融。在图34中证明了对于此器具的正面响应。通过图37和图38证明了在图35和图36中定位的在LIPVGP位点处的消融结果,该图37和图38描绘了在一个消融后测量中的负向HFS响应。此响应指示了消融过程的成功,即使该靶区域是在一个有限次数的消融阶段中用有限的功率治疗的。通过图40和图41证明了在图39中定位的在RIPVGP位点处的消融结果,该图40和图41描绘了在一个消融后测量中的负向HFS响应。此位点是通过使用如上所述的导管应用采用低功率(多至20W)的三个阶段来消融。还消融在图42和图43中的RSPVGP位点(用具有虚线图案的一个圆圈标记)。此位点是通过使用如上所述的导管应用采用低功率(多至20W)的三个阶段来消融。在一个第三实例中,定位一位72岁的男性,他具有阵发性心房颤动/高血压/血脂异常的病史,LV收缩大部分是正常的,LVEF=66%,LVDd=40mm,并且LAD(左心房尺寸)=42mm,即进行一个CT扫描并具有一组心脏位点,这些位点在此被称为根据以上参考图2-图3描述的方法和/或系统鉴别的GP1、GP2、GP3和GP4。在消融之前进行成像。在图44A、图44B、图44C和图44D中描绘了GP1、GP2、GP3、以及GP4,其中这些图中的每一张图从左至右包括横向切割图像、冠状切割图像和矢状切割图像。在图44A、图44B、图44C和图44D中的图像是将根据以上参考图2-图3描述的方法和/或系统描述的图像与一个对应的CT图像组合的图像。这些GP位点的位置被整合到用于消融指导的一个Carto系统中,例如如图45所示的。在一个第四实例中,定位一位72岁的男性,他具有阵发性心房颤动/高血压的病史,LV收缩是正常的,LVEF=58%,LDDd=37,并且LAD(左心房尺寸)=37,即进行一个CT扫描并具有一组心脏位点,这些位点在此被称为根据以上参考图2-图3描述的方法和/或系统鉴别的GP1、GP2和GP3。在一个电生理(EP)之前进行成像,这可以帮助评价患者的病状,例如以确定该患者是否适用于使用在此所述的方法和/或系统进行的治疗。在图46A、图46B、46B和图46C中描绘了GP1、GP2和GP3,其中这些图中的每一张图从左至右包括横向切割图像、冠状切割图像和矢状切割图像。在图46A、图46B和图46C中的图像是将根据以上参考图2-图3描述的方法和/或系统描述的图像与一个对应的CT图像组合的图像。所定位的GP位点的位置(用具有虚线图案的一个圆圈标记)被整合到用于消融指导的一个Carto系统中,例如如图47所示的。在以上实验中,我们响应于在这些GP位点处应用有限数目的HFS阶段而接收100%正面响应。此外,我们了解到在非GP位点处(所鉴别的GP位点外)应用相同的HFS,甚至应用多次,例如超过50次,实现了一个负向响应。在另一个实例中,基于参考图2-图3所述的方法和/或系统治疗患有持续性心房颤动(AF)的一位患者。图16-20根据本发明的一些实施例是在该方法的不同点的过程中生成的图像。在导管消融之后该患者经受123ImiBGD-SPECT成像。图16示出了在高频刺激(HFS)之前mIBG在左心房(LA)中的摄取。鉴别5个心外膜GP位置。图17示出在HFS之前图16的图像的饱和状态。图18示出了在消融程序之前正性HFS的位置。正性HFS证实了心外膜GP位置。图19示出了这些消融的位置。在与这些GP位置相对应的位置处进行消融。图20示出了对于在这些GP消融位点处重复的HFS的一个负向响应。负向响应表示这些GP已被治疗。心房颤动可以是受到控制和/或预防的。应注意,以上描述大部分集中于神经组织的定位;然而,以上方案、方法和系统可以用于定位一个或更多个内分泌器官和/或一个或更多个外分泌器官或其他信息。预期在从本申请到期的专利有效期间,将开发出许多相关方法和系统,并且术语消融单元、成像系统和方法、导管以及模态的范围旨在包括所有此类先验新技术。如在此所使用,术语“约”是指±10%。术语“包含(comprises)”、“包含(comprising)”、“包括(includes)”、“包括(including)”、“具有(having)”和它们的动词变化意指“包括但不限于”。这个术语涵盖术语“由…组成”和“基本上由…组成”。短语“基本上由…组成”意指组合物或方法可包括另外的成分和/或步骤,但条件是这些另外的成分和/或步骤不实质性地改变所要求保护的组合物或方法的基本特征和新颖特征。除非上下文另外清楚地指示,否则如在此所使用的单数形式“一个/种(a/an)”和“该”包括复数个指示物。例如,术语“一种化合物”或“至少一种化合物”可以包括多种化合物,包括其混合物。词语“示例性”在此用于意指“充当一个实例、例子或说明”。描述为“示例性”的任何实施例不一定被解释为是比其他实施例优选的或者有利的,和/或排除来自其他实施例的特征的并入。词语“任选地”在此用于意指“被提供在一些实施例中而未被提供在其他实施例中”。本发明的任何具体实施例可以包括多个“任选的”特征,除非此类特征冲突。贯穿本申请,本发明的不同实施例可以呈现为一个范围格式。应当理解,在范围格式内的描述仅为了方便和简明,并且不应当解释为是对本发明的范围的硬性限制。因此,一个范围的描述应当被认为是具有确切披露的所有可能的子范围以及该范围内的单独数值。例如,一个范围如从1至6的描述应当被认为是具有确切披露的子范围,如从1至3、从1至4、从1至5、从2至4、从2至6、从3至6等,以及该范围内的单独数字,例如1、2、3、4、5和6。无论范围的宽度为多少,此均适用。每当在此指示数值范围时,意味着包括所指示范围内的任何引用数字(分数或整数)。短语第一指示数字与第二指示数字“之间的变动范围/范围”以及第一指示数字“至”第二指示数字的“变动范围/范围”在此可互换使用,并且意指包括该第一指示数字和第二指示数字以及在此之间的所有分数和整数。应理解,出于清楚的目的描述于分开实施例的背景下的本发明的某些特征还可以按组合形式提供于单个实施例中。相反地,为简便起见,在单个实施例的背景下描述的本发明的不同特征也可以单独地或以任何适合的子组合或在适当情况下提供于本发明的任何其他描述实施例中。在不同实施例的背景下描述的某些特征不认为是那些实施例的必需特征,除非实施例在没有那些要素的情况下是无效的。尽管已结合本发明的特定实施例描述了本发明,但显而易见,本领域的技术人员应该清楚许多替代方案、修改以及变化。因此,意图涵盖落入所附权利要求书的精神和广泛范围内的所有此类替代方案、修改以及变化。本说明书中所提及的所有公开、专利以及专利申请在此通过全文引用结合到本说明书中,达到如同每一个单独的公开、专利或专利申请被专门地并且单独地指示通过引用结合在此的相同的程度。此外,本申请中对任何参考文件的引用或鉴别不应理解为承认该参考文件是作为本发明的现有技术可获得的。在使用章节标题的意义上,它们不应被解释为必要地限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1