吲哚基及吲哚啉基异羟肟酸于治疗神经退化病症或认知缺乏的用途的制作方法
本发明系关于吲哚基及吲哚啉基异羟肟酸的新颖用途。特定地,本发明系关于吲哚基及吲哚啉基异羟肟酸于制造用于治疗缺血性及出血性中风、脊髓损伤、脑神经损伤、周边神经损伤及神经退化病症或认知缺乏的药物或医药组合物中的用途。
背景技术:
神经退化病症(ND)为共有共同的病理生理学特征,即选择性神经元群体随时间推移发生进行性退化的一组相关人类疾病。此等神经退化疾病包括(但不限于)阿兹海默氏病(Alzheimer's disease)及相关痴呆、帕金森氏病(Parkinson's disease)、亨廷顿氏病(Huntington's disease)、路易体病(Lewy Body Disease)及相关运动障碍及弗里德利希共济失调(Friedrich's Ataxia)及相关脊髓小脑共济失调。由于老年人口的增加,吾人预期患有涉及诸如阿兹海默氏病的痴呆形式的神经退化病症的患者数目将增加。由于此等疾病随着年龄增长进展且影响患者及其生活环境,在初期发现治疗方法非常重要。阿兹海默氏病的特征性临床症状包括进行性认知恶化、参与日常活动的能力下降、神经精神症状及行为变化。含有称作β淀粉样蛋白的错误折迭的蛋白质斑在观测到阿兹海默氏病的临床症状之前多年形成于脑中。此等斑及神经原纤维缠结一起形成该疾病的病理性标志。此等特征仅可发现于尸体剖检时且帮助证实临床诊断。
亨廷顿氏病(HD)为常染色体显性神经退化病症,其症状系由脑基底神经节中的细胞损失造成。对细胞的此损害影响认知能力(思考、判断、记忆)、运动及情感控制。HD的特征为不可控、类舞蹈运动及人格变化。HD患者产生口齿不清、行走不稳及吞咽困难。对HD没有有效治疗。在长期疾病之后,患有HD的个体死于诸如窒息或感染的并发症。
帕金森氏病(PD)为特发性、缓慢进行性、退化性CNS病症,其特征为迟缓及减少的运动、肌僵直、静止性震颤及姿势不稳。尽管存在广泛研究,PD的起因仍为未知的。投射向尾核及壳核的黑质神经元的损失导致此等区域中的神经传递质多巴胺的耗乏。
成体CNS中的急性及/或慢性神经元损失由于成熟神经细胞增殖及补偿损失的神经元的极不佳能力而导致不可逆功能损失。因此,使神经元损失衰减或减少对保持功能至关重要。
因此,在相关技术中需要治疗神经退化病症的药剂或化合物。
技术实现要素:
本发明提供一种用于治疗个体的神经退化病症或认知缺乏的方法,其包含向个体投与治疗有效量的具有如下文中所提及的式(I)的化合物。因此,本发明提供一种式(I)化合物于制造用于治疗个体的神经退化病症或认知缺乏的药物中的用途。亦提供一种用于治疗个体的神经退化病症或认知缺乏的式(I)化合物。在另一态样中,本发明提供一种用于治疗个体的缺血性及出血性中风、脊髓损伤、脑神经损伤或周边神经损伤的方法,其包含向该个体投与治疗有效量的具有如下文中所提及的式(I)的化合物。因此,本发明提供一种式(I)化合物于制造用于治疗个体的缺血性及出血性中风、脊髓损伤、脑神经损伤或周边神经损伤的药物中的用途。
较佳化合物为3-(1-苯磺酰基-1H-吲哚-5-基)-N-羟基-丙烯酰胺。该化合物的量系藉由静脉内、肌肉内注射或经口摄入以每公斤个体体重约1至100毫克向个体投与。在一个实施例中,个体为人类且化合物的投与量为每公斤人类体重约1至约50毫克;较佳每公斤人类体重约1至约30毫克,较佳每公斤体重约1至约20毫克、每公斤体重约1至约10毫克、每公斤体重约2至约10毫克、每公斤体重约2至约8毫克或每公斤体重约2至约10毫克;更佳地,每公斤体重约3至约5毫克。
本发明化合物在治疗神经退化病症或认知缺乏,特定言之,亨廷顿氏病、帕金森氏病、痴呆及阿兹海默氏病中尤其有效。
附图说明
图1是根据本发明之一个实施例说明化合物1对增强记忆形成之影响。
图2是根据本发明之一个实施例说明化合物1对上调记忆相关蛋白质之影响。
图3是根据本发明之一个实施例说明化合物1对情境恐惧制约之影响,而经调节刺激-未经调节刺激(CS-US)配对表明Tg2576小鼠中之运动功能及认知。
图4是根据本发明之一个实施例说明用化合物1(每天50mg/kg,持续20天)经口处理对藉由Tg2576小鼠之海马区中年龄相关之变化衰减之突触可塑性蛋白质含量之表现之影响。
图5是根据本发明之一个实施例说明化合物1对运动功能之恢复之影响。
图6是根据本发明之一个实施例说明化合物1对脊髓损伤之后保留神经元损失之影响。
图7是根据本发明之一个实施例说明化合物1对脊髓损伤之后的抗细胞凋亡之影响。
图8是根据本发明之一个实施例说明化合物1对脊髓损伤之后的组蛋白3及4乙酰化、p21及磷酸基-ERK之表现之影响。
具体实施方式
本发明系基于吲哚基及吲哚啉基异羟肟酸在治疗神经退化病症或认知缺乏中有效的发现;因此,此等活性化合物为用作治疗神经退化病症或认知缺乏,较佳痴呆的治疗剂的潜在主导化合物。另外,本发明发现以上化合物在治疗脊髓损伤中有效。
除非另外说明,否则本申请案中所用的所有科学及技术术语均具有通常用于此项技术中的含义。如本申请案中所用,以下字语或词组具有指定含义。
如本文中所用,除非另外明确规定,否则「一(a)」或「一(an)」意谓至少一个。
术语「烷基」系指含有1-20个碳原子(例如C1-C10)的直链或分支链单价烃。烷基的实例包括(但不限于)甲基、乙基、正丙基、异丙基、正丁基、异丁基及第三丁基。术语「烯基」系指含有2-20个碳原子(例如C2-C10)及一或多个双键的直链或分支链单价烃。烯基的实例包括(但不限于)乙烯基、丙烯基、烯丙基及1,4-丁二烯基。术语「炔基」系指含有2-20个碳原子(例如C2-C10)及一或多个参键的直链或分支链单价烃。炔基的实例包括(但不限于)乙炔基、1-丙炔基、1-及2-丁炔基及1-甲基-2-丁炔基。术语「烷氧基」系指-O-烷基。烷氧基的实例包括(但不限于)甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、第二丁氧基及第三丁氧基。
术语「芳基」系指单价6-碳单环、10-碳单环、14-碳三环芳环系统。芳基的实例包括(但不限于)苯基、萘基及蒽基。术语「杂芳基」系指具有一或多个杂原子(诸如O、N、S或Se)的单价芳族5-8员单环、8-12员双环或11-14员三环环系统。杂芳基的实例包括(但不限于)吡啶基、呋喃基、咪唑基、苯并咪唑基、嘧啶基、噻吩基、喹啉基、吲哚基、四唑及噻唑基。
上文所提及的烷基、烯基、炔基、芳基及杂芳基包括经取代及未经取代部分。芳基及杂芳基上的可能的取代基包括(但不限于)C1-C10烷基、C2-C10烯基、C2-C10炔基。
术语「脊髓损伤(SCI)」中断神经脉冲的传导,导致神经功能障碍。脊髓的原发性损伤藉由释放各种有害因子而立即破坏细胞膜、破坏纵束中的髓鞘及轴突、损害微血管且因此触发破坏性继发性损伤过程。继发性损伤过程的多种细胞及分子机制经由复杂级联引起神经退化以将神经退化扩散至原发性损伤位点以外。继发性损伤级联为活性生物过程且因此为使用选择性抑制剂治疗SCI提供机会窗口。以SCI的活性继发性损伤介体为目标的适当治疗策略可保护神经元细胞,且加强轴突再生及重接。
词组「神经退化病症或认知缺乏」系指退化发生于神经系统的灰质或白质或二者中的疾病。
术语「痴呆」定义为藉由影响个人作用能力的心智能量的丧失表明的病症。痴呆病症一度被视为在年轻人群中为精神源性的且在老年人中为「老年」衍生化-衰老的结果。治疗此等病症中的任一者的希望极小。神经行为缺乏,尤其是认知功能受损通常为显著失能的起因。因此,在改良神经行为缺乏中有效的化合物为制造用于治疗痴呆的药物或组合物的潜在候选化合物。
如本文中所用,术语「个体」可指任何温血哺乳动物,包括(但不限于)人类、猪、大鼠、小鼠、狗、山羊、绵羊、马、猴、猿、兔、牛等。
如本文所用的术语「治疗(treatment)」包括预防性(例如防治性)、治愈性或缓解性治疗;且如本文所用的「治疗(treating)」亦包括预防性(例如防治性)、治愈性或缓解性治疗。
术语「有效量」在本说明书中用于意谓在其投与的情景内有效的本发明化合物的量或浓度,无论该情景产生使待治疗的病状或疾病病况缓解、反转或预防其进一步恶化的所需结果。本发明化合物的有效量包括有效增强及/或增加有需要的患者的认知及/或记忆的彼等量。
在一个态样中,本发明提供一种用于治疗个体的神经退化病症或认知缺乏的方法,其包含向个体投与治疗有效量的具有式(I)的化合物,
其中为单键或双键;B为R、C(O)R、CH2R、SO2R、SO3R或SO2NRR';C为R、C(O)R、CH2R、SO2R或CH=CHC(O)NHOH;各Xa、Xb、Xc及Xd独立地为R、卤素、硝基、亚硝基、OR或CH=CHC(O)NHOH;及各R及R'独立地为H、烷基、烯基、炔基、芳基或杂芳基。在一个实例中,各C、Xa、Xc及Xd独立地为H;B为SO2R;且Xb为CH=CHC(O)NHOH,
或其医药学上可接受的盐、异构体、前药或溶剂合物。
因此,本发明亦提供一种式(I)化合物于制造用于治疗个体的神经退化病症或认知缺乏的药物的用途。亦提供一种用于治疗个体的神经退化病症或认知缺乏的式(I)化合物。
在另一态样中,本发明提供一种用于治疗个体的缺血性及出血性中风、脊髓损伤、脑神经损伤或周边神经损伤的方法,其包含向该个体投与治疗有效量的具有式(I)的化合物。因此,本发明亦提供一种式(I)化合物于制造用于治疗个体的缺血性及出血性中风、脊髓损伤、脑神经损伤或周边神经损伤的药物的用途。亦提供一种用于治疗个体的缺血性及出血性中风、脊髓损伤、脑神经损伤或周边神经损伤的式(I)化合物。
在一些实施例中,B为SO2R;C为H;各Xa、Xb及Xc独立地为CH=CHC(O)NHOH;Xd为氢;且R为苯基或经F取代的苯基。
下文显示本发明的例示性化合物,化合物1-11。
本发明化合物,特定言之,式(I)化合物可根据Chen等人于2011年3月29日申请的美国专利申请案第13/074,312号中所描述的方法合成;此预先申请案的内容以引用的方式并入本文中。举例而言,本发明的化合物1,3-(1-苯磺酰基-1H-吲哚-5-基)-N-羟基-丙烯酰胺可根据Chen等人描述的流程2合成。
治疗神经元损伤(例如痴呆或脊髓损伤)的方法包括向有需要的个体投与有效量的如上文所示的式(I)化合物的步骤。在一较佳实施例中,该化合物为3-(1-苯磺酰基-1H-吲哚-5-基)-N-羟基-丙烯酰胺。
在一个实施例中,个体可为哺乳动物,较佳人类。
在一些实施例中,神经退化病症或认知缺乏包括(但不限于)中枢运动系统的疾病,包括影响基底神经节的退化性病状(亨廷顿氏病、威尔逊氏病(Wilson's disease)、纹状体黑质退化症、皮质基底节变性)、妥瑞氏症候群(Tourette's syndrome)、帕金森氏病、进行性核上麻痹、进行性延髓麻痹、家族性痉挛性截瘫、脊髓性肌肉萎缩症、ALS及其变型、齿状红核萎缩、橄榄体-脑桥小脑萎缩、副肿瘤性小脑变性及多巴胺毒性;影响感觉神经元的疾病,诸如弗雷德里希共济失调(Friedreich's ataxia)、糖尿病、周边神经病变及视网膜神经元变性;边缘及皮质系统的疾病,诸如脑淀粉样变性、皮克氏萎缩(Pick's atrophy)及雷特氏症候群(Retts syndrome);涉及多个神经元系统及/或脑干的神经退化病变,包括痴呆、阿兹海默氏病、帕金森氏病、AIDS相关性痴呆、莱氏症(Leigh's disease)、弥漫性路易体疾病(diffuse Lewy body disease)、癫痫症、多系统萎缩症、格林-巴利症候群(Guillain-Barre syndrome)、溶素体储积症(诸如脂褐质病)、唐氏症候群(Down's syndrome)的晚期退化阶段、阿尔珀氏病(Alper's disease)、由于CNS退化、ALS、皮质基底核退化症及进行性核上麻痹所致的头晕;与发育迟缓及学习障碍、唐氏症候群及氧化压力诱导性神经元死亡相关的病变;由衰老及长期酒精或药物滥用产生的病变,包括例如(i)由酒精中毒产生,蓝斑、小脑、胆碱激导性基底前脑中的神经元退化,(ii)由衰老产生,小脑神经元及皮层神经元的退化,导致认知及运动障碍,及(iii)由长期安非他明(amphetamine)滥用产生,基底神经节神经元的退化,导致运动障碍;由局部创伤产生的病理性变化,诸如中风、局部缺血、血管机能不全、缺氧缺血性脑病、高血糖症、低血糖症、闭合性头部创伤及直接创伤;作为治疗药物及治疗的负面副作用产生的病变(例如响应于麸胺酸受体的NMDA类别的拮抗剂的抗惊厥剂量的扣带及内嗅皮质神经元变性)。较佳地,神经退化病症或认知缺乏为痴呆、阿兹海默氏病、帕金森氏病、ALS或亨廷顿氏病。
因此,本发明亦提供治疗哺乳动物,较佳人类的痴呆或脊髓损伤的方法,其包含投与含有具有如上文所示的式的化合物的本发明的药物或该医药组合物。
在一些实施例中,向个体投与的式(I)化合物的有效量为藉由静脉内、肌肉内注射或经口摄入的每公斤个体体重约1至100毫克。该量系藉由静脉内、肌肉内注射或经口摄入以每公斤个体体重约2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90或100毫克向个体投与。在一个实施例中,个体为人类且化合物的投与量为每公斤人类体重约1至约50毫克;较佳每公斤人类体重约1至约30毫克,较佳每公斤体重约1至约20毫克、每公斤体重约1至约10毫克、每公斤体重约2至约10毫克、每公斤体重约2至约8毫克或每公斤体重约2至约10毫克;更佳每公斤体重约3至约5毫克。该剂量可以单一等分试样或者一个以上的等分试样投与。
在一些实施例中,该方法进一步包括在投与本发明化合物的前、与其一起及/或在其的后投与已知改良神经元损伤的症状的药剂的步骤。该药剂的实例包括(但不限于)此项技术中已知的活性氧清除剂(ROS)、抗凝血剂、神经元增强剂、神经元保护剂及其类似物。活性氧清除剂的实例包括(但不限于)过氧化氢酶、超氧化歧化酶(SOD)、α-苯基-N-第三丁基硝酮(PBN)、维生素E、维生素C、多酚化合物、类胡萝卜素及其类似物。抗凝血剂的实例包括(但不限于)维生素K、华法林(warfarin)、醋硝香豆醇、肝素、阿司匹灵(aspirin)、克罗匹多(clopidogrel)、双嘧达莫(dipyridamole)及其类似物。
本发明亦提供一种用于治疗神经元损伤的医药组合物;该组合物包含治疗有效量的具有如上文所示的式(I)的化合物;及治疗学上可接受的赋形剂。
一般而言,具有本发明的式(I)的化合物系以按医药组合物的总重量计约0.1重量%至99重量%的含量存在。在一些实施例中,具有本发明的式(I)的化合物系以按医药组合物的总重量计至少1重量%的含量存在。在某些实施例中,具有式(I)的化合物系以按医药组合物的总重量计至少5重量%的含量存在。在其他实施例中,具有式(I)的化合物系以按医药组合物的总重量计至少10重量%的含量存在。在其他实施例中,具有式(I)的化合物系以按医药组合物的总重量计至少25重量%的含量存在。
在一些实施例中,本发明的该医药组合物的药物进一步包括已知改良痴呆或脊髓损伤的症状的药剂。该药剂的实例包括(但不限于)此项技术中已知的活性氧清除剂(ROS)、抗凝血剂、神经元增强剂、神经元保护剂及其类似物。活性氧清除剂的实例包括(但不限于)过氧化氢酶、超氧化歧化酶(SOD)、α-苯基-N-第三丁基硝酮(PBN)、维生素E、维生素C、多酚化合物、类胡萝卜素及其类似物。抗凝血剂的实例包括(但不限于)维生素K、华法林(warfarin)、醋硝香豆醇、肝素、阿司匹灵(aspirin)、克罗匹多(clopidogrel)、双嘧达莫(dipyridamole)及其类似物。
该药物或该医药组合物系根据可接受的医药程序制备,诸如雷明顿医药科学(Remington's Pharmaceutical Sciences),第17版,Alfonoso R.Gennaro编,Mack Publishing Company,Easton,Pa(1985)中所述。医药学上可接受的赋形剂为与调配物中的其他成分可兼容且生物学上可接受的彼等赋形剂。
本发明化合物(例如具有如上文所示的式(I)的化合物可单独或与习知的医药学上可接受的赋形剂组合经口、非经肠、经皮、经直肠或藉由吸入投与。在较佳实施例中,本发明化合物系经口或非经肠向个体投与。
本发明化合物可调配为可藉由例如静脉内、肌肉内、皮下、腹膜内注射或经口摄入投与的液体医药组合物,其为无菌溶液或悬浮液。用于制造无菌可注射溶液或悬浮液的适合的稀释剂或溶剂包括(但不限于)1,3-丁二醇、甘露糖醇、水、林格氏溶液(Ringer's solution)及等张氯化钠溶液。脂肪酸,诸如油酸及其甘油酯衍生物亦适用于制备可注射剂,天然的医药学上可接受的油,诸如橄榄油或蓖麻油亦如此。此等油溶液或悬浮液亦可含有醇稀释剂或羧甲基纤维素或类似分散剂。通常用于制造医药学上可接受的剂型的其他常用界面活性剂,诸如Tweens或Spans或其他类似乳化剂或生物可用性增强剂亦可用于调配目的。经口投与可为液体或固体组合物形式。
本发明的药物或该等医药组合物可调配为多种剂型以用于局部施用。可采用此项技术熟知的多种皮肤病学上可接受的惰性赋形剂。表面组合物可包括液体、乳膏、洗剂、软膏、凝胶、喷雾剂、气溶胶、皮肤贴片及其类似物。典型的惰性赋形剂可为例如水、乙醇、聚乙烯吡咯啶酮、丙二醇、矿物油、硬脂醇及产生凝胶的物质。所有以上剂型及赋形剂已为医药技术所熟知。剂型的选择对于本文中所描述的组合物的功效并非至关重要。
本发明的药物或该等医药组合物亦可以调配成用于黏膜施用的多种剂型,诸如经由口腔黏膜进行药物递送的颊及/或舌下药物剂量单位。可使用多种生物可降解聚合赋形剂,其为医药学上可接受的,提供适合程度的黏附及所需药物释放型态,且与欲投与的活性剂及可能存在于颊及/或舌下药物剂量单位中的任何其他组分兼容。一般而言,聚合赋形剂包含黏附至口腔黏膜的湿表面的亲水性聚合物。聚合赋形剂的实例包括(但不限于)丙烯酸聚合物及共聚物;水解聚乙烯醇;聚氧化乙烯;聚丙烯酸酯;乙烯基聚合物及共聚物;聚乙烯吡咯啶酮;聚葡萄糖;瓜尔胶;果胶;淀粉;及纤维素聚合物。
该药物或组合物系藉由可有效地将组合物的活性成分输送至适当或所需作用位点的任何途径投与哺乳动物,较佳人类,诸如经口、经鼻、经肺,经皮,诸如被动或离子导入递送,或非经肠,例如经直肠、储槽(depot)、皮下、静脉内、肌肉内、鼻内、脑内、眼用溶液或软膏。另外,投与本发明化合物与其他活性成分可为并行或同时。
应了解,本发明化合物的剂量将在患者与患者间变化,其不仅由于所选择的特定化合物或组合物、投与途径及化合物(单独或与一或多种药物组合)在患者中引发所需反应的能力,且亦由于诸如以下的因素:欲缓解病状的疾病病况或严重程度,患者年龄、性别、体重,患者的状态及所治疗病理病状的严重程度,患者随后遵循的并行药物或特殊饮食,及熟习此项技术者将识别的其他因素,其中适当剂量最终由主治医师裁量。可调节剂量方案以提供改良的治疗反应。治疗有效量亦为化合物或组合物的治疗有益效应超过任何毒性或有害效应的量。较佳地,本发明的化合物或组合物系以使得症状的数目及/或严重程度减小的剂量投与一段时间。
现将参考以下实施例更特定地描述本发明,该等实施例系出于论证而非限制的目的提供。
实例
实例1化合物1为罹患痴呆的个体提供神经元保护活性
Tg2576转殖基因小鼠携有编码来源于一个患有早发型阿兹海默氏病(AD)的瑞典大家庭的人类APP的695个胺基酸的同功异构物的转殖基因。此等小鼠表现高浓度的突变Aβ,产生大量淀粉状蛋白斑且呈现记忆缺乏。为证实本发明化合物是否具有任何神经元保护效应,用测试化合物(例如化合物1)或媒剂处理Tg2576转殖基因小鼠,且藉由情境恐惧制约(Contextual Fear Conditioning)及西方墨点法分别量测测试化合物对脑功能缺乏及神经可塑性的影响。
1.1制备痴呆动物模型
Tg2576转殖基因小鼠携有编码来源于一个患有早发型阿兹海默氏病(AD)的瑞典大家庭的人类APP的695个胺基酸的同功异构物的转殖基因。此等小鼠表现高浓度的突变Aβ,产生大量淀粉状蛋白斑且呈现记忆缺乏。Tg2576小鼠系购自The Jackson laboratory(Maine,US)。6-8周龄C57BL/6J小鼠系购自BioLASCO Taiwan Co.,Ltd,用于剂量依赖性效应研究。将该等动物在12小时-12小时光-暗循环(早上6:00开灯)下以每笼5只圈养于温度(21±1℃)及湿度(70±5%)受控房间内。动物在实验期间可自由取用食物及水。在该循环的光照阶段进行行为测试。所有动物实验均系根据由台北医学大学机构性动物保健及利用委员会(Institutional Animal Care and Utilization Committee of the Taipei Medical University)(Taipei,Taiwan,R.O.C.)确立的指导原则进行。
1.2制备及投与药物
将化合物1以15mg/ml的浓度溶解于5%乙醇、35%聚乙二醇及60%生理食盐水中。在情境恐惧制约训练的前用化合物1(50、100、200mg/kg,腹膜内)或媒剂处理C57BL/6J小鼠一次。随后,在5月龄及11月龄时用化合物1(每天50mg/kg,持续20天)经口或媒剂处理Tg2576转殖基因小鼠。
1.3情境恐惧制约
将所有小鼠在训练的前2小时运送至实验室以消除不必要的压力。Tru Scan Photo Beam Tracking系统(Coulbourn Instruments,New York,US)用于此研究。在行为训练中,将小鼠置放于腔室中且在2分钟的后以2分钟时间间隔接受与未经调节刺激(US;0.7mA轻度足底电击,2秒)配对的两个经调节刺激(CS;80dB听觉声音,30秒)。24小时后,随后测试僵立行为以量测同样置放于训练腔室中的音调-电击相关记忆的强度。在测试日,小鼠在3分钟期间单独暴露于环境,且继之以3分钟CS呈现。藉由其系统软件(TruScan 2.02)记录及计算数据。
1.3样品制备、蛋白质提取及西方墨点法
用水合氯醛(400mg/kg)使动物深度麻醉且对其灌注生理食盐水及4%多聚甲醛。收集海马区且溶解于溶解缓冲液(Lysis-M试剂,Roche)中。溶胞物于冰上培育5分钟且在14,000r.p.m.及4℃下离心20分钟。收集上清液作为胞溶质蛋白提取物。使用Bradford蛋白质分析套组(Pierce)量测蛋白质浓度且标准化。在标准化的后,使30μg蛋白质经受西方墨点法。藉由增强化学发光(Millipore)检查免疫反应性。
1.4结果
图1描绘化合物1对增强具有剂量依赖显著性的正常C57BL/6J小鼠的记忆形成的影响。在24小时情境恐惧制约训练的后进行的僵立行为测试表示音调-电击配对记忆的强度显著增加(*p<0.05,**p<0.01;分别地,n=8、9、8及8)。自图1显而易见,本发明的化合物1即使在正常小鼠中亦对僵立行为测试有效。
图2描绘化合物1对腹膜内注射100mg/kg化合物1的后24小时上调记忆相关蛋白质的影响。A,来自海马提取的样品显示化合物1处理的小鼠中的蛋白质含量变化。B,定量数据表示媒剂与化合物1处理的间的显著差异(*p<0.05,**p<0.01,#p<0.001)。
图3描绘化合物1对情境恐惧制约的影响,而CS-US配对表明Tg2576小鼠中的运动功能及认知。Tg2576小鼠(分别地,n=7、7、6、5、3及5)的音调-电击配对记忆藉由用化合物1经口处理(每天50mg/kg,持续20天)增强(6月龄相对于6月龄-经化合物1处理,*p=0.0264)且藉由年龄相关健忘症受到阻滞(3月龄相对于6月龄,*p=0.0152;3月龄相对于12月龄,***p=0.0005;6月龄相对于6月龄-经化合物1处理,#p=0.0264;12月龄相对于12月龄-经化合物1处理,##p=0.0028)。
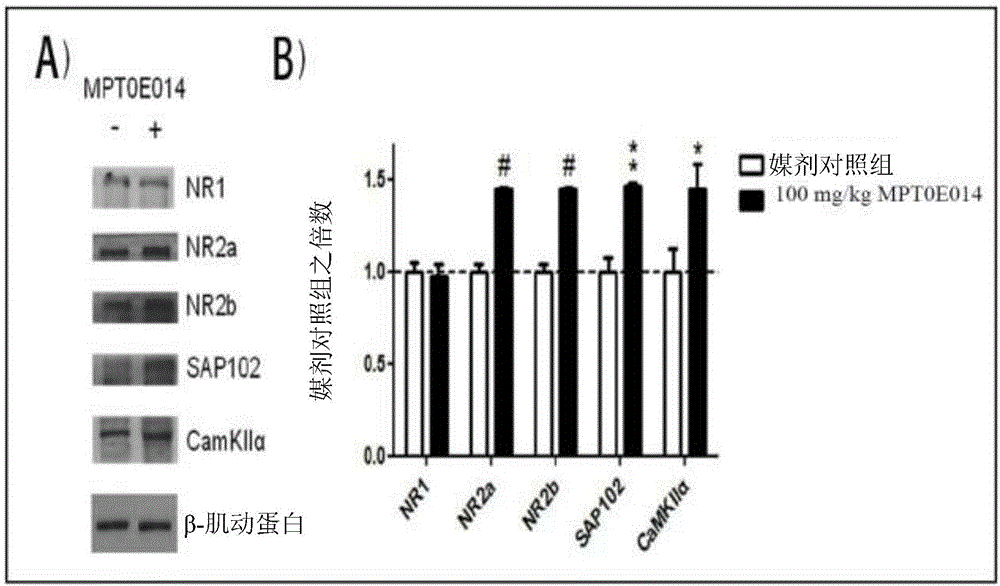
图4描绘用化合物1(每天50mg/kg,持续20天)经口处理对藉由Tg2576小鼠的海马区中年龄相关的变化衰减的突触可塑性蛋白质含量的表现的影响。A,NMDA受体的次单位,NR2a及NR2b蛋白表现随年龄降低(左侧:与3月龄小鼠比较,*p=0.0226;右侧:*p=0.0477;**p=0.0012)且在化合物1经口管饲的后升高(左侧:#p=0.0231;右侧:#p=0.0492),以及B,pERK,转录及转译标记物抗细胞凋亡标记物的活性形式(比较对照组3M与对照组6M,*p=0.0165;及对照组12M,*p=0.0486;#p=0.0428),C,p21,抗细胞凋亡标记物(*p=0.0175;#p=0.0145),及D,乙酰基-组蛋白H4(比较对照组3M与对照组6M,***p=0.0007;及对照组12M,***p=0.0002;###p=0.0008)。
实例2化合物1为患有脊髓损伤的个体提供神经元保护活性
在此实例中,使用脊髓损伤动物模型验证本发明化合物的影响。与实例1中所述的程序类似,动物经人工诱导以产生脊髓损伤,接着用测试化合物1或媒剂处理,且分别藉由Basso、Beattie及Bresnahan(BBB)运动评定量表、免疫组织化学(IHC)染色及西方墨点分析量测测试化合物对行为评分、神经保护及抗细胞凋亡的影响。
2.1制备脊髓损伤动物模型
称重280-330g的雄性史泊格多利大鼠(Sprague-Dawley rat)(Academia Sinica,Taiwan)在其到达的后保持每笼两只,持续至少五天。大鼠可随意取用食物及水且圈养于具有12:12小时暗-光循环的房间内。此研究系根据由实验动物实验室(Experimental Animal Laboratory)提供的指导原则进行且经台北医学大学动物保健及使用委员会批准。
藉由使用NYU(New York University)撞击器装置产生脊髓损伤。在使用Zoletil50(40mg/kg,腹膜内)的深度麻醉下进行脊髓挫伤。在对T9进行背侧椎板切除术的后,脊髓区段T9暴露。随后,藉由自50mm的高度掉落10公克棒产生脊髓损伤的手术。挫伤损伤导致后肢运动缺乏。
运动行为测试
藉由对处理盲目的观测者进行行为测试及分析。使用Basso、Beattie及Bresnahan(BBB)运动评定量表观测及记录运动功能。在损伤后第1、3及7天,使用旷场BBB评分运动测试评估后肢运动功能。
2.3制备及投与药物
将化合物1以15mg/ml的浓度溶解于5%乙醇、35%聚乙二醇及60%生理食盐水中。所有测试动物在脊髓损伤的后的第1-7天接受化合物1(每天30mg/Kg,持续7天)或媒剂(5%乙醇、35%聚乙二醇及60%生理食盐水)的静脉内注射。
组织学、免疫组织化学及细胞计数
在半切术脊髓损伤的后的第7天,动物藉由异氟醚深度麻醉且经由左心室灌注磷酸盐缓冲生理食盐水(PBS),接着为0.15M磷酸钠缓冲液(pH 7.4)中的冷4%多聚甲醛。立即移出脊髓,在相同固定剂中在4℃下后固定8小时,且在15%及30%蔗糖中防冷冻持续2-3天。脊髓冷冻于粉末状干冰中且储存于-80℃下直至需要时。藉由冷冻及滑动薄片切片机在脊髓半切术的中心处切割5微米切片。制备切片以用于免疫染色或细胞凋亡染色。对于免疫组织化学,在PBS中洗涤切片且在PBS中的3%正常山羊血清与0.3%Triton X-100中培育1小时。切片藉由抗NeuN(神经元-细胞核特异性蛋白质)(Chemicon,Temecula,CA)在4℃下自由浮动地培育。使用Vectastain Elite ABC过氧化酶法(Vector Laboratories,Burlingame,CA)且使用二胺基联苯胺(DAB)作为色素原观测免疫反应性。此外,使用细胞凋亡侦测套组(Oncogene Research Products,Cambridge,MA)藉由末端脱氧核苷酸转移酶介导的脱氧尿苷三磷酸切口端(TUNEL)侦测脊髓损伤的后的细胞凋亡。根据制造商的说明书进行TUNEL染色。藉由省略Klenow酶产生TUNEL染色的阴性对照组,而其他免疫组织化学研究的阴性对照切片系在无初级抗体的情况下如上培育。在藉由以上抗体染色的脊髓半切术的中心处的每一第六切片上以×400的放大倍率进行细胞计数。仅计数具有明显可见染色的细胞。所有数据呈现为5个连续细胞定量的平均值±SEM。
结果
图5藉由BBB评分描绘化合物1对运动功能的恢复的影响。在静脉内注射化合物1(每天30mg/Kg,持续7天)的后,经处理大鼠相比于媒剂组在脊髓损伤后7天具有BBB评分的显著恢复。(各组中p=0.0147,n=6)。
图6描绘化合物1对在脊髓损伤的后保留神经元损失的影响。NeuN,神经元特异性标记物的免疫组织化学揭示媒剂组中的严重神经元损失,而在化合物1处理组(每天30mg/Kg,持续7天)中显著保留。(神经元细胞百分比中p<0.0001,且神经元细胞数目中p=0.0151,各组中n=3,400×)。
图7描绘化合物1对脊髓损伤的后的抗细胞凋亡的影响。TUNEL染色显示媒剂组中的凋亡细胞显著增加,而化合物1处理组(每天30mg/Kg,持续7天)中显著减少。(凋亡细胞百分比中p=0.0098,且凋亡细胞数目中p=0.0015,各组中n=3,400×)。
图8描绘化合物1(30mg/kg,100mg/kg,静脉内注射)对脊髓损伤的后的组蛋白3及4乙酰化、p21及磷酸基-ERK的表现的影响。相比于媒剂对照组,在100mg/kg的剂量下注意到组蛋白3及4乙酰化、p21及磷酸基-ERK的表现的显著增加。(ac-H3p=0.0451,ac-H4p=0.0023,p21p=0.0043,p-ERK p=0.0311,各组中n=5)。
- 还没有人留言评论。精彩留言会获得点赞!