茴香霉素在制备预防/治疗卵巢癌药物中的应用的制作方法
本发明涉及药物,具体涉及茴香霉素在制备预防/治疗卵巢癌药物中的应用。
背景技术:
目前,已发现人卵巢癌干细胞是导致卵巢癌细胞对化疗药物耐受以及产生卵巢癌易于转移、复发和预后不佳的主要原因。然而OCSCs(卵巢癌干细胞)增值侵蚀的深层机制尚不清楚,也没有有效的医疗手段进行抑制。Fan等人报道了microRNA-20a的过表达可以通过抑制淀粉样前体蛋白的表达促进卵巢癌细胞的增殖侵袭(Fan X,Liu Y,Jiang J,Ma Z,Wu H,Liu T,Liu M,Li X and Tang H.miR-20a promotes proliferation and invASion by targeting APP in human ovarian cancer cells.Acta Biochim Biophys Sin(Shanghai)2010;42:318-324.)。因此,认为淀粉样前体蛋白是microRNA-20a的直接靶向基因。β淀粉样蛋白斑块(Aβ斑块)是阿尔茨海默病的主要组织病理学标志。β分泌酶,即β位点的淀粉样前体蛋白裂解酶1(BACE1),是一种通过裂解淀粉样前体蛋白胞外域启动Aβ产生的酶。抑制BACE1(β位点的淀粉样前体蛋白裂解酶1)表达可显著提高大脑内Aβ浓度。Liu和Faghih等证明AS相关BACE1长链非编码 RNA可调控BACE1 mRNA并通过增加BACE1 mRNA稳定性促进Aβ1-42的产生(Guo X,Wu X,Ren L,Liu G and Li L.Epigenetic mechanisms of amyloid-beta production in anisomycin-treated SH-SY5Y cells.Neuroscience 2011;194:272-281;Faghihi MA,Modarresi F,Khalil AM,Wood DE,Sahagan BG,Morgan TE,Finch CE,St Laurent G,3rd,Kenny PJ and Wahlestedt C.Expression of a noncoding RNA is elevated in Alzheimer's diseASe and drives rapid feed-forward regulation of beta-secretASe.Nat Med 2008;14:723-730.)。尽管如此,APP(淀粉样蛋白前体)在阿尔茨海默病中的功能作用仍需进一步研究,其调节人OCSCs的作用和机制尚未报道。以前的研究主要关注的是Aβ对神经元的毒性和副作用的影响,而很少有研究讨论Aβ对肿瘤细胞增殖、侵袭和肿瘤形成的影响。
总之,茴香霉素通过促进lncRNA BACE1-AS的表达,增加BACE1mRNA稳定,增强其对APP加工活性,提高Aβ1-42的浓度及其对肿瘤细胞的毒性,是抑制人OCSCs增殖和侵袭的一种新型的潜在目标。
茴香霉素,结构式如下:
化学名:2(对甲氧基苄基)-3,4-pyrrolidinediol-3-acetate,是经过确认的第一种原生动物抗生素,从浅灰链霉菌提取得到。它对 真核生物和某些原生动物有毒性作用。茴香霉素可通过结合60S核糖体亚基抑制多数细胞中肽键的形成,从而抑制蛋白质的合成。以往的研究表明,茴香霉素不仅可以促进Aβ生产,还能抑制某些癌细胞的增殖。郭等人报道了茴香霉素干预后,SH-SY5Y细胞甲基转移酶水平下降,三个基因启动子脱甲基化,进而导致APP、PS1 BACE1的表达上调。(Guo X,Wu X,Ren L,Liu G and Li L.Epigenetic mechanisms of amyloid-beta production in anisomycin-treated SH-SY5Y cells.Neuroscience 2011;194:272-281.)同时,茴香霉素能够通过上调组蛋白乙酰转移酶p300/CREB结合蛋白和下调组蛋白去乙酰化酶表达水平,提高蛋白H3总乙酰化程度。此外,Yu等人发现,茴香霉素通过刺激p53、p21和p27信号表达,阻断细胞进入S期和G2/M期,抑制Jurkat T细胞增殖(Yu C,Xing F,Tang Z,Bronner C,Lu X,Di J,Zeng S and Liu J.Anisomycin suppresses Jurkat T cell growth by the cell cycle-regulating proteins.Pharmacol Rep2013;65:435-444.)。SEO等人研究报道了茴香霉素可以通过下调Bcl-2、c-FLIP(L)和Mcl-1,从而诱导肾脏肿瘤细胞凋亡。(Seo BR,Min KJ,Kim S,Park JW,Park WK,Lee TJ and Kwon TK.Anisomycin treatment enhances TRAIL-mediated apoptosis in renal carcinoma cells through the down-regulation of Bcl-2,c-FLIP(L)and Mcl-1.Biochimie 2012;95:858-865.)同时,Liu等人也证明了茴香霉素通过刺激丝裂原活化蛋白激酶p38磷酸化和Jun氨基末端激酶的活化诱导对糖皮质激素耐受的急性淋巴细胞白血病细胞凋亡(Liu Y,Ge J, Li Q,Gu L,Guo X,Ma ZG and Zhu YP.Anisomycin induces apoptosis of glucocorticoid resistant acute lymphoblAStic leukemia CEM-C1 cells via activation of mitogen-activated protein kinASes p38 and JNK.NeoplASma 2012;60:101-110.)。此外,Li等人揭示了,茴香霉素在体外可通过下调PP2A催化亚基诱导胶质瘤细胞死亡。(Li JY,Huang JY,Li M,Zhang H,Xing B,Chen G,Wei D,Gu PY and Hu WX.Anisomycin induces glioma cell death via down-regulation of PP2A catalytic subunit in vitro.Acta Pharmacol Sin 2012;33:935-940.)由此,进一步探讨茴香霉素是否可以通过刺激lncRNA BACE1-AS表达和上调Aβ浓度从而抑制人OCSCs增殖和侵袭,以此寻找其新的医药用途。
技术实现要素:
本发明所要解决的技术问题在于进一步研究设计茴香霉素对OCSCs的影响机制,证实其对癌细胞的作用,开发新的抗癌药物。
本发明提供了茴香霉素在制备预防/治疗卵巢癌药物中的应用。
本发明人使用一种具有抑制多种肿瘤细胞的小分子化合物茴香霉素,来治疗人OCSCs。发现茴香霉素严重影响OCSCs增殖、侵袭和肿瘤形成。有趣的是,在经茴香霉素处理后,OCSCs的内源性Aβ1-42的浓度以及BACE1表达显著升高,鉴于Aβ对细胞的毒副作用,本发明认为在经茴香霉素处理后,Aβ1-42诱导OCSCs凋亡。然而,Aβ1-42只是一种产物,不应是茴香霉素的直接目标。本发明人采用了 siRNA靶向lncRNA BACE1-AS。实验结果表明,在茴香霉素处理72h后,siRNA-BACE1-AS转染OCSCs组的成活率比siRNA-Mock转染OCSCs组及未转染组显著升高。因此,siRNA靶向沉默lncRNA BACE1-AS的表达可以削弱茴香霉素对OCSCs的影响,lncRNA BACE1-AS是茴香霉素新的潜在靶点。茴香霉素通过维持BACE1 mRNA的稳定性,增强其对APP加工活性,提高Aβ1-42的浓度及其对肿瘤细胞的毒性,是抑制人OCSCs增殖和侵袭的一种新型的潜在目标。
本发明人通过茴香霉素对OCSCs的影响试验,说明茴香霉素明显抑制OCSCs增殖和侵袭。进行了茴香霉素刺激OCSCs凋亡相关蛋白lncRNA BACE1-AS的表达试验,数据表明,茴香霉素可以诱导lncRNA BACE1-AS及Aβ1-42相关蛋白的高表达。对茴香霉素或DMSO预处理人OCSCs在小鼠体内致瘤性及肿瘤生长情况比较试验,表明用茴香霉素预处理组形成的移植瘤比DMSO处理组要小,并且增殖和侵袭减少。通过对茴香霉素靶向lncRNA BACE1-AS表达的调节评价,siRNA对BACE1-AS的靶向调节得到体现。OCSCs分别转染了siRNA-BACE1-AS或siRNA-Mock后,用茴香霉素(IC50)处理72h。然后MTT法检测表明,siRNA-BACE1-AS转染OCSCs的茴香霉素处理组存活率明显高于siRNA-Mock组或未转染OCSCs的茴香霉素治疗组。因而,茴香霉素可用于制备预防/治疗卵巢癌药物。
本发明所述制备预防/治疗卵巢癌的药物为由茴香霉素作为活性成分与药用辅料组成的药物组合物。
本发明所述药物组合物为口服制剂或注射剂。
本发明为预防/治疗卵巢癌提供了新的药物,有很好的临床应用前景,具有较大的社会效益。
附图说明
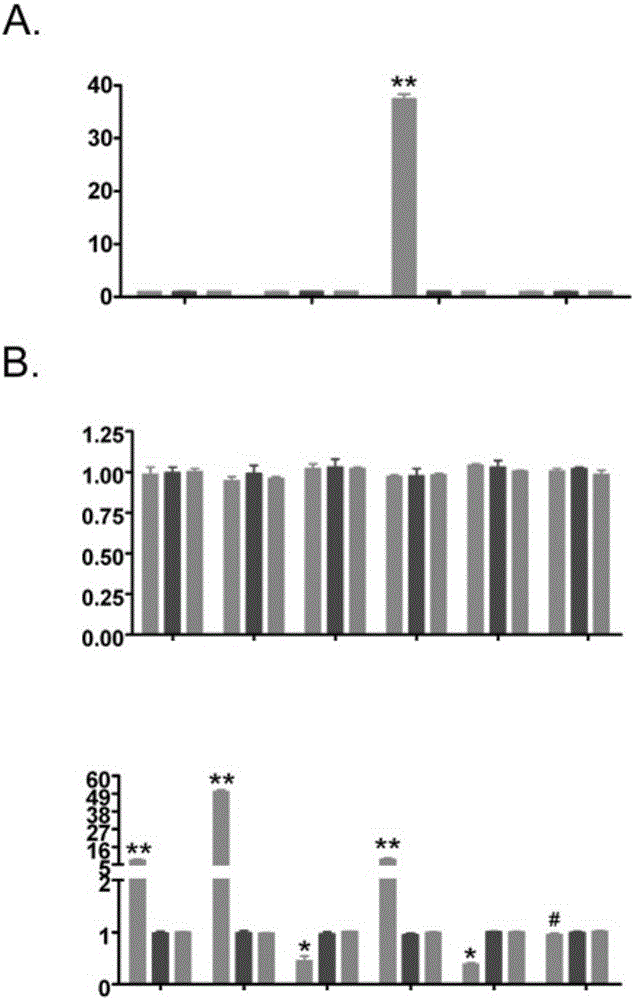
图1茴香霉素抑制人OCSCs增殖和侵袭。MTT检测提示随着茴香霉素处理(IC50浓度)时间的增加,OCSCs增殖抑制率显著增加;**P<0.01VS未处理组;*P<0.05与未处理组;P#>0.05与未处理组;n=3。(b)流式细胞仪检测显示茴香霉素处理组OCSCs细胞比DMSO处理组或未处理组存在显著较高的早起凋亡。(C)Transwell细胞迁移实验表明茴香霉素处理后的OCSCs比DMSO处理组OCSCs细胞或未处理OCSCs组细胞的侵袭性显著下降;*P<0.05vs未处理组;#P>0.05未处理组;n=3。(d)软琼脂克隆形成实验表明,茴香霉素处理OCSCs后,其克隆形成的密度比DMSO处理或未处理组要显著的低;*P<0.05vs未处理组;#P>0.05vs未处理组;n=3。
图2茴香霉素诱导OCSCs中lncRNA BACE1-AS和凋亡相关基因的表达。(A)qRT-PCR检测显示,处理在72h后,茴香霉素处理组lncRNA BACE1-AS的表达水平明显高于二甲基亚砜(DMSO)组或未处理组;基于18S rRNA的mRNA表达水平进行校准;**P<0.01VS未处理组;n=3。(B)qRT-PCR结果显示,茴香霉素处理OCSCs 72小时后,BACE1,APP,BCl-2和Bax mRNA的表达水平显著高于二甲基亚砜(DMSO)处理组或未处理组细胞;但是,Ki67 mRNA的表达却是显著降低的;基于18SrRNA的mRNA表达水平进行校准;**P<0.01 VS未处理组;*P<0.05vs未处理组;#P>0.05vs未处理组;n=3。
图3茴香霉素诱导OCSCs的lncRNA BACE1-AS和凋亡蛋白表达。(A)和(B)免疫印迹杂交法证实,茴香霉素处理组OCSCs内BACE1和Aβ1-42的表达显著增加;但是,Ki67蛋白表达显著降低;GAPDH为内参;**P<0.01vs未治疗组;P#>0.05vs未处理组;n=3。(c)免疫荧光染色结果显示,茴香霉素处理组OCSCs内BACE1和Aβ1-42的表达显著增加。
图4 OCSCs茴香霉素抑制移植瘤的生长。(A)荷瘤鼠表型,蓝色圆圈内为OCSCs形成的肿瘤。(b)肿瘤大小;*P<0.01vs DMSO组;n=7。(C)肿瘤重量;*P<0.01vs DMSO组;n=7。(D)肿瘤切片行苏木精-伊红染色病理学检测结果提示,所有皮下移植瘤均为中度或低分化(Ⅱ、Ⅲ级)的混合上皮性卵巢癌;免疫组织化学染色表明,茴香霉素预处理OCSCs瘤体中,BACE1和Aβ1-42蛋白表达均明显低于DMSO预处理组;但是,Ki67蛋白的表达显著降低;原始放大:×200。
图5 siRNA靶向沉默lncRNA BACE1-AS的表达可以削弱茴香霉素对OCSCs抑制能力。(A)MTT法检测表明,siRNA-BACE1-AS转染OCSCs组茴香霉素处理后,其细胞增殖抑制率比siRNA-Mock转染OCSCs组或未转染组72h后显著降低;*P<0.05vs未转染组;#P>0.05vs vs未转染组;n=3。(B)Western blot结果显示,siRNA-BACE1-AS转染OCSCs组茴香霉素处理后,其细胞BACE1蛋白的表达比 siRNA-Mock转染OCSCs组或未转染组72h后显著降低;*P<0.05vs未转染组;#P>0.05vs未转染组;n=3。(C)Northern blot显示,lncRNA BACE1-AS杂交信号在茴香霉素处理OCSCs 72h后明显强于二甲基亚砜(DMSO)处理组或未处理组;但是,siRNA-BACE1-AS转染OCSCs组茴香霉素处理后,其lncRNA BACE1-AS杂交信号比siRNA-Mock转染OCSCs组或未转染组72h后显著降低;*P<0.05vs未转染组;#P>0.05vs未转染组;n=3。
具体实施方式
以下实施例使用的原料和试剂通过市售得到。
茴香霉素(Anisomycin,纯度≥98%,HPLC级别),粉剂,购自美国Sigma试剂公司(A9789,Sigma-Aldrich,St.Louis,USA)。
以下实施例涉及的卵巢癌病人组织样本及病例来自于上海市浦东新区公利医院。(2014年2月-2015年4月)
实施例1 卵巢癌患者肿瘤干细胞的分离
未分化的混合性上皮性卵巢癌7例卵巢癌患者。所有卵巢癌患者人群的年龄,阶段,分化程度以及组织学分布情况见表1。
卵巢癌患者肿瘤干细胞的分离(7个卵巢癌病人行手术切除卵巢癌组织,本实验将手术切下的组织收集在无菌离心管中,用0.25%胰酶消化成单细胞悬液,每100μL卵巢癌细胞悬液加入4μL的CD44和CD117单克隆抗体(小鼠抗人CD117-FITC;兔抗人CD44-PE,eBioscience公司),细胞于4℃条件下孵育30分钟,反应结束后, 用磷酸盐缓冲盐水(PBS)清洗1次,然后用流式细胞仪(BD FACS Aria,BD Bioscience,CA,USA)分离CD44+/CD117+的OCSCs细胞亚群)
表1 卵巢癌病人特征
实施例2 茴香霉素明显抑制OCSCs增殖和侵袭
MTT法(噻唑兰法)检测细胞增殖
细胞接种于(2×103/ml)96孔板并在37℃、5%CO2条件下用含有10%FBS(胎牛血清)的DMEM(改良型高糖细胞培养基)培养液培养,直到85%的细胞融合。MTT(3(V/V)-二苯基溴化物;Sigma出品)试剂(5mg/ml)被在不同时间点被添加到细胞培养基中,在37℃条件下孵育4小时。每孔加入150μL的二甲基亚砜(DMSO,Sigma Chemicals)终止反应。细胞裂解15min,96孔板轻轻摇动5分钟。采用酶联免疫吸附法(ELISA)测定吸光度值,在490nm测定(model680,Bio-Rad博乐生物公司)。
Annexin V-FITC/PI(细胞膜磷酯酰丝氨酸-异硫氰酸荧光素/碘 化丙啶)染色和流式细胞仪分析
细胞接种(3×103/ml)于6孔板,并培养至85%融合。细胞用PBS洗涤三次,1000转5min离心收集(Allegra X-22R,Beckman Coulter(贝克曼库尔特公司))。细胞悬浮在0.1ml PBS(磷酸缓冲液),并用的Annexin V-FITC/PI试剂盒进行染色。4℃孵育30分钟后,使用流式细胞仪(FACS)(BD Biosciences公司)分析。每次检测20000个细胞,数据用CellQuest软件分析(BD Biosciences公司)。
Transwell(穿透小室)迁移实验
细胞(2×103/ml)重悬于200μL无血清培养基并接种在8μm孔的上部,6.5毫米厚的聚碳酸酯膜过滤器(Corning)中。在下部加入600μL量的DMEM+10%胎牛血清。37℃条件下在5%CO2中培养24小时。附在膜下表面的细胞在室温下用4%多聚甲醛固定30分钟,然后用4,6-diamidino-2-phenylindole(DAPI)(4',6-二脒基-2-苯基吲哚)染色(c1002,碧云天生物技术有限公司,中国)。在显微镜下计数过滤器下表面的细胞数。每个小室过滤器统计五个视野。
软琼脂集落形成实验
每孔的基层由2ml最终浓度1×介质(DMEM+10%胎牛血清)和0.6%低熔点琼脂糖构成。六孔板4℃冷藏直到凝固,然后倒入包含有1×104细胞悬浮于1×介质和0.3%低熔点琼脂糖的1ml生长层琼脂。六孔板再次4℃冷藏直到生长层凝结。另外取1ml的不含琼脂糖1×介质分别在第0天和第15天添加到生长层上。细胞在37℃生长1个 月并进行克隆集落总数计数。检测重复三次。结果采用配对t检验用PRISM GraphPad软件进行统计学分析(GraphPad software Inc,格瑞夫软件公司)。
首先,MTT检测法可见,在不同时间(0,12和24小时)用8.5umol(IC50,半数抑制浓度)茴香霉素对OCSCs进行干预,其生存能力没有显著变化。然而,随着处理时间的延长,茴香霉素处理的OCSCs增殖抑制率显著提高(图1A)。相反,同时期DMSO组和对照组的生长抑制作用均不明显(图1A)。细胞用IC50浓度茴香霉素处理72小时后,FCM检测显示,与DMSO对照组和空白组比较,茴香霉素处理组早期凋亡百分比(Annexin V-FITC+/PI-)显著升高(图1B)。此外,Transwell小室迁移侵袭实验显示,与DMSO处理组(102±16)或未处理的OCSCs组(115±15)相比,茴香霉素处理组侵袭水平显著降低(63±13)(图1C)。同时,处理72h后,软琼脂集落形成实验表明,与DMSO处理组(76.71%±6.26%)或未处理组(82.26%±8.32%)相比,茴香霉素处理OCSCs组集落形成大幅减少(33.01%±9.17%)(图1D)。这些结果表明,茴香霉素明显抑制OCSCs增殖和侵袭。
实施例3 茴香霉素刺激OCSCs凋亡相关蛋白和lncRNA BACE1-AS(长链非编码核糖核酸β分解酶翻译核酸序列)的表达
qRT-PCR(实时荧光定量多聚酶链式反应)进行RNA的提取和分析
采用Trizol(细胞/组织总核糖核酸抽提缓冲液)试剂从每个细胞分离总RNA。RNA样品用Dnase I(Sigma-Aldrich)(I型脱氧核糖核酸分解酶(西格玛试剂有限公司))处理,并使用revertraα(α型核糖核酸逆转录)第一链cDNA合成的酶试剂盒(TOYOBO)量化和反转录成cDNA。实时荧光定量RT-PCR采用Eppendorf公司(德国)的realplex4(荧光4色通道)实时荧光定量RT-PCR检测系统,以SYBR绿色荧光定量PCR Master Mix(东洋纺)作为检测染料。扩增以95℃变性15秒,58℃退火35秒,72℃延生42秒,进行40个循环反应。应用相对定量方法对目标基因进行定量分析。目标基因CT值计算公式为:ΔCt(起始扩增循环数)=Ct_genes–Ct_18sRNA进行归一化。相对表达水平的检测采用以下公式:ΔΔCt=ΔCt_all_groups–ΔCt_blankcontrol_group进行。该值用表达式2-ΔΔCt进行计算,可用于计算目标基因相对表达情况。mRNA水平可基于18S rRNA(核糖体核糖核酸)基因水平进行校准。如前面所述,每个基因的cDNA(互补脱氧核糖核酸)都被使用引物进行扩增。
Western blot analysis(蛋白质免疫印迹杂交实验)
各组细胞总蛋白提取物使用12%SDS-PAGE进行电泳,并转染到聚偏二氟乙烯膜(PVDF,Millipore)上。封闭之后,PVDF膜在室温下用含有吐温20的Tris(三羟甲基氨基甲烷)缓冲液(TBST,含吐温20的三羟甲基氨基甲烷)清洗4次,每次15分钟,并进行一抗孵育45分钟。洗膜后,用HRP(辣根过氧化物酶)标记羊抗兔IgG抗体再次孵育1小时。在室温下用清洗4次,每次15分钟,免疫活性经过 化学发光增强(ECL试剂盒,皮尔斯生物技术)激发后,用柯达xar-5胶片(Sigma-Aldrich公司)曝光显示。
免疫荧光染色
培养的细胞是用PBS洗涤3次,并用4%多聚甲醛(Sigma-Aldrich,St.Louis,USA)固定30min。封闭后,细胞首先用一抗于4℃条件下孵育过夜,然后用FITC(异硫氰酸胍)标记的羊抗兔IgG抗体和5μg/ml DAPI(4',6-二脒基-2-苯基吲哚)(Sigma-Aldrich公司)在室温下孵育30min。细胞用TBST彻底洗干净,并通过荧光显微镜(DMI3000;Leica,Allendale,NJ,USA)进行观察。
qRT-PCR(实时荧光定量聚合酶链式反应)结果表明,在处理72h后,茴香霉素处理组的lncRNAs BACE1-AS(长链非编码核糖核酸)表达水平显著高于DMSO组或空白组(图。2A)。但是,在0小时三组之间没有明显差异。同时,qRT-PCR结果还显示,处理72h后,茴香霉素组BACE1、APP、Bcl-2和Bax的mRNA表达水平显著高于DMSO组或空白组(图。2B)。但是,与DMSO组或空白组比较,处理72h的茴香霉素组Ki67 mRNA表达水平显著降低(图。2B)。在另一方面,Western blotting结果显示,处理72h后,组茴香霉素组与DMSO组或空白相比β-淀粉样相关蛋白(BACE1和Aβ1-42)表达显著增加(图。3A,3B)。然而,处理72h后,与其他组相比茴香霉素组Ki67蛋白的表达明显下降,(图。3A,3B)。此外,IF染色结果显示,相比其他组,在处理72h后,茴香霉素处理组BACE1酶和Aβ1-42表达显著增加(图。3C)。这些数据表明,茴香霉素可以诱导lncRNA BACE1-AS和β淀粉样肽相关蛋白的高表达。
实施例4 茴香霉素抑制OCSCs移植瘤的生长
体内异种细胞移植成瘤实验
OCSCs随机分为两组:阴性对照组(OCSCs用DMSO预处理),用二甲基亚砜(DMSO)处理72h;实验组(OCSCs用茴香霉素预处理),经茴香霉素(在其最大抑制浓度的半量,IC50=8.5μmol)处理72h。约1×105对数生长期的OCSCs接种于BALB/C裸鼠(成熟B细胞和T细胞双重缺陷小鼠)。每个实验组包含七只小鼠。观察七周后处死小鼠取肿瘤。肿瘤称重并根据公式计算体积:肿瘤体积(mm3)=(ab2)/2,a代表长轴(mm),b代表短轴(mm)。
苏木精-伊红染色(HE染色)
所有新鲜卵巢肿瘤组织分别用PBS洗涤3次,并用4%多聚甲醛(Sigma-Aldrich,St.Louis,USA)固定30分钟,通过乙醇浓度梯度脱水,二甲苯透明,石蜡包埋。切片机连续切6μm厚度的片子,并进行苏木精-伊红染色(HE)。
免疫组化染色实验
所有新鲜组织用PBS洗3次,4%多聚甲醛(Sigma-Aldrich,St.Louis,USA)固定30分钟,通过乙醇浓度梯度脱水,二甲苯透明,石蜡包埋。接下来,切片机连续切6μm厚度的片子,用3%的磷酸缓冲液冲洗,并进行微波热修复。样品添加一抗并进行孵育。然后,每个样品添加辣根过氧化物酶标记的二抗并进行孵育。最后,加入BCA 显色试剂观察切片颜色变化。PBS(pH 7.4)代替一抗作阴性对照。随机选择五个视野(200×)观察各组织切片,结果采用IPP软件(奥林巴斯光学仪器有限公司)进行分析。
所有接种茴香霉素或DMSO的预处理小鼠OCSCs肿瘤约在注射后7周开始长出肿瘤,虽然两个实验组最终都形成肿瘤,茴香霉素预处理组比DMSO预处理组肿瘤形成更缓慢(图4A)。此外,当小鼠注射7周后处死,茴香霉素预处理组获得的肿瘤比DMSO预处理组明显更小,更轻(图4B,4C)。苏木精-伊红染色切片显示,所有皮下移植瘤均属于中度或低度分化(II、III级)的混合上皮性卵巢癌(图。4D)。此外,免疫组织化学染色结果表明,肿瘤组织中茴香霉素预处理组BACE1和Aβ1-42蛋白的表达明显高于DMSO组(图。4D)而Ki67蛋白在茴香霉素组中的表达明显低于DMSO组(图。4D)。因此,用茴香霉素预处理OCSCs形成的移植瘤比DMSO处理组要小,并且OCSCs细胞在裸鼠体内的增殖和侵袭性减弱。
实施例5 siRAN(小干扰核糖核酸)靶向抑制lncRNA BACE1-AS的表达可削弱茴香霉素对OCSCs抑制的作用
MTT法检测细胞增殖
细胞接种于(2×103)96孔板并在37℃、5%CO2条件下用含有10%FBS的DMEM培养液培养,直到85%的细胞融合。MTT(3(V/V)-二苯基溴化物;Sigma出品)试剂(5mg/ml)在不同时间点被添加到细胞培养基中,在37℃条件下孵育4小时。每孔加入150μL的二甲 基亚砜(DMSO,Sigma Chemicals)终止反应。细胞裂解15min,96孔板轻轻摇动5分钟。采用酶联免疫吸附法(ELISA)测定吸光度值,在490nm测定(model 680,Bio-Rad)。
Western blot analysis(蛋白质免疫印迹杂交实验)
各组细胞总蛋白提取物使用12%SDS-PAGE进行电泳,并转染到聚偏二氟乙烯膜(PVDF,Millipore)上。封闭之后,PVDF膜在室温下用含有吐温20的Tris缓冲液(TBST)清洗4次,每次15分钟,并进行一抗孵育45分钟。洗膜后,用HRP标记羊抗兔IgG抗体再次孵育1小时。在室温下用清洗4次,每次15分钟,免疫活性经过化学发光增强(ECL试剂盒,皮尔斯生物技术)激发后,用柯达xar-5胶片(Sigma-Aldrich公司)曝光显示。
Northern blot analysis(核糖核酸印迹杂交实验)
对于所有的样品,20μg高质量总RNA溶于7.5M尿素12%聚丙烯酰胺变性凝胶,并转移到N+尼龙膜(Amersham,Freiburg,Germany)。膜使用1200mJ/cm2的UV照射30秒钟进行交联。以lncRNA Bace1-as(长链非编码核糖核酸)片段制作杂交用反义探针(上海生工生物工程有限公司)进行杂交检测。清洗后,膜暴露在20-40小时以进行xar-5柯达显影(Sigma-Aldrich)。作为阳性对照,所有的膜与人U6 snRNA探针(5’-GCAGGGGCCATGCTAATCTTCTCTGTATCG-3’,上海生工生物工程有限公司)进行杂交。U6对照探针曝光时间控制在15-30min。
lncRNA BACE1-AS(长链非编码核糖核酸)可以影响OCSCs的增 殖和侵袭,通过siRNA对lncRNA BACE1-AS的靶向抑制,可以探讨茴香霉素靶向调控lncRNA BACE1-AS表达以此抑制OCSCs的活性。OCSCs分别转染了siRNA siRNA-BACE1-AS或siRNA-Mock(随机序列构成的小分子干扰核糖核酸)后,用茴香霉素(IC50)处理72h。然后MTT法检测表明,茴香霉素处理siRNA-BACE1-AS转染OCSCs组存活率明显高于茴香霉素处理的siRNA-Mock组或未转染OCSCs组(图。5A)。此外,Western blot结果显示,在处理72后,茴香霉素处理siRNA-BACE1-AS转染OCSCs组BACE1蛋白表达水平与茴香霉素处理siRNA-Mock转染OCSCs组或未转染组相比显著降低(图。5B)。此外,Northern blot检测结果显示,干预72h后,茴香霉素处理OCSCs组lncRNA BACE1-AS杂交信号显著强于DMSO组或对照组(图。5C)。但是,茴香霉素处理siRNA-BACE1-AS转染组OCSCs中,lncRNA BACE1-AS杂交信号明显低于茴香霉素处理siRNA-mock组或未转染OCSCs组(图。5D)。这些结果表明,siRNA对lncRNA BACE1-AS的靶向沉默作用可以显著削弱茴香霉素对OCSCs的影响。
- 还没有人留言评论。精彩留言会获得点赞!