皮肤外用剂和皮肤刺激降低剂的制作方法
本发明涉及皮肤外用剂。进而,本发明涉及通过皮肤外用剂的组合使用而能够降低皮肤刺激的皮肤刺激降低剂。
背景技术:
以往,作为给药系统(Drug Delivery System)、用于标记特定的生物体组织的分子成像用探针,报道了很多对药物、荧光色素进行负载、包封或结合的聚合物纳米颗粒。
例如,专利文献1中记载了:作为静脉内直接给药的药物输送系统和分子成像探针,包含具有10个以上肌氨酸单元的亲水性多肽链、和作为必要构成单元含有5个以上氨基酸单元或羟基酸单元的疏水性分子链的两亲性嵌段聚合物。
另外,专利文献2中记载了:作为静脉内直接给药的分子成像探针,由包含具有20个以上的肌氨酸单元的亲水性嵌段链和具有10个以上的乳酸单元的疏水性嵌段链的两亲性嵌段聚合物、以及至少具有10个以上的乳酸单元和标记基团的标记聚合物这2种聚合物构成的分子聚集体。
另一方面,出于提高生理活性成分在皮肤中的活性等目的,提出了使生理活性成分包封在聚甲基丙烯酸甲酯(PMMA)的纳米颗粒中的经皮吸收外用剂(专利文献3)。另外,作为与该经皮吸收外用剂一样地在皮肤中发挥作用的目的,也提出了将氨甲环酸封入PLGA纳米颗粒中作为经皮吸收外用剂(专利文献4)。
然而,专利文献3所述的外用剂中,PMMA并非为生物降解性聚合物材料,所以在作为医药品、化妆品等长时间重复使用时,担心PMMA残留于皮肤而产生不良影响。另外,在减小颗粒尺寸时有可能变得难以封入药物。
专利文献4所述的外用剂由于能够封入PLGA纳米颗粒中的氨甲环酸是微量的,所以在送达深于皮肤层(真皮)的部分时需要给予大量的制剂。另外,在使用的药物伴随皮肤刺激之类的情况时,则担心无法完全封入药物载体中的药物可能会对皮肤产生不良影响等的问题。
现有技术文献
专利文献
专利文献1:日本特开2008-024816号公报
专利文献2:国际公开第2009/148121号
专利文献3:日本特开2002-308728号公报
专利文献4:日本特开2010-180145号公报
技术实现要素:
发明要解决的问题
本发明要解決的课题在于提供即使含有对皮肤刺激强且难以进行经皮给药的药物,也能够降低该药物对皮肤的刺激、安全性高且具有优异的药理效果的皮肤外用剂。
用于解决问题的方案
因此,本发明人等进行了深入广泛的研究,结果发现通过组合使用含有特定的两亲性嵌段共聚物的纳米尺寸的分子聚集体和药物,从而得到即使含有对皮肤刺激强且难以进行经皮给药的药物,也能够降低该药物对皮肤的刺激、安全性高且具有优异的药理效果的皮肤外用剂,因而完成了本发明。
即,本发明提供一种皮肤外用剂,其含有药物和纳米尺寸的分子聚集体,前述分子聚集体含有具有源自肌氨酸的结构单元的亲水性嵌段链和具有源自羟基酸的结构单元的疏水性嵌段链的两亲性嵌段共聚物(以下也简称为两亲性嵌段共聚物)。
另外,本发明是为了降低由含有药物的皮肤外用剂中的前述药物导致的皮肤刺激而使用的皮肤刺激降低剂,提供为了形成纳米尺寸的分子聚集体而使用的、包含具有源自肌氨酸的结构单元的亲水性嵌段链和具有源自羟基酸的结构单元的疏水性嵌段链的两亲性嵌段共聚物的皮肤刺激降低剂。
发明的效果
本发明的皮肤外用剂即使含有对皮肤刺激强且难以进行经皮给药的药物,也能够降低该药物对皮肤的刺激、安全性高且具有优异的药理效果。另外,本发明的皮肤外用剂的皮肤透过性也高。
附图说明
图1是表示匹伐他汀所致的皮肤刺激性试验的结果的图。
图2是表示匹伐他汀的皮肤透过试验的结果的图。
图3是表示匹伐他汀的皮肤透过试验的结果的图。
图4-1是表示适用皮肤外用剂后的总胆固醇量的图。
图4-2是表示适用皮肤外用剂后的HDL胆固醇量的图。
图4-3是表示适用皮肤外用剂后的LDL胆固醇量的图。
图4-4是表示适用皮肤外用剂后的磷脂量的图。
图5是表示用三维皮肤模型的匹伐他汀所致的刺激性试验的结果的图。
图6是表示用三维皮肤模型的匹伐他汀的透过试验的结果的图。
图7-1是表示用三维皮肤模型的卡巴拉汀所致的刺激性试验的结果的图。
图7-2是表示用三维皮肤模型的卡巴拉汀所致的刺激性试验的结果的图。
图8是表示用三维皮肤模型的卡巴拉汀的透过试验的结果的图。
图9是表示用三维皮肤模型的美金刚所致的刺激性试验的结果的图。
图10是表示用三维皮肤模型的美金刚所致的刺激性试验和IL-1α产生量的测定结果的图。
具体实施方式
本发明的皮肤外用剂含有药物和纳米尺寸的分子聚集体,该分子聚集体包含具有源自肌氨酸的结构单元的亲水性嵌段链和具有源自羟基酸的结构单元的疏水性嵌段链的两亲性嵌段共聚物。
<(A-1)两亲性嵌段共聚物>
(亲水性嵌段链)
两亲性嵌段共聚物中所含的亲水性嵌段链具有源自肌氨酸的结构单元。通过该结构单元来提高亲水性嵌段链的亲水性和柔软性。需要说明的是,亲水性嵌段链中的源自肌氨酸的结构单元可以全部连续,也可为不连续的。
在此,在本说明书中,“亲水性嵌段链”是指与两亲性嵌段共聚物中所含的疏水性嵌段链相比,亲水性相对高,且两亲性嵌段共聚物在溶剂中进行自组装,具有可形成自聚集体(优选为颗粒状的自聚集体)的亲水性的物质。
作为亲水性嵌段链,从皮肤刺激性降低、皮肤透过性和药理效果的观点、从使分子聚集体易于控制成如胶束、泡囊这种形状、适度的大小的观点出发,优选具有20个以上源自肌氨酸的结构单元。源自所述肌氨酸的结构单元的个数更优选为30个以上、进一步优选为40个以上、另外,优选为500个以下、更优选为200个以下、进一步优选为150个以下、特别优选为100个以下。
具体而言,上述源自肌氨酸的结构单元如下述式(1)所示。
作为源自肌氨酸的结构单元的含量,亲水性嵌段链中优选为50~100摩尔%、更优选为65~100摩尔%、进一步优选为80~100摩尔%、特别优选为90~100摩尔%。
亲水性嵌段链也可含有糖链、聚醚链等,但优选为多肽链。作为亲水性嵌段链中所含的除了源自肌氨酸的结构单元以外的结构单元,可列举出源自除了肌氨酸以外的氨基酸(包含亲水性氨基酸及其它氨基酸)的结构单元。
在此,本说明书中“氨基酸”为L体、D体、DL体均可,天然氨基酸、非天然氨基酸以及通过它们的修饰和/或化学改变的衍生物,且也包含α-、β-、γ-氨基酸。
上述氨基酸中优选为亲水性氨基酸。具体而言,可列举出丝氨酸、苏氨酸、赖氨酸、天冬氨酸、谷氨酸等。
(疏水性嵌段链)
两亲性嵌段共聚物中所含的疏水性嵌段链具有源自羟基酸的结构单元。疏水性嵌段链中的源自羟基酸的结构单元可以全部连续,也可为不连续的。
在此,在本说明书中,“疏水性嵌段链”是指与两亲性嵌段共聚物中所含的亲水性嵌段链相比,疏水性相对高,且两亲性嵌段共聚物在溶剂中进行自组装,具有可形成自聚集体(优选为颗粒状的自聚集体)的疏水性的物质。
另外,作为疏水性嵌段链,从皮肤刺激性降低、皮肤透过性和药理效果的观点、从使分子聚集体易于控制成如胶束、泡囊这种形状、适度的大小的观点出发,优选具有10个以上源自羟基酸的结构单元。所述源自羟基酸的结构单元的个数更优选为15个以上、进一步优选为20个以上、另外,优选为100个以下、更优选为80个以下、进一步优选为60个以下、特别优选为50个以下。
作为上述羟基酸,优选为脂肪族羟基酸。作为脂肪族羟基酸,可列举出乳酸、乙醇酸、羟基异丁酸等,可以单独使用这些当中的1种或组合使用2种以上。
这些当中,从对于低沸点溶剂的溶解性、生物适应性和稳定性提高的观点出发,特别优选为乳酸。该乳酸为L-乳酸、D-乳酸、DL-乳酸均可,疏水性嵌段链可以由这些当中的单种构成也可以由多种构成。
作为上述源自羟基酸的结构单元的适合的具体例,可列举出由下述式(2)所示的例子。
〔式(2)中,R1表示氢原子或甲基,R2表示单键或亚甲基。〕
式(2)中,作为R1与R2的组合,优选的是:R1为氢原子或甲基、R2为单键的组合,R1为甲基、R2为亚甲基的组合,从对于低沸点溶剂的溶解性、生物适应性和稳定性提高的观点出发,特别优选R1为甲基,特别优选R2为单键的组合。
作为源自羟基酸的结构单元的含量,疏水性嵌段链中优选为50~100摩尔%、更优选为65~100摩尔%、进一步优选为80~100摩尔%、特别优选为90~100摩尔%。
作为疏水性嵌段链中所含的源自羟基酸的结构单元以外的结构单元,可列举出源自氨基酸(包含疏水性氨基酸及其它氨基酸)的结构单元。
疏水性氨基酸的多数具有脂肪族侧链、芳香族侧链等。作为天然的疏水性氨基酸,可列举出丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、蛋氨酸、色氨酸等。作为非天然的疏水性氨基酸衍生物,可列举出谷氨酸甲酯、谷氨酸苄酯、天冬氨酸甲酯、天冬氨酸乙酯、天冬氨酸苄基酯等。
作为本发明中使用的两亲性嵌段共聚物中、亲水性嵌段链和疏水性嵌段链的含有比例〔亲水性嵌段链:疏水性嵌段链〕,从皮肤刺激性降低、皮肤透过性和药理效果的观点出发,结构单元数之比优选为10:1~1:1、更优选为6:1~1.5:1、特别优选为5:1~1.6:1。
另外,作为本发明中使用的两亲性嵌段共聚物的适合的具体例,可列举出由下述式(3)所示的例子。
〔式(3)中,R3表示碳数1~6的2价的烃基,m表示20~200的整数,n表示10~100的整数表示,R1和R2与前述相同意义。〕
式(3)中,作为R3所示的2价的烃基,优选为亚烷基。亚烷基可以是直链状也可以是支链状。作为亚烷基的具体例,可列举出亚甲基、亚乙基、三亚甲基、亚丙基(丙烷-1,2-二基)、四亚甲基、五亚甲基、六亚甲基等。
上述2价的烃基的碳数优选为2~5、更优选为2或3、进一步优选为2。
m表示20~200的整数,优选为30~150的整数、更优选为40~100的整数。n表示10~100的整数,优选为15~80的整数、更优选为20~60的整数、特别优选为20~50的整数。
需要说明的是,n个R1可以相同也可以不同,n个R2可以相同也可以不同。
本发明中使用的两亲性嵌段共聚物的数均分子量(Mn)没有特别限定,优选为3000~14000、更优选为3000~9000。两亲性嵌段共聚物的重均分子量(Mw)没有特别限定,优选为3000~14000、更优选为3000~9000。
两亲性嵌段共聚物的分子量分布(Mw/Mn)优选为1.5以下。
需要说明的是,各结构单元的含量通过13C-NMR、1H-NMR等进行测定既可。
<(A-2)疏水性聚合物>
本发明中使用的分子聚集体除了两亲性嵌段共聚物也可含有疏水性聚合物。
作为上述疏水性聚合物(以下也简称为疏水性聚合物。),从生物适应性、稳定性、生物降解性的观点、对于低沸点溶剂的溶解性的观点出发,优选为具有源自羟基酸的结构单元的疏水性聚合物。
疏水性聚合物具有源自羟基酸的结构单元时,作为源自羟基酸的结构单元的个数,从与两亲性嵌段聚合物的亲和性的观点以及从使分子聚集体易于控制成如胶束、泡囊这种形状、适度的大小的观点出发,优选为10个以上、更优选为15个以上、进一步优选为20个以上,另外,优选为200个以下、更优选为160个以下、进一步优选为100个以下。
上述个数优选为不超过两亲性嵌段聚合物中的疏水性嵌段链中所含的结构单元数2倍的个数。
作为上述羟基酸,优选为脂肪族羟基酸。作为脂肪族羟基酸,可列举出乳酸、乙醇酸、羟基异丁酸等,可以单独使用这些当中的1种或组合使用2种以上。
这些当中,从对于低沸点溶剂的溶解性、生物适应性和稳定性提高的观点出发,特别优选为乳酸。该乳酸为L-乳酸、D-乳酸、DL-乳酸均可,疏水性聚合物可以由这些当中的单种构成也可以由多种构成。所述乳酸中,从易于控制平均粒径的观点和稳定性的观点出发,两亲性嵌段聚合物中的疏水性嵌段链含有源自L-乳酸的结构单元时优选为L-乳酸、两亲性嵌段聚合物中的疏水性嵌段链含有源自D-乳酸的结构单元时优选为D-乳酸。
疏水性聚合物含有源自羟基酸的结构单元时,作为所述结构单元的含量,疏水性聚合物中优选为50~100摩尔%、更优选为65~100摩尔%、进一步优选为80~100摩尔%、特别优选为90~100摩尔%。
需要说明的是,疏水性聚合物也可含有源自上述疏水性氨基酸的结构单元等。
上述疏水性聚合物的数均分子量(Mn)没有特别限定,优选为700~6000、更优选为1000~4000。
上述疏水性聚合物的重均分子量(Mw)没有特别限定,优选为700~6000、更优选为1000~4000。
上述疏水性聚合物的分子量分布(Mw/Mn)优选为1.5以下。
使用疏水性聚合物时,从易于控制分子聚集体的疏水核心部的体积、分子聚集体的大小的观点出发,两亲性嵌段共聚物与疏水性聚合物的含量的摩尔比〔(A-1):(A-2)〕优选为10:1~1:10。
<(B)药物>
本发明的皮肤外用剂中所含的药物没有特别限定。本发明的皮肤外用剂通过组合使用含有上述两亲性嵌段共聚物的分子聚集体和药物,从而降低药物对皮肤的刺激,即使在使用皮肤刺激性高的物质作为药物时也能够安全地进行经皮给药。
因此,作为药物,具体而言,能够适合使用报道有引起接触性皮炎的药物等。这些药物可以单独使用或在多种组合中使用。
作为报道有引起接触性皮炎的药物,可列举出例如他汀类。作为他汀类,可列举出美伐他汀、辛伐他汀、氟伐他汀、洛伐他汀、阿托伐他汀、匹伐他汀、瑞舒伐他汀、普伐他汀、它们的药学上可接受的盐。在此,作为该药学上可接受的盐,可列举出钠盐等碱金属盐;钙盐等碱土金属盐;铵盐;烷基铵盐。由于本发明的皮肤外用剂的皮肤透过性高且容易移动至血中等,所以能够充分发挥他汀类所具备的药理作用。
这些当中,作为他汀类,优选为脂溶性他汀类、它们的药学上可接受的盐。作为脂溶性他汀类,可列举出美伐他汀、辛伐他汀、氟伐他汀、洛伐他汀、阿托伐他汀、匹伐他汀、瑞舒伐他汀、它们的药学上可接受的盐。
作为其它的报道有引起接触性皮炎的药物,例如,可列举出:硫酸新霉素、庆大霉素、卡那霉素、盐酸土霉素、磷酸克林霉素、硫酸多粘菌素B、杆菌肽、红霉素、氯霉素、梭链孢酸钠、磺胺嘧啶银等抗生素;
克霉唑、盐酸奈康唑、卢立康唑、硝酸硫康唑、联苯苄唑、兰诺康唑、盐酸阿莫罗芬、盐酸特比萘芬、盐酸布替萘芬、托萘酯等抗真菌药;
乙酰水杨酸、丁苯羟酸、布洛芬、布洛芬吡甲酯、乌芬那酯、双氯芬酸钠、吲哚美辛、酮洛芬、洛索洛芬、舒洛芬、噻洛芬、萘普生、氟比洛芬、吡罗昔康等非甾体性抗炎药;
盐酸普鲁卡因、氨基苯甲酸乙酯、盐酸地布卡因、盐酸利多卡因、盐酸托哌酮等局部麻醉药;
盐酸苯海拉明、克罗米通、L-薄荷醇、水杨酸乙二醇酯、水杨酸甲酯等止痒药;
醋酸氢化可的松、氢化可的松、强的松龙、曲安奈德、哈西奈德、氟齐胺、安西奈德、氟西奈德、地塞米松、丁酸氢化可的松、丁酸丙酸氢化可的松、地泼罗酮丙酯、泼尼松龙醋酸戊酸酯、丙酸氯倍他索、乙酸倍他松、戊酸倍他米松、戊酸地塞米松、戊酸二氟可龙、二丙酸倍他米松、倍他米松丁酸丙酸酯、丙酸倍氯米松、二丙酸地塞米松、特戊酸氟米松、阿氯米松、莫米松糠酸酯、二氟孕甾丁酯、醋酸双氟拉松等甾体性抗炎药;
盐酸去氧肾上腺素、盐酸地匹福林、硫酸阿托品、富马酸酮替芬、色甘酸钠、氨来占诺、妥布霉素、硫酸地贝卡星、硫酸西索米星、马来酸噻吗洛尔、尼普地罗、盐酸苯呋洛尔、盐酸左卡巴斯汀等滴眼药;
氯化溶菌酶、曲弗明等溃疡治疗药;
盐酸多奈哌齐、美金刚盐酸盐、卡巴拉汀、酒石酸卡巴拉汀、氢溴酸加兰他敏等阿尔茨海默氏痴呆治疗药;
氯霉素、卡马西平、苯巴比妥、苯妥英、乙替唑仑、硝西泮、艾地苯醌、盐酸米安色林等抗痉挛药;
水合氯醛、乙酰水杨酸、托芬那酸、布可隆等解热镇痛药;
盐酸美西律、甲磺酸多沙唑嗪、双嘧达莫、硝酸异山梨酯等循环系统治疗药;
磷酸双氢可待因、茶碱等呼吸器药;
盐酸噻氯匹定、贝前列素钠、利马前列素等血液·体液疾病治疗药;
盐酸奥昔布宁等尿频治疗药。
这些当中,作为其它的报道有引起接触性皮炎的药物,优选为阿尔茨海默氏痴呆治疗药、尿频治疗药。
<皮肤外用剂的形态>
本发明的皮肤外用剂含有具有上述两亲性嵌段共聚物的纳米尺寸的分子聚集体和上述药物。本发明的皮肤外用剂的剂型没有特别限定,可列举出:外用液剂、洗剂、补剂、擦剂、乳剂、凝胶剂、软膏剂、乳膏剂、泥膏剂、硬膏剂、湿布剂、巴布剂、膏药、胶带剂、储层型贴剂、喷雾剂、气雾剂、泡剂、化妆水、膜剂等。
皮肤外用剂含有药物和分子聚集体是指在皮肤外用剂中存在药物和分子聚集体,根据需要上述两亲性嵌段共聚物在含有上述疏水性聚合物的分子聚集体的聚合物纳米颗粒中也可含有上述药物。需要说明的是,该“含有”包括包封和负载的概念。分子聚集体含有药物时,分子聚集体本身具有作为药物的作用和作为皮肤刺激降低剂的作用两方面。
作为含有药物和分子聚集体的形态,除了分子聚集体含有药物的形态以外,可列举出分子聚集体和药物在混合状态下存在(同时存在)的形态、皮肤外用剂包括含有分子聚集体的区域和含有药物的区域的形态。这些形态中,分子聚集体作为皮肤刺激降低剂发挥作用。
作为皮肤外用剂包括分子聚集体含有区域和药物含有区域的形态,例如,可列举出在基材上具备药物含有层的皮肤贴剂中,在药物含有层上的皮肤粘贴面侧具备含有分子聚集体的层。这种皮肤粘贴外用剂在基材上依次具备作为药物含有区域的药物含有层、用于降低皮肤刺激的作为分子聚集体含有区域的分子聚集体含有层。
将分子聚集体用作皮肤刺激降低剂时,通过涂布等使分子聚集体与表皮接触后,在其上适用药物,从而能够得到降低对皮肤刺激的效果。
药物的含量相对于皮肤外用剂总量例如为0.0001~50质量%左右。从皮肤刺激性降低、皮肤透过性和药理效果的观点出发,药物的含量相对于皮肤外用剂总量,优选为0.001~30质量%、更优选为0.01~15质量%、进一步优选为0.05~10质量%、更优选为0.1~5质量%。特别是,从皮肤透过性和药理效果的观点出发,更优选为0.15~2.5质量%、更优选为0.2~1.5质量%、特别优选为0.3~1质量%。
两亲性嵌段共聚物的含量相对于皮肤外用剂总量,例如为0.0001~50质量%左右、优选为0.001~30质量%、更优选为0.01~20质量%、特别优选为0.1~10质量%。
皮肤外用剂中的两亲性嵌段共聚物与药物的含量的摩尔比〔(A-1):(B)〕优选为1:1000~1000:1、更优选为1:100~100:1、进一步优选为1:100~1:1、特别优选为1:50~1:1。
<分子聚集体>
本发明中使用的分子聚集体是通过上述两亲性嵌段共聚物的聚集、或者通过自组装的取向缔合而成立的构造体。上述分子聚集体的形状为颗粒状(胶束状、泡囊状等)、棒状、其它分子的聚集形态均可,从皮肤刺激性降低、皮肤透过性和药理效果的观点出发,优选为颗粒状、更优选为胶束状、泡囊状、特别优选为胶束状。
从皮肤刺激性降低、皮肤透过性和药理效果的观点出发,本发明中使用的分子聚集体的平均粒径优选为10~300nm、平均粒径更优选为10~200nm、平均粒径进一步优选为10~150nm、平均粒径进一步优选为10~100nm、平均粒径进一步优选为15~60nm、平均粒径特别优选为20~45nm。
需要说明的是,平均粒径是通过后述的实施例所述的方法测定的数值。
本发明的皮肤外用剂和皮肤刺激降低剂能够根据常规方法通过对如下述那样操作而得到的分子聚集体进行配混来制造。
使用能够通过适当组合肽合成法、聚酯合成法、缩肽类合成法的公知的方法而合成的两亲性嵌段共聚物,以及根据需要使用疏水性聚合物,能够通过薄膜法或注射法等来制作分子聚集体。在制作分子聚集体时,除了两亲性嵌段共聚物以及根据需要使用的疏水性聚合物以外,通过使用药物而能够得到含有药物的分子聚集体。另外,也能够将形成分子聚集体前的两亲性嵌段共聚物和根据需要使用的疏水性聚合物作为皮肤刺激降低剂来提供。在该形态中,通过使用作为皮肤刺激降低剂的两亲性嵌段共聚物和药物来制作分子聚集体,从而能够得到可以作为皮肤外用剂使用的分子聚集体。需要说明的是,对于得到的分子聚集体而言,也可以根据公知的方法进行表面修饰。
(薄膜法)
薄膜法通常是制备脂质体中所使用的方法,包括以下工序(1)~(3)。
工序(1):在容器(例如玻璃容器)内,使两亲性嵌段共聚物、药物以及根据情况的疏水性聚合物溶解于有机溶剂中的工序;
工序(2):从前述溶液中除去前述有机溶剂,在前述容器的内壁得到含有两亲性嵌段共聚物、以及根据情况的疏水性聚合物和/或药物的薄膜的工序;
工序(3):在前述容器中加入水或水溶液,使前述薄膜变换为颗粒状的分子聚集体而得到分子聚集体的分散液的工序。
进而,薄膜法也可以包括将前述的分子聚集体的分散液供于冷冻干燥处理的工序。另外,工序(3)中根据情况也可以进行超声波处理和水溶液的加热处理。
另外,在有机溶剂中含有两亲性嵌段共聚物、以及根据情况的疏水性聚合物和/或药物的溶液可由本领域技术人员适当制备。例如,可以通过将所有应该使用的聚合物和药物进行一次性混合来制备,也可以将该应该使用的聚合物和药物当中的一部分预先以薄膜的状态准备,之后通过加入含有该应该使用的成分当中的其它成分的溶液来制备。预先准备的一部分的聚合物的薄膜的形成法能够根据后述的方法来进行。
作为薄膜法中使用的有机溶剂,只要溶解使用的两亲性嵌段共聚物、药物和疏水性聚合物就没有特别限制,但出于溶解后进行蒸馏除去考虑而优选使用低沸点溶剂。本发明中的低沸点溶剂是指在1个大气压下的沸点为100℃以下、优选为90℃以下的溶剂。具体而言,可列举出氯仿、乙醚、乙腈、甲醇、乙醇、丙醇、异丙醇、丙酮、二氯甲烷、四氢呋喃、己烷、乙酸乙酯等。
对于两亲性嵌段共聚物、以及根据情况的疏水性聚合物和/或药物的溶解,通过使用这种低沸点溶剂而使溶剂的除去变得非常简单。作为溶剂的除去方法没有特别限定,根据使用的有机溶剂的沸点等,本领域技术人员进行适当确定即可。例如,可以在减压下进行溶剂除去,也可以通过自然干燥除去溶剂。
有机溶剂被除去后,在容器内壁形成含有两亲性嵌段共聚物、以及根据情况的疏水性聚合物和/或药物的薄膜。向粘附有该薄膜的容器中加入水或水溶液。作为水或水溶液没有特别限定,本领域技术人员适当选择在生化学、药学上可接受的物质即可。例如,可列举出注射用蒸馏水、生理盐水、缓冲液等。
加入水或水溶液后,通过根据需要进行加热处理和/或超声波处理,从而从容器内壁上剥离薄膜,在该过程中形成分子聚集体。超声波处理例如可以在1~60分钟的条件下进行。加热处理例如可以在20~95℃的条件下进行。与超声波处理同时进行加热处理时,例如在20~95℃、1~60分钟的条件下进行超声波处理即可。加热处理和/或超声波处理结束时,在容器中能制备分子聚集体被分散在前述水或水溶液中的分散液。
(注射法)
注射法是制备其它多种分子聚集体时使用的方法,不限定于本发明的分子聚集体。该方法中能够通过如下方式制备分子聚集体,即,在有机溶剂、例如三氟乙醇、乙醇、六氟异丙醇、二甲基亚砜等中溶解两亲性嵌段共聚物、以及根据情况的疏水性聚合物和/或药物,使得到的溶液分散于注射用蒸馏水、生理盐水、缓冲液等水系溶剂中,进行纯化处理、例如凝胶过滤层析、滤波、超离心等的处理后,除去有机溶剂。
在将分子聚集体作为泡囊进行制备时,制备包封型的分子聚集体时,在注射用蒸馏水、生理盐水、缓冲液等水系溶剂中使应包封的物质溶解或悬浮,在通过此操作而得到的水溶液或悬浮液中,使两亲性嵌段共聚物、以及根据情况的疏水性聚合物和/或药物溶解于上述有机溶剂而得到的溶液分散。
通过在制备分子聚集体时使用药物,从而在形成含有药物的分子聚集体时,出于药物容易被包封或负载而皮肤刺激性降低方面的考虑,优选使用疏水性的药物。例如,作为药物使用脂溶性他汀类时,药物变得容易被包封或负载在两亲性嵌段共聚物的疏水核心部分而进一步皮肤刺激性降低。
两亲性嵌段共聚物与药物的含量的摩尔比〔(A-1):(B)〕从颗粒的粗大化、漏出药物的聚集等的外观稳定性的观点出发,优选为1:1000~1000:1、更优选为1:100~100:1、进一步优选为1:100~1:1、特别优选为1:50~1:1。
<皮肤外用剂的附加的成分>
除了上述分子聚集体和药物以外,本发明的皮肤外用剂也可含有保湿剂、柔软剂、经皮吸收促进剂、无痛化剂、防腐剂、抗氧化剂、着色剂、增稠剂、香料、pH调整剂等。这些可以单独含有1种或组合含有2种以上。
作为上述保湿剂,例如,可列举出琼脂、二甘油、二硬脂二甲铵锂蒙脱石、丁二醇、聚乙二醇、丙二醇、己二醇、薏苡仁提取物、凡士林、尿素、透明质酸、氨甲环酸、神经酰胺、Lipidure(保湿因子)、异黄酮、氨基酸、胶原、粘多糖、褐藻糖胶、乳铁蛋白、山梨醇、甲壳素·壳聚糖、苹果酸、葡萄糖醛酸、胎盘提取物、海藻提取物、牡丹皮提取物、甜绣球(sweet hydrangea)提取物、小连翘提取物、彩叶草提取物、卫矛提取物、可可提取物、玫瑰花提取物、猪苓提取物、山楂提取物、迷迭香提取物、栽种色椰木提取物、春黄菊提取物、野芝麻提取物、荔支提取物、蓍提取物、芦荟提取物、马栗提取物、罗汉柏提取物、墨角藻提取物、欧丝磨(osmoin)提取物、燕麦提取物、晚香玉多糖、冬虫夏草提取物、大麦提取物、柑桔提取物、地黄提取物、花椒提取物、薏苡仁提取物等。
作为上述柔软剂,例如,可列举出甘油、矿物油、润肤成分(例如,异硬脂酸异丙酯、异硬脂酸聚甘油脂、异壬酸异十三烷酯、异壬酸辛酯、油酸、油酸甘油酯、可可脂、胆固醇、混合脂肪酸甘油三酯、琥珀酸二辛酯、蔗糖乙酸硬脂酸酯、环五硅氧烷、蔗糖二硬脂酸酯、棕榈酸二辛酯、羟基硬脂酸辛酯、山萮酸二十烷醇酯、蔗糖多山萮酸酯、聚甲基倍半硅氧烷、肉豆蔻醇、肉豆蔻酸十六酯、肉豆蔻酸肉豆蔻脂、月桂酸己酯等)。
作为上述经皮吸收促进剂,例如,可列举出乙醇、肉豆蔻酸异丙酯、柠檬酸、角鲨烷、油酸、薄荷脑、N-甲基-2-吡咯烷酮、己二酸二乙酯、己二酸二异丙酯、癸二酸二乙酯、癸二酸二异丙酯、棕榈酸异丙酯、油酸异丙酯、油酸辛基十二烷酯、异硬脂醇、2-辛基十二烷醇、尿素、植物油、动物油。
作为上述无痛化剂,例如,可列举出苯甲醇、盐酸普鲁卡因、盐酸利多卡因、氯丁醇等。
作为上述防腐剂,例如,可列举出苯甲酸、苯甲酸钠、对羟基苯甲酸酯、对羟基苯甲酸酯乙酯、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯、山梨酸钾、山梨酸钠、山梨酸、脱氢乙酸钠、过氧化氢、甲酸、甲酸乙酯、次氯酸钠、丙酸、丙酸钠、丙酸钙、果胶分解物、聚赖氨酸、苯酚、异丙基甲基苯酚、邻苯基苯酚、苯氧乙醇、间苯二酚、百里香酚、福美双、茶树油。
作为上述抗氧化剂,例如,可列举出维生素A、维甲酸(Retinoic acid)、视黄醇、醋酸视黄酯、维生素A棕榈酸酯、维生素A醋酸酯、视黄醇棕榈酸酯、生育酚视黄酸酯、维生素C及其衍生物、激动素、β-胡萝卜素、虾青素、叶黄素、番茄红素、维甲酸(Tretinoin)、维生素E、α-硫辛酸、辅酶Q10、聚苯酚、SOD、植酸等。
作为上述着色剂,例如,可列举出氧化铁、三氧化二铁、氧化铁黄、二氧化钛、高岭土、焦油系色素、叶绿素等。
作为上述增稠剂,例如,可列举出榅桲、卡拉胶、阿拉伯胶、卡拉牙胶、黄原胶、结冷胶、罗望子胶、刺槐豆胶、黄蓍胶、果胶、淀粉、环糊精、甲基纤维素、乙基纤维素、羧甲基纤维素、海藻酸钠、聚乙烯醇、聚乙烯吡咯烷酮、羧基乙烯聚合物、聚丙烯酸钠等。
作为上述香料,例如,可列举出麝香、阿拉伯胶油、茴香油、依兰油、肉桂油、茉莉油、甜柑桔油、留兰香油、天竺葵油、百里香油、橙花油、薄荷油、柏树油、茴香油、薄荷油、佛手柑油、酸橙油、薰衣草油、柠檬油、柠檬草油、玫瑰油、玫瑰木油、茴香醛、香叶醇、柠檬醛、灵猫酮、麝香酮、苎烯、香草醛等。
作为上述pH调整剂,例如,可列举出柠檬酸、柠檬酸钠、乙酸、乙酸钠、氢氧化钠、氢氧化钾、磷酸、磷酸氢钠、磷酸二氢钠、磷酸氢二钠、琥珀酸、琥珀酸钠、苹果酸、苹果酸钠、盐酸等。
<皮肤外用剂的用法>
本发明的皮肤外用剂只要是经皮给药(包括经粘膜给药)的物质即可,但由于不仅能够期待局部作用也能够期待全身作用,所以作为用于循环系统疾病、免疫疾病、精神疾病、神经系统疾病、内分泌疾病等全身性疾病的预防或治疗的皮肤外用剂是有用的。
另外,本发明的皮肤外用剂的给药量和给药期间可以根据药物的种类和用量、患者的体重、疾病的状态等适当设定。
本发明的皮肤外用剂降低了药物对皮肤的刺激,对人体的安全性高,容易透过皮肤移动至血中等体内,药理效果也优异。另外,具有优异的生物降解性和生物适应性,进而即使少量也能够在体内显现药效。
特别是,即使是在仅应用于皮肤时难以显现所期望药效的药物,也能够显现优异的药理效果,另外,即使是因皮肤刺激等副作用的风险高而不适合外用的药物,也能够兼顾显现出优异的药理效果和降低副作用的风险。
实施例
以下,列举实施例对本发明进行详细地说明,本发明不限定于实施例。
需要说明的是,实施例中的平均粒径使用评价溶液中的分子聚集体浓度成为1mg/mL的方式分散于纯化水的试样,根据Zetasizer Nano S(马尔文制)进行测定。另外,测定参数的Dispersant RI设为1.330、Material RI设为1.45(蛋白)和测定温度设为25.0℃。另外,数据解析时使用Zetasizer Software(ver.6.32)。
[合成例1:聚肌氨酸-聚-L-乳酸(PSar-PLLA)的合成]
按照以下的步骤,基于肌氨酸-NCA(Sar-NCA)和氨基化聚L-乳酸(a-PLA)合成聚肌氨酸-聚乳酸两亲性嵌段聚合物(PSar65-PLLA30)(方案1)。
在氩气气氛下,向氨基化聚L-乳酸(383mg,0.17mmol)和肌氨酸-NCA(3.21g,27.9mmol)中加入二甲基甲酰胺(DMF)(140mL),在室温下搅拌12小时。接着,将反应溶液冷却至0℃,加入乙醇酸(72mg,0.95mmol)、O-(苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐(HATU)(357mg,0.94mmol)和N,N-二异丙基乙胺(DIEA)(245μL,1.4mmol),在室温下反应18小时。
之后,通过旋转蒸发器减压蒸馏除去DMF,利用LH20色谱柱进行纯化。回收·浓缩在UV270nm下检测到峰的组分。将得到的浓缩溶液在0℃下滴加至乙醚中,通过再沉淀而得到目标产物的PSar65-PLLA30(1.7g)。
[实施例1:匹伐他汀钙的皮肤刺激性降低效果]
实施例1中,作为药物使用匹伐他汀钙,进行了有关使药物含在两亲性聚合物胶束的皮肤外用剂的试验。
[制备例1-1:含有匹伐他汀钙的聚合物胶束的制备(35nm)]
使合成例1中得到的PSar65-PLLA30 100mg和匹伐他汀钙20mg溶解于氯仿40mL中,利用旋转蒸发器减压蒸馏除去氯仿。减压蒸馏除去后向在容器内形成的薄膜中添加纯化水10mL,将容器在85℃热水浴中浸渍20分钟而形成胶束,使用0.2μm PTFE过滤器进行过滤,使滤液冷冻干燥,得到含有匹伐他汀钙的聚合物胶束。
平均粒径:35nm、药物含量:20质量%、回收率:90%以上
[制备例1-2:含有匹伐他汀钙的聚合物胶束的制备(60nm)]
合成例1中得到的PSar65-PLLA30 100mg、使对末端进行Z化(苄氧基羰基化)的聚-L-乳酸(PLLA30-Z)34mg和匹伐他汀钙20mg溶解于氯仿10mL中,利用旋转蒸发器减压蒸馏除去氯仿。减压蒸馏除去后向在容器内形成的薄膜中添加纯化水10mL,将容器在85℃热水浴中浸渍20分钟而形成胶束,使用0.2μm PTFE过滤器进行过滤,使滤液冷冻干燥,得到含有匹伐他汀钙的聚合物胶束。
平均粒径:60nm、药物含量:15质量%、回收率:90%以上
[制备例1-3:含有匹伐他汀钙的聚合物胶束的制备(35nm)]
除了将匹伐他汀钙的量设为10mg以外,通过与制备例1-1相同的步骤得到含有匹伐他汀钙的聚合物胶束。
平均粒径:35nm、药物含量:10质量%、回收率:90%以上
[制备例1-4:含有匹伐他汀钙的聚合物胶束的制备(35nm)]
除了将匹伐他汀钙的量设为40mg以外,通过与制备例1-1相同的步骤得到含有匹伐他汀钙的聚合物胶束。
平均粒径:35nm、药物含量:40质量%、回收率:90%以上
[试验例1-1:皮肤刺激性试验]
在给药开始日的前一天,使用电动剪毛刀和剃须刀剪掉背部皮毛,考虑到皮肤状态来选择被检动物(兔子)。使以下液<1-A>~<1-E>各500μL浸渗于切成2.5cm见方的绒布上作为被检物质,用油纸保护(以下作为制剂)后,粘贴在背部皮肤上。给药为封闭涂布,为了防止制剂涂布后绒布的偏离而用医疗用粘合片进行覆盖,进一步缠绕医用胶带进行固定,给动物安装伊丽莎白项圈(Elizabethan collar)。
涂布24小时后移除伊丽莎白项圈,用浸有生理盐水(日本药典生理盐水、大冢生理盐水注射液、Otsuka Pharmaceutical Co.,Ltd.制造)的脱脂棉除去(擦拭)制剂,结束给药部位的观察后,进行下面的涂布操作,实施了连续14天重复给药并进行了观察。
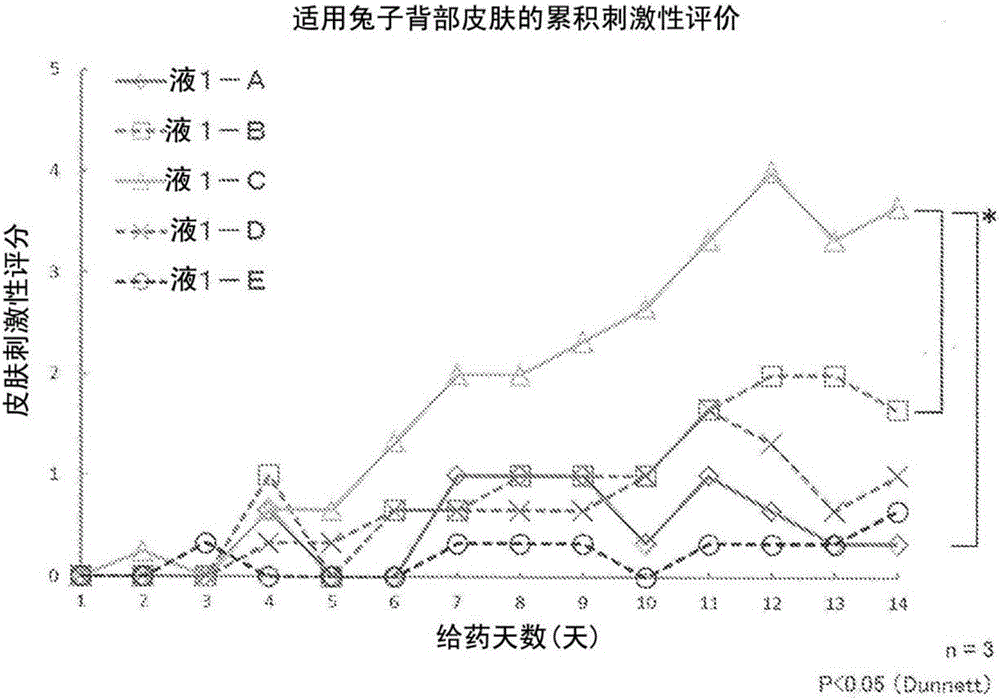
上述观察通过对出现红斑和焦痂以及浮肿进行肉眼观察,按照根据Draize法的皮肤刺激性判定基准,基于红斑和焦痂的评分和浮肿的评分的总值判断了皮肤刺激的程度。表1示出红斑和焦痂的评分标准和浮肿的评分标准,图1示出根据Dunnett法进行统计分析的试验结果。
<1-A>:制备例1-1中得到的含有匹伐他汀钙的聚合物胶束的浓度以匹伐他汀钙换算成为0.5质量%的方式制备的磷酸盐缓冲液(pH7.4)悬浮液
<1-B>:含有匹伐他汀钙(0.5质量%)和聚乙二醇400(9质量%)的磷酸盐缓冲液(pH7.4)溶液
<1-C>:含有匹伐他汀钙(0.5质量%)的磷酸盐缓冲液(pH7.4)悬浮液
<1-D>:含有合成例1中得到的聚合物(2.5质量%)的磷酸盐缓冲液(pH7.4)悬浮液
<1-E>:磷酸盐缓冲液(pH7.4)
[表1]
试验例1-1的结果证实了:使用含有匹伐他汀钙的聚合物胶束悬浮液(液1-A)的情况与使用匹伐他汀钙悬浮液(液1-C)的情况相比,皮肤刺激评分(Score)显著降低。而且,含有匹伐他汀钙的聚合物胶束悬浮液(液1-A)的皮肤刺激评分经过14天推移至1以下,意外的是几乎推移了与不含匹伐他汀的聚合物胶束悬浮液(液1-D)相同程度。
另外,在使匹伐他汀钙溶解于聚乙二醇400溶液的溶液(液1-B)中的皮肤刺激性评价的结果中,虽然累积刺激评分上未发现显著的上升趋势,但得到了比含有匹伐他汀钙的聚合物胶束悬浮液(液1-A)高的皮肤刺激评分。
[试验例1-2:皮肤透过试验(1)]
对大鼠腹部皮肤进行脱毛处理后进行摘出,将其制成透过膜。在卧式透过池中将摘出皮肤的角质层一侧作为供体侧固定摘出皮肤。制备例1-1和1-2中得到的含有匹伐他汀钙的聚合物胶束、以及将匹伐他汀钙作为对照,以匹伐他汀钙的浓度成为0.1质量%方式分别悬浮于磷酸盐缓冲液(pH7.4)中,将这些作为供体溶液用于固定的大鼠摘出皮肤上。受体溶液为磷酸盐缓冲液(pH7.4)2mL,实验开始后从样品采集口经时性地采集0.5mL,补充新的受体溶液0.5mL。用HPLC法测定采集的样品溶液中的匹伐他汀含量,测定各自的制剂中的匹伐他汀钙的大鼠皮肤透过量。图2示出试验结果。
[试验例1-3:皮肤透过试验(2)]
制备例1-1、1-3和1-4中得到的含有匹伐他汀钙的聚合物胶束的匹伐他汀钙的浓度分别成为0.1质量%、0.05质量%和0.2质量%的方式悬浮于磷酸盐缓冲液(pH7.4)中,使用由此而制备的样品,用与试验例1-2相同的方法测定了皮肤透过性。图3示出结果。
试验例1-2和1-3的结果证实了含有匹伐他汀钙的聚合物胶束的皮肤透过性高。
[试验例1-4:药效试验]
在给药开始日的前一天,使用电动剪毛刀和剃须刀剪掉被检动物(雄性豚鼠、Slc:Hartley、7周龄)的背部皮毛,用除毛乳膏(Epilat、Kanebo制造)进行除毛。各被检动物的除毛部位为了防止液体下垂而用带胶带的海绵包装(3.5cm×3.5cm×0.5cm、Ashiya Packing Manufactory制造)覆盖,在内侧被掏空的2.5cm×2.5cm部分分别使用以下液<4-A>~<4-E>各500μL。使给药液紧贴于涂布部位后,用切成2.5cm见方的绒布进行吸水(以下作为制剂)。给药为封闭涂布,在吸水的绒布上叠加3张硅片并用医疗用医用胶带和伸缩性包带进行固定。在涂布24小时后用浸渍于生理盐水(日本药典生理盐水、大冢生理盐水注射液、Otsuka Pharmaceutical Co.,Ltd.制造)的脱脂棉除去(擦拭)制剂。结束给药部位的观察后进行下面的涂布操作,连续涂布了10天。需要说明的是,在开始第5天时除了涂布部位以外,为了维持海绵框架型的粘接性而利用除毛乳膏进行了除毛。
在给药开始第0天和第10天时采血约2.5mL,在3300rpm、4℃的条件进行15分钟离心分离而得到血浆,对于得到的血浆而言,利用日立自动分析装置(LABOSPECT003)测定总胆固醇量(TC)、HDL胆固醇量(HDL-C)、LDL胆固醇量(LDL-C)和磷脂量(PL)。图4-1~4-4示出该结果。
<4-A>:在制备例1-1中得到的含有匹伐他汀钙的聚合物胶束的浓度以匹伐他汀钙换算成为0.1质量%的方式制备的磷酸盐缓冲液(pH7.4)悬浮液
<4-B>:在制备例1-1中得到的含有匹伐他汀钙的聚合物胶束的浓度以匹伐他汀钙换算成为0.5质量%的方式制备的磷酸盐缓冲液(pH7.4)悬浮液
<4-C>:含有匹伐他汀钙(0.1质量%)的磷酸盐缓冲液(pH7.4)悬浮液
<4-D>:含有匹伐他汀钙(0.5质量%)的磷酸盐缓冲液(pH7.4)悬浮液
<4-E>:磷酸盐缓冲液(pH7.4)
基于图4-1~4-4所示的试验结果,可知的是:含有匹伐他汀钙的聚合物胶束悬浮液(液4-A和4-B)的总胆固醇量、HDL胆固醇量、LDL胆固醇量和磷脂量均得以降低。
另外,如图4-1和图4-3所示,使用含有匹伐他汀钙(0.1质量%)的聚合物胶束悬浮液(液4-A)的情况,与使用含有0.1质量%匹伐他汀钙的磷酸盐缓冲液(液4-C)的情况相比,相同程度地降低了总胆固醇量和LDL胆固醇量。另外,如图4-1、图4-3和图4-4所示,使用含有匹伐他汀钙(0.5质量%)的聚合物胶束(液4-B)的情况,与使用含有0.5质量%匹伐他汀钙的磷酸盐缓冲液(液4-D)的情况相比,降低了总胆固醇量、LDL胆固醇量和磷脂量。
[试验例1-5:使用三维皮肤模型的刺激性试验]
使用以下的<5-A>~<5-G>作为试验物质,通过OECD承认的皮肤刺激性试验专用试剂盒(KURABO公司制造产品编号:EPI-212SIT),按照OECD TG439(In Vitro(体外)皮肤刺激试验),根据以下的步骤实施了试验物质对表皮的暴露和刺激性评价。
在预先进行一夜预培养的试剂盒表皮的角质层一侧添加试验物质30μL,用镊子放置尼龙网而对角质层进行试验物质的暴露。试验物质为固体时(下述<5-E>),向角质层中添加25μL的DPBS,之后立即向角质层中添加固体物质25mg,从而进行对角质层的试验物质的暴露。60分钟后进行清洗,完全除去试验物质后进行42小时的过培养(post-incubation)。培养过程中,经过24小时后进行一次培养基更换。培养后使用MTT法试剂盒(KURABO公司制造产品编号:MTT-100-JP),用MTT溶液反应3小时,提取由线粒体代谢产生的甲月朁染料,测定OD值。基于测定结果,计算出相对于阴性对照(下述<5-G>)的相对存活率。图5示出试验结果。
<5-A>:制备例1-1中得到的含有匹伐他汀钙的聚合物胶束的浓度以匹伐他汀钙换算成为0.5质量%的方式制备的磷酸盐缓冲液(pH7.4)悬浮液
<5-B>:制备例1-1中得到的含有匹伐他汀钙的聚合物胶束的浓度以匹伐他汀钙换算成为1.0质量%的方式制备的磷酸盐缓冲液(pH7.4)悬浮液
<5-C>:含有匹伐他汀钙(0.5质量%)的磷酸盐缓冲液(pH7.4)悬浮液
<5-D>:含有匹伐他汀钙(1.0质量%)的磷酸盐缓冲液(pH7.4)悬浮液
<5-E>:匹伐他汀钙原料药(粉体)
<5-F>:5%SDS溶液;阳性对照
<5-G>:杜氏磷酸盐缓冲生理盐水(DPBS);阴性对照
基于图5所示的试验结果证实了:在使用三维皮肤模型的试验中,使相对存活率依赖于匹伐他汀钙的使用浓度地降低,通过使用含有匹伐他汀钙的聚合物胶束,从而使相对存活率上升。这些结果与兔子累积刺激性评价(上述试验例1-1)的结果相同,通过三维皮肤模型的刺激性评价试验再现了动物实验的结果,通过使药物含在聚合物胶束中带来的皮肤刺激性降低效果利用细胞系得到启示。
[试验例1-6:使用三维皮肤模型的皮肤透过试验]
在带自动取样功能的经皮吸收试验装置(CosMED Pharmaceutical Co.Ltd制造TransView)的立式透过池中固定培养皮肤模型(KURABO公司制造产品编号:EPI-606X;屏障功能增强吸收试验推荐产品)的角质层一侧作为供体侧。作为供体溶液,上述<5-A:以匹伐他汀钙换算成为0.5质量%的方式制备的含有匹伐他汀钙的聚合物胶束的磷酸盐缓冲液(pH7.4)悬浮液>和<5-C:使用含有匹伐他汀钙(0.5质量%)的磷酸盐缓冲液(pH7.4)悬浮液>1.5mL,受体液使用磷酸盐缓冲液(pH7.4)。在2、4、6、8、10、12小时后采集受体溶液0.8mL,补充新的受体溶液0.8mL。用HPLC法测定采集的受体溶液中的药物含量。图6示出测定试验开始后至受体溶液采集为止的时间与药物的累积透过量的关系进行绘图表示的结果。
试验例1-6的结果证实了:在三维皮肤模型中,与使用大鼠腹部皮肤的试验(上述试验例1-2和1-3)相同地,含有匹伐他汀钙的聚合物胶束显示出高的皮肤透过性。另外,基于图6所示的结果,可知的是含有匹伐他汀的聚合物胶束在单独使用匹伐他汀钙时,对皮肤的透过性没有差异。基于以上的结果,可认为在豚鼠药效试验(上述试验例1-4)中,含有匹伐他汀的聚合物胶束显示出与单独使用匹伐他汀钙时同等或者同等以上的药效,是由于两者具有同等的皮肤透过性所致。
[实施例2:卡巴拉汀的皮肤刺激性降低效果]
在实施例2中,作为药物使用作为阿尔茨海默氏痴呆治疗药的卡巴拉汀,进行了有关混合了两亲性聚合物胶束和药物的皮肤外用剂的试验。
[制备例2-1:不含药物的聚合物胶束的制备]
使在合成例1中得到的PSar65-PLLA30 100mg溶解于氯仿40mL中,利用旋转蒸发器减压蒸馏除去氯仿。减压蒸馏除去后向在容器内形成的薄膜中添加纯化水10mL,将容器在85℃热水浴中浸渍20分钟而形成胶束,使用0.2μm PTFE过滤器进行过滤,使滤液冷冻干燥,得到聚合物胶束。
平均粒径:35nm、药物含量:0、回收率:90%以上
[制备例2-2:聚合物胶束与药物的混合液的制备(1)]
在肉豆蔻酸异丙酯(IPM)中添加卡巴拉汀,制备20质量%的溶液(下述1-A)。在该溶液中以浓度成为1质量%(下述1-B)或3质量%(下述1-C)的方式添加在上述制备例2-1中得到的聚合物胶束,制备了聚合物胶束分散在卡巴拉汀溶液中的悬浮液。
[制备例2-3:聚合物胶束与药物的混合液的制备(2)]
在油状的卡巴拉汀原液(下述2-A)中添加在上述制备例2-1中得到的聚合物胶束,对分散性进行确认,发现在相对于卡巴拉汀原液的聚合物胶束的添加量为10质量%以内时,得到了聚合物胶束均匀分散的悬浮液。在本制备例中,相对于卡巴拉汀原液以浓度成为1质量%(下述2-B)、3质量%(下述2-C)、或10质量%(下述2-D)的方式添加在制备例2-1中得到的聚合物胶束,制备了聚合物胶束分散于卡巴拉汀原液中的悬浮液。
[试验例2-1:使用三维皮肤模型的刺激性试验(1)]
作为试验物质使用以下的<1-A>~<1-E>,用与前述的试验例1-5相同的方法,实施了通过皮肤刺激性试验专用试剂盒的对表皮的试验物质的暴露和刺激性评价。图7-1示出相对于阴性对照的相对存活率。
<1-A>:20%卡巴拉汀IPM溶液
<1-B>:制备例2-2中得到的、20%卡巴拉汀IPM溶液1%聚合物胶束悬浮液
<1-C>:制备例2-2中得到的、20%卡巴拉汀IPM溶液3%聚合物胶束悬浮液
<1-D>:5%SDS溶液;阳性对照
<1-E>:DPBS;阴性对照
[试验例2-2:使用三维皮肤模型的刺激性试验(2)]
作为试验物质使用以下的<2-A>~<2-F>,用与前述的试验例1-5相同的方法,实施了通过皮肤刺激性试验专用试剂盒的对表皮的试验物质的暴露和刺激性评价。图7-2示出相对于阴性对照的相对存活率。
<2-A>:卡巴拉汀原液
<2-B>:制备例2-3中得到的、卡巴拉汀1%聚合物胶束悬浮液
<2-C>:制备例2-3中得到的、卡巴拉汀3%聚合物胶束悬浮液
<2-D>:制备例2-4中得到的、卡巴拉汀10%聚合物胶束悬浮液
<2-E>:5%SDS溶液;阳性对照
<2-F>:DPBS;阴性对照
试验例2-1和2-2的结果,卡巴拉汀溶液和卡巴拉汀原液的任一者中,伴随聚合物胶束的添加量增大相对存活率上升。基于这些结果证实了:与在聚合物胶束含有药物的情况(上述实施例1)相同地,在聚合物胶束和药物的混合体系中,降低药物导致的皮肤刺激性。即,可知的是:未包封药物的聚合物胶束通过与药物的组合使用而作为皮肤刺激降低剂发挥作用,通过使聚合物胶束与药物在混合状态下同时存在,从而能够得到降低了皮肤刺激性的皮肤外用剂。
[试验例2-3:使用三维皮肤模型的皮肤透过试验]
将添加了20质量%卡巴拉汀IPM悬浮和2质量%的聚合物胶束的20质量%卡巴拉汀IMP悬浮液作为供体溶液,用与上述试验例1-6相同的方法,实施了皮肤透过试验。作为对照,将卡巴拉汀作为药效成分的市售的皮肤外用贴剂(Novartis Pharma制造Ixellon patch18mg;(面积:1.33cm2))粘贴在培养皮肤模型的角质层一侧,实施了皮肤透过试验。图8示出对从试验开始后至受体溶液采集为止的时间与药物的累积透过量的关系进行绘图表示的结果。
基于图8所示的结果证实了:添加了聚合物胶束的卡巴拉汀溶液与未添加聚合物胶束的卡巴拉汀溶液相比,虽然发现皮肤透过性略有降低的倾向,但与市售的皮肤外用贴剂相比显示出充分高的皮肤透过性,作为皮肤外用剂是有用的。
[实施例3:美金刚的皮肤刺激性降低效果]
实施例3中,作为药物使用作为阿尔茨海默氏痴呆治疗药的美金刚盐酸盐,作为使两亲性聚合物胶束含有药物的皮肤外用剂和皮肤刺激降低剂的两亲性聚合物胶束与皮肤接触后,进行了有关使用药物的形态的试验。
[制备例3-1:含有美金刚的聚合物胶束的制备(52nm)]
使合成例1中得到的PSar65-PLLA30 100mg和美金刚盐酸盐100mg溶解于氯仿50mL中,利用旋转蒸发器减压蒸馏除去氯仿。减压蒸馏除去后向在容器内形成的薄膜中添加纯化水100mL,将容器在85℃热水浴中中浸渍20分钟而形成胶束,使其冷冻干燥,得到含有美金刚盐酸盐的聚合物胶束。
平均粒径:52nm、药物含量:100质量%、回收率:90%以上
[试验例3-1:使用三维皮肤模型的皮肤刺激性试验]
使用OECD承认的皮肤刺激性试验专用试剂盒(KURABO公司制造产品编号:EPI-200SIT),用与前述的试验例1-5相同的方法,对表皮以下述<A>~<E>的水准进行试验物质的暴露,实施了刺激性评价。图9示出相对于阴性对照的相对存活率。
<A>:向角质层中添加25μL的DPBS,之后立即向角质层中添加美金刚盐酸盐(固体)1mg
<B>:向角质层中添加25μL的DPBS,之后立即向角质层中添加在制备例3-1中得到的含有药物的聚合物胶束2mg(相当于药物1mg)
<C>:向角质层中添加25μL的DPBS,之后立即向角质层中添加在制备例2-1中得到的不含药物的聚合物胶束5mg,之后进一步向角质层中添加美金刚盐酸盐(固体)1mg
<D>:向角质层中添加25μL的DPBS,之后立即向角质层中添加在制备例2-1中得到的不含药物的聚合物胶束25mg,之后进一步向角质层中添加美金刚盐酸盐(固体)1mg
<E>:向角质层中添加5%SDS溶液;阳性对照
<F>:向角质层中添加DPBS;阴性对照
如图9所示,<B>:含有美金刚的含有药物的聚合物胶束与<A>:单独使用美金刚的情况相比,相对存活率大幅上升。另外,<C>和<D>:使用聚合物胶束后使用美金刚的情况与<A>:单独使用美金刚的情况相比,相对存活率也大幅上升,证实了皮肤刺激降低效果。基于这些结果,可知通过在使用药物之前使用聚合物胶束,从而聚合物胶束作为皮肤刺激降低剂发挥作用。
[试验例3-2:通过ELISA的IL-1α产生量的定量]
在上述试验例3-1的水准A、B、D、E、F中,采集自过培养起24小时后的培养基上清液,通过市售的白细胞介素(IL)-1αELISA(酶联免疫吸附测定:Enzyme-Linked Immuno Sorbent Assay)试剂盒,进行了培养基上清液中的IL-1α含量(产生量)的测定。需要说明的是,IL-1α是皮肤受到刺激时所产生的细胞因子中的1种。测定结果与相对存活率一同示于图10。
如图10所示,得到了:刺激性试验中相对存活率越高的试样,IL-1α的产生量越小结果。基于这些结果,从皮肤刺激机理的观点出发,证实了通过使用聚合物胶束的皮肤刺激性降低效果。
- 还没有人留言评论。精彩留言会获得点赞!