使用长寿命放射性同位素的实时伽马相机死区时间确定的制作方法
本专利文献要求2014年6月6日提交的序列号为62/008,791的临时美国专利申请在35 U.S.C.下的申请日的权益,所述美国专利申请由此通过引用被并入。
背景技术:
本实施例涉及单光子发射计算机断层扫描(SPECT)。特别地,本实施例涉及SPECT中的死区时间校正。
在SPECT成像期间,检测器电子器件花费时间来执行对发射的检测。在该时段期间,由于检测器电子器件的不可用性,附加的发射没有被检测到。结果,实际的发射可能少计。针对死区时间校正所检测发射的计数。在一种途径中,信号以固定的频率和幅度被输入到检测器电子器件。由于固定的频率,已知数目的信号被输入。由于来自从患者检测发射的死区时间,固定频率信号中的一些没有被检测到。固定频率中检测到的那些与输入数目的比率提供死区时间的度量。来自患者的所检测发射的计数除以所述比率以针对死区时间而进行校正。
由于在电子器件处输入固定频率信号,因此检测器对死区时间的任何贡献被忽略。这促成所重构图像中的不确定性。在定量SPECT中,不确切的校正可能导致不确切的量化。当对具有对应高计数率的治疗同位素进行成像时,不准确性可能更显著。
技术实现要素:
作为介绍,以下描述的优选实施例包括用于针对伽马相机或其它检测器的死区时间确定的方法、系统和非暂时性计算机可读介质。发射的长寿命的点源被定位在固定的位置处使得伽马相机检测来自源的发射而同时还用于检测来自患者的发射。长寿命的点源,在扫描时间中,充当发射的固定频率源,允许包括晶体检测器效应的死区时间校正测量。
在第一方面中,提供了一种用于针对伽马相机的死区时间确定的方法。所述伽马相机从被连接成邻近于伽马相机的放射性同位素源检测计数率,并且在检测所述计数率的同时检测来自患者体内的发射。根据所述计数率来确定死区时间。发射的计数作为死区时间的函数而被计算。
在第二方面中,一种SPECT系统包括被连接以向伽马相机发射辐射的经屏蔽点源。检测电子器件被配置成检测发射,包括来自经屏蔽点源的辐射以及来自患者的放射性同位素发射。处理器被配置成针对检测电子器件的死区时间进行校正,所述校正是来自经屏蔽点源的辐射的实时检测的函数。
在第三方面中,提供了一种用于针对发射检测器的死区时间确定的方法。检测器检测来自患者的第一发射和来自点源的第二发射。第二发射经受来自第一发射的检测的死区时间。处理器根据第二发射的计数而校正第一发射的计数。
本发明由随后的权利要求限定,并且本章节中没有什么应当被理解为对那些权利要求的限制。本发明的另外的方面和优点在以下结合优选实施例而被讨论并且可以稍后独立地或以组合地被要求保护。
附图说明
组件和各图不一定是按比例的,代替地将强调置于说明本发明的原理上。此外,在各图中,同样的参考标号贯穿不同的视图而指明对应的部分。
图1是根据一个实施例的具有死区时间校正的SPECT系统的框图;
图2是具有添加的长寿命点源的准直器和检测器的一个实施例的横截侧视图;以及
图3是用于针对发射检测器的死区时间确定的方法的一个实施例的流程图图解。
具体实施方式
长寿命放射性同位素用于针对伽马相机的实时绝对系统死区时间确定。在患者获取时间时,检测器被暴露于长寿命放射性同位素。来自长寿命放射性同位素的发射是规律的和可分离的,这是由于通过被成像的放射性示踪剂而来自患者体内发射的固定空间位置和不同的发射能量。通过使用长寿命的放射性同位素来测量死区时间,并且针对死区时间而校正来自放射性示踪剂的发射的计数。系统死区时间的实时测量被结合作为来自患者扫描的输入数据的部分,从而测量在获取时间时的真实系统死区时间。
图1示出了用于死区时间校正的单光子发射计算机断层扫描(SPECT)系统10的一个实施例。系统10包括处理器12、存储器14、显示器16、检测器18、检测器电子器件20、和经屏蔽的源26。处理器12、存储器14和/或显示器16是SPECT系统10的部分或者是分离的(例如计算机或工作站)。可以提供附加的、不同的或更少的组件。例如,提供用户输入装置、患者床、或其它SPECT有关的设备。系统的其它部分可以包括功率供给、通信系统和用户接口系统。可以使用任何现在已知或稍后开发的SPECT系统10。作为另一示例,显示器16不被提供。
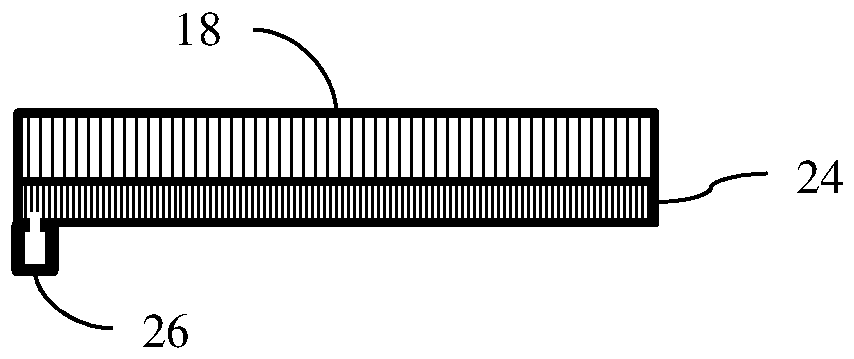
检测器18是与台架(gantry)连接的伽马相机。伽马相机可以包括检测器电路20和检测器18,或仅仅检测器18。伽马相机是平面光子检测器,诸如具有晶体或闪烁体与光电倍增管或其它光学检测器。所述台架绕患者而旋转伽马相机。在患者的扫描期间,利用相机在相对于患者的不同位置或角度处检测发射事件。
检测器18具有任何形状。例如,检测器18在与患者正交的平面上具有方形或矩形检测表面。可以使用其它形状。
参考图2,准直器24被定位成在检测器18前方、与其邻近、或在其附近。准直器24是检测器18的部分或连接到检测器18。准直器24包括铅、钨或者不透伽马辐射或吸收并衰减伽马辐射的其它材料。准直器24包括使来自一些方向(例如更加正交)的伽马辐射通过并且限制来自以其它角度的方向的辐射的孔或其它结构。
相对于检测器18而定位经屏蔽的点源26。经屏蔽的点源26被屏蔽在铅、钨或其它材料中,防止或限制暴露于患者。屏蔽可以在屏蔽中具有孔、窗口、或间隙,以用于允许来自点源26的伽马射线的发射照射在检测器18上。可以使用任何大小的点源26,诸如具有长寿命的放射性同位素的1mm3容器。可以使用线状或其它形状的源。
点源26是长寿命的、经工厂校准的点源。点源26的放射性同位素相对于由患者摄入的或用于从患者发射伽马射线的放射性同位素是长寿命的。如果放射性同位素的半衰期足够长(例如,6个月、1年或更多),那么来自放射性同位素的衰变速率在针对给定患者的患者获取期间基本上是恒定的。点源26的放射性同位素基本上充当固定频率信号,但是是与包括检测器18的整个成像链而不是仅仅信号处理检测器电路或电子器件20交互的一个固定频率信号。用于点源26的一些示例性放射性同位素包括单发射放射性同位素,诸如具有8.9E6Y的T1/2的182Hf、270.4的E-Gamma、和79.0的BR,或者多发射放射性同位素,诸如具有10.55y的T1/2的Ba133、81.0、276.4、和302.9+356.0+383.8keV的E-Gamma、和32.9、7.2和89.3%的对应BR、或具有3.76E10y的T1/2的176Lu、88.3、201.8和306.8的E-Gamma以及14.5、78.0和93.6的对应BR。可以使用其它放射性同位素。
经屏蔽的点源26被连接成以可重复的或已知的定位向检测器18发射辐射。连接是通过焊接、螺栓、闩锁、压合、螺纹化或者与准直器24、检测器18、台架、框架或其它结构的其它连接。经屏蔽的点源26可以被添加到现有的检测器18或准直器24,诸如添加支架以将点源26附连到支承检测器18的框架。经屏蔽的点源26可以被设计成配合准直器24或者是准直器24的部分。例如,在准直器26中形成螺纹孔。经屏蔽的点源26的屏蔽包括匹配螺纹以用于附连。
所述连接定位经屏蔽的点源26使得屏蔽中的孔或窗口指向检测器18。定位使点源26成角度以使伽马发射通过准直器24到检测器18。
点源26被定位在检测器18前方的任何地方。在一个实施例中,点源26被定位在拐角处或可能不会检测到来自患者的许多伽马射线的其它区域。由于准直,检测器18的边缘或拐角可能不太可能检测到来自患者的发射。结果,经屏蔽的点源26不太可能干扰对来自患者22的发射的检测。由于大小,点源26暴露或覆盖检测器18的小部分(例如小于1%)。对着准直器24来放置点源26或者将点源26放置在准直器24中或者使点源26与准直器24间隔开。
检测器电子器件20包括脉冲算术电路、脉冲高度分析器、数字化仪、滤波器、模拟到数字转换器、专用集成电路、现场可编程门阵列、信号处理器、其组合、处理器12、或其它现在已知的或稍后开发的用于对检测器18上每个发射的定位和能量进行检测的电路。处理器可以被提供用于积聚(pile-up)处置。检测器电子器件20接收光电倍增管或检测器18的其它光检测器的输出并且输出定位、时间和能级。检测器电子器件20可以包括阈函数、滤波器或用于由于不可解析的积聚或能量不在针对放射性同位素的预期窗口或范围中而拒绝发射的其它处理。
检测器电子器件20检测发射,包括来自经屏蔽的点源26的辐射以及来自患者22的放射性同位素发射。在患者获取期间使用放射性同位素标记(即点源26)用于死区时间确定不需要对检测器电子器件20的任何修改。检测器电子器件20可以应用不同的能量范围滤波器来在来自点源26和患者22的发射之间进行区分。例如,用于患者的放射性同位素是具有以140keV的发射的峰值能量的Tc-99m,并且点源26使用具有以270.4keV的发射的峰值能量的182Hf。通过检测如在140keV的10%或其它范围内的能量,来自患者的发射被检测到。通过检测如在270.4keV的10%或其它范围内的能量,来自点源26的发射被检测到。检测器电子器件20或其它处理器针对给定能量范围而对发射的数目进行计数。计数是绝对计数或计数率(即,每单位时间的发射的数目)。点源26的放射性同位素的能量与患者22体内使用的放射性同位素的能量可分离或可区分。具有范围外的能量的发射不被计数或被丢弃。
在针对患者22的扫描会话期间发生通过检测器18和检测器电子器件20的检测。患者22被定位在SPECT系统10的台架内或SPECT系统10的床上。为了患者体内的成像摄取,检测器18检测来自患者22的发射。从有限源(即患者22)中的任何位置发生发射。患者体内的放射性示踪剂迁移到与特定生物化学反应相关联的特定类型的组织或位置、与所述组织或位置连接或者以其它方式在所述组织或位置处集中。结果,从该类型的组织或反应的位置发生更大量的发射。例如,放射性示踪剂被设计成与葡萄糖摄取、脂肪酸合成或其它新陈代谢过程的位置链接。在针对SPECT成像的给定实例的一个扫描约定和/或放射性示踪剂的摄入或注入期间发生给定的成像会话。
在一个实施例中,检测器电子器件20执行积聚分离。发射可以足够快速地顺序发生使得来自一个发射的能量可以导致稍后的发射看似具有较高能量。通过分出发射并且计及积聚,可以更准确地确定以所期望能量的发射,而不丢弃应当维护的实际发射。由于使用来自不同能量的发射(例如来自患者22和点源26),因此积聚处理可以变更死区时间的计算。在一个实施例中,变更是可接受的。在另一实施例中,积聚处理不被使用。代替地,在没有积聚分离的情况下操作检测器电子器件20。使用完全整合(fully integrated)的模式(即,基于能量来检测而不尝试计及来自其它发射的能量尾)。
处理器12是通用处理器、数字信号处理器、图形处理单元、专用集成电路、现场可编程门阵列、数字电路、模拟电路、其组合、或用于处理发射信息的其它现在已知或稍后开发的设备。处理器12是单个设备、多个设备或网络。对于多于一个设备,可以使用处理的并行或顺序划分。构成处理器12的不同设备可以执行不同的功能,诸如一个处理器(例如专用集成电路或现场可编程门阵列)用于重构并且另一个用于针对死区时间校正发射计数。在一个实施例中,处理器12是控制处理器或SPECT系统10的其它处理器。在其它实施例中,处理器12是分离的工作站或计算机的部分。
处理器12依据所存储的指令来操作以执行本文中描述的各种动作,诸如执行图3的动作38、44和46。处理器12由软件、固件、和/或硬件来被配置以执行、控制执行和/或接收从图1的动作中的任何或全部动作所产生的数据。
在一个实施例中,处理器12被配置成针对检测器电子器件20的死区时间进行校正。在检测处理期间,检测器电子器件20(处理器12可以是其部分)引起延迟。在延迟期间发生的任何发射不被处理或不被检测到。这种纳秒或微秒的延迟是死区时间。为了针对死区时间进行校正,处理器12确定对所发生的但是由于死区时间而没有被检测到的发射的百分比或数目进行表示的缩放因子(scaling factor)。基于所述缩放因子来增加所检测发射的计数。
在一个实施例中,处理器12使用对来自经屏蔽点源26的辐射的实时检测来用于校正。使用来自经屏蔽点源26的发射的计数。由于这些发射被检测而同时还执行操作来用相同检测器检测来自患者的发射,所以来自点源26的发射经受检测器电子器件20的死区时间。点源26以规律或已知的速率生成发射,因此在来自患者的发射的计数期间发射的数目是已知的。
可替换地,来自点源26的发射的数目在当不存在死区时间的另一时间被测量,诸如在校准SPECT系统10之后但是没有体模或患者的情况下(例如在每个月度校准之后)。当没有来自患者体内的放射性示踪剂的发射的时候测量来自点源26的发射。通过对计数进行测量而不是使用假定的计数,由于未对准所引起的效应或其它变量更有可能被包括在计数中。在没有死区时间的情况下来自检测器18的所假定或测量的计数被存储在存储器14中以供在死区时间校正中使用。
处理器12计算在患者的扫描期间在给定时间段中点源26发射的数目与当不存在死区时间时的发射的数目的比率。该比率指示缩放因子。所述比率指示由于死区时间缺失了什么百分比的实际发射,使得所检测的计数可以增加以计及死区时间。在患者获取期间来自点源26的计数率与当不存在死区时间时的计数率的比率提供缩放因子。由于所述比率取决于患者扫描期间的测量,因此所述比率是在患者获取时的系统死区时间的实时度量。在其它实施例中,使用与比率不同的函数。
处理器12被配置成对来自患者22的发射的计数进行缩放。任何或所有计数被缩放,诸如针对检测器上每个位置的计数。通过缩放因子来对计数进行缩放。在有和没有死区时间的情况下来自点源26的计数的比率用于对来自患者的计数进行缩放。在有和没有死区时间的情况下来自患者的发射的计数的比率与来自点源26的比率相同。在没有死区时间的情况下来自患者的计数是未知的,所以在具有死区时间的情况下来自患者的发射的计数除以来自点源的发射的比率。对于除了比率之外的函数,使用用于调整或增加来自患者的发射的计数的乘法或其它函数。通过基于来自点源26的辐射的发射的数目而对来自患者的放射性示踪剂发射的计数进行加权,提供了更准确的计数。
对于给定的成像会话,使用单个校正。可替换地,针对不同的时段、诸如相对于患者的检测器18的不同定位来计算所述比率或缩放因子。基于针对该相应时段所测量的权重来校正针对每个时段的计数。
使用处理器12或另一处理器的SPECT系统10被配置成通过向所校正的计数应用系统矩阵或前向投影来重构所成像的容积。来自患者的发射,其针对死区时间被校正,在重构中被使用。任何重构可以用于估计患者体内的放射性浓度。SPECT系统10从存储器14或缓冲器中访问所检测的发射事件来重构。基于来自检测器上不同位置的发射仓(bin)的经校正的计数,处理器12被配置成作为患者体内的位置的函数来计算特定的摄取值(SUV)。通过利用针对患者22体内的放射性同位素的剂量来对如由计数所表示的放射性浓度进行归一化而计算一个或多个位置处的SUV。可替换地,没有SUV的放射性浓度被用于重构中。
所检测的发射事件、其它功能信息、或其它扫描数据被存储在存储器14中。数据以任何格式来被存储。存储器14是缓冲器、高速缓存、RAM、可移除介质、硬驱动器、磁性的、光学的、数据库或其它现在已知或稍后开发的存储器。存储器14是单个设备或者两个或多个设备的群组。存储器14是SPECT系统10的部分或远程工作站或数据库,诸如PACS存储器。
存储器14可以存储在处理的不同阶段的数据,诸如在没有死区时间的情况下来自点源26的计数和计数时段、在患者扫描期间的计数和时段、表示来自患者的所检测发射的没有进一步处理的原始数据(例如能量和位置)、在重构之前的经滤波或阈值化的数据、经重构的数据、经滤波的重构数据、系统矩阵、前向投影信息、投影数据、阈值、将显示的图像、已经显示的图像、或其它数据。存储器14或不同的存储器存储所述比率或其它缩放因子以用于针对死区时间进行校正。存储器14或不同的存储器存储来自患者的发射的经校正的计数。为了处理,数据绕过存储器14,被临时存储在存储器14中,或从存储器14被加载。
存储器14附加地或可替换地是具有处理指令的非暂时性计算机可读存储介质。存储器14存储对经编程的处理器12可执行的指令进行表示的数据。用于实现本文中所讨论的过程、方法和/或技术的指令被提供在非暂时性计算机可读存储介质或存储器(诸如高速缓存、缓冲器、RAM、可移除介质、硬驱动器、或其它计算机可读存储介质)上。计算机可读存储介质包括各种类型的易失性和非易失性存储介质。在图中图示的或本文中所述的功能、动作或任务响应于计算机可读存储介质中或其上存储的一个或多个指令集而被执行。功能、动作或任务独立于指令集、存储介质、处理器或处理策略的特定类型并且可以由单独或以组合而操作的软件、硬件、集成电路、固件、微代码等等来执行。同样地,处理策略可以包括多重处理、多重任务化、并行处理等等。在一个实施例中,指令存储在可移除介质设备上用于被本地或远程系统读取。在其它实施例中,指令存储在远程位置中用于通过计算机网络或在电话线路上传递。在还其它的实施例中,指令被存储在给定的计算机、CPU、GPU或系统内。
显示器16是CRT、LCD、等离子体屏幕、投影仪、打印机或用于示出图像或量的其它输出设备。显示器16显示经重构的患者容积的图像,诸如作为位置的函数而示出放射性浓度。患者的组织的摄取函数(例如SUV)可以被表示在图像中。多平面重构、3D再现、或横截面成像可以用于根据所重构容积的体元来生成图像。可替换地或附加地,由处理器12所得到的任何量可以被显示,诸如SUV和/或SUV中的改变。可以确定其它量,诸如针对区域的平均SUV或放射性浓度,在预定单位容积中的最大SUV、峰值SUV,放射性浓度中的变化,或总SUV。图像值或量基于已经通过使用点源26实时针对死区时间而校正的计数。
图3示出了用于针对伽马相机或其它发射检测器的死区时间确定的方法的一个实施例。死区时间被确定并且用于校正定性和/或定量SPECT中的发射计数。死区时间的实时度量用于校正来自患者的所检测发射的数目。方法适用于对给定患者的给定扫描。
所述方法通过图1的系统、图2的布置、二者或其它系统和布置来实现。处理器执行动作38-46。伽马相机或检测器以及检测器电子器件执行动作30-36。长寿命的源用于执行动作30、32和34。放射性示踪剂用于执行动作32和36。其它设备或材料可以被使用或控制以执行各种动作中的任一个。
可以执行附加的、不同的或更少的动作。例如,在其中来自长寿命源的发射的数目被假定或模拟的情况下不执行动作30。作为另一示例,不提供动作44和/或46。在其它示例中,提供与定位患者、配置SPECT扫描仪和/或SPECT成像有关的动作。动作以所示的次序或不同的次序来被执行。
在动作30中,检测来自长寿命源的发射。伽马相机或其它检测器对来自通过检测器所定位的经屏蔽的源的发射进行检测。作为校准或其中来自其它放射性同位素的发射没有同样被检测到的其它时间的部分,来自长寿命源的发射被检测到。随时间的计数或发射速率被确定。在检测器和电子器件不经受死区时间的时候做出所述确定。发射被测量以建立用于长寿命源的基线计数率。在可替换的实施例中,来自长寿命源的计数率被假定或模拟。计数率被存储并且稍后从存储器中加载。
在动作32中,在患者的扫描期间检测发射。在扫描期间,伽马相机或其它检测器检测来自任何源的发射。发射来自长寿命的源和来自患者体内的放射性同位素。在相对于检测器的拐角或其它定位处检测到来自长寿命的源的发射。通过安置经屏蔽的源来将发射指向检测器,可以检测发射。患者体内的放射性同位素是注入或摄入的液体示踪剂。在患者的扫描期间检测来自不同放射性同位素的发射。
在患者扫描期间来自两个源的发射经受死区时间。长寿命的源可以周期性地生成发射,但是具有足够的间隔来避免检测中的死区时间。来自患者体内的放射性同位素的发射可能不太规律并且可能以时间上可变量的间隔而发生。由于来自患者的发射,来自患者的其它发射和/或来自长寿命源的发射可能由于死区时间而没有被检测到。检测器和检测电子器件缺失了来自两个源的一些发射。
在其中患者被扫描的时间期间(即当患者被定位用于扫描时),实时检测发射。在发生来自患者和长寿命源的发射时,检测到至少一些发射。
能量对来自不同源的发射进行区分。检测电子器件对不同范围内的能量进行阈值化或窗口化。一个范围被提供用于检测来自患者体内的放射性同位素的发射。另一范围被提供用于检测来自长寿命的源的发射。能量范围不重叠,从而允许在发射的源之间进行区分。发射的计数和/或计数率由检测器和检测电子器件针对每个源分别测量。
伽马相机,诸如伽马相机的检测电子器件,以完全整合的模式而操作。对于SPECT,完全整合的模式避免积聚处理。发射要么在能量窗口中要么不在能量窗口中,而不是在积聚处理的情况下分出发射。如果多个发射积聚,那么发射中的一个或多个可能被检测为具有在感兴趣的一个或多个范围外的能量。结果,在没有积聚处理的情况下不对发射进行计数。通过以完全整合的模式进行操作,避免在来自以不同能量的源的发射之间进行区分。可替换地,提供积聚处理。
动作32在图3中被表示为包括动作34和36。附加的、不同的或较少的动作可以被提供用于在患者扫描期间检测发射。动作34和36以任何次序、以持续或重复的方式被执行。
在动作34中,检测来自长寿命的源的发射。所述源被定位成邻近于伽马相机。伽马相机检测发射。通过具有是患者体内的放射性同位素(例如以小时或天数的半衰期)至少10倍的半衰期(例如以月或年的半衰期),结果得到的发射可以被当作在患者扫描上的固定频率信号。
处理器或检测电子器件针对来自长寿命的源的发射而确定计数和/或计数率。计算发射的数目或某个时段上的数目。
在动作36中,检测来自患者体内的发射。随着患者体内的放射性同位素衰变,发射伽马辐射。伽马相机检测所述发射。
所述检测发生在检测来自长寿命的源的发射的同时。发射可以发生在相同时间或不同时间。每个所检测的发射导致死区时间。在死区时间中发生的任何随后的或后续的发射不被检测到。对发射的检测在患者扫描期间继续,其中一些发射缺失。
在动作38中,来自患者的发射的一个或多个计数被校正。处理器增加所述计数以计及在死区时间期间发生的发射。由于死区时间期间的发射没有被检测到,所以代替地校正依赖于在经受相同死区时间的时候来自长寿命的源的发射的计数或计数率。在不经受任何死区时间的时候的计数或计数率也可以被使用。针对检测器上的每个不同定位的计数被校正。
如图3中表示的动作38包括动作40和42。附加的、不同的或更少的动作可以被执行以基于动作30-36的检测来进行校正。
在动作40中,基于动作34的检测,根据来自长寿命的源的计数或计数率来确定死区时间。死区时间是在其期间检测不能发生的时间与总体相比的比率或百分比。在一个实施例中,计算动作34的计数或计数率(例如来自长寿命的源的、经受死区时间的计数)与动作30的计数或计数率(例如来自长寿命的源的、不经受死区时间的计数)的比率。该比率指示死区时间对于扫描或计数来自患者的发射的总体时间的相对量。所述比率部分地依赖于利用对来自患者的发射的检测的实时度量或检测。
在动作42中,在动作36中所检测的发射的计数被校正。动作36中所检测的发射经受由于死区时间所致的少计。为了更准确地反映实际发射的数目,增加计数。来自长寿命的源的比率指示少计的量。通过将所述计数除以所述比率,处理器校正所述计数。计数被增加以计及很可能或可能在死区时间期间缺失的发射。可以使用通过基于动作34的检测的缩放因子来增加计数的其它函数。
在动作44中,处理器计算放射性浓度。经校正的计数用于估计在患者体内的给定位置或区域处的放射性。放射性浓度可以是针对给定位置的发射的数目或经校正的计数。作为通过SPECT系统的重构的部分而确定已经接收了液体放射性示踪剂的患者体内的放射性浓度。在将放射性示踪剂摄入或注入患者体内之后,相对于检测器来定位患者和/或相对于患者来定位检测器。随着时间而检测来自患者体内的放射性示踪剂的发射。为了确定患者体内发生发射的位置,所检测的发射,其针对死区时间而被校正,被重构到对象空间中。
为了重构,通过使用系统矩阵或前向投影来重构放射性浓度(例如定量SPECT)。根据所检测的发射来重构容积或图像数据中发射的分布。可以作为计算机断层扫描中的重构的部分来估计针对每个位置(例如体元)的摄取数量或量。SPECT系统估计针对不同位置的所注入的放射性药物或示踪剂的放射性浓度。在定量SPECT中,目标是估计被注入到患者体内并分布在患者体内的示踪剂(即同位素)以kBq/ml的放射性浓度。
重构是迭代的并且包含成像形成物理学模型作为定量重构的先决条件。图像形成模型包括所检测的数据(例如,经校正的计数)、系统矩阵或前向投影、同位素性质(例如剂量值)和/或生物学。系统矩阵或前向投影表示系统的力学性质,但是可以包括其它信息(例如,如由SUV所表示的患者重量和注入时间)。
重构包括投影算子,所述投影算子能够模拟给定的SPECT系统或SPECT类。任何现在已知或稍后开发的重构方法可以被使用,诸如基于最大似然期望最大化(ML-EM)、定序子集期望最大化(OSEM)、惩罚加权最小二乘法(PWLS)、最大后验(MAP)、多模态重构、NNLS、或另一途径。
可以计算特定的摄取值(SUV)。放射性浓度表示在每个位置处的摄取量。该摄取量是所发射的辐射的度量,因此不针对被提供给患者的辐射剂量而被归一化。结果,比较来自不同时间的摄取可能并不有用,除非提供相同的剂量。通过计算SUV,提供针对剂量而归一化的摄取,从而允许不同度量的比较。
在动作46中,生成SPECT图像。在重构中使用经校正的计数。在其中不提供定量SPECT的情况下,可以在没有SUV和/或放射性浓度计算的情况下使用经校正的计数。为了定量或定性SPECT,经校正的计数用于作为位置的函数来重构发射。来自不同位置的发射的相对量被重构。
对经重构的发射分布进行成像。可以使用任何成像,诸如从表示分布的体元中提取平面表示。可以生成多平面重构。在一个示例中,执行表面再现或使用投影的三维再现。结果产生的三维表示被显示在二维屏幕上。
虽然以上已经参考各种实施例而描述了本发明,但是应当理解的是,在不偏离本发明的范围的情况下可以做出许多改变和修改。因此意图的是,前述详细描述被视为说明性的而不是限制性的,并且理解到是以下权利要求、包括所有等同物意图限定本发明的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!