微过氧化物酶用于治疗碳氧血红蛋白血症的用途的制作方法
本申请要求2014年5月22日提交的申请号为62/001,754的美国专利申请的权益,该申请在此通过引用全文纳入本申请。
技术领域
本申请公开内容涉及能够以高亲和力结合一氧化碳的微过氧化物酶,及其用于治疗碳氧血红蛋白血症和一氧化碳中毒的用途。
致谢政府支持
本发明是政府支持下做出的,该政府支持的授权号是HL103455,由美国国立卫生研究院授予。政府对本发明享有一定的权利。
背景技术:
对一氧化碳的吸入暴露是环境中毒的主要原因。个体可能在多种情况下暴露于空气中的一氧化碳,例如房屋火灾、使用发电机、或屋内使用户外烧烤架、或在封闭空间中运行汽车的自杀尝试期间。一氧化碳在细胞中结合血红蛋白(产生碳氧血红蛋白)和血红素蛋白,特别是呼吸传输链的酶。结合至血红蛋白和其它血红素蛋白的一氧化碳的累积损害了氧化磷酸化作用的氧输送和氧利用。这最终导致重要器官——如大脑和心脏——的严重缺氧和缺血性损伤。在其血液中累积大于15%的碳氧血红蛋白的个体具有脑损伤和神经认知功能障碍的风险。含有更高水平的碳氧血红蛋白的个体具有死亡的风险。存活的含有非常高水平的碳氧血红蛋白的患者通常会遭受不可逆的脑损伤和脑死亡。
尽管利用标准动脉和静脉血气分析以及共血氧饱和度的方法可以快速诊断一氧化碳中毒,尽管意识到一氧化碳中毒的危险因素,但是对于这种有毒暴露没有可用的解毒剂。当前疗法是由面罩给予100%的氧气,并且尽可能地使病人暴露于高压氧气。高压氧气疗法的机制是氧气会增加一氧化碳从血红蛋白和组织的释放速率,并加速一氧化碳的自然清除。然而,这种治疗只对一氧化碳的清除速率具有不太大的作用,并且基于高压氧气设备的复杂性,这种疗法无法在现场使用。
发明概要
需要一种有效的、快速的和容易获得的疗法治疗碳氧血红蛋白血症(也称为一氧化碳中毒)。本申请公开了微过氧化物酶能够以高亲和力结合一氧化碳(CO)并从血红蛋白中取代CO,从而作为CO的清除剂发挥作用。本申请所公开的数据表明,分离或重组的微过氧化物酶可以用在例如从血液或动物组织的血红蛋白中除去一氧化碳的方法中,以及用在治疗碳氧血红蛋白血症的方法中。
本申请提供了一种治疗受试者的碳氧血红蛋白血症的方法,该方法选择具有碳氧血红蛋白血症的受试者,并向受试者施用治疗有效量的分离或重组的微过氧化物酶,其中所述微过氧化物酶包括结合至卟啉部分的肽。在一些实施方案中,所述肽的氨基酸序列包括CXXCH(SEQ ID NO:1),其中X是任何天然的或非规范的氨基酸。
本申请进一步提供了一种从血液或组织的血红蛋白中除去一氧化碳的方法,该方法使血液或组织与分离或重组的微过氧化物酶相接触,其中所述分离或重组的微过氧化物酶包括结合至卟啉部分的肽。在一些实施方案中,所述肽的氨基酸序列包括CXXCH(SEQ ID NO:1),其中X是任何天然的或非规范的氨基酸。在一些实施方案中,该方法是体外方法。在其它实例中,该方法是体内方法,其中使血液或组织与分离或重组的微过氧化物酶相接触包括向受试者施用该分离或重组的微过氧化物酶。
本申请还提供了确定分离或重组的微过氧化物酶的有效性的方法。
根据参照附图进行的下面的详细说明,本申请的前述和其它目的、特征和优点将更加显而易见。
附图的简要说明
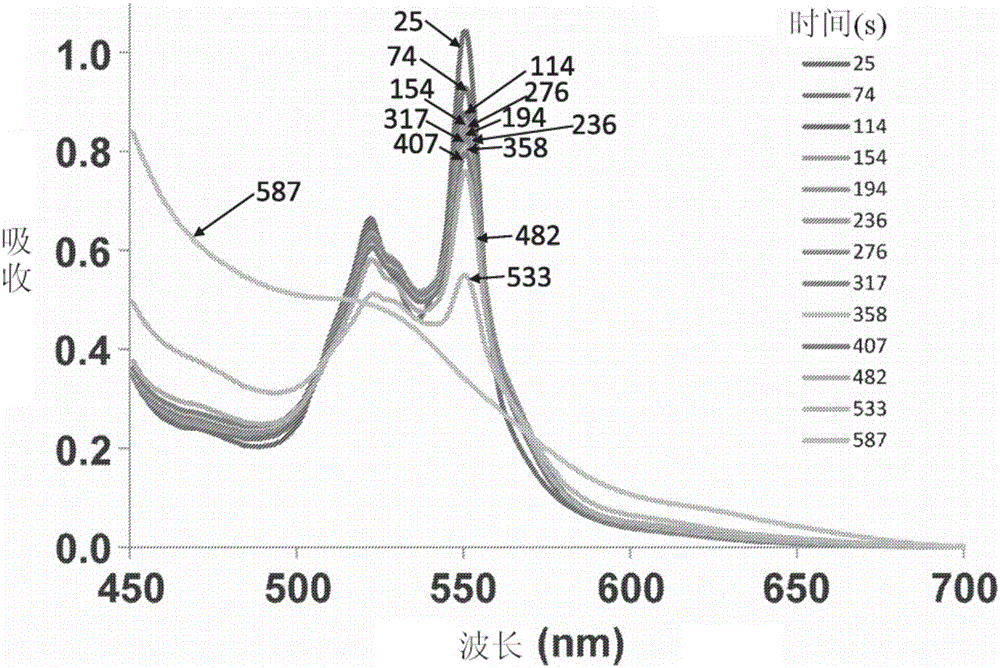
图1:脱氧-MP11从红细胞(RBC)中清除CO。该图显示了在与CO饱和的红细胞(RBC-CO)混合后,微过氧化物酶-11(MP11)的光谱的吸收变化。MP11与RBC-CO混合,并在不同的时间点(25-587秒)上从反应混合物中提取样品。MP11通过离心从RBC中提纯。该光谱展示了脱氧-MP11(峰值在520和550nm)衰减形成CO结合的MP11。
图2:MP11介导的从RBC中清除CO的动力学。在511nm处的吸收衰减后监测CO结合MP11的速率。每个数据点(*)表示所选择的时间点测量值,实线表示单指数衰减拟合。
图3:CO饱和的红细胞与MP11的混合导致CO从血红蛋白至MP11的净转移。数据点表示混合后在选定时间点上CO结合的(圆圈)或脱氧(*)血红蛋白的相对量。实线表示单指数方程的拟合。
序列表
如37C.F.R.1.822所定义的,在所附的序列表中列出的氨基酸序列使用标准的三字母代码表示氨基酸。序列表作为ASCII文本文件提交,创建于2015年4月28日,3.10KB,其通过引用纳入本申请。在所附的序列表中:
SEQ ID NO:1是能够结合卟啉部分的微过氧化物酶的氨基酸基序;在该序列中,Xaa是任何天然的或非规范的氨基酸。
SEQ ID NO:2和3是在所公开的方法中使用的重组微过氧化物酶的代表性氨基酸共有序列;在这些序列中,Xaa是任何天然的或非规范的氨基酸。
SEQ ID NO:4是微过氧化物酶-11(MP11)的肽部分的氨基酸序列。
SEQ ID NO:5是微过氧化物酶-6(MP6)的肽部分的氨基酸序列。
SEQ ID NO:6是微过氧化物酶-8(MP8)的肽部分的氨基酸序列。
SEQ ID NO:7是微过氧化物酶-9(MP9)的肽部分的氨基酸序列。
SEQ ID NO:8是微过氧化物酶-17(MP17)的肽部分的氨基酸序列。
SEQ ID NO:9是衍生自人细胞色素c的肽的氨基酸序列。
SEQ ID NO:10是衍生自马细胞色素c的肽的氨基酸序列。
详细说明
I.缩写
CO 一氧化碳
Hb 血红蛋白
HbA 血红蛋白A
HbCO 碳氧血红蛋白
MP 微过氧化物酶
RBC 红细胞
RBC-CO 一氧化碳饱和的红细胞
II.术语和方法
除非另有说明,否则技术术语按照常规用法使用。分子生物学中常用术语的定义可见Benjamin Lewin,Genes V,Oxford University Press出版,1994(ISBN 0-19-854287-9);Kendrew等(编),The Encyclopedia of Molecular Biology,Blackwell Science Ltd.出版,1994(ISBN 0-632-02182-9);和Robert A.Meyers(编),Molecular Biology and Biotechnology:a Comprehensive Desk Reference,VCH Publishers,Inc.出版,1995(ISBN 1-56081-569-8)。
为了方便理解本申请的各实施方案,下面提供了具体术语的解释:
施用:通过任何有效途径向受试者提供或给予药剂,例如治疗剂(如微过氧化物酶)。示例性的施用途径包括,但不限于,注射或输注(如皮下、肌内、皮内、腹膜内、鞘内、静脉内、脑室内、纹状体内、颅内和进入脊髓),口服、导管内、舌下、直肠、透皮、鼻内、阴道和吸入途径。
解毒剂:中和或抵消毒药作用的药剂。
一氧化碳(CO):一种无色、无臭且无味的气体,在浓度足够高时遇到对人类和动物是有毒的。在正常的动物新陈代谢中也产生低水平的CO。
碳氧血红蛋白(HbCO):一氧化碳(CO)和血红蛋白(Hb)的稳定络合物,当CO在正常的新陈代谢期间被吸入时或产生时在红细胞中形成碳氧血红蛋白。
碳氧血红蛋白血症或一氧化碳中毒:在血液中过量一氧化碳的存在导致的病症。通常,暴露于100每百万份(ppm)或更高的CO足以引起碳氧血红蛋白血症。轻度的急性CO中毒的症状包括头晕、精神错乱、头痛、眩晕和流感状效应;较大的暴露可导致中枢神经系统和心脏的明显中毒,甚至死亡。在急性中毒后,经常出现长期后遗症。一氧化碳也可对孕妇的胎儿产生严重影响。长期暴露于低水平的一氧化碳可导致抑郁、精神错乱和记忆丧失。一氧化碳主要通过在血液中与血红蛋白结合形成碳氧血红蛋白(HbCO)而在人体中引起不良影响。这阻止氧气结合血红蛋白,降低血液的携氧能力,导致缺氧。此外,认为肌红蛋白和线粒体细胞色素氧化酶也被不利地影响。碳氧血红蛋白可以还原为血红蛋白,但因为HbCO络合物相当稳定,恢复需要时间。目前的治疗CO中毒的方法包括施用100%的氧气或提供高压氧气疗法。
接触:以直接的物理关联方式放置;包括固体和液体形式。在体内方法的上下文中使用时,“接触”还包括施用。
血红蛋白(Hb):在脊椎动物和其它动物的血液的红细胞中的含铁的运输氧的金属蛋白。在人类中,血红蛋白分子是四种球状蛋白质亚基的集合。每个亚基由与非蛋白血红素基团紧密关联的蛋白质链构成。每个蛋白质链在球蛋白折叠排列中排成一组相互连接的α-螺旋结构片段,称作“球蛋白折叠排列”是因为这种排列与其它血红素/球蛋白中使用的折叠基序相同。这种折叠模式包括强烈结合血红素基团的口袋。
异源:异源蛋白质或多肽是指衍生自不同来源或物种的蛋白质或多肽。
分离的:“分离的”生物组分(例如核酸分子、蛋白质或细胞)已经基本上从该生物组分在其中自然存在的生物体本身或生物体的细胞、血液或组织的其它生物组分中分开或纯化出来,例如其它染色体和染色体外DNA和RNA、蛋白质和细胞。已经“分离的”核酸分子和蛋白质包括通过标准纯化方法纯化的那些。该术语还包括在宿主细胞中通过重组表达制备的核酸分子和蛋白质,以及化学合成的核酸分子和蛋白质。
金属离子:具有净电荷的分类是金属(如过渡金属)的任何原子元素。在本申请的上下文中,卟啉部分的金属离子通常(但不排他地)具有净正电荷2+或3+。示例性的金属离子包括二价铁离子(Fe2+)和三价铁离子(Fe3+)。
微过氧化物酶(MP):具有两个半胱氨酸残基的小肽,它共价结合至卟啉部分。微过氧化物酶通过细胞色素c蛋白水解或通过人工合成获得。
非规范的氨基酸:不是在自然界中发现的并由遗传密码直接编码的20种标准氨基酸的任何氨基酸。“非规范”的氨基酸也被称为“非标准”或“非天然”的氨基酸。
肽或多肽:聚合物,其中单体是氨基酸残基,它们通过酰胺键连接在一起。当氨基酸是α-氨基酸时,无论是L-光学异构体或是D-光学异构体都可以使用,优选的是L-异构体。本申请所用的术语“肽”、“多肽”或“蛋白质”意在涵盖任何氨基酸序列并且包括经修饰的序列,包括经修饰的球蛋白。术语“肽”和“多肽”是特别意在涵盖天然存在的蛋白质,以及通过重组或合成产生的蛋白质。
保守氨基酸取代是指,当发生取代时,对原蛋白质的性质干扰最少,即蛋白质的结构和特别是功能是保守的并且通过这种取代没有显著的改变。保守取代的实例如下表所示。
保守取代一般维持(a)多肽骨架在取代区域的结构,例如片状或螺旋的构象,(b)分子在目标位点的电荷或疏水性,或(c)侧链的体积。
一般预期使蛋白质性质产生最大变化的取代是非保守的,例如下列变化——其中:(a)亲水性残基,例如丝氨酸或苏氨酸,取代(或被……取代)疏水性残基,例如亮氨酸、异亮氨酸、苯丙氨酸、缬氨酸或丙氨酸;(b)半胱氨酸或脯氨酸取代(或被……取代)任何其它残基;(c)具有正电性侧链的残基,例如赖氨酸、精氨酸或组氨酸,取代(或被……取代)负电性残基,例如谷氨酸或天冬氨酸;或(d)具有大体积侧链的残基,例如苯丙氨酸,取代(或被……取代)不具有侧链的残基,例如甘氨酸。
药学上可接受的载体:使用的药学上可接受的载体是常规的。Remington’s Pharmaceutical Sciences,by E.W.Martin,Mack Publishing Co.,Easton,PA,15th Edition,1975描述了适用于本申请公开的组合物的药学输送的组合物和制剂。通常,载体的性质取决于所采用的具体施用模式。除了生物学上中性的载体,待施用的药物组合物可含有少量的无毒辅助物质,如润湿剂或乳化剂、防腐剂和pH缓冲剂等,例如乙酸钠或脱水山梨醇单月桂酸酯。
卟啉:含四个吡咯环的有机化合物,作为血红蛋白、叶绿素和某些酶中的金属结合辅助因子起作用。
原卟啉:不含金属的卟啉。原卟啉是四吡咯,其含有以下侧链-甲基(4)、丙酸(2)和乙烯基(2)。原卟啉结合例如二价铁以在血红蛋白和肌红蛋白中形成血红素基团,并且结合三价铁以在过氧化氢酶和某些细胞色素中形成血晶素基团。
原卟啉IX:辅基(如血红素和细胞色素c)的前体。原卟啉IX与二价铁(Fe2+)结合形成血红蛋白的血红素。
重组:重组核酸或蛋白质是具有非天然存在的序列或具有人工组合两个原本分开的序列片段得到的序列的重组核酸或蛋白质。人工组合通常是通过化学合成或通过人工操作核酸的分离片段,例如通过基因工程技术,而完成。术语重组包括通过添加、取代或除去天然核酸分子或蛋白质的一部分而改变的核酸或蛋白质。
序列同一性/相似性:两个或更多个核酸序列之间,或两个或更多个氨基酸序列之间的同一性,由术语序列之间的同一性或相似性来表述。序列同一性可以用同一性百分比来量度;百分比越高,序列越相同。序列相似性可以用相似性百分比(其考虑保守氨基酸取代)来量度;百分比越高,序列越相似。在使用标准方法比对时,核酸或氨基酸序列的同系物或直系同源物具有相对较高的序列同一性/相似性。当直系同源蛋白质或cDNA衍生自更密切相关的物种(如人和小鼠的序列)时,与更远相关的物种(如人类和线虫的序列)相比,同源性更显著。
用于比较的序列比对方法在本领域中是公知的。多种程序和比对算法描述于Smith&Waterman,Adv.Appl.Math.2:482,1981;Needleman&Wunsch,J.Mol.Biol.48:443,1970;Pearson&Lipman,Proc.Natl.Acad.Sci.USA 85:2444,1988;Higgins&Sharp,Gene,73:237-44,1988;Higgins&Sharp,CABIOS 5:151-3,1989;Corpetet al.,Nuc.Acids Res.16:10881-90,1988;Huang et al.Computer Appls.in the Biosciences 8,155-65,1992;和Pearson et al.,Meth.Mol.Bio.24:307-31,1994中。Altschul et al.,J.Mol.Biol.215:403-10,1990提供了详细考虑的序列比对方法和同源性计算法。
NCBI基本局部比对搜索工具(BLAST)(Altschul et al.,J.Mol.Biol.215:403-10,1990)是可从几个来源得到,包括国家生物信息中心(NCBI)和互联网,该工具可与序列分析程序blastp、blastn、blastx、tblastn和tblastx联合使用。更多信息可以在NCBI网站上找到。
受试者:活的多细胞生物体,包括脊椎动物生物体——一个包括人类和非人类哺乳动物的类别。
合成:通过人工装置在实验室中产生,例如合成多肽可以是在实验室中化学合成的。
治疗有效量:化合物或组合物(例如分离或重组的微过氧化物酶)的量,足以在所治疗的受试者上实现所需的效果。例如,这可以是清除在血液或组织中的一氧化碳、降低血液中的HbCO水平、和/或减轻一个或多个与一氧化碳中毒有关的体征或症状所必需的量。
过渡金属:一种元素,其原子具有部分充满的d子壳,或其可产生具有不完整d子壳的阳离子。周期表的d区中列出了过渡金属。过渡金属包括,例如,铁、钴、镍、铜、锌、钯、银、镉、钪、钛、钒、铬、锰、钇、锆、铌、钼、锝、钌、铑、铪、钽、钨、铼、锇、铱、铂、金、汞、钅卢(rutherfordium),钅杜(dubnium),钅喜(seaborgium),钅波(bohrium),钅黑(hassium)和序麦(meitnerium)。
除非另有说明,本申请的所有的技术和科学术语具有与本申请公开内容所属领域的技术人员的通常理解的相同的含义。单数术语“一”(“a”,“an”)和“该”(“the”)也可以理解为复数的,除非上下文另有明确的说明。“包括A或B”的意味着包括A、或B、或A和B。进一步地,可以理解针对核酸或多肽给出的所有碱基大小和氨基酸大小,以及所有分子重量或分子质量值都是近似值,而且是为说明的目的而提供的。尽管与本申请所述的内容类似或等同的方法和材料可以在本申请公开内容的实践或测试中使用,但合适的方法和材料是如下所述的。本申请提及的所有出版物、专利申请、专利和其他参考文献都通过引用全文纳入本申请。在冲突的情况下,以本申请说明书——包括术语解释——为准。另外,材料、方法和实施例仅是说明性的,而不是限制性的。
III.详细说明
需要一种有效的、快速的和容易获得的疗法来治疗碳氧血红蛋白血症(包括CO中毒)。本申请公开了微过氧化物酶能够以高亲和力结合一氧化碳(CO)并从血红蛋白中取代CO,从而作为CO清除剂发挥作用。本申请公开的方法涉及分离或重组的微过氧化物酶从血液或组织的血红蛋白中除去一氧化碳的用途,以及其用于治疗碳氧血红蛋白血症(或CO中毒)的用途。
A.治疗碳氧血红蛋白血症或一氧化碳中毒的方法
本申请提供了一种治疗受试者的碳氧血红蛋白血症的方法,包括选择具有碳氧血红蛋白血症的受试者,和向受试者施用治疗有效量的分离或重组的微过氧化物酶,其中所述分离或重组的微过氧化物酶包括结合(如共价结合)至卟啉部分的肽。所述肽可以是线状的或环状的。
在一些实施方案中,所述肽的氨基酸序列包括CXXCH(SEQ ID NO:1),其中X是任何天然的或非规范的氨基酸。在一些实例中,所述肽的氨基酸序列包括X(1-20)CXXCH(SEQ ID NO:2)或X(1-20)CXXCHX(1-20)(SEQ ID NO:3),其中X是任何天然的或非规范的氨基酸。在具体的非限制性实例中,所述肽的氨基酸序列包括VQKCAQCHTVE(SEQ ID NO:4),这是MP11肽的序列。在一个实例中,所述肽的氨基酸序列由VQKCAQCHTVE(SEQ ID NO:4)组成。在其它实例中,所述肽的氨基酸序列包括CAQCHT(SEQ ID NO:5),CAQCHTVE(SEQ ID NO:6)、KCAQCHTVE(SEQ ID NO:7)、CKACHMVQAPDGTDIVK(SEQ ID NO:8)、GDVEKGKKIFIMKCSQCHTVE(SEQ ID NO:9)或GDVEKGKKIFVQKCAQCHTVE(SEQ ID NO:10),或由这些序列组成。在另外的其它实例中,所述肽的氨基酸序列包括具有1、2、3、4或5个氨基酸取代的SEQ ID NO:4-10的任一个。
微过氧化物酶的卟啉部分包括金属离子。在一些实施方案中,该金属是过渡金属。在一些实例中,过渡金属是铁、锌、钯、锰、钴、铜、镍或镉。在一个非限制性的实例中,过渡金属是铁。例如,在一些情况下,金属铁是二价铁(Fe2+)。
在一些实施方案中,卟啉部分包括原卟啉IX。在一些实例中,原卟啉IX包括铁离子,例如Fe2+。在其它实例中,铁被替换为另一过渡金属,例如,但不限于,锌、钯、锰、钴、铜、镍或镉。
在一些情况下,选择肽的氨基酸组成和/或卟啉部分的过渡金属离子,以改变微过氧化物酶的一种或多种性质。例如,可进行对氨基酸序列和/或金属离子的修饰以降低过氧化物酶活性、提高疏水性或亲水性(以增加血浆半衰期或生物利用度)、和/或稳定血红素结合。此外,可以选择特定的氨基酸以允许环肽的生成。
在一些实施方案中,受试者在其血液中具有至少3%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%或至少50%的碳氧血红蛋白(HbCO)(相对于总血红蛋白)。用于测量HbCO方法,例如分光光度法或色谱法,是本领域公知的(参见,例如美国专利申请公布号2003/0202170;Rodkeyet al.,ClinChem 25(8):1388-1393,1979;Barker et al.,Anesthesiology105(5):892-897,2006)。
在一些实施方案中,分离或重组的微过氧化物酶是通过静脉输注施用的。
在一些实施方案中,向受试者施用的微过氧化物酶的剂量是约1克至约300克,例如约10克至约100克、约10克至约50克、约30克至约300克、或约30克至约150克。在具体的实例中,向受试者施用的微过氧化物酶的剂量是约1、约10、约20、约30、约40、约50、约60、约70、约80、约90、约100、约125、约150、约175、约200、约225、约250或约300克。
向受试者施用的分离或重组的微过氧化物酶可以是单一剂量,或是根据需要的多剂量形式,以使HbCO降至无毒的水平。
在一些实施方案中,向受试者施用的剂量是在受试者的血液和/或组织中减少HbCO至少1%、至少2%、至少3%、至少4%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、或至少90%(相对于治疗前的HbCO水平)所需的分离或重组的微过氧化物酶的量。
B.从血红蛋白中除去一氧化碳的方法
本申请还提供了从血液或动物组织的血红蛋白中除去一氧化碳的方法,包括使血液或组织与分离或重组的微过氧化物酶相接触,其中所述分离或重组的微过氧化物酶包括共价结合至卟啉部分的肽。本申请进一步提供了减少在血液或动物组织中的碳氧血红蛋白(HbCO)的方法,包括使血液或组织与分离或重组的微过氧化物酶相接触,其中所述分离或重组的微过氧化物酶包括共价结合至卟啉部分的肽。该肽可以是线状的或环状的。制备环肽的方法是本领域公知的(例如见美国专利申请公开号2013/0310265;2012/0122799;和2011/0256567)。
在该方法的一些实施方案中,所述肽的氨基酸序列包括CXXCH(SEQ ID NO:1),其中X是任何天然的或非规范的氨基酸。在一些实例中,所述肽的氨基酸序列包括X(1-20)CXXCH(SEQ ID NO:2)或X(1-20)CXXCHX(1-20)(SEQ ID NO:3),其中X是任何天然的或非规范的氨基酸。在具体的非限制性实例中,所述肽的氨基酸序列包括VQKCAQCHTVE(SEQ ID NO:4),这是微过氧化物酶-11(MP11)的序列。在一个实例中,所述肽的氨基酸序列由VQKCAQCHTVE(SEQ ID NO:4)组成。在其它实例中,所述肽的氨基酸序列包括CAQCHT(SEQ ID NO:5)、CAQCHTVE(SEQ ID NO:6)、KCAQCHTVE(SEQ ID NO:7)、CKACHMVQAPDGTDIVK(SEQ ID NO:8)、GDVEKGKKIFIMKCSQCHTVE(SEQ ID NO:9)或GDVEKGKKIFVQKCAQCHTVE(SEQ ID NO:10),或由这些序列组成。在另外的其它实例中,所述肽的氨基酸序列包括具有1、2、3、4或5个氨基酸取代的SEQ ID NO:4-10的任一个。
微过氧化物酶的卟啉部分包括金属离子。在一些实施方案中,该金属是过渡金属。在一些实例中,过渡金属是铁、锌、钯、锰、钴、铜、镍或镉。在一个非限制性的实例中,过渡金属是铁。例如,在一些情况下,金属铁是二价铁(Fe2+)。
在一些实施方案中,卟啉部分包括原卟啉IX。在一些实例中,原卟啉IX包括铁离子,例如Fe2+。在其它实例中,铁被替换为另一过渡金属,例如,但不限于,锌、钯、锰、钴、铜、镍或镉。
在一些情况下,选择肽的氨基酸组成和/或卟啉部分的过渡金属离子,以改变微过氧化物酶的一种或多种性质。例如,可进行对氨基酸序列和/或金属离子的修饰以降低过氧化物酶活性、提高疏水性或亲水性(以增加血浆半衰期或生物利用度)、和/或稳定血红素结合。此外,可以选择特定的氨基酸以允许环肽的生成。
在一些实施方案中,从血液或组织的血红蛋白中除去一氧化碳的方法,或减少在血液或组织中的HbCO的方法,是体外方法。
在一些实施方案中,从血液或组织的血红蛋白中除去一氧化碳的方法,或减少在血液或组织中的HbCO的方法,是体内方法,其中使血液或组织与分离或重组的微过氧化物酶相接触,包括向受试者施用所述分离或重组的微过氧化物酶。
在一些实施方案中,在治疗前受试者的血液中具有至少3%、至少5%、至少10%、至少15%或至少20%、至少30%、至少40%或至少50%的碳氧血红蛋白(HbCO)。
在一些实施方案中,分离或重组的微过氧化物酶是通过静脉输注施用的。
在一些实施方案中,向受试者施用的微过氧化物酶的剂量是约1克至约300克,例如约10克至约100克、约10克至约50克、约30克至约300克、或约30克至约150克。在具体的实例中,向受试者施用的微过氧化物酶的剂量是约1、约10、约20、约30、约40、约50、约60、约70、约80、约90、约100、约125、约150、约175、约200、约225、约250或约300克。
向受试者施用的分离或重组的微过氧化物酶可以是单一剂量,或是根据需要的多剂量形式,以使HbCO降至无毒的水平。
在一些实施方案中,向受试者施用的剂量是在受试者的血液和/或组织中减少HbCO至少1%、至少2%、至少3%、至少4%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、或至少90%(相对于治疗前的HbCO水平)所需的分离或重组的微过氧化物酶的量。
C.微过氧化物酶的生产和合成
微过氧化物酶由共价结合至卟啉部分——例如血红素——的肽组成,并且可以由天然存在的c型细胞色素衍生得到(Braun and-Meyer,Proc Natl Acad Sci USA 101(35):12830-12835,2004)。微过氧化物酶的肽链包括基序CXXCH(SEQ ID NO:1)。微过氧化物酶的卟啉部分通过硫醚链接到半胱氨酸侧链上的方式,与肽共价结合(Speeet al.,Eur J Biochem241:215-220,1996)。
微过氧化物酶可以由c型细胞色素的蛋白水解消化生成。通过蛋白水解消化生成微过氧化物酶(如MP6、MP8、MP9、MP11、MP17和MP50)的方法先前已有描述(参见,例如Speeetal.,Eur JBiochem 241:215-220,1996;Rusvaiet al.,Biochem Pharmacol 37:4574-4577,1988;Nakamura et al.,Tetrahedron Lett 33:5409-5412,1992;Adams et al.,Biometals 7:214-220,1994;Aron et al.,J Inorg Biochem 27:227-243,1986)。MP6、MP8、MP9、MP11和MP50,其分别具有6、8、9、11和50个氨基酸的肽链,已由马心脏细胞色素c衍生得到;MP17(具有17个氨基酸的肽),已由多能硫杆菌(Thiobacillus versutus)的细胞色素c550生成(Speeet al.,Eur J Biochem241:215-220,1996)。MP6、MP8、MP9、MP11和MP17肽的氨基酸序列如下所述:
MP6-CAQCHT(SEQ ID NO:5);
MP8-CAQCHTVE(SEQ ID NO:6);
MP9-KCAQCHTVE(SEQ ID NO:7);
MP11-VQKCAQCHTVE(SEQ ID NO:4);
MP17-CKACHMVQAPDGTDIVK(SEQ ID NO:8)。
本申请公开内容还预期使用替代的微过氧化物酶肽序列,例如下面所述的:
GDVEKGKKIFIMKCSQCHTVE(SEQ ID NO:9)
GDVEKGKKIFVQKCAQCHTVE(SEQ ID NO:10)。
SEQ ID NO:9和SEQ ID NO:10分别衍生自人和马的细胞色素c。这些肽具有比SEQ ID NO:4的MP11肽更长的N-末端部分。在一些实施方案中,SEQ ID NO:9和SEQ ID NO:10在细菌中生成,例如大肠杆菌。
生成重组微过氧化物酶的生物合成方法也有描述(参见Braun and-Meyer,Proc NatlAcadSci USA 101(35):12830-12835,2004)。Braun和-Meyer描述了一种人工微过氧化物酶的体内合成方法,该方法利用大肠杆菌的分泌和细胞色素c成熟装置。
在细菌中,c型细胞色素作为具有N-末端信号序列的多肽前体被合成,用于通过通用蛋白质II型分泌系统(Sec)输出至周质。在易位后,用引导肽酶处理可溶性c型细胞色素(-Meyer and Künzler,Eur J Biochem246:794-799,1997)。血红素与c型细胞色素的共价连接发生在细胞质膜的周质侧。在大肠杆菌中,该工艺需要八个细胞色素c成熟蛋白质(CcmA-H)(-Meyeret al.,J Bacteriol 177:4321-4326,1995;Grove et al.,Mol Microbiol 19:467-481,1996)。在Braun和-Meyer描述的系统中,含有CXXCH(SEQ ID NO:1)基序的小肽在大肠杆菌周质中表达,并且使用组成式表达ccmA-H操纵子的质粒实现血红素的共价连接,从而提供了一种生成在肽的氨基酸序列中发生变化的重组微过氧化物酶的方式。
微过氧化物酶,如MP8、MP9和MP11,也是市售可购的,如购自Sigma-Aldrich(St.Louis,MO)。
D.测试分离或重组的微过氧化物酶的有效性的方法
本申请还提供了测试分离或重组的微过氧化物酶的从血液或组织中除去HbCO的有效性的方法(也称为从血液或组织中清除CO,例如从血液或组织的RBC血红蛋白中清除)。在一些实施方案中,该方法包括使分离或重组的微过氧化物酶与HbCO相接触(如接触含CO饱和的红细胞的样品)持续一段时长,该时长足以允许CO向微过氧化物酶的转移,并且测量HbCO随时间的变化和/或脱氧-Hb随时间的变化。HbCO随时间的减少和/或脱氧-Hb随时间的增加,表明重组微过氧化物酶在从血液或组织中除去HbCO方面是有效的。在一些实例中,HbCO的减少(和/或脱氧-Hb的增加))是约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%或约90%。
在其它实施方案中,所述方法包括使分离或重组的微过氧化物酶与HbCO(如CO饱和的红细胞)接触持续一段时长,该时长足以允许CO向微过氧化物酶(MP)的转移,并且测量脱氧-MP随时间的变化和/或CO结合的MP随时间的变化。脱氧-MP随时间的减少和/或CO结合的MP随时间的增加,表明重组微过氧化物酶在从血液或组织中除去HbCO方面是有效的。在一些实例中,脱氧MP的减少(和/或CO结合的MP的增加)是约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%或约90%。
在一些实例中,足以允许CO转移至微过氧化物酶的时长是约30秒、约1分钟、约2分钟、约3分钟、约4分钟、约5分钟、约6分钟、约7分钟、约8分钟、约9分钟或约10分钟。在一些实例中,HbCO、脱氧HB、脱氧MP和/或CO结合的MP随时间的变化是通过分光光度法测量的,例如通过检测在HbCO与微过氧化物酶接触后微过氧化物酶光谱的吸收变化。
提供以下实施例用于说明某些具体特征和/或实施方案。这些实施例不应被解释为将本申请公开内容限制于所描述的具体特征或实施方案。
实施例
实施例1:用微过氧化物酶从RBC血红蛋白中除去CO
进行研究以确定微过氧化物酶是否能够从红细胞中清除CO。按照如下方案进行:
1.一氧化碳饱和的红细胞(RBC-CO)和微过氧化物酶-11(MP11)在10mM连二亚硫酸盐的存在下进行结合,得到50μM血红蛋白A(HbA)和约100μM MP11的最终浓度。
2.取0.3mL的体积,微离心5秒。
3.取上清液,并放入空的微管中。
4.将含有10mM连二亚硫酸盐和0.5%NP40的PBS加入RBC颗粒中。
5.重复步骤2-4,直至所有的反应体积耗尽。
6.立即测量在NP40/PBS中的RBC的吸收,然后测量上清液样品(以相同的顺序离心得到)的吸收。
在与RBC-CO混合之后MP11光谱的吸收变化如图1所示。光谱表明脱氧MP11衰减形成CO结合的MP11。在511nm处的吸收衰减后监测CO结合MP11的速率。MP11介导的从红细胞中清除CO的动力学如图2所示。在与脱氧MP11混合后,血红蛋白物质在选定时间点(0、2、4、6、8和10分钟)的变化如图3所示。脱氧Hb随时间的增加(和相应的HbCO随时间的减少)表明,CO-饱和的红细胞与MP11的混合导致CO从血红蛋白向MP11的净转移。因此,这些结果表明MP11从RBC血红蛋白中清除CO。
实施例2:用分离或重组的微过氧化物酶治疗受试者的方法
本实施例描述了分离或重组的微过氧化物酶用于治疗患有碳氧血红蛋白血症(或CO中毒)的人类受试者的用途。
选择被诊断患有或怀疑患有碳氧血红蛋白血症的受试者进行治疗。向受试者施用治疗有效量的分离或重组的微过氧化物酶,例如通过静脉输注施用。在一些实例中,微过氧化物酶是MP11,人类受试者被施用10-100克的MP11。在其它实例中,微过氧化物酶是重组的微过氧化物酶,人类受试者被施用30-300克的重组的微过氧化物酶。医疗从业者可以确定合适的治疗剂量,并根据需要调整,以有效地降低受试者的HbCO。可以测量受试者的HbCO水平,以确定已施用有效剂量。可以根据需要提供额外的剂量,以减少HbCO至可接受的水平(例如对于吸烟者≤5%或对于吸烟者≤15%)。
鉴于本发明的原理可应用于许多可能的实施方案,应当认识到,所举例说明的实施方案仅是本发明的优选实施例,而不应被视为对本发明范围的限制。相反地,本发明的范围由下面的权利要求限定。因此,我们要求将这些权利要求的范围和主旨所涵盖的所有实施方案作为本发明进行保护。
序列表
<110> 高等教育联邦系统-匹兹堡大学
<120> 微过氧化物酶用于治疗碳氧血红蛋白血症的用途
<130> 8123-92829-02
<150> US 62/001,754
<151> 2014-05-22
<160> 10
<170> PatentIn版本3.5
<210> 1
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<220>
<221> MISC_特征
<222> (2)..(3)
<223> Xaa = 任何天然的或非规范的氨基酸
<400> 1
Cys Xaa Xaa Cys His
1 5
<210> 2
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<220>
<221> MISC_特征
<222> (1)..(1)
<223> Xaa = 天然的或非规范的氨基酸的1-20个残基的任意组合
<220>
<221> MISC_特征
<222> (3)..(4)
<223> Xaa = 任何天然的或非规范的氨基酸
<400> 2
Xaa Cys Xaa Xaa Cys His
1 5
<210> 3
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<220>
<221> MISC_特征
<222> (1)..(1)
<223> Xaa = 天然的或非规范的氨基酸的1-20个残基的任意组合
<220>
<221> MISC_特征
<222> (3)..(4)
<223> Xaa = 任何天然的或非规范的氨基酸
<220>
<221> MISC_特征
<222> (7)..(7)
<223> Xaa = 天然的或非规范的氨基酸的1-20个残基的任意组合
<400> 3
Xaa Cys Xaa Xaa Cys His Xaa
1 5
<210> 4
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 4
Val Gln Lys Cys Ala Gln Cys His Thr Val Glu
1 5 10
<210> 5
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 5
Cys Ala Gln Cys His Thr
1 5
<210> 6
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 6
Cys Ala Gln Cys His Thr Val Glu
1 5
<210> 7
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 7
Lys Cys Ala Gln Cys His Thr Val Glu
1 5
<210> 8
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 8
Cys Lys Ala Cys His Met Val Gln Ala Pro Asp Gly Thr Asp Ile Val
1 5 10 15
Lys
<210> 9
<211> 21
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 9
Gly Asp Val Glu Lys Gly Lys Lys Ile Phe Ile Met Lys Cys Ser Gln
1 5 10 15
Cys His Thr Val Glu
20
<210> 10
<211> 21
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 10
Gly Asp Val Glu Lys Gly Lys Lys Ile Phe Val Gln Lys Cys Ala Gln
1 5 10 15
Cys His Thr Val Glu
20
- 还没有人留言评论。精彩留言会获得点赞!