用于递送皮肤护理用活性成分的透明组合物和方法与流程
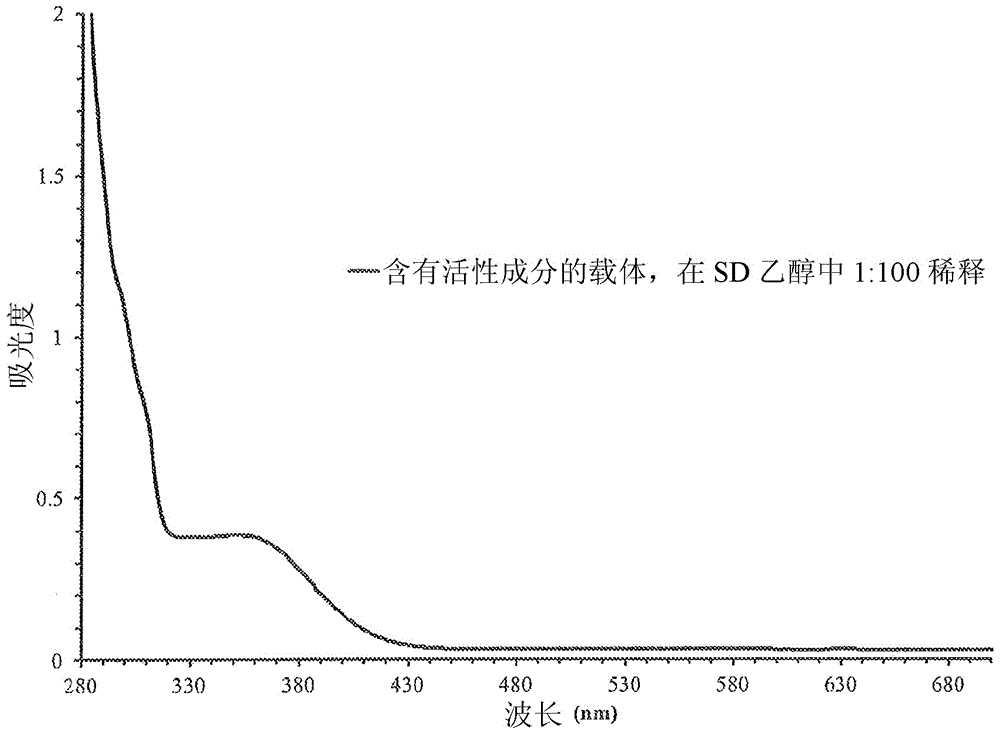
本申请要求2014年6月4日提交的美国临时申请系列号62/007,837的权益,其通过引用以其全部并入本文。发明领域在一些实施方案中,本发明涉及可用于皮肤护理的组合物和方法。发明背景用于局部递送活性成分的制剂必须同时处理多种挑战。皮肤的不可渗透性是公知的,其中角质层充当针对病原体和有毒的环境化学品的屏障。最佳的制剂可能具有以下能力:溶解宽范围的疏水性和亲水性活性成分,提高活性成分向皮肤中的渗透性,并表现出消费者感兴趣的最佳物理性质,如,例如理想的蒸发速率和在皮肤上的非油腻感觉。已经进行了许多尝试以使得皮肤病学媒介物在美学上更可接受。但是,使用消费者和患者偏爱的载体的能够溶解和递送亲水性和疏水性化合物的混合物的制剂的开发具有挑战性。在一些情况下,不提供疏水性和亲水性化合物在光学透明组合物中的溶解性的制剂、载体和媒介物可能在商业上不太合意。此外,不提供穿越皮肤,特别是穿过角质层的良好渗透性的制剂、载体和媒介物在一些情况下也可能在商业上不太合意。需要可用于递送疏水性和亲水性活性成分两者的产品组合物,其中载体的性质不产生油腻或油性的感觉和/或其中该活性成分甚至当皮肤润湿时也具有良好的保留性,并且,其此外可允许方便和有效地治疗或预防多种皮肤病症和化妆需要。发明概述在一个实施方案中,产品组合物包含载体组合物,该载体组合物包含(a)浓度为该产品组合物的40重量%至70重量%的挥发性硅酮,(b)浓度为该产品组合物的10重量%至30重量%的有机醇,和(c)浓度为该产品组合物的1重量%至10重量%的根据式I的化合物其中R1和R2独立地选自异丙基、丙基和乙基,并且其中n为1至6,并且其中该载体组合物是光学透明的液体。在一个实施方案中,该产品组合物附加地包含本文中所限定的活性成分。在一个实施方案中,方法包括改善人的皮肤紧实度(skinfirmness)、改善人的皮肤含水度(skinhydration)、降低人的平均细纹面积、降低人的皮肤皱纹平均面积和/或改善人的皮肤透明度,该方法包括将光学透明的液体产品组合物局部施用于人的皮肤。附图简述当结合附图阅读时将更好地理解前述概要以及本发明的以下详述。图1例示了该载体组合物的设计。图2例示了载体组合物(“载体”)、根据表5中给出的配方E制备的产品组合物(“含有活性成分的载体”)以及根据表5中给出的配方E制备但添加了1%的水的产品组合物(“含有1%的外加水的含有活性成分的载体”)、添加了1.5%的水的产品组合物(“含有1.5%的外加水的含有活性成分的载体”)和添加了2%的水的产品组合物(“含有2%的外加水的含有活性成分的载体”)的可见光透射光谱。图3例示了根据表5中给出的配方E制备并在特殊变性乙醇中以1∶100体积/体积稀释的产品组合物(“含有活性成分的载体,在SD乙醇中1∶100稀释”)的UV-可见光吸收光谱。图4例示了根据表5中给出的配方E制备的组合物(标记为4的溶液)和根据表5中给出的配方E制备但添加了1%的水的组合物(标记为6的溶液)、添加了1.5%的水的组合物(标记为7的溶液)和添加了2%的水的组合物(标记为8的溶液)的照片。发明详述在本文的公开内容中,描述了用于递送皮肤护理用活性成分的组合物和方法。本文中所用的术语“产品组合物”指的是适于用作施加于患者或受试者的皮肤或粘膜区域的化妆品或药物组合物的组合物。本文中涉及百分比或其它量所用的术语“按重量计”可以指的是基于重量/重量(例如%w/w)的组分浓度或基于%重量/体积(例如%w/v)的组分浓度。本文中所用的术语“活性成分”指的是适于递送至患者或受试者的皮肤或粘膜区域的分子、化合物或物质,包括分子、化合物或物质的混合物。本文中所用的术沿活性成分还指的是可以提供更健康的皮肤外观的药物、生物活性、天然或化妆品物质。如本文中所用,活性成分可以包括化妆品成分、改善皮肤的外观和/或质地的成分、生物活性成分、用于治疗或预防疾病或病症的药物活性成分、以及用于改善产品的消费者感知的成分。如本文中所用,活性成分可以包括化妆优雅的、不油腻的润肤剂,其显著提高了其它活性成分穿过人皮肤的递送,并还可以改善该成分在获得更健康皮肤、外表更健康的皮肤和/或外表光滑的皮肤方面的效力,并且其还可以提供优异的使用者依存性。如本文中所用,活性成分可以包括提供如下益处的物质:减少的眼周皱纹、没有老年斑的色调均匀的皮肤、更紧实、更光滑的皮肤质地、毛孔尺寸缩小、皮肤的保湿和水化、更柔软和更有弹性的皮肤感觉、减轻炎症的镇静作用、痤疮的预防和治疗、以及皮肤外观的美白和/或增白。活性成分也被称为活性剂。本文中所用的术语载体和载体组合物均指的是用于递送活性成分的组合物的基本组分。在一些实施方案中,该载体组合物还可以被认为是该活性成分的溶剂。寻求递送亲水性和疏水性化合物的混合物的许多递送体系使用高浓度的有机溶剂,如乙醇或异丙醇,例如如美国专利号4,826,828中所述。此类递送体系通常使用>35重量%的乙醇,如美国专利申请公开号2013/0310355A1中所述,其通过引用以其全部并入本文。不受本申请中任何理论的束缚,申请人在美国专利申请公开号2013/0310355A1中已经注意到这样大的乙醇浓度导致提高的皮肤刺激和干燥,并可能导致患者的非最佳使用和消费者满意度缺乏。美国专利申请公开号2013/0310355A1描述了用于不可溶于硅酮油的包括维生素A的活性剂的递送体系。该递送体系包含至少50重量%的乙基三硅氧烷(1,1,1,3,5,5,5-七甲基-3-乙基三硅氧烷)和小于15重量%的挥发性媒介物,如小于15重量%的全氟己烷、五氟丙烷、全氟己烷、全氟萘烷、甲氧基九氟丁烷、二硅氧烷、挥发性高分子量烃(如异十二烷)、乙醇或异丙醇。不受本申请中任何理论的束缚,申请人在美国专利申请公开号2013/0310355A1中已经注意到使用大量的乙基三硅氧烷产生在施加时引起不合意的皮肤干燥的产品。在一些实施方案中,产品组合物包括用于向皮肤局部递送水溶性活性成分和水不溶性活性成分两者的组合物和方法。一些实施方案包括用于具有减轻的干燥、刺激或炎症的成分的最佳递送的组合物和方法。该成分可以包括例如类视黄醇、抗菌剂、α-羟基酸、β-羟基酸、抗生素、含水植物提取物、保湿剂、皮肤镇静剂、皮肤再生剂、维生素A、B、C、D和E、皮质类固醇、抗炎化合物、皮肤美白成分、用于防护紫外辐射的防晒剂、皮肤平滑剂和用于皮肤的其它活性成分。一些实施方案包括包含用于递送疏水性和亲水性成分的光学透明载体的组合物。一些实施方案包含包括以下步骤的方法:将光学透明载体或本文中描述的产品组合物倾倒在衬垫(pad)上并将该衬垫施加至皮肤以实现该组合物中所需成分的递送,由此解决至少一种皮肤病症(例如通过提高外观或通过治疗该病症)。一些实施方案包括预防和/或治疗皮肤病症或疾病的方法。其它实施方案包括预防和/或治疗痤疮的方法。其它实施方案包括减少皮肤瑕疵、减少皮肤变色、降低平均细纹面积、降低皮肤皱纹平均面积、改善皮肤紧实度、改善皮肤含水度、改善皮肤透明度和/或通过提供上述结果之一的外观的方法。在一个实施方案中,本公开包括用于向皮肤局部递送水溶性活性成分和水不溶性成分(例如活性成分)的组合物和方法。在一个实施方案中,本公开包括用于向皮肤优化递送类视黄醇化合物、α-羟基酸、β-羟基酸、天然成分、防腐剂(antisepticagent)、抗菌剂、抗生剂、抗炎剂、抗病毒剂、抗真菌剂、防晒剂、皮肤美白剂、植物提取物、维生素、皮质类固醇、局部麻醉剂、其它生物活性成分、颜料和/或改善或改变产品的消费者感知的成分的组合物和方法。在另一实施方案中,本公开包括用于以减轻的干燥、刺激或炎症向皮肤优化递送含水植物提取物、保湿剂、皮肤镇静剂、皮肤再生剂和其它成分的组合物和方法。在一个实施方案中,本公开包括使用透明载体来递送疏水性和亲水性成分的组合物和方法。在另一实施方案中,本公开提供了包括将该透明载体倾倒在衬垫上和使用该衬垫将该溶液施加至皮肤的方法。一个实施方案包括制备用于向皮肤递送活性成分的无水产品组合物,其基本不含粘土、淀粉、多糖或纤维素作为无水体系中油类的替代物。在一个实施方案中,获得了有干燥感觉的产品组合物,其不会受困于活性成分向皮肤中的不佳渗透。在一些实施方案中,粘土、淀粉、多糖或纤维素以少量使用。在一些实施方案中,更大的量可以导致诸如粘性、糊状特性以及颗粒团聚的最终产品性质。在一个实施方案中,产品组合物以3重量%至30重量%的水平包含淀粉。在一个实施方案中,产品组合物以7.5重量%的水平包含淀粉。在一个实施方案中,产品组合物以10重量%的水平包含淀粉。在一个实施方案中,产品组合物包含无水的、疏水的“干燥流动”淀粉。合适的淀粉也描述在美国专利号4,894,222中,其公开内容通过引用并入本文。另一实施方案包括制备用于向皮肤递送活性成分的无水产品组合物,其基本不含矿物油、矿脂、以及动物和植物脂肪和油类作为皮肤病学媒介物或化妆品载体。另一实施方案包括制备用于向皮肤递送活性成分的无水产品组合物,其基本不含软膏、乳膏或洗剂。在一个实施方案中,获得了有干燥感觉的产品组合物,其不会受困于消费者所体验的油腻感觉。在一些实施方案中,更大量的作为皮肤病学媒介物或化妆品载体的矿物油、矿脂以及动物和植物脂肪和油类可导致最终产品表现出油腻的感觉。在一个实施方案中,产品组合物以0重量%至90重量%的水平包含矿物油。在一个实施方案中,产品组合物以1重量%至10重量%的水平包含矿物油。在一个实施方案中,产品组合物以7重量%的水平包含矿物油。合适的矿物油也描述在美国专利号4,894,222中,其公开内容通过引用并入本文。如本文中其它地方详细阐述的那样,已经发现,根据本文中体现的方法施用于受试者的本文中描述的产品组合物的实施方案提供了对皮肤病症和其它疾病的治疗的令人惊讶的功效,并且还展示了溶解疏水性和亲水性活性成分的预料不到的能力。在一个实施方案中,存在配置用于施加至皮肤的产品组合物。该产品组合物可以是液体和/或无色的。载体载体组合物(也称为载体)的设计描绘在图1中。在一些实施方案中,此处公开的产品组合物包含载体组合物。该载体组合物可以用作本文中所述的组合物的基本组分。该载体组合物可以提供媒介物,活性成分由此被溶解和递送至皮肤。该载体组合物还可以被称为皮肤护理组合物的“基底”、“媒介物”或“运输媒介物”。在本文中所述的产品组合物的实施方案中,在一个实施方案中,该载体组合物提供递送该活性成分的手段。在一个实施方案中,此处公开的产品组合物包含载体组合物,其中按重量计该载体组合物构成该产品组合物的至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。在一个实施方案中,此处公开的产品组合物包含载体组合物,其中该载体组合物构成该组合物的至少85重量%至90重量%。在另一实施方案中,组合物包含载体组合物,其中该载体组合物构成该产品组合物的至少90重量%至95重量%。在另一实施方案中,产品组合物包含载体组合物,其中该载体组合物构成该组合物的至少95重量%至99重量%。在另一实施方案中,产品组合物包含载体组合物,其中该载体组合物构成该组合物的至少90重量%至93重量%。在另一实施方案中,产品组合物包含载体组合物,其中该载体组合物构成该组合物的至少93重量%至97重量%。在另一实施方案中,产品组合物包含载体组合物,其中该载体组合物构成该组合物的至少97重量%至99重量%。示例性载体可以包含至少一种有机醇。合适的有机醇包括例如乙醇、特殊变性(SD)乙醇、异丙醇及其混合物。一个优选的实施方案包括SD乙醇。一个优选的实施方案包括SD乙醇,其中该SD乙醇包括乙醇和为了令该乙醇不适于饮用而添加的变性化合物。一个优选的实施方案包括SD乙醇,其中该SD乙醇包含乙醇和乙酸乙酯。在一个实施方案中,该有机醇可以包括大约50重量%的乙醇和大约50重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约40重量%的乙醇和大约60重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约60重量%的乙醇和大约40重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约30重量%的乙醇和大约70重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约70重量%的乙醇和大约30重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约25重量%的乙醇和大约75重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约75重量%的乙醇和大约25重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约20重量%的乙醇和大约80重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约80重量%的乙醇和大约20重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约10重量%的乙醇和大约90重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括大约90重量%的乙醇和大约10重量%的异丙醇的混合物。在一个实施方案中,该有机醇可以包括10重量%的乙醇对90重量%的与乙醇混合的异丙醇的混合物。在一个实施方案中,该有机醇可以包括20重量%的乙醇对80重量%的与乙醇混合的异丙醇的混合物。在一个实施方案中,该有机醇可以包括30重量%的乙醇对70重量%的与乙醇混合的异丙醇的混合物。在一个实施方案中,该有机醇可以包括40重量%的乙醇对60重量%的与乙醇混合的异丙醇的混合物。在一个实施方案中,该有机醇可以包括有机醇和变性剂(例如特殊变性乙醇或SD-40乙醇)。载体还可以包括润肤剂酯。润肤剂酯当施加于皮肤时可以有助于防止皮肤含水度的损失,用作增稠剂,提供润滑,并改善触觉感知。优选的润肤剂酯是包括式I的化合物的组合物。其中R1和R2独立地选自异丙基、丙基和乙基,并且其中n为1至6的整数。合适的润肤剂酯的实例包括癸二酸二异丙酯、壬二酸二异丙酯、辛二酸二异丙酯、庚二酸二异丙酯、己二酸二异丙酯及其组合。优选的润肤剂酯是癸二酸二异丙酯(diisopropylsebacate)(式II),也称为癸二酸二异丙酯(diisopropyldecanedioate)及其商品名为DUBDIS,已经发现其在水醇和无水化妆品制剂中展示出优异的相容性。式II癸二酸二异丙酯可以在面部乳液(faciallotion)中用作非油性润肤润滑剂,具有快速干燥效果和快速铺展作用。令人惊讶的是,在一个实施方案中,癸二酸二异丙酯用于在具有适用于衬垫施加的快速蒸发的透明、可倾倒制剂中提供优异的溶解和渗透增强性质以及润肤性质。另一优选的润肤剂酯是己二酸二异丙酯(diisopropyladipate)(式III),其也被称为己二酸二异丙酯(diisopropylhexanedioate)。在一个实施方案中,润肤剂酯选自苯甲酸癸酯、苯甲酸十一烷基酯、苯甲酸十二烷基酯、苯甲酸十三烷基酯、苯甲酸十四烷基酯、苯甲酸十五烷基酯、苯甲酸十六烷基酯、鲸蜡酯、辛酸/癸酸二甘油基琥珀酸酯、苹果酸二乙基己酯、棕榈酸乙基己酯、新戊二醇二癸酸酯、乙二醇二癸酸酯、蓖麻油苯甲酸酯(例如FINSOLVBCO-115)、乙基己基羟基硬脂酸酯苯甲酸酯(例如FINSOLVBOHS-111)、苯甲酸C12-15烷基酯(例如FINSOLVTN或FINSOLVTN-O)、一缩二丙二醇二苯甲酸酯(例如FINSOLVEPG-22)、甲基葡糖醇聚醚-20苯甲酸酯(例如FINSOLVEEMG-20)、苯甲酸C12-15烷基酯与一缩二丙二醇二苯甲酸酯和PPG-15硬脂基醚苯甲酸酯的混合物(例如FINSOLVTPP)、聚二甲基硅氧烷PEG/PPG-20/23苯甲酸酯(例如FINSOLVSLB-101)、聚二甲基硅氧烷PEG-8苯甲酸酯(例如FINSOLVSLB-201)、苯甲酸乙基己酯(例如FINSOLVEB)、其组合、其与式I的化合物的组合、其与癸二酸二异丙酯的组合、以及其与己二酸二异丙酯的组合。其它苯甲酸烷基酯和酯类也可能可用于一些实施方案。在一个实施方案中,合适的载体包含至少一种挥发性硅酮。挥发性硅酮也可被本领域普通技术人员称为硅酮油和有机硅氧烷。合适的挥发性硅酮描述在美国专利公开号2004/0197284A1、2009/0074689A1、2012/0129956A1、2002/0022040A1、2003/0049212A1、2008/0044494A1和美国专利号5,300,286中,其公开内容通过引用并入本文。在一个实施方案中,合适的挥发性硅酮可以包括式IV的有机硅氧烷:式IV其中R3、R4、R5、R6、R7、R8、R9和R10独立地选自烷基、芳基和烷氧基,并且m是1至8的整数。在一个优选实施方案中,R3、R4、R5、R6、R7、R8、R9和R10的一个或更多个是甲基,且m是1至6的整数。在最优选的实施方案中,R3、R4、R5、R6、R7、R8、R9和R10是甲基,且m是1至4的整数。优选的挥发性硅酮包括式V的有机硅氧烷:式V式V的挥发性硅氧烷也被称为八甲基三硅氧烷或同义地称为三硅氧烷。三硅氧烷是市售硅酮油共混物如XIAMETERPMX-1184共混物或2-1184硅酮流体共混物(均可获自DowCorning,Midland,MI,USA)的组分。在一个实施方案中,该挥发性硅酮包括三硅氧烷和/或其它相关物质,如美国专利公开号2004/0197284A1与2009/0074689A1中所述,其公开内容通过引用并入本文。优选的挥发性硅酮包括式VI的有机硅氧烷:式VI式VI的挥发性硅氧烷也被称为十甲基四硅氧烷或同义地称为四硅氧烷。四硅氧烷是市售硅酮油共混物如XIAMETERPMX-1184共混物(DowCorning,Midland,MI,USA)的组分。在此类共混物中,四硅氧烷的量可以被称为聚二甲基硅氧烷。在另一实施方案中,该挥发性硅酮包括四硅氧烷和/或其它相关物质,如美国专利公开号2004/0197284A1与2009/0074689A1中所述,其公开内容通过引用并入本文。优选的挥发性硅酮包括式VII的有机硅氧烷:式VII式VII的挥发性硅氧烷也被称为十二甲基五硅氧烷或同义地称为五硅氧烷。五硅氧烷是市售硅酮油共混物如XIAMETERPMX-1184共混物(DowCorning,Midland,MI,USA)的组分。在此类共混物中,五硅氧烷的量可以被称为聚二甲基硅氧烷。在另一实施方案中,该挥发性硅酮包括五硅氧烷和/或其它相关物质,如美国专利公开号2004/0197284A1与2009/0074689A1中所述,其公开内容通过引用并入本文。在一个优选实施方案中,该挥发性硅酮包含聚二甲基硅氧烷。聚二甲基硅氧烷是甲基化聚硅氧烷的混合物,并描述在例如美国专利号2,441,098中,其公开内容通过引用以其全部并入本文。使用术语聚二甲基硅氧烷通常还包括四硅氧烷和五硅氧烷。聚二甲基硅氧烷在皮肤护理产品中的某些应用、性质和用途描述在Disapio,A.;Fridd,P.Int.J.Cosmet.Sci.1988,10,75-89中。在一个实施方案中,该挥发性硅酮包括聚二甲基硅氧烷。在一个优选实施方案中,该挥发性硅酮包括聚二甲基硅氧烷与三硅氧烷的混合物。在另一优选实施方案中,该挥发性硅酮包括混合物,其包含30至70重量%的聚二甲基硅氧烷和30至70重量%的三硅氧烷。在另一实施方案中,该挥发性硅酮包括其它硅氧烷和相关物质,包括增溶剂,如美国专利申请公开号2014/0010769、2013/0310355A1、2004/0197284A1和2009/0074689A1中所述,其公开内容通过引用并入本文。在另一实施方案中,该挥发性硅酮包括1,1,1,3,5,5,5-七甲基-3-乙基三硅氧烷,也被称为乙基三硅氧烷,其对应于当m=1、R7为乙基且R3、R4、R5、R6、R8、R9和R10为甲基时的式IV。可以使用市售乙基三硅氧烷,如SILSOFTETS产品(MomentivePerformanceMaterials,Columbus,OH,USA)。美国专利申请公开号2013/0310355A1,其公开内容通过引用并入本文,描述了乙基三硅氧烷在用于可能不可溶于硅酮油的活性剂包括类视黄醇的递送体系中的用途。在另一实施方案中,该挥发性硅酮包括二硅氧烷,其也被称为六甲基二硅氧烷。二硅氧烷提供快速蒸发和其它有用的性质,并且单独或与其它材料组合可以提供具有最佳特性的组合物。在另一实施方案中,该挥发性硅酮包括二硅氧烷和/或其它相关物质,如美国专利公开号2004/0197284A1与2009/0074689A1中所述,其公开内容通过引用并入本文。在另一实施方案中,该挥发性硅酮包括二硅氧烷、三硅氧烷、四硅氧烷、五硅氧烷和/或聚二甲基硅氧烷。在另一实施方案中,该挥发性硅酮包括环硅氧烷,如六甲基环三硅氧烷(也被称为环三硅氧烷或D3)、八甲基环四硅氧烷(也被称为环四硅氧烷或D4)、十甲基环五硅氧烷(也被称为环五硅氧烷或D5),或十二甲基环六硅氧烷(也被称为环六硅氧烷或D6)、十四甲基环七硅氧烷(D7),或其混合物。在另一实施方案中,该挥发性硅酮包括通式(CH3)2pOpSip的化合物,其中p是3至7的整数。在另一实施方案中,该挥发性硅酮包括环甲硅油。在一些实施方案中可以使用市售环硅氧烷共混物,如具有商品名XIAMETERPMX-0345(DowCorning,Midland,MI,USA)的环六硅氧烷共混物。在另一实施方案中,该挥发性硅酮包括环硅氧烷、三硅氧烷、四硅氧烷、五硅氧烷和/或聚二甲基硅氧烷。在一个实施方案中,该挥发性硅酮包括有机硅氧烷的共混物,包括共混的聚二甲基硅氧烷如XIAMETERPMX-200硅酮流体和XIAMETERPMX-0225硅酮流体(DowCorning,Midland,MI,USA)。在另一实施方案中,该挥发性硅酮包括氨端聚二甲基硅氧烷如XIAMETEROFX-8220流体(DowCorning,Midland,MI,USA)。在另一实施方案中,该挥发性硅酮包括环五硅氧烷和稀释在环五硅氧烷中的三甲基甲硅烷氧基硅酸酯的共混物,如市售可得的XIAMETERRSN-0749树脂(DowCorning,Midland,MI,USA)。在另一实施方案中,除了三硅氧烷、四硅氧烷、五硅氧烷和/或聚二甲基硅氧烷之外,该挥发性硅酮包括环五硅氧烷与稀释在环五硅氧烷中的三甲基甲硅烷氧基硅酸酯的共混物。在一个实施方案中,该挥发性硅酮包括苯基聚三甲基硅氧烷、双苯基聚三甲基硅氧烷、有机硅树脂SR1000(MomentivePerformanceMaterials,Columbus,OH,USA)和/或有机硅树脂SF1318(MomentivePerformanceMaterials,Columbus,OH,USA)。在另一实施方案中,除了三硅氧烷、四硅氧烷、五硅氧烷和/或聚二甲基硅氧烷之外,该挥发性硅酮包括苯基聚三甲基硅氧烷、双苯基聚三甲基硅氧烷或有机硅树脂。任何上述挥发性硅酮的共混物可以在一些实施方案中使用以实现关于干燥时间、分布、触感、和皮肤护理组合物的其它关键性质的优异结果。在一个实施方案中,挥发性硅酮包含30重量%至50重量%的十甲基四硅氧烷、30重量%至50重量%的八甲基三硅氧烷、10重量%至35重量%的十二甲基五硅氧烷和10重量%至30%的聚二甲基硅氧烷。在另一实施方案中,挥发性硅酮包含30重量%至45重量%的十甲基四硅氧烷、25重量%至40重量%的八甲基三硅氧烷、12重量%至20重量%的十二甲基五硅氧烷和12重量%至20%的聚二甲基硅氧烷。在一个优选实施方案中,挥发性硅酮包含大约32至38重量%的十甲基四硅氧烷、大约29至35重量%的八甲基三硅氧烷、12重量%至20重量%的十二甲基五硅氧烷、12重量%至20%的聚二甲基硅氧烷和小于2%的八甲基环四硅氧烷。在一个优选实施方案中,挥发性硅酮包含大约35重量%的十甲基四硅氧烷、大约32重量%的八甲基三硅氧烷、15重量%至18重量%的十二甲基五硅氧烷、15重量%至18%的聚二甲基硅氧烷和小于1%的八甲基环四硅氧烷。在一个实施方案中,任何前述挥发性硅酮组合物可以附加地包含小于0.5%、1%、2%或3%的八甲基环四硅氧烷。在一个实施方案中,载体组合物包含:(1)有机醇;(2)挥发性硅酮;和(3)式I的化合物。在一个实施方案中,载体组合物包含:(1)10至30%的有机醇;(2)30至80%的挥发性硅酮;和(3)1至10%的式I的化合物。在一个实施方案中,载体组合物包含:(1)10至30%的有机醇;(2)40至70%的挥发性硅酮;和(3)1至10%的式I的化合物。在一个实施方案中,载体组合物包含:(1)20至30%的有机醇;(2)40至70%的挥发性硅酮;和(3)2至8%的式I的化合物。在一个实施方案中,载体组合物包含:(1)10至30%的SD乙醇;(2)40至70%的挥发性硅酮,其中该挥发性硅酮是包含32至38重量%的十甲基四硅氧烷、29至35重量%的八甲基三硅氧烷、12重量%至20重量%的十二甲基五硅氧烷、12重量%至20%的聚二甲基硅氧烷和小于2%的八甲基环四硅氧烷的其混物;和(3)1至10%的式II的化合物。在一个实施方案中,载体组合物包含:(1)10至30%的SD乙醇;(2)40至70%的挥发性硅酮,其中该挥发性硅酮是包含大约35重量%的十甲基四硅氧烷、大约32重量%的八甲基三硅氧烷、15重量%至18重量%的十二甲基五硅氧烷、15重量%至18%的聚二甲基硅氧烷和小于1%的八甲基环四硅氧烷的共混物;和(3)1至10%的癸二酸二异丙酯(式II)。在一个实施方案中,载体组合物包含:(1)20至30%的SD乙醇;(2)40至70%的挥发性硅酮,其中该挥发性硅酮是包含大约35重量%的十甲基四硅氧烷、大约32重量%的八甲基三硅氧烷、15重量%至18重量%的十二甲基五硅氧烷、15重量%至18%的聚二甲基硅氧烷和小于1%的八甲基环四硅氧烷的共混物;和(3)2至8%的癸二酸二异丙酯(式II)。在一个实施方案中,载体组合物包含(1)SD乙醇、(2)挥发性硅酮(其中该挥发性硅酮是包含大约35重量%的十甲基四硅氧烷、大约32重量%的八甲基三硅氧烷、15重量%至18重量%的十二甲基五硅氧烷、15重量%至18%的聚二甲基硅氧烷和小于1%的八甲基环四硅氧烷的共混物)和(3)癸二酸二异丙酯(式II),其中SD乙醇∶挥发性硅酮∶癸二酸二异丙酯的重量∶重量∶重量比选自19∶70∶1、20∶69∶1、21∶68∶1、22∶67∶1、23∶66∶1、24∶65∶1、25∶64∶1、26∶63∶1、27∶62∶1、28∶61∶1、29∶60∶1、30∶59∶1、19∶70∶2、20∶69∶2、21∶68∶2、22∶67∶2、23∶66∶2、24∶65∶2、25∶64∶2、26∶63∶2、27∶62∶2、28∶61∶2、29∶60∶2、30∶59∶2、19∶70∶3、20∶69∶3、21∶68∶3、22∶67∶3、23∶66∶3、24∶65∶3、25∶64∶3、26∶63∶3、27∶62∶3、28∶61∶3、29∶60∶3、30∶59∶3、19∶70∶4、20∶69∶4、21∶68∶4、22∶67∶4、23∶66∶4、24∶65∶4、25∶64∶4、26∶63∶4、27∶62∶4、28∶61∶4、29∶60∶4、30∶59∶4、19∶70∶5、20∶69∶5、21∶68∶5、22∶67∶5、23∶66∶5、24∶65∶5、25∶64∶5、26∶63∶5、27∶62∶5、28∶61∶5、29∶60∶5、30∶59∶5、19∶70∶6、20∶69∶6、21∶68∶6、22∶67∶6、23∶66∶6、24∶65∶6、25∶64∶6、26∶63∶6、27∶62∶6、28∶61∶6、29∶60∶6、30∶59∶6、19∶70∶7、20∶69∶7、21∶68∶7、22∶67∶7、23∶66∶7、24∶65∶7、25∶64∶7、26∶63∶7、27∶62∶7、28∶61∶7、29∶60∶7、30∶59∶7、19∶70∶8、20∶69∶8、21∶68∶8、22∶67∶8、23∶66∶8、24∶65∶8、25∶64∶8、26∶63∶8、27∶62∶8、28∶61∶8、29∶60∶8、30∶59∶8、19∶70∶9、20∶69∶9、21∶68∶9、22∶67∶9、23∶66∶9、24∶65∶9、25∶64∶9、26∶63∶9、27∶62∶9、28∶61∶9、29∶60∶9、30∶59∶9、19∶70∶10、20∶69∶10、21∶68∶10、22∶67∶10、23∶66∶10、24∶65∶10、25∶64∶10、26∶63∶10、27∶62∶10、28∶61∶10、29∶60∶10和30∶59∶10。在一个实施方案中,该载体组合物基本上是无水的。该载体组合物也可以与少量的水混溶。在一些实施方案中,并且不希望受任何特定理论的束缚,少量的水允许使用含有吸湿性造成的水、水化的水或作为共混物的组分的水的活性成分。这可以提供超越其它制剂的优点。在一个实施方案中,组合物包含按重量计含有0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%或2.0%的水的载体组合物。在一个实施方案中,该组合物包含按重量计含有小于0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%或2.0%的水的载体组合物。在一个实施方案中,该组合物包含按重量计0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%或2.0%的水。在一个实施方案中,该组合物包含无色液体组合物,其包含按重量计小于0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%或2.0%的水。优选所选载体包含在为无色和/或液体组合物的组合物中。组合物的蒸发速率本文中描述的载体和/或产品组合物的实施方案可以具有设计为提供最佳消费者体验的蒸发速率。载体和产品组合物的合适的蒸发速率是流体可以在接触皮肤时快速蒸发。在一个实施方案中,载体和产品组合物的蒸发速率是流体可以在接触皮肤时在周围环境中在室温(25℃)下和在大气压(760torr)下在小于1分钟、5分钟、15分钟、30分钟和/或1小时内蒸发。在一个实施方案中,载体和产品组合物的蒸发速率在室温和大气压下在10至500mg/cm2/min范围内。在另一实施方案中,载体和产品组合物的蒸发速率在室温和大气压下在20至200mg/cm2/min范围内。在一个实施方案中,载体和产品组合物的蒸发速率在室温和大气压下在100至200mg/cm2/min范围内。在另一实施方案中,载体和产品组合物的蒸发速率在室温和大气压下在200至500mg/cm2/min范围内。透明和/或无色组合物本文中描述的载体和/或产品组合物的实施方案可以是光学透明的液体。光学透明的液体可以提供超越浑浊或不透明组合物的审美与功能的优点两者。在一个实施方案中,组合物包含为基本无色的液体组合物的载体组合物。在一个实施方案中,组合物包含对肉眼光学透明的载体和/或产品组合物。在一个实施方案中,组合物包含肉眼看起来为光学透明的、浅色的液体的载体和/或产品组合物。在一个实施方案中,组合物包含肉眼看起来为淡黄色的光学透明液体的载体和/或产品组合物。光学透明度可以通过测量溶液的透射率和溶液的浊度的公认方法来测量。在一个实施方案中,组合物包含在300和700纳米之间基本不具有吸光度的载体组合物。在一个实施方案中,组合物包含在400和700纳米之间具有大于90%的透射率的载体组合物。在一个实施方案中,组合物包含在400和700纳米之间具有大于85%的透射率的载体组合物。在一个实施方案中,组合物包含在400和700纳米之间具有大于80%的透射率的载体组合物。在一个实施方案中,组合物包含在400和700纳米之间具有大于75%的透射率的载体组合物。在一个实施方案中,组合物包含在450纳米处具有大于50%的透射率的载体组合物。在一个实施方案中,组合物包含在500纳米处具有大于75%的透射率的产品组合物。在一个实施方案中,组合物包含在550纳米处具有大于85%的透射率的产品组合物。在一个实施方案中,组合物包含在600纳米处具有大于90%的透射率的产品组合物。在一个实施方案中,组合物包含在650纳米处具有大于90%的透射率的产品组合物。在一个实施方案中,组合物包含在700纳米处具有大于90%的透射率的产品组合物。在一个实施方案中,组合物包含在500纳米处具有75%和90%之间的透射率的产品组合物。在一个实施方案中,组合物包含在550纳米处具有80%和95%之间的透射率的产品组合物。在一个实施方案中,组合物包含在600纳米处具有80%和95%之间的透射率的产品组合物。在一个实施方案中,组合物包含在650纳米处具有80%和95%之间的透射率的产品组合物。在一个实施方案中,组合物包含在700纳米处具有80%和95%之间的透射率的产品组合物。在一个实施方案中,组合物包含在550纳米处具有90%和95%之间的透射率的产品组合物。在一个实施方案中,组合物包含在600纳米处具有90%和95%之间的透射率的产品组合物。在一个实施方案中,组合物包含在650纳米处具有90%和95%之间的透射率的产品组合物。在一个实施方案中,组合物包含在700纳米处具有90%和95%之间的透射率的产品组合物。在一个实施方案中,该载体是光学透明的。在一个实施方案中,载体组合物是无色的、光学透明的、或对人眼光学透明的。在一个实施方案中,产品组合物是对人眼光学透明的并具有淡黄色。在另一实施方案中,产品组合物是对人眼光学透明的并具有浅黄色。在另一实施方案中,产品组合物是对人眼光学透明的并具有选自浅红色、浅橙笆、浅黄笆、浅粉红笆、浅绿笆、浅蓝笆和浅紫笆的颜笆。在另一实施方案中,产品组合物是对人眼光学透明的并是略微乳白色的。在另一实施方案中,产品组合物是对人眼光学透明的并是略微浑浊的。活性成分前述载体可以与一种活性成分或活性成分的组合结合。与此处描述的组合物和方法一起使用的活性成分可以包括本领域普通技术人员已知的那些活性成分,如以下文献中描述的那些:Draelos,Z.D.,Activeagentsinskincareproducts,Plast.Reconstru.Surg.,2010,125,719-724。适于与该组合物和方法一起使用的活性成分的非限制性实例描述在本文中。组合物可以包含一种或更多种本领域普通技术人员已知的疏水性(即油溶性)或亲水性(即水溶性)活性成分。活性成分还包括其盐(包括药学上可接受的盐)、其共品、其复合物、或其衍生物,包括前药如酯类和磷酸酯,如本文中描述或本领域普通技术人员已知的那样。本文中描述的组合物和方法中的活性成分可以包括类视黄醇化合物。优选的类视黄醇化合物包括疏水性化合物。合适的类视黄醇化合物包括维生素A、维生素A衍生物、视黄醛、视黄酸、视黄基酯、视黄醇、维甲酸或其酯、异维甲酸或其酯、反式视黄酸或其衍生物、β-胡萝卜素、β-胡萝卜素衍生物、阿达帕林、他佐罗汀或其组合,以及其盐(包括药学上可接受的盐)、其共品、其复合物或其其它衍生物,包括前药。在一个优选实施方案中,类视黄醇化合物包括羟基频哪酮视黄酸酯(hydroxypinacoloneretinoate,HPR)。本说明书中其它地方描述的其它活性成分也可以是类视黄醇化合物,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分可以包括以类似方式起作用的类视黄醇化合物替代物(例如维甲酸类(retinoid-like)化合物),包括混源萜烯酚类(meroterpenephenols)。优选的维甲酸类化合物包括补骨脂酚(4-[(1E,3S)-3-乙烯基-3,7-二甲基-1,6-辛二烯-1-基]苯酚),其描述在以下文献中:Chaudhuri,R.K.,Bojanowski,K.Bakuchiol:aretinol-likefunctionalcompoundrevealedbygeneexpressionprofilingandclinicallyproventohaveanti-agingeffects.Int.J.Cosmet.Sci.2014,36,221-230。本文中描述的组合物和方法中的活性成分可以包括皮肤渗透增强剂。皮肤渗透增强剂通常与类视黄醇化合物以及本文中所述的其它活性成分一起使用。优选的皮肤渗透增强剂是异山梨醇二甲基醚。适用于此处描述的组合物和方法的皮肤渗透增强剂可以包括本领域普通技术人员已知的皮肤渗透增强剂,如描述在以下文献中的那些:Williams,A.C.,Barry,B.W.Penetrationenhancers,Adv.Drug.Deliv.Rev.2004,56,603-618。合适的皮肤渗透增强剂包括亚砜类(如二甲亚砜)、氮酮类(如月桂氮酮和1-十二烷基氮杂环庚-2-酮)、吡咯烷酮类(如2-吡咯烷酮)、醇类(如乙醇或癸醇)、二醇类(如丙二醇)、表面活性剂(包括烷基羧酸盐及其相应的酸如油酸、氟烷基羧酸盐及其相应的酸、烷基硫酸盐、烷基醚硫酸盐、多库酯类如琥珀酸二辛酯磺酸钠、烷基苯磺酸盐、烷基醚磷酸盐和烷基芳基醚磷酸盐)、以及萜烯类(如柠檬烯、对伞花烃、香叶醇、法呢醇、丁香油酚、薄荷醇、萜品醇、香芹醇、香芹酮、葑酮和马鞭草烯酮)。本文中描述的组合物和方法中的活性成分还可以包括α-羟基酸,其也被称为α-羟基羧酸。α-羟基酸,如羟基乙酸,可以提供皮肤保湿和剥脱性质。α-羟基酸可以使用合适的载体快速渗透皮肤上层并削弱将死皮细胞保持在一起的锚点(anchor),允许容易地除去死皮细胞层,这又允许再生和显露更光滑和更均匀着色的下层皮肤。α-羟基酸可以由此提供改善的皮肤色调、颜色和质地。此外,α-羟基酸有助于使水结合至皮肤以提高皮肤含水度并提供健康的肤色。在一个实施方案中,产品组合物或载体包含α-羟基酸,其选自羟基乙酸、乳酸、苹果酸、柠檬酸、洒石酸、丙酮酸及其组合,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。在一个优选实施方案中,产品组合物或载体包含羟基乙酸。合适的α-羟基酸还描述在美国专利号6,521,271中,其公开内容通过引用并入本文。本说明书中其它地方描述的其它活性成分也可以是α-羟基酸,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括β-羟基酸,其也被称为β-羟基羧酸。β-羟基酸,如水杨酸,除其它有用的性质之外,因其抗微生物性质而已知,所述抗微生物性质使其能够用作问题皮肤病症的药物(remedy)。NAB柳树皮提取物(LonzaLtd.,Basel,Switzerland),也称为含水黑柳(SalixNigra)(柳树)树皮提取物,是标准化至10%水杨酸的含水提取物,其已经显示具有有效的体外抗微生物性质。功效试验已经显示该提取物其有对抗金黄色匍萄球菌(Staphylococcusaureus)和丙酸杆菌(Propionibacterium)的活性,这两种细菌均与皮肤痤疮相关。NAB柳树皮提取物是类水杨酸成分的来源,并提供类似于由合成水杨酸观察到的那些的效果,但是表现出降低的刺激。在一个实施方案中,产品组合物或载体包含β-羟基酸,其选自水杨酸、乙酰水杨酸、NAB柳树皮提取物及其组合,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。在一个优选实施方案中,产品组合物或载体包含水杨酸。在另一优选实施方案中,产品组合物或载体包含NAB柳树皮提取物。本说明书中其它地方描述的其它活性成分也可以是β-羟基酸,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括含有α-羟基酸和β-羟基酸两者的成分如天然成分,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。在一个实施方案中,产品组合物或载体包含乳酸与果酸的天然混合物(例如MFA复合物,BarnetProductsCorp.,EnglewoodCliffs,NJ,USA)。MFA复合物是乳酸、柠檬酸、苹果酸、绿茶和水的混合物。本说明书中其它地方描述的其它活性成分也可以包括α-羟基酸和β-羟基酸两者,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括防腐剂。合适的局部防腐剂包括例如下列文献中描述的那些:Singal,A.;Thami,G.P.Topicalantibacterialagentsindermatology,JDermatol.2003,30,644-48。在一个实施方案中,产品组合物或载体包含防腐剂,其选自苯扎氯铵、十六烷基三甲基溴化铵、十六烷基氯化吡啶鎓、苄索氯铵、氯己定、奥替尼啶和过氧化苯甲酰,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。本说明书中其它地方描述的其它活性成分也可以是抗生剂,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括抗生剂。在一个实施方案中,产品组合物或载体包含抗生剂,其选自红霉素、克拉霉素、磺胺醋酰钠、四环素、四环素衍生物、新霉素、多粘菌素B、丙吗卡因、莫匹罗星、杆菌肽、磺胺嘧啶银、克林霉素、头孢呋辛、头孢羟氨苄、氯碳头孢、瑞他莫林、硫康唑、磺胺甲基异噁唑、甲氧苄氨嘧啶、甲硝哒唑、过氧化苯甲酰、水杨酸、turmerin、姜黄素及其组合,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。合适的抗生剂描述在美国专利公开号2013/0280308A1以及美国专利号2,799,620、2,888,455、3,475,407、4,331,803和6,521,271中,其公开内容通过引用并入本文。本说明书中其它地方描述的其它活性成分也可以是抗生剂,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括抗炎剂。在一个实施方案中,产品组合物或载体包含抗炎剂,其选自氟比洛芬、布洛芬、荼普生、吲哚美辛、大豆异黄酮、海带、水飞蓟素、槲皮素、石榴提取物、烟酰胺、绞股蓝、葡糖胺、银杏、绿茶提取物、葡萄籽原花青素、积雪草、印度乳香(boswelliaserrata)、α-没药醇(也称为α没药醇、α-(-)-没药醇或左美诺醇)、没药醇、α-(±)-没药醇、β-没药醇、甘草酸二钾、β-葡聚糖、3-O-乙基抗坏血酸(也称为3-O-乙基抗坏血酸醚、乙基抗坏血酸和维生素C乙基醚)和尿囊素,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。在一个优选实施方案中,产品组合物或载体包含抗炎剂,其选自没药醇、没药醇活性植物提取物、没药醇(没药醇,生姜(zingiberofficinale)(姜,ginger)根提取物)、没药醇与姜提取物、α-没药醇、α-(-)-没药醇、左美诺醇、α-(±)-没药醇或β-没药醇。没药醇与相美化合物描述在以下文献中:Russell,K.;Jacob,S.E.Bisabolol,Dermatitis.2010,21,57-58。本说明书中其它地方描述的其它活性成分也可以是抗炎剂,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括抗病毒剂。在一个实施方案中,产品组合物或载体包含抗病毒剂,其选自更昔洛韦、喷昔洛韦、伐昔洛韦、阿昔洛韦、泛昔洛韦、赖氨酸、二十二烷醇和三氟胸苷,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。其它合适的抗病毒剂描述在美国专利公开号2013/0216590A1、2012/0058959A1、2006/0058265A1和2005/0032739A1以及美国专利号8,236,768和5,585,379中,其公开内容通过引用并入本文。本说明书中其它地方描述的其它活性成分也可以是抗病毒剂,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括抗真菌剂。在一个实施方案中,产品组合物或载体包含抗真菌剂,其选自酮康唑、益康唑、联苯苄唑、咪康唑、克霉唑、噻康唑、托荼酯、托西拉酯、特比荼芬、制霉菌素、环吡酮、环吡酮胺、十一碳烯链烷醇酰胺(undecylenicalkanolamide)、苯甲酸及其组合,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。合适的抗真菌剂描述在美国专利公开号2011/0008474A1、2011/0251146A1和2004/0101538以及美国专利号6,075,056、8,026,238、8,586,066、7,553,835、8,449,926和8,586,066中,其公开内容通过引用并入本文。本说明书中其它地方描述的其它活性成分也可以是抗真菌剂,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括抗痤疮剂。在一个实施方案中,产品组合物或载体包含抗痤疮剂,其选自壬二酸、扁桃酸、水杨酸、硫、胶态硫、间苯二酚和过氧化苯甲酰,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。本说明书中其它地方描述的其它活性成分也可以是抗痤疮剂,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括防晒剂。防晒剂也被称为UV过滤剂。安全和有效的防晒剂可用于本文中描述的组合物和方法,如以下文献中描述的那些:Shaath,N.A.TheEncyclopediaofUltravioletFilters,第1版.AlluredPublishingCorp.,2007。在一个实施方案中,产品组合物或载体包含遮挡UV-B辐射、UV-A辐射、或UV-B辐射和UV-A辐射两者的防晒剂。在一个优选实施方案中,防晒剂是丁基甲氧基二苯甲酰甲烷(BMDBM)。基于硅酮的UV过滤剂如聚硅氧烷-15(例如PARSOLSLX,DSMNutritionalProducts)也可用作防晒剂。可以使用用作活性成分的其它防晒剂包括但不限于2-氰基-3,3-二苯基丙烯酸2-乙基己酯(也称为奥克立林)、2-氰基-3,3-二苯基丙烯酸乙酯、4-甲基亚苄基樟脑、3-亚苄基樟脑、樟脑苯扎铵甲基硫酸盐、聚丙烯酰胺甲基亚苄基樟脑、磺胺亚苄基樟脑(sulfabenzylidenecamphor)、磺基甲基亚苄基樟脑、对苯二亚甲基二樟脑磺酸(例如MEXORYLSX);甲氧基肉桂酸乙基己酯(例如PARSOLMCX)、甲氧基肉桂酸乙氧基乙酯、甲氧基肉桂酸异戊酯、包封的(encapsulated)甲氧基肉桂酸乙基己酯(例如EUSOLEXUV-pearls)、对氨基苯甲酸、对二甲基氨基苯甲酸2-乙基己酯、N-氧丙烯化的对氨基苯甲酸乙酯、对氨基苯甲酸甘油酯、二苯甲酮-3、二苯甲酮-4、2,2′,4,4′-四羟基-二苯甲酮、2,2′-二羟基-4,4′-二甲氧基二苯甲酮、二-(2-乙基己基)4-甲氧基亚苄基丙二酸酯、甲酚曲唑三硅氧烷(例如MEXORYLXL)、2-苯基苯并咪唑磺酸(例如PARSOLHS)、水杨酸异丙基苄酯、水杨酸苄酯、水杨酸丁酯、水杨酸乙基己酯(PARSOLEHS)、水杨酸异辛酯、水杨酸三甲环己酯(也称为胡莫柳酯,例如PARSOLHMS)、乙基己基三嗪酮、二乙基己基丁酰胺基三嗪酮、双-乙基己氧基苯酚甲氧基苯基三嗪、2,4,6-三[1,1′-联苯]-4-基-1,3,5-三嗪、2,2′-亚甲基-双-(6-(2H-苯并三唑-2-基)-4-(1,1,3,3-四甲基丁基)-苯酚、2-(4-二乙基氨基-2-羟基-苯甲酰基)-苯甲酸己酯、2,4-双-5-1(二甲基丙基)苯并噁唑-2-基-(4-苯基)-亚氨基]-6-(2-乙基己基)-亚氨基-1,3,5-三嗪(K2A);2,2-(1,4-亚苯基)双-(1H-苯并咪唑-4,6-二磺酸)(AP);1,1′-(1,4-哌嗪二基)双[1-[4-(二乙基氨基)-2-羟基苯甲酰基]苯基]-甲酮、双(丁基苯甲酸酯)二氨基三嗪氨丙基三硅氧烷,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。本说明书中其它地方描述的其它活性成分也可以是防晒剂,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括皮肤美白剂。在一个实施方案中,产品组合物或载体包含皮肤美白剂,其选自L-抗坏血酸、3-O-乙基抗坏血酸、乙基抗坏血酸、抗坏血酸四异棕榈酸酯(抗坏血酸四己基癸酸酯)、抗坏血酸葡糖苷、阿魏酸、γ-谷维素、葡糖胺、L-乳酸、柠檬生物酵素(bioferment)、烟酰胺、南瓜生物酵素、石榴提取物、抗坏血酸磷酸酯钠、白藜芦醇、乙基己基间苯二酚、氢醌和大豆异黄酮,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。合适的皮肤美白剂描述在美国专利公开号2007/0105947A1、2006/0210497A1、2006/0210498A1、2008/0131382A1、2004/0042983A1和2002/0176903A1以及美国专利号4,959,393、6,132,740、6,504,037和6,682,763中,其公开内容通过引用并入本文。本说明书中其它地方描述的其它活性成分也可以是皮肤美白剂,并包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括植物提取物。在一个实施方案中,产品组合物或载体包含植物提取物,其选自补骨脂酚、混源萜烯类(meroterpenes)、terpenophenol相关化合物、生姜(姜)根提取物、北美金缕梅、澳洲坚果甘油酯类、掌状昆布(laminariadigitata)提取物、紫花苜蓿(medicagosativaalfalfa)提取物和菊苣(cichoriumintybus)(苣荬菜,chicory)根提取物,以及其盐(包括药学上可接受的盐)、其共晶、其复合物或其衍生物,包括前药。适用于本发明的组合物和方法的植物提取物还描述在美国专利公开号2011/0086116A1、2012/0276025A1、2013/0243708A1、2013/0216635A1、2013/0236403A1、2013/0309332A1、2012/0282195A1、2012/0195923A1、2010/0316747A1、201/0318437A1、2003/0180231A1和2002/0176903A1以及美国专利号8,454,943、8,609,072、8,273,387、8,481,089、8,444,959、8,636,989、8,043,637、8,313,783和6,682,763中,其公开内容通过引用并入本文。本说明书中其它地方描述的其它活性成分也可以是植物提取物,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括维生素。在一个实施方案中,产品组合物或载体包括维生素,其选自维生素A、维生素B1、维生素B2、维生素B3、维生素B5、维生素B6、维生素B7、维生素B9、维生素B12、维生素C、维生素D、维生素E、维生素K及其组合,以及其盐(包括药学上可接受的盐)、其共品、其复合物或其衍生物,包括前药。本说明书中其它地方描述的其它活性成分也可以是维生素,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括皮质类固醇。在一个实施方案中,产品组合物或载体包括皮质类固醇,其选自氢化可的松、氢化可的松乙酸酯、氢化可的松醋丙酸酯、氢化可的松丁丙酸酯、氢化可的松17-丁酸酯、氢化可的松21-丁酸酯、氢化可的松戊酸酯、可的松、可的松乙酸酯、替可的松匹伐酯、泼尼松龙、甲基泼尼松龙、二氟泼尼酯、泼尼松、曲安奈德、曲安西龙醇(triamcinolonealcohol)、莫米松、安西奈德、布地奈德、地奈德、氟轻松乙酸酯、氟西奈德、哈西奈德、倍他米松、倍他米松磷酸钠、地塞米松、地塞米松磷酸钠、氟可龙、氢化可的松-17-戊酸酯、卤米松、阿氯米松二丙酸酯、倍他米松戊酸酯、倍他米松二丙酸酯、泼尼卡酯、氯倍他松-17-丁酸酯、氯倍他索-17-丙酸酯、氟可龙己酸酯、氟可龙特戊酸酯和氟泼尼定乙酸酯、氢化可的松-17-丁酸酯、氢化可的松-17-醋丙酸酯、氢化可的松-17-丁丙酸酯、泼尼卡酯、氯替泼诺、氟米龙、氟米龙乙酸酯、甲羟松、利美索龙及其组合,以及其盐(包括药学上可接受的盐)、其共品、其复合物或其衍生物,包括前药(如乙酸酯或磷酸酯)。其它皮质类固醇也可用于本文中描述的组合物和方法,如美国专利号8,546,363和美国专利公开号2009/0215735、2012/0053161、2012/0129824和20120214776中描述的那些,其公开内容通过引用并入本文。本说明书中其它地方描述的其它活性成分也可以是皮质类固醇,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括局部麻醉剂。在一个实施方案中,产品组合物或载体包含局部麻醉剂,其选自利多卡因、苯佐卡因、赛罗卡因、氨苯丁酯、地布卡因、奥布卡因、普莫卡因、丙美卡因、丙氧间卡因、丁卡因及其组合,以及其盐(包括药学上可接受的盐)、其共品、其复合物或其衍生物,包括前药。本说明书中其它地方描述的其它活性成分也可以是局部麻醉剂,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括其它生物活性成分。在一个实施方案中,产品组合物或载体包含生物活性成分,其选自苯海拉明、炉甘石、多塞平及其组合,以及其盐(包括药学上可接受的盐)、其共品、其复合物或其衍生物,包括前药。本说明书中其它地方描述的其它活性成分也可以是生物活性成分,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括改善或改变产品的消费者感知的成分。此类活性成分的非限制性实例包括提供香味或颜色的活性成分。香味和芳香疗法已知对情绪(提升、平衡和幸福感)、压力减轻和释放、睡眠增强、自信、以及身体活动与认知能力(例如免疫系统、呼吸系统和循环系统的增强)产生积极影响。在一个实施方案中,产品组合物或载体包含活性成分,其选自橙花油(nerolioil)(也称为橙花油(oilneroli)或甜橙(橙)花油)、茉莉油(也称为茉莉净油(asmineabsolute))、依兰精油、柠檬精油、莱姆精油、葡萄柚精油、红橘精油、甜橙精油(也称为橙油)、薰衣草精油、醒目熏衣草精油、天竺葵精油、玫瑰精油、薄荷精油、留兰香精油、安息香树脂(也称为安息香净油)、香草净油、肉桂精油、丁香精油及其组合,以及其盐(包括药学上可接受的盐)、其共品、其复合物或其衍生物,包括前药。在一个实施方案中,产品组合物或载体包含选自食品级染料和化妆品染料的活性成分。本说明书中其它地方描述的其它活性成分也可以是改善产品的消费者感知的成分,并由此同样地包括在本公开的范围内。本文中描述的组合物和方法中的活性成分还可以包括颜料。在一个实施方案中,产品组合物或载体包含颜料,以及其盐(包括药学上可接受的盐)、其共品、其复合物或其衍生物,包括前药。合适的颜料描述在例如美国专利公开号2014/0010769A1中,其公开内容通过引用并入本文。在一个实施方案中,方法包括使用颜料以改善皮肤色调、皮肤颜色或肤色。在一个实施方案中,方法包括使用产品组合物或载体以改善皮肤色调、皮肤颜色或肤色。在一些实施方案中,能够电离的活性成分或化合物可以以其游离碱或游离酸的形式使用,或可以以盐,包括药学上可接受的盐的形式使用。合适的盐和制备盐的程序是本领域普通技术人员已知的并描述在例如P.H.Stahl和C.G.Wermuth,HandbookofPharmaceuticalSalts:Properties,Selection,andUse,Wiley-VCH,Zürich,2002中。在一个实施方案中,也可以利用活性成分与药学上可接受的酸的替代盐,例如衍生自功能性游离碱和酸的盐,所述酸包括但不限于盐酸、棕榈酸、氢溴酸、磷酸、乙酸、富马酸、马来酸、水杨酸、柠檬酸、草酸、乳酸、苹果酸、甲磺酸和对甲苯磺酸。本文中所用的术语盐还包括保持母体化合物的所需生物活性并且表现出最小的(如果有的话)不期望的毒理学作用的盐。此类盐的非限制性实例是(a)与无机酸(例如盐酸、氢溴酸、硫酸、磷酸、硝酸等等)形成的酸加成盐和与有机酸(如乙酸、草酸、酒石酸、琥珀酸、苹果酸、抗坏血酸、苯甲酸、鞣酸、双羟萘酸、海藻酸、聚谷氨酸、萘磺酸、萘二磺酸和聚半乳糖醛酸)形成的盐;(b)与多价金属阳离子如锌、钙、铋、钏、镁、铝、铜、钴、镍、镉、钠、钾等等形成的碱加成盐,或与有机阳离子形成的碱加成盐,所述有机阳离子由N,N-二苄基乙二胺、铵或乙二胺形成;或(c)(a)与(b)的组合;例如鞣酸锌盐等等。如本文中描述的活性成分或其药学上可接受的衍生物的所有替代物理形式,包括但不限于替代结晶形式、多晶型物、溶剂合物、非晶形式、共晶、环糊精复合物、冠醚复合物、分子复合物和分散体也在本发明的范围内,并且本文中所有提及活性成分包括其所有替代物理形式。本文中关于活性成分、盐、共晶、复合物、衍生物、化合物或组合物所用的术语“药学上可接受的”指的是通常对用于药物、化妆品或食品级产品安全的活性成分、化合物或组合物的形式。在一个方面,本文中的公开内容还涵盖了本文中体现的化合物与组合物的药学上可接受的的水合物、溶剂合物、立体异构体、共晶、复合物、或非晶固体。例如,术语“药学上可接受的盐”是描述本文中的一种或更多种组合物的盐形式。在一个实施方案中,药学上可接受的盐包括衍生自药学上可接受的无机或有机碱和酸的那些。合适的盐包括衍生自碱金属如钾和钠、碱土金属如钙、镁和铵盐以及本领域中公知的许多其它酸的那些。如上所述,活性成分或组合物包括该活性成分或组合物中该化合物的盐,如药学上可接受的盐。在一些实施方案中,用于制备前述化合物或活性成分的酸加成盐的酸是形成无毒的酸加成盐的那些,即含有药理学上可接受的阴离子的盐,尤其如盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、乙酸盐、乳酸盐、柠檬酸盐、酸式柠檬酸盐、酒石酸盐、酒石酸氢盐、琥珀酸盐、马来酸盐、富马酸盐、葡萄糖酸盐、糖酸盐、苯甲酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐[即1,1′-亚甲基-双-(2-羟基-3-萘甲酸盐)]。如上所述,活性成分或组合物包括该活性成分或组合物中的化合物的盐,如药学上可接受的盐。在一些实施方案中,活性成分或化合物包括该化合物或该组合物中的活性成分的碱加成盐。可以用作试剂来制备为酸性性质的本发明的化合物的药学上可接受的碱盐(basesalt)的化学碱是与此类化合物形成无毒碱盐的那些。此类无毒碱盐尤其包括,但不限于衍生自诸如碱金属阳离子(例如钾和钠)和碱土金属阳离子(例如钙和镁)的阳离子的那些、铵或水溶性胺加成盐如N-甲基葡糖胺(葡甲胺)和链烷醇铵以及药学上可可接受的有机胺的其它碱盐。活性成分的改性可以影响该活性种类的溶解性、生物利用度和代谢速率,由此对活性种类的递送提供控制。此外,该改性可以影响该化合物的活性,在一些情况下提高该活性超出母体化合物。这可以通过根据本文中涵盖的方法或本领域技术人员已知的其它方法制备衍生物并测试其活性来评估。本文中所用的术语“药学上可接受的衍生物”或“衍生物”描述了化学衍生物,如活性成分的药学上可接受的前药(例如酯、磷酸酯或醚),其在施用于患者时直接或间接提供母体化合物或活性成分的活性代谢物。衍生物及其制备是本领域普通技术人员已知的,并例如描述在J.Rautio,H.Kumpulainen,T.Heimbach,R.Oliyai,D.Oh,Dooman,T.和J.Savolainen,Prodrugs:Designandclinicalapplications,Nat.Rev.DrugDisc.,2008,7,255-270中。在一个实施方案中,此处公开的组合物可以使用其它药学上可接受的载体来配制。可用于这些组合物的药学上可接受的载体包括但不限于离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白如人血清白蛋白、缓冲剂物质如磷酸盐、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的偏甘油酯混合物、水、盐或电解质如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶态二氧化硅、三硅酸镁、聚乙烯基吡咯烷酮、基于纤维素的物质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯类、蜡、聚乙烯-聚氧丙烯嵌段聚合物、聚乙二醇和羊毛脂。在其它实施方案中,如本文中其它地方更详细阐述的那样,活性成分的剂量和给药方案可以基于待治疗的受试者的健康和病症以及期望的治疗成果来优化。剂型和量在一个实施方案中,如本文中其它地方详细描述的那样,现在已经发现,施用于受试者的本文中所述的组合物对皮肤病症和其它疾病的治疗提供了令人惊讶的功效。在一个实施方案中,活性成分以小于0.01毫克/千克的剂量局部施用于受试者。在一个实施方案中,活性成分以小于0.5毫克/千克的剂量局部施用于受试者。在一个实施方案中,本文中涵盖的剂量可以基于受试者的重量以组合物形式施用。在一个实施方案中,可以每单位受试者重量施用剂量(例如本文描述的组合物的毫克数/受试者的千克重量)。在一个实施方案中,本文中涵盖的剂量可以仅基于剂量的重量以组合物形式施用,而不考虑受试者的重量(例如本文描述的组合物的毫克数/施用于受试者的剂量)。在一个实施方案中,基于该载体中活性成分的重量来确定该剂量。在另一个实施方案中,基于该载体中该组合物的活性成分总重量来确定该剂量。在一个实施方案中,以本文中描述的任何形式或组合,出于本文中所述的任何目的施用化合物可以包括以1纳克至100微克、5纳克至75微克、10纳克至50微克、25纳克至40微克、50纳克至30微克、75纳克至20微克、100纳克至10微克、250纳克至5微克、500纳克至200微克、750纳克至100微克、1微克至75微克、5微克至50微克、或10微克至40微克的剂量施用活性成分或其药学上可接受的盐。作为非限制性实例,并如本文中其它地方详细阐述,例如10微克至40微克的剂量代表10微克/千克受试者重量至40微克/千克受试者重量的剂量范围,并还可以代表施用于受试者的10微克至施用于受试者的40微克的剂量范围。在个实施方案中,任何前述活性成分可以以任何前述剂量或质量施用。在一个实施方案中,以本文中描述的任何形式或组合,出于本文中所述的任何目的施用化合物可以包括以1纳克至1克、5纳克至1克、10纳克至1克、25纳克至1克、50纳克至1克、75纳克至1克、100纳克至750毫克、500纳克至500毫克、10微克至200毫克、15微克至190毫克、25微克至180毫克、50微克至170毫克、75微克至160毫克、100微克至150毫克、250微克至140毫克、400微克至130毫克、500微克至128毫克、600微克至100毫克、750微克至75毫克、900微克至50毫克、或0.1毫克至64毫克的剂量施用活性成分或其盐、共晶、复合物或衍生物,例如药学上可接受的盐。在一个实施方案中,任何前述活性成分可以以任何前述剂量或质量施用。在一个实施方案中,活性成分或其盐、共晶、复合物或衍生物,例如药学上可接受的盐可以以大约1000毫克或更少、大约500毫克或更少、大约200毫克或更少、大约150毫克或更少、大约100毫克或更少、大约50毫克或更少、大约40毫克或更少、大约30毫克或更少、大约20毫克或更少、大约10毫克或更少、大约9毫克或更少、大约8毫克或更少、大约7毫克或更少、大约6毫克或更少、大约5毫克或更少、大约4毫克或更少、大约3毫克或更少、大约2毫克或更少、大约1毫克或更少、大约0.9毫克或更少、大约0.8毫克或更少、大约0.7毫克或更少、大约0.6毫克或更少、大约0.5毫克或更少、大约0.4毫克或更少、大约0.3毫克或更少、大约0.2毫克或更少、大约0.1毫克或更少、大约0.09毫克或更少、大约0.08毫克或更少、大约0.07毫克或更少、大约0.06毫克或更少、大约0.05毫克或更少、大约0.04毫克或更少、大约0.03毫克或更少、大约0.02毫克或更少、大约0.01毫克或更少、大约0.009毫克或更少、大约0.008毫克或更少、大约0.007毫克或更少、大约0.006毫克或更少、大约0.005毫克或更少、大约0.004毫克或更少、大约0.003毫克或更少、大约0.002毫克或更少、大约0.001毫克或更少、或大约0.0005毫克或更少的剂量根据本文中涵盖的组合物和方法施用于受试者。在一个实施方案中,任何前述活性成分可以以任何前述剂量或质量施用。在一个实施方案中,活性成分或其盐、共晶、复合物或衍生物,例如药学上可接受的盐可以以大约1克、大约500毫克或更多、大约200毫克或更多、大约150毫克或更多、大约100毫克或更多、大约50毫克或更多、大约40毫克或更多、大约30毫克或更多、大约20毫克或更多、大约10毫克或更多、大约9毫克或更多、大约8毫克或更多、大约7毫克或更多、大约6毫克或更多、大约5毫克或更多、大约4毫克或更多、大约3毫克或更多、大约2毫克或更多、大约1毫克或更多、大约0.9毫克或更多、大约0.8毫克或更多、大约0.7毫克或更多、大约0.6毫克或更多、大约0.5毫克或更多、大约0.4毫克或更多、大约0.3毫克或更多、大约0.2毫克或更多、大约0.1毫克或更多、大约0.09毫克或更多、大约0.08毫克或更多、大约0.07毫克或更多、大约0.06毫克或更多、大约0.05毫克或更多、大约0.04毫克或更多、大约0.03毫克或更多、大约0.02毫克或更多、大约0.01毫克或更多、大约0.009毫克或更多、大约0.008毫克或更多、大约0.007毫克或更多、大约0.006毫克或更多、大约0.005毫克或更多、大约0.004毫克或更多、大约0.003毫克或更多、大约0.002毫克或更多、大约0.001毫克或更多、或大约0.0005毫克或更多的剂量根据本文中涵盖的组合物和方法施用于受试者。在一个实施方案中,任何前述活性成分可以以任何前述剂量或质量施用。在一个实施方案中,活性成分或其盐、共晶、复合物或衍生物,例如药学上可接受的盐可以以大约1000毫克、大约500毫克、大约200毫克、大约150毫克、大约100毫克、大约50毫克、大约40毫克、大约30毫克、大约20毫克、大约10毫克、大约9毫克、大约8毫克、大约7毫克、大约6毫克、大约5毫克、大约4毫克、大约3毫克、大约2毫克、大约1毫克、大约0.9毫克、大约0.8毫克、大约0.7毫克、大约0.6毫克、大约0.5毫克、大约0.4毫克、大约0.3毫克、大约0.2毫克、大约0.1毫克、大约0.09毫克、大约0.08毫克、大约0.07毫克、大约0.06毫克、大约0.05毫克、大约0.04毫克、大约0.03毫克、大约0.02毫克、大约0.01毫克、大约0.009毫克、大约0.008毫克、大约0.007毫克、大约0.006毫克、大约0.005毫克、大约0.004毫克、大约0.003毫克、大约0.002毫克、大约0.001毫克或大约0.0005毫克的剂量根据本文中涵盖的组合物和方法施用于受试者。在一个实施方案中,任何前述活性成分可以以任何前述剂量或质量施用。在一个实施方案中,活性成分或其盐、共晶、复合物或衍生物,例如药学上可接受的盐可以以1000毫克、500毫克、200毫克、150毫克、100毫克、50毫克、40毫克、30毫克、20毫克、10毫克、9毫克、8毫克、7毫克、6毫克、5毫克、4毫克、3毫克、2毫克、1.9毫克、1.8毫克、1.7毫克、1.6毫克、1.5毫克、1.4毫克、1.3毫克、1.2毫克、1.1毫克、1毫克、0.9毫克、0.8毫克、0.7毫克、0.6毫克、0.5毫克、0.4毫克、0.3毫克、0.2毫克、0.1毫克、0.09毫克、0.08毫克、0.07毫克、0.06毫克、0.05毫克、0.04毫克、0.03毫克、0.02毫克、0.01毫克、0.009毫克、0.008毫克、0.007毫克、0.006毫克、0.005毫克、0.004毫克、0.003毫克、0.002毫克、0.001毫克、或0.0005毫克的剂量根据本文中涵盖的组合物和方法施用于受试者。在一个实施方案中,任何前述活性成分可以以任何前述剂量或质量施用。在一个实施方案中,活性成分或其盐、共晶、复合物或衍生物,例如药学上可接受的盐可以以大约1000毫克/千克、大约500毫克/千克、大约200毫克/千克、大约150毫克/千克、大约100毫克/千克、大约50毫克/千克、大约40毫克/千克、大约30毫克/千克、大约20毫克/千克、大约10毫克/千克、大约9毫克/千克、大约8毫克/千克、大约7毫克/千克、大约6毫克/千克、大约5毫克/千克、大约4毫克/千克、大约3毫克/千克、大约2毫克/千克、大约1.9毫克/千克、大约1.8毫克/千克、大约1.7毫克/千克、大约1.6毫克/千克、大约1.5毫克/千克、大约1.4毫克/千克、大约1.3毫克/千克、大约1.2毫克/千克、大约1.1毫克/千克、大约1毫克/千克、大约0.9毫克/千克、大约0.8毫克/千克、大约0.7毫克/千克、大约0.6毫克/千克、大约0.5毫克/千克、大约0.4毫克/千克、大约0.3毫克/千克、大约0.2毫克/千克、大约0.1毫克/千克、大约0.09毫克/千克、大约0.08毫克/千克、大约0.07毫克/千克、大约0.06毫克、大约0.05毫克、大约0.04毫克、大约0.03毫克/千克、大约0.02毫克、大约0.01毫克、大约0.009毫克、大约0.008毫克、大约0.007毫克、大约0.006毫克/千克、大约0.005毫克/千克、大约0.004毫克/千克、大约0.003毫克/千克、大约0.002毫克/千克、大约0.0019毫克/千克、大约0.0018毫克/千克、大约0.0017毫克/千克、大约0.0016毫克/千克、大约0.0015毫克/千克、大约0.0014毫克/千克、大约0.0013毫克/千克、大约0.0012毫克/千克、大约0.0011毫克/千克、大约0.001毫克/千克、大约0.0005毫克/千克、或可由前述剂量确定的任何范围(例如大约0.0013毫克/千克至大约0.0016毫克/千克,或大约0.001毫克/千克至大约0.002毫克/千克)的剂量根据本文中涵盖的组合物和方法施用于受试者。在一个实施方案中,任何前述活性成分可以以任何前述剂量、质量比或浓度施用。在一个方面,施用活性成分或其盐、共晶、复合物或衍生物,例如药学上可接受的盐的方法可以包括滴定该化合物上至预定水平。在一个实施方案中,活性成分以规定水平使用(例如0.05毫克b.i.d.、0.1毫克b.i.d.、0.2毫克b.i.d.、0.4毫克b.i.d.、0.6毫克b.i.d.、0.8毫克b.i.d.、1毫克b.i.d.、2毫克b.i.d.、4毫克b.i.d.、8毫克b.i.d.、16毫克b.i.d.、32毫克b.i.d.、64毫克b.i.d.)。在一个实施方案中,活性成分以规定水平使用(例如大约0.05毫克b.i.d.、大约0.1毫克b.i.d.、大约0.2毫克b.i.d.、大约0.4毫克b.i.d.、大约0.6毫克b.i.d.、大约0.8毫克b.i.d.、大约1毫克b.i.d.、大约2毫克b.i.d.、大约4毫克b.i.d.、大约8毫克b.i.d.、大约16毫克b.i.d.、32毫克b.i.d.、64毫克b.i.d.)。在一个实施方案中,活性成分被滴定上至预定剂量(例如滴定上至0.1毫克b.i.d.、0.2毫克b.i.d.、0.4毫克b.i.d.、0.6毫克b.i.d.、0.8毫克b.i.d.、1毫克b.i.d.、2毫克b.i.d.、4毫克b.i.d.、8毫克b.i.d.、16毫克b.i.d.、32毫克b.i.d.、64毫克b.i.d.等等)。在一个实施方案中,活性成分被滴定上至预定剂量(例如滴定上至大约0.1毫克b.i.d.、大约0.2毫克b.i.d.、大约0.4毫克b.i.d.、大约0.6毫克b.i.d.、大约0.8毫克b.i.d.、大约1毫克b.i.d.、大约2毫克b.i.d.、大约4毫克b.i.d.、大约8毫克b.i.d.、大约16毫克b.i.d.、大约32毫克b.i.d.、大约64毫克b.i.d.等等)。在一个实施方案中,活性成分被滴定上至预定剂量,该剂量如本文中其它地方所述。在一个实施方案中,活性成分或其盐、共晶、复合物或衍生物(例如药学上可接受的盐)可以根据本文中涵盖的组合物和方法以通过产品组合物中的浓度实现的剂量施用于受试者。在一个实施方案中,组合物或产品组合物以按重量计0.001%、0.005%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、5.1%、5.2%、5.3%、5.4%、5.5%、5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%、6.5%、6.6%、6.7%、6.8%、6.9%、7.0%、7.1%、7.2%、7.3%、7.4%、7.5%、7.6%、7.7%、7.8%、7.9%、8.0%、8.1%、8.2%、8.3%、8.4%、8.5%、8.6%、8.7%、8.8%、8.9%、9.0%、9.1%、9.2%、9.3%、9.4%、9.5%、9.6%、9.7%、9.8%、9.9%或10.0%的浓度包含活性成分。在一个实施方案中,组合物或产品组合物以按体积计0.001%、0.005%、0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%、5.1%、5.2%、5.3%、5.4%、5.5%、5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%、6.5%、6.6%、6.7%、6.8%、6.9%、7.0%、7.1%、7.2%、7.3%、7.4%、7.5%、7.6%、7.7%、7.8%、7.9%、8.0%、8.1%、8.2%、8.3%、8.4%、8.5%、8.6%、8.7%、8.8%、8.9%、9.0%、9.1%、9.2%、9.3%、9.4%、9.5%、9.6%、9.7%、9.8%、9.9%或10.0%的浓度包含活性成分。在一个实施方案中,组合物或产品组合物以按重量计0.001%至0.005%、0.0005%至0.01%、0.01%至0.05%、0.01%至0.1%、0.1%至0.3%、0.1%至1.0%、0.1%至3%、1%至3%、1%至5%或1%至10%的浓度包含活性成分。在一个实施方案中,组合物或产品组合物以按体积计0.001%至0.005%、0.0005%至0.01%、0.01%至0.05%、0.01%至0.1%、0.1%至0.3%、0.1%至1.0%、0.1%至3%、1%至3%、1%至5%或1%至10%的浓度包含活性成分。在一个实施方案中,任何前述活性成分可以以任何前述浓度或质量百分比施用。在一个实施方案中,活性成分或其盐、共晶、复合物或衍生物,例如药学上可接受的盐可以基于该活性成分的所需血浆浓度使用和/或施用于受试者。在一个实施方案中,施用于受试者的活性成分的剂量通过确定在受试者体内获得大约10纳克/毫升该活性成分的血浆浓度所需要的剂量来确定。在一个实施方案中,施用于受试者的活性成分的剂量通过确定在受试者体内获得大约1纳克/毫升、大约2纳克/毫升、大约3纳克/毫升、大约4纳克/毫升、大约5纳克/毫升、大约6纳克/毫升、大约7纳克/毫升、大约8纳克/毫升、大约9纳克/毫升、大约10纳克/毫升、大约12纳克/毫升、大约14纳克/毫升、大约16纳克/毫升、大约18纳克/毫升、大约20纳克/毫升、大约25纳克/毫升、大约30纳克/毫升、大约35纳克/毫升、大约40纳克/毫升、大约45纳克/毫升、或大约50纳克/毫升该活性成分的血浆浓度所需要的剂量来确定。在一个实施方案中,任何前述活性成分可以以任何前述剂量或浓度施用。该剂量可以作为每周剂量、每日一次剂量、每日两次(b.i.d.)、每日三次、每日四次、每日五次或更频繁地施用。在一个实施方案中,施用频率可以为一天1至5次。在另一实施方案中,施用频率可以为一天2至4次。在另一实施方案中,施用频率可以为一天至少3次。在另一实施方案中,施用频率可以为一天两次。在另一实施方案中,施用频率可以为一天一次。在另一实施方案中,施用频率可以比一天一次频率更低。在其它实施方案中,施用频率可以为每2天一次或每3天一次或每4天一次或每5天一次或每6天一次。在另一实施方案中,施用频率可以为一周一次。在另一实施方案中,施用频率可以按照需要,如需要或期望治疗性治疗时。根据本文中涵盖的公开内容,将理解的是如何确定受试者是否需要额外和/或连续计量。还将理解的是,所选择的给药频率可能需要调节活性成分的剂量。根据本文中涵盖的公开内容,还将理解的是所选择的活性成分的剂量可能需要调节给药频率。本文中涵盖的公开内容结合本领域的技术将使得本领域技术人员能够优化该活性成分的剂量和施用该活性成分的频率两者以治疗需要其的受试者。本领域技术人员将进一步理解,除了上述剂量和给药方案的实施方案之外,将考虑剂量和给药方案两者,并且其各自根据需要鉴于接受治疗的受试者的病症来调节。组合物的共同施用在一个实施方案中,本文中描述的组合物与一种或更多种其它药物或消费品结合施用。此类其它药物或消费品可以以本领域已知的形式和剂量,或以替代方案,如上文对使用本文中所述的组合物施用活性成分所述施用或共同施用。术语“共同施用”或“组合疗法”用于描述其中至少两种组合物——其可以包括一种或更多种本文中描述的产品组合物——用于同时治疗、解决或影响本文中所述的皮肤病症或另一种疾病的疗法。在一个实施方案中,有效量的至少两种组合物用于同时治疗、解决或影响本文中所述的皮肤病症或另一种疾病。在另一实施方案中,至少两种活性成分——其组合包含有效量——用于同时治疗、解决或影响本文中所述的皮肤病症或另一种疾病。在一个实施方案中,采用所述至少两种组合物的治疗的结果可以是单独使用各组合物获得的治疗结果的累加,或直接累加,或累加至小于单独用两种组合物获得的结果的程度。在一个实施方案中,使用至少两种组合物的治疗的结果可以程度不同地是协同的。在一个实施方案中,使用至少两种组合物的治疗的结果可以大于单独使用各组合物获得的治疗结果。在一方面,至少两种活性成分的治疗结果小于单独用该活性成分获得的治疗结果,而该组合物中其它活性成分的治疗结果与单独获得的治疗结果大致相同。在一个方面,该组合物中所有活性成分的治疗结果小于单独用该活性成分获得的治疗结果。尽管术语共同施用涵盖了同时向患者施用两种组合物,但是不一定同时向患者施加该组合物,尽管通过该组合物递送的个体活性成分的有效量将同时存在于患者体内。本文中描述的产品组合物可以有利地与至少一种其它治疗剂组合施用以提供皮肤病症或另一种疾病的改善的治疗。本发明的组合、用途和治疗方法还可以在无法对其它已知治疗作出充分响应的患者或消费者的治疗方面提供优势。在一个实施方案中,本文中描述的产品组合物可以施用至已经用至少一种其它皮肤护理组合物进行治疗的患者,以提供本文中描述的病症的任何组合的改善的治疗。在一个实施方案中,本文中阐述的产品组合物与一种或更多种洗剂、泡沫剂或霜剂共同施用。治疗方法和皮肤护理方法本文中描述的产品组合物对皮肤护理和对治疗各种皮肤病症和疾病是有用和有效的。例如,该产品组合物可用于改善皮肤含水度、改善皮肤紧实度、改善皮肤弹性、减少皮肤皱纹平均面积、减小毛孔尺寸、改善皮肤透明度和减少皮肤斑点,或提供任何前述的化妆印象。在一个实施方案中,本文中描述的产品组合物用于治疗皮肤病症或疾病。在一个实施方案中,使用本文中描述的产品组合物治疗皮肤病症或疾病的方法包括向受试者施用该组合物的步骤。在一个实施方案中,使用本文中描述的产品组合物治疗皮肤病症或疾病的方法包括局部施用该组合物的步骤。在一个实施方案中,使用本文中描述的产品组合物治疗皮肤病症或疾病的方法包括向人受试者的面部皮肤局部施用该组合物的步骤。可以通过该产品组合物治疗或化妆处理的皮肤病症包括但不限于,干燥皮肤、湿疹、皮肤变色、苍白的皮肤、痤疮、寻常痤疮、皮肤瑕疵、皮肤变色、皮肤皱纹、牛皮癣、尿布疹、晒伤、皮脂溢、特应性皮炎、慢性单纯性苔癣、毒葛疹、炎性瘙痒、光老化、吸烟者的纹路、薄型皮肤、弹性组织变性、雀斑、日光性着色班、滴状色素减少症、特发性滴状色素减少症、白斑、毛细血管扩张、樱桃状血管瘤、老年性紫癜、日光性粉刺、胶样粟粒疹和脂溢性角化病。可以使用本文中描述的产品组合物治疗、预防或化妆处理的各种皮肤病症还描述在美国专利公开号2002/0004056A1、2004/0156805、2006/0257845和2013/0210759中,其公开内容通过引用并入本文。本文中所述的组合物在活性成分的局部递送中也是有效的,所述活性成分包括化妆品成分、改善皮肤外观的成分、用于治疗或预防疾病或病症的药物活性成分、以及用于改善产品的消费者感知的成分。在一个实施方案中,治疗哺乳动物的疾病(disease或illness)的方法包括使用本文中描述的组合物递送药物活性成分的步骤。在一个实施方案中,改善皮肤外观的方法包括使用本文中描述的组合物递送化妆品成分的步骤。在一个实施方案中,改善产品的消费者感知的方法包括使用本文中描述的组合物递送化妆品成分的步骤。本文中所述的组合物经各种时期施用时有效地治疗皮肤病症和疾病。在一个实施方案中,本文中描述的组合物一天施用一次,持续1、2、3、4、5、6或7天的时期。在一个实施方案中,本文中描述的组合物一天施用两次,持续1、2、3、4、5、6或7天的时期。在一个实施方案中,本文中描述的组合物一天施用三次,持续1、2、3、4、5、6或7天的时期。在一个实施方案中,本文中描述的组合物一天施用一次,持续1、2、3、4、5、6、7或8周的时期,或持续1个月、2个月、3个月、6个月或1年的时期。在一个实施方案中,本文中描述的组合物一天施用两次,持续1、2、3、4、5、6、7或8周的时期,或持续1个月、2个月、3个月、6个月或1年的时期。在一个实施方案中,本文中描述的组合物一天施用三次,持续1、2、3、4、5、6、7或8周的时期,或持续1个月、2个月、3个月、6个月或1年的时期。术语“治疗”(“treating”)(和相应的术语“治疗”(“treat”和“treatment”))包括受试者的姑息、修复和预防(preventative)(“预防性”(“prophylactic”))治疗,以及提供治疗外观的化妆应用。术语“姑息治疗”指的是在不治愈病症的情况下缓和或减轻受试者体内病症的影响或强度的治疗。术语“预防治疗”(以及相应术语“预防性治疗”)指的是预防受试者体内病症的发生的治疗。术语“修复治疗”(“治愈性”)指的是中止受试者体内病症的进展、减轻其病理表现、或将其完全消除的治疗。可以用治疗有效量的化合物、盐或组合物进行治疗,所述化合物、盐或组合物引起诸如研究人员、医生、兽医或临床医师的个体所寻求的组织、系统或受试者的生物或药物响应。术语“治疗”还将理解为不仅包括受治个体所经历的所有症状的完全缓解,而且包括一种或更多种现有症状的减轻,以及通过预先向倾向于或可能发展皮肤病症的个体施用本文中描述的组合物来预防症状的出现。本文中公开的方法可用于治疗表现出皮肤病症的症状的任何哺乳动物,例如用于治疗哺乳动物如猫、狗、大鼠、兔、马等等;但是,在一个优选实施方案中,该方法用于治疗人。在一个实施方案中,皮肤紧实度改善至少5%。在一个实施方案中,皮肤紧实度改善至少10%。在一个实施方案中,皮肤紧实度改善1%至25%。在一个实施方案中,皮肤含水度改善至少5%。在一个实施方案中,皮肤含水度改善至少10%。在一个实施方案中,皮肤含水度改善1%至25%。在一个实施方案中,平均细纹面积改善至少5%。在一个实施方案中,平均细纹面积改善至少10%。在一个实施方案中,平均细纹面积改善1%至25%。在一个实施方案中,皮肤皱纹平均面积改善至少5%。在一个实施方案中,皮肤皱纹平均面积改善至少10%。在一个实施方案中,皮肤皱纹平均面积改善1%至25%。在一个实施方案中,平均皮肤透明度改善至少5%。在一个实施方案中,平均皮肤透明度改善至少10%。在一个实施方案中,平均皮肤透明度改善1%至25%。实施例现在参照下列实施例描述本文中涵盖的实施方案。提供这些实施例仅为说明目的,并且本文中涵盖的公开内容决不应解释为限于这些实施例,而是应当解释为涵盖由于本文中提供的教导而变得显而易见的任何和所有变化。实施例1:皮肤护理产品组合物通过以下程序制备在表1中配方A中规定的范围内或具有表1中配方A中规定的量的产品组合物,并且其还可以使用替代的混合、共混、均化、喷雾或本领域普通技术人员已知的相关制造程序来制备。表1配方A在不锈钢滚筒或罐中使用空气混合器制备该组合物。不得使用带有电气元件的罐,因为它们可能造成爆炸风险。应采用接地线将该滚筒、空气混合器和泵接地,并且操作员在分配和处理乙醇时应佩戴防静电带。在搅拌下向装配有空气混合器的经消毒、带夹套的不锈钢罐中依次加入下列材料:SD乙醇40-B,辛酸/癸酸甘油三酯、己基间苯二酚和亚油酸乙酯的混合物(ASYNTRASL),没药醇与羟基甲氧基苯基癸酮的混合物(SYMRELIEF100,InnovadexLLC,OverlandPark,KS,USA),补骨脂酚(SYTENOLA),3-O-乙基抗坏血酸(Arg-Enb-Vee,CAS#86404-04-8),壬二酸(ORISTARAZA),扁桃酸(ORISTARMA)和烟酰胺PC。持续混合,直到所有固体溶解并获得均匀的混合物。该混合物被称为“主相”。在装配有混合器和刮刀的经消毒、带夹套的不锈钢罐中,以适度轴向和侧扫混合将硅酮油(XIAMETERPMX-1184SILFluid,DowCorning)与癸二酸二异丙酯(DUBDIS,StearinerieDubois,Cedex,France)混合。该混合物被称为“预混相”。将该预混相转移到主相中,并以适度轴向和侧扫混合进行混合,直到获得均匀的混合物。向该组合的混合物中加入在异山梨醇二甲基醚中的10%的羟基频哪酮视黄酸酯(GRANACTIVERETINOID,GrantIndustries,ElmwoodPark,NJ)、共混的紫花苜蓿提取物与菊苣(苣荬菜)根提取物(PHYTINOL,Arbonne,Inc.)和橙花油(OilNeroli)(也称为橙花油(nerolioil),或INCI名称为甜橙(橙)花油),以适度轴向和侧扫混合将其混合直到获得均匀的混合物。实施例2:皮肤护理产品组合物用表2中的配方B中规定的范围制备产品组合物。表2配方B使用实施例1中描述的方法制备该组合物。可以如实施例1中所述添加附加活性成分。实施例3:替代的皮肤护理产品组合物用表3中的配方C中规定的组成制备产品组合物。表3配方C通过预混合SD乙醇40-B、壬二酸、扁桃酸、烟酰胺、SYMWHITE377和DERMX并加热至45-50℃直到所有固体溶解来制备该组合物。随后向该组合物中加入DUBDIS、XIAMETERPMX-1184、BV-OSC、ASYNTRASL、SYSTENOLA和SYMRELIEF100的预混合组合物。还可加入附加活性成分。实施例4:含水皮肤护理产品组合物用表4中的配方D中规定的组成制备产品组合物。表4配方D通过预混合甘油、HYDROLITE5、ZEMEA、DERMX、AZA、MA、SYNOVEAHR、SYMWHITE377和烟酰胺来制备该组合物。将混合物加热至40-50℃直到所有固体溶解。向这之中加入Tween20、BrijIC20、SYSTENOLA、synDOI和SYMRELIEF100以及SENSIVASC50的预混合物。还可加入附加活性成分。实施例5:皮肤护理产品组合物用表5中的配方E中规定的组成或范围制备产品组合物。表5配方E可以使用实施例1中描述的方法制备该组合物。附加活性成分可以按需添加,并且活性成分的水平可以改变。实施例6:具有更干燥、较不柔滑感觉的皮肤护理产品组合物用表6中配方F中规定的组成制备产品组合物。该组合物在施加时提供更干燥、较不柔滑的感觉,这在一些产品和使用方法中可能是有利的。表6配方F可以使用实施例1中描述的方法制备该组合物。附加活性成分可以按需添加。实施例7:具有湿润感觉的皮肤护理产品组合物用表7中配方G中规定的组成制备产品组合物。该组合物提供湿润感觉,这在一些产品和使用方法中可能是有利的。表7配方G可以使用实施例1中描述的方法制备该组合物。附加活性成分可以按需添加。实施例8:具有强润肤性质的皮肤护理产品组合物用表8中配方H中规定的组成制备产品组合物。该组合物提供强润肤性质,这在一些产品和使用方法中可能是有利的。表8配方H可以使用实施例1中描述的方法制备该组合物。附加活性成分可以按需添加。实施例9:组合物的光学透明度该载体组合物与产品组合物的光学透明度可以使用紫外(UV)-可见光谱仪根据下列程序来测量。实施UV-可见光谱测量的细节例如可以在以下文献中找到:D.Skoog等人,PrinciplesofInstrumentalAnalysis,第6版,ThomsonBrooks/ColePublishing,Belmont,CA,2007。使用PerkinElmerLambda25UV-可见光谱仪(Waltham,MA,USA)收集光谱。使用玻璃移液管将样品引入1厘米的石英比色皿中。对于可见光谱,在400至700纳米的可见光谱范围内进行波长扫描,并且对于UV-可见光谱,在190纳米至700纳米的光谱范围内进行波长扫描。狭缝宽度设定在1纳米,扫描速度为480纳米/分钟,数据间隔为1纳米,并且以1秒的循环时间收集1个循环。以吸光度单位收集测量数据并在数据收集后以%透射率单位再处理。对净载体与产品组合物的可见光谱测量的结果显示在图2中。对于载体组合物(“载体”)、根据表5中给出的配方E制备的产品组合物(“含有活性成分的载体”)和根据表5中给出的配方E制备但添加了1%的水的产品组合物(“含有1%外加水的含有活性成分的载体”)、添加了1.5%的水的产品组合物(“含有1.5%外加水的含有活性成分的载体”)和添加了2%的水的产品组合物(“含有2%外加水的含有活性成分的载体”)显示可见光透射光谱。观察到该产品组合物在几乎整个可见光区域上透射光。对根据表5中给出的配方E制备并在UV-可见光谱分析之前在特殊变性乙醇中稀释1∶100体积/体积的产品组合物(“含有活性成分的载体,在SD乙醇中1∶100稀释”)进行UV-可见光谱测量。该产品组合物表现出最大波长为大约360纳米的吸光度。溶液的光学外观可以在图4的照片中看到。显示了根据表5中给出的配方E制备的组合物(标记为4的溶液)和根据表5中给出的配方E制备但添加了1%的水的组合物(标记为6的溶液)、添加了1.5%的水的组合物(标记为7的溶液)和添加了2%的水的组合物(标记为8的溶液)的照片。实施例10:疏水性和亲水性活性成分在载体中的溶解性如表9中所示测量代表疏水性和亲水性化合物的几种活性成分的溶解性。结果展示了该载体的实施方案的预料不到的优异的溶解能力。表9所选活性成分在载体中的溶解性(NS=不可溶,S=可溶)1.硅酮油,XIAMETERPMX-1184(DowCorning)。2.所有值以重量%的单位以比率形式给出,并附加地包括6重量%的活性成分。实施例11:比较四种测试产品对皮肤病症的效果的八周随机化评估进行临床研究以比较表3(配方C)的组合物对两种竞争产品和如表4(配方D)中所述同样制备用于研究的含水皮肤护理组合物。该八周研究随机化研究的目标是评估和比较四种前述皮肤护理组合物减少与面部皮肤老化相关的特征的能力。总计64名受试者参与该研究。基于受过训练的专家作出的视觉属性分级(visualattributegrading)、仪器分析、成像分析和参与者问卷来进行评估。研究目标该研究的目标是评估四种抗老化皮肤治疗产品在按照指示使用1、4和8周后减少老化迹象的能力。特别注意以下观察:(1)通过视觉分级、CUTOMETER和主观问卷评估的在1、4和8周的治疗后紧实面部皮肤;(2)通过视觉分级、主观问卷和CLARITYPro分析(每个产品组10的亚组)评估的在1、4和8周的治疗后在眼角鱼尾纹和口周区域中减少细纹/皱纹的出现;(3)通过视觉分级、主观问卷和CLARITYPro分析评估的在1、4和8周的治疗后减少面部皮肤变色(老年斑);(4)通过视觉分级、主观问卷和CLARITYPro分析评估的在1、4和8周后减少面部皮肤发红;(5)通过视觉分级、主观问卷和CLARITYPro分析评估的在1、4和8周后提高面部皮肤光泽度/明亮度;(6)通过视觉分级和主观问卷评估的在1、4和8周后改善面部皮肤色调;(7)通过视觉分级、CUTOMETER和主观问卷评估的在1、4和8周后改善面部皮肤质地/光滑度;(8)通过视觉分级、主观问卷和CLARITYPro分析评估的在1、4和8周后最小化面部毛孔尺寸外观;(9)通过视觉分级、主观问卷和CLARITYPro分析评估的在1、4和8周后改善面部肤色健康;(10)通过视觉分级、主观问卷和CLARITYPro分析评估的在1、4和8周后改善整体面部皮肤外观;(11)通过视觉分级、水分计仪器评估和主观问卷评估的在1、4和8周后改善面部皮肤含水度;(12)通过仪器评估、CUTOMETER和主观问卷评估的在1、4和8周后改善面部皮肤弹性/紧实度;(13)通过视觉分级、主观问卷和CLARITYPro分析评估,测试产品在改善整体肤色健康方面是主流视黄醇/类视黄醇治疗的X%有效(其中“X%”是通过临床研究评估的量);(14)通过主观耐受、客观耐受和主观问卷评估,与主流视黄醇/类视黄醇治疗相比,测试产品耐受性良好,没有与主流视黄醇/类视黄醇治疗相关的所有粗糙度和刺激;(15)通过视觉分级、主观问卷和CLARITYPro分析评估,测试产品在减少纹路/皱纹、毛孔尺寸和皮肤变色(老年斑)以及改善皮肤色调均匀度、肤色健康、质地/光滑度、光泽度/明亮度、弹性/紧实度和发红方面是主流视黄醇/类视黄醇治疗的X%有效;(16)通过视觉分级、CUTOMETER、主观问卷和CLARITYPro分析评估,X%的受试者在1、4和8周后显示出在纹路/皱纹、皮肤变色(老年斑)、皮肤色调均匀度、肤色健康、质地/光滑度、光泽度/明亮度、毛孔尺寸、弹性/紧实度和发红方面的改善。研究设计该研究是用不少于60名受试者完成的八周的随机化评估,受试者分成每种产品至少15名受试者的四个组。除了一种测试产品之外,所有受试者供应以每日清洁剂和具有防晒系数(SPF)的保湿剂。在八周的研究期之前是一周的仅用肥皂(CAMAY肥皂)的清洗期。使用CUTOMETER和水分计通过仪器来评估面部皮肤状况。此外,对每个产品组10名受试者的子集,总计40名进行CLARITYPro分析。还由受过训练的研究技术人员使用标准顺序量表和视觉模拟量表(VAS)进行皮肤属性的视觉临床分级。利用主观问卷来收集产品功效的消费者感知。在第0周(基线)和在使用测试产品1、4和8周后进行评估。该研究中的参与者分为四个研究组,每个组16名参与者。各研究组提供有不同的皮肤护理组合物或产品。A组提供有类视黄醇产品(YoungPharmaceuticals,Wethersfield,CT,USA)。B组提供有市售PHILOSOPHYMIRACLEWORKER产品(CotyInc.,NewYork,NY,USA)。C组提供有根据本申请的表3中给出的配方C制备并描述在前述实施例3和本申请中的其它地方的组合物。D组提供有根据本申请的表4中给出的配方D制备并描述在前述实施例4和本申请中的其它地方的组合物。招募了足够数量的受试者以确保完成,有不少于60名受试者,或每小组15名受试者的四个小组。至少90%的受试者是高加索人或浅肤色西班牙裔美国人,并且各组中大约10%的受试者是亚洲人。选择参与该研究的所有受试者满足招收的以下纳入和排除标准。参与该研究的受试者满足以下纳入标准:(1)健康的高加索女性,在研究招收时年龄为30至59岁(含端点);(2)自我报告的Fitzpatrick皮肤分型I-IV;(3)能够理解并愿意:完成简要个人病史,审阅并签署知情同意书并遵守所有研究指示;(4)眼角鱼尾纹区域或口周区域中的细纹/皱纹基于标准10厘米视觉模拟量表(VAS)的评分≥3.0或≤7.0厘米,以及基于标准10厘米VAS的弹性/紧实度或色调评分≥3.0或≤7.0;(5)没有任何可能干扰测试产品性能评估的皮肤疾病;(6)愿意签署允许将包括她们的图像的研究结果用于多媒体广告目的的模型发布文档;(7)愿意使用提供的清洁剂和具有SPF产品的保湿剂,并在研究期间避免长时间的面部光暴露并且不使用任何人工晒黑;(8)愿意继续使用所有常用品牌的彩妆,只要它们在保湿/抗老化方面未作出任何主张,并且除了指定测试材料之外避免开始使用任何新的面部产品;(9)愿意不带妆来到实验室;(10)愿意在研究期间除了指定的测试产品之外不使用任何皮肤紧实、抗老化、抗皱、保湿、皮肤增亮或任何其它未指定的产品或已知影响皮肤老化或皮肤变色的局部或全身药物(含有α/β/多-羟基酸、维生素C、大豆、Q-10、氢醌的产品;全身或局部类视黄醇等等);和(11)愿意在研究期间避免任何面部spa治疗,包括面部按摩、微品磨皮、化学换肤、BOTOX等等。受试者如果满足以下任一标准,则其被排除在研究之外:(1)在研究期间怀孕、哺乳或计划怀孕;(2)定期使用(每周>3次)抗组胺药和/或抗炎药;(3)任何对皮肤治疗产品敏感的历史;(4)在进入时显而易见或在进入后确认的任何状况,该状况可能使受试者参与本研究的同意失效和/或限制受试者定期参加所有研究访问或遵守所有其它协议要求的能力,所述状况例如:疾病、损伤、酗酒、药物滥用、精神病、对抗性人格、弱动机、体弱伤残、可能是情感、智力、心理或社会的其它问题;(5)研究员认为是取消招收进入研究资格的正当理由的任何其它状况;和(6)进行该研究的公司或其它测试公司/实验室、化妆品或原料制造商或供应商的雇员。评估和研究程序筛选和清洗程序如下。受试者完成简要病史/个人史,并在接受任何研究指示前阅读和签署知情同意书。为了清洗,所有受试者被指示用CAMAY肥皂每天洗涤面部皮肤至少两次,用温水冲洗。受试者还被指示在整个清洗期内停止使用除了非保湿/抗老化彩妆品之外的所有其它局部面部产品。所有受试者被指示在每次随后的访问前至少一至二小时洗涤其面部。第零周/基线访问程序如下。在到达和访问登记程序后,受试者坐在室温和室内湿度下至少十五分钟以便令她们的面部皮肤平衡至室内环境条件。受试者随后将接受视觉和仪器基线评估。在满足所有纳入/排除标准后,受试者被认为是合格的并被招收。所有发现被记录在适当的病历报告表上。在完成基线评估后,各受试者按照预备的随机化方案接受四种研究产品中的一种,用于在整个研究的剩余时间使用的每目清洁剂,以及具有SPF的保湿剂,用于接下来的十二周的产品使用的日记和使用说明。如果在面部皮肤上发现任何反应,建议受试者立即通知研究中心的工作人员。受试者为接下来的三次访问(第一、四和八周)给出预约时间并被指示在之前一至二小时洗其脸。受试者随后离开基线访问。在第一、四和八周遵循的程序如下。在到达和访问登记程序后,受试者坐在室温和室内湿度下至少十五分钟以便令她们的面部皮肤平衡至室内环境条件。在此期间她们完成主观问卷。所有受试者随后接受预定的视觉和仪器评估。采访受试者和/或对受试者日记和测试产品进行审查,以确保适当地记录可能已经发生的任何不利经历、产品被正确使用、以及对于研究持续时间留有足够量的产品(第八周除外)。所有发现均记录在适当的病例报告表上。在第八周访问时,受试者在满足所有访问要求(包括收回产品和日记)后收到她们参与的津贴。她们随后被该研究遣散。使用以下程序进行视觉评估。受试者的面部皮肤由受过训练的评估者利用标准顺序量表和视觉模拟量表(或VAS)在第零周(基线)和在第一、四和八周进行临床分级。VAS是一种方法,通过该方法可以对不能直接测量的主观特征或态度获取数值评估值。当响应VAS项目时,响应者通过沿着两个端点或锚点响应之间的线(10厘米)指示位置来确定她们对一叙述同意的水平。光老化的迹象可以如下分类:轻度=1-3.9,中度=4-6.9,重度=7-10。利用眼角鱼尾纹和口周区域中的细纹/皱纹、色调、质地/光滑度、光泽度/明亮度、弹性/紧实度和整体外观的VAS。除非指出的地方,所有视觉评估是全面的(面颊、前额、鼻唇区、下巴都有)。相同的受过训练的视觉评估者在整个研究过程中进行所有视觉评估。要在该研究中利用的VAS如下。细纹/皱纹(全面——眼角鱼尾纹)从无至大量分级。细纹/皱纹(全面——口周区域)从无至大量分级。色调从“均匀、健康的肤色”至“不均匀、变色的外观”分级。质地/光滑度从“光滑、柔滑”至“粗大、粗糙”分级。光泽度/明亮度从“容光焕发、明亮的外观”至“暗淡/黯哑和/或灰黄外观”分级。弹性/紧实度(面部/左颊)从“具有良好的拉伸性质的紧实、绷紧表现”至“具有不佳的拉伸性质的松散表现”分级。整体外观从“健康的外表”至“年老/不健康的外表”分级。顺序量表向给定属性的品质分配一个数字。下列顺序量表用于评估本研究的暗斑/变色和产品耐受性(干燥、红斑和水肿)。还使用顺序量表在所有访问中评估了主观耐受。暗斑/变色分级如下:0.0,不存在色差,弱强度(浅棕色);1.0,轻度,淡淡的颜色;2.0,中度色差和强度(浅棕色/棕褐色);3.0,中度/深度色差(棕色/棕褐色);4.0,强烈/深度色差(深棕色/棕褐色)。干燥分级如下:0.0,正常皮肤,无干燥迹象;1.0,轻度,轻微但明确的干燥,存在微细鳞屑,可能具有粉状或灰状外观;2.0,中度,一定程度的鳞片状,一些裂纹明显为隆起的鳞屑;3.0,显著,显著的粗糙起鳞,裂纹明显为隆起的鳞屑;4.0,重度,非常粗糙的起鳞,裂纹进展成裂隙,可能存在红斑(测试部位停止附加产品施加)。红斑分级如下:0,无红斑;1,非常轻微的红斑(几乎不可察觉);2,清晰可辨的红斑;3,中度至重度红斑;4,重度红斑(甜菜红,beetredness)至形成轻微焦痂(深度损伤,测试部位停止附加产品施加)。水肿分级如下:0,无水肿;1,非常轻微的水肿(几乎不可察觉);2,轻微水肿(通过明确凸起而清晰可辨区域边缘);3,中度水肿(凸起大约1毫米);4,重度水肿(凸起超过1毫米并扩展超出暴露区域,测试部位停止附加产品施加)。利用下列量表由受试者对刺痛、麻刺、瘙痒和烧灼进行刺激症状的评估和报告:0=无,1=轻度,2=中度,3=重度。CUTOMETER、水分计和CLARITYPro(通常是每产品组受试者的亚组)用于在该研究中评估受试者的面部皮肤。受试者在任何仪器评估之前停留在室内温度和湿度下至少十五分钟以便确保她们的皮肤平衡至室内环境条件。CUTOMETER(紧实度/弹性)仪器向皮肤表面施加负压并计算皮肤可以被提起的高度以及其恢复至平衡的速率,从而通过波形分析提供紧实度和弹性的测量。使用紧实度的波形变量R0和弹性的波形变量R5的标准测量。在所有访问时在所有受试者的面部右侧上测量紧实度和弹性。角质层水平的面部皮肤表面含水度的测量将使用MoistureMeterSC进行评估,其为实验室级仪器,精确和准确地测量皮肤含水度。该MoistureMeterSC测量由探针、角质层和下方的皮肤层组成的层状结构的电容。测得的电容与角质层水含量成正比。测量频率为1.25MHz。该MoistureMeterSC的有效测量深度取决于干燥层的厚度,并由此是独立的。在所有访问时在所有受试者的面部左侧上进行MoistureMeter测量。CLARITYProStudyManager成像系统在多光谱照明中捕捉全脸、正面和45°侧面图像。白光和深蓝色光图像显示皮肤表面层上方和下方的皮肤状况。该系统使用皮肤特征识别和提取以允许随后的皮肤分析。在每次访问时从来自各产品组的十人亚组中的各受试者(总计四十名受试者)获取一张正面和一张左侧面图像。分析所得图像的皱纹(左):总皱纹计数,细纹计数,深纹计数,眼角鱼尾纹和日周区域皱纹长度,宽度和严重程度;色素沉着(左):总斑点,受影响的面积,色素均匀度;肤色(前):肤色健康、光泽度;以及发红(前):表面下红斑;毛孔(左):毛孔计数,毛孔尺寸,毛孔可见度。就用于皱纹长度和宽度的CLARITYPro分析而言:用于CLARITY的软件基于像素来捕获和评估皱纹宽度和长度。对特定测量时间点提供长度和宽度的计算。因此,为了与基线比较,将使用新的数学算法来近似在两个时间点之间的平均严重程度、长度和宽度的变化。对于CLARITYPro评估,将向主办者提供来自在皱纹长度、宽度和严重程度方面获得最大临床改善(通过评估结果来指示)的亚组的总计五名受试者的照片。这些照片将分析细纹/皱纹(计数、宽度、长度和严重程度)、毛孔尺寸、计数和可见度以及肤色健康/光泽度。在第一周、第四周和第八周访问时向所有受试者提供主观问卷。研究结果研究发现,对四组中的任意一组,在受试者耐受性方面没有显著差异。耐受性评估为干燥、红斑、水肿、刺痛、麻刺、瘙痒或烧灼的增加。对任何测试组未发现统计学上显著的经时恶化。就耐受性而言没有记录任何组之间的统计学差异。视觉皮肤属性分级的总体结果总结如下,其中讨论了显示出显著改善的各个组,而未讨论的所有其它组未显示显著的改善。进行视觉皮肤属性分级以评估暗斑、纹路和皱纹(包括眼角鱼尾纹和口周纹路与皱纹)、色调、质地、光泽度和整体外观。在第4周,对B和D组观察到整体外观的显著改善。在第8周,对于A组,暗斑、纹路和皱纹(包括眼角鱼尾纹和口周纹路与皱纹)、色调、质地、光泽度和整体外观均显著改善。同样在第8周,对于B组,纹路和皱纹(包括眼角鱼尾纹和口周纹路与皱纹)、色调、质地、光泽度和整体外观均显著改善。此外,在第8周,对于D组,纹路和皱纹(包括眼角鱼尾纹和口周纹路与皱纹)和质地得到改善。仪器分析的总体结果总结如下,其中讨论了显示出显著改善的各个组,而未讨论的所有其它组未显示显著的改善。在第1周对A和B组观察到皮肤含水度方面的显著的改善。在第8周对D组观察到皮肤含水度方面的显著的改善。在第8周对C组观察到皮肤紧实度方面的显著的改善。使用CLARITYPro系统的成像分析的总体结果总结如下,其中讨论了显示出显著改善的各个组,而未讨论的所有其它组未显示显著的改善。在第1周,A组显示出在纹路和皱纹的平均长度方面的改善,B组显示出在平均毛孔可见度、肤色健康、皮肤光泽度和明亮度、以及整体发红方面的改善,C组显示出在总纹路和皱纹以及细纹、毛孔计数、平均毛孔尺寸、平均毛孔可见度、肤色健康、皮肤光泽度和明亮度、以及发红变化方面的改善。在第4周,A组显示出在毛孔计数和平均毛孔尺寸方面的改善,B组显示出在毛孔计数与皮肤光泽度和明亮度方面的改善,C组显示出在总纹路和皱纹以及细纹、毛孔计数、平均毛孔尺寸、平均毛孔可见度、肤色健康、皮肤光泽度和明亮度、以及发红变化方面的改善,且D组显示出在皮肤光泽度与明亮度方面的改善。在所有情况下,在第4周,产品C和D的评分显示出比产品A更大的改善。在第8周,A组显示在皱纹严重程度和皮肤光泽度与明亮度方面的改善,B组显示在皱纹严重程度、毛孔计数和皮肤光泽度与明亮度方面的改善,C组显示在皱纹的平均长度与宽度、细纹数量、毛孔计数、肤色健康、皮肤光泽度与明亮度、整体发红和发红变化方面的改善。在表9、10和11中报道了来自CLARITYPro系统的详细研究结果。受试者问卷结果表明四组之间无显著差异。实施例12:皮肤治疗产品的消费者感知与临床功效使用配方E、表5和实施例5中描述的组合物进行临床研究。该研究使用50名女性受试者来进行,以确定该组合物在每天使用一次,持续8周时是否改善了细纹与皱纹的深度和宽度(面积)、皮肤透明度、皮肤斑点、皮肤含水度、皮肤紧实度和皮肤弹性。本研究的目的是确定使用皮肤治疗产品是否:(1)降低了细纹/皱纹的深度(面积);(2)降低了细纹/皱纹的宽度(面积);(3)改善了皮肤透明度/斑点;(4)提高了皮肤含水度;和(5)改善了皮肤紧实度/弹性。50名女性受试者的年龄为33-55岁(中值年龄38-42)。在使用产品2、4和8周后进行评估,除了在单次施加测试产品之后立即和在施加后30分钟、1小时、2小时和3小时对皮肤含水度进行附加评估。研究设计和评估程序应用以下纳入标准来选择该研究的受试者:(1)年龄在33至55岁之间(含端点)的女性,一般健康状况良好(无体格检查需要);(2)在面部具有“5”(明显)或更大的全面细纹评分(仅用于定性目的)的个体;(3)在面部具有“5”(明显)或更大的全面皱纹评分(仅用于定性目的)的个体;(4)在面部具有“~5”(中等的可见变色面积)或更大的皮肤透明度评分(仅用于定性目的)的个体;(5)在面部具有“5”或更大(中等的斑点/不均匀皮肤色调的面积)的皮肤斑点评分的个体;(6)能够阅读、理解并签署知情同意书的个体;和(7)预期能够遵循研究指导、参与研究、对所有访问进行回馈和按照说明书应用该产品的个体。应用以下排除标准来选择该研究的受试者:(1)怀孕、计划怀孕、授乳和/或哺乳(nursing)儿童的妇女;(2)患有任何可见皮肤疾病的个体;(3)面部具有晒伤、晒黑或在研究期间计划伴有光暴露的度假或计划使用人工日光浴的个体;(4)参与同时进行的面部产品研究项目的个体;(5)服用可能于扰测试结果的药物的个体,包括使用甾体/非甾体抗炎药或抗组胺药;(6)在过去2年中在面部接受过激光磨削或磨皮程序或接受过面部化学去皮法(在过去1年中接受过深层去皮;在过去2个月内接受过表面去皮)的个体;(7)患有痤疮、活动性特应性皮炎/湿疹或牛皮癣的个体;(8)在过去10年中在面部进行手术“化妆”程序的个体;(9)任何类型的癌症的治疗或病史;(10)接受哮喘或糖尿病治疗的个体;(11)具有已知的对化妆品或个人护理产品敏感的个体。该研究设计为8周研究,其中各测试受试者根据主办者的使用说明书使用测试产品。受试者向测试机构报告基线访问。受过训练的技术人员全面评估每个受试者面部上的纹路、皱纹、皮肤透明度和斑点以确定资格。在各受试者面部上进行CUTOMETER(Courage+Khazaka,Germany)测量以测量皮肤弹性/紧实度,并在面部上进行CORNEOMETER(Courage+Khazaka)测量以测量皮肤含水度。拍摄各受试者面部的数字照片,并对该照片进行分析以确定细纹/皱纹的深度和宽度(面积)和皮肤透明度/斑点的外观的变化(如果有变化的话)。出于安全目的还进行了刺激评估。向受试者提供该测试产品、使用说明书和每日日记,并指示她们在使用产品2、4和8周后向测试机构报告以便进行附加评估、视觉评估、照片和仪器测量。要求受试者在使用产品2、4和8周后完成问卷。此外,仅在基线访问时,在受过训练的技术人员的监督下施加该测试产品。在施加后即刻和在施加后30分钟、1小时、2小时和3小时进行CORNEOMETER读数以测量皮肤含水度。功效的评估基于基线评估对各观察期的比较。如下进行基线评估。对于基线访问,受试者以刚清洗过的“于净”面部(不带妆或不具有施加的任何皮肤护理产品)向测试机构报告,以便进行基线视觉评估、照片和仪器测量。根据下述程序进行评估。将测试产品和每日日记给予受试者带回家,附有如下说明:在该日记中必须包括下列内容:1.使用该产品的日期和时间(p.n.)。2.使用该方案时你可能出现的任何评论或观察。3.不得在测试期间使用任何新的皮肤护理产品或化妆品。4.在整个测试程序期间不得在你的脸上使用任何其它视黄醇衬垫。5.根据以下指导施加该产品:“每天晚上使用一次。将溶液缓慢倾倒在衬垫上。以轻柔的上下移动在面部擦拭该衬垫。每天早上施加防晒剂。注意:仅供外用。仅按指示使用。远离眼睛和嘴巴。如果发生接触,用水充分冲洗。如果发生刺激、发红或瘙痒,立即联系测试机构。如果怀孕或哺乳的话不得使用。放在儿童拿不到的地方。”如下进行两周、四周和八周评估。在使用产品2、4和8周后获取随访视觉评估、仪器测量和数字照片。此外,受试者在第2周、4周和8周访问时完成问卷。如下进行细纹的全面评估。仅用于定性目的,受过训练的技术人员根据用于细纹评分的量表全面评估各受试者面部上的细纹:0=无;1-3=轻微;4-6=明显;7-9=非常明显。如下进行皱纹的全面评估。仅用于定性目的,受过训练的技术人员根据用于皱纹评分的量表全面评估各受试者面部上的皱纹:0=无;1-3=轻微;4-6=明显;7-9=非常明显。如下进行皮肤斑点的全面评估。仅用于定性目的,受过训练的技术人员根据用于皮肤斑点评分的量表评估各受试者面部上的皮肤斑点:0=完全均匀的皮肤色调(没有可见的变色);1-3=轻微的可见斑点区域;4-6=中等的可见斑点区域;7-9=严重的可见斑点区域。如下进行皮肤透明度的评估。仅用于定性目的,受过训练的技术人员根据用于皮肤透明度评分的量表评估各受试者面部上的皮肤透明度:0=完全均匀的肤色(没有可见的变色);1-3=轻微的可见变色区域;4-6=中等的可见变色区域;7-9=严重的可见变色区域。根据以下程序进行CUTOMETER测量。在基线处和在使用产品2、4和8周后,使用CUTOMETER在各受试者面部上测量皮肤的弹性/紧实度。CUTOMETER测量值的提高表明皮肤弹性/紧实度方面的改善(提高)。降低代表恶化。根据以下程序进行CORNEOMETER测量。在基线处(在产品施加前)和在单次施加后30分钟、1小时、2小时和3小时以及在使用产品2、4和8周后,使用CORNEOMETER在各受试者面部上测量皮肤的水分含量。CORNEOMETER测量值的提高表明皮肤水分的改善(提高)。降低代表恶化。在各评估中进行刺激评估,其中受过训练的技术人员根据下面的量表对各受试者面部进行刺激评估。该评估仅出于安全目的,且不用于确定功效。刺激评分的量表:0=无刺激存在;+=儿乎感觉不到刺激存在;1=存在轻度刺激;2=存在中度刺激;3=存在明显的刺激;4=存在重度刺激。根据以下程序进行数字摄影程序和分析。在每次访问时,使用VISIACR2.2(CanfieldScientific,Fairfield,NewJersey)从正面、右侧和左侧视角拍摄各受试者面部的数字图像。为了确保照片之间的一致性,各受试者在肩部周围覆盖有黑布以消除图片中服装的出现,并且各受试者佩戴黑色头带以便将头发拢开并远离面部。使用IMAGEPRO软件(MediaCybernetics,Bethesda,MD)分析该图像以确定下列参数的变化(如果有变化的话):(1)细纹的深度和宽度(面积);(2)皱纹的深度和宽度(面积);和(3)皮肤透明度/斑点。为了确定细纹深度和宽度(面积)的变化,测量该细纹的深度和宽度(以像素为单位)。平均像素计数减少代表改善。提高代表恶化。为了确定皱纹深度和宽度(面积)的变化,测量细纹的深度和宽度(以像素为单位)。平均像素计数减少代表改善。提高代表恶化。为了确定皮肤透明度/斑点的变化,对色度进行分析。一种颜色不与其它颜色混合的程度是其色度(chromacity)的良好指示。色度评分提高代表皮肤透明度/斑点的改善。降低代表恶化。作为研究的一部分还包括受试者问卷。在第2、4和8周访问时,要求受试者回答该问卷。研究结果选拔五十一(51)名年龄在34至56岁之间的女性受试者。总计50(50/51)名受试者顺利完成研究。一位测试专门小组成员(受试者编号23)因与研究进行无关的个人原因而中断。当在纳入标准中规定的年龄范围之外招收一(1/51)名测试专门小组成员(受试者编号18)时发生方案偏差。(受试者编号18年龄为56岁。)该偏差不影响研究的进行。在每次访问时,受过训练的技术人员使用CUTOMETER在各受试者面部上测量皮肤紧实度。CUTOMETER评估结果显示在表12中。表12平均CUTOMETER测量值平均分±标准偏差(S.D.)、距基线的平均%变化和自基线得到改善的受试者的%*距基线的统计学显著变化p≤0.05当将在使用产品2、4和8周后获得的测量值与基线测量值进行比较时,基于CUTOMETER测量在皮肤弹性/紧实度方面分别存在13.3%、31.4%和40.1%的高度显著的(p<0.001)平均百分比改善。总计100%的受试者在使用产品2、4和8周后显示出改善。在每次访问时,受过训练的技术人员使用CORNEOMETER在各受试者面部上测量皮肤水分。CORNEOMETER评估结果显示在表13中。表13平均CORNEOMETER测量值平均分±S.D.、距基线的平均%变化和自基线得到改善的受试者的%*距基线的统计学显著变化p≤0.05当将在单次施加后30分钟、1小时、2小时和3小时以及在使用产品2、4和8周后获得的测量值与基线测量值进行比较时,基于CORNEOMETER测量在皮肤水分方面分别存在64.0%、121.3%、145.5%、167.7%、164.1%、172.8%和191.9%的高度显著的(p<0.001)平均百分比改善。总计98.0%的受试者在30分钟和3小时处显示出改善,96.0%的受试者在2小时处显示出改善,和100%的受试者在1小时后和在使用产品2、4和8周后显示出改善。在每次访问时,受过训练的技术人员在各受试者面部上评估刺激。表14呈现了平均刺激评分的总结。表14平均刺激评分平均分±S.D.、距基线的平均%变化平均分±S.D.p值距基线的平均%变化基线0.0±0.0--第2周0.0±0.01.0000%第4周0.0±0.01.0000%第8周0.0±0.01.0000%在研究过程中对任何受试者均未观察到刺激。在使用产品2、4和8周后,受过训练的技术人员在各受试者的面部上拍摄了数字图像。使用IMAGEPRO软件,对该图像进行分析以确定细纹面积的变化。表15显示了平均细纹图像分析的总结。表15平均细纹面积图像分析评分平均分±S.D.、距基线的平均%变化和自基线得到改善的%变化*距基线的统计学显著变化p≤0.05当将在使用产品2、4和8周后拍摄的图像与基线图像进行比较时,基于图像分析在细纹面积方面在4周和8周后分别存在9.8%和43.7%的高度显著的(p<0.001)平均百分比改善。在使用产品2、4和8周后,分别有总计58.8%、74.5%和100%的受试者显示出改善。在使用产品2、4和8周后,受过训练的技术人员在各受试者的面部上拍摄了数字图像。使用IMAGEPRO软件,对该图像进行分析以确定皱纹面积的变化。表16呈现了平均皱纹图像分析的总结。表16平均皱纹面积图像分析评分平均分±S.D.、距基线的平均%变化和自基线得到改善的受试者的%*距基线的统计学显著变化p≤0.05当将在使用产品2、4和8周后拍摄的图像与基线图像进行比较时,基于图像分析在皱纹面积方面分别存在7.2%、11.2%和29.2%的高度显著的(p<0.001)平均百分比改善。在使用产品2、4和8周后,分别有总计74.5%、90.2%和100%的受试者显示出改善。在使用产品2、4和8周后,受过训练的技术人员在各受试者的面部上拍摄了数字图像。使用IMAGEPRO软件,对该图像进行分析以确定皮肤透明度/斑点的变化。表17呈现了平均皮肤透明度/斑点分析的总结。表17平均皮肤透明度/斑点图像分析评分平均分±S.D.、距基线的平均%变化和自基线得到改善的受试者的%*距基线的统计学显著变化p≤0.05当将在使用产品2、4和8周后拍摄的图像与基线图像进行比较时,基于图像分析在皮肤透明度/斑点方面在4周和8周后分别存在1.6%和4.2%的统计学显著的(p≤0.05)平均百分比改善。在使用产品2、4和8周后,分别有总计56.9%、74.5%和80.0%的受试者显示出改善。该研究的总体结论总结如下。基于仪器分析,在用该组合物治疗2周、4周和8周后,皮肤紧实度和皮肤弹性得到改善。基于仪器分析,在单次施加该组合物后30分钟和1小时、2小时和3小时以及在用该组合物治疗2周、4周和8周后,皮肤含水度得到显著改善。基于图像分析,在用该组合物治疗4周和8周后,细纹面积显著改善。基于图像分析,在用该组合物治疗2周、4周和8周后,皱纹面积显著改善。基于图像分析,在治疗4周和8周后,皮肤透明度和皮肤斑点显著改善。实施例13:皮肤治疗产品的临床刺激测试对如实施例3和表3中所述的配方C和如实施例5和表5中所述的配方E进行了临床刺激测试研究。这些研究的目的是确定在封闭斑贴试验条件下重复施加于人受试者(非专有小组)的皮肤后各测试配方的刺激和/或致敏潜力。在研究中从每个受试者处获得知情同意书,并在参与研究之前以书面记录。向每个受试者提供了知情同意书的副本。对两种配方的每一种的测试设定了年龄在18至79岁范围内的至少50名男性和女性受试者的目标招收人数。所选择的受试者是可靠的,并能够阅读和理解指示。受试者不会表现出本将排除应用测试物品或确定各测试配方的潜在作用的任何身体或皮肤病病症。程序该研究使用“9次重复性损伤性(封闭)斑贴试验”(9-RIPT),其描述在Marzulil,F.N.,Maibach,H.I.Contactallergy:predictivetestinginman,ContactDermatitis2,1-17(1976)中。采用诱导期和激发期。在配方C的诱导期测试过程中使用下列程序。将足够量的配方C(大约0.2毫升)放置到2厘米×2厘米的正方形棉布(大约0.05毫升/平方厘米的测试材料)上,将该棉布固定到Scanpor(Allerderm)半封闭医用胶带上。该斑贴(patch)随后施加到各受试者的背部,在肩胛骨与腰部之间,邻近脊柱中线。该程序由受过训练的技术人员/检查员进行,并在每周一、周三和周五重复,直到已经进行9次测试物品的施加。在配方E的诱导期测试过程中使用下列程序。将足够量的测试物品(大约0.2毫升)放置到Parke-Davis封闭斑贴(大约0.05毫升/平方厘米的测试材料)上,将其施加到各受试者的背部,在肩胛骨与腰部之间,邻近脊柱中线。该程序由受过训练的技术人员/检查员进行,并在每周一、周三和周五重复,直到已经进行9次测试物品的施加。在配方C和配方E两者的诱导期过程中,采用下列程序。指示受试者在施加后24小时移除该斑贴。在周二和周四的移除后是24小时的休息期,并且在各周六的移除后是48小时的休息期。受试者返回测试机构,并在正好在下一次斑贴施加前由受过训练的检查员对该部位进行评分。如果受试者在诱导期过程中发展2级或更高水平的红斑的阳性反应,或如果由研究负责人决定,该皮肤响应证明在部位发生改变,该斑贴将被施加至此前未贴斑贴的相邻部位用于下一次施加。如果在新的部位发生2级或更高水平的反应,将不进行进一步的施加。任何反应性受试者将随后在激发期过程中进行测试。在配方C和配方E两者的激发期过程中,采用以下程序。在大约2周的休息期(没有施加测试物品)后,将激发斑贴施加到先前未贴斑贴的(未利用的)测试部位。该部位在施加后24小时和72小时予以评分。指示所有受试者报告在最终激发斑贴读数后发生的任何延迟的皮肤反应性。当得到证明时,将选择的测试受试者召回诊所以进行附加的检查和评分以确定在激发斑贴反应性方面可能的提高或降低。根据下列6分量表对该研究的诱导期和激发期两者的皮肤反应进行评分:0=没有任何影响的迹象,+=几乎感觉不到(最小的、微弱的、均匀的或斑点状红斑),1=轻度(粉红色的均匀红斑,覆盖大部分接触部位),2=中度(粉红色-红色红斑,在整个接触部位中均匀),3=显著(鲜红色红斑,具有/不具有瘀点或丘疹),4=重度(深红色红斑,具有/不具有起疱或渗液)。在数据表上适当记录所有其它观察到的皮肤后遗症(例如水肿、干燥、色素减退或色素沉着过度)并描述为轻度、中度或重度。使用下列程序进行数据解释。在诱导期和/或激发期过程中在强度方面保持或增加的水肿、水泡、丘疹和/或红斑可以指示过敏性接触性皮炎。过敏反应通常不会在72-96小时内消退或显著改善。可能发生典型皮肤反应例外。这些可以包括但不限于在诱导期早期对一种或更多种测试产品的过敏性接触敏感的症状。当这种情况在一个受试者中发生时,这样的反应通常暗示特异反应、或受试者对测试材料或测试材料的组分具有预先暴露和/或致敏、或与类似产品和/或组分具有交叉反应性。此类反应的数据将包括在研究报告中,但不会包括在致敏的最终研究分析/结论中。配方C的研究结果选拔总计55名受试者(15名男性和40名女性,年龄在19至79岁范围内)用于测试程序。五十三(53/55)名受试者令人满意地完成了配方C的测试程序。两(2/55)名受试者因与研究进行无关的个人原因而中断。中断的受试者数据评估直至中断的时间点,但是不用在研究的结论中。在研究过程中在任何时间均没有观察到皮肤反应性。在诱导期和激发期两者过程中,没有受试者收到不为0的皮肤反应评分。在诱导期过程中没有刺激的迹象,并且在激发期过程中没有致敏的迹象。总之,在于54名受试者中进行的重复性损伤性(封闭)斑贴测试程序的条件下,配方E与人受试者的皮肤刺激或过敏性接触性皮炎无关。在研究过程中在任何时间均没有观察到皮肤反应性。在诱导期和激发期两者过程中,没有受试者收到不为0的皮肤反应评分。在诱导期过程中没有刺激的迹象,并且在激发期过程中没有致敏的迹象。总之,在于53名受试者中进行的重复性损伤性(半封闭)斑贴测试程序的条件下,配方C与人受试者的皮肤刺激或过敏性接触性皮炎无关。配方E的研究结果选拔总计55名受试者(16名男性和39名女性,年龄在18至71岁范围内)用于测试程序。五十四(54/55)名受试者令人满意地完成了配方E的测试程序。一(1/55)名受试者因与研究进行无关的个人原因而中断。中断的受试者数据评估直至中断的时间点,但是不用在研究的结论中。在研究过程中在任何时间均没有观察到皮肤反应性。在诱导期和激发期两者过程中,没有受试者收到不为0的皮肤反应评分。在诱导期过程中没有刺激的迹象,并且在激发期过程中没有致敏的迹象。总之,在于54名受试者中进行的重复性损伤性(封闭)斑贴测试程序的条件下,配方E与人受试者的皮肤刺激或过敏性接触性皮炎无关。本文中公开的所有参考文献全部和完全通过引用如同以其全部阐述的那样并入。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1