确定预期心力衰竭住院风险的制作方法
本申请要求2014年7月14日提交的美国临时申请号62/024,285的权益。将以上申请的公开内容通过引用以其全文结合在此。本申请还要求于2014年8月15日提交的美国临时申请号62/037,895的权益。将以上申请的公开内容通过引用以其全文结合在此。
技术领域
本公开涉及医疗设备,且更具体地涉及监测心脏健康的医疗设备。
背景技术:
当心脏不能以响应于充盈压力的适当速率连续泵血时发生慢性心力衰竭(HF)。为了提高心脏泵血的能力,分类为具有II至IV型HF的纽约心脏协会(NYHA)分级状态的充血性心力衰竭患者可需要植入式医疗设备(IMD),诸如植入式复律除颤器(ICD)和具有除颤能力的心脏再同步设备(CRT-D)。尽管使用IMD改善心脏功能,一些HF患者可需要住院。由于心力衰竭住院(HFH),全球医疗保健系统每年花费数十亿美元。标识处于HFH风险的患者以使得能够及时干预并避免昂贵的住院费用仍然是挑战。植入式复律除颤器(ICD)和具有除颤能力的心脏再同步设备(CRT-D)被配置为采集随着HF状态改变的各种诊断度量的数据,并且共同具有表示HFH的增加风险的潜力。由IMD收集的诊断参数数据包括活动、白天心率和夜间心率、房性心动过速/心房纤颤(AT/AF)负荷、AT/AF期间的平均速率、CRT起搏百分比、电击次数和胸内阻抗。此外,诊断度量的预设或可编程阈值在超过时触发通知,称为设备观察。每个设备观测值被记录在IMD报告中。
用于预测HFH风险的一种常规方法是授予萨卡(Sarkar)等人的标题为心力衰竭监测的美国授权前公布号2012/0253207A1。萨卡等人针对出院后时期,其中通过无线传输远程地询问IMD,以使用设备诊断来评估患者的预后。例如,可以在出院后的7天时间段期间进行评估,使得确定患者是否具有1-6天的AF负荷>6小时,差的速率控制(即1天AF>6小时、速率>90bpm),流体指数大于60或100欧姆-天,夜间心率>85bpm,心率变异性小于或等于40ms,室性心动过速或%CRT起搏<90%。如果满足所列出的参数中的任意两个,患者被认为具有再入院的高风险,并且被指定出院后护理(例如护士呼叫或治疗修正)。如果没有符合标准,则认为患者处于较低HFH风险,并对该患者给予较少的关注。虽然萨卡等人提供了关于计算HFH风险的有用信息,期望提供HFH风险的分级。另外,还希望提供开发一种简化HFH风险计算的方法,而不考虑是否触发了两个不同的所列出的参数。
另一种用于估计HFH风险的方法公开在马丁R.考伊(Martin R.Cowie)等人的风险分层研究中,源自植入式设备中监测的参数的综合诊断算法的开发和验证以在动态设置标识患者心力衰竭住院的风险,公开了可以结合前30天的各种IMD诊断变量使用启发式方法评价患者在接下来的30天的HF风险,欧洲心脏杂志(European Heart Journal)(2013年8月14日)(以下称为EHJ文章)。
又另一种方法涉及卡萨莱斯(Cazares)等人的美国专利号8,768,718B2。卡萨莱斯等人使用患者之间的比较用于未来心力衰竭代偿失调的风险分层。当前患者数据由患者监测设备收集。确定与患者相关的参考组。从参考组中选择参考组数据集。数据集包括从患者监测设备接收的类似类型的患者数据。使用概率分布函数生成参考组数据集的模型,并且自动地将所接收的生理数据与模型进行比较以导出患者的指数。这种方法很麻烦。例如,该方法需要生成参考组数据集的模型,并使用概率分布函数自动比较。许多其他方法包括各种复杂性,例如丘(Cho)等人的US 8,777,850,海瑞克(Hettrick)等人的美国授权前申请2012/0109243,安德森(Anderson)等人的US 7,682,316B2。
虽然可以使用多种方法来预测HFH风险,但是可以进行改进。例如,期望开发一种能够容易地实现的评估HFH风险的而不会给医疗保健提供者带来过度的负担的方法。另外,期望具有能够呈现HFH风险的增加分级而不是诸如高风险和低风险的宽泛风险类别的方法或系统。
附图说明
图1是展示了被配置为传输指示心力衰竭的诊断信息的示例系统的概念图,该系统包括联接到植入式医疗引线的植入式医疗设备(IMD)。
图2A是展示了与心脏连接的图1的示例IMD和引线的概念图。
图2B是展示了与心脏连接的联接到植入式医疗引线的不同配置的图1的示例IMD的概念图。
图3是展示了图1的IMD的示例配置的功能框图。
图4是展示了促进用户与IMD的通信的外部编程器的示例配置的功能框图。
图5是展示了包括经由网络联接到图1中所示的IMD和编程器的外部设备和一个或多个计算设备的示例计算机系统的框图。
图6展示了包括可用于确定患者的心力衰竭住院的示例性心力衰竭数据的示例用户界面。
图7展示了包括可用于确定患者的心力衰竭住院的示例性心力衰竭数据的示例用户界面。
图8是组织并存储在随后用于预测患者的预期心力衰竭住院风险的存储器中的示例性技术心力衰竭患者相关数据的流程图。
图9描绘了诊断变量和示例性默认阈值。
图10描绘了取决于心力衰竭患者的数据观察的持续时间和量的示例性心力衰竭住院风险评价。
图11A-图11B图示地描绘其中排除阻抗趋势(图11A)和包括阻抗趋势(图11B)的心力衰竭住院事件率。
图12是描绘与增加的风险相关联的设备和临床事件心血管警报的图形用户界面。
图13A-13C涉及形成其中生成预期心力衰竭风险的查找表的数据库。图13A描绘了一组其中针对一组患者触发的数据观察值的时间轴。图13B描绘了一组用于预测预期心力衰竭住院的与心力衰竭住院相关联的数据观察值类别。图13C是被创建为用于将评估期期间的总数据观察值与预期心力衰竭住院相关联的查找表。
图14描绘了预测患者的预期心力衰竭住院风险的流程图。
图15是描绘了能够向用户显示的设备和临床事件心血管警报的图形用户界面。
具体实施方式
提出了其中医疗设备系统使用通过习惯上用植入式医疗设备(IMD)采集的数据预测患者的心力衰竭住院风险(HFH)的技术。该医疗系统包括在预测患者的HFH风险时访问的外部设备(例如服务器等)。该外部设备具有组织和存储在存储器中用于通过处理器访问的心力衰竭患者相关数据的集合。
收集患者数据涉及多个操作。数据被解释为包括数据,单数形式的数据或复数形式的数据。通常通过植入式医疗设备或其他合适的装置从每个患者收集数据。本文描述的技术集中于由植入式医疗设备和/或通过其他合适的装置测量的数据观察值。数据观察值是超过参数或度量阈值的数据。测量的数据观察值被存储在植入式医疗设备存储器中。然后将数据随后传输并存储到外部设备的存储器中。此外,其他数据被传输并存储到存储器中,其包括在评估期期间患者是否经历HFH。发生在评估期的开始或结束的HFH是否与预测HFH的预期风险无关。本文描述的技术仅确定HFH在评估期期间的某个时间发生。
在将数据存储在外部设备的存储器中之后,计算机系统将回顾期定义为一组评估时间段。例如,患者的回顾期包括两个连续的评估期-先前评估期和当前评估期。先前评估期紧接着发生在当前评估期之前。在一个或多个实施例中,每个评估期延长相同的时间量(例如,30天、45天、60天、75天、90天等)。在一个或多个其他实施例中,评估期可以延长不同的时间量。例如,一个评估期可以是30天,而另一个评估时间段可以是35天。在再又另一个实施例中,先前评估期可以包括与当前评估期相比基本上不同的时间量(例如,针对先前评估期为90天,相比而言针对当前评估期为30天)。在一个或多个其他实施例中,评估期可以包括两个连续的随访会话之间的整个持续时间。可替代地,针对同一患者,随着时间的推移,整个持续时间可以是可变的。例如,随访1和随访2之间的整个持续时间可以是60天,以及随访2和随访3之间的持续时间可以是90天。
每个评估期由其在该评估期期间内患者经历的数据观察值的总量而分类。对数据观察值的总量进行计数,而不考虑数据观察值的类型。为了对评估期进行分类或归类,对数据观察值进行计数以确定在该评估期期间发生的数据观察值的总量。例如,如果在评估期期间存在0个数据观察值,那么评估期被指定为0个数据观察值,并且将评估期置于0个数据观测类别。然后,与零个数据观察值类别相关联的计数器以“1”为增量,以指示评估期已经被确定为具有零个数据观察值。在对所有的评估期进行分类期间或者之后,在具体数据观察值类别内对每个评估期或评估窗计数。在确定被分类为数据观察值类别(例如,0个数据观察值类别,1个数据观察值类别,2个数据观察值类别,3个数据观察值类别等)内的总量评估期之后,将总量存储到外部设备的存储器中。
在同一时间或大约相同的时间,对患者经历的每个当前评估期是否已发生HFH进行判定。如果患者在当前评估期期间经历了HFH,那么用于该具体数据观察值类别的HFH计数器增量为“1”。
然后针对每个数据观察值类别估计HFH的风险。例如,用于估计针对指定为0、1、2、3或更多个数据观察值的每个评估期的HFH风险的等式如下:
然后针对每个数据观察值类别估计HFH的预期风险。例如,用于估计针对指定为0、1、2、3或更多个数据观察值的每个评估期的HFH风险的等式如下:
或者,以另一种方式说明如下:
HFH风险=(HFH下一个)/N下一个
其中HFH下一个是针对该具体数据观察值类别在当前预测期期间发生的HFH(在图13B中被示为“HFH”)的总量,而N下一个表示与具体数据观察值类别相关联的评估窗的总数(也称为“风险评价窗”或“风险预测窗”)。
此后,创建将评估期期间的总数据观察值与预期心力衰竭住院相关联的查找表。在数据库完成并且被存储在存储器中之后,可以使用查找表来估计患者的预期心力衰竭住院风险。
例如,可以通过植入式医疗设备采集患者数据,该医疗设备在先前评估期期间指示患者经历2个数据观察值以及针对当前评估期指示患者经历1个数据观察值。使用总数据观察值,访问查找表,以及针对每个评估期确定心力衰竭住院风险。在一个或多个实施例中,通过使用加权因子来确定预期心力衰竭住院风险,其中后者评估时间段相比于较早的评估时间段加权更重。在一个或多个其他实施例中,每个评估期可以基于用户定义的输入被自动加权。
在一个或多个其他实施例中,医师能够通过将数据输入计算机来获得为患者定制的HFH风险,计算机需要生成将HFH患者的数据与医师的患者的一个或多个特征单独相关联的新的查找表。例如,可以生成新的查找表,查找表中的数据限于从具有与医师的患者共享的特征的患者采集的心力衰竭数据,所述特征诸如单独的性别(即,仅限于女性的数据,仅限于男性的数据)、年龄(例如,儿科患者)或一些其他年龄分组(即,超过40岁,超过50岁,超过60岁,40至50岁,50至60岁,60至70岁等)或其他合适的类别。在一个或多个其他实施例中,可以通过考虑可与患者的健康史更相关的一个或两个参数来进一步定制HFH风险。例如,医师可以关注在数据库中找到的参数的子集。然后可以使用图形用户界面来向用户显示患者的预期心力衰竭住院风险。
本公开被配置为提供比常规方法更现实的HFH风险。例如,在一个或多个实施例中,与当前评估时间段之前的评估期相比,通过对最近评估期(即,当前评估期)进行更重的加权来计算预期HFH风险。而另一个区别是本公开提供增加的粒状风险水平,这也增加了估计HFH风险的准确性。通过能够使用当前可用的诊断数据更现实地预测患者的HFH风险,患者或医师可以采取行动以最小化或潜在地避免患者经历HFH。例如,可以调整治疗以避免HFH。预防HFH可以潜在地改善长期患者结果,同时降低护理成本。
本公开实现了优于常规方法的许多益处。例如,本领域技术人员将理解,本公开能够呈现HFH风险的增加的分级,而不是宽泛的风险分类。此外,与常规方法相比,本公开通过只需要评估期内的数据观察值的总数来易于估计HFH的预期风险,而不过度地增加医疗保健提供者的负担。
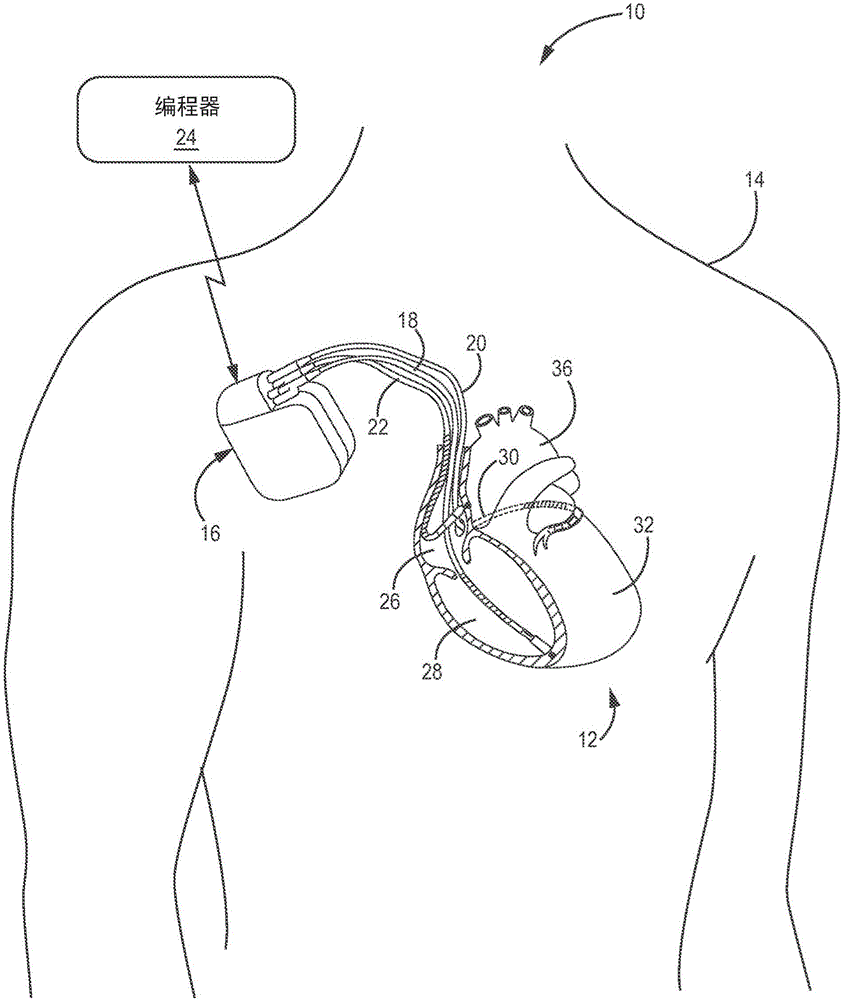
图1是展示了被配置为传输指示患者14的心力衰竭诊断信息的示例系统10的概念图。在图1的示例中,系统10包括IMD 16,所述IMD联接到引线18、20和22以及编程器24。IMD 16可以是例如植入式起搏器、复律器和/或除颤器,其经由联接至引线18、20和22中的一条或多条的电极向心脏12提供电信号。患者14通常是人类患者,但也不一定如此。
一般来说,本公开中描述的技术可以通过感测指示患者14内的心脏活动、患者14活动和/或流体体积的信号的任意医疗设备(例如,植入式的或外部的设备)来实现。作为一个可替代的示例,本文描述的技术可以在生成心脏12的电描记图并且检测患者14的胸液容量、呼吸和/或心血管压力的外部心脏监测器中实现。
在图1的示例中,引线18、20、和22延伸至患者14的心脏12内来感测心脏12的电活动和/或将电刺激递送到心脏12。引线18、20和22还可以用于检测指示患者14体内的流体体积、呼吸速率、睡眠呼吸暂停或者其他患者度量的胸阻抗。呼吸度量(例如呼吸速率、潮气量和睡眠呼吸暂停)也可以经由电描记图检测,例如基于与呼吸相关的心脏电描记图中的信号分量。在图1中示出的示例中,右心室(RV)引线18延伸通过一个或多个静脉(未示出)、上腔静脉(未示出)和右心房26并进入右心室28。左心室(LV)冠状窦引线20延伸通过一个或多个静脉、腔静脉、右心房26,并且进入冠状窦30至相邻于心脏12的左心室32的游离壁的区域。右心房(RA)引线22延伸通过一个或多个静脉和腔静脉,并且进入心脏12的右心房26。
在一些示例中,系统10可另外或可替代地包括一条或多条引线或一个或多个引线段(图1中未示出),它们在腔静脉或其他静脉内部署一个或多个电极。此外,在一些示例中,系统10可另外或可替代地包括具有被植入在心脏12外部的电极的临时或永久心外膜引线或皮下引线,作为经静脉的心脏内引线18、20和22的替代或补充。这样的引线可以用于心脏感测、起搏或心脏复律/除颤中的一种或多种。例如,这些电极可允许在一些患者体内提供改善的或补充的感测的可替代电感测配置。在其他示例中,这些其他引线可以用于检测作为用于标识心力衰竭风险或流体保持水平的患者度量的胸内阻抗。
IMD 16可以经由被联接到引线18、20、22中的至少一个上的电极(在图1中未示出)感测伴随心脏12的去极化和复极化的电信号。在一些示例中,IMD 16基于心脏12内感测的电信号来向心脏12提供起搏脉冲。由IMD16使用的用于感测和起搏的电极的配置可以是单极的或双极的。IMD 16可检测心脏12的心律失常,如心房26和36和/或心室28和32的心动过速或纤颤,并且还可经由位于引线18、20、22中的至少一个上的电极来提供除颤治疗和/或复律治疗。在一些示例中,IMD 16可被编程以递送治疗的进展,例如具有升高的能量水平的脉冲,直至心脏12的纤颤停止。IMD 16可采用在本领域中已知的一种或多种纤颤检测技术来检测纤颤。
另外,IMD 16可以针对存储在IMD 16中和/或用于产生心力衰竭风险水平的患者度量监测心脏12的电信号。IMD 16可以利用引线18、20、22上携带的任意电极中的两个来产生心脏活动的电描记图。在一些示例中,IMD 16还可以使用IMD 16(未示出)的壳体电极来产生电描记图并监测心脏活动。尽管可使用这些电描记图来监测心脏12的潜在心律失常和其他失调以便治疗,还可使用电描记图来监测心脏12的状况。例如,IMD 16可以监测心率(夜间和白天时间)、心率变异性、心室或心房固有起搏率、血流指标、或心脏12泵血能力或心力衰竭进展的其他指标。
在一些示例中,IMD 16还可以使用引线18、20和22的任意两个电极或壳体电极来感测患者14的胸内阻抗。当患者14的胸腔内的组织的流体含量增加时,两个电极之间的阻抗也可改变。例如,RV线圈电极和壳体电极之间的阻抗可以用于监测胸内阻抗的变化。
IMD 16可以使用胸内阻抗来产生流体指数。随着流体指数增加,更多的流体被保持在患者14体内,并且心脏12可以被压迫以跟上移动更大量的流体。因此,该流体指数可以是在诊断数据中传输或用于产生心力衰竭风险水平的患者度量。通过监测除了其他患者度量之外的流体指数,IMD 16可以相对于当仅监测一个或两个患者度量时可能发生的假阳性心力衰竭标识的数量,减少假阳性心力衰竭标识的数量。此外,IMD 16以及本文所述的其他联网计算设备可以促进患者14的远程监测,例如,患者在住院后的时间期间不在保健机构或与保健专业人员相关联的诊所中时,由医疗保健专业人员进行监测。在萨卡等人的标题为“基于阻抗测量检测恶化心力衰竭”的美国专利公开号2010/0030292(其公开于2010年2月4日)中描述了用于测量胸阻抗和确定流体指数的示例系统,并且将此专利通过引用以其全文结合在此。
IMD 16还可以与外部编程器24进行通信。在一些示例中,编程器24包括外部设备,例如手持计算设备、计算机工作站或网络计算设备。编程器24可以包括从用户接收输入的用户界面。在其他示例中,用户还可以经由联网的计算设备远程地与编程器24交互。用户可以与编程器24交互以与IMD 16通信。例如,用户可以与编程器24交互以发送询问请求并且从IMD 16检索患者度量或其他诊断信息。用户还可与编程器24交互以对IMD16进行编程,例如选择IMD 16的操作参数值。尽管用户是医师、技术人员、外科医生、电生理学家或其他医疗保健专业人员,但是在一些示例中,用户可以是患者14。
例如,用户可以使用编程器24从IMD 16检索关于患者度量数据和/或心力衰竭风险水平的信息。心力衰竭风险水平可以作为诊断信息被传输。虽然编程器24可以在提交询问请求之后检索该信息,但是例如如果心力衰竭风险水平指示需要改变患者治疗,IMD 16则可以推送或传输心力衰竭风险水平。例如,可以基于患者度量超过其代表性阈值的总数来确定风险水平的分级。另外或可替代地,风险水平可以单独地由在预先指定或后来指定的时间段内与一个或多个度量相关联的数据观测值的总数来确定。
IMD 16、外部设备114和/或编程器24可以生成HFH风险水平。示例性患者度量数据可以包括心脏内或血管内压力、活动、姿势、呼吸、胸阻抗、阻抗趋势等。
作为另一个示例,用户可使用编程器24从IMD 16检索关于IMD 16或系统10的其他部件(例如引线18、20和22或IMD 16的电源)的性能或完整性的信息。在一些示例中,任意这种信息可以作为警报(例如,通知或指令)呈现给用户。此外,每当编程器24可由IMD 16检测时,可从IMD16推送警报以促进警报递送。IMD 16可以无线地传输警报或其他诊断信息,以便于立即通知心力衰竭状况。
编程器24还可以允许用户定义IMD 16如何感测、检测和管理每个患者度量。例如,用户可以定义采样的频率或用于监测患者度量的评估窗。另外或可替代地,用户可以使用编程器24来设置用于监测每个患者度量的状态的每个度量阈值。度量阈值可以用于确定何时一个或多个患者度量已经达到指示处于心力衰竭和/或心力衰竭住院风险的量值。在一些示例中,当数据超过其相应的度量阈值时,可以针对该评估期对度量进行计数。例如,如果一个或多个患者度量超过其阈值预定数量,则可以以例如在三十天内患者14住院的增加的风险水平的分级显示HFH风险水平。HFH风险水平基于预定数量的数据观察。在其他示例中,预定数量可以被设置为不同的数量或风险水平百分比(分数)。以这种方式,预定数量超过度量阈值。编程器24可以用于设置该预定数量或用于生成和解释心力衰竭风险水平的任意其他因素。
IMD 16和编程器24可以使用本领域已知的任意技术经由无线通信进行通信。通信技术的示例可以包括例如射频(RF)遥测术,但是也可以考虑其他通信技术,例如磁联接。在一些示例中,编程器24可以包括可以邻近患者的身体靠近IMD 16植入位点放置的编程头部,以便改善IMD 16与编程器24之间的通信质量或安全性。
IMD 16可以自动检测每个患者度量并将它们存储在IMD内用于稍后传输。尽管在一些示例中IMD 16可以自动检测多个(例如10个或更少)不同的患者度量,但是在其他示例中IMD 16可以检测更多或更少的患者度量。例如,患者度量可以包括两个或更多个胸液指数、心房纤颤持续时间、心房纤颤期间的心室收缩速率、患者活动、夜间心率、心率变异性、心脏再同步治疗(CRT)百分比(例如,提供心脏再同步起搏的心动周期的百分比)、或治疗性电击的发生或数目。度量特异性阈值可以包括以下中的至少两个:约60的胸液指数阈值、约6小时的心房纤颤持续时间阈值、持续24小时大约等于每分钟90次搏动的心室收缩速率阈值、持续连续七天每天约等于1小时的患者活动阈值、持续连续七天每分钟大约85次的夜间心率阈值、持续连续七天大约40毫秒的心率变异性阈值、持续连续七天中的五天的心脏再同步治疗百分比为90%的阈值、或1次电击的电击阈值。除了在住院时间期间和住院后时间期间传输诊断信息之外,IMD 16可以在住院时间之前向临床医生或其他用户传输诊断信息。换言之,IMD 16可以针对心力衰竭代偿失调事件在患者14曾被许可进入医院之前向临床医生传输心力衰竭风险水平。所传输的风险水平可以类似于住院后风险水平,但是在一些示例中,在住院前传输的风险水平可以响应于来自临床医生或其他用户的询问请求或者达到更严重水平的风险水平(例如高或中等住院风险)时不太频繁地传输。
另外,IMD 16可改变存储在IMD 16内的患者度量的方法。换言之,IMD 16可以以动态数据存储速率自动地存储检测到的数据观察值。在患者14被许可进入医院之前,例如在住院时间之前,临床医生或许可医疗保健专业人员可以向IMD 16提交询问请求,以便检索存储的患者度量的一部分。患者度量可以帮助临床医生确定患者14的住院是否是谨慎的治疗行动。响应于询问请求,IMD 16可以传输存储在IMD 16中的至少一些自动检测的患者度量。
图2A是更为详细地展示了系统10的IMD 16和引线18、20和22的概念图。如图2A所示,IMD 16联接到引线18、20和22。引线18、20、22可以经由连接器块34电联接到IMD 16的信号发生器(例如,刺激发生器)和感测模块上。在一些示例中,引线18、20、22的近端可包括电联接至IMD16的连接器块34内的对应电触头的电触头。另外,在一些示例中,引线18、20、22可以借助于固定螺钉、连接销、按扣连接器或另一种适当的机械联接机构机械地联接到连接器块34上。
每个引线18、20、22包括细长的绝缘引线体,该引线体可以携带许多通过管状绝缘鞘而彼此分隔开的同心盘绕导体。双极电极40和42被定位成与右心室28中的引线18的远端相邻。此外,双极电极44和46被定位成与冠状窦30中的引线20的远端相邻,并且双极电极48和50被定位成与右心房26中的引线22的远端相邻。在所展示的示例中,不存在定位于左心房36中的电极。然而,其他示例可以包括位于左心房36中的电极。
电极40、44和48可以采取环形电极的形式,并且电极42、46和50可以采取对应地可回缩地安装在绝缘电极头52、54和56内的可延长螺旋尖端电极的形式。在其他实例中,电极42、46和50中的一者或多者可以采取在尖齿形引线的尖端或其他固定元件处的小型圆状电极的形式。引线18、20、22还对应地包括可以采取线圈形式的细长电极62、64、66。每个电极40、42、44、46、48、50、62、64和66可以被电联接到其相关联的引线18、20、22的引线体内的对应螺旋导体上,并且由此被联接到引线18、20和22的近端上的对应电触头上。
在一些示例中,如在图2A中展示,IMD 16包括一个或多个壳体电极,诸如壳体电极58,该一个或多个壳体电极可以与IMD 16的气密壳体60的外表面一体地形成或以其他方式被联接到壳体60上。在一些示例中,壳体电极58由IMD 16的壳体60的面朝外部分的非绝缘部分限定。壳体60的绝缘部分与非绝缘部分之间的其他区分可以被采用来限定两个或更多个壳体电极。在一些示例中,壳体电极58包括基本上全部的壳体60。如参考图3进一步详细地描述那样,壳体60可围绕产生诸如心脏起搏脉冲和除颤电击的治疗刺激的信号发生器以及用于监测心脏12的心律的感测模块。
IMD 16可以经由电极40、42、44、46、48、50、62、64和66感测伴随心脏12的去极化和复极化而来的电信号。电信号经由相应的引线18、20、22从电极传导到IMD 16。IMD 16可以经由电极40、42、44、46、48、50、62、64和66的任意双极组合感测此类电信号。此外,电极40、42、44、46、48、50、62、64和66中的任一个都可与壳体电极58组合用于单极探测。用于感测的电极的组合可称为感测配置或电极向量。
在一些示例中,IMD 16经由电极40、42、44、46、48和50的双极组合递送起搏脉冲,以产生心脏12的心脏组织的去极化。在一些实例中,IMD16经由电极40、42、44、46、48和50中的任一者与呈单极配置的壳电极58组合来递送起搏脉冲。此外,IMD 16可以经由细长电极62、64、66和壳电极58的任何组合来向心脏12递送除颤脉冲。电极58、62、64、66还可以用来向心脏12递送心脏复律脉冲。电极62、64、66可以由任何适合的导电材料制成,诸如但不限于铂、铂合金或已知可用于植入式的除颤电极的其他材料。用于递送刺激或感测的电极的组合(其相关联的导体和连接器)以及电极之间的任意组织或流体可以限定电通路。
在图1和图2A中展示的系统10的配置仅仅是一个示例。在其他示例中,取代或除了图1展示的经静脉引线18、20、22之外,系统可以包括心外膜引线和/或皮下电极。此外,IMD 16不需要植入患者14体内。在其中IMD 16未被植入在患者14体内的示例中,IMD 16可经由经皮引线感测电信号和/或向心脏12递送除颤脉冲和其他治疗,该经皮引线通过患者14的皮肤延伸到心脏12内或外的各个位置。此外,可由IMD 16使用外部电极或其他传感器来向患者14递送治疗和/或感测被用于生成例如心力衰竭风险水平的诊断信息的患者度量。
另外,在其他示例中,系统可以包括联接到IMD 16上的任意适合数量的引线,并且各引线可以延伸到心脏12内或邻近心脏的任意位置。例如,根据本公开的系统可以包括如图1和图2中所展示定位的三个经静脉引线以及定位在左心房36内或邻近该左心房的另外引线。作为另一个示例,系统可以包括从IMD 16延伸进入右心房26或右心室28的单个引线,或延伸进入对应右心室26和右心房26中的对应一者的两根引线。系统的这两根引线类型的示例在图2B中示出。位于这些另外引线上的任意电极可用于感测和/或刺激配置中。
电极40、42、44、46、48、50、62、64、66和58中的任意一个可以被IMD 16用于感测或检测用于产生患者14的心力衰竭风险水平的患者度量。通常,IMD 16可以从用于治疗患者14的那些电极向量中检测和收集患者度量。例如,IMD 16可以从生成以递送起搏治疗的电描记图中导出心房纤颤持续时间、心率和心率变异性度量。然而,当其他电信号可能更适合于治疗时,IMD 16可利用其他电极来检测来自患者14的这些类型的度量。
除了心脏信号的电描记图之外,电极40、42、44、46、48、50、62、64、66和58中的任一个可以用于感测非心脏信号。例如,两个或更多个电极可以用于测量患者14胸腔内的阻抗。胸内阻抗可以用于生成指示患者14体内积聚的流体量的流体指数患者度量。由于更大量的流体可以指示心脏12上增加的泵送负载,流体指数可以用作HFH风险的指标。IMD 16可以周期性地测量胸内阻抗,以在患者监测的数天、周、月和甚至数年中标识流体指数的趋势。通常,用于测量胸内阻抗的两个电极可以位于患者14胸部内的两个不同位置。例如,线圈电极62和壳体电极58可以针对胸内阻抗用作感测向量,因为电极62位于RV 28内,并且壳体电极58通常位于上胸部区域中的IMD 16植入部位。然而,也可以使用跨过患者14的多个器官或组织的其他电极,例如,仅用于测量胸阻抗的另外的植入电极。
图2B是示例了与图1和2A的系统10类似的另一示例系统70的概念图,但是包括两个引线18、22,而不是包括三个引线。引线18、22分别被植入右心室28和右心房26内。在图2B中示出的系统70可用于生理感测和/或向心脏12提供起搏、复律、或其他治疗。根据本公开的患者诊断数据的检测可以以本文关于三引导系统所描述的方式在二引线系统中执行。在其他示例中,类似于系统10和70的系统可以仅包括一根引线(例如,引线18、20或22中的任一个)以递送治疗和/或传感器并且检测与监测心力衰竭风险相关的患者度量。可替代地,诊断数据可以在利用皮下引线、皮下IMD或甚至外部医疗设备的系统中实现。尽管图1-图2提供了一些有用的IMD 16植入示例,本领域技术人员理解,IMD 16及其相关联的电极可以植入身体的其他位置中,并且可以包括引线或是无引线的。
图3是IMD 16的示例配置的功能框图。在展示的示例中,IMD 16包括处理器80、存储器82、度量检测模块92、信号发生器84、感测模块86、遥测模块88和电源90。存储器82包括计算机可读指令,这些计算机可读指令在由处理器80执行时,致使IMD 16和处理器80执行归属于此处IMD 16和处理器80的不同功能。存储器82可以包括任意易失、非易失、磁、光或电介质,诸如随机存取存储器(RAM)、只读存储器(ROM)、非易失RAM(NVRAM)、电可擦除可编程ROM(EEPROM)、闪存和/或任意其他数字或模拟介质。
处理器80可以包括微处理器、控制器、数字信号处理器(DSP)、专用集成电路(ASIC)、现场可编程门阵列(FPGA)或等效离散或模拟逻辑电路中的任意一个或多个。在一些示例中,处理器80可以包括多个部件,诸如一个或多个微处理器、一个或多个控制器、一个或多个DSP、一个或多个ASIC、或一个或多个FPGA、以及其他离散或集成逻辑电路的任意组合。归属于在此的处理器80的功能可以具体化为软件、固件、硬件或它们的任意组合。
处理器80根据可以存储在存储器82中的治疗参数控制信号发生器84向心脏12递送刺激治疗。例如,处理器80可以控制信号发生器84来递送具有由治疗参数指定的振幅、脉冲宽度、频率或电极极性的电脉冲。
信号发生器84例如经由相应引线18、20、22的导体或者在壳体电极58的情况下经由设置在IMD 16的壳体60内的电导体电联接到电极40、42、44、46、48、50、58、62、64和66。在展示的示例中,信号发生器84被配置成生成电刺激治疗并将电刺激治疗递送给心脏12。例如,信号发生器84可经由至少两个电极58、62、64、66递送除颤电击至心脏12。信号发生器84可以经由分别联接到引线18、20和22的环形电极40、44、48和/或引线18、20和22的螺旋形电极42、46和50来递送起搏脉冲。在一些示例中,信号发生器84以电脉冲的形式递送起搏、复律或除颤刺激。在其他示例中,信号发生器可以以诸如正弦波、方波或其他基本上连续的时间信号的其他信号形式递送这些刺激类型中的一个或多个。
信号发生器84可以包括切换模块,并且处理器80可以使用该切换模块例如经由数据/地址总线选择,可用电极的数据/地址总线来递送除颤脉冲或起搏脉冲。切换模块可包括切换阵列、切换矩阵、多路复用器或适于选择性地将刺激能量联接到所选电极上的任意其他类型的切换设备。
电感测模块86监测来自电极40、42、44、46、48、50、58、62、64或66中的至少一个信号,以便监测心脏12的电活动、阻抗或其他电现象。可以进行感测以确定心率或心率变异性,或者检测心律失常或其他电信号。感测模块86还可包括切换模块来选择使用可用电极中的哪些来感测心脏活动,这取决于在当前感测配置中所使用的电极组合、或电极向量。在一些示例中,处理器80可经由感测模块86内的切换模块来选择用作感测电极的电极,即选择感测配置。感测模块86可包括一个或多个检测信道,每个信道可联接到所选择的电极配置,以经由该电极配置来检测心脏信号。一些检测信道可以被配置为检测心脏事件,诸如P波或R波,并且向处理器80提供此类事件的发生的指示,例如,如凯摩尔(Keimel)等人的美国专利号5,117,824中所描述的,其于1992年6月2日授权,标题为“用于监测电生理信号的仪器”,将其通过引用以其全文结合在此。处理器80可通过经由数据/地址总线提供信号来控制感测模块86的功能。
处理器80可以包括定时和控制模块,其可以具体化为硬件、固件、软件或其任意组合。定时和控制模块可以包括专用硬件电路,诸如从其他处理器80部件(诸如微处理器)分离的ASIC,或由处理器80的部件(其可以是微处理器或ASIC)执行的软件模块。定时和控制模块可以实现可编程计数器。如果IMD 16被配置为生成起搏脉冲并将起搏脉冲递送至心脏12,那么这样的计数器可控制与DDD、VVI、DVI、VDD、AAI、DDI、DDDR、VVIR、DVIR、VDDR、AAIR、DDIR、CRT以及其他起搏模式相关联的基本时间间期。
由处理器80内的定时和控制模块限定的间期可以包括心房起搏逸搏间期和心室起搏逸搏间期,在其期间感测的P波和R波对重启这些逸博间期的定时以及起搏脉冲的脉冲宽度无效的不应期。作为另一个示例,针对向心脏12递送电刺激期间和向所述心脏递送电刺激之后的时间间期,定时模块和控制模块可以停止来自感测模块86的一个或多个信道的感测。这些间期的持续时间可由处理器80响应于存储在存储器82中的数据来确定。处理器80的定时和控制模块还可以确定心脏起搏脉冲的振幅。
在用感测模块86的检测信道感测到R波和P波时,可重置由处理器80的定时和控制模块实现的间期计数器。在IMD 16提供起搏的示例中,信号发生器84可包括例如由切换模块选择性地联接到电极40、42、44、46、48、50、58、62、或66的任意组合的起搏器输出电路,其适于将双极或单极起搏脉冲递送到心脏12腔室中的一个。在此类示例中,通过信号发生器84生成起搏脉冲时,处理器80可重置间期计数器,由此控制心脏起搏功能(包括抗快速性心律失常起搏)的基本定时。
当由感测到的R波和P波重置时,间期计数器中出现的计数值可由处理器80使用以测量R-R间期、P-P间期、P-R间期和R-P间期的持续时间,它们是可存储在存储器82中的测量值。处理器80可以使用间期计数器中的计数来检测快速性心律失常事件,诸如心房纤颤(AF)、房性心动过速(AT)、心室纤颤(VF)或室性心动过速(VT)。这些间期也可以用于检测整体心率、心室收缩速率和心率变异性。一部分存储器82可被配置成多个再循环缓冲器,其能够保持多系列测量间期,这些测量间期可以由处理器80响应于起搏或感测中断的发生进行分析,以确定当前患者的心脏12是否表现出心房或心室性快速性心律失常。
在一些示例中,心律失常检测方法可以包括任意适合的快速性心律失常检测算法。在一个示例中,处理器80可以利用在1996年8月13日发布的授予奥尔森(Olson)等人的标题为“基于优先规则诊断和治疗心律失常的方法和仪器(PRIORITIZED RULE BASED METHOD AND APPARATUS FOR DIAGNOSIS AND TREATMENT OF ARRHYTHMIAS)”的美国专利号5,545,186,或1998年5月26日发布的授予吉尔伯格(Gillberg)等人的标题为“基于优先规则诊断和治疗心律失常的方法和仪器(PRIORITIZED RULE BASED METHOD AND APPARATUS FOR DIAGNOSIS AND TREATMENT OF ARRHYTHMIAS)”的美国专利号5,755,736中描述的基于规则的检测方法的全部或子集。将奥尔森等人的美国专利号5,545,186吉尔伯格等人的美国专利号5,755,736通过引用以其全文结合在此。然而,在其他示例中,处理器80也可以采用其他心律失常检测方法。
在一些示例中,处理器80可以通过标识缩短的R-R(或P-P)间期长度来确定快速性心律失常已经发生。大体而言,处理器80在间期长度降到低于220毫秒(ms)时检测心动过速并且在间期长度降到低于180ms时检测纤颤。这些间期长度仅仅是示例,并且用户可以如所希望地限定间期长度,这些间期长度可以随后存储在存储器82内。作为示例,此间期长度可能需要被检测一定数量的连贯周期,运行窗内的循环的一定百分比,或一定数量心脏循环的运行平均值。
在处理器80基于来自感测模块86的信号检测到心房或心室性快速性心律失常并且需要抗快速性心律失常起搏方案的情况下,由信号发生器84控制产生抗快速性心律失常起搏治疗的时间间期可以通过处理器80加载进入定时和控制模块,以控制其中的逸搏间期计数器的操作,并且限定不应期,在不应期期间R波和P波的检测针对抗快速心律失常起搏重启逸搏间期计数器是无效的。处理器80在IMD16检查和/或询问时间点检测数据(例如数据观察值等)。基于来自感测模块86的信号感测数据。另外,可以基于感测的数据确定需要复律或除颤电击,并且处理器80可以控制由信号发生器84递送的电击的振幅、形式和定时。
存储器82被配置为存储数据。示例性数据能够与各种操作参数、治疗参数、感测数据和检测数据以及与患者14的治疗和处理相关的任意其他信息相关联。在图3的示例中,存储器82还包括度量参数83和度量数据85。度量参数83可以包括由处理器80和度量检测模块92感测和检测用于生成由IMD 16传输的诊断信息的每个患者度量所需的所有参数和指令。度量数据85可以存储从感测和检测每个患者度量产生的所有数据。以这种方式,存储器82存储多个自动检测的患者度量作为生成由于心力衰竭而被许可进入医院的患者14的风险水平所需的数据。
度量参数83可以包括由度量检测模块92自动感测或测量的每个患者度量的定义。这些定义可以包括关于在检测每个度量中使用什么电极或传感器的指令。优选的度量包括(1)阻抗趋势指数(也称为可从位于MN的美敦力公司(Medtronic Inc.)IMD中商购的),(2)胸内阻抗,(3)房性心动过速/心房纤颤(AT/AF)负荷,(4)(AT/AF)期间的平均心室率,(5)患者活动,(6)V率,(7)白天心率和夜间心率,(8)CRT起搏百分比,和/或(9)电击次数。相对于2003年12月3日提交的美国专利序列号10/727,008而进行描述,该专利作为美国专利号7,986,994进行发布并转让给本发明的受让人,将其公开内容通过引用以其全文结合在此。也可以使用其他合适的度量。例如,为患者建立参考或基线水平阻抗,从其中比较随后采集的原始阻抗数据。例如,可以从电极(例如RV线圈到罐)采集原始阻抗,并与参考阻抗进行比较。可以通过在7天(1周)至90天(3个月)的持续时间内平均化阻抗来导出基线阻抗。
度量参数83还可以针对由度量检测模块92自动检测的每个患者度量来存储度量特异性阈值。度量阈值可以是预定的并且在患者14的整个监测期间保持恒定。然而,在一些示例中,度量阈值可以由用户在治疗期间修改,或者处理器80可以自动修改一个或多个度量阈值以补偿某些患者状况。例如,如果正常或基线心率在治疗期间已经改变,则心率阈值可以在监测过程中改变。
在一个实施例中,这些度量特异性阈值可以包括约60的胸液指数阈值、约连续6小时的心房纤颤负荷阈值、持续24小时大约等于每分钟90次搏动的心室收缩速率阈值、持续连续七天每天约等于1小时的患者活动阈值、持续连续七天每分钟大约85次搏动的夜间心率阈值、持续连续七天大约40毫秒的心率变异性阈值、持续连续七天中的五天的心脏再同步治疗百分比为90%的阈值、以及1次电击的电击数阈值。这些阈值在其他示例中可以不同,并且可以由用户(例如,临床医生)针对个体患者而配置。
处理器80可以改变患者度量作为度量数据85存储在存储器82中的方法。换言之,处理器80可以以动态数据存储速率自动地存储检测的患者度量。度量检测模块92可以例如基于患者度量以及任意度量是否超过对应的特定度量阈值而传输诊断数据。在自动地检测的患者度量超过其对应的度量阈值的任意时间,可以对患者度量进行计数。
以这种方式,度量检测模块92可以自动地检测每个患者度量并将它们存储在度量数据85内用于稍后传输。
示例流体指数值和阻抗测量值在标题为“基于阻抗测量值检测恶化心力衰竭”的美国专利申请号2010/0030292中描述过,将其通过引用以其全文结合在此。当胸内阻抗保持较低时,流体指数可增加。相反,当胸内阻抗保持高时,流体指数可降低。以这种方式,流体指数值可以是患者14特有的保留流体的数字表示。在其他示例中,可替代地,可以使用胸内阻抗。
度量数据85是存储器82的一部分,其可以存储由度量检测模块92感测和/或检测的一些或全部患者度量数据。度量数据85可以在评估窗期间滚动地存储每个度量的数据。当新数据进入评估窗时,评估窗可以仅保留最近的数据并从评估窗删除较旧的数据。以这种方式,评估窗可以仅包括预定时间期的最近数据。在一个或多个其他实施例中,存储器可以被配置用于数据的长期存储。处理器80可以在当需要检索和传输患者度量数据和/或产生心力衰竭风险水平时访问度量数据。另外,度量数据85可以存储与患者14的心力衰竭风险相关的任意和所有数据观察、心力衰竭风险水平或其他生成的信息。存储在度量数据85中的数据可以作为诊断信息的一部分被传输。虽然度量参数83和/或度量数据85可以由单独的物理存储器组成,但是这些部件可以简单地是较大存储器82的分配的部分。
度量检测模块92可以自动地感测和检测每个患者度量。然后,度量检测模块92可以基于患者度量生成诊断数据,例如指示阈值已被超过的数据、风险水平。例如,度量检测模块92可以测量胸阻抗,分析心脏12的电描记图,监测递送给患者14的电刺激治疗或感测患者活动。注意,归属于本文的度量检测模块92的功能可以具体化为软件、固件、硬件或其任意组合。在一些示例中,度量检测模块92可以至少部分地是由处理器80执行的软件过程。度量检测模块92可以感测或检测用作生成心力衰竭风险水平或心力衰竭状态的其他指示或者患者14处于住院风险的基础的任意患者度量。在一个示例中,度量检测模块92可以将每个患者度量与在度量参数83中定义的它们各自的度量特异性阈值进行比较,以生成心力衰竭风险水平。度量检测模块92可以自动地检测两个或更多个患者度量。在其他示例中,度量检测模块92可以检测不同的患者度量。
在一个示例中,度量检测模块92可以分析从感测模块86接收的电描记图以检测心房纤颤或房性心动过速,并且确定房性心动过速或纤颤负荷(例如持续时间)以及心房纤颤期间的心室收缩速率。度量检测模块92还可以结合例如来自活动传感器96的实时时钟、患者姿势或活动信号,和/或指示患者何时睡着或醒来的其他生理信号来分析电描记图,以确定夜间(或睡眠)心率或白天(或醒着)心率或白天心率和夜间心率之间的差异,并且还分析电描记图以确定心率变异性或来自一个或多个电描记图的任意其他可检测的心脏事件。如上文所述,度量检测模块92可以使用峰值检测、间期检测或其他方法来分析电描记图。
另外,度量检测模块92可以包括和/或控制阻抗模块94和活动传感器96。阻抗模块94可以用于检测用于产生胸液指数的胸阻抗。如本文所述,阻抗模块94可以利用图1、图2或图3中的电极的任一个以进行胸内阻抗测量。在其他示例中,阻抗模块94可以利用联接到IMD 16或与遥测模块88无线通信的单独的电极。一旦阻抗模块94测量患者14的胸内阻抗,度量检测模块92可以生成胸液指数并将该指数与在度量参数83中定义的胸液指数阈值进行比较。
活动传感器96可以包括能够检测患者14的运动和/或位置的一个或多个加速计或其他设备。因此,活动传感器96可以检测患者14的活动或患者14进行的姿势。度量检测模块92可以例如基于每个活动的量值或持续时间来监测患者活动度量,并将所确定的度量数据与在度量参数83中定义的活动阈值进行比较。除了检测患者14的事件之外,度量检测模块92还可以检测例如如由处理器80指示的由信号发生器84递送的某些治疗。度量检测模块92可以通过信号发生器84监测信号或直接从处理器80接收用于检测的治疗信息。通过该方法检测的示例患者度量可以包括心脏再同步治疗百分比或与递送电击相关的度量。
心脏再同步治疗(CRT)度量可以是每天的时间的量或百分比,或者心动周期的百分比的量,作为示例,即IMD 16向心脏12递送心脏再同步治疗。低CRT量或百分比可以指示有益的治疗没有被有效地递送,并且治疗参数(例如,房室延迟或更低的起搏速率)的调整可以改善治疗功效。在一个示例中,较高的CRT量或百分比可以指示心脏12借助于治疗通过脉管系统充分地泵血以防止流体积聚。在其他类型的心脏起搏(非CRT)或刺激治疗的示例中,较高的治疗百分比可以指示心脏12不能跟上血流量需求。
电击可以是除颤事件或用于将心脏12返回到正常心律的其他高能量电击。度量相关的电击可以是电击的数量或频率,例如,在一段时间内的电击数量。度量检测模块92也可以检测这些患者度量,并将它们分别与在度量参数83中定义的心脏再同步治疗百分比和电击事件阈值进行比较,以确定每个患者度量何时变得临界。在一个示例中,当递送阈值次数的电击时(例如在时间段内,或甚至当患者14甚至接受一次治疗性电击时),电击事件度量可变得临界。
度量检测模块92可以包括检测和监测用于监测患者14和/或生成HFH风险水平的其他患者度量的附加子模块或子例程。在一些示例中,度量检测模块92或其部分可以结合在处理器80或感测模块86中。在其他示例中,用于产生患者度量数据的原始数据可以存储在度量数据85中,用于以后处理或传输到外部设备。外部设备然后可以从原始数据(例如,电描记图或胸内阻抗)产生每个患者度量。在其他示例中,度量检测模块92可以另外地从用于检测IMD 16可以存储为度量数据的每个度量的一个或多个植入或外部设备中接收数据。
在一些示例中,用于生成风险水平的患者度量阈值可以随时间改变,例如,患者度量阈值可以由用户修改或者基于其他患者条件自动地改变。遥测模块88可以从编程器24接收命令,例如以修改一个或多个度量参数83(例如,度量创建指令或度量特异性阈值)。在一些示例中,如果患者14体内存在某些条件,则处理器80可以自动调整度量特异性阈值。例如,如果患者14正在经历某些心律失常或包含在心电图中的数据发生变化(例如,存在ST升高的偏差或存在心室前收缩,以需要阈值变化的这种方式),则可以调整阈值。
处理器80可以基于感测、检测和存储在存储器82的度量数据85中的患者度量来生成HFH风险水平。例如,当度量检测模块92更新每个患者度量时,处理器80可以连续更新HFH风险水平。在其他示例中,处理器80可以根据更新时间表周期性地更新HFH风险水平。在一个或多个其他实施例中,在预先指定的时间期内超过阈值的数据观察值的总数可以用于确定心力衰竭住院的风险。
如上所述,处理器80可以向例如编程器24的用户提供关于来自任意患者度量和/或HFH风险水平的数据的警报。在一个示例中,当编程器24或另一设备与IMD 16通信时,处理器80可以提供具有HFH风险水平的警报。遥测模块88包括用于与诸如编程器24(图1)的另一设备通信的任意适合的硬件、固件、软件或其任意组合。在处理器80的控制下,借助于可以是内部和/或外部的天线,遥测模块88可以从编程器24接收下行链路遥测并向编程器发送上行链路遥测。例如经由地址/数据总线,处理器80可以提供待向编程器24向上传输的数据以及用于遥测模块88内的遥测电路的控制信号。在一些实例中,遥测模块88可以经由多路复用器向处理器80提供所接收数据。
在一些示例中,处理器80可以将由感测模块86内的心房和心室感测放大器电路产生的心房和心室心脏信号(例如,EGM)发送到编程器24。编程器24可以询问IMD 16以接收心脏信号。处理器80可将心脏信号存储在存储器82中,并从存储器82中检索所存储的心脏信号。处理器80还可以生成和存储指示感测模块86检测到的不同心脏事件的标记代码,并将该标记代码发送到编程器24。在马科维茨(Markowitz)的标题为“用于医疗设备的标记信道遥测系统(MARKER CHANNEL TELEMETRY SYSTEM FOR A MEDICAL DEVICE)”的美国专利号4,374,382中描述了具有标记信道能力的示例起搏器,该专利在1983年2月15日发布,并且将其通过引用以其全文结合在此。
在一些示例中,IMD 16可以向编程器24发信号以进一步通过网络(诸如由明尼苏达州的美敦力公司开发的美敦力网络,或将患者14连接到临床医生的一些其他网络)与警报通信并传达警报。以这种方式,网络的计算设备或用户界面可以是递送警报(例如患者度量数据)的外部计算设备。在其他示例中,产生心力衰竭风险水平的一个或多个步骤可以发生在患者14外部的设备内,例如在编程器24内或联网到编程器24的服务器内。以这种方式,IMD 16可以在将患者度量传输到不同的计算设备之前检测和存储患者度量。
除了在住院时间期间和住院后时间期间传输诊断信息之外,处理器80可以控制遥测模块88在住院时间之前向临床医生或其他用户传输诊断信息。如果自动检测的患者度量中的一个超过其对应的度量特异性阈值,那么处理器80可以控制遥测模块来传输该患者度量和可能的其他患者度量,以允许临床医生更准确地诊断患者14的问题。
图4是展示外部编程器24的示例配置的功能框图。如图4中所示,编程器24可以包括处理器100、存储器102、用户界面104、遥测模块106和电源108。编程器24可以是具有针对IMD 16进行编程的专用软件的专用硬件设备。可替代地,编程器24可以是运行使得编程器24能够对IMD 16进行编程的应用程序的现有计算设备。
用户可以使用编程器24来配置IMD 16(图1)的操作参数并从IMD 16检索数据。临床医生可以经由用户界面104与编程器24交互,用户界面104可以包括向用户呈现图形用户界面的显示器,以及用于从用户接收输入的键盘或另一机构。另外,用户可以经由编程器24从IMD 16接收指示心力衰竭风险水平和/或患者度量的警报或通知。换言之,编程器24可以从IMD16接收诊断信息。
处理器100可以采取以下形式:一种或多种微处理器、DSP、ASIC、FPGA、可编程逻辑电路等形式,并且归属于本文的处理器100的功能可以具体化为硬件、固件、软件或其任意组合。存储器102可以存储使处理器100提供归于本文的编程器24的功能的指令,以及由处理器100提供归于本文的编程器24的功能的信息。存储器102可以包括任意固定的或可移除的磁性介质、光学介质或电介质,诸如RAM、ROM、CD-ROM、硬磁盘或软磁盘、EEPROM等。存储器102还可以包括可移除存储器部分,该可移除存储器部分可以用于提供存储更新或存储容量的增加。可移除存储器还可以允许容易地将患者数据转移到另一计算设备,或在编程器24用来对另一患者的治疗进行编程之前将所述患者数据移除。
编程器24可以与IMD 16无线地通信,诸如使用RF通信或近侧感应交互。这种无线通信通过使用遥测模块106而成为可能,该遥测模块可以被联接到内置天线或外置天线上。被联接到编程器24上的外置天线可以对应于程序设计头部,该程序设计头部可以置于心脏12上,如以上参考图1所描述的。遥测模块106可以类似于IMD 16(图4)的遥测模块88。
遥测模块106还可以被配置成经由无线通信技术与另一计算设备通信或通过有线连接来直接通信。可以被采用来促进编程器24与另一计算设备之间的通信的局部无线通信技术的示例包括根据802.11或蓝牙规范设置的RF通信、红外通信(例如,根据IrDA标准或其他标准或专有遥测协议)。以此方式,其他外部设备可以能够在不需要建立安全无线连接的情况下与编程器24通信。与编程器24通信的另外计算设备可以是网络设备,诸如能够处理从IMD 16检索到的信息的服务器。
以这种方式,遥测模块106可以向IMD 16的遥测模块88传输询问请求。因此,遥测模块106可以接收通过请求或基于已经输入到IMD 16的患者状态所选择的数据(例如诊断信息等)或诊断信息。该数据可以包括来自IMD 16的遥测模块88的患者度量值或其他详细信息。该数据可以包括来自IMD 16的遥测模块88的心力衰竭风险水平的警报或通知。当心力衰竭风险水平变得临界时,可以由IMD 16自动传输或推送该警报。另外,警报可以是向医疗专业人员(例如,临床医生或护士)通知风险水平和/或让患者14寻求可能需要再住院的潜在心力衰竭状况的医疗的指令未被处理。响应于接收警报,用户界面104可以向医疗专业人员呈现关于风险水平的警报或呈现让患者14寻求医疗的指令。
响应于心力衰竭数据(例如,风险水平或患者度量)或所请求的心力衰竭信息,用户界面104可向用户呈现患者度量和/或心力衰竭风险水平。在一些示例中,用户界面104还可以突出已经超过多个度量特异性阈值中的对应一个的每个患者度量。以这种方式,用户可以快速地查看促成所标识的心力衰竭风险水平的那些患者度量。
在经由用户界面104接收到警报时,用户还可以与用户界面104交互以取消警报,转发警报,检索关于心力衰竭风险水平(例如,患者度量数据)的数据,修改用于确定风险水平的度量特异性阈值,或进行与患者14的治疗相关的任意其他动作。在一些示例中,临床医生能够查看原始数据以诊断患者14的任意其他问题或监测给予患者14的治疗的功效。例如,临床医生可以检查在利尿剂治疗之后胸内阻抗是否已经增加,或者响应于控制药物的速率心率在心房纤颤期间是否已经降低。用户界面104甚至可以显示伴随警报的治疗(例如某些药物和剂量),以最小化可能由心力衰竭导致的症状和组织损伤。用户界面104还可以允许用户基于心力衰竭风险水平的严重性或危险程度来指定警报的类型和定时。除了心力衰竭风险水平之外,在其他示例中,用户界面104还可以提供潜在的患者度量以允许临床医生监测治疗功效和剩余患者状况。
在一些示例中,编程器24的处理器100和/或一个或多个联网计算机的一个或多个处理器可以执行本文关于处理器80、度量检测模块92和IMD16所描述的技术的全部或一部分。例如,编程器24内的处理器100或度量检测模块92可以分析患者度量以检测超过阈值的那些度量并生成心力衰竭风险水平。
图5是展示示例系统的框图,所述示例系统包括经由网络112联接到在图1中示出的IMD 16和编程器24的外部设备114(例如服务器等)以及一个或多个计算设备120A-120N。网络112通常可用于在住院后时间期间将诊断信息(例如,风险水平)从远程IMD 16传输到另一外部计算设备。然而,网络112还可以用于将诊断信息从IMD 16传输到医院内的外部计算设备,使得临床医生或其他医疗专业人员可以监测患者14。在这个示例中,IMD 16可以使用其遥测模块88来经由第一无线连接与编程器24通信,并且经由第二无线连接与接入点110通信。在图5的示例中,接入点110、编程器24、外部设备114以及计算设备120A-120N互连,并且能够通过网络112彼此通信。在一些情况下,接入点110、编程器24、外部设备114以及计算设备120A-120N中的一者或多者可以通过一种或多种无线连接联接到网络112上。IMD 16、编程器24、外部设备114以及计算设备120A-120N可各自包括一个或多个处理器(诸如一个或多个微处理器、DSP、ASIC、FPGA、可编程逻辑电路等),所述一个或多个处理器可以执行诸如本文所描述的那些的各种功能和操作。接入点110可以包括经由各种连接(诸如电话拨号、数字用户线路(DSL)或电缆调制解调器连接)中的任一种来连接网络112的设备。在其他示例中,接入点110可以通过不同形式的连接(包括有线或无线连接)联接到网络112上。在一些示例中,接入点110可以与患者14协同定位并且可以包括可以执行在此描述的不同功能和操作的一个或多个程序设计单元和/或计算设备(例如,一个或多个监测单元)。例如,接入点110可以包括与患者14协同定位并且可以监测IMD 16的活动的家用监测单元。在一些示例中,外部设备114或计算设备120可以控制或执行本文所述的各种功能或操作中的任意一个,例如基于患者度量比较来生成心力衰竭风险水平或者根据原始度量数据创建患者度量。外部设备114还包括输入/输出设备116、处理器118和存储器119。输入/输出设备116包括诸如键盘、鼠标、语音输入等的输入设备,以及包括图形用户界面、打印机和其他合适装置的输出设备。处理器118包括任意合适的处理器,例如Intel Xeon Phi。处理器118被配置为针对每个评估期设置开始和结束日期。评估期用作评估窗,所述评估窗包括从每个患者采集的处于边界(即开始和结束时间)内的数据。处理器118还被配置为执行各种计算。例如,处理器118计算每个评估期的HFH的风险。在一个或多个实施例中,将加权因子应用到两个或更多个评估期以确定F风险。
存储器119可以包括任意易失、非易失、磁、光或电介质,诸如随机存取存储器(RAM)、只读存储器(ROM)、非易失RAM(NVRAM)、电可擦除可编程ROM(EEPROM)、闪存和/或任意其他数字或模拟介质。
存储器119存储数据。存储在存储器119中的示例性数据包括心力衰竭患者数据、心力衰竭预期风险数据等。评估期开始时间和结束时间也存储在存储器中。心力衰竭患者数据包括数据观察值(例如,从传感器感测的超过阈值的数据)。另外,评估期数据也存储在存储器119中。例如,评估期数据的开始日期和结束日期被存储在存储器119中。
在一些情况下,外部设备114可以被配置为提供用于存档已经从IMD 16和/或编程器24收集和生成的诊断信息(例如,患者度量数据和/或心力衰竭风险水平)的安全存储位置。网络112可以包括局域网、广域网或全球网,诸如互联网。在一些情况下,编程器24或外部设备114可以在网页或其他文档中收集诊断数据、心力衰竭数据、预期心力衰竭风险数据或其他合适的数据,以用于由经训练的专业人员(诸如临床医生)经由与计算设备120相关联的查看终端进行查看。图5的系统在一些方面中可以利用类似于由明尼苏达州明尼阿波里斯市的美敦力公司(Medtronic,Inc.,of Minneapolis,MN)开发的美敦力网络提供的通用网络技术和功能来实施。
以图5的方式,计算设备120A或编程器24例如可以是从多个患者的IMD接收和呈现传输的诊断信息的远程计算设备,使得临床医生可以立即优先处理需要治疗的患者。换言之,临床医生可以通过分析多个患者的HFH水平来对患者进行分诊。计算设备可以使用其通信模块来接收经由网络112从多个IMD传输的诊断信息(例如,心力衰竭数据)。
图6展示了包括诊断数据的用户界面104的示例性屏幕130。如图6所示,屏幕130包括指示患者14由于心力衰竭而住院的风险的风险水平144。如本文所述,心力衰竭风险水平可以指示患者14将第一次住院或另一时间住院(例如,重新住院或再次住入医院)。虽然屏幕130被描述为呈现在编程器24的用户界面104上,但是屏幕130可以呈现在由医疗专业人员使用的任意设备的任意用户界面上。屏幕130的心力衰竭报告可以以预定的频率(例如,每天一次或每周一次)或响应于来自用户的询问请求被传输给用户。如图6所示,屏幕130是包括标识数据132和患者病史数据134的心力衰竭报告。标识数据132包括诸如患者姓名、设备名称、IMD16的序列号、日期、以及甚至医师姓名的项目。患者病史数据134可以是可以帮助治疗患者14的相关数据。
屏幕130还包括关于由IMD 16递送的刺激治疗的信息的临床状态136。屏幕130还呈现趋势概要138。趋势概要138呈现某些患者度量的快照,这些患者度量超过它们各自的度量阈值以促成危险水平144的严重性。临界指标140被提供用于提醒用户具有临界指标140的每个患者度量促成风险水平,因为已经满足或超过度量阈值。在利用统计分析确定风险水平144的示例中,临界指标140可能是不必要的。然而,对于患者14可能被重新住院的概率有显著作用的某些患者度量仍然可以呈现给用户。
在图6的示例中,趋势概要138呈现四个患者度量142A、142B、142C和142D(统称为“患者度量142”)。胸液指数度量142A指示最大检测值96。虽然胸液指数度量142A在该示例中不对风险水平144起作用,但是提供它是因为其是胸液体积和潜在心力衰竭的重要指标。心房纤颤持续时间142B指示患者14已经有28天持续24小时的心房纤颤或房性心动过速。活动度量142C指示患者14在过去4周内每天活动时间小于1小时。另外,心室起搏度量142D(例如,心脏再同步治疗百分比)表示IMD 16已经在小于90%的时间起搏心脏12。如患者度量142所指示,可以给出比仅仅超过阈值更具体的信息。实际观察的患者度量数据或数据的概要可以在趋势概要138中呈现。
风险水平144由双线矩形突出显示,以便于用户进行定位。在其他示例中,风险水平144可以按不同的方式从屏幕130的其余部分突出。例如,风险水平144可以是不同的颜色、字体大小、或者用动画(例如,闪烁或滚动)来呈现。可替代地,风险水平144可以位于屏幕130的顶部或其他易于标识的位置。虽然风险水平144通常被呈现为词语类别,但是风险水平144可以用指示风险水平的严重性的分数、百分比、加权平均值或其他数字分数来呈现。
虽然屏幕130可以是被动地呈现的信息屏幕,但是屏幕130可以是交互式的。用户可以选择屏幕130的区域以查看关于任意患者度量142的更多细节,例如,用户可以从IMD 16请求诊断信息。在其他示例中,屏幕130可以提供滚动条、菜单和导航按钮,以允许用户使用患者度量和风险水平来查看另外的信息、调整治疗、调整度量参数或执行与患者14的治疗相关的其他操作。
图7展示了具有诊断数据的另一个用户界面104的示例屏幕146。屏幕146可以包括来自用于生成患者14的心力衰竭风险水平的所有患者度量的数据(例如,原始或校准的数据)。虽然屏幕146被描述为呈现在编程器24的用户界面104上,但是屏幕130可以呈现在由医疗专业人员使用的任意设备的任意用户界面上。如图7所示,屏幕146提供另一个类似于图6的屏幕130的心力衰竭报告。所包括的是各种患者度量152、154、156、158、160、162、164和166的度量数据。时间轴150指示数据在所有度量图表中代表哪些月份。虽然这四个月的时间段可以是评估窗,但时间轴150可以覆盖许多评估窗。例如,评估窗可以等于一周或一个月,使得在评估窗期满之后审查风险水平。另外,在其他示例中,用户可以利用交互式时间轴150移动通过时间。虽然没有在屏幕146中呈现,但是也可以呈现心力衰竭风险水平。在一些示例中,用户可以针对患者度量选择图表内的任意点以检索在该时间点的患者度量的特定值。
胸液指数度量152被标记为“流体指数”。胸液指数度量152展示出胸液指数在5月和6月的两个月内已经周期性地升高和降低。在一个示例中,胸液指数阈值可以大约是60。然而,胸液指数阈值通常可以在大约40和200之间。
心房纤颤持续时间度量154被标记为“AF持续时间”并且指示患者每天经历了多少小时的心房纤颤。如图所示,由于在6月底显示的心房纤颤的天数,心房纤颤持续时间度量154包括临界指标140。示例心房纤颤持续时间阈值可以大约是6小时。然而,心房纤颤持续时间阈值通常可以设置在大约1小时和24小时之间。
心室收缩度量156标记为“AF+RVR”并且指示心房纤颤期间的心室收缩速率。心室收缩度量156的图表提供了每天的平均心室收缩速率以及在每天期间观察到的最大心室收缩速率。通常,在心房纤颤阈值期间的心室收缩速率可以设定为在24小时内约70次搏动/分钟和120次搏动/分钟之间。在一个示例中,心室收缩速率阈值可以是在24小时内近似等于每分钟90次搏动。在其他示例中,24小时的持续时间可以更短或更长。
活动度量158也用临界指标140突出显示。活动度量158被标记为“活动”并且指示患者每天活动多少小时。例如,当加速度计的输出超过阈值时,可以认为患者是活动的。较低的活动水平可以是心力衰竭的风险因素,并且活动度量158的图表指示患者14在6月底时活动较少。以这种方式,活动的患者度量可以是其中超过度量特异性阈值包括下降到低于阈值的度量。在一个示例例中,患者活动阈值可以是持续连续七天每天大约等于1小时。在其他示例中,阈值可以被设置为在不同持续时间上更多或更少的时间。代替小时/天,活动度量158的其他示例可以提供某些姿势的持续时间,例如,躺下、坐着或站立。一般来说,活动度量158可包括患者活动的严格度的测量和/或患者14活动的时间量的测量。
屏幕148还提供心率度量。心率度量160被标记为“HR”,并且指示针对夜间心率和白天心率中的每一个的单独图表。在一些示例中,夜间心率可以更多地指示心力衰竭风险。一般来说,夜间心率阈值设置为大约70次搏动/分钟和120次搏动/分钟之间持续某一时间段。在一个示例中,夜间心率阈值可以是每分钟大约85次搏动持续连续七天。心率变异性度量162被标记为“HR变异性”并且指示一整天中心率的变化程度。由于较低的心率变异性可以指示不利于通过脉管系统的血流的增加的交感神经紧张,心率变异性也可以是其中超过度量特异性阈值包括下降到低于阈值的患者度量。在一个示例中,心率变异性阈值可以设置为大约40毫秒持续连续七天,但是也可以使用其他变异性阈值。在其他示例中,屏幕148还可以提供两个或更多个患者度量之间的比较,例如,白天心率和夜间心率之间的差异。
另外,屏幕148还可以提供从递送给患者14的治疗中导出的几个患者度量。治疗百分比度量164被标记为“%CRT”,并且指示IMD 16递送心脏再同步治疗例如起搏治疗的每个昼夜的时间百分比。治疗的较低百分比可以指示流过脉管系统减少的血液。一般而言,心脏再同步治疗百分比阈值可以设置为在70%和100%之间的值持续给定时间段。在一个示例中,心脏再同步治疗百分比阈值可以设置为大约90%持续连续七天中的五天。由于夜间治疗百分比小于90%,所以临界指示器140用于突出治疗百分比度量164。
在其他示例中,可以对于接受用双室或单室起搏设备的起搏治疗的患者监测心室起搏百分比。由于心脏中心室收缩的不同步,来自单室心脏再同步治疗设备的增加的心室起搏在一些患者中可增加心力衰竭的风险。相反,双室设备中的下室心室起搏可增加一些患者的心力衰竭的风险。
此外,电击度量166标记为“电击”,并且指示患者14承受的电击事件(例如,复律或除颤)的次数。如图7所示,患者14没有经受任何电击疗法。虽然阈值可以被设置为不同的值,但是电击阈值通常可以被设置为大约1次电击。
由于每个患者度量154、158和164已经超过它们各自的度量特异性阈值,因此针对每个度量提供了临界指标140。除了临界指标140或替代所述临界指标,可以用不同的文本颜色、围绕每个度量的圆圈或框、或每个度量的临界水平的一些其他指示来突出显示患者度量。在其他示例中,可以在心力衰竭度量148中呈现其他患者度量,例如血压、血糖、肺容积、肺密度或呼吸速率、体重、从呼吸衍生的睡眠呼吸暂停负荷、温度、缺血负荷、感测的心脏事件间期、以及肌钙蛋白和/或脑利钠肽(BNP)水平。
尽管屏幕148可以是具有诊断信息的被动地呈现的信息屏幕,但是屏幕148可以是交互式的。例如,用户可以选择屏幕148的区域来查看关于呈现的患者度量任一个的更多细节。用户还可以移动到具有时间轴150的不同时间段。在其他示例中,屏幕130可以提供滚动条、菜单和导航按钮,以允许用户使用患者度量和风险水平来查看另外的信息、调整治疗、调整度量参数或执行与患者14的治疗相关的其他操作。此外,用户可以与每个患者度量的图表交互以展开图表并查看表图的更多细节,甚至可能是单个值。
在其他示例中,诊断信息可以一次呈现一个患者度量,或者甚至IMD 16用于生成患者度量的原始数据。例如,在患者14住院时间期间,IMD 16可以将检测到的胸阻抗传输到治疗患者14的临床医生的远程计算设备上。IMD 16可以按预定的间期或响应于来自临床医生的询问请求来传输检测到的胸阻抗。预定间期通常可以在大约一分钟和四小时之间,但是可以使用其他预定间期。临床医生可以使用诊断信息中的一些或全部来确定患者14何时已经改善到足以从医院机构内出来,或者患者14是否应该由于心力衰竭而许可进入医院。
一旦风险水平生成,处理器80生成风险水平的警报,并且经由遥测模块88将警报传输给用户(244)。如本文所述,可以按照时间安排或者一旦可能向另一个设备或接入点进行通信就可以发送该警报。在一些示例中,心力衰竭风险水平可以仅当用户请求时被传输。在一些示例中,警报还可以包括关于包括在风险水平中的患者度量的更详细的信息。
图8-图15涉及能够更现实地预测患者的HFH的预期风险的技术。通过确定患者的预期HFH风险,医务人员可以介入心力衰竭患者的护理,以避免或减少患者经历HFH的机会。为了预测患者的HFH的预期风险,创建了心力衰竭患者的数据库并将其存储到存储器中。心力衰竭患者的数据库通常基于存储在每个患者的IMD 16中的实时数据,然后将其传输并存储到外部设备114的存储器119中。当患者与医务人员通信和/或与从IMD 16访问的信息通信时,也采集数据(例如在评估期期间发生的HFH)并将其存储到存储器119中。基于从每个心力衰竭患者的IMD 16获得的实时数据以及患者是否经历HFH,形成查找表并将该查找表存储到数据库中。
图8中的流程图描述了用于创建数据库的示例性方法200,在该数据库中从多个心力衰竭患者采集的数据被存储到存储器中。为了更好地理解创建数据库的方式,呈现了其中从单个心力衰竭患者获取数据的过程描述。针对数据库的患者总量中的每个患者重复执行图8中的过程。通常从植入式医疗设备和/或通过患者和医务人员之间的通信采集数据,所有数据都被传输并存储到数据库中。例如,患者在评估期期间是否经历HFH通常是已知的,因为患者的数据记录在住院期间被存储到存储器中。发生在评估期的开始或结束的HFH是否与预测HFH的预期风险无关。本文描述的技术仅确定HFH在评估期期间的某个时间发生。
另外,称为数据观察值的数据与在框202处经由布置在患者体内的一个或多个IMD 16传感器(例如电极、化学传感器等)测量的诊断参数相关联。传感器采集由处理器进行的与阈值比较的数据,以确定是否已经检测到度量。检测到的(多个)数据观察值与单个度量或多个度量相关联。检测到的数据被自动存储到IMD 16的存储器中。参考图9,表1给出了可以使用的示例性诊断参数数据和相关联的阈值。本领域技术人员理解,表1中的阈值是示例,并且可以为一组心力衰竭患者建立,或者可以由方法200的用户为每个患者定制。
表1的左列提供IMD参数和相关联的代表性趋势,而右列呈现对应于每个诊断度量的示例性默认阈值。每次超过诊断阈值的阈值时,数据被自动地存储到存储器中,其可以由处理器访问以生成IMD报告以由医师经由GUI或打印的IMD报告来查看。
典型地指示恶化的心力衰竭、死亡风险和/或住院风险的诊断度量包括(1)阻抗趋势指数(也称为从位于明尼苏达州的美敦力公司IMD中商购的),(2)胸内阻抗,(3)房性心动过速/心房纤颤(AT/AF)负荷,(4)(AT/AF)期间的平均心室率,(5)患者活动,(6)心室(V)率,(7)白天心率和夜间心率,(8)CRT起搏百分比,和/或(9)电击次数。指数是患者经历的流体堵塞量的指标。指数是在实时期间使用IMD 16测量的阻抗与由IMD 16建立的可以连续更新的或在另一次访问医师期间的参考阻抗之间的差值。相对于2003年12月3日提交的美国专利序列号10/727,008而进行详细的描述,该专利作为美国专利号7,986,994进行发布并转让给本发明的受让人,将其公开内容通过引用以其全文结合在此。
表1进一步描绘了在几个月的时间段(即X轴)上与阈值306相比的示例性阻抗信号300,其中Y轴从0延伸到160欧姆-天。在胸腔内跨右心室(RV)线圈和IMD壳体或罐来测量阻抗。阈值302可以设置为60欧姆-天;然而,阈值可以由用户设置为另一个适当的值。当阈值超过阈值时,它表示患者可能处于堵塞的风险。来自患者的信号在2009年1月有时显现达到160欧姆-天,因为参考阻抗保持在原始阻抗之上,并且然后在此后在原始阻抗变得高于参考阻抗时降低到低于阈值。
阻抗是用于预测HFH的又另一个诊断参数。作为诊断参数的阻抗是针对作为阈值水平的基线信号306被测量。相对于基线信号306的值,流体容积的增加和楔压的相关联的增加与胸内阻抗的减小相关。与此相反,流体体积的减小和相关的楔压降低与相对于基线值的胸内阻抗的增加相关。
另一示例性诊断参数涉及AT/AF。测量心房纤颤(AF)负荷作为在与房室传导比≥2:1的相关的24小时时间期间的快速心房率的总持续时间。快速心房率通常与速率150bpm或更快相关联。约60bpm是白天的正常情况,夜间40-50是正常的,而70bpm通常只与儿童相关。同样地,如果患者具有心脏传导阻滞,那么心房率可以例如以90bpm搏动,而RV和LV保持60bpm的正常心律。快速心房率也可以被定义为比RV率更快。
AT/AF阈值指示患者具有持续连续最小时间量的AT/AF。例如,当患者在一天中经历AT/AF持续大于6个小时时,AT/AF阈值被超出。
在AT/AF(VRAF)阈值期间的平均心室率是又另一个诊断参数,其可以用于预测患者是否正经历恶化的HF,使得患者经受增加的HFH风险。通常在AF期间经24小时时间段测量VRAF。V率可被定义搏动/每分钟(bpm),其为从R波到R波的时间。在AT/AF阈值期间的V率被指定为AT/AF中的时间段大于或等于6小时以及平均V率大于100bpm。
患者平均活动是又另一个用于预测HFH风险的有用的诊断参数。活动(功能能力的替代者)是在预先指定的时间段期间活动持续时间的定量测量。较低的活动(例如持续至少1周的平均活动小于每天1小时)可以表示受损的功能能力。如果患者平均活动在一周的时间段内少于一小时/天,那么患者的HF恶化的风险增加。
另一个有用的诊断参数是以搏动/每分钟(bpm)测量的V率。V率使用依赖于夜间心率(NHR)的阈值。如果NHR升高,NHR(自主神经紧张的标记)可与HFH的风险增加相关联。NHR测量午夜和4AM之间的平均静息心率。在最近七天的数据收集中,NHR的阈值大于85bpm。
以毫秒测量的心率变异性(HRV)和升高的NHR可用作自主神经紧张的失调的标记。小于50-60ms的HRV潜在地是交感神经紧张和/或交感神经和副交感神经紧张失衡的标记。再又另一示例性参数阈值是起搏百分比,其中自上次或前一次会话以来,V起搏小于90%,这仅适用于CRT起搏设备。V起搏是递送的心室起搏量。IMD还记录其他数据,例如在一天期间递送的CRT起搏百分比,VT发作次数,以及患者是否接收到除颤电击。
在框202,采集患者数据并将其存储到存储器中。例如,患者数据可以经由来自IMD 16的遥测被传输并存储到外部设备114的存储器119中。从被称FAST和PARTNERS-HF的临床试验中获得的患者数据将数据观察值与可能在患者体内发生的任意HFH(即220HFH)相关联。FAST是使用美敦力CRT-D或ICD设备对患者(n=109)的预期双盲观察性研究,其中EF≤35%,以及NYHA等级为III级或IV级。PARTNERS-HF为招募患者(n=1024)的采用CRT-D设备的预期观察性研究,其中EF≤35%,NYHA等级为II I级或IV级,以及QRS持续时间≥130ms。
如在图13A中所描绘,用于创建数据库的示例性患者数据可以由从患者1、2和3获得的一组时间轴数据来显示。每个患者时间轴示出在回顾期内的第一时间段和第二时间段期间(即FUX,FUX+1)发生的数据观察值。患者1在FUX期间触发与活动阈值(例如,持续至少1周的平均活动是小于1小时/天)相关的数据观察值。在FUX+1期间向患者递送除颤电击。因此,针对患者1的FUX和FUX+1二者都将被分类为应该被置于1个数据观察类别中的评估期。患者2在第一时间段(即FUx)期间触发与相关的数据观察值,而CRT和NHR在下一个或第二时间段(即FUx+1)中被触发。患者3在第一评估期期间触发与CRT相关的数据观察值,而以及活动则在第二评估期期间被触发。在数据观察类型(例如活动、NHR、电击、CRT等)之间不进行区分;因此,在评估窗期间触发的任意类型的数据观测值被计数。
在图13A的时间轴中示出的患者数据被概括在表示0、1、2和多于2个数据观察值的列(在图13B中所描绘)中。例如,列1表示来自所有患者的零个数据观察值类别。列1中的每个水平线针对每个评估期发生0个观察值的持续时间。如果确定评估窗具有零个数据观察值,那么将评估期或窗放置或插入列1。列1还指示十个评价期中的两个包括HFH。因此,针对零个观察值类别的HFH风险是2/10或0.2,这是HFH的20%的风险。
列2与其中一个(1)数据观察值已被触发的FU相关联,列3与其中两个(2)数据观察值已经被触发的FU相关联,并且列3与其中三个(3)数据观察值已经被触发的FU相关联。可以通过注意具有HFH的所有评估窗的比例来计算每个观察值类别的HFH风险。
在数据被存储在数据库中之后,计算机系统将回顾期定义为图8中的框204处的一组评估时间段。例如,患者的回顾期包括两个连续的评估期-先前评估期和当前评估期。在一个或多个实施例中,每个评估期延长相同的时间量(例如,30天、45天、60天、75天、90天等)。在一个或多个其他实施例中,评估期可以延长不同的时间量,这提供了可变的回顾期。例如,一个评估期可以是30天,而另一个评估时间段可以是35天。方法200的用户确定在回顾期期间是否使用了可变或不可变的评估期。
在框208,每个评估期由在该评估期期间该患者经历的数据观察值的总量进行分类。为了对评估期间进行分类或归类,在框206处对数据观察值(例如0、1、2、3个等)进行计数。例如,如果在评估期期间存在0个数据观测值,那么评估期被指定为0个数据观测值。然后,与零个数据观察值类别相关联的计数器以“1”为增量,以指示评估期已经被确定为具有零个数据观察值。当其他评估期具有零个数据观察值时,零个数据观察值分类计数器继续增加。
在对所有评估期进行分类期间或者在对所有评估期进行分类之后,然后在框210处对具体数据观察值类别内的每个评估期进行计数。在处于数据观察值类别(例如0个数据观察值类别、1个数据观察值类别、2个数据观察值类别、3个数据观察值类别等)内的总评估期之后,将总量存储到数据库中。一旦已经处理了所有评估期,则终止计数过程。
在同一时间或大约相同的时间,在框212处判定患者经历的每个评估期是否发生了HFH。如果患者在对于患者的当前评估期期间经历了HFH,那么用于该具体数据观察值类别的HFH计数器增量为“1”。另外,处理器跟踪HFH和发生HFH的时间段的数据观察值类别。
然后针对每个数据观察值类别估计HFH的预期风险。例如,用于估计针对指定为0、1、2、3或更多个数据观察值的每个评估期的HFH风险的等式如下:
或者,以另一种方式说明如下:
HFH风险=(HFH下一个)/N下一个
其中HFH下一个是针对该具体数据观察值类别在当前预测期期间发生的HFH(在图13B中被示为“HFH”)的总量,而N下一个表示与具体数据观察值类别相关联的评估窗的总数(也称为“风险评价窗”或“风险预测窗”)。
此后,创建查找表(图13C),以将其在评估期期间的总数据观察值与预期心力衰竭住院风险相关联,示为十进制或百分比。在来自所有心力衰竭患者的患者数据已经被处理之后,数据库被认为完成。本领域技术人员应当理解,虽然数据库可以被认为是完整的,但是数据库可以被配置为被更新以包括来自设备的另外的患者数据或诊断数据。
在数据库已完成之后,可以使用存储在存储器中的查找表来估计患者的预期心力衰竭住院风险。例如,在图14所示的方法400示出了对患者估计的预期HFH风险。在框402处,可通过IMD 16或其他合适的装置采集患者数据。在框404,建立回顾期。回顾期包括一组连续的评估期。该组评估期包括第一评估期(也称为先前评估期)和第二评估期(也称为当前评估期)等。
对在先前评估期期间发生的数据观察值进行计数以确定数据观察值的总量。另外,在当前评估期对数据观测值进行计数,以确定数据观测值的总量。在框408处,基于总数据观察值来对每个评估期进行分类。使用总数据观察值类别,通过处理器访问查找表。处理器在查找表内搜索总观察值类别,然后确定与总观察值相关联的心力衰竭住院风险。针对每个评估期,重复从查找表查找每个HFH风险的过程。在一个或多个实施例中,针对每个评估期通过处理器搜索图13中的查找表中所示的风险百分比来确定HFH风险。
在一个或多个实施例中,通过使用加权因子来确定预期心力衰竭住院风险。例如,可以使用加权因子,其中靠后的评估时间段比靠前的评估时间段的加权更重。例如,最近发生的评估时间段(即当前评估期)的加权因子的范围为从0到0.9。与靠后的评估期(即当前评估期)相比,评估时间段(即,先前评估期)的加权因子的范围为从0到0.5。在一个或多个其他实施例中,与另一个较长的评估期相比,可以使用加权因子针对延长较短时间段的评估期进行调整。例如,短的评估期(例如,延长总30天)可以是60天的长评估期乘以0.50(即,使用比率等式,30/60)。在确定HF风险之后,图形用户界面向用户显示患者的预期心力衰竭住院风险。
基于预测的HFH风险,可以向医师自动地生成指示患者具有相当大的住院风险并且需要进行评估的通知。通知医师干预可以预防或减少HFH,这可以潜在地改善长期患者结果,同时降低护理成本。另外或者可替代地,医师能够对患者执行另外的临床评估,或者可以无线地调整心脏治疗。在可替代的实施例中,基于在植入物或随访期间确定的预先指定的标准来自动调整心脏治疗。
虽然确定预期的HFH风险是重要的,但是尽可能有效地传达信息的方式可以节省医师的时间。图10、图12和图15是可以显示给用户的示例性图形用户界面。图10提供了包括在较长时间期内针对单个患者的一组示例性HFH风险评价的图形用户界面。在预先指定的时间段(例如30天时间段)内为每个随访(FU1-FU4)示出一组示例性风险评价。在单个时间点发生随访,而两个连续随访之间的时间段称为风险评估窗或风险预测窗。随访1(FU1)在时间零开始并在开始时间后三十天结束。随访2(FU2)在FU1结束时开始并在此后三十天后结束。随访3(FU3)在FU2结束时开始,并在FU3的开始时间后延长三十天。随访4(FU4)在FU3结束时开始,并在FU4的开始时间后延长三十天。每个随访会话的风险评价窗的持续时间由图10中所示的每个风险评价的水平长度示出。
对于FU1和FU2的风险评价的持续时间大致相同,如长度大约相同的每个风险评价的水平长度所示。FU4的风险评价持续时间大于FU1和FU2,而FU3风险评价持续时间基本上大于图10中所示的所有风险评价。HFH的预期性风险评价通过箭头(从每个FU期的结束到它们各自的开始时间)示出以根据回顾性数据反映风险评价。回顾性数据是来自评估期的数据观察结果。如前文所述,预期HFH风险(即,接下来的30天等)要求处理器回顾评估期并确定患者经历的数据观察值。基于总数据观察值来访问存储在外部设备114的存储器119中的查找表,然后确定预期HFH风险。
在可替代的实施例中,对从等于零的时间(例如,植入IMD)延伸的所有触发的诊断数据执行评估。当所有当前和最近的先前随访从时间等于零开始时,每个FU时间周期在不同的时间结束。在这种情况下,风险预测窗从FU1延伸到FU2,这是30天;风险预测窗从FU2延伸到FU3,这是60天;风险预测窗从FU3延伸到FU4,这是90天,并且风险预测窗从FU4延伸到另一个时间点,可以是120天。包括更长时间段的实施例可以提供延伸更长时间段的趋势数据,一些医师可以认为其是有用的。在一个或多个实施例中,医师可以在单独显示最近数据或提供更长趋势信息的数据的图形用户界面之间切换。
图10的一个或多个实施例可被应用,以使例如当前评估期从由FU2的箭头指示的时间延伸到FU1的箭头。先前评估期从由FU1的箭头指示的时间延伸到开始点。在该示例中(在图10中以粗体和大写字母表示),当前评估期和先前评估期用于预测紧接在当前评估期之后的30天预期风险。
图12是向用户显示数据内容的又另一用户界面。数据内容被解析为设备事件和心力衰竭相关事件。一个用户可能对设备事件更感兴趣,而另一个用户可能对心力衰竭相关事件更感兴趣。可以通过点击其上显示有词语“设备事件”的选项卡来访问设备事件。该设备事件包括但不限于VF治疗关闭、捕获管理警告、电气重置、关于引线问题的警告、设备的推荐更换时间、充电电路警告、VF检测治疗关闭、活性罐(或壳体)关闭、VT/VF检测禁用、无线遥测不可用、SVC引线未检测到。
图15是当相对于患者某些规定的事件发生时提供警报的又另一用户界面。提供用户界面选项卡以允许用户快速访问该用户最关心的数据。用户界面显示与综述数据、警报组、临床管理警报(例如红色、黄色和仅网站警报)和通知小时相关的选项卡。红色警报意味着已经超过了非常重要的阈值,而黄色警报意味着该项目是需关注的。
在用户界面的左侧是与临床管理警报相关的项目列表。该列表被解析为数据观察值和设备项目。数据观察值列表包括大于阈值的AT/AF每日负荷,AT/AF期间的平均心室率,发作中递送的电击数,以及区域中的消耗的所有治疗。多个临床事件包括AT/AF中的时间大于或等于预定小时数/天、AT/AF中的时间大于或等于预定小时数、以及V-率均值大于预先给定的水平持续至少1天、NHR大于85bpm持续7天的全部或大部分、续持至少一周的平均活动是小于1小时/天、至少1次VT/VF电击、自上次传输以来(仅对CRT设备可见)VP小于90%、从列表中发生事件的预定数量、以及用户选择的发生的事件数(1项-6项)。用户可以输入数字(例如,1项-6项),如图所示,或者下拉菜单可以用于让用户选择多个项目。提供的数字范围反映用户已检查列表中的事件数。
本领域技术人员将理解,图15中的任意数量的框可以被打勾或未被打勾以指示事件或警报已发生。图15仅示例了一种可能的情况。例如,未被打勾的事件包括在AT/AF中的时间≥[x]小时持续至少1天,以及NHR>85bpm持续所有最近7天。打勾的事件自从上次传输包括在AT/AF中的时间≥预先指定小时数的X量]和V-率均值>预先指定的小时数的y量]持续至少一天,持续至少1周的平均活动是<1小时/天,至少一次VT/VF电击,以及VP<90%。
设备列表包括引线/设备完整性问题,VF检测治疗关闭、指示设备的推荐更换时间的低电池电压警告、针对服务结束的过度充电时间、右心室引线完整性、右心室噪声、心房起搏阻抗超出范围以及右心室起搏阻抗超出范围。
为了避免模糊本发明的技术,下面给出关于存储在外部设备114的存储器119中的数据库的细节。通过使用称为FAST和PARTNERS的两个组合临床研究来建立HFH风险评价有效性数据。下文呈现的表2概述了用于本分析的在FAST和PARTNERS试验中775名患者的患者人口统计。所有患者均有CRT-D IMD,大多数(87%)患者展现NYHA III的心力衰竭状态。此外,患者具有接受心脏再同步治疗的患者群体的相似特征。
表2概述了其中结合FAST和PARTNERS-HF试验用于本分析的患者人口统计。大多数患者被分类为NYHA III,平均年龄为69岁。大多数患者还经历了通常与HF患者相关的各种疾病(例如缺血性、冠状动脉疾病、高血压、糖尿病等)并服用多种药物(例如ACE/ARB、β-阻断剂、利尿剂、地高辛、醛固酮等。)
表2概述了患者的人口统计学特征
表3-表7概述了临床试验的一些数据。排除阻抗(表3),与包括阻抗的数据(表4)相比,针对许多IMD参数,775例患者和2276个随访会话显示了风险分层。表3包括多个数据观察值(即IMD观察值),参加由医师评估的随访的多个患者、经历的HFH的数量、HFH的百分比、GEE调整的HFH(95%置信水平CI)和优势比对0个观察值(95%CI)。
从表3中可以看出,HFH率随着数据观察值的数量的增加而增加。例如,当没有触发IMD观察值时,30天事件率为0.9%,并且针对三个或更多个触发的IMD观察值增加到13.6%。绝大多数(约71%)的全程随访会话没有IMD观察值。此外,随访会话与增加的观察值的比例单调地减少(针对1、2和≥3个观察值分别为23.5%、4.3%和1.3%)。
表3是在具有心力衰竭住院风险(HFH)的分层患者中排除的数据观察值表现。
作为HFH的预测因子的各种参数的单变量分析在表4中示出。所评估的诊断参数数据包括活动、NHR、AF负荷、VRAF、CRT起搏的减少、电击和针对每个参数的数据观察值已在特定行中以“是”表示而发生,而缺少数据观测值由“否”表示。还提供了与特定参数的数据观察值相关联的FU和HFH的数量。从列表数据中,数据观察值提出HFH的风险增加,而不是缺乏数据观察值。另外,列表数据显示,针对各种参数,HFH率从4.6%(针对CRT起搏减少)变化到11.2%(针对VRAF)。针对在较大比例(约10%或更多)的随访会话期间触发的活动、AF负荷和V起搏,事件率分别为5.1%、4.7%和4.6%。
表4HFH的各种设备参数的单变量分析和风险
在775例患者和2276个随访会话的各种参数(包括)的风险分层表现在表4中示出。与排除的参数组类似,HFH的事件率随观察值数的增加而增加。没有IMD观察值的情况的事件率为0.4%,并且针对更多个观察值中的三个增加到13.6%。具有零个IMD观察值的随访会话构成所有随访会话的最大比例(48.5%),并且该比例随着IMD观察值数量的增加而下降(针对1、2和≥3个观察值分别为36.4%、12.2%和2.9%)。在单变量分析中,发现指数具有3.5%的HFH事件率,如在表4中示出。
表5是在具有心力衰竭住院风险(HFH)的分层患者中包括的数据观察值的表现。
图11A-图11B示出了针对排除(图11A)和包括(图11B)的IMD参数,评估后30天中的HFH事件率。针对0、1、2和2个数据观察值的卡普兰-迈耶曲线沿着X轴从时间0至30天示出,并且针对不同的数据观察值数量经过诊断评估后沿着Y轴的HFH住院率为从0%到13%。在图11A-图11B中,事件率的增加随着观察值数量的增加是明显的。
表6和表7示出了方法200在针对参数组预测HFH的灵敏度和特异性,所述参数组中从范围为1、2和≥3个的数据观察值中包括或不包括对于排除的参数组,针对≥1个观察值的灵敏度为68.9%,而对于≥3个观察值的灵敏度降至9.5%。针对≥1个观察值的相应特异性为71.2%,而针对≥3个观察值的相应特异性增加至98.8%。类似地,对于包括的情况,针对≥1个观察值的灵敏度为90.5%,而针对≥3个观察值的灵敏度降低到21.6%。相应的特异性从49.1%(≥1个观察值)增加到97.4%(≥3个观察值)。与特异性降低(97.4%对98.8%)相比,包括数据时针对≥3个观察值的灵敏度的相对增加是显著的(21.6%对9.5%;见表5和表6中最底部的行)。
表6:在30天评估构架中针对排除的参数组的0、1、2和≥3个观察值的灵敏度对特异性。
表7:在30天评估构架中针对包括的参数组的0、1、2和≥3个数据观察值的灵敏度对特异性。
另外,用于评价诊断的回顾期被认为是在随访期之间的整个持续时间以反映真实世界临床实践。随着IMD观察值的增加,HFD事件的风险。例如,取决于IMD参数组是否排除或包括(如表格2和表格4分别所指示的),与没有观察值的患者相比在FU时间段期间发生三个或更多个数据观察值时,患者具有18倍至42倍增加的HFH风险。针对不同观察值数量的灵敏度和特异性展现出两个或更多个度量之间的权衡,使得当特异性随着更严格的渐增观察值数量的标准而改善时,灵敏度恶化。例如,大于或等于三个IMD观察值的灵敏度低于≥2个观察值的灵敏度,这是因为在大于或等于3个IMD观察值中未捕获到几个住院事件,即它们以较低数量的IMD观察值发生。大于或等于3个IMD观察值(不含)的灵敏度和特异性分别为9.5%和98.8%。对于具有的IMD,相应的灵敏度基本上提高到21.6%,而特异性略微降低到97.4%。
由于连续或周期性地收集IMD数据,因此HFH风险可以在动态设置中而被实时预测。例如,可以在临床环境中评价患者。可替代地,IMD数据能够在特定警报(例如,在美敦力公司CARELINK中的)已经发生时自动地传输到临床,或者可以由患者以临床医生选择的预定时间表传输。因此,可以向临床医生提供动态HF风险评价,然后可以与其他临床信息一起使用以管理患者的HF。
IMD中的各种IMD诊断参数是各种潜在生理过程的反映。给定参数超过一定范围的偏差可以表示生理性体内平衡的受损,因此是患者风险的标记。例如,阻抗是流体状态的指标。阻抗下降和伴随的指数的上升表示可能的流体过载,而阻抗的过度上升和指数的下降可能表示脱水。类似地,升高的NHR和异常HRV是自主神经紧张失衡的潜在标记,并且较低的活性可以指示受损的功能能力。尽管每个诊断参数是风险的标记,但是当将诊断参数组合时改善预后值,如通过将表3与表2和表4进行比较所示。
本公开的一个或多个实施例采用增量的方法来仅基于增加的观察数量(例如0、1、2、≥3个数据观察值)来预测预期风险。另外,尽管临床相关的30天时间段用于HF风险预测,但是用于评估IMD诊断的回顾期的不同之处在于,针对同一患者在先前和当前随访会话之间使用所有数据。在一个或多个其他实施例中,用于评估IMD诊断数据的回顾期的不同之处在于,针对类似境遇的患者在先前和当前随访会话之间使用所有数据。本公开对健康护理提供者是有利的,因为本公开不需要对来自其默认值的阈值实施修改。在不修改诊断参数的情况下实现本公开易化了HFH风险的实现,因为医师不需要修改IMD阈值。与单独的仅仅是在IMD诊断参数组中的一个分量的胸内阻抗相比,使用多个诊断参数的方案提高了整体诊断的准确性,如表3和表4所示。本公开仅仅使用通过IMD(CRT-D IMD)感测的现有数据观察值参数针对流动患者提供动态和特别敏感的HFH风险评价。各种参数和相应的IMD观察值的阈值从现有的CRT-D IMD中未修改。
由于本公开依赖于当前存在的设备诊断观察值,因此不必修改IMD的计算机指令或配置以便实现方法200。此外,可以在经由从IMD到医师的遥测术而发送的两次传输之间、两次临床随访访问中、或者在经由来自IMD的遥测发送的传输和临床随访访问之间采集数据。还有另一个区别是预期HFH风险水平仅仅基于触发的数据观察值的数量。例如,一个数据参数或诊断不被给予来自另一诊断的更大权重。每个数据参数与另一个数据参数的加权相同。因此,仅仅在缩短的评估时间段(例如30天)期间对数据观察值的数量进行计数对于计算预期HF风险是有用的。
已经描述了各种示例,包括使用单独从使用IMD感测的实时数据获得的数据来确定患者的预期HFH风险。这些示例包括用于鉴定由于心力衰竭而再次住院的风险升高的患者的技术。此外,可以从多个不同的患者远程地向医疗保健专业人员递送患者风险水平的警报,以便在再住院前对心力衰竭进行分诊并进行更早的诊断和治疗。在一个或多个实施例中,可以在一组较短的评估期中针对每个较短的评估期计算预期HFH风险。通过判定在接下来30天(HFH下一个)中是否发生(多个)HFH事件除以在接下来30天(N下一个)中有或没有HFH事件的评估总数来预测预期HFH风险。在又另一个实施例中,公开了一种用于确定预期心力衰竭住院风险的医疗设备系统的操作的方法,使得该方法包括经由与布置在患者体内的植入医疗设备相关联的一个或多个电极测量一个或多个数据观察值,每个数据观察的存储器中。回顾期被定义为包括先前评估期和当前评值与诊断参数相关联。检测到的数据观值被自动地存储在患者的IMD 16估期。在先前评估期中计数每个数据观察值,以确定在预定时间内的数据观察值的总数。对当前评估期中是否发生心力衰竭住院事件进行判定。将当前评估期的心力衰竭住院事件乘以在预先指定的时间段内的数据观察值的总数。确定当前评估期中的评估总数。将当前评估期中的评估总数划分为用于确定预期心力衰竭住院风险的结果。在图形用户界面上显示的是从预设的开始时间延伸并且在该组较短的评估期上延伸的总评估期。针对一个较短评估期的预期心力衰竭住院风险与来自评估期组的另一较短评估期权重不同。在一个或多个其他实施例中,计算HFH风险,将心力衰竭住院(HFH)风险计算为在先前评估期中具有给定数量的数据观察值的评估数量以及在接下来30天中的HFH(或无HFH)事件除以在接下来30天中具有HFH(无HFH)的评估的总数。
在一个或多个实施例中,基于IMD数据观察值的总数来计算HF风险。使用针对具有不同观察值数目的组的广义估计方程(GEE)模型来估计HFH事件率和几率。出于本公开的目的,没有对基线变量(例如年龄、性别、NYHA、冠状动脉疾病史、MI、AF、糖尿病和高血压)或基线药物(例如ACE-I/ARB、利尿剂、β-阻断剂和抗心律失常药)进行调整。
本文描述的示例性系统、方法和界面可以被配置为帮助用户(例如,医师、其他医疗人员等)预测患者的HFH风险。该医疗设备系统包括在当预测患者的HFH风险时访问的外部设备(例如服务器等)。该外部设备具有组织和存储在存储器中用于通过处理器访问的心力衰竭患者相关数据的集合。
在一个或多个实施例中,使用HFH的预期风险以便从由植入式设备递送的起搏治疗切换到另一个起搏治疗。例如,起搏治疗可以在CRT和融合起搏之间切换。在一个或多个实施例中,预期HFH的风险可以导致起搏治疗在一个腔室中切换到多点起搏,如在2015年4月25日提交的标题为“用于有效递送多部位起搏的方法”的临时申请号62/152,684中所描述,将其通过引用以其全文结合在此。示例性起搏治疗包括心脏再同步治疗(CRT)。CRT治疗涉及双心室起搏,其包括用RV电极起搏右心室(RV)以及用(多个)LV电极起搏左心室(LV);或单心室起搏(其仅起搏单个心室,例如左心室)。这些方法可以在任意单室、双室或多室起搏设备中实施,该设备具有定位成用于心腔的双极起搏的至少两个电极。更常见的是,当沿着提供两个或更多个起搏向量的起搏心腔提供多个电极以供选择以便起搏心腔时,将使用所公开的方法的实践。
一个或多个实施例涉及单个心动周期期间的多部位起搏。该方法包括选择起搏向量。起搏向量由参考一个或多个阳极的一个或多个阴极形成,这允许能量从阴极流到阳极。在通过参考第一阴极到第一阳极选择第一起搏向量之后,选择第二起搏向量。第二起搏向量包括第二阴极和第二阳极。第一起搏脉冲被递送到位于沿心腔的第一起搏部位处的第一起搏向量。第二起搏脉冲被递送到位于沿心腔的第二起搏部位处的第二起搏向量。在单个心动周期期间递送第一和第二起搏脉冲。第一起搏脉冲可以具有与第二起搏脉冲不同的能量特征。另外或可替代地,第一和第二脉冲(例如,第一和第二左心室起搏脉冲)彼此独立。例如,第一和第二起搏脉冲具有不同的起搏脉冲宽度和/或振幅。
在示例性实施例中,多极性LV CS引线18被传送穿过RA进入CS并且进一步进入心静脉48以沿着LV腔室延伸远端四个起搏/感测电极30、32、34和36以使用电极30至36的任意组合实现LV EGM信号的LV起搏和感测。LV CS引线18联接在插入IMD连接器块14的镗孔中的近端引线连接器(未示出)处,以提供电极30至36到IMD内部电路的电联接。在其他实施例中,多极性引线18可以包括多于四个或少于四个的电极。被配置成用于将多部位起搏脉冲递送至组织的任意医疗电引线可以被采用来实现在此描述的方法。示例性医疗电引线可以是从位于爱尔兰的美敦力公司(Medtronic,PLC.)可获得的ATTAINLV引线。引线可以用于实施方法200以从两个或更多个电极(例如LV1、LV2、LV3、LV4、LV5、LV6、LV7、LV8...LVn,其中n是由引线制造商指定的整数)同时或大约相同时间递送起搏脉冲。
除了实施例或可替代实施例,起搏/感测电极可以沿着LV可操作地定位,以用于使用进入不同心脏静脉的多个LV引线、使用心内引线和电极、心外膜起搏引线和电极或其任意组合起搏LV心肌。如本文所使用的,递送引起心室反应的电刺激通常被称为捕获心室。另外,使用“沿着心腔”定位的电极对心腔进行起搏是指起搏心腔的心肌组织以捕获该心腔(即唤起对起搏脉冲的响应),并且包括使用可操作地定位在心内膜、心外膜或静脉内位置处的电极或其任意组合。为了起搏心外膜组织,可以使用心外膜引线。在一个或多个实施例中,无引线起搏器设备可用于起搏,诸如在2014年2月12日提交的标题为“用于无引线起搏和电击治疗的系统和方法”的美国专利申请序列号14/178,711中描述的,将其通过引用以其全文结合在此。
在图1中在右心室和左心室中或在右心室和左心室周围所示的引线和电极的所描绘的位置是近似的并且仅仅是示例性的。应认识到,适于放置在RA、LA、RV和/或LV上或其中或相对于RA、LA、RV和/或LV的起搏或感测位置处的可替代引线和起搏/感测电极可结合本文所述的方法使用。例如,在三腔室起搏设备中,RA引线可以定位成承载用于在右心房腔室中起搏和感测的尖端和环形电极。另外,在四腔室实施例中,LV CS引线22可以承载沿着引线体放置以位于LA附近的(多个)近侧LA CS起搏/感测电极,用于起搏LA或感测LA EGM信号。其中可以实施本文所述的方法的多腔室设备通常公开在西斯(Sheth)等人的美国专利号7,555,336中,特此将其通过引用以其全文结合在此。
上文指定为“起搏/感测”电极的电极通常可用于起搏和感测功能两者。“起搏/感测”电极可以被选择为专门用作起搏或感测电极,或者用于在编程组合中的起搏和感测以用于感测心脏信号并沿着所选的感测和起搏向量递送心脏刺激脉冲。起搏向量包括含有一个或多个阴极和一个或多个阳极的一对电极。通常,阴极将电荷递送到心脏组织中,因为能量通常从阴极流入阳极;然而,可以切换极性以使阳极将电荷递送到组织。也可以在起搏和感测功能中指定单独或共享的不同的起搏和感测电极,包括使用RV线圈电极24和/或SVC线圈电极26作为起搏阳极或用于感测心脏信号。
以下从1到21连续地列举的段落提供了本公开的不同方面。在第一段(1)中的一个实施例中,本公开提供了一种用于确定预期心力衰竭住院风险的医疗设备系统的操作的方法,所述方法包括:
1.用于确定预期心力衰竭住院风险的医疗设备系统的一种或多种操作的方法,所述方法包括:
(a)将患者检测到的数据观察值存储在存储器中;
(b)定义一组其中发生检测到的数据观察值的评估期;
(c)对来自所述评估期组的评估期的检测到的数据观察值进行计数,以确定针对所述评估期的检测到的数据观察值的总量;
(d)响应于确定检测到的数据观察值总量,将每个评估期置于数据观察值类别中;
(e)对放置在数据观察值类别内的每个评估期进行计数,以确定数据观察值类别内的评估期的总量;
(f)对与数据观察值类别相关联的心力衰竭住院(HFH)进行计数,以确定HFH的总量;
(g)确定HFH的总量与数据观察值类别内的评估期的总量的比率;
(h)将针对每个数据观察值类别的每个比率存储到存储器中以形成查找表;
(i)从存储器访问心力衰竭患者的当前评估期和先前评估期;
(j)对当前评估期和先前评估期中的检测的数据观察值进行计数;
(k)使用所述查找表来确定所述先前评估期和所述当前评估期的预期心力衰竭住院风险;
(l)通过将加权因子与所述先前评估期和当前评估期的预期心力衰竭住院风险相乘来确定HFH的加权预期风险;以及
(h)在图形用户界面上显示HFH的加权预期风险。
2.如段落1所述的方法,还包括:
选择待应用到所述先前评估期和所述当前评估期的加权因子。
3.如段落1或2所述的方法,其中对先前评估期的加权不同于对当前期的加权。
4.如段落1-3中任一项所述的方法,其中将较小的加权因子应用到所述先前评估期,以及将较大的加权因子应用到所述当前评估期。
5.如段落3-4中任一项所述的方法,其中最近发生的评估时间段的加权因子大于比所述最近发生的评估时间段早出现的评估时间段的加权因子。
6.如段落5所述的方法,其中所述当前评估期的加权因子的范围为从0到0.9。
7.如段落5-6中任一项所述的方法,其中所述先前评估期的加权因子的范围为从0到0.5。
8.如段落1-7中任一项所述的方法,其中所述心力衰竭住院风险是针对长达30天的预期时间段来预测。
9.如段落1-8中任一项所述的方法,其中所述诊断参数是以下中的一种:胸内阻抗、胸液指数、复律治疗后的心房纤颤持续时间、心率变异性、持续性心房纤颤期间的心室率升高、夜间心率的升高、以及心脏再同步治疗百分比。
10.如段落1-9中任一项所述的方法,还包括:
对在当前评估期和先前评估期中的一个期间的数据观察值进行合计;
产生描绘心力衰竭住院风险的分级的数据图;以及
响应于数据观察值数量的合计,在图形用户界面上显示心力衰竭住院风险的分级。
11.如段落1-10中任一项所述的方法,其中可以在不与医务人员直接接触的情况下确定心力衰竭住院风险。
12.如段落1-11中任一项所述的方法,还包括:
通过无线连接将检测到的数据发送给医务人员。
13.如段落1-12中任一项所述的方法,还包括:
将第一时间段的心力衰竭住院风险与第二时间段的另一心力衰竭住院风险进行比较;以及
响应于比较所述第一时间段和第二时间段的心力衰竭住院风险,确定所述心力衰竭住院风险的趋势。
14.如段落1-13中任一项所述的方法,其中数据观察值是在经由遥测发送的两个数据传输上发生。
15.如段落1-14中任一项所述的方法,其中数据观察值是在经由遥测和临床随访发送的一个数据传输上发生。
16.如段落1-15中任一项所述的方法,将回顾期定义为包括先前评估时间段和当前评估时间段。
17.如段落1-16中任一项所述的方法,其中所述当前评估时间段是紧接在先前评估时间段之后发生的数据传输或随访临床访问之一。
18.如段落15-17中任一项所述的方法,其中采用可变回顾期。
19.如段落15-18中任一项所述的方法,其中所述可变回顾期没有设置持续时间。
20.如段落1-19中任一项所述的方法,其中与具有零个数据观察值的患者相比,3个或更多个数据观察值提供在下一评估时间段中心力衰竭住院的增加约35至约45倍的风险。
21.如段落1-20中任一项所述的方法,其中对于给定数量的观察值的心力衰竭住院(HFH)风险被计算为接下来30天中的HFH事件除以在接下来的30天中具有或不具有HFH(无HFH)的评估值的总数。
22.一种用于确定预期心力衰竭住院风险的医疗系统的操作的方法,所述方法包括:
(a)从设备存储器获取心力衰竭患者的当前评估期和先前评估期;
(b)针对当前评估总量对在所述当前评估期中检测到的数据观察值进行计数,以及针对先前评估期总量对在所述先前评估期中检测到的数据观察值进行计数;
(c)将所述当前评估总量和所述先前评估总量与查找表相关联,以获得针对所述先前评估期和所述当前评估期的预期心力衰竭住院(HFH)风险
(d)采用针对所述先前评估期和所述当前评估期的所述预期HFH风险的加权和来计算患者的加权预期HFH风险;以及
(e)在图形用户界面上显示所述患者的所述加权预期HFH风险。
23.如段落22所述的方法,其中所述查找表包括成组的数据观察值类别以及针对每个所述类别的存储比,
其中每个所述数据观察值类别限定组数据评估期的总数,每个所述组数据评估期具有来自其中患者群体的限定的相同数量的或落在相同数量范围内的数据观察值,以及
其中每个所述数据观察值类别的所述存储比包括与所述数据观察值类别相关联的心力衰竭住院值与在所述数据观察值类别内的所述组数据评估期的总数的比。
24.如段落22-23中任一项所述的方法,其中使用植入设备来获得在所述先前评估期和所述当前评估期中的一者内的数据观察值。
25.如段落22-24中任一项所述的方法,还包括:
使用所述预期风险来修改由植入式设备递送的治疗。
26.如段落22-25中任一项所述的方法,还包括:
使用所述预期风险来从由植入式设备递送的起搏治疗切换到另一起搏治疗。
27.如段落22-26中任一项所述的方法,还包括:
其中另一起搏治疗是双心室起搏和融合起搏中的一种。
28.如段落22-27中任一项所述的方法,还包括:
使用所述预期风险来修改通过施用递送至患者的药剂或调节递送至患者的药剂递送的治疗。
28.如任意段落28所述的方法,其中所述药剂为药物。
29.如段落22-28中任一项所述的方法,还包括:
基于适用于所述先前评估期和所述当前评估期中的一者的观察类别使用所述查找表来预期地评估患者HFH风险。
30.如段落22-29中任一项所述的方法,还包括:
选择待应用到所述先前评估期和所述当前评估期的加权因子。
31.如权利要求1所述的方法,其中对先前评估期的加权不同于对当前期的加权。
32.如段落22-32中任一项所述的方法,其中将较小的加权因子应用到所述先前评估期,以及将较大的加权因子应用到所述当前评估期。
33.如段落22-33中任一项所述的方法,其中所述先前评估期的加权因子的范围为从0直到0.9。
34.如段落22-33中任一项所述的方法,其中所述先前评估期的加权因子的范围为从0直到0.5。
35.如段落22-34中任一项所述的方法,其中所述心力衰竭住院风险是针对长达30天的预期时间段来预测的。
36.如段落22-35中任一项所述的方法,其中所述检测到的数据观察值是以下中的一种:胸内阻抗、胸液指数、复律治疗后的心房纤颤持续时间、心率变异性、持续性心房纤颤期间的心室率升高、夜间心率的升高,以及心脏再同步治疗百分比。
37.一种用于确定预期心力衰竭住院(HFH)风险的医疗系统的操作的方法,所述方法包括:
(a)在个体评估期期间确定个体心力衰竭患者的检测到的数据观察值的数量;
(b)基于所述个体评估期使用查找表来确定预期心力衰竭住院风险;以及
(c)在图形用户界面上显示HFH的预期风险,
其中所述查找表包括成组的数据观察值类别以及针对每个所述类别的存储比,
其中每个所述数据观察值类别限定组数据评估期的总数,每个所述组数据评估期具有其中限定的相同数量的来自患者群体的观察值;以及
其中每个所述数据观察值类别的所述存储比包括与所述数据观察值类别相关联的心力衰竭住院值与在所述数据观察值类别内所述组数据评估期的总数的比。
38.一种用于确定预期心力衰竭住院风险的医疗系统,所述系统包括:
(a)用于从设备存储器获取心力衰竭患者的当前评估期和先前评估期的装置;
(b)用于针对当前评估总量对在所述当前评估期中检测到的数据观察值进行计数以及针对先前评估期总量对在所述先前评估期中检测到的数据观察值进行计数的装置;
(c)用于将所述当前评估总量和所述先前评估总量与查找表相关联以获得针对所述先前评估期和所述当前评估期的预期心力衰竭住院(HFH)风险的装置;
(d)用于采用针对所述先前评估期和所述当前评估期的所述预期HFH风险的加权和来计算患者的加权预期HFH风险的装置;以及
(e)在图形用户界面上显示所述患者的所述加权预期HFH风险。
39.如段落38所述的系统,其中所述查找表包括成组的数据观察值类别以及针对每个所述类别的存储比,
其中每个所述数据观察值类别限定组数据评估期的总数,每个所述组数据评估期具有来自其中患者群体的限定的相同数量的或落在相同数量范围内的数据观察值,以及
其中每个所述数据观察值类别的所述存储比包括与所述数据观察值类别相关联的心力衰竭住院值与在所述数据观察值类别内的所述组数据评估期的总数的比。
40.如段落38-39中任一项所述的系统,其中使用植入设备来获得在所述先前评估期和所述当前评估期中的一者内的数据观察值。
41.如段落38-40中任一项所述的系统,还包括:
用于使用所述预期风险来修改由植入式设备递送的治疗的装置。
42.如段落38-41中任一项所述的系统,还包括:
用于使用所述预期风险来从由植入式设备递送的起搏治疗切换到另一起搏治疗的装置。
43.如段落38-42中任一项所述的系统,还包括:
使用所述预期风险来修改通过施用药剂或调节递送至患者的药剂递送的治疗。
44.如段落38-43中任一项所述的系统,还包括:
使用所述查找表基于适用于所述先前评估期和所述当前评估期中的一者的观察类别来预期地评估患者HFH风险。
45.一种用于确定预期心力衰竭住院风险的医疗系统的操作的方法,所述方法包括:
(a)从设备存储器获取心力衰竭患者的当前风险评价期和先前风险评价期;
(b)针对当前风险评价总量对在所述当前风险评价期中检测到的数据观察值进行计数,以及针对先前风险评价期总量对在所述先前风险评价期中检测到的数据观察值进行计数;
(c)将所述当前风险评价总量和所述先前风险评价总量与查找表相关联,以获得所述先前风险评价期和所述当前风险评价期的预期心力衰竭住院(HFH)风险;
(d)采用针对所述先前风险评价期和所述当前风险评价期的所述预期HFH风险的加权和来计算患者的加权预期HFH风险;以及
(e)在图形用户界面上显示所述患者的所述加权预期HFH风险。
本文引用的专利、专利文献和出版物的完整公开内容通过引用以其全文结合在此,就如同各自被单独地结合一样。在不脱离本发明的范围和精神的情况下,本发明的各种修改和改变对于本领域技术人员将变得清楚。应当理解,本发明不旨在由本文阐述的说明性实施例和示例不当地限制,并且这些示例和实施例仅以示例的方式呈现,本发明的范围仅由如下所述权利要求书限定。
46.如段落45所述的方法,其中可以在动态设置中实时预测预期HFH风险。
- 还没有人留言评论。精彩留言会获得点赞!