用于低剂量授精的方法和组合物与流程
本发明涉及用于低剂量人工授精的组合物和使用源自相同物种的雄性哺乳动物的精子对雌性哺乳动物人工授精的方法,所述精子的剂量显著低于不存在该组合物情况下所需的剂量。优选的雌性哺乳动物是母猪(野猪(susscrofa)),优选该组合物用于人工子宫授精,而人工授精的方法优选是子宫授精。
背景技术:
对于母猪的传统人工授精,新鲜公猪精子使用的剂量为在100ml体积稀释液中的约1至3x109个精子,其在24小时内进入子宫两次,并且使用的冷冻精子的剂量为约5x109个精子。公猪射精因此可以分成5至30份剂量的新鲜精子。通常情况下,这种传统的人工授精是在排卵前24小时左右第一次进行的,其被观察为发情旺期(standingheat)。
使用侵入性方法,例如外科腹腔镜检查,精子剂量低至1x107的冻融精子可直接放入母猪的输卵管进行授精。
us5135759a描述了facs装置和方法,用于将精细胞的性染色体特异性分选成主要包含携带x-染色体或y-染色体的精子部分。
wo2010/0149739a1描述了一种facs装置和和方法,其使用激光器偏转含有精子的流体部分以分选成主要含有携带x-染色体或y-染色体的精子部分。
green等人,reproduction122,305-315(2001)描述了碳水化合物聚糖介导公猪精子与输卵管上皮细胞的结合。
ekhlasi-hundrieser等人,biolreprod73,536-545(2005)描述了精子粘附因子aqn-1为用于在母猪输卵管中形成贮精囊的候选受体。
dostalova等人,eurjbiochem230,329-336(1995),calvete等人,biolchem377,521-527(1996)描述了精子粘附因子aqn-1和aqn-3对于卵透明带糖蛋白显示类似awn的亲和力。
krueger和rath,reprodfertildev.12,113-117描述了将非常低剂量的精子通过剖腹给予到子宫角的尖端以导致怀孕。
taylor等人,socreprodfertilsuppl66,83-84(2009)描述了猪的精子与子宫上皮细胞结合。
发明目的
本发明的一个目的是提供一种用于人工授精的组合物,尤其是用于子宫授精的组合物,其允许通过显著较低的精子剂量进行授精。人工授精的过程应该避免任何手术步骤,并且应当优选包括通过传统的人工授精施用精子授精剂量,或由通过传统的人工授精施用精子授精剂量组成,例如,通过在母猪中的子宫体施用。
技术实现要素:
本发明通过权利要求的特征实现该目的,特别是在第一变体中通过使精子与对n-乙酰葡糖胺(glc-nac)具有亲和力和/或对唾液酸具有亲和力和/或对甘露糖具有亲和力的结合剂接触,和/或与水解唾液酸和/或水解n-乙酰葡糖胺和/或水解低聚甘露糖的试剂接触,例如上述接触在将精子引入雌性哺乳动物的子宫之前或同时进行;以及在第二变体中,使子宫与对唾液酸具有亲和力和/或对β-d(1,3)-半乳糖胺具有亲和力的结合剂接触,和/或与水解唾液酸的试剂接触,和/或与唾液酸和/或n-乙酰葡糖胺和/或低聚甘露糖或甘露糖接触,例如上述接触在将精子引入雌性哺乳动物的子宫之前或同时进行。第一个和第二个变体可以独立或组合。
在第一个变体中,在第一个实施方案中,精子与这些化合物中至少一种的接触可以通过提供用于人工授精的组合物(也称为液体制剂)来实现,所述组合物含有精子,其中所述组合物至少含有这些化合物之一。优选地,组合物含有的精子剂量显著低于常规人工授精所使用的剂量。
在第一个变体中,在第二个实施方案中,精子可以与这些化合物中的至少一种接触,从这些化合物的未结合部分分离,例如,通过将精子与这些化合物至少一种混合并清洗精子,例如通过离心从含有这些化合物至少一种的悬浮液中收集精子,并将精子转移到不含这些化合物中至少一种的液体组合物中,该液体组合物例如适合于授精,例如用作至少一份授精剂量。
在第一变体中,在第三实施方案中,用于接触精子的这些化合物中的至少一种可以作为用于在引入精子之前或同时被给予至雌性生殖道的组合物而提供,所述精子被包含在独立的液体组合物中。
在第二变体中,在第四实施方案中,至少一种用于接触子宫的化合物可以作为用于在引入精子之前或同时被施用于雌性的生殖道(尤其是子宫)的组合物提供,所述精子被包含在独立的液体组合物中。
在第二个变体中,在第五个实施方案中,至少一种用于接触子宫的化合物可以在含有精子配剂(spermdose)的组合物中提供。
在其中所述方法包括在将精子引入雌性之前施用组合物的实施方案中,例如其中所述组合物不含精子,该方法用于使雌性准备进行人工授精。其中,人工授精可以在施用组合物后发生,例如,通过随后将精子引入子宫。
优选地,雌性哺乳动物为小母猪(gilt)或母猪(sow),精子是新鲜或冷冻的公猪精子。在变体中,性别富集(gender-enriched)的精子,例如公猪精子配剂,例如性染色体特异性分选的精子,为新鲜使用或冷冻使用,优选从冷冻状态解冻。
本发明基于以下发现:至少在猪中,可育的精子在很大程度上与子宫上皮尤其是子宫内膜结合(以子宫上皮细胞为例),且减少精子与子宫上皮的结合导致通过以较低剂量的用于人工授精的精子进行。为了减少精子与子宫上皮的结合,可以掩蔽精子的介导与子宫内膜结合的结合配体,例如:通过使精子与对n-乙酰葡糖胺(glc-nac)具有亲和力和/或对唾液酸具有亲和力的结合剂接触,所述结合剂可以例如为凝集素或抗体;和/或通过使精子与水解唾液酸和/或水解n-乙酰葡糖胺的酶(例如,水解唾液酸的唾液酸酶)接触。替代地或此外,子宫内膜可以与对唾液酸具有亲和力和/或对β-d(1,3)-半乳糖胺具有亲和力的结合剂接触,所述结合剂可以例如是凝集素或抗体;和/或与水解唾液酸的试剂接触;和/或与唾液酸和/或n-乙酰葡糖胺和/或低聚甘露糖或甘露糖接触。在另外的选择中,精子可以与唾液酸和/或β-d(1,3)-半乳糖胺接触。优选地,凝集素、唾液酸酶和抗体是天然分子,例如,未经化学修饰,尤其未经peg部分修饰。
当在精子和/或子宫内膜细胞上掩蔽n-乙酰葡糖胺(glc-nac)和/或唾液酸和/或低聚甘露糖或甘露糖,或从精子和/或子宫内膜细胞去除这些分子,和/或使精子和/或子宫与n-乙酰葡糖胺(glc-nac)和/或唾液酸和/或低聚甘露糖或甘露糖接触时,观察到精子与子宫内膜的结合减少,导致例如与这些结合的分子的饱和。这些观察可以最终解释为:至少在猪中,精子与子宫内膜的结合是由存在于精子上、特别是在精子头部的n-乙酰葡糖胺和/或唾液酸和/或甘露糖和/或葡萄糖的相互作用介导的,并且也由存在于子宫内膜上的唾液酸和/或β-d(1,3)-半乳糖胺介导。
由于根据本发明的组合物和方法允许通过以下物质使用与常规人工授精相比数量显著减少的精子对雌性哺乳动物、特别是非人类雌性哺乳动物优选母猪进行授精:对n-乙酰葡糖胺(glc-nac)具有亲和力和/或对唾液酸具有亲和力、和/或对甘露糖具有亲和力的结合剂、和/或水解唾液酸和/或水解n-乙酰葡糖胺的试剂和/或水解低聚甘露糖的试剂(例如在将精子引入雌性哺乳动物子宫之前或同时);和在第二变体中,对唾液酸具有亲和力和/或对β-d(1,3)-半乳糖胺具有亲和力的结合剂和/或水解唾液酸的试剂,和/或用于接触子宫的唾液酸和/或n-乙酰葡糖胺和/或低聚甘露糖或甘露糖,这些组合物作为药物活性化合物以增强使用相比常规人工授精较少数量的精子进行的授精。因此,所述组合物用于增强人工授精精子配剂的生育能力,特别是用于在引入精子之前或同时被给予至雌性的生殖道例如子宫,和/或通过使精子与组合物接触,特别是在将精子引入雌性生殖道之前或同时,例如,引入子宫,特别是引入母猪的短小子宫体内。
在此,给予的精子剂量与剂量中的活精子有关。优选地,相比于用于常规人工授精的剂量,根据本发明的人工授精的剂量降低至至多5分之一,优选至多10分之一,更优选至多20分之一或至多30分之一,更优选至多50分之一或至多100分之一,其中在常规授精中,精子悬浮在不含化合物的合成培养基中,并且其中在根据本发明的剂量和用于常规人工授精的剂量中,精子都是新鲜的(即非冷冻的)或冷冻的。例如,对于母猪(野猪),对于新鲜精子来说,常规人工授精的剂量含有大约1至3x109个(colenbrander等,reproddomestanim1,298-333(1991)),和对于冷冻精子来说含有大约5x109个(其通常在授精之前解冻)。通常优选,授精至少在排卵前24小时进行,例如,其被观察为发情旺期。
优选地,人工授精的剂量可分别包含0.4x109,优选0.2x109,更优选100x106或66x106,更优选40x106或20x106个精子(对于新鲜精子),和1x109,优选0.5x109,更优选250x106或165x106,更优选100x106或50x106个精子(对于冷冻精子)。
通过本发明的组合物和方法获得的生育能力和常规的人工授精获得的生育能力优选地被确定为授精率、产仔率和断奶率的总和,例如,如vazquez等,theriogenology63,536-547(2005)中所述。
任选地,精子主要是携带x染色体的精子,例如,通过性染色体特异性分选获得。
所述剂量可以例如包括80至100ml的体积。
结合剂可以以例如0.1-1或1.0-5.0μg/ml的量包含在剂量中。
优选地,精子配剂可以包含至少一种对n-乙酰葡糖胺(glc-nac)具有亲和力和/或对唾液酸具有亲和力的结合剂,所述结合剂可以例如是凝集素或抗体,和/或可以含有水解唾液酸和/或水解n-乙酰葡糖胺的酶,例如水解唾液酸的唾液酸酶。任选地,替代地,精子配剂可以含有n-乙酰葡糖胺(glc-nac)、唾液酸和/或低聚甘露糖和/或甘露糖。
任选地,所述至少一种对n-乙酰葡糖胺(glc-nac)具有亲和力和/或对唾液酸具有亲和力的结合剂(其可为例如凝集素或抗体)和/或水解唾液酸和/或水解n-乙酰葡糖胺的酶(例如水解唾液酸的唾液酸酶),可以在引入精子(例如授精)之前给予到雌性的生殖道,例如子宫颈,优选到子宫。
最优选地,本发明的组合物和方法包含对n-乙酰葡糖胺具有亲和力的和/或对唾液酸具有亲和力的结合剂,特别是结合至n-乙酰葡糖胺和/或对唾液酸具有亲和力的凝集素或抗体,和/或水解唾液酸的酶,例如唾液酸酶。这些组合物和方法具有不干扰或仅以可接受的低水平干扰精子与透明带结合的优点,该结合通常被认为至少部分取决于含有甘露糖的配体在透明带上的结合。
现在参照附图通过实施例更详细地描述本发明
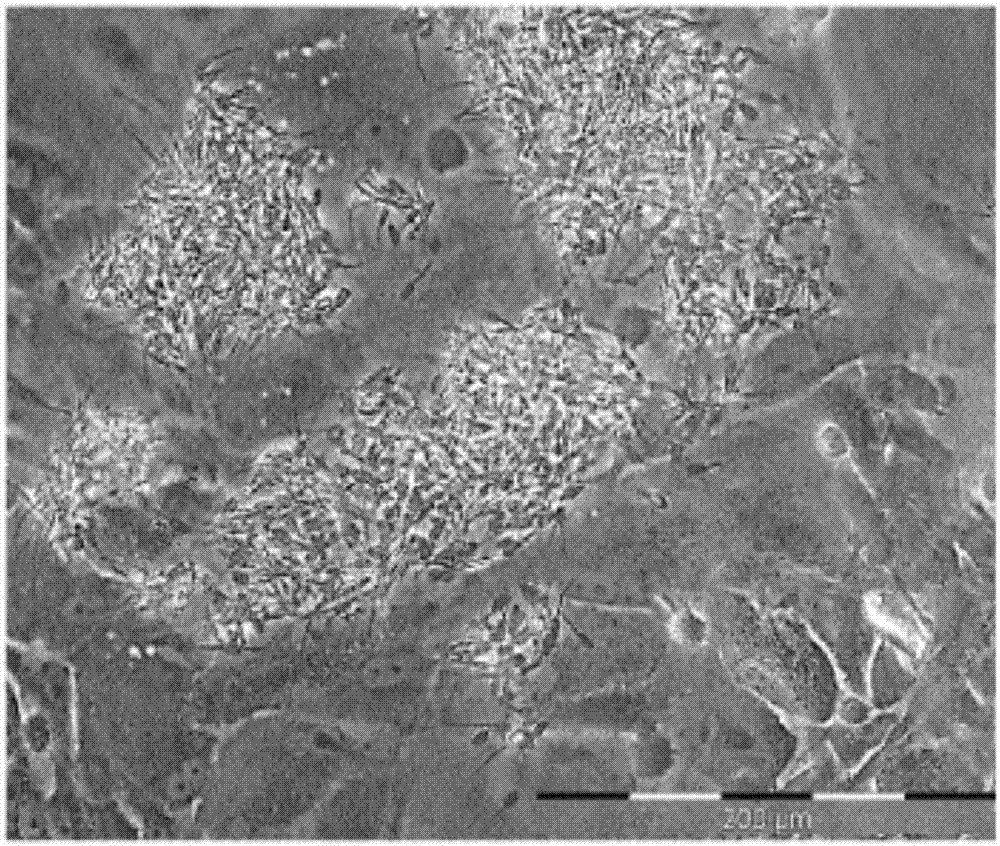
-图1是与培养的uec单层共培养10分钟后猪精子的共焦显微照片,
-图2a是与培养的uec单层共培养10分钟后用cona预处理的猪精子的共焦显微照片,
-图2b是与培养的uec单层共培养10分钟后用wga预处理的猪精子的共焦显微照片,以及
-图3a是未处理的猪精子与培养的猪胎儿成纤维细胞(porc.foet.f)共培养10分钟后的共焦显微照片,
-图3b是与猪主动脉内皮细胞(paec)共孵育10分钟后未处理的猪精子的共焦显微照片,
-图4a是与猪精子共孵育10分钟后用swga预处理后uec的共焦显微照片,以及
-图4b是与猪精子共孵育10分钟后用wga预处理后uec的共焦显微照片。
实施例1:通过阻断精子上的结合位点来提高生育能力
根据第一个变体,鉴定和阻断参与结合子宫上皮细胞(uec)的精子的结合位点,然后将精子与培养的uec共孵育,显示精子与uec的结合降低。
使融合的uec在玻璃盖玻片上生长,形成原代细胞培养物。总共获得78头初产德国长白猪(landrace)或8-10个月龄的德国明白猪(edelschwein)小母猪(且活体重超过110公斤)的子宫,以收集原代细胞。所有动物都按照德国动物福利法规进行饲养和处理。监测小母猪的自然发情期,并根据发情旺期,即在将进行人工授精时,进行屠宰。小母猪被电击昏,随后被放血屠宰。出血三分钟后打开腹部,将子宫全部取出。此外,用无菌剪刀切除卵巢、输卵管和子宫系膜,而不损伤子宫肌层。将子宫角用缝合线结扎在一起,切下20-25厘米的切片。将切片置于玻璃瓶中的含有2%青霉素/链霉素(p/s;paa,pasching,austria)且无ca++和mg++的无菌磷酸盐缓冲盐水(pbs)(karlroth,karlsruhe,德国)中,并在5℃保持45分钟。在5℃保持45分钟后,将子宫切片从瓶中取出并置于无菌层流系统下的纤维素组织上。缝合材料被移除。用无菌动脉夹固定每个角,确保开口端,然后使用10ml无菌血清移液管用10ml含有2%p/s的无菌pbs冲洗管腔三次。然后用夹钳关闭一端,并通过10ml无菌血清移液管将10ml乙二胺四乙酸和胰蛋白酶(edta/try;在pbs中10%(paa,pasching,austria),不含ca++/mg++)插入到角中,剩下的一端同样用夹钳关闭。子宫角的精细移动确保了在整个管腔中的等同分布。在新鲜的含有2%p/s的20ml纯pbs中于37℃孵育15分钟。酶消化后,加入10mlpbs,使角略微移动,并将液体置于含有5ml温热细胞培养基(d20,77%dmem,20%fbs,1%丙酮酸钠,1%氨基酸,1%p/s)的50ml离心管中。将细胞悬浮液在209×g和室温下离心4分钟。这个过程每个角进行三次,消化时间不同,其中第二次和第三次重复的消化时间为10分钟,而不是15分钟。离心后,通过抽吸去除上清液,将细胞沉淀轻轻地重悬于500μl的37℃温热的d20培养基中。将来自两个角的细胞合并并分散到在6孔培养皿中涂覆有胶原的玻璃盖玻片上,并在37℃和潮湿气氛下在5%co2饱和度的培养箱中培养。用在无菌pbs中的0.02m乙酸稀释至50μg/ml(无ca++和mg++)的大鼠尾部胶原i型(bectondickinsonbiosciences,heidelberg,德国)薄薄地涂覆玻璃盖玻片(直径22mm,karlroth,karlsruhe,德国)。将一个盖玻片置于六孔板的每个孔中,并将600μl胶原溶液小心移液到每个盖玻片上以形成凸形弯月面并在室温(rt)下温育1小时。然后通过抽吸除去剩余的液体,并使用基质分散细胞。收获子宫上皮细胞,在含有修饰的完整达尔伯克改良伊格尔氏培养基dmem(含有2mmoll-谷氨酰胺(applichem,darmstadt,德国)和0.1mmolβ-巯基乙醇(sigmaaldrich,darmstadt,德国)的细胞培养基(d20)中分散并培养,且该细胞培养基补充有20%热灭活的胎牛血清、1%改良伊格尔氏培养基(mem)非必需氨基酸、1%p/s(全部paa,pasching,austria)和1%丙酮酸钠(sigmaaldrich,darmstadt,德国)。为了分散细胞,加入15μg/ml内皮细胞生长因子(ecgf,reliatech,wolfsburg,德国)。2天后,将2ml新鲜d20培养基(不含ecgf)加入细胞中,而不去除旧的培养基。这保证了细胞的完全粘附,并且不会因漂浮细胞的抽吸而被清除。五天后,完全除去旧培养基,每三天每孔更换一次2ml新培养基。
为了鉴定上皮细胞,从融合的uec中除去细胞培养基,并用纯pbs洗涤细胞,每个孔用1ml冰冷的甲醇(meoh;80%;karlroth,karlsruhe,德国)固定10分钟。除去甲醇,每孔加入1ml封闭溶液(在纯pbs中的2%驴血清)并在室温下孵育15分钟。随后用纯pbs洗涤细胞2次,持续5分钟,进行免疫荧光抗体染色,其使用上皮细胞特异性单克隆大鼠抗体(tromaiii-s;大鼠抗细胞角蛋白-19;developmentalstudieshybridomabank,iowa,usa)作为初级抗体,其对细胞角蛋白-19(krt-19)具有特异性,该细胞角蛋白-19是负责上皮细胞结构完整性的中间丝蛋白。将初级抗体以在pbs和triton(10x;merck,darmstadt,德国)中1:100、1:200和1:500的稀释度施加于固定的细胞,并在5℃的潮湿室中孵育24小时。通过用每孔1ml纯pbs洗涤细胞三次,除去未结合的抗体。作为二级抗体,以1:2000稀释度施用山羊抗小鼠igg(h+l),
如上所述,使用在玻璃盖玻片上生长的融合uec。为了比较,使用融合的猪主动脉内皮细胞(paec)以及猪胎儿成纤维细胞(foet.f)。猪精子对猪子宫内膜的结合特异性通过与比较细胞的结合的减少来证实。用作种间而非表面细胞类型的成纤维细胞用于证明精子是否以与猪uec相同的强度与任何种类的细胞或组织结合。猪主动脉内皮代表来自非生殖器官的管腔细胞。这些细胞类型是按照boquest等人,biol.reprod60,1013-1019(1999)分离的。
精液从四个经验证具有生育能力的公猪(德国长白猪和德国明白猪)收集。为了保证精液质量不变,每周两次(间隔两到三天)定时采集种公猪的精液。通过手握采精法收集富集精子的部分,并用温热的d20培养基小心地将其相同部分扩散。使用
使用
为了识别可能的精浆效应,uec还与四只已知可生育的公猪(德国明白猪)的附睾精子一起孵育。对于附睾精子,通过去势去除睾丸,从睾丸切下精小管,且用温热的d20培养基冲洗附睾尾部,且附睾精子分别扩散至100x106/ml。因此可以排除已经附着于精子表面的精浆成分对uec的结合的影响。在d20培养基中将精液稀释至100x106/ml,并与以下凝集素中的一种一起孵育:wga、swga或cona,其通过与1μl凝集素在200μlpbs(不含ca++和mg++)中的稀释液一起孵育,以获得10μg/ml的浓度。将15微升这种凝集素稀释液加入到100μl精子中,并在37℃的培养箱中温育15分钟。通过洗涤(4分钟,800xg,rt)除去未结合的凝集素,并将沉淀重新悬浮于d20中。
作为结合的对照,使用流式细胞仪试管(greinerbio-one,frickenhausen,德国),用fitc标记的凝集素wga、swga、cona或rca120标记射精的猪精子,使用480μlpbs(不含ca++和mg++)和各自3μlpi制备。完成孵育后,加入20μl精子-凝集素溶液,并在室温下再温育10分钟。作为对照,对一等份的精子悬浮液进行相同的处理,但不用凝集素。如下所示在facs分析中观察到强结合,其中列出了聚糖配体,凝集素对于该配体具有主要的亲和力:
这些结果表明这些凝集素与精子细胞有很强的结合,表明在射出的猪精子上存在n-乙酰基-葡糖胺、唾液酸、甘露糖和葡萄糖,以及存在β-d-gal-d-半乳糖胺。
将与一种凝集素预孵育的精液加入融合的uec并通过共焦显微镜分析。
为了与uec共孵育,将500μl用凝集素预孵育的精子释放到uec单层上,并且在装配有高分辨率数码相机(olympusdl70,olympus,hamburg,德国)的相差显微镜(olympusbx60,olympus,hamburg,德国)下观察结合活性。通过观察区域对结合密度进行定量并将其与在未处理的精子培养下的对照结果进行比较。图像(每只公猪和每种凝集素重复2次重复)被分成61.6μm2的区域且计数存在和不存在精子的区域。
图1显示了用uec孵育的对照精子(未处理,在d20培养基中)的显微镜图片,显示精子细胞与uec的强结合。图2a中显示了用cona预孵育后的精子的结果,图2b显示了在用wga预孵育后精子的结果。为了对照,对精子进行平行处理,但没有凝集素。精子与培养细胞层结合的分析是通过手动的观察区域法,其中以200x放大率拍摄图像并分级为61.6μm2大小的正方形。对覆盖和不覆盖精子的区域进行定量。每头公猪拍摄五张照片并进行评估。在整个实验中,由同一个人进行区域评估。对照精子以18050.25±5520.06μm2结合,wga预处理的精子以2362.87±248.61μm2结合且swga预处理的精子以1684.83±107.94μm2结合,显示通过用wga和swga预处理,与uec的结合显著减少。用cona(对甘露糖/葡萄糖有亲和力)预处理的精子以12718.39±1999.52μm2结合,显示结合的显著降低,尽管相比通过wga或swga的预培养降低程度较小。
使用附睾精子代替射精精子(对照)重复未处理的精子的结合。发现结合强度是相同的。
为了分析与除了uec之外其他细胞结合的精子,将细胞培养基从uec猪胎儿成纤维细胞或猪主动脉内皮细胞的融合单层去除,使其分别在涂覆有胶原的盖玻片上生长,向每个孔施加射精精子或尾部附睾精子的500μl精子悬浮液(100x106/ml)。在培养箱(37℃,8%co2)中共孵育至多60分钟,优选孵育10分钟,因为这段时间被认为是足够的。随后,通过抽吸小心去除剩余的精子,用温热的d20细胞培养基温和洗涤单层。将盖玻片安装到显微镜载玻片上,使细胞和精子朝上,并将200μld20液滴滴加到盖玻片上以防止细胞变干。在与高分辨率数码相机(olympusdp71,olympus,hamburg,德国)连接的相差显微镜(olympusgx60,olympus,hamburg,德国)下观察精子结合。使用
这些结果表明,通过对n-乙酰葡糖胺具有亲和力和/或对唾液酸具有亲和力的结合剂的结合剂(例如凝集素wga)和/或对甘露糖/葡萄糖具有亲和力的结合剂(例如凝集素cona)阻断了精子上的结合位点,减少了精子与子宫内膜的结合,从而增加可用于授精(例如在输卵管或壶腹部)的精子数量。
实施例2:通过阻断uec上精子的结合位点来增强生育能力
融合的uec用1mlpbs(不含ca++和mg++)和45μl四种可选的凝集素(wga、swga、pna、cona)之一的凝集素悬浮液(10μg/ml)洗涤两次并在37℃下在8%co2在培养箱中温育15分钟。随后,将凝集素溶液抽吸,用1mlpbs(不含ca++和mg++)轻轻洗涤细胞,且将500μl精子(100x106个精子/ml)释放到uec单层上并孵育10分钟。在配备有高分辨率数码相机(olympusdl70,olympus,hamburg,德国)的相差显微镜(olympus,bx60,olympus,hamburg,德国)下观察结合活性并估计密度。
图4a显示了用swga预孵育、用稀释于d20培养基中的猪精子细胞孵育后的uec的显微照片,图4b是用wga预孵育、用稀释于d20培养基中的猪精子细胞孵育后的uec的显微照片。与未处理的对照uec细胞(17426.81.4±4653.58μm2)相比,用wga预孵育的uec(对glc-nac/唾液酸具有亲和力;5961±309.18μm2)上的精子结合密度显著较低(p<0.05)。此外,用swga(对glc-nac具有亲和力)和cona(对甘露糖/葡萄糖具有亲和力)处理不显著损害精子结合。
该结果显示阻断uec上的唾液酸,例如通过对唾液酸具有亲和性的试剂,或从uec中除去唾液酸配体,减少了精子与子宫内膜的结合,并因此增加了可用于授精(例如,在输卵管或壶腹部)的精子的数量。
在用pna(对β-d-(1-3)-d-半乳糖胺具有亲和力)预孵育uec之后,一些区域显示出未处理的uec所见的大量精子结合,而另一些区域完全不存在,类似于wga处理的uec。
实施例3:通过阻断或去除结合位点提高生育能力
对于人工授精,将母猪用作雌性哺乳动物的一个例子。通常,母猪在发情旺期授精,在12小时后再次授精,每次使用50x106、100x106、500x106或1000x106新鲜稀释的精子进行授精。为了比较,将母猪的对比组用在市售标准稀释剂中的30亿精子剂量的新鲜精子授精。
每组包括4-6只动物。所有组合物的给予是通过标准的人工授精,以在子宫体的远端部分沉积。
以在标准稀释液中的10μg/mlwga的组合物向第一组母猪施用精子配剂;
以在标准稀释剂中的1u/ml唾液酸酶(从霍乱弧菌获得)的组合物向第二组母猪施用精子配剂;
向第三组母猪施用含有10μg/mlwga的100ml标准稀释剂的组合物,然后在2至20分钟后施用标准稀释剂中的精子配剂;且
第四组母猪施用含有1u/ml唾液酸酶(从霍乱弧菌获得)的100ml标准稀释剂的组合物,然后在2至20分钟后施用标准稀释剂中的精子配剂。
而且,通常根据us5135759a使用facs将来自同一公猪的精子分选成含有至少90%携带x染色体的精子的部分。使用性染色体特异性精子而不冷冻。
在用于对照的第五组母猪中,仅在标准稀释剂中含有精子配剂,
在第六组母猪中,在标准稀释剂中在…μg/mlwga的组合物中包含精子配剂,
在第七组母猪中,在标准稀释剂中在1u/ml唾液酸酶(可获自霍乱弧菌)的组合物中包含精子配剂,
第八组母猪施用含有10μg/mlwga的100ml标准稀释剂的组合物,然后在2至20分钟后施用标准稀释剂中的精子配剂,且
第九组母猪施用含有1u/ml唾液酸酶(可从霍乱弧菌获得)的100ml标准稀释剂的组合物,然后在2至20分钟后施用标准稀释剂中的精子配剂。
36天后,通过超声诊断监测授精。
在第二至第四组中,与第一对照组相比,授精显著增加。
在第六至第九组中,与第五对照组相比授精显著增加,且表现出对雌性后代的强烈倾向。
- 还没有人留言评论。精彩留言会获得点赞!