微针阵列的制作方法
本发明涉及一种微针阵列。
背景技术:
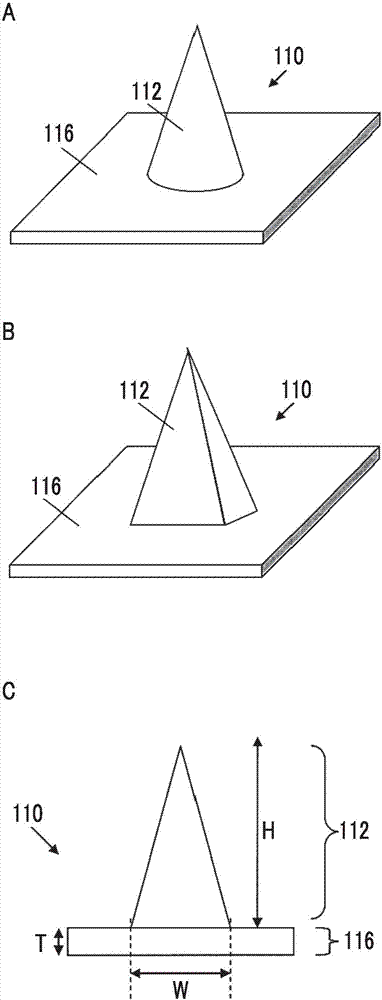
:作为将药物投与到皮肤、粘膜等生物体表面的方法,有将液体物质或粉末物质附着于生物体表面的方法。另外,在近年来受到关注的生物药品中,由于很难突破基于渗透的阻挡层,因此选择通过注射的投药。另外,作为投与适量的药物并且用于实现充分的药效的药物的投与方法,使用形成有含有药物的高纵横比的微针(针状凸部)的微针阵列,通过微针贯穿角质阻挡层并将药物以不会带来疼痛的方式注射到皮肤内的方法备受瞩目。例如,已经报道了将具有生物体内溶解性的物质作为基材的自溶型微针阵列。在自溶型微针阵列中,将药物保持在该基材上,当微针插入到皮肤中时,基材自溶,由此能够向皮内投与药物。专利文献1中记载有一种经皮吸收片材及其制造方法,所述经皮吸收片材为聚合物制的经皮吸收片材,在片材部的表面形成有含有药物的针状凸部,所述经皮吸收片材及其制造方法的特征在于,针状凸部中含有的药物的浓度从针状凸部的尖端朝向根部连续减小而成。专利文献2中记载有一种微针,其为角锥状或棱柱状、或者圆锥状或圆柱状的细针,其特征在于,细针中,主要成分材料为麦芽糖与葡聚糖的混合物或海藻糖,并含有作用于皮肤的功能性物质,通过将细针插入到皮肤中,主成分材料溶解并且功能性物质被供给到皮肤中。专利文献3中记载有一种微针片材的制造方法,其特征在于,具备:将第1微针原料填充于从压膜的第1表面朝向与第1表面对置的第2表面逐渐减小第1规定长度的锥形凹部中的工序;及在规定相对湿度的环境下静置干燥填充于凹部中的第1微针原料,形成延伸比第1规定长度短的第2规定长度的针尖端层的工序,规定相对湿度为60%以上且99%以下,抑制第1微针原料在凹部内壁中的凝固速度。现有技术文献专利文献专利文献1:日本特开2011-224332号公报专利文献2:日本特开2005-154321号公报专利文献3:日本专利5587647号公报技术实现要素:发明要解决的技术课题在将作为液体物质或粉末物质的药物附着到生物体表面的方法中,由于药物的附着区域仅限于皮肤表面,因此有时可通过出汗、异物接触等来去除附着的药物,难以投与适量的药物。并且,在利用这种基于药物的扩散的渗透的方法中,由于药物的渗透受到角质的阻挡层的阻挡,所以很难获得充分的药效。并且,通过注射投药需要医务人员的帮助,进而也伴有疼痛和感染风险。作为通过注射投药的替代方法,使用微针阵列将药物注射到皮肤内的方法近年来备受瞩目,但是难以获得与使用微针阵列的注射相等的药效。尤其是在设想为人类的大型动物的情况下,与小鼠和大鼠那样的小动物相比,皮肤厚,稳定地投与规定量,难以获得充分的药效。在专利文献1~3中,没有记载针部所含的药物的分布、穿刺性、溶解性及药效之间的关系。本发明要解决的问题在于提供一种由片材部及针部构成且能够实现高药效的微针阵列。用于解决技术课题的手段本发明人为了解决上述问题进行了深入研究的结果发现,一种微针阵列,其具有片材部及存在于片材部的上表面的多个针部,通过在针部的尖端部以高浓度承载药物,并且投与将针部的水溶性高分子比率设定为对皮肤的穿刺性良好的微针阵列,能够获得与皮下注射相等的药效,由此完成了本发明。即,根据本发明,提供以下发明。(1)一种微针阵列,其具有片材部及存在于片材部的上表面的多个针部,所述微针阵列中,针部包含水溶性高分子及药物,针部的总固体成分的50质量%以上为水溶性高分子,水溶性高分子和药物在包含针部尖端的区域且具有相当于整个针部高度的20%长度的高度的针部尖端区域以下述式1的质量比率存在,片材部包含水溶性高分子。式1水溶性高分子:药物=0.05~0.9:1(2)根据(1)所述的微针阵列,其中,针部包含水溶性高分子、二糖类及药物,水溶性高分子、二糖类及药物在包含针部尖端的区域且具有相当于整个针部高度的20%长度的高度的针部尖端区域以下述式2的质量比率存在。式2水溶性高分子+二糖类:药物=0.05~5:1(3)根据(1)或(2)所述的微针阵列,其中,二糖类为选自包括蔗糖、麦芽糖及海藻糖的组中的至少一种。(4)根据(1)至(3)中任一项所述的微针阵列,其中,针部的水溶性高分子为选自包括羟乙基淀粉、羟丙基甲基纤维素、支链淀粉、葡聚糖、软骨素硫酸钠、透明质酸钠、羟甲基纤维素、聚乙烯吡咯烷酮、聚氧乙烯聚氧丙烯二醇、聚乙二醇、聚乙烯醇的组中的至少一种。(5)根据(1)至(4)中任一项所述的微针阵列,其中,片材部的水溶性高分子为选自包括羟乙基淀粉、羟丙基甲基纤维素、支链淀粉、葡聚糖、软骨素硫酸钠、透明质酸钠、羟甲基纤维素、聚乙烯吡咯烷酮、聚氧乙烯聚氧丙烯二醇、聚乙二醇、聚乙烯醇的组中的至少一种。(6)根据(1)至(5)中任一项所述的微针阵列,其中,药物为选自包括肽激素、疫苗及佐剂的组中的至少一种。(7)根据(1)至(6)中任一项所述的微针阵列,其中,针部包含两种以上的水溶性高分子、二糖类及药物。(8)根据(1)至(7)中任一项所述的微针阵列的制造方法,其包括:通过对填充有含有药物的第一水溶性高分子溶解液的针部形成用模具进行干燥而形成一部分针部的工序;及将第二水溶性高分子溶解液填充于上述中形成的一部分针部的上表面并进行干燥的工序。(9)根据(8)所述的方法,其中,将填充有含有药物的第一水溶性高分子溶解液的针部形成用模具,在干燥开始后30分钟起经过300分钟之后,第一水溶性高分子溶解液的含水率达到20%以下的条件下进行干燥。(10)根据(8)或(9)所述的方法,其中,在将容器盖上的状态或收容于容器的状态下干燥填充有含有药物的第一水溶性高分子溶解液的针部形成用模具。(11)根据(7)至(9)中任一项所述的方法,其中,在温度1~40℃、相对湿度30~95%的条件下干燥填充含有药物的第一水溶性高分子溶解液而成的针部形成用模具。发明效果根据本发明,能够在具有片材部及存在于片材部的上表面的多个针部的微针阵列中实现高药效。附图说明图1是说明包括针部尖端的区域且具有相当于整个针部高度的20%长度的高度的针部尖端区域的图。图2中,图2a是圆锥状微针的立体图,图2b是角锥状微针的立体图,图2c是圆锥状及角锥状微针的剖视图。图3是另一种形状的微针的立体图。图4是另一种形状的微针的立体图。图5是图3、图4所示的微针的剖视图。图6是另一种形状的微针的立体图。图7是另一种形状的微针的立体图。图8是图6、图7所示的微针的剖视图。图9是针部侧面的倾斜(角度)连续地变化的另一种形状的微针的剖视图。图10中,图10a~图10c是模具的制造方法的工序图。图11是模具的放大图。图12是表示另一形态的模具的剖视图。图13中,图13a~图13c是表示将含有药物的高分子溶解液填充到模具的工序的示意图。图14是表示喷嘴的前端的立体图。图15是填充期间的喷嘴的前端与模具的局部放大图。图16是移动期间的喷嘴的前端与模具的局部放大图。图17中,图17a~图17d是表示另一微针阵列的形成工序的说明图。图18中,图18a~图18c是表示另一微针阵列的形成工序的说明图。图19是表示剥离工序的说明图。图20是表示另一剥离工序的说明图。图21是表示微针阵列的说明图。图22中,图22(a)及图22(b)是原版的俯视图及侧视图。图23是实施例中所使用的填充装置的示意图。具体实施方式以下,对本发明的实施方式详细进行说明。在本说明书中,“含有规定量的药物”是指含有穿刺到体表时发挥药效的量的药物。“不含规定量的药物”是指不含有发挥药效的量的药物,药物的量的范围包括完全不含药物的情况到不发挥药效的量的范围。以下,将“包含规定量的药物”称为“含有药物”,将“不包含规定量的药物”称为“不含药物”。在本发明的微针阵列中,通过提高针部的水溶性高分子的比率来提高穿刺性,并且通过提高包括针部尖端在内的针部尖端区域的药物比率来提高药效。根据具有上述结构的本发明的微针阵列,能够实现与皮下注射相等的药效。为了提高穿刺性,通常只要提高针部的水溶性高分子的比率即可。但是,若提高针部的水溶性高分子的比率,则药物的比率降低,无法实现充分的药效。在本发明中,将针部分为包括针部的尖端且具有相当于整个针部高度的20%长度的高度的针部尖端区域和除上述以外的区域,并研究了药物的分布。并且,在本发明中,通过提高上述针部尖端区域中的药物比率,并且提高整个针部的水溶性高分子的比率,成功实现了良好的穿刺性和高的药效。并且,如本说明书中的比较例所示,存在即使穿刺性及溶解性良好也无法实现良好的药效的情况。即,为了显现出良好的药效,建议除穿刺性及溶解性以外的因素存在,例如,当存在没有足够量的药物进入血液中等情况时,预计不会显现出高的药效。根据上述本发明的结构,具有良好的穿刺性及良好的溶解性,并且能够实现高的药效是以往完全预想不到的效果。[微针阵列的结构]本发明的微针阵列为具有片材部及存在于片材部的上表面的多个针部的微针阵列,其中,针部包含水溶性高分子及药物,针部的总固体成分的50质量%以上为水溶性高分子,水溶性高分子和药物在包括针部尖端的区域、即具有相当于整个针部高度的20%长度的高度的针部尖端区域以下述式1的质量比率存在,片材部包含水溶性高分子。式1水溶性高分子:药物=0.05~0.9:1在本发明中,多个是指1个以上。本发明的微针阵列为了有效地将药物投与皮肤中,至少包括片材部及针部,并在针部承载药物。本发明的微针阵列是多个针部在片材部的上表面侧配置成阵列状的设备。针部优选配置于片材部的上表面侧。针部可直接配置于片材部的上表面,或者针部也可配置于片材部的上表面所配置的截头锥体部的上表面。片材部为用于支撑针部的基座,具有如图1~图9所示的片材部116那样的平面状形状。此时,片材部的上表面是指多个针部在表面上配置成阵列状的表面。片材部的面积没有特别限定,优选为0.005~1000mm2,更优选为0.05~500mm2,进一步优选为0.1~400mm2。片材部的厚度以与截头锥体部或针部接触的表面和与其相反的一侧的表面之间的距离来表示。作为片材部的厚度,优选为1μm以上且2000μm以下,更优选为3μm以上且1500μm以下,进一步优选为5μm以上且1000μm以下。片材部包含水溶性高分子。片材部可由水溶性高分子构成,也可包含除此以外的添加物(例如,二糖类等)。另外,优选片材部不含药物。作为片材部中所包含的水溶性高分子,并没有特别限定,能够列举多糖类(例如,透明质酸、透明质酸钠、支链淀粉、葡聚糖、糊精、软骨素硫酸钠、羟甲基纤维素、羟丙基纤维素、羟乙基淀粉、羟丙基甲基纤维素、聚乙烯吡咯烷酮、聚氧乙烯聚氧丙烯二醇、聚乙二醇、阿拉伯胶等)、蛋白质(例如,明胶等)。上述成分可单独使用一种,也可作为两种以上的混合物来使用。上述中优选多糖类,进一步优选羟乙基淀粉、羟丙基纤维素、羟丙基甲基纤维素、支链淀粉、葡聚糖、软骨素硫酸钠、透明质酸钠、羟甲基纤维素、聚乙烯吡咯烷酮、聚氧乙烯聚氧丙烯二醇、聚乙二醇、聚乙烯醇,尤其优选软骨素硫酸。片材部中可添加二糖类,作为二糖类,可列举蔗糖、乳果糖、乳糖、麦芽糖、海藻糖或纤维二糖等,尤其优选蔗糖、麦芽糖、海藻糖。微针阵列由在片材部的上表面侧配置成阵列状的多个针部构成。针部为具有尖端的凸状结构物,但不限定于具有尖锐的尖端的针形状,也可以是不尖锐的形状。作为针部的形状的例子,可列举圆锥状、多角锥状(四角锥状等)或纺锤状等。例如,具有如图1~图9所示的针部112那样的形状,整个针部的形状可以是圆锥状或多角锥状(四角锥状等),也可以是使针部侧面的倾斜度(角度)连续改变的结构。并且,也能够采用针部侧面的倾斜度(角度)不连续改变的、两层或两层以上的多层结构。在将本发明的微针阵列应用于皮肤的情况下,优选将针部插入到皮肤中,片材部的上表面或其一部分与皮肤接触。针部的高度(长度)由从针部的尖端向截头锥体部或片材部(在不存在截头锥体部的情况下)落下的垂线的长度来表示。针部的高度(长度)并没有特别限定,优选为50μm以上且3000μm以下,更优选为100μm以上且1500μm以下,更优选为100μm以上且1000μm以下。若针部的长度为50μm以上,则能够进行药物的经皮投与,并且通过将针部的长度设为3000μm以下,能够防止针部与神经接触而产生疼痛,并且能够避免出血,因此优选。将截头锥体部(其中,不存在截头锥体部时为针部)与片材部之间的界面成为基底部。1个针部的基底上的最远点之间的距离优选为50μm以上且2000μm以下,更优选为100μm以上且1500μm以下,进一步优选为200μm以上且1000μm以下。优选每1个微针阵列配置1~2000个针部,更优选配置3~1000个,进一步优选配置5~500个。当每1个微针阵列包括2个针部时,针部的间隔由从针部的尖端向截头锥体部或片材部(在不存在截头锥体部的情况下)落下的垂线的足部之间的距离来表示。当每1个微针包括3个以上的针部时,在所有针部中分别针对最靠近的针部求出从尖端向截头锥体部或片材部(在不存在截头锥体部的情况下)落下的垂线的足部之间的距离,并以其平均值来表示所排列的针部的间隔。针部的间隔优选为0.1mm以上且10mm以下,更优选为0.2mm以上且5mm以下,进一步优选为0.3mm以上且3mm以下。针部包含水溶性高分子及药物。优选水溶性高分子为生物体溶解性物质,以便即使针部残留在皮肤内也不会妨碍人体。作为针部中所含的水溶性高分子,并没有特别限定,能够列举多糖类(例如,透明质酸、透明质酸钠、支链淀粉、葡聚糖、糊精、软骨素硫酸钠、羟甲基纤维素、羟丙基纤维素、羟乙基淀粉、羟丙基甲基纤维素、聚乙烯吡咯烷酮、聚氧乙烯聚氧丙烯二醇、聚乙二醇、阿拉伯胶等)、蛋白质(例如,明胶等)。上述成分可单独使用一种,也可作为两种以上的混合物来使用。上述中优选多糖类,进一步优选羟乙基淀粉、羟丙基纤维素、羟丙基甲基纤维素、支链淀粉、葡聚糖、软骨素硫酸钠、透明质酸钠、羟甲基纤维素、聚乙烯吡咯烷酮、聚氧乙烯聚氧丙烯二醇、聚乙二醇、聚乙烯醇,尤其优选羟乙基淀粉。另外,由于与药物混合时不易凝聚,因此通常更优选不带电荷的多糖类。针部中所含的水溶性高分子可以与片材部中所含的水溶性高分子相同,也可不同。针部中可添加二糖类,作为二糖类,可列举蔗糖、乳果糖、乳糖、麦芽糖、海藻糖或纤维二糖等,尤其优选蔗糖、麦芽糖、海藻糖。作为针部,优选设为包含两种以上的水溶性高分子、二糖类及药物的结构。作为两种以上的水溶性高分子,并没有特别限定,优选羟乙基淀粉与其他水溶性高分子的组合。在本发明中,针部的总固体成分的50质量%以上为水溶性高分子。优选针部的总固体成分的55质量%以上为水溶性高分子,更优选60质量%以上为水溶性高分子,进一步优选为65质量%以上为水溶性高分子。上限并没有特别限定,优选针部的总固体成分的99质量%以下为水溶性高分子,更优选针部的总固体成分的95质量%以下为水溶性高分子,进一步优选针部的总固体成分的90质量%以下为水溶性高分子。通过将针部的总固体成分的50质量%以上设为水溶性高分子,能够实现良好的穿刺性及良好的药效。针部的总固体成分中的水溶性高分子的比率能够通过以下方法来测量,但没有特别限定。作为测量方法,例如将已制作的微针阵列的针部切断,将针部溶解在缓冲液(磷酸盐缓冲生理盐水(pbs)等适于溶解构成针部的水溶性高分子的缓冲液)中,能够使用高效液相色谱法来测量溶解液中的水溶性高分子的量。在本发明中,水溶性高分子和药物在包括针部尖端的区域、即具有相当于整个针部高度的20%长度的高度的针部尖端区域,以下述式1的质量比率存在。式1水溶性高分子:药物=0.05~0.9:1针部尖端区域为包括针部尖端在内的针部的局部区域。如图1所示,针部尖端区域为具有相当于整个针部高度的20%长度的高度的区域。图1的左图表示在片材部116的表面形成有针部112的情况,图1的右图表示在片材部116的表面形成有截头锥体部113且在截头锥体部113的上表面形成有针部112的情况。将针部112的高度设为h(整个针部的高度)。在图1中,将包括针部尖端且具有相当于整个针部高度的20%长度的高度的区域以“20%”来表示。在针部尖端区域,水溶性高分子和药物以上述式1的质量比率存在,由此能够发挥良好的药效。在针部尖端区域中,水溶性高分子和药物优选以下述式1a的质量比率存在,更优选以下述式1b的质量比率存在,更优选以下述式1c的质量比率存在,进一步优选以下述式1d的质量比率存在。式1a水溶性高分子:药物=0.1~0.8:1式1b水溶性高分子:药物=0.1~0.7:1式1c水溶性高分子:药物=0.2~0.7:1式1d水溶性高分子:药物=0.3~0.6:1并且,针部包含水溶性高分子、二糖类及药物时,水溶性高分子、二糖类及药物在包括针部尖端的区域且具有相当于整个针部高度的20%长度的高度的针部尖端区域优选以下述式2的质量比率存在。式2水溶性高分子+二糖类:药物=0.05~5:1在针部尖端区域,水溶性高分子、二糖类及药物以上述式2的质量比率存在,由此能够通过良好的穿刺性及良好的溶解性来实现良好的药效。在针部尖端区域,水溶性高分子、二糖类及药物更优选以下述式2a的质量比率存在,更优选以下述式2b的质量比率存在,进一步优选以下述式2c的质量比率存在,尤其优选以下述式2d的质量比率存在。式2a水溶性高分子+二糖类:药物=0.1~5:1式2b水溶性高分子+二糖类:药物=0.1~4:1式2c水溶性高分子+二糖类:药物=0.2~4:1式2d水溶性高分子+二糖类:药物=0.3~3:1针部尖端区域中的水溶性高分子与药物的质量比率、以及针部尖端区域中的水溶性高分子、二糖类及药物的质量比率能够通过以下方法来测量,但没有特别限定。作为质量比的测量方法,例如包括针部尖端的区域、及具有相当于整个针部高度的20%长度的高度的针部尖端区域与片材部平行地切割,并将切割后的针部尖端区域溶解于缓冲液(磷酸盐缓冲生理盐水(pbs)等适于溶解构成针部的水溶性高分子及药物的缓冲液)中。能够通过elisa(enzyme-linkedimmunosorbentassay:酶联免疫吸附试验)法等测量溶解液中的药物量,并能够通过高效液相色谱法分别测量水溶性高分子及二糖类的量。药物为具有对人体起作用的效能的物质。药物优选选自肽(包含肽激素等)或其衍生物、蛋白质、核酸、多糖类、疫苗、佐剂、属于水溶性低分子化合物的药类化合物或化妆品成分。药物的分子量没有特别限定,为蛋白质时优选分子量500以上的药物。作为肽或其衍生物及蛋白质,例如可列举降血钙素、促肾上腺皮质激素、甲状旁腺激素(pth)、人pth(1→34)、胰岛素、艾塞那肽、胰泌素、催产素,血管紧张素、β-内啡肽、胰高血糖素、赖氨加压素、生长抑素、胃泌素、黄体生成素释放激素、脑啡肽,神经降压素,心房钠尿肽、生长激素、生长素释放激素、舒缓激肽、物质p、强啡肽、促甲状腺激素、催乳素、干扰素、白细胞介素、粒细胞集落刺激因子(g-csf)、谷胱甘肽过氧化物酶、超氧化物歧化酶、去氨加压素、促生长因子、内皮素以及它们的盐等。作为疫苗,可列举流感抗原(流感疫苗)、hbs抗原(b型肝炎病毒表面抗原)、hbe抗原(乙型肝炎be抗原)、bcg(bacilledecalmetteetguerin)抗原、麻疹抗原、风疹抗原、水痘抗原、黄热病抗原、带状疱疹抗原、轮状病毒抗原、hib(流感杆菌b型)抗原、狂犬病抗原、霍乱抗原、白喉抗原、百日咳抗原、破伤风抗原、灭活脊髓灰质炎抗原、日本脑炎抗原、人乳头瘤病毒抗原或者它们的2~4种混合抗原等。作为佐剂,可列举磷酸铝、氯化铝、氢氧化铝等铝盐、mf59、as03等乳剂、或者脂质体、植物源成分、核酸、生物聚合物、细胞因子、肽、蛋白质、糖链等。上述中,作为药物,优选为选自包括肽激素、疫苗及佐剂的组中的至少一种。作为肽激素,尤其优选生长激素,作为疫苗,尤其优选流感疫苗。整个针部中的药物的含量没有特别限定,相对于针部的固体成分质量,优选为1~60质量%,更优选为1~50质量%,尤其优选为1~45质量%。以下,根据附图,对本发明的优选实施方式进行说明,但本发明并不限定于此。图2~图9示出微针阵列的局部放大图即微针110。本发明的微针阵列通过在片材部116的表面形成多个针部112而构成(在图中,在片材部116上只显示一个针部112,或者1个锤台部113和1个针部112,将此称为微针110)。在图2a中,针部112具有圆锥状的形状,在图2b中,针部112具有四角锥状的形状。在图2c中,h表示针部112的高度,w表示针部112的直径(宽度),t表示片材部116的高度(厚度)。图3及图4示出具有在片材部116的表面形成有截头锥体部113及针部112的另一种形状的微针110。在图3中,截头锥体部113具有圆锥台的形状,针部112具有圆锥形状。并且,在图4中,截头锥体部113具有四角截头锥体的形状,针部112具有四角锥的形状。其中,针部的形状并不限定于这些。图5是图3及图4所示的微针110的剖视图。在图5中,h表示针部112的高度,w表示基底部的直径(宽度),t表示片材部116的高度(厚度)。本发明的微针阵列相较于图2c的微针110的形状,更优选设为图5的微针110的形状。通过采用这种结构,整个针部的体积变大,在制造微针阵列时,能够将更多的药物集中到针部的上端。图6及图7进一步示出具有另一种形状的微针110。图6所示的针部第1层112a具有圆锥状的形状,针部第2层112b具有圆柱状的形状。图7所示的针部第1层112a具有四角锥状的形状,针部第2层112b具有四棱柱状的形状。其中,针部的形状并不限定于这些形状。图8是图6及图7所示的微针110的剖视图。在图8中,h表示针部112的高度,w表示基底部的直径(宽度),t表示片材部116的高度(厚度)。图9是针部112的侧面的倾斜度(角度)连续改变的另一种形状的微针的剖视图。在图9中,h表示针部112的高度,t表示片材部116的高度(厚度)。在本发明的微针阵列中,针部优选针对横列以每1mm约0.1~10根的间隔配置。微针阵列优选每1cm2具有1~10000根微针。通过将微针的密度设为1根/cm2以上,能够有效地刺穿皮肤,并且通过将微针的密度设为10000根/cm2以下,微针阵列能够充分穿刺。针部的密度优选为10~5000根/cm2,进一步优选为25~1000根/cm2,尤其优选为25~400根/cm2。本发明的微针阵列能够以与干燥剂一同密封保存的形态供给。作为干燥剂,能够使用公知的干燥剂(例如,硅胶、生石灰、氯化钙、氧化硅、氧化铝、片状干燥剂等)。[微针阵列的制造方法]本发明的微针阵列例如能够根据日本特开2013-153866号公报或国际公开wo2014/077242号公报中记载的方法并通过以下方法来制造。(模具的制作)图10a至10c是模具(mold)制作的工序图。如图10a所示,首先制作用于制作模具的原版。该原版11的制作方法有2种。第1个方法是在si基板上涂布光致抗蚀剂之后进行曝光、显影。而且,通过进行基于rie(反应离子蚀刻)等的蚀刻,在原版11的表面制作圆锥的形状部(凸部)12的阵列。另外,为在原版11的表面形成圆锥的形状部而进行rie等的蚀刻时,通过一边使si基板旋转一边从倾斜方向进行蚀刻,能够形成圆锥的形状。第2个方法有如下方法:通过在ni等金属基板上使用金刚石钻头等的切削工具进行加工,能够在原版11的表面形成四角锤等形状部12的阵列。接着,进行模具的制作。具体而言,如图10b所示,由原版11制作模具13。作为方法可考虑以下4种方法。第1个方法为将在pdms(聚二甲基硅氧烷,例如,dowcorningcorp.制造的sylgard184(注册商标))中添加了固化剂的硅树脂注入到原版11,在100℃下进行加热处理并固化之后从原版11剥离的方法。第2个方法为将通过照射紫外线而固化的uv(ultraviolet,紫外线辐射)固化树脂注入到原版11,在氮气气氛中照射紫外线后,从原版11剥离的方法。第3个方法为将使聚苯乙烯和pmma(聚甲基丙烯酸甲酯)等塑料树脂溶解于有机溶剂中的溶液注入到涂布有剥离剂的原版11,通过干燥使有机溶剂挥发固化后,从原版11剥离的方法。第4个方法为通过ni电铸制作反转品的方法。由此,制作作为原版11的圆锥形或角锥性的倒置形状的针状凹部15以二维排列而排列的模具13。将这样制作的模具13示于图10c。图11是表示另一优选模具13的形态的图。针状凹部15具备从模具13的表面沿深度方向变窄的锥形的入口部15a及沿深度方向逐渐变细的尖端凹部15b。通过将入口部15a设为锥形形状,容易将水溶性高分子溶解液填充到针状凹部15。图12是表示制造微针阵列的更优选的模具复合体18的形态的图。图12中,(a)部表示模具复合体18。图12中,(b)部是(a)部中用圆包围的部分的放大图。如图12的(a)部所示,模具复合体18具备在针状凹部15的前端(底)形成有排气孔15c的模具13及贴合于模具13的背面并且由供气体透过但液体不会透过的材料形成的气体透过片19。排气孔15c作为贯穿模具13的背面的贯穿孔而形成。在此,模具13的背面是指形成有排气孔15c的一侧的面。由此,针状凹部15的前端经由排气孔15c及气体透过片19与大气连通。通过使用这种模具复合体18,填充于针状凹部15的高分子溶解液不会透过,能够从针状凹部15只排出存在于针状凹部15中的空气。由此,将针状凹部15的形状转印到高分子的转印性变得良好,能够形成更尖锐的针部。作为排气孔15c的直径d(diameter),优选1~50μm的范围。排气孔15c的直径d小于1μm时,无法充分地发挥作为排气孔的作用。并且,当排气孔15c的直径d超过50μm时,所形成的微针的尖端部的锐度受损。作为由气体透过但液体不会透过的材料形成的气体透过片19,例如,能够适用透气性薄膜(sumitomoelectricindustries,ltd.制造,poreflon(注册商标),fp-010)。作为用于模具13的材料,能够使用弹性材料或金属制材料,优选弹性材料,进一步优选透气性高的材料。代表透气性的透氧性优选为1×10-12(ml/s·m2·pa)以上,进一步优选为1×10-10(ml/s·m2·pa)以上。另外,1ml为10-6m3。通过将透气性设为上述范围,能够从模具侧排出存在于模具13的凹部中的空气,并能够制造缺陷少的微针阵列。作为这种材料,具体而言,能够列举将硅树脂(例如,dowcorningcorp.制造的sylgard184(注册商标),shin-etsuchemicalco.,ltd.的ke-1310st(编号))、紫外线固化树脂、塑料树脂(例如,聚苯乙烯、pmma(聚甲基丙烯酸甲酯))熔融或溶解在溶剂中的树脂。其中,硅橡胶系的材料对基于反复加压的转印有耐久性,并且与材料的剥离性良好,因此优选。并且,作为金属制材料,能够列举ni、cu、cr、mo、w、ir、tr、fe、co、mgo、ti、zr、hf、v、nb、ta、α-氧化铝,氧化锆、不锈钢(例如,bohler-uddeholmcorporation(bohler-uddeholmkk)的stavax材(stavax)(商标))等和其合金。作为框14的材质,能够使用与模具13的材质相同的材质。(水溶性高分子溶解液)在本发明中,优选准备用于形成针部的至少一部分的含有药物的水溶性高分子溶解液及用于形成片材部的水溶性高分子溶解液。水溶性高分子的种类如本说明书中所述。上述任一水溶性高分子溶解液中可混合二糖类,二糖类的种类如本说明书中所述。水溶性高分子溶解液中的水溶性高分子的浓度根据所使用的水溶性高分子的种类而不同,通常优选为1~50质量%。并且,用于溶解的溶剂只要具有挥发性,则可以是除温水以外的任何溶剂,能够使用甲乙酮(mek)、醇等。(针部的形成)如图13a所示,具有二维排列的针状凹部15的模具13配置于基座20上。模具13中形成有5×5的二维排列的2组多个针状凹部15。准备供液装置36,该供液装置具有收容含有药物的水溶性高分子溶解液22的罐30、连接于罐的配管32及连接于配管32的前端的喷嘴34。另外,在本例中,例示针状凹部15以5×5二维排列的情况,针状凹部15的个数并不限定于5×5,只要以m×n(m及n分别独立地表示1以上的任意整数,优选为2~30,更优选为3~25,进一步优选为3~20)二维排列即可。图14表示喷嘴的尖端部的概略立体图。如图14所示,喷嘴34的前端具备作为平坦面的唇部34a及狭缝形状的开口部34b。通过狭缝形状的开口部34b,例如能够将含有药物的水溶性高分子溶解液22同时填充到构成1列的多个针状凹部15。开口部34b的大小(长度和宽度)根据一次要填充的针状凹部15的数量来适当地选择。通过增加开口部34b的长度,能够一次将含有药物的高分子溶解液22填充到更多的针状凹部15。由此,能够提高生产率。作为用于喷嘴34的材料,能够使用弹性材料或金属制材料。例如,可列举特氟龙(注册商标)、不锈钢(sus(steelspecialusestainless))、钛等。如图13b所示,喷嘴34的开口部34b被调位在针状凹部15上。喷嘴34的唇部34a与模具13的表面接触。从供液装置36向模具13供给含有药物的水溶性高分子溶解液22,并从喷嘴34的开口部34b向针状凹部15填充含有药物的水溶性高分子溶解液22。在本实施方式中,向构成1列的多个针状凹部15同时填充含有药物的高分子溶解液22。但并不限定于此,能够逐一填充到针状凹部15中。模具13由具有透气性的材料构成时,通过从模具13的背面抽吸而能够抽吸含有药物的溶解液22,能够促进向针状凹部15内填充含有药物的高分子溶解液22。参考图13b,继填充工序之后,如图13c所示,一边使喷嘴34的唇部34a与模具13的表面接触,一边使供液装置36沿与开口部34b的长度方向垂直的方向相对移动,并将喷嘴34移动到未填充有含有药物的水溶性高分子溶解液22的针状凹部15。喷嘴34的开口部34b被调位在针状凹部15上。在本实施方式中,说明了移动喷嘴34的例子,但也可移动模具13。通过使喷嘴34的唇部34a与模具13的表面接触而移动,因此喷嘴34能够刮除残留在模具13的针状凹部15以外的表面上的含有药物的水溶性高分子溶解液22。能够防止含有药物的高分子溶解液22残留于模具13的针状凹部15以外。为了减少对模具13的损坏并且尽可能地抑制由于模具13的压缩而引起的变形,移动时喷嘴34对模具13的按压压力优选尽可能较小。并且,为了防止含有药物的高分子溶解液22残留在模具13的针状凹部15以外,优选模具13或喷嘴34中的至少一个为柔性的弹性变形材料。通过反复图13b的填充工序和图13c的移动工序,在5×5二维排列的针状凹部15中填充含有药物的水溶性高分子溶解液22。若在5×5二维排列的针状凹部15中填充含有药物的水溶性高分子溶解液22,使供液装置36移动到相邻的5×5二维排列的针状凹部15,并反复图13b的填充工序和图13c的移动工序。在相邻的5×5二维排列的针状凹部15中也填充有含有药物的水溶性高分子溶解液22。针对上述填充工序和移动工序,可以是(1)一边使喷嘴34移动一边将含有药物的水溶性高分子溶解液22填充到针状凹部15的形态,也可以是(2)在喷嘴34移动期间,使喷嘴34暂时静止在针状凹部15上并填充含有药物的高分子溶解液22,填充后使喷嘴34再次移动的形态。在填充工序与移动工序之间,喷嘴34的唇部34a与模具13的表面接触。图15是将含有药物的水溶性高分子溶解液22填充到针状凹部15时的喷嘴34的前端与模具13的局部放大图。如图15所示,通过向喷嘴34内施加加压力p1,能够促进向针状凹部15内填充含有药物的水溶性高分子溶解液22。另外,向针状凹部15内填充含有药物的水溶性高分子溶解液22时,优选将使喷嘴34与模具13的表面接触的按压力p2设为喷嘴34内的加压力p1以上。通过设为按压力p2≥加压力p1,能够抑制含有药物的水溶性高分子溶解液22从针状凹部15泄漏到模具13的表面。图16是喷嘴34移动时的喷嘴34的前端与模具13的局部放大图。在使喷嘴34相对于模具13相对移动时,优选将使喷嘴34与模具13的表面接触的按压力p3设为小于使填充时的喷嘴34与模具13的表面接触的按压力p2。这是为了减小对模具13的损坏,并抑制由于模具13的压缩而引起的变形。若向由5×5构成的多个针状凹部15的填充结束,则喷嘴34向相邻的由5×5构成的多个针状凹部15移动。关于液体供给,向相邻的由5×5构成的多个针状凹部15移动时,优选停止供给含有药物的水溶性高分子溶解液22。从第5列的针状凹部15到下一个第1列的针状凹部15是有距离的。喷嘴34在其之间移动期间,若继续供给含有药物的水溶性高分子溶解液22,则有时喷嘴34内的液压变得过高。其结果,含有药物的高分子溶解液22从喷嘴34向模具13的针状凹部15以外流出,为了抑制这种情况,优选检测喷嘴34内的液压,当判定为液压过高时,停止供给含有药物的高分子溶解液22。另外,在上述中说明了使用具有喷嘴的分配器供给含有药物的高分子溶解液的方法,但除了基于分配器的涂布以外,也能够应用基于棒涂、旋涂、喷涂等的涂布等。在本发明中,优选将含有药物的水溶性高分子溶解液供给到针状凹部之后,实施干燥处理。优选能够通过以下工序来制造本发明微针阵列,即通过对填充有含有药物的第一水溶性高分子溶解液的针部形成用模具进行干燥来形成一部分针部的工序;及将第二水溶性高分子溶解液填充到上述中所形成的一部分针部的上表面并将其干燥的工序。作为对填充有含有药物的第一水溶性高分子溶解液的针部形成用模具进行干燥时的条件,优选为从干燥开始30分钟后经过300分钟之后,第一水溶性高分子溶解液的含水率达到20%以下的条件。通过在上述条件下进行干燥,有助于实现“水溶性高分子和药物以式1的质量比率存在于针部尖端区域”这样的结构。尤其优选,控制上述干燥,以使温度保持在药物不会失效的温度以下,并且开始干燥后经过60分钟以上,水溶性高分子溶解液的含水率达到20%以下。作为上述干燥速度的控制方法,能够采用温度、湿度、干燥风量、容器的使用、容器的容积和/或形状等、能够延迟干燥的任意方式。干燥优选能够将填充有含有药物的第一水溶性高分子溶解液的针部形成用模具在覆盖容器的状态或收容于容器的状态下进行。干燥时的温度优选为1~45℃,更优选为1~40℃。干燥时的相对湿度优选为10~95%,更优选为20~95%,更优选为30~95%。(片材部的形成)针对形成片材部的工序,说明几个方式。针对形成片材部的工序,参考图17a至17d对第1方式进行说明。从喷嘴34向模具13的针状凹部15填充含有药物的水溶性高分子溶解液22。接着,如图17b所示,通过使含有药物的高分子溶解液22干燥固化而在针状凹部15内形成含有药物的层120。接着,如图17c所示,通过分配器将水溶性高分子溶解液24涂布于形成有含有药物的层120的模具13中。除了基于分配器的涂布以外,还能够应用基于棒涂、旋涂、喷涂等的涂布等。含有药物的层120已被固化,因此能够抑制药物扩散到水溶性高分子溶解液24中。接着,如图17d所示,通过使水溶性高分子溶解液24干燥固化而形成由多个针部112、截头锥体部113及片材部116构成的微针阵列1。在第1方式中,为了促进含有药物的水溶性高分子溶解液22及水溶性高分子溶解液24向针状凹部15内的填充,还优选从模具13的表面进行加压及从模具13的背面进行减压抽吸。接着,参考图18a至18d对第2方式进行说明。如图18a所示,从喷嘴34向模具13的针状凹部15填充含有药物的高分子溶解液22。接着,以与图17b同样地,通过使含有药物的水溶性高分子溶解液22干燥固化而在针状凹部15内形成含有药物的层120。接着,如图18b所示,在另一支撑体29上涂布水溶性高分子溶解液24。支撑体29并没有限定,例如能够使用聚乙烯、聚对苯二甲酸乙二醇酯、聚碳酸酯、聚丙烯、丙烯酸树脂、三乙酰纤维素、玻璃等。接着,如图18c所示,使形成于支撑体29上的水溶性高分子溶解液24与在针状凹部15形成有含有药物的层120的模具13重叠。由此,将水溶性高分子溶解液24填充到针状凹部15的内部。由于含有药物的层已被固化,所以能够抑制药物扩散到水溶性高分子溶解液24中。接着,通过使水溶性高分子溶解液24干燥固化来形成由多个针部112、截头锥体部113及片材部116构成的微针阵列1。在第2方式中,为了促进水溶性高分子溶解液24向针状凹部15内的填充,还优选从模具13的表面进行加压及从模具13的背面进行减压抽吸。作为使水溶性高分子溶解液24干燥的方法,只要是使高分子溶解液中的溶剂挥发的工序即可。该方法并没有特别限定,例如使用加热、送风、减压等方法。干燥处理能够在1~50℃且1~72小时的条件下进行。在送风的情况下,可列举吹送0.1~10m/秒的暖风的方法。干燥温度优选为不会使含有药物的高分子溶解液22内的药物热劣化的温度。(剥离)将微针阵列从模具13剥离的方法没有特别限定。剥离时优选针状凸部不会弯曲或折断。具体而言,如图19所示,使形成有粘附性的粘附层的片状的基材40附着于微针阵列上后,进行剥离以使从端部翻转基材40的剥离。然而,在该方法中,针状凸部有可能弯曲。因此,如图20所示,能够应用在微针阵列上的基材40设置吸盘(未图示),利用空气抽吸的同时垂直拉起的方法。另外,作为基材40可使用支撑体29。图21示出从模具13剥离的微针阵列2。微针阵列2由基材40、形成于基材40上的针部112、截头锥体部113及片材部116构成。针部112至少在尖端具有圆锥形状或多角锥形状,但针部112并不限定于该形状。以下列举本发明的实施例而进一步具体地说明本发明。另外,以下实施例所示的材料、使用量、比例、处理内容、处理步骤等只要不脱离本发明的宗旨,则能够适当改变。因此,本发明的范围不应该由以下所示的具体例来限制性地解释。作为本发明的微针阵列的制造方法并没有特别限定,优选通过包括如下工序的制造方法获得:(1)模具的制造工序、(2)制备药物及水溶性高分子的工序、(3)将在(2)中获得的液体填充到模具中而形成针部的上端部的工序、(4)将水溶性高分子填充到模具中而形成针部的下端部及片材部的工序、及(5)从模具中剥离的工序。实施例包封人体生长激素(hgh)的微针阵列的制作(模具的制造)在一边为40mm的平滑的ni板的表面上,将如图22所示的底面为500μm的直径d1且150μm的高度h1的圆锥台50上形成有300μm直径d2且500μm的高度h2的圆锥52的针状结构的形状部12以1000μm的间距l1二维正方排列100根针而研磨加工成四边形状,由此制造了原版11。在该原版11上使用硅橡胶(dowcorningtorayco.,ltd.制造的silasticmdx4-4210)以0.6mm的厚度形成膜,在原版11的圆锥尖端部从膜面突出50μm的状态下使其热固化,进行了剥离。由此,制作了具有约30μm的直径的贯穿孔的硅橡胶的反转品。将该硅橡胶反转品的、中央部形成有10列×10行的二维排列的针状凹部的、一边为30mm的平面部以外切掉后用作模具。将针状凹部的开口部宽的一侧作为模具的表面,将具有30μm的直径的贯穿孔(排气孔)的面作为模具的背面。(含有人体生长激素(hgh)的水溶性高分子溶解液的制备)通过离心超滤法浓缩人体生长激素(pfizer公司,genotropin(注册商标))之后,制备与羟乙基淀粉(hes)(freseniuskabi)、蔗糖(suc)(japanesepharmacopoeiagrade,wakopurechemicalindustries,ltd.)混合而成的水溶液,作为含有药物的水溶性高分子溶解液。关于各溶解液,如下述表所记载。[表1]hghhessuc比较例150.00mg/ml50.00mg/ml0.00mg/ml比较例250.00mg/ml50.00mg/ml0.00mg/ml比较例350.00mg/ml0.00mg/ml0.00mg/ml比较例450.00mg/ml25.00mg/ml0.00mg/ml比较例550.00mg/ml100.00mg/ml100.00mg/ml实施例150.00mg/ml45.00mg/ml0.00mg/ml实施例250.00mg/ml2.50mg/ml0.00mg/ml实施例350.00mg/ml25.00mg/ml0.00mg/ml实施例450.00mg/ml25.00mg/ml12.50mg/ml实施例515.00mg/ml7.50mg/ml67.50mg/ml实施例615.00mg/ml7.50mg/ml75.00mg/ml(形成片材部的水溶性高分子溶解液的制备)在微针阵列成型时,将硫酸软骨素(maruhanichirocorporation制造)和二糖类(蔗糖)以任意的浓度比率溶解在水中以成为表2的组成,从而制备了形成片材部的水溶性高分子溶解液。(含有药物的高分子溶解液的填充及干燥)使用了图23所示的填充装置。填充装置具备:控制模具与喷嘴的相对位置坐标的x轴驱动部61及z轴驱动部62;能够安装喷嘴63的供液装置64(musashiengineering.inc.制造的超微量定量分配器smp-iii);将模具69进行固定的抽吸台65;测量模具表面形状的激光位移计66(panasoniccorporation制造的hl-c201a);测量喷嘴按压压力的负载传感器67(kyowaelectronicinstrumentsco.,ltd.制造的lcx-a-500n);及基于表面形状及按压压力的测量值的数据控制z轴的控制机构68。在水平的抽吸台上放置一边为15mm的透气性薄膜(sumitomoelectricindustries,ltd.制造,poreflon(注册商标),fp-010),在其上以表面朝上的方式设置了模具。从模具背面方向以表压90kpa的抽吸压力进行减压,将透气性薄膜和模具固定在真空台上。准备如图14所示的形状的sus制造(不锈钢)的喷嘴,在长度20mm、宽度2mm的唇部的中央形成了长度12mm、宽度0.2mm的狭缝状的开口部。将该喷嘴连接于供液装置。将3ml的含有药物的水溶性高分子溶解液装填在供液装置和喷嘴内部。调整喷嘴,使得开口部与由形成于模具的表面的多个针状凹部构成的第1列平行。将喷嘴在相对于第1列朝向与第2列相反的方向隔开2mm的间隔的位置以1.372×104pa(0.14kgf/cm2)的压力按压于模具。保持按压喷嘴的状态,控制z轴使得按压压力的变动在±0.490×104pa(0.05kgf/cm2),并且一边以0.5mm/秒在与开口部的长度方向垂直的方向上移动,一边利用供液装置以0.15μl/秒从开口部释放含有药物的溶解液20秒钟。通过二维排列的多个针状凹部的孔图案,在设置2mm间隔的位置停止喷嘴的移动,使喷嘴从模具脱离。将填充有含有药物的水溶性高分子溶解液的模具在温度23℃、相对湿度45%的环境下覆盖容器的状态下静置并进行了干燥。此时,含有药物的水溶性高分子溶解液慢慢干燥,经过60分钟以上之后,使含水率成为20%以下。(片材部的形成及干燥)作为形成片材部的支撑体使用如下支撑体,即在下述条件(使用气体:o2、气压:13pa、高频(rf)功率:100w、照射时间:3分钟、o2流量:sv250、目标真空度(ccg):2.0×10-4pa)下用除云剂(victorjvc公司)对聚对苯二甲酸乙二醇酯(pet)片材(175μm)进行亲水化等离子体处理。在实施了处理的pet上,在表面和背面以75μm的膜厚涂布水溶性高分子溶解液。另一方面,将填充有含有药物的高分子溶解液的模具抽吸固定到抽吸台上。将涂布有水溶性高分子溶解液的pet的表面侧与模具表面面对面地配置,进而将pet与模具之间的空隙、以及与pet的模具相反的一侧的空间减压2分钟。减压后,通过仅在与pet的模具相反的一侧的空间释放大气压,从而使涂布有水溶性高分子溶解液的pet与模具贴合。维持接触状态10分钟后,将pet与模具贴合成为一体的物质进行干燥。(剥离)通过仔细地从模具剥离已干燥固化的微针阵列,形成了包封人体生长激素的微针阵列。本微针由锤台部和针部构成,且为如下圆锥台结构:针部为高度:约460μm、基底部的宽度:约270μm且锤台部为高度约130μm、上底面直径约270μm、下底面直径约460μm,以片材部厚度约为205μm(其中聚对苯二甲酸乙二醇酯约175μm)针数100根、针间隔约为1mm正方配置。包封人体生长激素(hgh)的微针阵列的针部分布将制作的微针阵列的针部与锤台部的界面与片材部平行地切断,并将针部浸渍于缓冲液中并使其溶解。通过elisa(enzyme-linkedimmunosorbentassay:酶联免疫吸附试验)法测量溶解液中的hgh量,并通过高效液相色谱法测量hes量、suc量、硫酸软骨素(cs)量。接着,将包括针部尖端的区域、即具有相当于整个针部高度的20%长度的高度的针部尖端区域与片材部平行地切断,使切断后的针部尖端区域溶解于buffer液中。通过elisa(enzyme-linkedimmunosorbentassay:酶联免疫吸附试验)法测量溶解液中的hgh量,并通过高效液相色谱法分别测量hes量、suc量、cs量。由此,确认到获得了表2的微针阵列。包封人体生长激素(hgh)的微针阵列的穿刺性评价准备购买了切除的猪皮(yucatanmicropigskinset、sinclairbioresourcesllc),解冻后用剪刀去除脂肪而得的去脂切除猪皮。将制作的微针与干燥剂一同密封干燥3天以上之后,在25℃、相对湿度60%的环境下开封,开封后在5分钟以内刺穿去脂切除猪皮。此时计数能够穿刺的针的数量,将以以下基准进行了评价的结果示于表2。微针阵列的所有针的80%以上的针被刺穿的情况:a微针阵列的所有针的60%以上且小于80%的针被刺穿的情况:b小于微针阵列的所有针的60%的针被刺穿的情况:c包封人体生长激素(hgh)的微针阵列的溶解性评价将制作的微针阵列溶解于上述缓冲液中并通过elisa法进行了测量。将微针阵列中的经实测的hgh定量值相对于理论值的回收率作为溶解性的指标,将以以下基准进行了评价的结果示于表2。回收率为95%以上:a回收率为70%以上且小于95%:b回收率小于70%:c对迷你猪的基于微针阵列的血液动力学试验通过血液动力学试验评价了本例的效果。购买迷你猪(gottingenmini-pig、雄性、5周龄、约10kg),进行了hgh的投与试验。在麻醉下去除迷你猪的背面的毛之后,刺穿微针阵列10分钟。为了评价对皮下注射(s.c.)的相对生物利用度(ba),对相同条件的迷你猪,通过皮下注射投与了与成为对象的微针相同量的hgh。投与前和投与后,在5、15、20、30、45分钟、1、2、4、6小时后的各时刻,通过导管进行了各0.5ml的经时血液采样。从所采取的血液中回收血浆溶液,并通过elisa法测量血浆中的hgh量。将血液中的hgh量图表化而计算auc(血液中浓度-时间曲线下面积、areaunderthebloodconcentration-timecurve),计算对皮下注射的相对ba,将以以下基准进行了评价的结果示于。对皮下注射的相对ba为70%以上:a对皮下注射的相对ba小于70%:c[表2]包封流感疫苗(flu)的微针阵列的制作(模具的制造)以与包封人体生长激素(hgh)的微针阵列相同的方法制作。(含有流感疫苗的水溶性高分子溶解液的制备)通过离心超滤法浓缩季节性3种混合流感疫苗(denkaseikenco.,ltd.)(flu)之后,制备了将羟乙基淀粉(hes)(freseniuskabi)与蔗糖(suc)(japanesepharmacopoeiagrade,wakopurechemicalindustries,ltd.)混合而成的水溶液。关于各水溶液,为下述表所示。[表3]fluhessuc比较例66.66mg/ml6.66mg/ml0.00mg/ml比较例76.66mg/ml6.66mg/ml0.00mg/ml比较例86.66mg/ml0.00mg/ml0.00mg/ml比较例96.66mg/ml3.33mg/ml0.00mg/ml实施例76.66mg/ml5.99mg/ml0.00mg/ml实施例86.66mg/ml0.33mg/ml0.00mg/ml实施例96.66mg/ml3.33mg/ml0.00mg/ml实施例106.66mg/ml3.33mg/ml3.33mg/ml实施例116.66mg/ml3.33mg/ml29.97mg/ml实施例126.66mg/ml3.33mg/ml33.30mg/ml(形成片材部的水溶性高分子溶解液的制备)在微针阵列成型时,将硫酸软骨素(maruhanichirocorporation制造)和二糖类(蔗糖)以任意的浓度比率溶解在水中以成为表4的组成,从而制备了形成片材部的水溶性高分子溶解液。(含有药物的高分子溶解液的填充及干燥)以与包封人体生长激素(hgh)的微针阵列相同的方法制作。(片材部的形成及干燥)以与包封人体生长激素(hgh)的微针阵列相同的方法制作。(剥离)以与包封人体生长激素(hgh)的微针阵列相同的方法制作。包封流感疫苗(flu)的微针阵列的针部分布以与包封人体生长激素(hgh)的微针阵列相同的方法进行了评价。包封流感疫苗(flu)的微针阵列的穿刺性评价以与包封人体生长激素(hgh)的微针阵列相同的方法进行了评价。包封流感疫苗(flu)的微针阵列的溶解性评价以与包封人体生长激素(hgh)的微针阵列相同的方法进行了评价。基于包封流感疫苗(flu)的微针阵列的疫苗投与试验购买小鼠(balb/c(cleajapan,inc.)、雌性、7周龄),在驯化1周后,进行了流感疫苗的投与试验。在麻醉下去除小鼠背面的毛之后,在拉伸皮肤的状态下穿刺微针阵列。为了评价对皮下注射(s.c.)的抗体产生量,对相同条件的小鼠通过皮下注射投与了与成为对象的微针相同量的疫苗。小鼠血清中的抗体产生量的评价投药后,将饲养4周的小鼠在麻醉下剖腹,从后腔静脉采集血液。静置于室温下的血液经离心分离并收集上清液而获得了血清。通过以下方法测量了对所获得的血清中所含的流感特异的抗体(igg:免疫球蛋白g)的量。(igg抗体产生量的测量)在nuncimmunoplatemaxisorp(cbottom,96well)中分注投药后的3种混合疫苗50μl/well,通过密封而在4℃下静置过夜。静置后,用pbst(gibco磷酸盐缓冲生理盐水(pbs)+0.1%tween(注册商标))清洗了4次。之后,滴加封闭液(50mm三羟基甲基氨基甲烷(tris)(ph8.0),1%牛血清白蛋白(bsa))200μl/well,在室温下静置了30分钟。静置后,用pbst(gibcopbs+0.1%tween(注册商标))清洗了4次。清洗后,滴加用稀释液(50mmtris(ph8.0),1%bsa,0.1%tween)稀释成约10,000倍的样品100μl/well,在室温下静置了1小时。静置后,同样用pbst(gibcopbs+0.1%tween)清洗了4次。接着,滴加用稀释液(50mmtris(ph8.0),1%bsa,0.1%tween)稀释而得的辣根过氧化物酶(hrp)标记抗mouseigg抗体(500倍)100μl/well,在室温下静置了1小时。静置后,同样用pbst(gibcopbs+0.1%tween)清洗了4次。另外,作为基质反应,滴加3,3’,5,5’-四甲基联苯胺(tmb)100μl/well,并在遮光下在室温下静置了15分钟。之后,滴加了终止溶液(1mol/lhcl)100μl/well。滴加后,通过测量λ=450nm的吸光度(参考620nm),根据以下基准通过吸光度的大小对igg抗体产生量进行了相对评价,将其结果示于表4。相对于皮下注射的igg抗体产生量,igg抗体产生量为90%以上:a相对于皮下注射的igg抗体产生量,igg抗体产生量为70%以上且小于90%:b相对于皮下注射的igg抗体产生量,igg抗体产生量小于70%:c[表4]由上述结果可知,在实施例的各微针阵列的组成中,相较于比较例的各组药效优异。尤其,若如实施例4、5、10、11那样添加二糖类,则针的溶解性出乎意料地提高,能够更有利地从微针阵列的针中释放药物。但是,如实施例6、12那样,若二糖类的添加比率过大,则基于湿度的吸湿的影响增加且尖端部逐渐变软,穿刺性稍微降低。并且,在本实施例中,将蔗糖列举为二糖类,但麦芽糖、海藻糖也能够期待相同的效果。在比较例1、4、6、9中,由于针部的水溶性高分子少,因此无法保持整个针的强度,成为软针。并且,在比较例2、7中,由于尖端部的水溶性高分子的比率接近药物浓度,因此变成相分离,尖端部变脆。另一方面,在比较例3、8中,由于基材中不包含水溶性高分子,因此药物过度凝缩,导致溶解性显著降低。另外,如比较例5那样,针尖端部的水溶性高分子过多时,显示药效所需的足够量的药物无法只集中在针的尖端部分,在投药时向血液中的转移量减少。这样,为了获得足够的药效,在整个针部及尖端部处保持柔软的强度,通过在穿刺后针无法充分溶解在皮肤中,能够释放药物的本发明的组成的微针阵列是最佳的。符号说明1微针阵列2微针阵列110微针112针部113截头锥体部116片材部120含有药物的层122不含药物的层w直径(宽度)h高度t高度(厚度)11原版12形状部13模具15针状凹部d直径(diameter)18模具复合体19气体透过片20基座22含有药物的水溶性高分子溶解液24水溶性高分子溶解液29支撑体30罐32配管34喷嘴34a唇部34b开口部36供液装置p1加压力p2按压力p3按压力40基材50圆锥台52圆锥d1直径d2直径l1间距h1高度h2高度61x轴驱动部62z轴驱动部63喷嘴64供液装置65抽吸台66激光位移计67负载传感器68控制机构69模具当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1