用于食欲控制和体重管理的方法和组合物与流程
本发明一般涉及用于食欲控制和体重管理的组合物和方法,和用于治疗食欲紊乱和代谢紊乱病症的方法和组合物。具体地,本发明涉及使用调节deg/enac离子通道的表达或活性的药剂用于控制食欲和治疗病症例如肥胖的应用,以及鉴定可用于控制食欲和治疗病症例如肥胖的潜在新药剂的方法,所述方法包括对调节deg/enac离子通道活性的化合物进行测定。
背景技术:
肥胖/超重
近十年来,超重和/或肥胖群体一直在全球稳步增加,尤其是在美国(chaudhri,etal.,2005,drugdiscoverytoday:diseasemechanisms2:289-294;mokdad,etal.,2003,jama289:76-79;nguyenandel-serag,210,gastroenterolclinnortham39:1-7;wangandbeydoun,2007,epidemiolrev.29:6-28)。由此导致的结果是令人担忧的糖尿病增加、以及显著影响生活质量和发病率的其它相关健康风险的增加。毫不奇怪,这些后续的健康风险将带来显著的健康和社会负担(kopelman,2000,nature404:635-643;must,etal.,1999,jama282:1523-1529;wang,etal.,2008,obesity16:2323-2330)。
肥胖在中国也已经成为一种常见疾病。肥胖的病因是多方面的,包括遗传因素和各种环境影响,例如,久坐不动的生活方式、和现代社会中随处可得的高热量食物(bleich,etal.,2008,annurevpublichealth29:273-295;rossner,2002,intjobesrelatmetabdisord26(suppl4):s2-4)。然而,造成肥胖的确切机制仍不甚明了。
目前,有5种抗肥胖药物被fda批准,包括xenical(一种胰脂肪酶抑制剂)、qsymia,belviq,和contrave(通过作用于中枢神经系统来抑制食欲的药物)、和saxenda(作用于葡萄糖代谢的药物)。这些药物的功效有限(52周体重减少仅3-9%),并且会引起严重副作用,包括急性肾损伤、肝损伤、头痛等。这些药物的退出率高达50%,主要原因是不可耐受的副作用。
对于抗肥胖药物的全球需求,已经导致在抵制进行性的体重增加的药物和食品方面的研发。涉及多种不同作用机制的药物已经被提出用于体重控制,包括可以增加胃肠道蠕动的药物、和可以通过调节胃肠道的机械感觉(mechanosensation)来控制食欲或饱腹感的药物。
deg/enac离子通道
退化蛋白/上皮钠通道(degenerin/epithelialsodiumchannel,缩写deg/enac)基因家族编码参与后生动物的多种细胞功能的钠通道。该超家族包括上皮钠通道(enac)、酸敏感离子通道(asics)、pickpocket(ppk)基因(在双翅目(dipteraorder)昆虫,包括果蝇和蚊子中),参与感觉传导的退化蛋白亚基(在线虫,例如秀丽隐杆线虫(caenorhabditiselegans)中),以及肽门控hydrana+通道(hynac)(在水螅虫类中)(israelhanukogluandaaronhanukoglu,gene579(2016)95–132)。
在秀丽隐杆线虫、果蝇和小鼠中的之前研究已经证实,退化蛋白/上皮钠通道成员作为一组保守的机械感觉离子通道来发挥作用(o'haganetal.,2005,natureneuroscience8:43–50;hwangetal.,2007,currentbiology17:2105–2116;zhongetal.,2010,currentbiology20:429–434)。近来的研究(williamholds1,tianxu,elife2014;3:e04402)显示,在果蝇中,肠神经元通过专化的机械感觉离子通道,在进食调节方面发挥着主要作用。具体地,已经证实,在果蝇中ppk1离子通道存在于围裹肠道肌肉的后肠神经元上,并且证实,机械感觉离子通道ppk1基因的缺乏或药物抑制可以导致食物摄取增加。
哺乳动物deg/enac超家族成员明显区别于在非脊椎后生动物物种中的同源物,具有低的序列相似性。哺乳动物deg/enac家族包括两类,即,上皮钠通道(enacs)和酸敏感离子通道(asics)。enac在远端肾单位中、在远端结肠中对于na+的重吸收具有明确作用,并且在控制气道上皮上的液体膜方面也表现出明确作用。enac可以被临床上用作保钾利尿剂的药物阿米洛利(amiloride)和氨苯蝶啶(triamterene)所抑制。asics是存在于中枢和外周神经元中的h+活化通道,在这些位置的活化可以诱导神经元去极化。asics参与疼痛感知、恐惧表现、和缺血后的神经变性。然而然,在现有技术中没有deg/enac离子通道参与哺乳动物的食物摄取或食欲控制的教导。
本发明人期望克服现有技术中的至少一个缺陷、或提供有用的备选方案。更为具体地,本发明人致力于提供治疗替代物,该替代物可以通过调节deg/enacs的活性,用于在哺乳动物中调节食欲和控制体重、用于对抗超重/肥胖和与肥胖相关的病症。
发明概述
第一方面,本发明提供,通过在有需要的个体中施用deg/enac受体调节剂来调节食欲的方法,所述方法包括:向所述个体施用包含治疗有效量的所述调节剂和任选地可药用载体的组合物,其中所述调节剂能够调节deg/enac受体的活性。
第二方面,本发明提供,在个体中治疗或预防食欲紊乱病症或代谢紊乱病症,如肥胖或超重、或肥胖相关病症的方法,所述方法包括:向所述个体施用包含治疗有效量的调节剂和任选地可药用载体的组合物,其中所述调节剂能够调节deg/enac受体的活性。
第三方面,本发明提供,用于鉴定调节食欲和/或控制体重的药剂的方法,所述方法包括步骤:提供测定试验,所述测定试验能够测定对deg/enac受体表达或活性的调节;向所述测定试验中引入疑似deg/enac调节剂的化合物;和确定是否发生deg/enac调节,其中调节deg/enac离子通道的表达或活性水平的化合物是用于调节食欲或控制体重的候选药剂。
第四方面,本发明提供,用于调节食欲或控制体重、或用于治疗食欲紊乱病症或代谢紊乱病症例如肥胖或超重或肥胖相关病症的药物组合物,所述药物组合物包含:deg/enac受体调节剂和可药用载体。
通过下面的发明详述,本领域技术人员将充分理解本发明及其优点。应当明了,本发明的各个方面仅是对实施和使用本发明的具体方式的举例说明,而非对本发明范围的限制。
附图简述
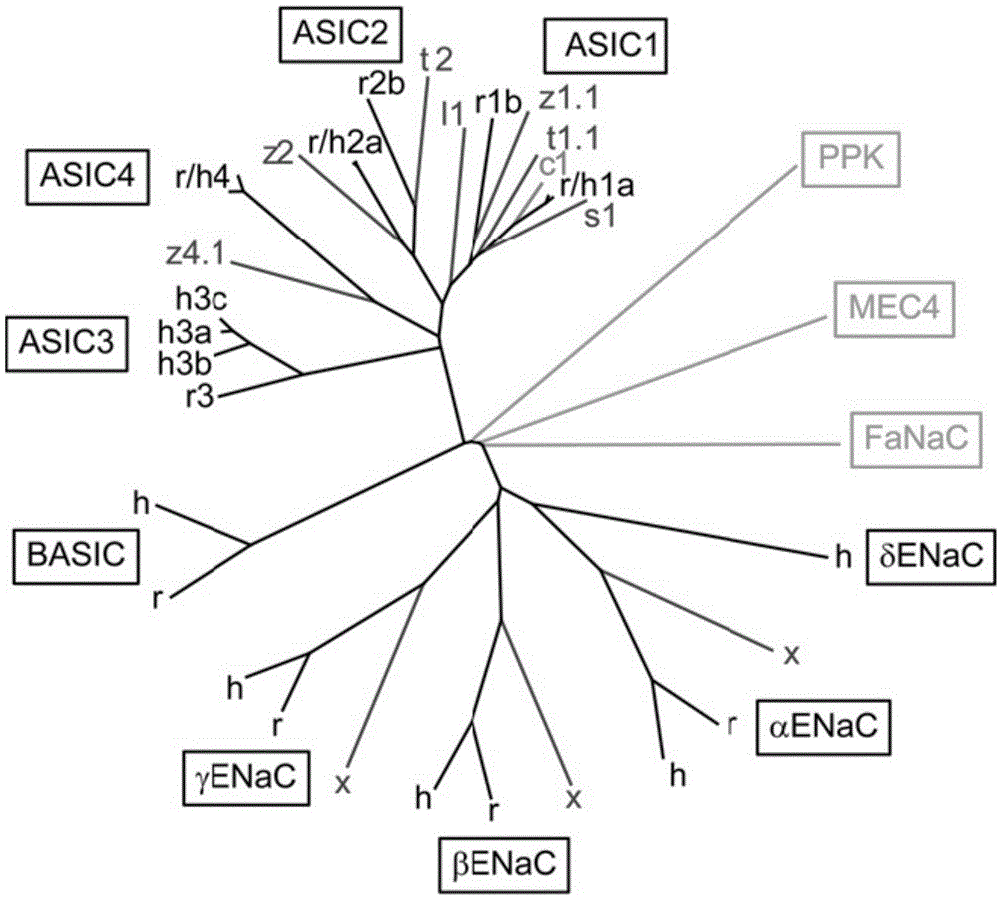
图1显示退化蛋白(deg)/上皮钠通道(enac)的系统发生树。enac、asics、和代表其它deg/enac亚家族的成员,果蝇的pickpocket(ppk),秀丽隐杆线虫的degmec4,和h.aspersa的肽门控fanac,的蛋白质序列,使用clustalw比对法进行比对。此外,也显示了胆汁酸敏感离子通道basic(也称作asic5,hinac或blinac)。物种以单字母表示,其中c,鸡;h,人;l,七鳃鳗;r,大鼠;s,鲨鱼;t,豹蟾鱼;x,非洲蟾蜍;z,斑马鱼。(引自:stephankellenbergerandlaurentschild,pharmacolrev67:1–35,2015年1月)。
图2显示,果蝇后肠神经元(pen)中的ppk1离子通道对食物摄取的调节。(a)后肠(红色,鬼笔环肽,肌肉)的外部和内部视图,其中显示后肠神经元投射(绿色,22c10)。(b)ppk1在投射到后肠(hindgutpylorus)的pen中的表达(ppk1-gal4;uas-mcd8::gfp)。(c)ppk1缺陷(纯合子)和野生型(杂合子)动物的食物摄取结果(n=4-7个重复)。(d)在野生型中使用benzamil抑制ppk1时的食物摄取结果(n=8-10个重复)。*=p<0.05,与相应的dmso对照相比。
图3显示小鼠胃肠道中deg/enac离子通道的表达。使用从小鼠的胃、空肠和结肠中提取的rna进行pcr反应。评估deg/enac基因(αenac,βenac,asic1,asic2,asic3,asic5)和gadph基因(作为对照)的表达。
图4显示阿米洛利和benzamil的结构。benzamil是一种更有效和特异的enacs拮抗剂。
图5显示阿米洛利对小鼠的短期食物消耗的影响。(a)雌性c57bl6小鼠(13周龄)经口管饲给药1,10或100μmole/kg阿米洛利(每个浓度n=3);(b)雄性c57bl6小鼠(13周龄)通过腹膜内(i.p.)注射给药1,10或100μmole/kg阿米洛利(每个浓度n=3)。在从晚6点(6pm)进行夜间喂食前15分钟给药。在指定的时间监测食物摄入。结果表示为平均值±标准误。*=p<0.05,**=p<0.01,与相应的溶媒对照相比。
图6显示阿米洛利在肥胖动物中诱导的体重减轻。通过经口管饲法,用阿米洛利(n=10)或作为对照的溶媒dmso(n=10),每周6次,持续5周,处理雌性肥胖模型leprpb小鼠。在第14,21,28和35天,称重小鼠。绘制与第14天相比的体重变化。结果表示为平均值±标准误。到第35天,与喂食dmso的小鼠相比,喂食阿米洛利的小鼠显示出明显的体重减轻(p<0.005)。
图7显示阿米洛利在肥胖动物中诱导的身体组成变化。小鼠随机分配接受阿米洛利(n=10)或dmso(n=10)。在5周给药之前和之后,使用brukerminispecmq10nmr分析仪,通过核磁共振(nmr)扫描小鼠,以确定脂肪重(fatmass),瘦组织重(leanmass)和游离体液(freefluid)。与用dmso喂养的小鼠相比,阿米洛利诱导了显著更多的脂肪/瘦组织比降低(p<0.05)和体脂百分比降低(p<0.02)。但是,在阿米洛利和dmso诱导的体液百分比降低上,没有观察到显著差异。
图8显示benzamil对小鼠的短期食物消耗的影响。雌性c57bl6小鼠(15周龄)从早上8点(8am)到下午6点(6pm)不喂给食物,然后经口管饲给药0.01,0.1,1或10μmole/kgbenzamil(每个浓度n=4)。在给药后15分钟给小鼠喂食正常食物,然后在所示时间,即,在开始喂食后15分钟,30分钟和2小时,监测食物摄入。结果表示为平均值±标准误。benzamil当在临喂食前给药时,导致了小鼠短期食物消耗的减少。
发明详述
本发明至少部分基于以下令人惊奇的发现:deg/enac离子通道在调节哺乳动物的食物摄入中起作用,并且抑制deg/enac离子通道可以控制食欲并由此引起哺乳动物体重减轻。
因此,一方面,本发明提供了通过施用deg/enac受体调节剂来调节或控制食欲的方法。在一个实施方案中,可以抑制食欲以诱导减少的食物摄入和/或体重减轻。在另一个实施方案中,可以刺激食欲以诱导食物摄入和/或体重的增加。在一个实施方案中,调节剂在进食之前或期间施用,优选在进食之前施用。在另一个实施方案中,调节剂在进食前5分钟至3小时施用,例如,在进食之前例如5-30分钟。在一些实施方案中,调节剂在个体中诱导脂肪减少。
另一方面,本发明提供了通过施用deg/enac受体调节剂治疗有需要的个体的食欲紊乱或代谢紊乱病症的方法。在一个实施方案中,个体患有食欲紊乱病症,例如暴食或厌食。在另一个实施方案中,个体患有或有风险罹患食欲或代谢紊乱病症(如肥胖和/或肥胖相关病症),或是所述病症的风险个体。在一个实施方案中,调节剂可通过抑制个体,优选患有肥胖和肥胖相关病症的个体的食欲来诱导体重减轻和/或脂肪减少。在一个实施方案中,调节剂可以在个体,优选进食欲望低的个体中,刺激食欲以诱导期望的体重增加。
另一方面,本发明提供筛选方法,所述方法基于药剂调节deg/enac受体的能力来鉴定可用于食欲调节和/或体重管理、或用于治疗食欲紊乱或代谢紊乱病症如肥胖和/或肥胖相关病症的新药剂。
在再一方面,本发明涉及包含deg/enac受体调节剂和可药用载体的药物组合物,该组织物可以用于调节食欲或控制体重、或用于治疗食欲紊乱病症、肥胖和/或肥胖相关病症。
定义:
本文中,冠词“一个”和“一种”是指一或多于一(即,至少一个或一种)的该冠词的语法对象。举例来说,“一个/一种deg/enac蛋白”是指一个/一种deg/enac蛋白或一个/一种以上的deg/enac蛋白。
如本文所用,词语“包括”,“包含”和“含有”应理解为包含性的而非排他性的。同样,术语“包括”应解释为包括性的,除非该解释在上下文被明确禁止。类似地,术语“示例”,特别是其后列出一系列例子时,仅仅是示例性和举例说明性的,而不应被视为排他性或完全的。
术语“约”为本领域普通技术人员所理解,并且在某种程度上可以根据其使用的上下文而变化。优选地,术语“约”旨在涵盖数值之上和之下≤20%,更优选≤10%的变化。
“超重”被定义为例如成年人具有在25和30之间的bmi。
“体重指数”或“bmi”是指体重(kg)除以身高(米)的平方得到的比值。
“肥胖”是这样一种病况,其中存储在动物(特别是人和其他哺乳动物)的脂肪组织中的天然能量储备增加到与某些健康状况或增加的死亡率相关的程度。“肥胖”定义为例如成年人具有大于30的bmi。
如本文所用,术语“治疗”定义为:将治疗剂,即,在本发明中有用的化合物,例如deg/enac受体调节剂,例如阿米洛利、其类似物或衍生物,单独或与其它物质例如药学上可接受的载体或助剂组合,应用或施用于个体;或将治疗剂应用或施用于经工程化的或来自个体的分离的组织或细胞(例如,用于诊断或离体应用),以旨在治愈,恢复健康,缓解,减缓,改变,纠正,改善,或影响所治疗的病症,例如食欲紊乱,超重/肥胖,或肥胖相关病症。
如本文所用,术语“患者”或“个体”是指人或非人动物。非人动物包括例如绵羊,牛,猪,犬,猫和鼠类哺乳动物。优选地,患者或个体是哺乳动物,更优选是人。
deg/enac离子通道
deg/enac超家族的哺乳动物成员包括上皮钠通道(enacs)和酸敏感离子通道(asic)。除非本文另有定义,否则本文使用的术语“deg/enac”意指哺乳动物deg/enac成员enacs和asic。
enacs是钠通道,参与盐稳态。enac家族由四个基因scnn1a,scnn1b,scnn1g和scnn1d组成,分别编码四个enac亚基之一,亚基α(人氨基酸序列数据库条目,对于同种型1,np_001029.1gi:4506815;对于同种型2,np_001153048.1gi:227430289;对于同种型3,np_001153047.1gi:227430287),亚基β(np_000327.2gi:124301196),亚基γ(np_001030.2gi:42476333)和亚基δ(np_001123885.2gi:315259090)。在小鼠基因组中未发现scnn1d的基因。
asic是质子门控的非选择性阳离子通道,其在哺乳动物中枢和外周神经系统的神经元中广泛表达。已发现asic家族包括不同的asic亚基:asic1,其具有同种型asic1a(人氨基酸序列数据库条目np_064423.2g1:21536351)和asic1b(np_001086.2g1:21536349)(也分别称为asicα或bnac2α和asicβ或bnac2β);asic2,其具有同种型asic2a(np_899233.1g1:34452695)和asic2b(npj301085.2g1:9998944)(也分别称为mdeg1,bnaciα或bnc1和mdeg2或bnaciβ);asic3(npjd04760.1gi:4757710)(也称为drasic或tnac);asic4(np_898843.1gi:33942102)(也称为spasic);和asic5(np_059115.1gi:74753059)(也称为blinac或hinac,或basic)。
enacs组装为由α(或δ),β和γ亚基组成的异源多聚体。功能性asic被认为可以由相同或不同的亚基组成(同源和异源多聚体)。鸡asic1的解析结构揭示为由三个相同亚基组成的同源三聚体。在drg神经元中,据报道天然asic是异源多聚体的。(israelhanukoglu和aaronhanukoglu,gene579(2016)95-132)
一方面,本发明的方法和组合物可用于调节deg/enac离子通道的活性。在一些实施方案中,deg/enac离子通道由属于哺乳动物deg/enac家族的至少一个亚基组成。在一些实施方案中,离子通道由选自αenac,βenac,γenac,δenac,asic1a,asic1b,asic2a,asic2b,asic3,asic4和asic5的三个亚基组成。在某些实施方案中,deg/enac离子通道是由enacα,β,γ和δ亚基组成的异源多聚体enac蛋白。在某些实施方案中,deg/enac离子通道是asic蛋白,其由选自asic1a,asic1b,asic2a,asic2b,asic3,asic4和asic5的三个亚基组成。
在另一个实施方案中,deg/enac离子通道是阿米洛利敏感的。enacs和asic形成阿米洛利敏感的离子通道。在一些实施方案中,本发明的方法包括调节enac受体和/或asic受体的活性,更优选调节个体哺乳动物胃肠道中的一种或多种deg/enac离子通道的活性。在另一个实施方案中,本发明的方法包括调节至少一种选自αenac,βenac,γenac,asic1,asic2,asic3,asic4和asic5的deg/enac蛋白的活性。
deg/enac调节剂
如本文所用,哺乳动物deg/enac家族成员的调节剂是调节(包括增加或减少)哺乳动物deg/enac家族的一个或多个成员的活性的药剂,所述成员是例如αenac,βenac,γenac,δenac,asic1a,asic1b,asic2a,asic2b,asic3,asic4和asic5。在一些实例中,调节剂(活化剂或抑制剂)可以改变(增加或减少)一种或多种成员的通道活性,例如改变成员使钠离子流通过细胞膜(进和/或出细胞)的能力。
调节剂可以是化合物(小于约10kda的小分子,肽,核酸,脂质等)、两种或更多种化合物的复合物、和/或混合物等。调节剂还包括天然存在的和合成的配体,拮抗剂,激动剂,肽,环肽,核酸,抗体,反义分子,sirna,核酶,有机小分子等。在一个实施方案中,调节剂与deg/enac受体相互作用。在另一个实施方案中,调节剂调节细胞(优选胃肠道细胞)中的deg/enac受体,优选enac受体和/或asic受体的表达水平。在另一个实施方案中,调节剂增强或降低deg/enac受体的转录或翻译。在另一个实施方案中,调节剂选自,例如,靶向编码deg/enac受体的基因的催化性和抑制性寡核苷酸分子、以及deg/enac受体转录或翻译的抑制剂,例如反义分子,sirna或核酶。
如本文所用,deg/enac离子通道的“活化剂”和“抑制剂”是指活化或抑制性分子。“抑制剂”是这样的化合物;其可以例如,部分地、基本上或完全地,阻断deg/enac蛋白的活性,减小、防止、延迟deg/enac蛋白的激活,使deg/enac蛋白失活、脱敏、或下调deg/enac蛋白的活性或表达,例如拮抗剂或阻断剂。“活化剂”是增加、打开、激活、促进、增强deg/enac蛋白的活化,敏化、激动或上调deg/enac蛋白的活性或表达的化合物,例如激动剂。
在一些实施方案中,deg/enac调节剂是能够抑制enac通道和asic通道两者的抑制剂,例如阿米洛利或阿米洛利类似物。在一些实施方案中,调节剂可以特异于enacs或asic。例如,化合物a-317567特异地抑制asic蛋白。在一些实施方案中,调节剂可以是针对一个deg/enac家族内的特异性。例如,如果抑制剂是asic家族内特异的抑制剂,则该asic抑制剂可以具有抑制一种或多种asic(例如,仅asic1a,或仅asic1a加上asic1b)的能力,但基本上排除对其他asic成员的抑制。例如,pctx1是靶向asic1a的特异性抑制剂。
deg/enac抑制剂
在一个实施方案中,本发明的deg/enac抑制剂与deg/enac离子通道相互作用,更优选与胃肠道中的一个或多个deg/enac离子通道相互作用。在进一步的实施方案中,抑制导致食欲和/或体重降低。
在一些实施方案中,本发明的抑制剂靶向上述阿米洛利敏感性deg/enac离子通道,并与阿米洛利竞争作为抑制剂。在一个优选的实施方案中,deg/enac抑制剂是阿米洛利或阿米洛利类似物,例如benzamil。在一个实施方案中,阿米洛利用于本发明的方法和组合物中。在一个实施方案中,benzamil用于本发明的方法和组合物中。
阿米洛利,3,5-二氨基-6-氯-n-(二氨基亚甲基)吡嗪-2-甲酰胺,是enacs和asic的非特异性阻断剂,对于enacαβγ的ic50值为约0.1μm,对于asic的ic50值为约10-100μm。
阿米洛利具有以下结构式:
阿米洛利可以是任何合适的非离子形式或离子形式(即,盐形式)。
本文所用的术语“阿米洛利类似物”是指阿米洛利的任何结构类似物,更具体地说,是与阿米洛利结构相关的化学化合物,并且在一个或多个位置通过取代而与阿米洛利不同。在一些实施方案中,阿米洛利类似物是具有以下结构式的化合物:
其中x是卤素,例如氟,氯或溴。在一些实施方案中,x是氯。氨基取代基r1至r8可以独立地选自h,具有1-12个碳的烷基,具有7-13个碳的芳烷基,芳基或杂芳基。如果取代基r1至r8中的一个或多个是烷基或芳烷基,则每个烷基或芳烷基取代基的烷基部分可以任选地和独立地进一步被选自以下的取代基取代一次或多次:卤素,羟基,具有1-6个碳的烷氧基,芳基,杂芳基,氨基,具有1-6个碳的烷基氨基,具有2-12个碳的二烷基氨基,羧酸,或者形式上衍生自羧酸和具有1-6个碳的醇的酯。如果取代基r1至r8中的一个或多个是芳基,芳烷基或杂芳基,则每个芳基,芳烷基或杂芳基取代基的芳族部分可以独立地进一步被选自以下的取代基取代一次或多次:卤素,具有1-6个碳的烷基,氨基,具有1-6个碳的烷基氨基,具有2-12个碳的二烷基氨基,羧酸,或形式上衍生自羧酸和具有1-6个碳的醇的酯。在一些实施方案中,取代基r1至r8中的每一个独立地选自h,具有1-6个碳的烷基和芳烷基,其中每个可以如上所述进一步被取代。
在一些实施方案中,阿米洛利类似物是具有以下结构式的化合物:
其中r1,r2,r7和r8独立地是h,具有1-6个碳的烷基、或具有7-13个碳的芳烷基。
在其他实施方案中,本发明的抑制剂包括阿米洛利类似物或其药学上可接受的盐。在一个相关的实施方案中,阿米洛利类似物选自benzamil,phenmil,5-(n-乙基-n-异丁基)-阿米洛利(eipa),bepridil,kb-r7943,5-(n-甲基-n-异丁基)阿米洛利,5-(n,n-六亚甲基)阿米洛利和5-(n,n-二甲基)阿米洛利盐酸盐。在另一个相关的实施方案中,阿米洛利类似物是benzamil。在另一个相关的实施方案中,阿米洛利类似物是benzamil的甲基化类似物。在另一个相关的实施方案中,阿米洛利类似物包含在胍基基团上形成的环。在另一个相关的实施方案中,阿米洛利类似物包含酰基胍基团。在另一个相关的实施方案中,阿米洛利类似物包含在胍基上形成的水增溶性基团,其中水增溶性基团是n,n-二甲基氨基或糖基。
在一些实施方案中,如上所述,本发明的抑制剂靶向阿米洛利敏感性deg/enac蛋白,并与阿米洛利竞争作为阻断剂。已知的阻断剂包括triamterene,phenamil,benzamil及其衍生物,特别是3',4'-二氯benzamil;2',4'-二甲基benzamil;5-(n-乙基-n-异丙基)阿米洛利;和5-(n-甲基-n-异丁基)阿米洛利。另外的阿米洛利类似物和衍生物包括以下文献中描述的化合物:thomasr.等,j.membranebiol.105,1-21(1988);wo2012035158;wo2009074575;wo2011028740;wo2009150137;wo2011079087;和wo2008135557,每一文献在此特别引入作为参考。
在一些实施方案中,个体是人,并且阿米洛利、阿米洛利类似物或其药学上可接受的盐在人中以0.01-3mg/kg体重/天的剂量施用。在一些实施方案中,个体是啮齿动物,例如小鼠,并且阿米洛利、阿米洛利类似物或其药学上可接受的盐以约0.1-40mg/kg/天,例如0.12-37mg/kg/天的剂量施用。
在一些实施方案中,enac抑制剂用于本发明的方法或组合物中。enac抑制剂可以是能够实质性降低(包括消除)至少一种enac蛋白的活性的任何药剂和/或组合物。已知的enac阻断剂的实例是triamterene,其特异性阻断γenac,并且是保钾利尿剂。enac阻断剂的其他实例包括p301,p365,p321,p552-02,p1037,gs-9411/p680,它们由parionsciences开发(https://clinicaltrials.gov;http://www.parion.com/pipeline/p-1037-pullmonary-disease/)。来自parionsciences/gilead的gs-9411/p680已经进入i期临床试验作为吸入制剂用于囊性纤维的治疗(o'riordantgetal.,journalofaerosolmedicineandpullmonarydrugdelivery2014,27(3):200-8)。当施用于眼睛时,p301和p365增加泪液体积(williamr.thelin,etal.,joculpharmacolther.2012aug;28(4):433–438);p321处于慢性干眼症的ii期临床试验中(http://www.parion.com/pipeline/p-321-dry-eye/)。enac阻断剂的另一个例子是novartis的nvp-qbe170。nvp-qbe170是二聚的阿米洛利衍生物,其在体外和体内均显示出有力和选择性的enac阻断。其效力类似于parionscience的p552-02,但在豚鼠tpd模型中测试时,就高钾血症而言,比现有enac阻断剂具有显著增加的安全窗口。p552-02和nvp-qbe170都是阿米洛利类似物(kjcoote,etal.,brjpharmacol.2015jun;172(11):2814-26.),它们的化学结构如下:
在一些实施方案中,asic抑制剂用于本发明的方法或组合物中。已知的asic阻断剂的实例包括阿米洛利,a-317567,a-317567类似物和芳族二脒类。
a-317567(casregis.#:371217-32-2,来自abbottlaboratories)是具有以下结构式的小分子非阿米洛利asic阻断剂。
该化合物具有外周活性,在大鼠drg神经元中(体外)可以引起asics电流,效力比阿米洛利的效力高1.8-15倍。已经在慢性炎性疼痛的cfa模型中测试了a-317567的镇痛作用。
scottd.kuduk等(acschemneurosci.2010jan20;1(1):19-24)报道了比a-317567具有更强效力的a-317567类似物,尤其是化合物‘10a’和‘10b’(约3倍):
芳香二脒类是合成的小分子,与dna的小沟结合。它们已被临床用于治疗原生动物或真菌感染疾病。几种抗原生动物二芳基脒类,4',6-二脒基-2-苯基吲哚(dapi),diminazene,hydroxystilbamidine(hsb)和pentamidine,在体外显示出有效的asic阻断活性。(chenx,etal.,neuropharmacology.2010jun;58(7):1045-53;xuanmaochen,etal.,eurjpharmacol.2010dec1;648(1-3):15-23)
另外,已知一些毒素肽是asic调节剂。asic靶向抑制性毒素的实例包括蜘蛛毒素psalmotoxin1(pctx1),海葵毒素apetx2和蛇毒素mambalgin-1-3。这些asic靶向抑制性毒素在小鼠体内注射时(pctx1,0.46mgi.t.或23mg/kg;mambalgins,2.2mgi.t.和i.c.v.或110mg/kg;apetx2,1.8mgintraplantar;0.9mg静脉注射;2.7mgi.t.或135mg/kg),不会引起兴奋性毒性,痉挛,抽搐,运动麻痹和共济失调(a.baronetal.toxicon75((2013)187–204)。
蜘蛛psalmopoeuscambridgei的pctx1以纳摩尔效力抑制同聚体asic1a和异聚体asic1a/2b。该肽具有序列
该毒素肽可以作为来自狼蛛物种的毒液的一部分在不经实质性纯化的情况下使用,或者可以从毒液中纯化,或者可以化学合成,或者可以由工程化生物生物合成,等。另外,pctx1衍生物可以根据本发明使用。pctx1衍生物是具有与pctx1在形式上相关的化学结构的肽,并通过一个或多个氨基酸取代、缺失和/或插入而不同于pctx1。pctx1衍生物描述于例如美国专利申请20080242588和wo/2015/026339中。
deg/enac活化剂
在一个实施方案中,本发明方法中使用的调节剂是deg/enac活化剂,其增强deg/enac受体的活性以引起食欲和/或体重的增加。在另一个实施方案中,deg/enac活化剂选自deg/enac刺激性小分子,肽及其模拟物。在另一个实施方案中,deg/enac活化剂选自化合物s3969,n,n,n-三甲基-2-((4-甲基-2-((4-甲基-1h-吲哚-3-基)硫代)戊酰基)氧基)碘化乙铵,和n-(2-羟乙基)-4-甲基-2-((4-甲基-1h-吲哚-3-基)硫代)戊酰胺(来自senomyxinc.),gmq,ap301及其任何类似物或衍生物,以及任何组合。
化合物s3969,[n-(2-羟乙基)-4-甲基-2-(4-甲基-1h-吲哚-3-基硫代))戊酰胺],是人enac的小分子活化剂。最近报道了化合物s3969在异源细胞表达系统中可逆地刺激人enac。该化合物作用于enac,增加通道开放率,表观亲和力(ec50)为1mm。参见,例如,stephankellenberger和laurentschild,internationalunionofbasicandclinicalpharmacology..xci.structure,function,andpharmacologyofacid-sensingionchannelsandtheepithelialna+channel,jclinpharmacol.2014march;54(3):341–350.doi:10.1002/jcph.203。
ap301是enac活化剂(stephankellenberger和laurentschild,同上引文)。它是由17个天然氨基酸组成的人tnf-α衍生肽(~2kd)。在异源表达系统中该环肽显示可以通过增加enac的开放率来激活enac。已经在多种急性肺损伤(ali)的小动物模型中证实,该tip肽的肺部给药可以实质性减轻各种病理生理状况的肺通透性水肿。在ap301存在下,大鼠,狗和猪aecii型细胞中阿米洛利敏感性na+流(通过enac)分别比基线条件增加约9倍,13倍和16倍。ap301目前正在进行吸入临床试验。
合成化合物2-胍-4-甲基喹唑啉(gmq)是asic的另一活化剂(stephankellenberger和laurentschild,同上引物):
化合物gmq诱导持续的asic3电流并诱发疼痛相关行为。
在小鼠爪中注射asic活化剂——德州珊瑚蛇毒的mit-toxin(mittx)会引起疼痛行为,而破坏asic1a可以导致疼痛的减小(bohlencj等,(2011),nature479:410–414)。
治疗
食欲存在于所有高等生命形式中,并且用于调节足够的能量摄入以维持代谢需要。异常的食欲可能导致营养不良或超重和代谢紊乱,如肥胖和相关问题。与肥胖有关的健康风险包括心脏病和中风;高血压和高胆固醇;糖尿病;癌症,例如结肠癌,乳腺癌(绝经后),子宫内膜(子宫内衬)癌,肾癌和食道癌;胆囊疾病和胆结石;骨关节炎;痛风;呼吸问题,例如睡眠呼吸暂停(人在睡眠时短暂停止呼吸)和哮喘。
本发明人通过证实可以在药理学上靶向deg/enac离子通道以诱导减少的食物摄入和体重减轻,提出了用于个体中控制食欲和体重的方法和组合物。本发明的方法和组合物避免了与目前的体重控制化合物(例如直接作用于大脑的抗肥胖药物)相关的副作用。
在一些实施方案中,所述方法和组合物可用于治疗食欲紊乱和相关疾病,代谢紊乱或病症,包括超重,肥胖和肥胖相关病症,例如2型糖尿病,高血压,心血管疾病和其组合。
在一些实施方案中,所述方法和组合物可以在个体中诱导食欲抑制。在一个实施方案中,个体具有过度食欲。在再一实施方案中,个体具有肥胖和/或超重。在再一实施方案中,个体患有肥胖相关病症。在再一实施方案中,个体将受益于由抑制deg/enac离子通道而导致的食物摄入减少,例如,以维持期望体重或实现期望的体重减轻和脂肪减少。
在一些实施方案中,所述方法和组合物可以在个体中诱导食欲刺激。在一个实施方案中,个体患有与诸如癌症等病症相关的食欲减退和/或体重减轻。在另一个实施方案中,个体将受益于由deg/enac离子通道活化而引起的食物摄入增加,例如,以实现期望的体重增加。
在一个实施方案中,个体可以是人或哺乳动物个体,其具有超重或肥胖、或肥胖相关病症、和/或具有出现肥胖或肥胖相关病症的显著可能性。合适的示例性动物包括任何动物,例如啮齿动物(小鼠,大鼠等),狗,猫,绵羊,山羊,非人灵长类动物等。可以为了动物自身的目的,例如,为了兽医用途(如宠物的治疗)而对动物进行治疗。或者,该动物可以提供动物模型,例如肥胖模型,以便于测试候选药物供人使用,例如确定候选药物的效力、有效性窗口、副作用等。
施用
如本文所用,关于药物或药物候选物和个体,术语“施用”或“给药”是指向个体施用或应用药物或药物候选物,使得药物或药物候选物可在个体上发挥其生物活性作用。因此,施用药物可包括通过任何合适的途径将药物递送至个体,包括例如注射,吞服,吸入,局部施用或其任何组合。注射可以是例如,皮下,皮内,静脉内,动脉内,鞘内,硬膜外,硬膜下,脑室内(即进入脑),眼内,腹膜内,滑膜内,或其任何组合。注射可以例如通过针头或可以使用无针注射器。吞服可以通过液体制剂,胶囊,片剂等进行。吸入(或局部施用于身体上皮)可以通过吸入器,雾化器,喷雾器等进行,并且可以涉及任何合适尺寸的喷雾或颗粒/液滴,例如经配置或在尺寸上适用于递送至鼻,口,咽,喉或肺等上皮细胞的喷雾或颗粒/液滴。局部施用可以包括将药物置于上皮层上以进行跨上皮摄取。示例性上皮局部施用可以包括外用于皮肤或其伤口(即,直接放置在表皮,真皮,皮下组织或暴露的伤口组织等上)。可以用于局部施用的其他示例性上皮可以包括直肠,阴道,尿道,口腔,鼻或眼上皮,或其任何组合。通过将药物配制成软膏和/或通过将药物置于皮肤贴剂上,促进局部施用。
在一些实施方案中,本发明的组合物通过选自下组的途径给药:口服,局部,舌下,口腔,鼻内,直肠和静脉内。在一些实施方案中,口服或静脉内施用阿米洛利或阿米洛利类似物。
可以施用治疗有效量的调节剂(例如抑制剂)。如本文所用,术语“有效量”,“药学有效量”和“治疗有效量”是指,无毒但足够量的药剂以提供所需的生物学结果。该结果可以是减少和/或减轻疾病的体征、症状或原因、或是提供生物系统的任何其他期望的改变,例如,超重或肥胖个体的体重减少。任何情况下,合适的治疗量可以由本领域普通技术人员使用常规实验确定。例如,约75kg体重的成人,作为deg/enac调节剂的口服阿米洛利的有效量可以为约0.75-250毫克/天。
施用方案可以影响有效量的构成。可以每天或顺序地施用几个分剂量或交错剂量,或者可以连续输注剂量或者可以推注注射。治疗制剂的剂量可根据治疗或预防情况的紧急性,按比例增加或减少。
对于将本发明的组合物施用给个体,优选哺乳动物,更优选人,可以使用已知的方法,以有效产生所需体重管理(例如在超重或肥胖个体中减轻体重)的剂量和时间进行。达到所需效果所需的治疗化合物的有效量可根据诸如个体的年龄,性别和体重等因素而变化。可以调整剂量方案以提供最佳治疗反应。例如,可以每天施用几个分剂量,或者可以按照治疗情况的紧急程度按比例减少剂量。本领域普通技术人员将能够研究相关因素并且无需过度实验就可以确定治疗化合物的有效量。
在一些实施方案中,个体是人。在一些实施方案中,调节剂是阿米洛利、阿米洛利类似物或其盐,并且以在以下范围中的日剂量(以单剂或多剂形式)施用:0.01-30mg/kg体重,0.01-10mg/kg体重,0.01-5mg/kg体重,0.01-3mg/kg体重,0.01-2mg/kg体重,0.01-1mg/kg体重,0.01-0.3mg/kg体重,0.01-0.1mg/kg体重,0.01-0.03mg/kg体重,0.03-30mg/kg体重,0.03-10mg/kg体重,0.03-5mg/kg体重,0.03-3mg/kg体重,0.03-1mg/kg体重,0.03-0.3mg/kg体重,0.03-0.1mg/kg体重,0.1-30mg/kg体重,0.1-10mg/kg体重,0.1-3mg/kg体重,0.1-1mg/kg体重,0.1-0.3mg/kg体重,0.3-30mg/kg体重,0.3-10mg/kg体重,0.3-3mg/kg体重,0.3-1mg/kg体重,1-30mg/kg体重,1-10mg/kg体重,1-3mg/kg体重,3-30mg/kg体重,3-10mg/kg体重或10-30mg/kg体重。在一个实施方案中,阿米洛利类似物选自benzamil,phenamil,eipa,bepridil,kb-r7943,5-(n-甲基-n-异丁基)-阿米洛利,5-(n,n-六亚甲基)-阿米洛利,5-(n,n-二甲基)阿米洛利盐酸盐,p552-02,和nvp-qbe170。
在其他实施方案中,调节剂是阿米洛利、阿米洛利类似物或其盐,并且配制为单剂的药物组合物施用,剂量范围为0.1-1000mg/剂,0.1-300mg/剂,0.1-100mg/剂,0.1-30mg/剂,0.1-10mg/剂,0.1-3mg/剂,0.1-1mg/剂,0.1-0.3mg/剂,0.3-1000mg/剂,0.3-500mg/剂,0.3-300mg/剂,0.3-100mg/剂,0.3-30mg/剂,0.3-10mg/剂,0.3-3mg/剂,0.3-1mg/剂,1-1000mg/剂,1-300mg/剂,1-100mg/剂,1-30mg/剂,1-10mg/剂,1-3mg/剂,3-1000mg/剂,3-300mg/剂,3-100mg/剂,3-30mg/剂,3-10mg/剂,10-1000mg/剂,10-300mg/剂,10-100mg/剂,10-30mg/剂,30-1000mg/剂,30-300mg/剂,30-100mg/剂,100-1000mg/剂,100-300mg/剂,或300-1000mg/剂。在一个实施方案中,阿米洛利类似物选自benzamil,phenamil,eipa,bepridil,kb-r7943,5-(n-甲基-n-异丁基)-阿米洛利,5-(n,n-六亚甲基)-阿米洛利,5-(n,n-二甲基)阿米洛利盐酸盐,p552-02,和nvp-qbe170。在一些实施方案中,配制阿米洛利或阿米洛利类似物用于静脉内注射或口服给药。
在优选的实施方案中,根据本发明的调节剂在进食之前或期间施用,优选在进食之前5分钟至3小时,例如15分钟施用。
药物组合物
本申请的另一方面涉及用于调节食欲或用于治疗食欲紊乱和相关疾病、代谢紊乱或病症,例如超重,肥胖或肥胖相关病症,的药物组合物。药物组合物包含有效量的deg/enac调节剂和药学上可接受的载体。在一些实施方案中,药物组合物包含阿米洛利类似物或其药学上可接受的盐,其中阿米洛利类似物选自benzamil,phenamil,eipa,bepridil,kb-r7943,5-(n-甲基-n-异丁基)-阿米洛利,5-(n,n-六亚甲基)-阿米洛利,5-(n,n-二甲基)阿米洛利盐酸盐,p552-02,和nvp-qbe170。
根据本发明的调节剂,例如抑制剂,可以以任何合适的形式、在任何合适的组合物中施用给个体。在一些实例中,调节剂可以是药学上可接受的盐的形式。
如本文所用,术语“药物组合物”是指,至少一种本发明中有用的化合物与可药用载体(根据情况而定)的混合物。药物组合物有助于化合物向患者的施用。
如本文所用,术语“可药用载体”是指药学上可接受的材料、组合物或载体,例如液体或固体填充剂,稳定剂,分散剂,悬浮剂,稀释剂,赋形剂,增稠剂,溶剂或包封材料,涉及在患者体内或向患者体内携带或运输本发明有用的化合物,使其可以发挥其预期的功能。通常,这种构建物可以被携带至、或从一个器官或身体的一部分运输至另一个器官或身体的一部分。在与制剂的其他成分(包括本发明有用的化合物)相容且对患者无害的意义上,每种载体必须是“可接受的”。可用作药学上可接受的载体的材料的一些实例包括:糖,例如乳糖,葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠,乙基纤维素和醋酸纤维素;粉末黄蓍胶;麦芽;明胶;滑石;赋形剂,如可可脂和栓剂蜡;油,如花生油,棉籽油,红花油,芝麻油,橄榄油,玉米油和豆油;二醇,如丙二醇;多元醇,如甘油,山梨糖醇,甘露糖醇和聚乙二醇;酯类,如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,如氢氧化镁和氢氧化铝;表面活性剂;海藻酸;无热原水;等渗盐水;林格氏溶液;乙醇;磷酸盐缓冲液;和药物制剂中使用的其他无毒相容物质。如本文所用,“可药用载体”还包括与本发明化合物的活性相容的且对于患者是生理学上可接受的任何和所有包衣、抗细菌和抗真菌剂、和吸收延迟剂等。增补性活性化合物也可以掺入组合物中。“可药用载体”可以进一步包括可用于本发明的化合物的药学上可接受盐。可以包括在本发明的药物组合物中的其他成分是本领域已知的并且描述于例如remington'spharmaceuticalsciences(genaro,ed。,mackpublishingco.,1985,easton,pa),其通过引用并入本文。
在一些实施方案中,配制药物组合物用于口服施用。在其他实施方案中,药物组合物包含配制用于口服施用的阿米洛利和/或阿米洛利类似物。对于口服应用,特别合适的是片剂,糖衣丸,液体,滴剂,栓剂或胶囊,囊片和凝胶帽。用于口服使用的组合物可根据本领域已知的任何方法制备,并且此类组合物可含有一种或多种试剂,所述试剂选自适用于制备片剂的惰性无毒药物赋形剂。这些赋形剂包括,例如,惰性稀释剂,如乳糖;制粒和崩解剂如玉米淀粉;粘合剂如淀粉;和润滑剂如硬脂酸镁。片剂可以是未包衣的,或者可以为美观或为了延迟活性成分的释放而通过已知技术包衣。口服使用的制剂也可以作为硬明胶胶囊提供,其中活性成分与惰性稀释剂混合。
在一些实施方案中,配制药物组合物用于静脉内注射。在其他实施方案中,药物组合物包含配制用于静脉内注射的阿米洛利和/或阿米洛利类似物。适于注射使用的药物组合物包括无菌水溶液(水溶性的)或分散体、和用于即时制备无菌可注射溶液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水,抑菌水,cremophoreltm(basf,parsippany,nj),或达到易于注射程度的流体。可注射组合物在制造和储存条件下必须是稳定的,并且必须防止微生物如细菌和真菌的污染。载体可以是溶剂或分散介质,含有例如水,乙醇,多元醇(例如,甘油,丙二醇和液体聚乙二醇等),以及它们的合适混合物。例如,可以通过使用诸如卵磷脂的涂层、在分散体的情况下通过维持所需的颗粒尺寸、和通过使用表面活性剂,来保持适当的流动性。通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯,氯丁醇,苯酚,抗坏血酸,硫柳汞等,可以防止微生物的作用。在许多情况下,优选在组合物中包含等渗剂,例如糖,多元醇如甘露醇,山梨糖醇,氯化钠。通过在组合物中包括延迟吸收的试剂,例如单硬脂酸铝和明胶,可以实现可注射组合物的延长吸收。
无菌可注射溶液可以通过将所需量的阿米洛利和/或阿米洛利类似物掺入适当的溶剂中,然后过滤除菌来制备。通常,通过将活性化合物掺入无菌溶媒中来制备分散体,所述无菌溶媒含有基础分散介质和来自上面列举的所需其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其从先前无菌过滤的溶液产生包含活性成分以及任何其他所需成分的粉末。
筛选方法
另一方面,本发明提供了一种鉴定新药剂的方法,所述药剂可用于调节食欲或治疗食欲紊乱或代谢紊乱病症,特别是肥胖或超重或肥胖相关病症,其中所述鉴定基于所述药剂调节,例如抑制或刺激deg/enac受体的能力来进行。
在一个实施方案中,本发明提供一种用于筛选能够调节食物摄入或食欲和/或控制体重的药剂的方法,所述方法包括以下步骤:
-提供测定试验,所述测定试验用于确定对deg/enac受体的表达或活性的调节;
-向所述测定试验中引入疑似deg/enac调节剂的化合物;和
-确定是否发生deg/enac的调节,
其中调节deg/enac离子通道的表达或活性水平的化合物是调节食物摄入或食欲或控制体重的候选药剂。
在进一步的实施方案中,所述方法包括以下步骤:
(i)使所述药剂与deg/enac受体接触,和
(ii)检测所述deg/enac受体活性的任何变化。
候选化合物
作为enac和/或asic蛋白的调节剂测试的化合物可以是有机小分子或生物实体,例如蛋白质,例如抗体或肽,糖,核酸,例如多核苷酸,寡核苷酸,sirna,反义寡核苷酸或核酶,脂质,脂肪酸等,可以测试其调节deg/enac离子通道活性的能力。测试化合物可以是测试化合物文库的形式,例如组合文库或随机化文库,其可以提供足够的多样性。常规地,可以通过鉴定具有一些期望的性质或活性(例如抑制活性)的测试化合物(称为“先导化合物”),之后产生先导化合物的变体,以及评估变体化合物的性质和活性,来产生具有有用性质的新化学实体。通常,高通量筛选(hts)方法用于这种分析。典型地,测试化合物可以是有机小分子和肽。在一个实施方案中,化合物是阿米洛利类似物。
测定试验
各种测定试验,包括体外和体内测定试验,包括基于细胞的模型,均可用于评估deg/enac蛋白的活性或表达所受到的调节。参见例如美国专利9244081(描述enac调节剂的筛选方法)和美国专利申请20080242588(描述asic调节剂的筛选方法)。另可以参见andrewj.hirsh等,j.med.chem.2006,49,4098-4115(描述enac阻断剂的设计,合成和结构-活性关系);g.r.dube等,pain117(2005)88–96(描述asic阻断剂的体外和体内表征)。这些文献在此引入作为参考。
筛选可涉及适用于测量deg/enac蛋白与候选调节剂(例如抑制剂)之间相互作用的任何合适的测定试验系统。示例性测定试验系统可包括生物化学测定(例如,结合测定试验),使用例如在培养中生长的细胞(“培养细胞”)和/或使用生物体进行。
在一些实施方案中,用于检测调节剂例如抑制剂和活化剂的此类测定试验包括,例如,在体外、在细胞、细胞提取物或细胞膜中表达enac和/或asic蛋白,施加推定的调节剂化合物,然后确定对所述蛋白活性的功能性影响。
在一些实施方案中,进行高通量结合测定试验,其中使deg/enac蛋白与潜在的调节剂接触并孵育合适的时间。如上所述,可以使用各种调节剂,包括有机小分子,肽,抗体和deg/enac配体类似物。
多种测定试验可用于鉴定deg/enac与调节剂的结合,包括标记的蛋白质-蛋白质结合测定试验,电泳迁移率变化,免疫测定试验,酶学测定试验,如磷酸化测定试验等。在一些情况下,候选调节剂的结合通过使用竞争性结合测定来确定,其中在潜在调节剂存在下测量对已知配体的结合的干扰。deg/enac家族的配体是已知的。此外,已知阿米洛利抑制enac和asic的功能。在此类测定试验中,可以首先使deg/enac蛋白例如enac和asic蛋白与已知配体结合,然后加入期望的化合物,即推定的活化剂或抑制剂。在洗涤deg/enac蛋白后,测定对潜在调节剂或已知配体的结合的干扰。通常,标记潜在调节剂或已知配体。
测定离子通道功能的方法包括,例如膜片钳技术,双电极电压钳制,全细胞电流测量,以及使用离子敏感性荧光染料的荧光成像技术和离子通量测定试验,例如放射性标记离子通量测定或离子通量测定。在一些实施方案中,候选化合物可以在短路电流(short-circuitcurrent,isc)测定中进行测试,例如在kjcoote等,brjpharmacol.2015jun;172(11):2814-26中描述的。在一些实施方案中,调节asic活性的化合物可以在组合物和酸的存在下以全细胞膜片钳模式进行测试,如在例如g.r.dube等,pain117(2005)88–96中所述。
在一些实施方案中,基于细胞的测定试验系统用于测量每种候选调节剂(例如抑制剂)对细胞中离子通量(例如钠离子通量或酸敏感离子通量)的影响。在一些实施方案中,离子通量是钠通量。例如,钠通量可以通过评估放射性标记的钠的摄取来测量。在一些实施方案中,测定试验系统使用表达deg/enac家族成员(例如enacαβγ,asic1a或asic2a)的细胞,或表达两种或更多种不同deg/enac家族成员(例如enacαβγ和(一种或多种)asic家族成员)的两种或更多种不同的细胞,用于确定每种调节剂(例如抑制剂)对这些家族成员的选择性作用。细胞可以内源性地表达,或可以通过引入外来核酸来表达各家族成员。在一些实例中,测定试验系统可以通过电生理学方式(例如通过膜片钳)、使用离子敏感或膜电位敏感染料(例如钠敏感染料)来测量离子通量,或通过基于基因的报告系统来测量,尤其是对膜电位和/或细胞内离子(例如钠)浓度的变化敏感的报告系统。该测定试验系统可用于测试候选调节剂对deg/enac家族成员(特别是,在哺乳动物(例如人)胃肠道中表达的enac离子通道和asic离子通道)的选择性和/或特异性抑制。
在筛选方法的一些实施方案中,可以在存在或不存在测试化合物的情况下,测量表达enac受体和/或asic受体的任何细胞,检测其功能所受到的调节,所述细胞包括例如胃肠道中的细胞,如肠内分泌细胞。
可以将经潜在调节剂处理的包含enac和/或asic蛋白的样品或测定,与不含调节剂的对照样品进行比较,以检查调节的程度。可以将(未用调节剂处理的)对照样品指定为具有100%的相对蛋白活性值。在一个实施方案中,enac或asic被抑制,其中相对于对照,该活性值为约80%,优选50%,更优选25-0%。在另一个实施方案中,enac或asic被活化,其中相对于(未用活化剂处理的)对照,该活性值为110%,更优选150%,更优选200-500%(即相对于对照,活性值高2至5倍),更优选1000-3000%。
在体外测定(例如基于细胞的测定试验)中鉴定的化合物、及其生物学上可接受的衍生物可以在食物摄入或体重控制试验中,使用例如正常小鼠或肥胖小鼠模型进一步测试,以确认其对食物摄入或体重控制的影响。
应当理解,对于本文提供的值和范围,被这些值和范围所涵盖的所有值和范围都包括在本发明的范围内。此外,本申请还考虑落入这些范围内的所有值,包括整数或小数增量,以及数值范围的上限或下限。
本文引用或提及的所有专利,专利申请,出版物,技术文献和/或学术文章以及其他参考文献在法律允许的范围内通过引用而整体并入本文。
实施例
现在参考以下实施例描述本发明。提供这些实施例仅用于举例说明的目的,本发明不局限于这些实施例,而是涵盖基于本文提供的教导而显而易见的所有变化。
实施例1
果蝇中的食物摄取调节
先前在果蝇中的研究表明,机械感觉离子通道ppk1在后肠神经元(pens)中表达,并在食物摄入的调节中起作用。
首先,使用以下抗体和荧光标记物,通过免疫组织化学,使用四种先前表征的gal4果蝇系,在果蝇中研究了肠神经投射:兔抗gfp抗体(ab290;1:1000;abcam,cambridge,uk),alexafluor488山羊抗兔igg(h+l)(a11034;1:800;lifetechnologies,gaithersburg,md,usa),mab22c10(developmentalstudieshybridomabank,universityofiowa),和alexafluor633鬼笔环肽(a22284;1:250;lifetechnologies)。mab22c10是在轴突中高度表达的微管相关蛋白,因此可以被标记以显示轴突的形态。
使用ppk1-gal4驱动mcd8::gfp,检查在果蝇的胃肠道(gi)中ppk1(deg/enac超家族成员)的表达。
对于后肠神经元区域的三维模型建立,从mab22c10和alexafluor633鬼笔环肽免疫染色的肠样品,取一系列z-stack共聚焦图像,然后使用imaris将其转化为模型。所有图像均使用zeisslsm510获取,并使用imaris(bitplane,zurich,switzerland)分析。
结果显示,后肠神经元(pens)紧紧围裹在肠道的肌肉周围(图2a,pens:绿色;肌肉:红色);并且ppk1离子通道存在于pen上(图2b)。
接着,在果蝇中检查了ppk1缺陷和药理学抑制对食物摄取的影响。简而言之,果蝇在18℃饲养。如所述(ja等人,2007,proceedingsofthenationalacademyofsciencesofusa104:8253-8256),对2日龄雄性,以4个为一组,在29℃进行毛细管饲养测定24小时。饮食是5%酵母提取物和5%蔗糖溶液。对于抑制实验,使用benzamil(deg/enac离子通道拮抗剂),向雄性yw果蝇提供食物——补充有10mmbenzamil或dmso的100mm蔗糖。
ppk1缺陷果蝇具有增加的食物摄入量(图2c)。与这些结果一致,benzamil对ppk1的抑制也导致了果蝇的食物消耗增加(图2d)。
实施例2
脊椎动物中的deg/enac超家族成员与无脊椎动物中的同源物具有低序列相似性,构成独特不同的家族。在哺乳动物中,有两个deg/enac家族,上皮钠通道(enacs)和酸敏感离子通道(asic)。enac家族包括四种enac同源物,enacα,β,γ,和δ。asic家族包括asci同源物,asci1a,asci1b,asic2a,asic2b,asic3,asic4和asic5。
进行以下实验,以研究deg/enac离子通道是否在哺乳动物的食物摄入中起作用。
2.1.小鼠胃肠道中deg/enac基因的表达
从8周龄c57b6雄性小鼠解剖胃,空肠和结肠。使用tri试剂(invitrogen)提取rna,并用primescript试剂盒(takara)制备cdna。每个pcr反应使用10ngrna。
对于rt-pcr,使用下列引物:
αenac:f:5’-acctgtcgtttcaaccaggc
r:5’-tccaggcatggaagacatccag
βenac:f:5’-ggcccaggctacacctaca
r:5’-agcagcgtaagcaggaacc
asic1:f:5’-atgcttctctcgtgccacttcc
r:5’-tggcccgagttgaatgtgtagc
asic2:f:5’-gcccgcacaacttctcctc
r:5’-ggcaggtactcatcttgctgaa
asic3:f:5’-ttcgctactatggggagttcc
r:5’-gccatgtcaaaagtcggactg
asic5:f:5’-ctgccatctccaactgaccg
r:5’-caccaagagcgagacagagc
测试的deg/enac基因,包括αenac,βenac,asic1,asic2,asic3,asic5,在小鼠的胃,空肠和结肠中均表达(图3)。推测哺乳动物可能具有与果蝇肠道中的pen类似的肠神经元,其中pen通过其上存在的deg/enac离子通道的活性来调节食物摄取。
2.2.抑制deg/enac离子通道对食物摄取的影响
阿米洛利是已知的deg/enac离子通道的非选择性抑制剂,可阻断enacs和asci。该化合物首先由cragoe等人在1967年描述(美国专利3,313,813;1967年4月11日;转让给merckco.,inc.)。该化合物已经用作抗高血压药、保钾利尿剂,用于治疗高血压和充血性心力衰竭。在高血压患者中,阿米洛利通过与阿米洛利敏感性钠通道结合来抑制肾脏中的钠重吸收。这可以促进钠和水自身体的去除,但不会消耗钾。
在以下实验中,阿米洛利用于拮抗小鼠中的deg/enac离子通道。
2.3在正常小鼠中阿米洛利抑制短期食物摄取
13周龄c57bl6雌性和雄性小鼠在实验前单独笼养2周。在上午8点至下午6点,不喂食小鼠,使其饥饿。然后通过经口管饲或腹膜内注射,给予阿米洛利,剂量为1,10或100μmole/kg体重(229.6μg,2.296mg,或22.96mg/kg体重;每种浓度n=3只动物),或给予溶媒(蒸馏水用于经口管饲,盐水用于ip注射)。给药体积为10ml/kg体重。15分钟后,向小鼠提供正常的固体食物(chow),并测量在指定时间点的食物消耗。对于数据点,使用t检验(未配对,2尾)计算p值。*=p<0.05,**=p<0.01,***=p<0.001。
结果显示在图5中。口服和腹膜内施用阿米洛利均抑制了小鼠的短期食物摄入。
2.4在肥胖小鼠模型中阿米洛利引起的体重减轻和脂肪减少
在实验中使用8周龄leprpb雌性小鼠。leprpb小鼠是肥胖模型小鼠,其携带瘦蛋白受体基因突变。将20只小鼠随机分成两组。治疗组小鼠每周6次给予阿米洛利,通过经口管饲法在下午的晚些时候在夜间喂食前进行。阿米洛利溶解在dmso中并在无菌水中稀释。阿米洛利的给药剂量在第1-14天为4.1mg/kg/天,在第15-35天为12.3mg/kg/天。注射体积为10ml/kg。对照组小鼠接受无菌水中的82μldmso/kg/天。测量体重。分析与第14天的体重相比的体重变化。
图6显示了阿米洛利对leprpb肥胖小鼠体重变化的影响。与用dmso喂养的对照小鼠相比,用阿米洛利喂养的瘦蛋白受体突变小鼠显示体重显著降低。该数据说明,阿米洛利具有诱导体重减轻的作用。
2.5表征由阿米洛利诱导的小鼠体重减轻
为了表征由阿米洛利诱导的体重减轻的性质,通过brukerminispeclf50nmr仪,根据制造商的说明,在5周药物施用之前和之后,测定了小鼠的身体组成(包括脂肪,瘦组织和体液)的变化。
结果显示在图7中。用阿米洛利和溶媒dmso喂养的小鼠具有脂肪/瘦组织比、体脂百分比和体液百分比的降低。然而,阿米洛利导致了脂肪/瘦组织比和体脂百分比的更为显著的降低。与饲喂对照dmso的小鼠相比,喂食阿米洛利的小鼠的体液百分比降低没有显著差异。这些数据表明,由阿米洛利引起的体重减轻是由于脂肪减少而非体液减少导致。
2.6在正常小鼠中benzamil对短期食物摄取的抑制
为了进一步确定用阿米洛利喂养的小鼠的体重减轻是否是由于抑制deg/enac离子通道所导致,在短期食物摄入实验中使用了阿米洛利类似物benzamil。benzamil是一种更有效的、高度特异的、长效deg/enac离子通道拮抗剂。
在实验前将15周龄c57bl6雌性小鼠单独笼养2周。在上午8点至下午6点,不喂食小鼠,使其饥饿。然后通过腹膜内注射,给予benzamil(benzamil盐酸盐水合物)0.01-10μmole/kg体重(3.5621μg-3.5621mg/kg体重),或给予盐水。给药体积为10ml/kg体重。15分钟后,向小鼠提供正常的固体食物(chow),并测量在指定时间点的食物消耗。
结果显示在图8中。与阿米洛利类似,benzamilal抑制了小鼠的短期食物摄入。
总之,数据支持deg/enac离子通道在调节哺乳动物食物摄入中起作用的观点。然而,与在果蝇中抑制其同源物ppk1时所观察到的体重增加效果(实施例1)不同,令人惊奇地,哺乳动物中deg/enac抑制诱导体重减轻,而且该体重减少可以主要归因于体脂的减少。
- 还没有人留言评论。精彩留言会获得点赞!