包括依伐卡托和鲁玛卡托及其盐和衍生物的复合制剂的药物联合组合物、其制备方法及含有它们的药物组合物与流程
本发明涉及一种包括具有可控的粒径、增加的表观溶解度和增加的溶出度的稳定的复合物的药物组合物,其包括作为活性化合物的依伐卡托(ivacaftor)和鲁玛卡托(lumacaftor)、其盐或其衍生物,该复合物用于囊性纤维化跨膜传导调节因子(cysticfibrosistransmembraneconductanceregulator,cftr)介导的疾病的治疗。更具体地,包括本发明的复合物的该药物组合物具有瞬时再分散性、增加的表观溶解度和渗透率,没有可观察到的食物效应,提供了精准剂量和易于给药以溶液形式的重构复合物的机会。本发明还涉及配制和制造根据本发明的复合物、含有该复合物的药物组合物的方法,其用途和使用该复合物及其组合物的治疗方法。
背景技术:
依伐卡托是一种几乎不溶于水(<0.05mg/ml)白色至灰白色的粉末,。由于较差的水溶解性,需要广泛的配方尝试并产生适于口服给药的喷雾干燥的依伐卡托分散体。含有该喷雾干燥的依伐卡托分散体的
依伐卡托是囊性纤维跨膜传导调节因子(cftr)蛋白的增强剂。cftr蛋白是存在于多个器官中的上皮细胞的表面的氯离子通道。依伐卡托通过加强cftr蛋白的通道开启概率(或门控(gating))来促进增加的氯化物运输。
在对处于进食状态的健康志愿者的单次150mg剂量的口服给药后,血浆浓度峰值(tmax)在大约4小时时出现,且药时曲线下面积(auc)和cmax的平均值(±sd)分别为10,600(5260)ng×hr/ml和768(233)ng/ml。在每12小时给药后,在第3至5天达到依伐卡托的稳态血浆浓度,具有范围在2.2至2.9的累计比。
当与含脂肪的食物一起服用时,依伐卡托的暴露量(exposure)增加约2至4倍。因此,
在进食状态下的单次剂量275mg的
依伐卡托在人体内广泛代谢。体外和临床研究表明,依伐卡托主要由同工酶3a(cyp3a)代谢。m1和m6是依伐卡托在人体内的两种主要代谢产物。m1具有约为依伐卡托的六分之一的效力,且被认为具有药理活性。m6具有少于依伐卡托的五十分之一的效力,且被认为不具有药理活性。
口服给药后,大部分依伐卡托(87.8%)在代谢转化后被排除在排泄物中。主要代谢产物m1和m6占排除的总剂量的约65%,其中22%为m1,43%为m6。由于亲本(parent)未改变,因此依伐卡托的尿排泄可忽略不计。在单次剂量后,表观终末半衰期约为12小时。依伐卡托的平均表观清除率(apparentclearance)(cl/f)对健康受试者和cf患者是相似的。在健康受试者中,150mg剂量的表观清除率(平均值)为17.3(8.4)l/hr。
鲁玛卡托是
鲁玛卡托是一种几乎不溶于水(0.02mg/ml)的白色至灰白色的粉末,。
鲁玛卡托改进了f508del-cftr的构象稳定性,导致了增加的成熟蛋白质向细胞表面的加工和运输(trafficking)。体外研究已经表明:鲁玛卡托直接作用在原代人支气管上皮培养物和携带f508del-cftr突变的其他细胞系中的cftr蛋白上,以便增加f508del-cftr在细胞表面的数量、稳定性和功能,从而导致增加的氯离子迁移。
在鲁玛卡托的多次口服剂量给药后,鲁玛卡托的暴露量随每天50mg至每天1000mg的剂量大致成比例地增加。在患有囊性纤维化(cf)的受试者中,鲁玛卡托cmax和auc也随超过鲁玛卡托每天25mg至每12小时400mg剂量范围的剂量而大致成比例地增加。当与含脂肪的食物一起服用时,鲁玛卡托的暴露量增加约1.6倍至2.0倍。在进食状态下,最大浓度的中值(范围)时间(tmax)约为4.0(2.0、9.0)小时。
鲁玛卡托约99%与血浆蛋白结合,主要与白蛋白结合。在进食状态下,对囊性纤维化(cf)患者的每24小时200mg口服给药28天后,表观分布容积的平均值(±sd)为86.0(69.8)l。
cf患者体内,鲁玛卡托的半衰期约为26小时。对于cf患者,鲁玛卡托的典型表观清除率cl/f(cv)估计为238l/hr(29.4%)。
鲁玛卡托在人体内并未广泛代谢,其中大部分的鲁玛卡托(51%)不变地被排泄在排泄物中。尿液中具有鲁玛卡托及其代谢物的最小消除量(尿液中仅有8.6%的总放射性被恢复,0.18%为未改变的亲本)。体外和体内数据表明,鲁玛卡托主要通过氧化和葡萄糖醛酸化(glucuronidation)来代谢。
通过结肠直肠腺癌(colorectaladenocarcinoma,caco-2)细胞系统评估,鲁玛卡托具有低水溶解度和高渗透率。尽管观察到ph依赖性溶解度,但鲁玛卡托药物几乎不溶于水和ph1.0至ph8.0的缓冲溶液。因此,鲁玛卡托被建议为bcsii类(低溶解性/高渗透率)化合物。
由于鲁玛卡托被认为是bcsii类,因此在开发早期对药物进行喷磨以减小粒径并可能地提高生物利用度。基于这些研究,建立了对药物规格中的鲁玛卡托粒径的控制。
各种制剂已经单独地和组合地用在包括混悬剂、胶囊剂和片剂的鲁玛卡托的开发中。在健康的志愿者的单剂量研究中观察到鲁玛卡托的不同制剂的相当的暴露量。混悬剂的暴露量低于所见的胶囊剂和片剂的暴露量。早期临床研究是用依伐卡托和鲁玛卡托的共同给药来进行的。进行交叉研究(007),以评价固定剂量的组合片剂与单独片剂相比的相对生物利用度。片剂和固定剂量复合剂(fixed-dosecombination,fdc)似乎是生物等效的,并且唯一不符合标准生物等效性标准的参数是依伐卡托的cmax(glsmr[90%ci]-1.20[1.09,1.33])。然而,出于实际目的,这是可接受的,并且片剂制剂的pk结果也可认为适用于fdc。
当单次剂量的鲁玛卡托/依伐卡托与含脂肪的食物一起给药时,鲁玛卡托暴露量比在禁食状态下给药时大约高出2倍,且依伐卡托暴露量大约高出3倍。
在鲁玛卡托结合依伐卡托的多次口服剂量给药后,鲁玛卡托的暴露量通常超过每24小时200mg至每12小时400mg的范围的剂量成比例地增加。在进食状态下,鲁玛卡托的中值(范围)tmax约为4.0(2.0、9.0)小时。
在依伐卡托结合鲁玛卡托的多次口服剂量给药后,依伐卡托的暴露量通常从每12小时150mg增加至每12小时250mg的剂量。在进食状态下,依伐卡托的中值(范围)tmax约为4.0(2.0、6.0)小时。
围绕依伐卡托和鲁玛卡托给药的主要医疗问题涉及两种化合物均表现出的阳性的食物效应,其不允许目前的制剂的精确给药。对于儿科患者而言,这是非常正确的,其中目前的、固定剂量的片剂制剂不允许将该化合物向儿童给药。
为了克服与现有常规制剂和含有依伐卡托与鲁玛卡托组合的可用药物递送系统相关的问题,制备了新型药物组合物,其包括:依伐卡托或者其盐或其衍生物和络合剂和药学可接受赋形剂的复合制剂、以及鲁玛卡托或者其盐或其衍生物和络合剂和药学可接受赋形剂的复合制剂。本发明的新型药物组合物的特征在于瞬时的再分散性、增加的表观溶解度、瞬时溶解、增加的表观渗透率,其没有表现出食物效应,这允许精确给药活性成分。
已经使用了各种策略来尝试克服这些问题,例如参见wo/2014/118805、wo/2014/125506、wo/2015/070336、wo/2014/135096、jp2014097964、cn104725314、us20150246031、us20150182517、wo2015160787、us20150246031、us20150182517、us20150246031、us20150182517、wo2015073231、ep2872122、us20150024047、ep2826776、us20150010628、ep2819670、us20140255483、us20140221424、us20140163068、us7495103、us8324242、us8354427、us8754224、us7,495,103、us8,507,534、us8,653,103、us8,716,338、us8,846,718、us8,993,600、wo2015175773、wo2009076141、wo2011127290、wo2013112804、wo2011127241、us20130085158、us20130296379、us20140221430、us20140163068、us20150196539、us20160039800、us20150140094和wo2015073231。
技术实现要素:
的简要描述
1、一种具有改进的物理化学特性和增强的生物学性能的药物联合组合物,该药物联合组合物包括:
i.复合物依伐卡托制剂或其药物组合物;和
ii.复合物鲁玛卡托制剂或其药物组合物;和
iii.可选地,药学可接受赋形剂,
其中,所述复合物依伐卡托制剂或其药物组合物包括:
i.依伐卡托、或者其盐或衍生物;
ii.至少一种络合剂,该络合剂选自:由甘油单酯、甘油二酯和甘油三酯以及聚乙二醇单酯和聚乙二醇二酯组成的聚乙二醇甘油酯,羟丙基纤维素,泊洛沙姆(poloxamers)(环氧乙烷和环氧丙烷嵌段的共聚物),乙烯吡咯烷酮和乙酸乙烯酯的共聚物,聚(2-乙基-2-
iii.可选地,药学可接受赋形剂,
其中,所述复合物鲁玛卡托制剂或其药物组合物包括:
i.鲁玛卡托、或者其盐或衍生物;
ii.至少一种络合剂,该络合剂选自:由甘油单酯、甘油二酯和甘油三酯以及聚乙二醇单酯和聚乙二醇二酯组成的聚乙二醇甘油酯,羟丙基纤维素,泊洛沙姆(环氧乙烷和环氧丙烷嵌段的共聚物),乙烯吡咯烷酮和乙酸乙烯酯的共聚物,聚(2-乙基-2-
iii.可选地,药学可接受赋形剂,
其中,所述复合制剂或其药物联合组合物具有处于10nm至600nm之间的粒径,且所述药物联合组合物具有以下特征中的至少一项:
a)在生理相关介质中是瞬时可再分散的;
b)在固体形式中和在胶体溶液和/或分散体中是稳定的;
c)复合物依伐卡托和复合物鲁玛卡托制剂或它们的药物组合物具有在水中的至少1mg/ml的表观溶解度;
d)当分散在禁食状态模拟的肠液(fasted-statesimulatedintestinalfluid,fassif)或进食状态模拟的肠液(fed-statesimulatedintestinalfluid,fessif)生物相关介质中时,复合物依伐卡托和复合物鲁玛卡托制剂,或它们的药物组合物的具有对依伐卡托至少为0.2×10-6cm/s的平行人工膜渗透测定(pampa)渗透率、对鲁玛卡托至少为2×10-6cm/s的pampa渗透率,所述pampa渗透率在至少6个月的时间内不会降低;
e)具有增加的溶出度:在生物相关介质中,5分钟内80%的依伐卡托和80%的鲁玛卡托从药物组合物中释放;
f)没有表现出可观察到的食物效应;
g)具有改进的依伐卡托和鲁玛卡托的生物利用度。
2、根据点1的药物联合组合物,其中,所述复合物具有范围在10nm和600nm之间的粒径。
3、根据点2的药物联合组合物,其中,所述复合物具有范围在10nm和400nm之间的粒径。
4、根据点1的药物联合组合物,其中,所述复合物在固体形式中呈现出x射线无定形特征。
5、根据点1的药物联合组合物,其中,所述复合物或其药物组合物或者所述药物联合组合物具有(a)至(g)中描述的特性中的至少两项。
6、根据点5的药物联合组合物,其中,所述复合物或其药物组合物或者所述药物联合组合物具有(a)至(g)中描述的特性中的至少三项。
7、根据点6的药物联合组合物,其中,所述药物联合组合物或所述复合物或者其药物联合组合物具有瞬时的再分散性,具有在水中的至少1mg/ml的表观溶解度,没有表现出可观察到的食物效应,这提供了精确给药和易于给药以溶液的形式重构的药物联合组合物的机会。
8、根据点6的药物联合组合物,其中,所述复合物或其药物联合组合物具有瞬时的再分散性,当分散在水、fassif或fessif生物相关介质中时,具有对依伐卡托至少为2×10-6cm/s的pampa渗透率和对鲁玛卡托为2×10-6cm/s的pampa渗透率,所述pampa渗透率在至少6个月的时间内不会降低,没有表现出可观察到的食物效应,这提供了精确给药和易于给药以溶液形式的重构药物联合组合物的机会。
9、根据点1的药物联合组合物,其中,所述复合物依伐卡托制剂的络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物、和可选地泊洛沙姆;且所述复合物鲁玛卡托制剂的络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物。
10、根据点1的药物联合组合物,其中,所述复合物依伐卡托和复合物鲁玛卡托制剂的所述药学可接受赋形剂选自脱氧胆酸钠、二辛基磺基琥珀酸钠、乙酸钠、氯化十六烷基吡啶、柠檬酸、葡甲胺和十二烷基硫酸钠。
11、根据点10的药物联合组合物,其中,所述药学可接受赋形剂为十二烷基硫酸钠。
12、根据点1的药物联合组合物,其包括:
i.复合物依伐卡托制剂;和
ii.复合物鲁玛卡托制剂;和
iii.可选地,药学可接受赋形剂,
其中,所述复合物依伐卡托制剂包括:
i.依伐卡托;
ii.作为络合剂的乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆;和
iii.作为赋形剂的十二烷基硫酸钠,
其中,所述复合物依伐卡托制剂通过红外(atr)峰表征,所述红外(atr)峰位于588cm-1,628cm-1,767cm-1,842cm-1,962cm-1,1019cm-1,1108cm-1,1148cm-1,1240cm-1、1343cm-1、1370cm-1、1425cm-1、1465cm-1、1525cm-1、1567cm-1、1666cm-1和1732cm-1,且通过拉曼位移表征,所述拉曼位移处于552cm-1、648cm-1、826cm-1、845cm-1、888cm-1、932cm-1、1026cm-1、1062cm-1、1082cm-1、1129cm-1、1140cm-1、1208cm-1、1233cm-1、1262cm-1、1284cm-1、1295cm-1、1361cm-1、1450cm-1、1528cm-1、1573cm-1、1618cm-1、1677cm-1、1738cm-1、746cm-1、2884cm-1和2936cm-1,
且其中,所述复合物鲁玛卡托制剂包括:
i.鲁玛卡托;
ii.作为络合剂的乙烯吡咯烷酮和乙酸乙烯酯的共聚物;和
iii.作为赋形剂的十二烷基硫酸钠,
其中,所述复合物鲁玛卡托制剂通过红外(atr)峰表征,所述红外(atr)峰位于635cm-1,703cm-1,747cm-1,837cm-1,1021cm-1,1165cm-1,1231cm-1,1288cm-1,1369cm-1、1423cm-1、1462cm-1、1494cm-1、1667cm-1、和1731cm-1,且通过拉曼位移表征,所述拉曼位移处于553cm-1、602cm-1、635cm-1、654cm-1、747cm-1、841cm-1、899cm-1、934cm-1、1002cm-1、1021cm-1、1117cm-1、1205cm-1、1310cm-1、1352cm-1、1372cm-1、1428cm-1、1444cm-1、1497cm-1、1592cm-1、1609cm-1、1677cm-1、和1737cm-1。
13、根据点1的药物联合组合物,其中所述药物联合组合物包括复合物依伐卡托与25mg至250mg的鲁玛卡托等效复合物鲁玛卡托制剂结合的50mg至300mg的依伐卡托等效复合物依伐卡托制剂。
14、一种根据点1或点12的药物联合组合物,其包括复合物依伐卡托制剂或其药物组合物、和复合物鲁玛卡托制剂或其药物组合物,二者总量基于所述药物组合物的总重量为约10.0重量%至100.0重量%。
15、一种根据点1或点12的药物联合组合物,其包括复合物依伐卡托制剂或其药物组合物、和复合物鲁玛卡托制剂或其药物组合物,二者总量基于所述药物组合物的总重量为约50.0重量%至100.0重量%。
16、根据点1的药物联合组合物,其中,所述药物联合组合物具有增加的溶出度。
17、一种根据点1的依伐卡托的复合物的制备方法,所述方法包括:将含有依伐卡托和络合剂的药学可接受溶液和含有至少一种药学可接受赋形剂的水性溶液混合的步骤,所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆,所述药学可接受赋形剂为十二烷基硫酸钠。
18、一种根据点1的鲁玛卡托的复合物的制备方法,所述方法包括:将含有鲁玛卡托和络合剂的药学可接受溶液和含有至少一种药学可接受赋形剂的水性溶液混合的步骤,所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物,所述药学可接受赋形剂为十二烷基硫酸钠。
19、一种根据点1的依伐卡托和鲁玛卡托的复合物的制备工艺,所述工艺包括:将含有依伐卡托和鲁玛卡托、以及络合剂的药学可接受溶液和含有至少一种药学可接受赋形剂的水性溶液混合的步骤,所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物,所述药学可接受赋形剂为十二烷基硫酸钠。
20、根据点17至19的方法,其中,所述方法在连续流动仪中执行。
21、根据点20的方法,其中,所述连续流动仪为微流体流动仪。
22、根据点17-21的方法,其中,所述药学可接受溶液的药学可接受溶剂选自水、甲醇、乙醇、异丙醇、正丙醇、丙酮、乙腈、二甲基亚砜、四氢呋喃、或其组合。
23、根据点22的工艺,其中,所述药学可接受溶液的药学可接受溶剂为甲醇、四氢呋喃、或四氢呋喃和甲醇的溶剂混合物。
24、根据点17至19的方法,其中,所述药学可接受溶剂和所述水性溶液是可彼此混溶的,并且所述水性溶液包括0.1至99.9重量%的最终溶液。
25、一种药物联合组合物,其包括根据点1的药物联合组合物和药学可接受载体。
26、根据点25的药物联合组合物,其中,所述药物组合物适合于口服、肺、直肠、结肠、肠胃外、脑池内、阴道内、腹膜内、眼、耳、表面局部(local)、口腔、鼻腔或表面给药。
27、根据点26的药物联合组合物,其中所述药物组合物适合于口服给药。
28、包括根据点25的包括所述的药物组合物的药物联合组合物,其中,所述药物组合物包括根据点1的复合制剂的速溶颗粒。
29、根据点28的药物联合组合物,其中,所述速溶颗粒剂适合于散剂剂型的制备。
30、一种根据点1的药物联合组合物,其用于cftr介导的疾病的治疗。
31、根据点28的用途,其中,所述cftr介导的疾病选自囊性纤维化(cysticfibrosis)、哮喘、吸烟引起的慢性阻塞性肺病(smokeinducedcopd)、慢性支气管炎、鼻窦炎、便秘、胰腺炎、胰功能不全、先天性双侧输精管缺如(cbavd)引起的男性不育、轻度肺病、特发性胰腺炎、过敏性支气管肺曲霉病(abpa)、肝脏疾病、遗传性肺气肿、遗传性血色素沉着症、凝血-纤维蛋白溶解缺陷症如蛋白c缺陷症、1型遗传性血管性水肿、脂质处理缺陷如家族性高胆固醇血症、1型乳糜微粒血症、无β脂蛋白血症、溶酶体贮积症如包涵体细胞病/伪赫勒氏病(i-celldisease/pseudo-hurler)、粘多糖病、桑德霍夫/神经节苷脂沉积病(sandhof/tay-sachs)、克里格勒-纳贾尔综合征ii型(crigler-najjartypeii)、多内分泌腺病/高胰岛素血症、糖尿病、拉伦侏儒症,髓过氧化物酶缺乏症、原发性甲状旁腺功能减退症、黑色素瘤、1型先天性糖基化病cdg(glycanosiscdgtype1)、先天性甲状腺功能亢进症、成骨不全症、遗传性低纤维蛋白原血症、act缺乏症、尿崩症(di)、神经生理性di、肾性di、沙-马-图综合征(charcot-marietoothsyndrome)、佩-梅病(perlizaeus-merzbacherdisease)、神经退行性疾病如阿尔茨海默病、帕金森病、肌萎缩侧索硬化症、进行性核上性麻痹、皮克病、若干多聚谷氨酰胺神经障碍如亨廷顿氏病(huntington’s)、脊髓小脑性共济失调i型、脊髓和延髓肌萎缩、齿状核红核苍白球路易体萎缩症和肌强直性营养不良、以及海绵状脑病如遗传性克-雅病(creutzfeldt-jakobdisease,由于朊蛋白加工缺陷)、法布里病(fabrydisease)、斯托斯勒-谢恩克尔综合症(straussler-scheinkersyndrome)、慢性阻塞性肺病、干眼症、或干燥综合征、骨质疏松症、骨质减少、骨愈合和骨生长(包括骨修复、骨再生、减少骨再吸收和增加骨沉积)、戈汉综合征(gorham'ssyndrome)、氯化物通道病如先天性肌强直(汤姆森和贝克尔形式)、巴特综合征iii型(bartter'ssyndrometypeiii)、登特氏病(dent'sdisease)、过度惊骇症、癫痫、溶酶体贮积症、安格尔曼综合征(angelmansyndrome)、和原发性纤毛运动障碍(pcd),pcd是用于遗传性纤毛结构和/或功能紊乱的术语,其包括伴有内脏转位的pcd(也称为卡塔格内氏综合征)、无内脏转位的pcd和睫状体发育不全。
32、一种cftr介导的疾病的治疗方法,其包括:治疗有效量的根据点1的药物联合组合物、或根据点25的药物组合物的给药。
33、根据点1的药物联合组合物,其中,所述药物组合物还包括一种或多种另外的活性剂。
34、根据点31的药物联合组合物,其中,所述另外的活性剂选自用于cftr介导的疾病的治疗的试剂。
发明描述
本文中公开了一种药物联合组合物,其包括以下成分的混合物:
a)稳定的复合物依伐卡托制剂;和
b)稳定的复合物鲁玛卡托制剂;和
c)可选地,药学可接受赋形剂。
在一些实施方案中,本发明的药物联合组合物可另外包括:一种或多种药学可接受赋形剂、辅助材料(auxiliarymaterial)、载体、活性剂、或其组合。
在一实施方案中,所述药物联合组合物适合于口服给药。
在一些实施方案中,所述药物联合组合物适合于作为散剂形式(sachetform)中的液体分散颗粒口服给药。
在一些实施方案中,可以基于体重,通过以所需量施用本发明的药物组合物,调节所述药物联合组合物的每日人体剂量。
在一实施方案中,所述药物联合组合物可从0岁开始口服给药。
在一实施方案中,所述复合制剂和所述药物组合物用于制造用于cftr介导的疾病的治疗的药物。
在一实施方案中,所述复合制剂和所述药物组合物用于cftr介导的疾病的治疗。
cftr介导的疾病选自囊性纤维化、哮喘、吸烟引起的慢性阻塞性肺病(copd)、慢性支气管炎、鼻窦炎、便秘、胰腺炎、胰腺功能不全、先天性双侧输精管缺如(cbavd)引起的男性不育、轻度肺病、特发性胰腺炎、过敏性支气管肺曲霉病(allergicbronchopulmonaryaspergillosis,abpa)、肝脏疾病、遗传性肺气肿、遗传性血色素沉着症(hereditaryhemochromatosis)、凝血-纤维蛋白溶解缺陷症如蛋白c缺陷症、1型遗传性血管性水肿、脂质处理缺陷如家族性高胆固醇血症、1型乳糜微粒血症、无β脂蛋白血症、溶酶体贮积症如包涵体细胞病/伪赫勒氏病、粘多糖病、桑德霍夫/神经节苷脂沉积病、克里格勒-纳贾尔综合征ii型、多内分泌腺病/高胰岛素血症、糖尿病、拉伦侏儒症,髓过氧化物酶缺乏症、原发性甲状旁腺功能减退症、黑色素瘤、1型先天性糖基化病cdg(glycanosiscdgtype1)、先天性甲状腺功能亢进症、成骨不全症、遗传性低纤维蛋白原血症、act缺乏症、尿崩症(di)、神经生理性di、肾性di、沙-马-图综合征、佩-梅病、神经退行性疾病如阿尔茨海默病、帕金森病、肌萎缩侧索硬化症、进行性核上性麻痹、皮克病、若干多聚谷氨酰胺神经障碍如亨廷顿氏病、脊髓小脑性共济失调i型、脊髓和延髓肌萎缩、齿状核红核苍白球路易体萎缩症和肌强直性营养不良、以及海绵状脑病如遗传性克-雅病(由于朊蛋白加工缺陷)、法布里病、斯托斯勒-谢恩克尔综合症、慢性阻塞性肺病、干眼症、或干燥综合征、骨质疏松症、骨质减少、骨愈合和骨生长(包括骨修复、骨再生、减少骨再吸收和增加骨沉积)、戈汉综合征、氯化物通道病如先天性肌强直(汤姆森和贝克尔形式)、巴特综合征iii型、登特氏病、过度惊骇症、癫痫、溶酶体贮积症、安格尔曼综合征、和原发性纤毛运动障碍(pcd),pcd是用于遗传性纤毛结构和/或功能紊乱的术语,其包括伴有内脏转位的pcd(也称为卡塔格内氏综合征)、无内脏转位的pcd和睫状体发育不全。
在一实施方案中,一种cftr介导的疾病的治疗方法,其包括:治疗有效量的如本文中描述的复合制剂或其药物联合组合物的给药。
在一实施方案中,所述药物组合物还包括一种或多种另外的活性剂。
在一实施方案中,所述另外的活性剂选自用于cftr介导的疾病的治疗的药剂。
在一实施方案中,所述药物组合物包括复合物依伐卡托制剂结合复合物鲁玛卡托制剂以及进一步可选地药学可接受赋形剂,其特征在于,其具有以下特性中的至少一项:
a)在生理相关介质中是瞬时可再分散的;
b)在固体形式中和在胶体溶液和/或分散体中是稳定的;
c)复合物依伐卡托和/或复合物鲁玛卡托制剂具有在水中的至少1mg/ml的表观溶解度;
d)当分散在fassif或fessif生物相关介质中时,复合物依伐卡托和复合物鲁玛卡托制剂,或它们的药物组合物具有对依伐卡托至少为0.2×10-6cm/s的pampa渗透率、对鲁玛卡托至少为2×10-6cm/s的pampa渗透率,所述pampa渗透率在至少6个月的时间内不会降低;
e)具有增加的溶出度:在生物相关介质中,5分钟内80%的依伐卡托和80%的鲁玛卡托从药物组合物中释放;
f)不表现出可观察到的食物效应;
g)具有改进的依伐卡托和鲁玛卡托的生物利用度。
下面,将详细描述本发明中使用的依伐卡托复合物。
本发明中使用的复合物依伐卡托制剂包括:依伐卡托;络合剂、和作为药学可接受赋形剂的十二烷基硫酸钠;所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆,所述复合物特征在于,它们具有以下特性中的至少一项:
a)在生理相关介质中是瞬时可再分散的;
b)在固体形式中和在胶体溶液和/或分散体中是稳定的;
c)具有在水中至少为1mg/ml的表观溶解度;
d)当分散在fassif或fessif生物相关介质中时,具有至少2×10-6cm/s的pampa渗透率,该pampa渗透率在至少6个月的时间内不会降低;
e)没有表现出可观察到的食物效应。
在一实施方案中,本发明中使用的所述依伐卡托复合物具有(a)至(e)中所述的特性中的至少两项。
在一实施方案中,本发明中使用的所述依伐卡托复合物具有(a)至(e)中所述的特性中的至少三项。
本发明中使用的依伐卡托制剂具有瞬时再分散性,增加的表观溶解度和渗透率,没有可观察到的食物效应,这提供了精确给药和易于给药以溶液形式的重构复合物机会。
术语“依伐卡托”通常用于依伐卡托、或者其盐或其衍生物。
在一实施方案中,用于如本发明中使用的依伐卡托复合物中的所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆。
在一实施方案中,用于如本发明中使用的依伐卡托复合物中的所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物。
在一实施方案中,所述乙烯吡咯烷酮和乙酸乙烯酯的共聚物具有乙基吡咯烷酮单体与乙酸乙烯酯单体为60:40的重量比。
在一实施方案中,所述泊洛沙姆为泊洛沙姆338。
在一实施方案中,所述泊洛沙姆为泊洛沙姆407。
在一实施方案中,用于如本发明中使用的依伐卡托复合物的所述药学可接受赋形剂为十二烷基硫酸钠。
在一实施方案中,用于如本发明中使用的依伐卡托复合物的络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和泊洛沙姆,且所述药学可接受赋形剂为十二烷基硫酸钠,且
a)所述依伐卡托复合物通过红外光谱(atr)表征,所述红外光谱(atr)具有位于588cm-1、628cm-1、767cm-1、842cm-1、962cm-1、1019cm-1、1108cm-1、1148cm-1、1240cm-1、1343cm-1、1370cm-1、1425cm-1、1465cm-1、1525cm-11567cm-1、1666cm-1和1732cm-1的特征吸收峰。
b)所述依伐卡托复合物具有在552cm-1、648cm-1、826cm-1、845cm-1、888cm-1、932cm-1、1026cm-1、1062cm-1、1082cm-1、1129cm-1、1140cm-1、1208cm-1、1233cm-1、1262cm-1、1284cm-1、1295cm-1、1361cm-1、1450cm-1、1528cm-1、1573cm-1、1618cm-1、1677cm-1、1738cm-1、746cm-1、2884cm-1和2936cm处的特征拉曼位移。
在一些实施方案中,所述组合物可另外包括:一种或多种药学可接受赋形剂、辅助材料、载体、活性剂、或其组合。
在一实施方案中,本发明中使用的所述依伐卡托复合物具有处于10nm和600nm之间的粒径。
在一实施方案中,本发明中使用的所述依伐卡托复合物具有范围在10nm和400nm之间的粒径。
在一实施方案中,本发明中使用的所述依伐卡托复合物在生理相关介质中是瞬时可再分散的。
在一实施方案中,相比于市售形式的单独的和联合使用的依伐卡托(
在一实施方案中,本发明中使用的所述依伐卡托复合物在固体形式中和在胶体溶液和/或分散体中是稳定的。
在一实施方案中,本发明中使用的所述依伐卡托复合物具有在水中至少1mg/ml的表观溶解度。
在一实施方案中,本发明中使用的所述依伐卡托复合物在固体形式中呈现出x射线无定形特征。
在一实施方案中,当分散在蒸馏水中时,本发明中使用的所述依伐卡托复合物具有至少2×10-6cm/s的pampa渗透率,该pampa渗透率在至少6个月的时间内不会降低。
在一实施方案中,相比于市售形式的单独的和联合使用的依伐卡托(
在一实施方案中,本发明中使用的所述依伐卡托复合物不具有可观察到的食物效应,这使得有精确给药并易于给药以溶液形式的重构的复合物的机会。
在一实施方案中,含有乙烯吡咯烷酮和乙酸乙烯酯的共聚物以及泊洛沙姆以及十二烷基硫酸钠的本发明中使用的所述依伐卡托复合物,或其药物组合物通过如图11所示的拉曼光谱和如图12所示的红外光谱表征。
在一实施方案中,本发明中使用的所述依伐卡托复合物通过位于552cm-1、648cm-1、826cm-1、845cm-1、888cm-1、932cm-1、1026cm-1、1062cm-1、1082cm-1、1129cm-1、1140cm-1、1208cm-1、1233cm-1、1262cm-1、1284cm-1、1295cm-1、1361cm-1、1450cm-1、1528cm-1、1573cm-1、1618cm-1、1677cm-1、1738cm-1、746cm-1、2884cm-1和2936cm-1处的特征拉曼位移表征。
在一实施方案中,本发明中使用的所述依伐卡托复合物通过位于1082cm-1、1233cm-1、1284cm-1、1361cm-1、1528cm-1、1618cm-1和1738cm-1处的特征拉曼位移表征。
在一实施方案中,本发明中使用的所述依伐卡托复合物通过红外光谱表征,所述红外光谱具有在588cm-1、628cm-1、767cm-1、842cm-1、962cm-1、1019cm-1、1108cm-1、1148cm-1、1240cm-1、1343cm-1、1370cm-1、1425cm-1、1465cm-1、1525cm-1、1567cm-1、1666cm-1和1732cm-1处的特征峰。
在一实施方案中,本发明中使用的所述依伐卡托复合物通过红外光谱表征,所述红外光谱具有在628cm-1、767cm-1、1108cm-1、1370cm-1、1465cm-1和1666cm-1处的特征峰。
在一实施方案中,本发明中使用的所述依伐卡托复合物包括:
a)依伐卡托、或包括依伐卡托的活性化合物的组合物;
b)络合剂,其为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆;和
c)作为药学可接受赋形剂的十二烷基硫酸钠。
在一实施方案中,本发明中使用的所述依伐卡托复合物包括:络合剂,其为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆,该泊洛沙姆为泊洛沙姆407或泊洛沙姆338;和药学可接受赋形剂,其为十二烷基硫酸钠,二者的总量包括基于复合物总重量的约1.0重量%至约95.0重量%。
在一实施方案中,本发明中使用的所述依伐卡托复合物包括:络合剂,其为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆,该泊洛沙姆为泊洛沙姆407或泊洛沙姆338;和药学可接受赋形剂,其为十二烷基硫酸钠,二者的总量包括基于复合物总重量的约50重量%至约95重量%。
本发明中使用的依伐卡托的稳定复合物包括:
a.5至40重量%的依伐卡托、或者其盐或衍生物;
b.20至80重量%的乙烯吡咯烷酮和乙酸乙烯酯的共聚物;
c.5至40重量%的十二烷基硫酸钠;和可选地
d.0至50重量%的泊洛沙姆。
本发明中使用的依伐卡托的稳定复合物的制造包括将含有依伐卡托和至少一种络合剂和可选地一种或多种药学可接受赋形剂与含有可选地至少一种药学可接受赋形剂的水性溶液混合的步骤。
在一实施方案中,本发明中使用的所述依伐卡托复合物是通过混合法而获得的。
在一实施方案中,本发明中使用的所述依伐卡托复合物是通过连续流动混合法而获得的。
在一实施方案中,所述工艺在连续流动仪中执行。
在一实施方案中,所述连续流动仪为微流体流动仪。
在一实施方案中,本发明中使用的所述依伐卡托复合物不是通过研磨法、高压均质化法、包封法和固体分散法而获得的。
在一实施方案中,所述药学可接受溶液的溶剂选自水、甲醇、乙醇、1-丙醇、2-丙醇、丙酮、乙腈、二甲基亚砜、四氢呋喃、甲基乙基酮、或其组合。
在一实施方案中,所述药学可接受溶剂为四氢呋喃。
在一实施方案中,所述药学可接受溶剂和所述水性溶液是可彼此混溶的。
在一实施方案中,所述水性溶液包括0.1至99.9重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至90重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至80重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至70重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至60重量%的最终溶液。
在一实施方案中,所述水性溶液包括45至55重量%的最终溶液。
在一实施方案中,所述水性溶液包括50重量%的最终溶液。
在一实施方案中,所述水性溶液包括35至45重量%的最终溶液。
在一实施方案中,所述水性溶液包括25至35重量%的最终溶液。
在一实施方案中,所述水性溶液包括15至25重量%的最终溶液。
在一实施方案中,所述水性溶液包括5至15重量%的最终溶液。
在一实施方案中,一种药物组合物,其包括依伐卡托复合物和药学可接受载体。
下面,将详细描述本发明中使用的鲁玛卡托复合物。
本发明中使用的复合物鲁玛卡托制剂包括:鲁玛卡托、络合剂、和作为药学可接受赋形剂的十二烷基硫酸钠,所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物,所述复合物特征在于,它们具有以下特性中的至少一项:
a)在生理相关介质中是瞬时可再分散的;
b)在固体形式中和在胶体溶液和/或分散体中是稳定的;
c)在水中的表观溶解度至少为1mg/ml;
d)当分散在fassif或fessif生物相关介质中时,具有至少2×10-6cm/s的pampa渗透率,该pampa渗透率在至少6个月的时间内不会降低;
e)没有表现出可观察到的食物效应。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物具有(a)至(e)
中所述的特性中的至少两项。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物具有(a)至(e)中所述的特性中的至少三项。
本发明中使用的鲁玛卡托复合制剂具有瞬时的再分散性、在预期提供完全吸收并消除食物效应的禁食和进食状态模拟中的增加的表观溶解度和渗透率,这提供了精确给药并易于给药以溶液形式的重构复合物的机会。
术语“鲁玛卡托”通常用于鲁玛卡托、或者其盐或其衍生物。
在一实施方案中,用于如本发明中使用的鲁玛卡托复合物中的所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物。
在一实施方案中,所述乙烯吡咯烷酮和乙酸乙烯酯的共聚物具有乙烯吡咯烷酮单体与乙酸乙烯酯单体为60:40的重量比。
在一实施方案中,用于如本发明中使用的鲁玛卡托复合物的所述药学可接受赋形剂为十二烷基硫酸钠。
在一实施方案中,所述鲁玛卡托复合制剂的特征在于:
a)在553cm-1、602cm-1、635cm-1、654cm-1、747cm-1、841cm-1、899cm-1、934cm-1、1002cm-1、1021cm-1、1117cm-1、1205cm-1、1310cm-1、1352cm-1、1372cm-1、1428cm-1、1444cm-1、1497cm-1、1592cm-1、1609cm-1、1677cm-1、和1737cm-1处的拉曼位移;和
b)位于635cm-1,703cm-1,747cm-1,837cm-1,1021cm-1,1165cm-1,1231cm-1,1288cm-1,1369cm-1、1423cm-1、1462cm-1、1494cm-1、1667cm-1、和1731cm-1处的红外(atr)峰。
在一些实施方案中,药物组合物可另外包括:一种或多种药学可接受赋形剂、辅助材料、载体、活性剂、或其组合。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物具有处于10nm和500nm之间的粒径。
在一实施方案中,所述粒径处于10nm和250nm之间。
在一实施方案中,相比于市售形式的鲁玛卡托(晶体形式的鲁玛卡托),本发明中使用的所述鲁玛卡托复合物具有增加的溶出度。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物在固体形式中和在胶体溶液和/或分散体中是稳定的。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物具有在水中的至少1mg/ml的表观溶解度。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物在固体形式中呈现出x射线无定形特征。
在一实施方案中,当分散在蒸馏水中时,本发明中使用的所述鲁玛卡托复合物具有至少2×10-6cm/s的pampa渗透率,该pampa渗透率在至少1个月、优选6个月的时间内不会降低。
在一实施方案中,与市售形式
在一实施方案中,本发明中使用的所述鲁玛卡托复合物在体外不具有可观察到的食物效应,这使得有精确给药并易于给药以溶液的形式重构复合物的机会。
在一实施方案中,本发明使用的所述鲁玛卡托复合物或其药物组合物通过图13中所示的拉曼光谱和图14中所示的红外光谱表征。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物通过位于553cm-1、602cm-1、635cm-1、654cm-1、747cm-1、841cm-1、899cm-1、934cm-1、1002cm-1、1021cm-1、1117cm-1、1205cm-1、1310cm-1、1352cm-1、1372cm-1、1428cm-1、1444cm-1、1497cm-1、1592cm-1、1609cm-1、1677cm-1、和1737cm-1处的拉曼位移表征。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物通过635cm-1,703cm-1,747cm-1,837cm-1,1021cm-1,1165cm-1,1231cm-1,1288cm-1,1369cm-1、1423cm-1、1462cm-1、1494cm-1、1667cm-1、和1731cm-1处的红外(atr)峰表征。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物包括:
a)鲁玛卡托、或包括鲁玛卡托的活性化合物的组合物;
b)络合剂,其为乙烯吡咯烷酮和乙酸乙烯酯的共聚物;和
c)作为赋形剂的十二烷基硫酸钠。
在一实施方案中,本发明中使用的所述复合物鲁玛卡托制剂包括:络合剂,其为乙烯吡咯烷酮和乙酸乙烯酯的共聚物;和药学可接受赋形剂,其为十二烷基硫酸钠,二者的总量基于所述复合物的总重量约1.0重量%至约95.0重量%。
在一实施方案中,本发明中使用的所述复合物鲁玛卡托复合物包括:络合剂,其为乙烯吡咯烷酮和乙酸乙烯酯的共聚物;和药学可接受赋形剂,其为十二烷基硫酸钠,二者包括基于所述复合物的总重量约50重量%至约95重量%的重量。
本发明中使用的鲁玛卡托的稳定复合物包括:
a)5至40重量%的鲁玛卡托、其盐、或其衍生物;
b)50至90重量%的乙烯吡咯烷酮和乙酸乙烯酯的共聚物;
c)0.01至40重量%的十二烷基硫酸钠。
本发明中使用的鲁玛卡托的稳定复合物的制造包括将含有鲁玛卡托和至少一种络合剂和可选地一种或多种药学可接受赋形剂与含有可选地至少一种药学可接受赋形剂的水性溶液混合的步骤。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物是通过混合法而获得的。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物是通过连续流动混合法而获得的。
在一实施方案中,所述复合物在连续流动仪中执行。
在一实施方案中,所述连续流动仪为微流体流动仪。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物不是通过研磨法、高压均质化法、包封法和固体分散法而获得的。
在一实施方案中,所述药学可接受溶液的溶剂选自甲醇、乙醇、1-丙醇、2-丙醇、丙酮、乙腈、二甲基亚砜、四氢呋喃、甲基乙基酮、或其组合。
在一实施方案中,所述药学可接受溶剂为甲醇。
在一实施方案中,所述药学可接受溶剂和所述水性溶液是可彼此混溶的。
在一实施方案中,所述水性溶液包括0.1至99.9重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至90重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至80重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至70重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至60重量%的最终溶液。
在一实施方案中,所述水性溶液包括45至55重量%的最终溶液。
在一实施方案中,所述水性溶液包括50重量%的最终溶液。
在一实施方案中,所述水性溶液包括35至45重量%的最终溶液。
在一实施方案中,所述水性溶液包括25至35重量%的最终溶液。
在一实施方案中,所述水性溶液包括15至25重量%的最终溶液。
在一实施方案中,所述水性溶液包括5至15重量%的最终溶液。
在一实施方案中,一种药物组合物,其包括该复合物和药学可接受载体。
在一实施方案中,络合物自身或与药学可接受赋形剂一起具有通过非共价次级相互(secondaryinteraction)作用来形成具有活性药物成分的复合物结构的功能。该次级相互作用可以通过静电相互作用来形成,例如离子相互作用、h-键、偶极-偶极相互作用、偶极-诱导偶极相互作用、伦敦色散力、π-π相互作用、和疏水相互作用。络合剂、药学可接受赋形剂和活性成分选自能够通过非共价次级相互作用形成这样的复合结构的络合剂、药学可接受赋形剂和活性成分的组。
下面,将详细描述本发明中使用的药物联合组合物。
本发明中使用的药物联合组合物包括:
a)复合物依伐卡托制剂,其包括:依伐卡托、络合剂、和作为药学可接受赋形剂的十二烷基硫酸钠,所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆;和
b)复合物鲁玛卡托制剂,其包括:鲁玛卡托、络合剂、和作为赋形剂的十二烷基硫酸钠,所述络合剂为乙烯吡咯烷酮和乙酸乙烯酯的共聚物;和
c)任选地,药学可接受赋形剂,
其中,所述药物联合组合物的特征在于它们具有以下特性中的至少一项:
a)在生理相关介质中是瞬时可再分散的;
b)在固体形式中和在胶体溶液和/或分散体中是稳定的;
c)依伐卡托和鲁玛卡托在水中的表观溶解度均至少为1mg/ml;
d)当分散在fassif或fessif生物相关介质中时,依伐卡托和鲁玛卡托复合制剂的pampa渗透率对依伐卡托至少为0.2×10-6cm/s、对鲁玛卡托至少为2×10-6cm/s,该pampa渗透率在至少6个月的时间内不会降低;
e)在体外没有表现出可观察到的食物效应。
在一实施方案中,本发明中使用的所述药物联合组合物具有(a)至(e)中所述特性中的至少两项。
在一实施方案中,本发明中使用的所述药物联合组合物具有(a)至(e)中所述特性中的至少三项。
本发明中使用的药物联合组合物具有瞬时再分散性、在预期提供完全吸收和食物效应的消除的禁食和进食状态模拟中的增加的表观溶解度和渗透率,这提供了精确给药并易于给药以溶液形式的重构药物联合组合物的机会。
在一些实施方案中,所述药物联合组合物可另外包括:一种或多种药学可接受赋形剂、辅助材料、载体、活性剂或其组合。
在一实施方案中,相比于市售形式
在一实施方案中,本发明中使用的所述药物联合组合物在固体形式中和在胶体溶液和/或分散体中是稳定的。
当分散在水或生物相关介质中时,本发明中使用的所述药物联合组合物对依伐卡托和鲁玛卡托复合制剂均具有pampa渗透率,对依伐卡托至少为0.2×10-6cm/s、对鲁玛卡托至少为2×10-6cm/s,该pampa渗透率在至少6个月的时间内不会降低。
在一实施方案中,与市售形式
在一实施方案中,本发明中使用的所述药物联合组合物在体外不具有可观察到的食物效应,这使得有精确给药并易于给药以溶液形式的重构药物联合组合物的机会。
在一实施方案中,本发明中使用的所述药物联合组合物包括:络合剂,其为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆;和药学可接受赋形剂,其为十二烷基硫酸钠,二者的总量基于该药物联合组合物的总重量约1.重量%至约95.0重量%。
在一实施方案中,本发明中使用的所述药物联合组合物包括:络合剂,其为乙烯吡咯烷酮和乙酸乙烯酯的共聚物和可选地泊洛沙姆;和药学可接受赋形剂,其为十二烷基硫酸钠,包括该药物联合组合物的总重量的约50重量%至约95重量%。
在一实施方案中,所述药物联合组合物包括50mg至300mg的依伐卡托等效复合物依伐卡托制剂与25mg至250mg的鲁玛卡托等效复合物鲁玛卡托制剂的组合。
在一实施方案中,本发明中使用的药物联合组合物的制造包括:将含有依伐卡托和至少一种络合剂和可选地一种或多种药学可接受赋形剂与含有可选地至少一种药学可接受赋形剂的水性溶液混合、并将所得溶液混合物固化的步骤;和将含有鲁玛卡托和至少一种络合剂和可选地一种或多种药学可接受赋形剂与含有可选地至少一种药学可接受赋形剂的水性溶液混合、并将所得溶液混合物固化的步骤;和将固化的依伐卡托和鲁玛卡托复合制剂共混并造粒的步骤。
在一实施方案中,本发明中使用的药物联合组合物的制造包括:将含有依伐卡托、鲁玛卡托和至少一种络合剂和可选地一种或多种药学可接受赋形剂与含有可选地的至少一种药学可接受赋形剂的水性溶液混合的步骤。
在一实施方案中,本发明中使用的所述依伐卡托复合物是通过混合法而获得的。
在一实施方案中,本发明中使用的所述鲁玛卡托复合物是通过混合法而获得的。
在一实施方案中,本发明中使用的所述依伐卡托和鲁玛卡托是通过混合法而获得的。
在一实施方案中,所述混合工艺为连续流动混合法。
在一实施方案中,所述工艺在连续流动仪中执行。
在一实施方案中,所述连续流动仪为微流体流动仪。
在一实施方案中,所述药学可接受溶液的溶剂选自甲醇、乙醇、1-丙醇、2-丙醇、丙酮、乙腈、二甲基亚砜、四氢呋喃、甲基乙基酮或其组合。
在一实施方案中,所述药学可接受溶剂为甲醇和四氢呋喃的溶剂混合物。
在一实施方案中,所述药学可接受溶剂和所述水性溶液是可彼此混溶的。
在一实施方案中,所述水性溶液包括0.1至99.9重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至90重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至80重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至70重量%的最终溶液。
在一实施方案中,所述水性溶液包括50至60重量%的最终溶液。
在一实施方案中,所述水性溶液包括45至55重量%的最终溶液。
在一实施方案中,所述水性溶液包括50重量%的最终溶液。
在一实施方案中,所述水性溶液包括35至45重量%的最终溶液。
在一实施方案中,所述水性溶液包括25至35重量%的最终溶液。
在一实施方案中,所述水性溶液包括15至25重量%的最终溶液。
在一实施方案中,所述水性溶液包括5至15重量的%最终溶液。
在一实施方案中,一种药物组合物,其包括该复合物和药学可接受载体。
包括复合物依伐卡托和复合物鲁玛卡托制剂的本发明的药物联合组合物可以配制成:(a)用于选自由口服、肺、直肠、结肠、肠胃外、脑池内、阴道内、腹膜内、眼、耳、局部、口腔、鼻腔或表面给药组成的组的给药;(b)选自由液体分散剂、凝胶、气溶胶、软膏、乳膏、冻干制剂、片剂、胶囊剂组成的组的剂型;(c)选自由控释制剂、快速熔化制剂、延迟释放制剂、延长释放制剂、脉冲释放制剂、以及混合速释和控释制剂组成的组的剂型;或(d)上述(a)、(b)、(c)的任何组合。
所述药物联合组合物可通过添加不同类型的用于以固体、液体、局部(粉末、膏剂或液滴)等口服给药、或者表面给药的药学可接受赋形剂来配制。
在一实施方案中,本发明的剂型为固体剂型,虽然可以利用任何药学可接受剂型。
用于口服给药的固态剂型包括,但不限于:胶囊剂、片剂、丸剂、粉末剂(袋剂)和颗粒剂。在这些固体剂型中,本发明的复合制剂与下列中的至少一种混合:一种或多种惰性赋形剂(或载体):(a)填充剂(filler)或增量剂,例如,乳糖、蔗糖、葡萄糖、甘露醇、山梨糖醇、右旋糖(dextrose)、淀粉水解寡糖(dextrates)、糊精、赤藓糖醇、果糖、异麦芽酮糖醇(isomalt)、乳糖醇、麦芽糖醇、麦芽糖、麦芽糖糊精、海藻糖、木糖醇、淀粉、微晶纤维素、磷酸二钙、碳酸钙、碳酸镁、氧化镁;(b)甜味剂、调味剂、芳化剂和芳香剂(aromatizingandperfumingagent),例如糖精、糖精钠、乙酰磺胺酸钾、阿利甜、阿斯巴甜、甘氨酸、菊粉、新橙皮苷二氢查尔酮、纽甜、甜蜜素、三氯蔗糖、塔格糖、奇异果甜蛋白、柠檬酸、己二酸、富马酸酸、亮氨酸、苹果酸、薄荷醇、丙酸、酒石酸;(c)粘结剂,例如纤维素衍生物、丙烯酸衍生物、藻酸盐、明胶、聚乙烯吡咯烷酮、淀粉衍生物、右旋糖、淀粉水解寡糖、糊精、麦芽糖、麦芽糖糊精;(d)崩解剂,例如交联聚乙烯吡咯烷酮(crospovidon)、泡腾组合物、交联羧甲基纤维素钠和其它纤维素衍生物、羟基乙酸淀粉钠和其它淀粉衍生物、海藻酸、某些复合硅酸盐和碳酸钠;(e)溶液缓凝剂,例如丙烯酸系化合物、纤维素衍生物、石蜡;(f)吸收促进剂,例如季铵化合物;(g)润湿剂,例如聚山梨醇酯、鲸蜡醇和单硬脂酸甘油酯;(h)润滑剂,例如滑石、硬脂酸及其衍生物、固体聚乙二醇、十二烷基硫酸钠、山嵛酸甘油酯、中链甘油三酯或其混合物。对于胶囊剂、片剂和丸剂,剂型也可包括缓冲剂。
在一实施方案中,本发明的剂型为散剂型中的液体分散颗粒剂。
在一实施方案中,所述液体分散颗粒剂包括所述复合物依伐卡托制剂和所述符合鲁玛卡托制剂和可选地药学可接受赋形剂。
在一实施方案中,所述药学可接受赋形剂选自填充剂或增量剂的组,例如,乳糖、蔗糖、葡萄糖、甘露醇、山梨糖醇、右旋糖、淀粉水解寡糖、糊精、赤藓糖醇、果糖、异麦芽酮糖醇、乳糖醇、麦芽糖醇、麦芽糖、麦芽糖糊精、海藻糖、木糖醇、淀粉、微晶纤维素、磷酸二钙、碳酸钙、碳酸镁、氧化镁。
在一实施方案中,所述药学可接受赋形剂选自甜味剂、调味剂、芳化剂和芳香剂的组,例如糖精、糖精钠、乙酰磺胺酸钾、阿利甜、阿斯巴甜、甘氨酸、菊粉、新橙皮苷二氢查尔酮、纽甜、甜蜜素、三氯蔗糖、塔格糖、奇异果甜蛋白、柠檬酸、己二酸、富马酸、亮氨酸、苹果酸、薄荷醇、丙酸、酒石酸。
本文中还公开了一种液体分散颗粒,其包括:
a)25至95%药物联合组合物,所述药物联合组合物包括复合物依伐卡托和复合物鲁玛卡托制剂;
b)5至75%的填充剂或增量剂;
c)0.5至25%的粘结剂;
d)0.1至5%的甜味剂、调味剂、芳化剂和芳香剂,
其中,所述液体分散颗粒在3分钟内分散在液体中;并且其中,所述液体分散颗粒通过湿法或干法工艺获得。
在一实施方案中,所述分散时间处于0.1min和10min之间。
在一实施方案中,所述分散时间处于0.1min和5min之间。
在一实施方案中,所述分散时间处于0.1min和3min之间。
在一实施方案中,所述分散时间处于0.1min和1min之间。
在一实施方案中,所述液体分散颗粒的豪斯纳比值(hausnerratio)小于1.25、更优选1.00至1.18。
在一实施方案中,所述液体分散颗粒的豪斯纳比值处于1.00和1.18之间。
在一实施方案中,所述液体分散颗粒的粒径(d(90))小于2000微米。
在一实施方案中,60至99%的所述液体分散颗粒处于160微米至1200微米的尺寸范围内。
在一实施方案中,所述液体为水、唾液、其他生理上或生物学可接受流体。
本发明的药物联合组合物的优势包括,但不限于:(1)物理和化学稳定性,(2)瞬时再分散性,(3)治疗时间窗(therapeutictimewindow)中的胶体溶液或分散体中的稳定性,(4)与常规制剂相比增加的表观溶解性和渗透率,(5)没有可观察的食物效应,提供精确给药和易于给药以溶液形式的重构复合制剂的机会,(6)良好的加工性。
本发明的有益特征如下:本发明的药物组合物在水、生物相关介质(例如,生理盐水溶液,ph=2.5的hcl溶液,fassif和fessif介质、和胃肠液)中的良好/瞬时再分散性,以及在治疗时间窗中的胶体溶液和/或分散体中的足够稳定性。
在一实施方案中,本发明的药物联合组合物具有增加的表观溶解度和渗透率。在一些实施方案中,药物联合组合物的表观溶解度和渗透率为至少1mg/ml、和2x10-6cm/s。
本发明的药物联合组合物具有瞬时再分散性、增加的表观溶解度和渗透率,没有可观察到的食物效应,这提供精确剂量和易于再分散固体的给药的机会。
附图的简要说明
并入并形成说明书一部分的附图仅说明了本发明的某些实施方案,而不应被解释为限制本发明。它们旨在用于向本领域技术人员解释本发明的具体模式。
图1示出了在流程优化期间复合物依伐卡托制剂的物理外观和稳定性。
图2示出了单独的和组合的复合物依伐卡托和鲁玛卡托制剂的表观溶解度。
图3示出了来自本发明的药物组合物的依伐卡托和鲁玛卡托的胃肠道(gitract)模拟溶解。
图4示出了从通过联合喷雾干燥和粉末共混制得的药物联合组合物的依伐卡托和鲁玛卡托溶出。
图5示出了复合物依伐卡托制剂和复合物鲁玛卡托制剂的pampa渗透率。
图6示出了由粉末共混制得的药物组合物中的复合物依伐卡托制剂和复合物鲁玛卡托制剂的pampa渗透率。
图7示出了由联合喷雾干燥制得的药物联合组合物中的复合物依伐卡托制剂和复合物鲁玛卡托制剂的pampa渗透率。
图8示出了在不同条件下储存的复合物依伐卡托和复合物鲁玛卡托制剂的pampa渗透率。
图9示出了在不同条件下储存的药物组合物中复合物依伐卡托和复合物鲁玛卡托制剂的pampa渗透率。
图10示出了复合物依伐卡托(a)和复合物鲁玛卡托(b)制剂的sem照片。
图11示出了晶体依伐卡托(a)、冷冻干燥的依伐卡托(b)、复合物依伐卡托制剂(c)、安慰剂样品(在没有依伐卡托的情况下制得)(d)、巴斯夫va64(e)、十二烷基硫酸钠(f)和泊洛沙姆(泊洛沙姆338-普流尼克f108)普流尼克f108(g)的拉曼光谱。
图12示出了晶体依伐卡托(a)、无定形依伐卡托(b)、复合物依伐卡托制剂(c)、安慰剂(在没有依伐卡托的情况下制得)(d)、巴斯夫va64(e)、十二烷基硫酸钠(f)和泊洛沙姆(泊洛沙姆338-普流尼克f108)(g)的红外光谱。
图13示出了晶体鲁玛卡托(a)、无定形鲁玛卡托(b)、复合物鲁玛卡托制剂(c)、安慰剂(d)、巴斯夫va64(e)、sds(f)的拉曼光谱。
图14示出了晶体鲁玛卡托(a)、无定形鲁玛卡托(b)、复合物鲁玛卡托制剂(c)、安慰剂(d)、巴斯夫va64(e)、sds(f)的红外光谱。
图15示出了晶体依伐卡托(a、c)、复合物依伐卡托制剂(a)、鲁晶体玛卡托(b、c)和复合物鲁玛卡托制剂(b)和喷雾干燥的复合物依伐卡托和复合物鲁玛卡托制剂组合(c)的xrd衍射图。
图16示出了晶体依伐卡托、依伐卡托的固体分散体和复合物依伐卡托制剂的pampa渗透率。
图17示出了不同依伐卡托制剂的比较表观溶解度数据。
图18示出了依伐卡托的固体分散体和复合物依伐卡托制剂的比较溶出测试。
图19示出了不同的依伐卡托和鲁玛卡托制剂的粒径。
图20示出了鲁玛卡托制剂的表观溶解度。
图21示出了鲁玛卡托制剂的比较pampa渗透率。
图22示出了依伐卡托从不同药物制剂中的溶出。
图23示出了鲁玛卡托从不同药物制剂中的溶出。
图24示出了不同的
图25示出了以3mg/kg剂量对比格犬在禁食和进食状态下口服给药新型复合物后的依伐卡托的血浆浓度(n=4)。
图26示出了以3mg/kg剂量对比格犬在禁食和进食状态下口服给药新型复合物后的药代动力学参数。
实施例
将通过以下实施例进一步说明本发明的具体实施方案。应该理解的是,这些实施方案仅通过举例说明的方式公开,不应解释为限制本发明的范围。
复合物依伐卡托制剂的制造
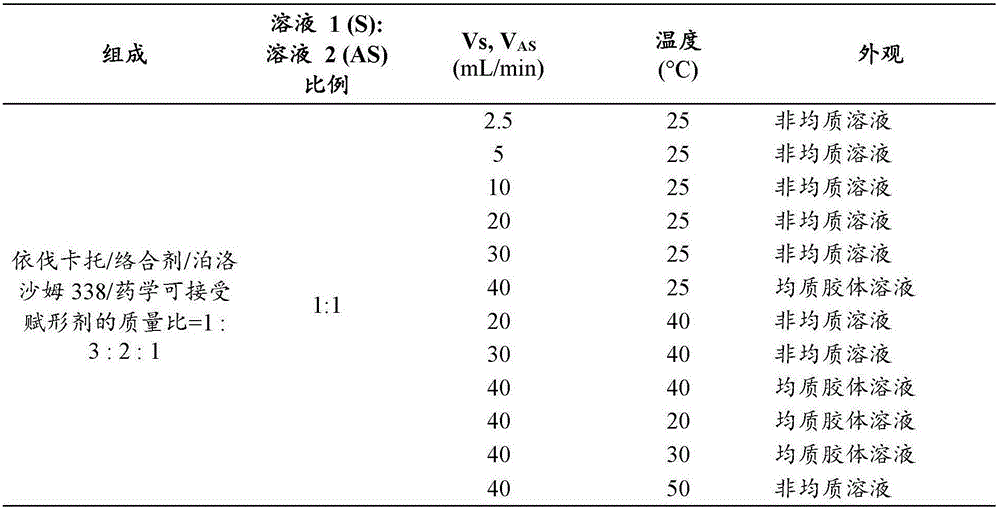
通过混合法制备本发明的复合物依伐卡托制剂的溶液混合物。将在100ml四氢呋喃中含有500mg依伐卡托和1500mg乙烯吡咯烷酮和乙酸乙烯酯共聚物(巴斯夫va64)和1000mg泊洛沙姆(泊洛沙姆338-普流尼克f108)的溶液1与在100ml超纯水中含有500mg十二烷基硫酸钠的溶液2以不同流速混合。使用1:1的溶液1:溶液2的比例。在大气压和20至50℃温度下生产复合物依伐卡托制剂的胶体溶液。监控所生产的胶体溶液的外观和稳定性。基于所生产的复合物依伐卡托制剂在胶体溶液中的物理外观和稳定性,选择最佳组合物用于喷雾干燥实验。图1汇总了结果。
通过喷雾干燥技术来执行胶体溶液的固化。四氢呋喃中5mg/ml依伐卡托、15mg/ml乙烯吡咯烷酮和乙酸乙烯酯共聚物(巴斯夫va64)和10mg/ml泊洛沙姆(泊洛沙姆338-普流尼克f108)以及水中5mg/ml十二烷基硫酸钠被选为起始浓度。发现溶液的比例在1:1比例下是最佳的。为了获得固体粉末,将由最佳的参数设置制得的复合物依伐卡托制剂的胶体溶液喷雾干燥(yamatodl-410/gas410)。优化喷雾干燥法。发现最佳的生产参数为tinlet=95℃、vair=0.8m3/min、min=18ml/min、p=1bar,tout=58-59℃。
复合物鲁玛卡托制剂的制造
通过连续流动混合方法制备鲁玛卡托复合物制剂(有时简称为“复合制剂”)的混合溶液。通过在20ml甲醇中溶解40mg鲁玛卡托和180mg乙烯吡咯烷酮和乙酸乙烯酯的共聚物,制备20ml溶液1。为了生产复合物鲁玛卡托制剂,将所制的溶液1与80ml水中含有24mg十二烷基硫酸钠的溶液2以1:4的体积比混合。在大气压和环境温度下生产复合物鲁玛卡托制剂的溶液混合物。将所生产的溶液混合物在干冰上冷冻,然后使用配备有-110℃冰冷凝器的冷冻干燥器和真空泵将其冻干。喷雾干燥也适用于从复合物鲁玛卡托制剂的溶液混合物生产固态粉末。
药物联合组合物的制造
通过将复合物依伐卡托和复合物鲁玛卡托制剂的粉末共混制备本发明的药物组合物。所得的药物组合物含有125:200活性化合物当量比的复合物依伐卡托和复合物鲁玛卡托制剂。
通过混合法制备本发明的药物联合组合物的溶液混合物。在具有体积比为5:2的甲醇和四氢呋喃的100ml溶剂混合物中含有192mg依伐卡托和308mg鲁玛卡托和1000mg乙烯吡咯烷酮和乙酸乙烯酯的共聚物(巴斯夫va64)的溶液1与在400ml超纯水中含有150mg十二烷基硫酸钠的水性溶液2以不同流速混合。溶液1:溶液2为1:4。在大气压和25℃温度下生产复合物依伐卡托制剂的胶体溶液。通过喷雾干燥技术执行胶体溶液的固化。体积比为5:2的甲醇:四氢呋喃溶剂混合物中的1.92mg/ml依伐卡托、3.08mg/ml鲁玛卡托和10mg/ml乙烯吡咯烷酮和乙酸乙烯酯共聚物(巴斯夫va64)以及水中的0.375mg/ml的十二烷基硫酸钠被选为起始浓度。发现溶液1和溶液2的比例在1:4比例下是最佳的。为了获得固体粉末,将所制的溶液混合物喷雾干燥(yamatodl-410/gas410)。优化了喷雾干燥法。发现最佳的生产参数为tinlet=90℃、vair=0.85m3/min、min=20ml/min、雾化压力=1bar,tout=50℃。
复合物依伐卡托制剂的液体分散颗粒的制备
可以通过湿法或干法制粒工艺获得包括本发明的复合物依伐卡托制剂的液体分散颗粒。
干法制粒工艺包括、但不限于:将复合物依伐卡托的粉末制剂重压(slugging)或辊压(rollcompaction)成压制体(compact);和将压制体破碎成具有适当筛目尺寸的颗粒。可将所获得的颗粒与药学可接受赋形剂混合。
干法制粒技术也可用于复合物依伐卡托制剂的粉末共混物上。粉末共混物由复合物依伐卡托和药学可接受赋形剂组成,并可由粉末的混合制成。重压或辊压用于从粉末共混物制造压制体。然后将压制体破碎成具有适当筛目尺寸的颗粒。
湿法制粒工艺包括:复合物依伐卡托的粉末制剂的保湿(直接制粒);或用药学可接受粘结剂的水性溶液对药学可接受赋形剂进行保温并将其与复合物依伐卡托的粉末制剂混合(非直接制粒)。在干燥步骤之前和之后,可以通过物理冲击来控制颗粒的粒径。
通过使用0.5吨载荷压实适量的复合物鲁玛卡托粉末共混物来制备本发明的复合物依伐卡托制剂的液体分散颗粒。粉末共混物包含:依伐卡托和选自甜味剂、调味剂、芳化剂和芳香剂的组的药学可接受赋形剂的复合物的固体制剂。发现压制体的高度在0.8mm至1.0mm之间为最佳。通过物理冲击将压制体破碎以形成颗粒。通过用适当筛目尺寸筛分来控制颗粒的粒径,从而获得160至800微米的粒径。
复合物鲁玛卡托制剂的液体分散颗粒的制备
可通过湿法或干法制粒工艺获得包括本发明的复合物鲁玛卡托制剂的液体分散颗粒。
干法制粒工艺包括、但不限于:将复合物鲁玛卡托的粉末制剂重压(slugging)或辊压(rollcompaction)成压制体(compact);和将压制体破碎成具有适当筛目尺寸的颗粒。所获得的颗粒可以与药学可接受赋形剂混合。
干法制粒技术也可用于复合物鲁玛卡托制剂的粉末共混物上。粉末共混物由复合物鲁玛卡托和药学可接受赋形剂组成,并可由粉末的混合制成。重压或辊压用于从粉末共混物制造压制体。然后将压制体破碎成具有适当筛目尺寸的颗粒。
湿法制粒工艺包括:复合物鲁玛卡托的粉末制剂的保湿(直接制粒),或用药学可接受粘结剂的水性溶液对药学可接受赋形剂进行保湿并将其与复合物鲁玛卡托的粉末制剂混合(非直接制粒)。在干燥步骤之前和之后,可以通过物理冲击来控制颗粒的粒径。
通过使用0.5吨载荷压实适量的复合物鲁玛卡托粉末共混物来制备本发明的复合物鲁玛卡托制剂的液体分散颗粒。粉末共混物包含:鲁玛卡托和选自甜味剂、调味剂、芳香剂和芳香剂的组的药学可接受赋形剂的复合物的固体制剂。发现压制体的高度在0.8mm至1.0mm之间为最佳。通过物理冲击将压制体破碎以形成颗粒。通过用适当筛目尺寸筛分来控制颗粒的颗粒尺寸,从而获得160至800微米的粒径。
本发明的药物联合组合物的液体分散颗粒的制备
可以通过将复合物依伐卡托制剂和复合物鲁玛卡托制剂的液体分散颗粒或丸共混;或将复合物依伐卡托制剂与复合物鲁玛卡托制剂在制粒前混合、制丸;或将复合物依伐卡托制剂或复合物鲁玛卡托制剂的液体分散颗粒或丸与复合物依伐卡托制剂或复合物鲁玛卡托制剂的固体形式共混来获得本发明的药物联合组合物的液体分散颗粒。
可以通过使用0.5吨至3吨载荷压实适量的由联合喷雾干燥制得的药物联合组合物来获得本发明的药物联合组合物的液体分散颗粒。粉末包含:药物联合组合物和选自甜味剂、调味剂、芳香剂和芳香剂的组的药学可接受赋形剂的固体制剂。发现压制体的高度在0.8mm至1.0mm之间为最佳。通过物理冲击将压制体破碎以形成颗粒。通过用适当筛目尺寸筛分来控制颗粒的粒径,从而获得160至800微米的颗粒尺寸。
共混和混合包括但不限于容器旋转或高剪切混合。
比较溶解度测试
在室温下,通过uv-vis分光光度法或rp-hplc测量表观溶解度。将样品以1mg/ml至20mg/ml的活性成分等效浓度范围分散在超纯水中。所得溶液由100nm一次性针筒过滤器过滤。通过uv-vis分光光度法或rp-hplc测量滤液中活性成分含量并计算表观溶解度。滤液可含有不能使用100nm孔径过滤器滤出的颗粒。图2示出了结果。
当1mg/ml、2.5mg/ml、5mg/ml、10mg/ml和20mg/ml的依伐卡托等效制剂分散在超纯水中时,本发明的复合物依伐卡托制剂的表观溶解度分别为0.991mg/ml、2.356mg/ml、4.924mg/ml、9.463mg/ml和18.474mg/ml。
复合物依伐卡托制剂的表观溶解度为18.474mg/ml。
当1mg/ml、10mg/ml和20mg/ml鲁玛卡托等效制剂分散在超纯水中时,本发明的复合物鲁玛卡托制剂的表观溶解度分别为0.950mg/ml、9.839mg/ml和14.913mg/ml。发现未制剂化的晶体鲁玛卡托的表观溶解度为0.032mg/ml。
复合物鲁玛卡托制剂的溶解度为14.913mg/ml。
当1mg/ml、5mg/ml、10mg/ml和20mg/ml鲁玛卡托等效制剂分散在超纯水中时,本发明的药物联合组合物的表观溶解度分别为对鲁玛卡托1.009mg/ml、4.6967mg/ml、9.591mg/ml和19.9493mg/ml,对依伐卡托为0.6117mg/ml、2.8444mg/ml、5.7553mg/mland11.3187mg/ml。
由粉末共混制得的本发明的药物联合组合物的表观溶解度对鲁玛卡托为19.9493mg/ml,对依伐卡托为11.3187mg/ml。
当1mg/ml、5mg/ml、10mg/ml和20mg/ml鲁玛卡托等效制剂分散在超纯水中时,由联合喷雾干燥制得的本发明的药物联合组合物的表观溶解度分别为对鲁玛卡托0.9656mg/ml、4.8253mg/ml、8.9099mg/ml和19.2660mg/ml,对依伐卡托为0.5969mg/ml、3.0105mg/ml、5.5397mg/mland12.0467mg/ml。
由喷雾干燥制得的本发明的药物联合组合物的表观溶解度对鲁玛卡托为19.2660mg/ml,对依伐卡托为12.0467mg/ml。
溶出测试
通过将上述共混的药物联合组合物分散在纯水中来执行胃肠道模拟药物溶出测试。分散体含有1mg/ml鲁玛卡托和0.625mg/ml依伐卡托(与
在使用0.1μm孔径过滤器过滤后,通过rp-hplc在不同时间点测量鲁玛卡托和依伐卡托从共混的药物联合组合物中的溶出量。在禁食和进食状态模拟条件下,依伐卡托和鲁玛卡托从共混的、颗粒状的复合制剂中的溶出均是瞬时的,在5分钟内,超过85%的依伐卡托和鲁玛卡托从本发明的药物组合物中溶出。(图3)。
通过将粉末共混或联合喷雾干燥制得的药物联合组合物分散在水中,来执行药物溶出测试。在使用0.1μm孔径过滤器过滤后,通过rp-hplc在不同时间点测量鲁玛卡托和依伐卡托的溶出量。联合喷雾干燥制得的依伐卡托和鲁玛卡托的溶出均是瞬时的,在5分钟内,超过85%的依伐卡托和鲁玛卡托从本发明的药物组合物中溶出。(图4)。
比较体外pampa测定
测量复合制剂的pampa渗透率并将其与未配制的晶体参考活性化合物进行比较。如m.kansi等人(journalofmedicinalchemistry,41,(1998)pp1007)基于s.bendels等人(pharmaceuticalresearch,23(2006)pp2525)所描述的,执行pampa渗透率测量。在96孔板测定中,穿过由聚偏二氟乙烯(pvdf)膜(millipore,usa)支撑的、由十二烷和20%大豆卵磷脂组成的人造膜测定渗透率。接收室是补充有1%十二烷基硫酸钠的磷酸盐缓冲盐水(ph7.0)。在室温下执行该测定;在超纯水、fassif和fessif中的培养时间分别为4小时。通过uv-vis分光光度法或rp-hplc方法(thermoscientificmultiscangospectrophotometer或thermosurveyorhplc或rigoll-3000serieshplc)来确定接收室中的浓度。
在fassif和fessif介质中测量复合物依伐卡托制剂和复合物鲁玛卡托制剂的pampa渗透率,并且通过uv-vis测量发现,pampa渗透率对依伐卡托为高于0.5×10-6cm/s,且对鲁玛卡托为2×10-6cm/s(图5)。
在水、fassif和fessif介质中测量由粉末共混制得的药物联合组合物的pampa渗透率,并且通过uv-vis测量发现,pampa渗透率对依伐卡托为高于0.5×10-6cm/s,且对鲁玛卡托为2×10-6cm/s(图6)。
在水、fassif和fessif介质中测量由联合喷雾干燥制得的药物联合组合物的pampa渗透率,并且通过uv-vis测量发现,pampa渗透率对依伐卡托为高于0.2×10-6cm/s,且对鲁玛卡托为1.5×10-6cm/s(图7)。
固体复合制剂的稳定性
使用pampa试验监控本发明的复合物依伐卡托、复合物鲁玛卡托制剂和药物组合物的物理稳定性。在不同条件下储存样品后,在fassif和fessif介质中测量pampa渗透率。在室温或40℃/75%相对湿度下储存6个月,在通过rp-hplc测量的任何测试条件下,复合物依伐卡托和复合物鲁玛卡托的测量的pampa渗透率没有显示出显著的降低(图8)。当在40℃/75%相对湿度下储存时,药物组合物显示出超过两个月的稳定性(图9)。
结构分析
使用feiquanta三维扫描电子显微镜观察复合物依伐卡托制剂和复合物鲁玛卡托制剂的形貌。复合物依伐卡托制剂包括具有小于50nm的粒径的球形颗粒,而复合物鲁玛卡托制剂的球形颗粒具有小于100nm范围的粒径(图10)。
通过使用具有atr的vertex70ft-ir仪器和horibajobinyvonlabramhruv–vis–nir仪器,执行结构分析。
本发明中使用的复合物依伐卡托制剂如图11中所示的拉曼光谱和图12中所示的红外光谱表征。
本发明中使用的复合物依伐卡托制剂通过拉曼位移表征,所述拉曼位移处于552cm-1、648cm-1、826cm-1、845cm-1、888cm-1、932cm-1、1026cm-1、1062cm-1、1082cm-1、1129cm-1、1140cm-1、1208cm-1、1233cm-1、1262cm-1、1284cm-1、1295cm-1、1361cm-1、1450cm-1、1528cm-1、1573cm-1、1618cm-1、1677cm-1、1738cm-1、746cm-1、2884cm-1和2936cm-1。
本发明中使用的复合物依伐卡托制剂通过拉曼位移表征,所述拉曼位移处于1082cm-1、1233cm-1、1284cm-1、1361cm-1、1528cm-1、1618cm-1和1738cm-1。
通过红外(atr)光谱表征的本发明中使用的复合物依伐卡托制剂具有处于588cm-1、628cm-1、767cm-1、842cm-1、962cm-1、1019cm-1、1108cm-1、1148cm-1、1240cm-1、1343cm-1、1370cm-1、1425cm-1、1465cm-1、1525cm-1、1567cm-1、1666cm-1和1732cm-1的特征峰。
通过atr光谱表征的本发明中使用的复合物依伐卡托制剂具有处于628cm-1、767cm-1、1108cm-1、1370cm-1和1465cm-1的特征峰。
如图13所示,本发明中使用的复合物鲁玛卡托制剂或其药物组合物通过特征拉曼位移表征,所述特征拉曼位移处于553cm-1、602cm-1、635cm-1、654cm-1、747cm-1、841cm-1、899cm-1、934cm-1、1002cm-1、1021cm-1、1117cm-1、1205cm-1、1232cm-1、1310cm-1、1352cm-1、1372cm-1、1428cm-1、1444cm-1、1497cm-1、1592cm-1、1609cm-1和1677cm-1。
本发明中使用的复合物鲁玛卡托制剂通过特征拉曼位移表征,所述特征拉曼位移处于553cm-1、654cm-1、747cm-1、841cm-1、899cm-1、1117cm-1、1205cm-1、1310cm-1、1372cm-1、1428cm-1、1677cm-1、和1737cm-1处位移。
如图14所示,本发明中使用的复合物鲁玛卡托制剂通过特征红外(atr)峰表征,所述特征红外(atr)峰位于635cm-1,703cm-1,747cm-1,837cm-1,1021cm-1,1165cm-1,1231cm-1,1288cm-1,1369cm-1、1423cm-1、1462cm-1、1494cm-1、1667cm-1、和1731cm-1。
本发明中使用的复合物鲁玛卡托制剂通过特征红外(atr)峰表征,所述特征红外(atr)峰位于703cm-1、837cm-1、1231cm-1、1369cm-1和1667cm-1。
通过粉末x射线衍射(x-raydiffraction,xrd)分析(philipspw1050/1870rtg粉末衍射仪)检测复合物依伐卡托、复合物鲁玛卡托制剂和药物联合组合物的结构。测量结果显示依伐卡托和鲁玛卡托在复合物和在联合制剂中均为xrd无定形(图15)。衍射图上位于43和44的2theta处的特征衍射可以归因于样品台。
比较制剂研究
依伐卡托以商品名
比较分析试验用于研究由本发明的固体分散技术和连续流动混合制得的制剂的物理化学特性。
在水fassif中无法检测到固体分散体的pampa渗透率,而在fessif条件下,为本发明的复合物依伐卡托制剂的渗透率的70%(图16)。
比较表观溶解度测量显示,复合物依伐卡托制剂的表观溶解度至少为0.99mg/ml,而晶体依伐卡托、物理混合物中的依伐卡托、十二烷基硫酸钠的水性溶液中的无定形依伐卡托和固体分散体的表观溶解度低于0.1mg/ml(图17)。
在水中进行的比较溶出测试显示,依伐卡托从颗粒状复合制剂的溶出是瞬时的,在10分钟内,90%的依伐卡托从复合物依伐卡托制剂中溶出,而在60分钟内,0%依伐卡托从固体分散体中溶出(图18)。
在存在用于固体分散体的制备的赋形剂的条件下,将依伐卡托球磨。在不存在络合剂(luviscolva64)和药学可接受赋形剂(sds)、和存在它们的情况下,将晶体鲁玛卡托球磨。球磨参数如下:
研磨后,用5mlmilli-q水清洗容器。将产物在盐冰上冷冻,然后使用配备有-110℃冰冷凝器和真空泵的冷冻干燥器将其冻干。将所得制剂的材料和体外性质与本发明的复合物鲁玛卡托和依伐卡托制剂进行比较。
通过dls技术在重构的分散体/溶液中测量制剂的粒径。结果汇总于图19中。球磨的晶体鲁玛卡托在纯化水中几乎不可再分散,导致具有可见颗粒的悬浮液,无法确定粒径。
当20mg鲁玛卡托当量制剂再分散时,复合物鲁玛卡托制剂的表观溶解度为14.913mg/ml(图20)。
在fassif生物相关介质中测量制剂的pampa渗透率并进行比较。复合物鲁玛卡托制剂的pampa渗透率为4.651,而对于球磨的晶体鲁玛卡托的pampa渗透率为0.288(图21)。
复合物依伐卡托和鲁玛卡托制剂的粉末混合物的胃肠模拟溶出显示了依伐卡托和鲁玛卡托在体外的完全消除的食物效应。基于溶出数据,体外研究中预期出现显著增加的或完全的吸收。在5分钟内,依伐卡托和鲁玛卡托从粉末共混物的溶出超过80%(图22和图23)。
作为对比,依伐卡托从依伐卡托的固体分散体的溶出显示了在fessif条件中五倍的增长,表现出其在体内进食状态下的吸收的显著差异。对于球磨的依伐卡托的固体分散体和与luviskolva64、普流尼克f108和sds一起球磨的依伐卡托,溶出度的增加分别为3倍和1.5倍。在fassif和fessif介质中,鲁玛卡托从晶体材料中的溶出度均低于10%。当粒径降低时,鲁玛卡托的溶出度增大,然而在任何测试条件下,其均未超过40%。对比于fassif条件,在fessif介质中观察到溶出度的两倍差异(图22和图23)。
测量并比较不同组合物的pampa渗透率。本发明的药物组合物中的复合物依伐卡托制剂和复合物鲁玛卡托制剂的pampa渗透率优于测试的制剂的体外性能(图24)。
药代动力学
体外试验
基于体外数据(图2、图3、图19和图20),该数据显示了在禁食和进食状态模拟中的快速和完全溶出以及增加的渗透率,预期复合物鲁玛卡托制剂提供完全吸收和食物效应的消除。
大型动物体内的pk试验
在禁食和进食状态下,使用3mg/kg的剂量的本发明的颗粒状的复合物依伐卡托制剂进行比格犬研究。将颗粒状的复合制剂作为重构的分散体口服向动物给药。食物效应仅为1.1倍(在进食状态下,人体内的食物效应高2至4倍,这就是为什么该药物必须在高脂肪膳食后服用)。暴露量比参考暴露量高1.25倍。复合物依伐卡托制剂的cmax稍低,然而,对于更重要的参数c24h而言,复合物依伐卡托高1.4倍(图25和图26)。
从前面的描述中,本领域的技术人员能够容易地确定本发明的基本特征,并且在不脱离本发明的精髓和范围的情况下,可以对本发明进行各种改变和修改以使其适应各种用途和条件。
- 还没有人留言评论。精彩留言会获得点赞!