一种基于光遗传学的无线神经调控装置的制作方法
本发明属于医疗器械技术领域,尤其涉及一种基于光遗传学的无线神经调控装置。
背景技术:
光遗传学(optogenetics)是近几年正在迅速发展的一项整合了光学、软件控制、基因操作技术、电生理等多学科交叉的生物工程技术。其主要原理是首先采用基因操作技术将光感基因转入到特定细胞中进行光敏感蛋白的表达,光敏感蛋白在相应波长的光照刺激下会分别对阳离子或者阴离子的通过产生选择性,从而造成细胞膜内外的膜电位发生变化,达到对细胞选择性地兴奋或者抑制的目的,从而对细胞、组织、器官和生物体的生理功能实现精准调控。光遗传学技术在神经科学等领域得到了迅速发展,2010年该技术入选《Nature Methods》杂志2010年年度方法,并被认为是最有希望获得诺贝尔生物学奖的技术之一。
自主神经系统虽然不受意识支配,但在维持机体生命健康方面发挥重要作用,比如不同状态下呼吸、心率、血压的变化均由自主神经控制。自主神经的交感、迷走成分互相拮抗,二者之间的平衡对维持机体健康十分重要。经过大量基础和临床研究,发现心脏自主神经系统的失平衡尤其是交感神经的过度兴奋参与并介导了心律失常、心力衰竭、心肌梗死、高血压等多种疾病的发生发展。因此通过各种手段调控自主神经使其再平衡十分重要,而目前对心脏自主神经再平衡的方法多为消融、切除等损毁方法,容易产生副作用,使用光遗传学技术调控自主神经不仅不损伤神经,而且可以做到精准、可控。但目前的光遗传学刺激系统多为有线设置,需要一根光纤连到体外,难以在临床推广,即使动物实验也存在对其活动的限制等不足。
技术实现要素:
本发明的目的是提供一种无线供能的光遗传学刺激系统,能够利用连接wifi并通过APP进行交互,从而实现无线调控。
为实现上述目的,本发明采用的技术方案是:一种基于光遗传学的无线神经调控装置,包括病毒载体,所述病毒载体携带启动子、光敏感蛋白和荧光蛋白植入目标组织,所述启动子用于在特定目标组织特异性表达光敏感蛋白,实现特异性精准控制,所述荧光蛋白用于确认充分表达;其特征在于,还包括LED发光模块和无线调控装置;所述LED发光模块包括LED阵列和能量接收系统;所述无线调控装置包括能量发射系统和控制器;所述能量发射系统向所述能量接收系统传递能量;所述LED阵列和能量接收系统均封装于生物相容性绝缘材料中,设置在贴近所述病毒载体所在的目标组织处。
在上述的基于光遗传学的无线神经调控装置中,所述LED阵列包括数个LED;所述能量接收系统包括设置在所述数个LED周围的多个天线,所述多个天线依次连接整流器和放大器;所述放大器连接数个LED。
在上述的基于光遗传学的无线神经调控装置中,所述能量发射系统包括依次连接的供电系统、逆变器、控制模块和RF发射单元;所述控制器包括相互连接的控制面板、wifi接收模块、集成芯片,程序内置APP;所述能量发射系统与控制器连接且封装在同一个外壳里。
在上述的基于光遗传学的无线神经调控装置中,所述控制模块用于调节刺激参数,发出矩阵波;所述刺激参数包括刺激电压、刺激电流、刺激脉宽、间歇时间、持续时间。
在上述的基于光遗传学的无线神经调控装置中,所述无线调控装置采用内置电池或外接电源。
在上述的基于光遗传学的无线神经调控装置中,所述病毒载体包括慢病毒和腺相关病毒;所述腺相关病毒包括AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9,根据目标组织选用病毒亚型。
在上述的基于光遗传学的无线神经调控装置中,所述光敏感蛋白选用兴奋性光敏感蛋白、抑制性光敏感蛋白、双向调节光敏感蛋白。
在上述的基于光遗传学的无线神经调控装置中,所述兴奋性光敏感蛋白若选用ChR2,则所述LED阵列发射470nm左右波长的光线;若选用VChR1,则所述LED阵列发射545nm左右波长的光线; 若选用C1V1,则所述LED阵列发射540nm左右波长的光线;所述抑制性光敏感蛋白若选用ArchT,则所述LED阵列发射565nm左右波长的光线; 若选用eNpHR3.0,则所述LED阵列发射590nm左右波长的光线;若选用eBR,则所述LED阵列发射540nm左右波长的光线;所述双向调节光敏感蛋白若选用ChR2-step function opsins,则所述LED阵列发射470nm附近波长光线激活,发射590nm附近波长光线抑制;若选用VCHR-step function opsins,则所述LED阵列发射560nm附近波长光线激活,发射390nm附近波长光线抑制。
在上述的基于光遗传学的无线神经调控装置中,所述光敏感蛋白既可通过病毒载体在目标组织中特异性表达,也可在动物实验中通过转基因动物模型、Cre-loxP系统使目标组织表达光敏感蛋白。
光敏感蛋白是基于光遗传学的无线神经调控装置发挥作用的关键,被特定波长光线激活后通道开放,引起细胞膜内外离子流动,改变细胞膜电位,引起去极化、超级化,从而起兴奋、抑制作用。
本发明的有益效果是:实现了光遗传学刺激系统的无线供能和远程控制。具有小型化,无线调控,产热少,对靶组织损伤小的特点,光遗传学所能应用的领域均可使用该装置。
附图说明
图1为本发明一个实施例的整体结构示意图;
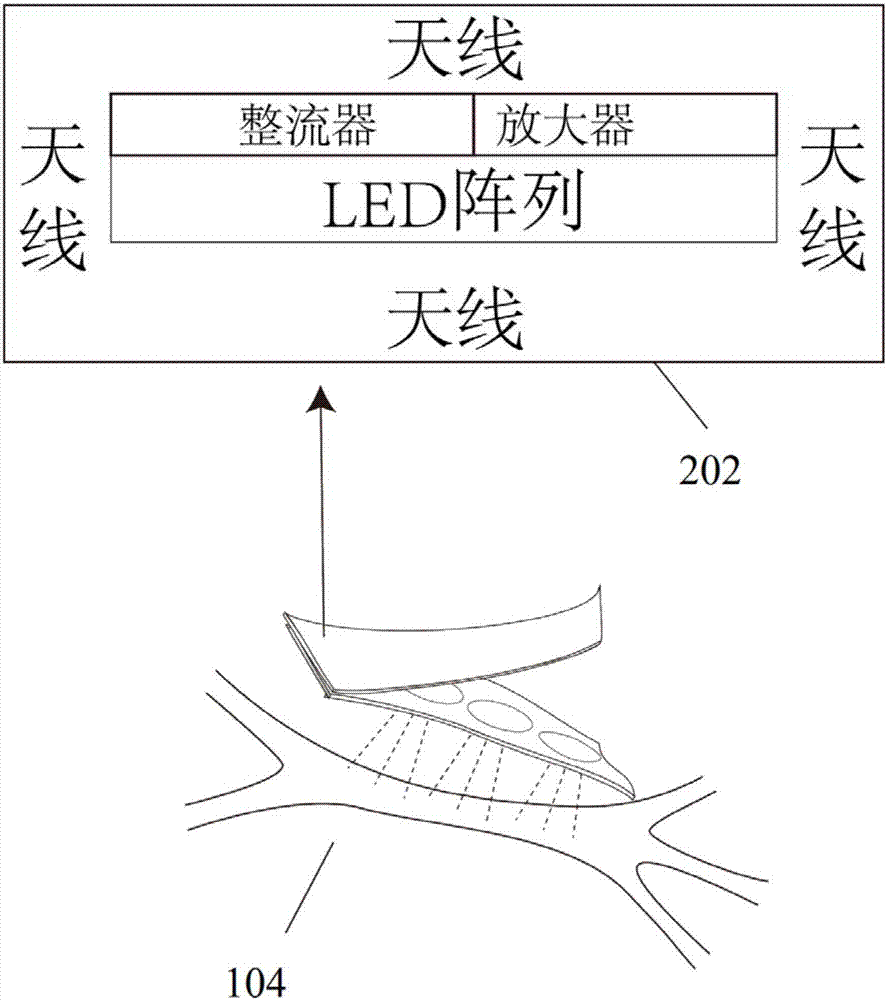
图2为本发明一个实施例的LED阵列和能量接收系统示意图;
图3为本发明一个实施例的无线调控装置及能量发射系统示意图;
图4为本发明一个实施例的能量发射系统和能量接收系统连接示意图;
图5为本发明一个实施例的工作流程示意图;
其中,101-无线调控装置、102-无线射频信号、103-LED发光模块、104-左侧星状神经节、105-LED阵列、106-LED发射特定波长光线、201-能量发射系统、202-能量接收系统及LED阵列、401-病毒载体注射示意图、402-病毒载体、403-光照刺激作用机制图。
具体实施方式
下面结合附图对本发明的实施方式进行详细描述。
本实施例采用如下技术方案:一种基于光遗传学的无线神经调控装置,包括病毒载体,所述病毒载体携带启动子、光敏感蛋白和荧光蛋白植入目标组织,所述启动子用于在特定目标组织特异性表达光敏感蛋白,实现特异性精准控制,所述荧光蛋白用于确认充分表达;其特征在于,还包括LED发光模块和无线调控装置;所述LED发光模块包括LED阵列和能量接收系统;所述无线调控装置包括能量发射系统和控制器;所述能量发射系统向所述能量接收系统传递能量;所述LED阵列和能量接收系统均封装于生物相容性绝缘材料中,设置在贴近所述病毒载体所在的目标组织处。
进一步,所述LED阵列包括数个LED;所述能量接收系统包括设置在所述数个LED周围的多个天线,所述多个天线依次连接整流器和放大器;所述放大器连接数个LED。
进一步,所述能量发射系统包括依次连接的供电系统、逆变器、控制模块和RF发射单元;所述控制器包括相互连接的控制面板、wifi接收模块、集成芯片,程序内置APP;所述能量发射系统与控制器连接且封装在同一个外壳里。
进一步,所述控制模块用于调节刺激参数,发出矩阵波;所述刺激参数包括刺激电压、刺激电流、刺激脉宽、间歇时间、持续时间。
进一步,所述无线调控装置采用内置电池或外接电源。
进一步,所述病毒载体包括慢病毒和腺相关病毒;所述腺相关病毒包括AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9,根据目标组织选用病毒亚型。
进一步,所述光敏感蛋白选用兴奋性光敏感蛋白、抑制性光敏感蛋白、双向调节光敏感蛋白。
进一步,所述兴奋性光敏感蛋白若选用ChR2,则所述LED阵列发射470nm左右波长的光线;若选用VChR1,则所述LED阵列发射545nm左右波长的光线; 若选用C1V1,则所述LED阵列发射540nm左右波长的光线;所述抑制性光敏感蛋白若选用ArchT,则所述LED阵列发射565nm左右波长的光线; 若选用eNpHR3.0,则所述LED阵列发射590nm左右波长的光线;若选用eBR,则所述LED阵列发射540nm左右波长的光线;所述双向调节光敏感蛋白若选用ChR2-step function opsins,则所述LED阵列发射470nm附近波长光线激活,发射590nm附近波长光线抑制;若选用VCHR-step function opsins,则所述LED阵列发射560nm附近波长光线激活,发射390nm附近波长光线抑制。
更进一步,所述光敏感蛋白既可通过病毒载体在目标组织中特异性表达,也可在动物实验中通过转基因动物模型、Cre-loxP系统使目标组织表达光敏感蛋白。
具体实施时,如图1所示,一种基于光遗传学的无线神经调控装置,包含病毒载体,LED发光模块和无线调控装置。病毒载体使目标区域特异性表达光敏感蛋白,LED发光模块包括LED阵列和能量接收系统,LED阵列用于发射适合光敏感蛋白波长的光照,能量接收系统用于接收能量;无线调控装置包括能量发射系统和控制器;能量发射系统包括供电系统、逆变器、控制模块和RF发射单元;控制器包括相互连接的控制面板、wifi接收模块、集成芯片,程序内置APP,能量发射系统和控制器合并在一个装置上,且封装在同一个外壳里。每次发放刺激的记录存储集成芯片,可连接wifi,上传APP,通过手机等移动端同步,绘制治疗曲线。
如图2所示,LED发光模块,用于发出特定波长光照,刺激目标组织内光敏感蛋白,改变目标组织细胞内外膜电位,从而兴奋或抑制目标组织,LED发光模块含有数个LED阵列和能量接收系统均封装于生物相容性绝缘材料之内,LED阵列贴近目标组织,可完整照射到每个目标组织。LED所发射波长取决于光敏感蛋白,ArchT可采用565nm左右波长光照,ChR2可采用470nm左右波长光照。能量接收系统包含LED周围的天线,整流器和放大器;天线可收到无线调控装置发出射频信号,从而转化为电信号,并通过整流器转化为直流电,再经过放大器发大,产生足以供应LED发光的能量。能量接收系统与LED阵列一起封装于生物相容性绝缘材料中。
如图3所示,无线调控装置包括能量发射系统和控制器。能量发射系统由供电系统、逆变器、控制模块和RF发射单元组成;控制器由控制面板、wifi接收模块和APP组成。无线调控装置由内置电池或外界电源供电,能量发射单元产生电流后经过逆变器转化为交流电,交流电经过RF发射单元,发出射频信号,传递出能量,供能量接收系统接收。其控制模块,可调节刺激参数,包括刺激电压、刺激电流、刺激脉宽、间歇时间、持续时间,发出矩阵波。无线调控装置还带有wifi接收模块、集成芯片,程序内置APP,可将每次发放刺激及的记录存储下来,连接wifi并通过上传APP与手机等移动设备进行同步,绘制治疗曲线。
无线神经调控装置既可用于调控心脏自主神经系统,通过再平衡自主神经来治疗心律失常、改善心肌缺血、心力衰竭、预防猝死等疾病,也可用于植入颈部等其他部位,实现治疗抑郁症等其他作用,不仅可以用于临床,亦可用于动物实验。
病毒载体主要为慢病毒、腺相关病毒,腺相关病毒包括AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9,根据作用对象及目标组织选择具体病毒类型及病毒亚型,动物实验、短期使用可用腺相关病毒,特点在于转染效率高。长期实验、临床使用可采用慢病毒,其特点在于可以整合至宿主基因组,稳定表达。腺相关病毒AAV9亚型主要对心脏、中枢神经系统、肌肉等组织亲和性高,AAV8亚型主要对肝脏、眼、神经系统亲和力高,引起可根据不同靶器官选择特定病毒亚型,针对心脏可用AAV9亚型。根据需要采用兴奋性光敏感蛋白,抑制性光敏感蛋,双向调节光敏感蛋白,用于抑制星状神经节活性治疗心律失常可采用ArchT、eNpHR作为抑制性光敏感蛋白,病毒载体还携带特异性启动子,仅在靶器官表达目的基因,达到特异性精准控制。在动物实验时,也可再用转基因动物模型、Cre-loxP系统表达光敏感蛋白,只使用本发明中的LED光照系统和无线控能、控制系统。
LED阵列用于发出特定波长光照,刺激目标组织内光敏感蛋白,改变目标组织细胞内外膜电位,从而兴奋或抑制靶组织,LED阵列含有数个LED封装于生物相容性绝缘材料之内,贴近目标组织,可完整照射到整个目标组织。LED所发射波长取决于光敏感蛋白, ChR2采用470nm左右波长光照,VChR1,采用545nm左右波长光线; C1V1采用540nm波长左右光线;ArchT采用565nm左右波长光线; eNpHR3.0采用590nm左右波长光线;eBR,采用540nm左右波长光线。
本实施例的无线神经调控装置,除可用于调控心脏自主神经外,还可用于控制中枢神经、颈部迷走神经治疗抑郁症等用途,由于其小型化,无线调控,产热少、对靶组织损伤小的特点,光遗传学所能应用的领域均可使用该系统。
以下将本实施例的无线神经调控装置应用于通过抑制左侧星状神经节来减少室性心律失常,改善心肌缺血预后。如图1所示,首先通过手术方式将携带有ArchT的AAV9病毒注射至左侧星状神经节104,并在附近植入LED发光模块103,约4周时ArchT稳定表达,此时打开无线调控装置101控制开关,在控制面板中调整好刺激参数,无线调控装置101发出无线射频信号102,被植入的LED发光模块103接收,LED发光模块103内部的能量接收系统接收信号,出现电流,供给LED阵列105发出565nm波长光线106照射左侧星状神经节104,左侧星状神经节104内ArchT被激活,导致神经细胞内外离子分布变化,膜电位呈现超极化改变,抑制神经电活动,从而降低交感神经兴奋性,减少心肌梗死后室性心律失常等的发生。
如图2所示LED阵列104照射左侧星状神经节示意图。LED发光模块103内部的能量接收系统202中天线接收射频信号,转化为电能,并通过整流器转化为直流电,经放大器放大,供应LED发光。
如图3所示无线调控装置101中能量发射系统201包括供电系统、逆变器、控制模块和RF发射单元,并内置集成芯片和wifi模块,程序内置APP。能量由内置电池或外接电源供应,并经过逆流器转化为交流电,电流流经RF发射单元,发射出无线射频信号为LED供能。
如图4所示,能量发射系统201发射出无线能量被能量接收系统202接收,用于供应LED发光。
如图5中所示,病毒载体注射示意图401,光照刺激作用机制图403。携带有特定序列的病毒载体402,启动子作用为在特定目标组织特异性表达,视蛋白即光敏感蛋白发挥离子通道作用,是该系统的核心,可根据需要选用抑制性或敏感性等类型,荧光蛋白可用于检测确认目标蛋白是否表达。本实施例中可以AAV9携带ArchT作为光敏感蛋白,并连接荧光蛋白,当病毒注入104左侧星状神经节内后,经过4周左右病毒稳定表达,此时给予565nm光照左侧形状神经节(LSG),使得神经细胞内外膜电位发生变化,神经细胞超极化,同抑制LSG内神经活性降低心肌梗死后心律失常的发生。
应当理解的是,本说明书未详细阐述的部分均属于现有技术。
虽然以上结合附图描述了本发明的具体实施方式,但是本领域普通技术人员应当理解,这些仅是举例说明,可以对这些实施方式做出多种变形或修改,而不背离本发明的原理和实质。本发明的范围仅由所附权利要求书限定。
- 还没有人留言评论。精彩留言会获得点赞!