大鼠炎症汤刺激模型及建立方法与流程
本发明涉及医学实验技术领域,尤其涉及一种大鼠炎症汤刺激模型及建立方法。
背景技术:
众所周知,大鼠是生物学、医学科研和教学中较理想而常用的实验动物之一。
在大鼠进行颅骨硬脑脑膜的刺激实验时,一般都会采用植入电极建立电极模型的方式进行刺激;然后通过电极发出的电刺激观察大鼠的行为,再通过行为学分析实验,得到想要的实验形式和实验结果。
但是,很显然传统的大鼠硬脑脑膜的电刺激模型也有其缺陷,即电刺激模型只能在通电时实施有效的电极刺激观察大鼠的刺激后行为;其电刺激是瞬间的刺激操作,同时其无法实现大鼠硬脑脑膜部位的持续性长期刺激。
在某些实验要求下,只是瞬间的电极刺激是无法满足要求的,同时仅仅实施电极刺激也将影响刺激后行为学长期数据指标的检测及实验数据的准确,甚至影响到整个实验的成败。
因此在大鼠硬脑脑膜的刺激模型实验中,如何对大鼠损伤小且短刺激时间长反复多次的刺激实验,至今未见有很好的解决办法。
技术实现要素:
本发明的目的在于提供一种大鼠炎症汤刺激模型及建立方法,以解决上述问题。
为了达到上述目的,本发明的技术方案是这样实现的:
本发明提供了一种大鼠炎症汤刺激模型,包括大鼠的颅骨和套管组件、炎症汤注射组件;
沿着所述大鼠的颅骨的颅中线与冠状缝交叉点处设置有一个刺激孔;
其中,所述套管组件包括盖帽、炎症汤容纳管;所述炎症汤注射组件具体包括圆筒管、连接管、圆锥管、细管和微量注射器;所述连接管、所述圆筒管、所述圆锥管和所述细管依次首尾连接连通;所述细管还与所述微量注射器连接连通;
所述微量注射器用于连接所述炎症汤注射组件后吸收炎症汤;所述微量注射器还用于通过所述炎症汤注射组件注入所述炎症汤到所述套管组件的炎症汤容纳管内;
所述套管组件上的炎症汤容纳管嵌入配合在所述刺激孔内;所述盖帽与所述炎症汤容纳管螺纹连接。
优选的,作为一种可实施方案;所述炎症汤容纳管包括外腔管和不锈钢输入管;所述不锈钢输入管设置在所述外腔管的中心处,且所述外腔管的外表面设置有外螺纹。
优选的,作为一种可实施方案;所述盖帽的内壁上还设置有内螺纹;所述盖帽的内壁上的内螺纹与所述炎症汤容纳管上的外螺纹配合。
优选的,作为一种可实施方案;所述圆筒管为圆筒管;
优选的,作为一种可实施方案;所述连接管具体包括不锈钢连接管和固定连接在不锈钢连接管中部的塑料卡块;所述连接管上的短端不锈钢连接管以及塑料卡块伸入到所述圆筒管的底部固定配合,所述连接管上的长端伸出所述圆筒管的外部。
优选的,作为一种可实施方案;所述圆锥管的顶端与所述连接管上的底端不锈钢连接管连接配合,所述圆锥管的底端与所述细管的顶端连接配合。
优选的,作为一种可实施方案;所述细管具体为塑料细管。
优选的,作为一种可实施方案;所述炎症汤容纳管的外径尺寸与所述刺激孔的孔径尺寸相适应。
优选的,作为一种可实施方案;所述大鼠为活体sd大鼠或waster大鼠。
优选的,作为一种可实施方案;所述刺激孔b的直径范围为1-5mm。
相应地,本发明还提供了一种大鼠炎症汤刺激模型的建立方法,其特征在于,包括如下步骤:
步骤s100、对大鼠实施麻醉操作:即对大鼠使用水合氯醛进行腹腔注射麻醉,麻醉成功后固定于操作台上(即10%的水合氯醛麻醉(0.4ml/100g)进行腹腔注射麻醉);
步骤s200、对所述大鼠的头部部位实施备皮及消毒操作:即剪去所述大鼠的头部正中毛发,暴露头皮,利用碘伏对暴露头皮处部位实施消毒皮肤;
步骤s300、对所述大鼠的暴露头皮处部位进行切开操作,并暴露术野:即对所述大鼠的暴露头皮处部位逐层切开皮肤、肌肉,并使用乳突手术撑开器暴露手术视野,彻底分离骨膜并暴露大鼠的颅骨;
步骤s400、对所述大鼠的颅骨进行钻孔操作:即将颅正中线与冠状缝交叉点处做一记号,用牙科钻在记号部位钻开一个刺激孔;
步骤s500、将套管组件置入所述刺激孔内建立化学刺激模型:即将套管组件上的炎症汤容纳管置于刺激孔内,将盖帽旋拧到炎症汤容纳管上,周围覆以圆锥体凝固层用以固定炎症汤容纳管(底面直径约1.5cm),术后恢复3天;在给药时,将盖帽从炎症汤容纳管旋开拧下;再将连接管、圆筒管、圆锥管和细管自头端至尾端顺序依次连接组装成炎症汤注射组件;再将微量注射器连接于炎症汤注射组件尾端的细管上,将炎症汤注射组件头端的连接管置于炎症汤中,依靠微量注射器操作吸收炎症汤;将炎症汤注射组件头端的连接管旋入到套管组件上的炎症汤容纳管,通过微量注射器将炎症汤缓慢注入到大鼠的硬脑膜表面,待注入完成后将炎症汤注射组件头端的连接管旋出炎症汤容纳管;最后将盖帽旋拧到炎症汤容纳管上盖好,注射完毕。
与现有技术相比,本发明实施例的优点在于:
本发明提供的一种大鼠炎症汤刺激模型及建立方法,其中上述大鼠炎症汤刺激模型,其主要由套管组件、炎症汤注射组件等构成,其是一种对大鼠的颅骨实施的化学刺激模型(其不同于电刺激模型,其可以持续的对大鼠进行药物刺激);
在上述具体模型结构中:沿着所述大鼠的颅骨的颅中线与冠状缝交叉点处设置有一个刺激孔;其中,所述套管组件包括盖帽、炎症汤容纳管;所述炎症汤注射组件具体包括圆筒管、连接管、圆锥管、细管和微量注射器;所述连接管、所述圆筒管、所述圆锥管和所述细管依次首尾连接连通;所述细管还与所述微量注射器连接连通;
上述微量注射器用于连接所述炎症汤注射组件后吸收炎症汤;所述微量注射器还用于通过所述炎症汤注射组件注入所述炎症汤到所述套管组件的炎症汤容纳管内;所述套管组件上的炎症汤容纳管嵌入配合在所述刺激孔内;
在具体操作过程中:在给药时,将盖帽从炎症汤容纳管旋开拧下;再将连接管、圆筒管、圆锥管和细管自头端至尾端顺序依次连接组装成炎症汤注射组件;再将微量注射器连接于炎症汤注射组件尾端的细管上,将炎症汤注射组件头端的连接管置于炎症汤中,依靠微量注射器操作通过负压方式吸收炎症汤;将炎症汤注射组件头端的连接管旋入到套管组件上的炎症汤容纳管,通过微量注射器将炎症汤缓慢注入到大鼠的硬脑膜表面,待注入完成后将炎症汤注射组件头端的连接管旋出炎症汤容纳管;最后将盖帽旋拧到炎症汤容纳管上盖好,注射完毕。
综上,本发明提供的大鼠炎症汤刺激模型是一种建立可连续实施的化学刺激模型,其解决了传统电极刺激模型的局限性,其刺激后可对大鼠行为进行长期数据指标及实验数据的监测。在大鼠硬脑脑膜的刺激模型实验中,上述大鼠炎症汤刺激模型刺激时间长,可以反复多次进行刺激,上述套管组件、炎症汤注射组件等器件也可反复进行使用。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
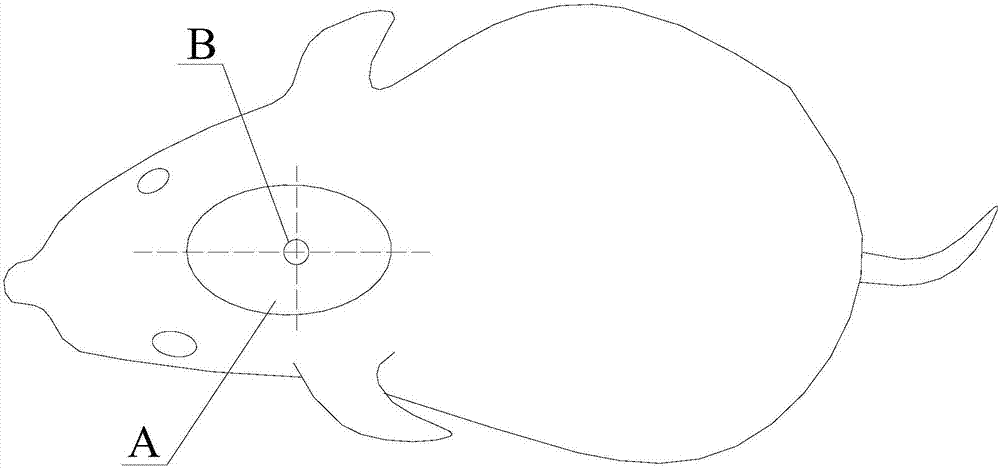
图1为本发明实施例提供的大鼠炎症汤刺激模型中的大鼠钻孔前俯视结构示意图;
图2为本发明实施例提供的大鼠炎症汤刺激模型中的大鼠钻孔后俯视结构示意图;
图3为本发明实施例提供的大鼠炎症汤刺激模型中的大鼠与套管组件的装配结构示意图;
图4为本发明实施例提供的大鼠炎症汤刺激模型的套管组件中的盖帽结构示意图;
图5为本发明实施例提供的大鼠炎症汤刺激模型的套管组件中的炎症汤容纳管结构示意图;
图6为本发明实施例提供的大鼠炎症汤刺激模型的炎症汤注射组件中的圆筒管结构示意图;
图7为本发明实施例提供的大鼠炎症汤刺激模型的炎症汤注射组件中的连接管结构示意图;
图8为本发明实施例提供的大鼠炎症汤刺激模型的炎症汤注射组件中的圆锥管结构示意图;
图9为本发明实施例提供的大鼠炎症汤刺激模型的炎症汤注射组件中的细管结构示意图;
图10为本发明实施例提供的大鼠炎症汤刺激模型的炎症汤注射组件中的微量注射器结构示意图;
图11为本发明实施例提供的大鼠炎症汤刺激模型的炎症汤注射组件的装配结构示意图;
附图标记说明:
颅骨a;
刺激孔b;
盖帽1;
炎症汤容纳管2;外腔管21;不锈钢输入管22;
圆筒管3;
连接管4;不锈钢连接管41;塑料卡块42;
圆锥管5;
细管6;
微量注射器7。
具体实施方式
下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
在本发明的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性。
在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
下面通过具体的实施例子并结合附图对本发明做进一步的详细描述。
参见图1、图2和图3,本发明实施例提供的一种大鼠炎症汤刺激模型,包括大鼠的颅骨a和套管组件(另参见图4和图5)、炎症汤注射组件(另参见图6-图11);
如图2所示,沿着所述大鼠的颅骨a的颅中线与冠状缝交叉点处设置有一个刺激孔b;
其中,所述套管组件包括盖帽1(参见图4)、炎症汤容纳管2(参见图5);所述炎症汤注射组件具体包括圆筒管3(参见图6)、连接管4(参见图7)、圆锥管5(参见图8)、细管6(参见图9)和微量注射器7(参见图10);所述连接管4、所述圆筒管3、所述圆锥管5和所述细管6依次首尾连接连通;所述细管6还与所述微量注射器7连接连通(参见图11);
所述微量注射器7用于连接所述炎症汤注射组件后吸收炎症汤;所述微量注射器还用于通过所述炎症汤注射组件注入所述炎症汤到所述套管组件的炎症汤容纳管2内;
所述套管组件上的炎症汤容纳管2嵌入配合在所述刺激孔b内;所述盖帽1与所述炎症汤容纳管2螺纹连接,周围覆以圆锥体凝固层用以固定炎症汤容纳管(底面直径约1.5cm)。
在具体操作过程中:在给药时,将盖帽1从炎症汤容纳管2旋开拧下;再将连接管4、圆筒管3、圆锥管5和细管6自头端至尾端顺序依次连接组装成炎症汤注射组件(此时连接管4的长端在外设置);再将微量注射器连接于炎症汤注射组件尾端的细管6上,将炎症汤注射组件头端的连接管4的长端置于炎症汤中,依靠微量注射器操作吸收炎症汤;将炎症汤注射组件头端的连接管4旋入到套管组件上的炎症汤容纳管2(即连接管4的长端间接地插入到了大鼠的硬脑膜表面),通过微量注射器将炎症汤缓慢注入,待注入完成后将炎症汤注射组件头端的连接管4旋出炎症汤容纳管2;最后将盖帽1旋拧到炎症汤容纳管2上盖好,注射完毕。
本发明提供的大鼠炎症汤刺激模型及建立方法是一种建立可连续实施的化学刺激模型,其解决了传统电极刺激模型的局限性,其刺激后可对大鼠行为进行长期数据指标及实验数据的监测。在大鼠硬脑脑膜的刺激模型实验中,上述大鼠炎症汤刺激模型刺激时间长,可以反复多次进行刺激,上述套管组件、炎症汤注射组件等器件也可反复进行使用。
下面对本发明实施例提供的大鼠炎症汤刺激模型的具体结构以及具体技术效果做一下详细说明:
优选的,作为一种可实施方案;所述炎症汤容纳管2包括外腔管21和不锈钢输入管22;所述不锈钢输入管22设置在所述外腔管21的中心处,且所述外腔管21的外表面设置有外螺纹。
优选的,作为一种可实施方案;所述盖帽1的内壁上还设置有内螺纹;所述盖帽1的内壁上的内螺纹与所述炎症汤容纳管2上的外螺纹配合。
优选的,作为一种可实施方案;所述圆筒管3为圆筒管;
需要说明的是,上述炎症汤容纳管2其具体由外腔管21和不锈钢输入管22构成;上述外腔管21其可以与盖帽1实现螺纹配合,在药液注入后实现盖帽1密封;同时不锈钢输入管22主要作用是直接渗入和注入炎症汤药液。
优选的,作为一种可实施方案;所述连接管4具体包括不锈钢连接管41和固定连接在不锈钢连接管中部的塑料卡块42;所述连接管4上的短端不锈钢连接管以及塑料卡块42伸入到所述圆筒管3的底部固定配合,所述连接管4上的长端伸出所述圆筒管3的外部。
需要说明的是,上述连接管4具体由不锈钢连接管41和固定连接在不锈钢连接管中部的塑料卡块42结构组成;不锈钢连接管41是主要的连接结构,其主要作用是炎症汤药液的输送使用。
优选的,作为一种可实施方案;所述圆锥管5的顶端与所述连接管4上的底端不锈钢连接管连接配合,所述圆锥管5的底端与所述细管6的顶端连接配合。
需要说明的是,上述圆锥管5其起到连接连接管4和细管6的结构,同样其主要作用也是炎症汤药液的输送。
优选的,作为一种可实施方案;所述细管6具体为塑料细管。
需要说明的是,上述细管6可以选择使用多种类型的结构,但是优选使用塑料细管,其可以与微量注射器7的头部针头形成良好的配合作用。
有关微量注射器7,需要说明的是,注射器是通过负压来采集和吸取炎症汤药液,最后再通过推送将炎症汤药液推送到圆筒管3和炎症汤容纳管2处;它对于小型动物的采血,如小鼠、大鼠等非常适合。
优选的,作为一种可实施方案;所述大鼠为活体sd大鼠或waster大鼠。
需要说明的是,sd大鼠为大鼠(rat;rattusnorregicus)的一个品系,其毛色白化。广泛用于药理、毒理、药效及glp实验。
wistar大鼠为大鼠(rat;rattusnorregicus)的一个品系,现已遍及世界各国的实验室。其毛色白化,主要特性:①头部较宽、耳朵较长、尾的长度小于身长。②性周期稳定,繁殖力强,产仔多,平均每胎产仔在10只左右,生长发育快。③性情温顺。④对传染病的抵抗力较强。⑤自发性肿瘤发生率低。wistar大鼠是动物实验大鼠类最为常用及生物医学研究中使用历史最长的品种,广泛应用于生物医学各领域的实验;因此在本发明实施例提供的大鼠炎症汤刺激模型及建立方法,其优选使用上述两种大鼠作为炎症汤刺激模型的建立基础。
优选的,作为一种可实施方案;所述炎症汤容纳管2的外径尺寸与所述刺激孔b的孔径尺寸相适应。所述刺激孔b的直径范围为1-5mm。
相应地,本发明还提出了一种大鼠炎症汤刺激模型的建立方法,包括如下步骤:
步骤s100、对大鼠实施麻醉操作:即对大鼠使用水合氯醛进行腹腔注射麻醉,麻醉成功后固定于操作台上;(即10%的水合氯醛麻醉(0.4ml/100g)进行腹腔注射麻醉);
步骤s200、对所述大鼠的头部部位实施备皮及消毒操作:即剪去所述大鼠的头部正中毛发,暴露头皮,利用碘伏对暴露头皮处部位实施消毒皮肤;
步骤s300、对所述大鼠的暴露头皮处部位进行切开操作,并暴露术野:即对所述大鼠的暴露头皮处部位逐层切开皮肤、肌肉,并使用乳突手术撑开器暴露手术视野,彻底分离骨膜并暴露大鼠的颅骨;
步骤s400、对所述大鼠的颅骨进行钻孔操作:即将颅正中线与冠状缝交叉点处做一记号,用牙科钻在记号部位钻开一个刺激孔;
步骤s500、将套管组件置入所述刺激孔内建立化学刺激模型:即将套管组件上的炎症汤容纳管2置于刺激孔内,将盖帽1旋拧到炎症汤容纳管2上,周围覆以圆锥体凝固层用以固定炎症汤容纳管(底面直径约1.5cm),术后恢复3天;在给药时,将盖帽1从炎症汤容纳管2旋开拧下;再将连接管4、圆筒管3、圆锥管5和细管6自头端至尾端顺序依次连接组装成炎症汤注射组件;再将微量注射器连接于炎症汤注射组件尾端的细管6上,将炎症汤注射组件头端的连接管4置于炎症汤中,依靠微量注射器操作吸收炎症汤;将炎症汤注射组件头端的连接管4旋入到套管组件上的炎症汤容纳管2,通过微量注射器将炎症汤缓慢注入到大鼠的硬脑膜表面,待注入完成后将炎症汤注射组件头端的连接管4旋出炎症汤容纳管2;最后将盖帽1旋拧到炎症汤容纳管2上盖好,注射完毕。
优选的,作为一种可实施方案;在步骤s500操作之后还包括如下步骤:
步骤s600:对手术钻孔处,进行消毒处理操作;
步骤s700、对所述大鼠注射抗生素:术后即刻腹腔注射青霉素钠,且术后三日每日均给予青霉素钠腹腔注射,预防所述大鼠的颅骨手术处感染发生。
需要说明的是,为了保证化学刺激模型建立手术后,实验大鼠的安全以及化学刺激建立质量的可靠性;应当对实验大鼠进行必要的术后操作处理,即术后腹腔注射青霉素钠(4万iu/100g),且术后三日每日均给予青霉素钠腹腔注射(4万iu/100g),预防感染发生。以上操作均于无菌条件下进行,术后大鼠单笼饲养,自由进食水。
在本发明还提出了一种大鼠炎症汤刺激模型的实验中,需要注意实验时间和测试方式的要求:
实验时间:模拟慢性偏头痛患者,根据实验需要,is给予每周5-7次,。由于大鼠属于夜行动物,白天睡觉,故给药时间选择在上午8:00至10:00,相当于人类的睡前。
头面部的痛觉阈值由vonfrey纤维丝进行检测。这是一组不同粗细的尼龙纤维,有不同的压力值,相当于作用在皮肤表面的压力。最初主要用于检测动物的缩爪的阈值,现也被广泛用于检测大鼠眶周疼痛阈值(periorbitalpainthreshold,ppt)。使用一定压力程度的vonfrey纤维丝作用于大鼠头面部,大鼠会出现头部的回缩或者大叫,而低于一定程度的压力大鼠不会出现头部的回缩,从而判定大鼠眶周疼痛阈值。
测试方法1:检测眶周的疼痛阈值时,需要将动物置于一个限制动物活动的塑料管中,这个限制器可使动物自由进入,不会受伤,但要使动物转身困难。如果检测小鼠,则需要将限制器倾斜30度角,因为小鼠喜欢向斜上方攀爬,使小鼠进入检测区域更为容易,且防止小鼠在测试中转身。检测前需要让动物适应环境,进入限制器时不应强迫,而应为自己适应后进入,啮齿动物都有探索精神,需通过短暂而充分的探索进入而找到合适的位置停下来,再开始测试。总测试时间不应超过15分钟,其中包括5到10分钟的适应,测试时间不应超过5分钟。测试阈值时使用dixon发现的上升-下降的方法,阳性反应为头部回缩,甩头或尖叫,阴性反应则未出现这些现象。测试时两根纤维丝之间转换时需要有一定的间隔时间,间隔时间太短可能会导致敏化而使测试结果不准确。
测试的方法2:实验者戴橡胶手套爱抚大鼠30分钟使其适应并可自在的依靠在实验者的手臂上,然后进行vonfrey纤维丝的测定。这样操作需要大鼠较大且能对实验者的手臂有充分的适应,实验者可轻易的接触到大鼠的颅面部区域。
本发明实施例提供的大鼠炎症汤刺激模型及建立方法具有如下方面的技术优势:
一、本发明实施例提供的大鼠炎症汤刺激模型,其具有特殊的结构设计,且该大鼠炎症汤刺激模型的具体结构装置之间连接、布局等都具有巧妙的设计;因此,本发明实施例提供的大鼠炎症汤刺激模型,其设计更为合理,系统架构更加新颖和完善;该大鼠炎症汤刺激模型,可以对大鼠进行长时间且反复刺激,其为实验的长期数据指标及数据监测提供了模型基础。
二、本发明实施例提供的大鼠炎症汤刺激模型的建立方法,其分为若干个步骤来完成;其主要步骤是通过套管组件置入刺激孔,并通过炎症汤注射组件将炎症汤药液注入到刺激孔,从而建立一种化学刺激模型。
三、本发明实施例提供的大鼠炎症汤刺激模型及建立方法,其技术目的在于:1、观察炎症汤(inflammatorysoup,is)反复刺激大鼠硬脑膜模拟临床偏头痛反复发作的大鼠模型机械性痛阈变化;2、建立反复头痛发作的大鼠模型:麻醉大鼠后暴露颅骨,颅骨上钻开一个刺激孔,后插入一个套管组件以及炎症汤注射组件,实施注射炎症汤药液;
本发明的大鼠炎症汤刺激模型及建立方法,其克服了传统电极刺激模型的技术缺陷,其为大鼠硬脑膜模拟临床偏头痛反复发作的大鼠模型提供了全新的技术方案和方法。
基于以上诸多显著的技术优势,本发明提供的大鼠炎症汤刺激模型及建立方法必将带来良好的市场前景和经济效益。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!