夏天无粉直接口服中药饮片的制作方法
本发明涉及一种夏天无粉直接口服中药饮片,属于医药技术领域。
背景技术:
夏天无为罂粟科紫堇属多年生草本伏生紫堇corydalisdecumbens
(thunb.)pers.的干燥块茎,又名伏地延胡索,伏地元胡,无柄紫堇,夏无踪。夏天无在初夏来临前完成开花、结果等生命过程,然后开始整株植物的枯萎,等到夏日炎炎来临时,地面上就找不到夏天无的植株,故名为“夏天无”
夏天无是一种常见的中药材,其性温,味辛,具有活血止痛的功效,对治疗淤血红肿、关节疼痛、跌打损伤、类风湿等有治愈功效。而且夏天无中含有的生物碱对于心血管疾病有治疗作用,可以起到降血压、降血脂的功效,通过实验发现,夏天无还可以治疗血栓等心血管疾病。对于骨折扭伤,夏天无能起到治疗缓解作用,而且对小儿麻痹症也有治疗的功效。
夏天无所含有的化学成分主要为生物碱,包括普鲁托品(protopine),别隐品碱(allocryptopine),隐品碱(cryptopine),隐品巴马亭(muramine),四氢巴马亭(tetrahydropalmatine),延胡索丹酚碱(kikemanine),斯阔任(scoulerine),球紫堇碱(bulbocapnine),加若定(capnoidine),季胺生物碱部分共有6个化合物,分别为二氢巴马亭,巴马亭(palmatine),药根碱(jatrorrhizine),白毛莨碱宁(hydroxyhydrastine),蝙蝠葛林(menisperine)和阿魏酸(ferulicacid)等;其药理研究表明:1)抗炎作用:夏天无总碱中含量最高的是原阿片碱,具有解痉止痛之功效,延胡索乙素具有解痉镇痛活血的作用。2)作用于外周神经系统:在对夏天无总生物碱的研究中,有学者发现其具有的较强的抑制乙酰胆碱酯酶(ache)活性的作用,通过色谱法从夏天无总生物碱中提取并分离出5中成分,用改进的ellman法对其进行体外抗ache活性测定,其中原阿片碱的作用最强,表明原阿片碱是夏天无总生物碱中抗ache活性的主要成分之一。3)其他作用:夏天无总生物碱和普鲁托品对睫状肌均有解痉作用,可用于近视眼的治疗,夏天无中的四氢巴马汀对突触体及囊泡摄取多巴胺产生影响,且夏天无具有抗疟疾的作用,夏天无中含有多种生物碱,且有些成分药理不明确,若对其进行深入系统的研究,有可能发现其他新的药理活性物质。
《中国药典》2015版一部夏天无【炮制】项下的饮片产品为夏天无粉,即取夏天无,净制,干燥,碾成细粉,其用法为吞服(直接口服)。细粉按《中国药典》的标准为95%通过六号筛(150μm±6.6μm,即100筛目)。
夏天无粉质量标准中的“浸出物”及含量测定样品的制备,往往都是使用醇或有机溶剂,因此,所测定的结果只能反映其本身的质量,不能说明指标成分或有效成分经口服后在体内能溶出或释放“量”的真实情况,使夏天无粉作为直接口服饮片的最佳生产工艺的设计和选择缺乏科学依据,由此,夏天无粉对心血管的恢复功能和临床疗效也受到很大影响或得不到保障。
中药粉末的灭菌历来是中药制药行业中一大难题。干热、高温高压蒸汽等物理灭菌法,环氧乙烷等化学灭菌法,以及钴-60等伽马射线灭菌法均存在重大缺陷,其灭菌方式有的灭菌效果欠佳,有的对不同质地中药中所含有的不同结构类型的有效成分产生破坏和部分化学性质改变,有的留有核物质残留,有的则存在污染因素等等。
直接口服中药饮片是近年来国家刚刚定义的一类新型的现代中药饮片,除了《中国药典》2015版四部对直接口服饮片列有微生物限度标准外,至今仍然没有国家统一的直接口服中药饮片质量执行标准,夏天无(粉)产品也不例外。此外,由于每味中药所含有的不同类型结构的化学成分非常复杂,加之产地不同,品质不一样,其含量质量要求往往是以其指标成分或有效成分的含量达到某一值以上(毒性成分除外),加上有效成分大都储存其细胞内,如此种种原因,夏天无粉作为药品,至今仍未有数据性,科学性的“有效期”。
技术实现要素:
本发明的目的是克服现有技术的不足,提供一种夏天无粉直接口服中药饮片。
本发明的夏天无粉直接口服中药饮片,其制备工艺特征如下:
1)将夏天无原药材检验、净制、干燥后粉碎,得到中间体;
2)检验中间体,包装后进行电子束辐照灭菌;
3)进行成品标准检验,包装后得到成品;
所述的步骤1)中,粉碎条件如下:在d级洁净区,应用吸尘式低温粉碎技术,将夏天无原药材粉碎成100-300目;
所述的步骤2)中,电子束辐照灭菌的照射剂量为3-10kgy。
优选地,
所述的步骤1)中,粉碎条件如下:在d级洁净区,应用吸尘式低温粉碎技术,将夏天无原药材粉碎成200-300目。
所述的步骤2)中,电子束辐照灭菌的照射剂量为5kgy。
本发明是引用现代天然药物分析手段和方法,模拟人体体温37℃,对不同细度(筛目数)的夏天无粉进行水浸实验(可较为真实地反映夏天无粉在体内溶出或释放可供吸收的成分情况),在相同的10、30、60、90和120分钟的各时间段内,不同细度的夏天无粉分别以水浸出物总量及水浸出物中所含原阿片碱和盐酸巴马汀的溶出总量为指标,确定了『夏天无粉』的最佳粉碎细度,以及利用快速、低温、高效、无污染、无残留和不会破坏有效成分的电子束辐照灭菌技术的最佳gmp生产工艺。同时,建立了符合现行国家相关药品标准的『夏天无粉』直接口服中药饮片的质量执行标准。本发明可使夏天无(粉)产品较《中国药典》的细粉标准(100目)的水浸出物总量及水浸出物中原阿片碱和盐酸巴马汀水溶出总量提高15~35%(每6克『夏天无粉』产品第一次可溶出被体内吸收的纯原阿片碱和盐酸巴马汀的总量达9.15毫克以上),微生物限度检验结果则能完全符合相关直接口服饮片的标准,同时,通过新药加速考察实验方法,以『夏天无粉』中的总生物碱含量为指标,初步考察了其产品的【有效期】。
附图说明
图1为夏天无粉(6克)不同细度灭菌前后水浸泡(37±1℃)浸出物重量(毫克)比较;
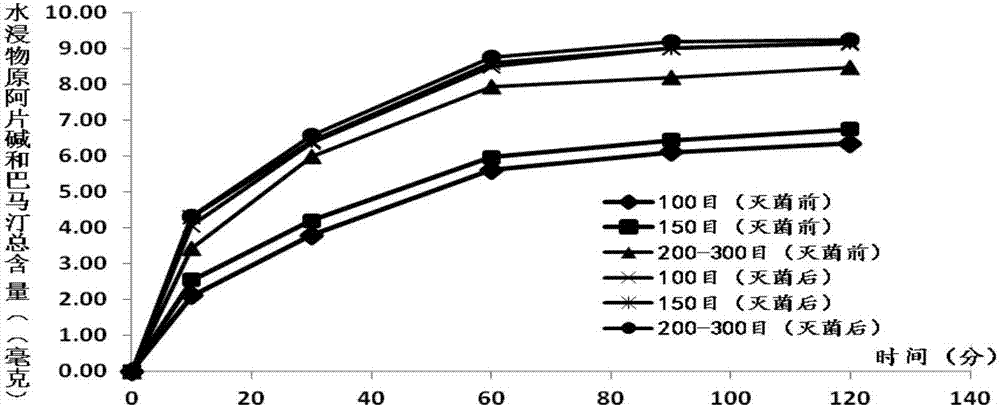
图2为夏天无粉(6克)不同细度灭菌前后水浸泡(37±1℃)浸出物原阿片碱和盐酸巴马汀重量(毫克)比较;
图3为夏天无粉经电子束辐照灭菌(5kgy,室温)工艺处理前后hplc特征图谱(分析柱:phenomenex,c18,3μm,4.6x250mm);
图4为夏天无粉经电子束辐照灭菌(5kgy)工艺处理与未经处理的夏天无粉产品不同贮藏(40±2℃)时间hplc特征图谱(分析柱:phenomenex,c18,3μm,4.6x250mm)
图5为夏天无粉的加速稳定性考察。
图6为夏天无粉的特征图谱。
表1为夏天无粉(100目,6克)灭菌前水浸(37±1℃)浸出物重量(毫克);
表2为夏天无粉(150目,6克)灭菌前水浸(37±1℃)浸出物重量(毫克);
表3为夏天无粉(200-300目,6克)灭菌前水浸(37±1℃)浸出物重量(毫克);
表4为夏天无粉(100目,6克)灭菌后水浸(37±1℃)浸出物重量(毫克);
表5为夏天无粉(150目,6克)灭菌后水浸(37±1℃)浸出物重量(毫克);
表6为夏天无粉(200-300目,6克)灭菌后水浸(37±1℃)浸出物重量(毫克);
表7为夏天无粉(100目,6克)灭菌前水浸出物(37±1℃)原阿片碱和盐酸巴马汀含量(毫克);
表8为夏天无粉(150目,6克)灭菌前水浸出物(37±1℃)原阿片碱和盐酸巴马汀含量(毫克);
表9为夏天无粉(200-300目,6克)灭菌前水浸出物(37±1℃)原阿片碱和盐酸巴马汀含量(毫克);
表10为夏天无粉(100目,6克)灭菌后水浸出物(37±1℃)原阿片碱和盐酸巴马汀含量(毫克);
表11为夏天无粉(150目,6克)灭菌后水浸出物(37±1℃)原阿片碱和盐酸巴马汀含量(毫克);
表12为夏天无粉(150目,6克)灭菌后水浸出物(37±1℃)原阿片碱和盐酸巴马汀含量(毫克);
表13为电子束照射剂量对不同细度(筛目)的夏天无粉的灭菌效果;
表14为夏天无粉微生物限度稳定性检查;
表15为夏天无粉灭菌后原阿片碱和盐酸巴马汀含量(%);
表16为夏天无粉灭菌前原阿片碱和盐酸巴马汀含量(%)。
具体实施方式
本发明中,夏天无粉xiatianwufen说明如下:
【来源】本品为罂粟科紫堇属多年生草本伏生紫堇corydalisdecumbens(thunb.)pers.的干燥块茎
【炮制】本品按《中国药典》2015年版夏天无【炮制】项下规范经净制、干燥(离地)、碰碎、粉碎、干燥、包装、灭菌等工艺制成的小包装夏天无粉(直接口服中药饮片)。
【成品性状】本品为浅黄棕色粉末。气微,味苦。
【装量差异】±7%。
【鉴别】
(1)本品粉末浅黄棕色。下表皮厚壁细胞成片,淡黄棕色,细胞呈类长方形或不规则形,壁稍厚,呈断续的连珠状,常具壁孔。薄壁细胞淡黄色或几无色,呈类方形或类圆形;螺纹导管或网纹导管细小。淀粉粒单粒类圆形或长圆形,直径5~16pm,脐点点状或飞鸟状,复粒由2~6分粒组成。糊化淀粉粒隐约可见,或经水合氯醛透化可见糊化淀粉粒痕迹。
(2)取本品粗粉4g,加1%碳酸钠溶液25ml,置近沸的水浴中浸溃5分钟,滤过,滤液用稀盐酸调节ph值至6,加三氯甲烷15ml振摇提取,分取三氯甲烷液2ml,加硫酸1ml,振摇,硫酸层即显棕红色,放置后显棕黑色。
(3)取本品粉末4g,加三氯甲烷-甲醇-浓氨试液(5:1:0.1)混合溶液40ml,超声处理30分钟,滤过,滤液浓缩至干,残渣加甲醇2ml使溶解,作为供试品溶液。另取原阿片碱对照品,加三氯甲烷制成每lml含2mg的溶液,作为对照品溶液。照薄层色谱法(通则0502)试验,吸取上述两种溶液各5ul,分别点于同一硅胶g薄层板上,以环己烷-乙酸乙酯-二乙胺(16:3:1)为展开剂,预饱和15分钟,展开,取出,晾干,喷以稀碘化铋钾试液。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
【检查】
水分不得过15.0%(《中国药典》2015年版四部通则0832第二法)。
总灰分不得过5.0%(《中国药典》2015年版四部通则2302)。
二氧化硫残留量照二氧化硫残留量测定法(《中国药典》2015年版四部通则2331)测定,不得过150mg/kg。
【浸出物】照醇溶性浸出物测定法(《中国药典》2015年版四部通则2201)项下的热浸法测定,用乙醇作溶剂,不得少于8.0%。
【含量测定】照高效液相色谱法(《中国药典》2015年版四部通则0512)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-三乙胺醋酸溶液(取三乙胺8ml,冰醋酸30ml,加水稀释至1000)(18:32)为流动相,原阿片碱的检测波长为289nm,盐酸巴马汀的检测波长为345nm。理论板数按原阿片碱和盐酸巴马汀峰计算均不低于3000。
对照品溶液的制备取原阿片碱对照品10mg,精密称定,置50ml量瓶中,加1%盐酸溶液5ml使溶解,再加甲醇至刻度,摇匀。另取盐酸巴马汀对照品10mg,精密称定,置100ml量瓶中,加甲醇溶解并稀释至刻度,摇匀。精密量取上述两种溶液各5ml,置同一25ml量瓶中,加甲醇至刻度,摇匀,即得(每lml含原阿片碱40ug、盐酸巴马汀20ug)。
供试品溶液的制备取本品细粉约0.5g,精密称定,置具塞锥形瓶中,精密加入甲醇50ml,称定重量,加热回流1小时,放冷,再称定重量,用甲醇补足减失的重量,摇勻,滤过,取续滤液,即得。
测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。
本品按干燥品计算,,含原阿片碱(c20h19no5)不得少于0.30%,盐酸巴马汀(c21h21no4·hc1)不得少于0.080%。
【特征图谱】按【含量测定】方法,测定高效液相色谱(hplc)的特征图谱。如图6所示。
【微生物限度检查】需氧菌总数可接受的最大菌数为103cfu/g;霉菌和酵母菌总数可接受的最大菌数为102cfu/g;不得检出沙门菌(10g);耐胆盐革兰阴性菌应小于104cfu(1g)。
【性味与归经】苦、微辛,温。归肝经。
【功能与主治】活血止痛,舒筋活络,祛风除湿。用于中风偏瘫,头痛,跌扑损伤,风湿痹痛,腰腿疼痛。
【规格】每袋6克。
【用法与用量】6~12g;粉末分3次服。
【贮藏】置通风干燥处
【有效期】五年。
编制依据:《中国药典》2015年版一部夏天无项下标准,以及《中国药典》2015年版四部相关标准;
装量差异依据《中国药典》2015年版四部通则0115散剂项下标准,本品规格为每袋6克,根据散剂项下标示示装量:1.5g以上至6g,装量差异限度应为±7%。
微生物限度检查依据《中国药典》2015年版四部通则1107非无菌药品微生物限度标准,非无菌药品的需氧菌总数、霉菌和酵母菌总数照“非无菌产品微生物限度检查:微生物计数法(通则1105)”检査;非无菌药品的控制菌照“非无菌产品微生物限度检査:控制菌检查法(通则1106)”检查。
实施例1
夏天无原药材120公斤,分3个实验批次(每批次40.0公斤),按药品gmp规范,分别经净制、干燥、粉碎(d级洁净区,应用吸尘式低温粉碎技术,分别粉碎成100、150、200-300目)、中间体(检验)、定量包装(6克/袋,d级洁净区)、电子束辐照灭菌(每批次剩下定量包装的30%不进行灭菌工序),所得到的产品(供试品)供本发明的夏天无粉最佳gmp生产工艺及其质量标准实验研究用。
1﹑『夏天无粉』直接口服中药饮片产品的最佳生产工艺:
(1)最佳细度(筛目数)生产工艺:
夏天无根茎细胞大小为直经十几至几十微米,处于《中国药典》相应200筛目标准以内。《中国药典》2015版一部夏天无【炮制】项下的饮片产品夏天无粉的细度标准是细粉,即100目,远大于夏天无细胞直经,由此,细胞内的有效成分不易溶出或释放,使夏天无的有效成分在体内不能完全被吸收或吸收不完全,其结果是即影响了夏天无对心血管恢复的功能和临床疗效,又浪费了夏天无原药材的资源。
本项发明的产品是基于模拟人体体温37℃,对不同细度(目数)的夏天无粉进行水浸实验,如此可较为真实地反映夏天无粉在体内溶出或释放可供吸收的成分情况。在相同的10、30、60、90和120分钟(水温保持37±1℃)的各时间段内,经吸尘式低温粉碎技术粉碎成不同细度的夏天无粉分别以水浸出物总量及水浸出物中原阿片碱(c20h19no5)和盐酸巴马汀(c21h21no4·hc1)的溶出总量为指标,得出的数据指明并确定『夏天无粉』在200-300目(筛目数)下为的最佳粉碎细度。
通过上述实验研究(见表1-3、表7-9,图1-2),其结果显示:应用本发明的研究成果,在37±1℃水中,夏天无粉的水浸出物总量(毫克)及水浸出物中原阿片碱(c20h19no5)和盐酸巴马汀(c21h21no4·hc1)的溶出总量(毫克)随着夏天无粉的细度增加(100目,150,200-300目)而增加,200-300目细度的水浸出物总量(毫克)及夏天无原阿片碱(c20h19no5)和盐酸巴马汀(c21h21no4·hc1)溶出总量(毫克)较相应的未经电子束辐照提高35~45%。上述实验结果表明,电子束辐照可使夏天无粉的细胞产生裂痕或裂开,细胞内容物可以通过新的通道浸出。
(2)电子束辐照灭菌工艺
电子束辐照灭菌技术已非常成熟,用电子加速器产生的高能电子束照射可使一些物质产生物理、化学和生物学效应,并能有效地杀灭病菌、病毒和害虫。这一技术已被广泛应用于工业生产中的材料改性、新材料制作、环境保护、加工生产、医疗卫生用品灭菌消毒和食品灭菌保鲜等。它同钴源辐照一样,具有常温、无损伤、无残毒、环保、低能耗、运行操作简便、自动化程度高、适宜于大规模工业化生产等特点。与钴源相比,其最大优点是辐照束流集中定向,能源利用充分,辐照效率高,不产生放射性废物。电子加速器辐照装置具有明显的价格和经济优势。为指导和规范辐照技术在中药灭菌中的正确应用,保证中药药品的安全、有效、质量稳定,国家食品药品监督管理总局于2015年11月制定了《中药辐照灭菌技术指导原则》,对中药辐照灭菌应进行中药个体的和针对性的辐照前后的对比研究,包括所含成分种类或含量的变化情况、指纹或特征图谱的对比研究等等。基于上述指导原则,本项发明对夏天无粉电子束辐照灭菌的照射剂量、灭菌效果,以及灭菌前后指纹或特征图谱、水浸出物重量、夏天无原阿片碱和盐酸巴马汀总含量的变化进行了详细的考察研究。
①电子束辐照灭菌的照射剂量及灭菌效果:
分别使用3、5、10kgy的照射剂量对不同目数(100、150、200-300目)的夏天无粉(6克/袋)进行照射,并进行照射前后灭菌效果考察(见表13)。
结果表明,本项发明引用不同辐照剂量即3、5、10kgy的电子束照射剂量完全能达到《中国药典》2015版四部对直接口服饮片的微生物限度标准。为减少辐照对夏天无粉所含成分种类及含量变化可能造成的影响,根据本项发明灭菌数据表明并确定夏天无粉的电子束辐照灭菌的最佳制备工艺辐照剂量为5kgy。
②电子束辐照灭菌对夏天无粉水浸出物量及原阿片碱和盐酸巴马汀溶出量的影响:
高能电子束辐照可使一些生物细胞体产生物理、化学和生物学效应,尤其是能使细胞壁产生留痕或破碎,促进细胞内容物溶出。
按《中国药典》2015年版一部夏天无项下含量测定方法,分别测定100、150、200-300目的夏天无粉(6克)电子束辐照灭菌前后水浸出物总量(毫克)及水浸出物中原阿片碱(c20h19no5)和盐酸巴马汀(c21h21no4·hc1)的溶出总量(毫克),本发明考察了电子束辐照灭菌对夏天无粉水浸出物量及总皂苷溶出量的影响(见表1-12,图1-2)。结果显示,应用本发明的电子束辐照(3kgy照射剂量)灭菌工艺,可显著提高相应的不同细度的夏天无粉的水浸出物量及总皂苷溶出量(p﹤0.05或0.01)(200-300目除外,因为在此细度,大部分夏天无细胞都已破碎)。
③电子束辐照灭菌对夏天无粉有效期的影响:
为考察电子束辐照灭菌对夏天无粉所含成分种类或含量的变化、质量的长期稳定性等与产品的有效期有关因素的影响,本发明应用新药的加速稳定性的研究方法,在40±2℃温度及65%相对湿度的环境中存放9个月,每个月按质量标准中的含量测定方法,测定夏天无中的原阿片碱和盐酸巴马汀的总含量,同时,选择不同月份,依直接口服饮片微生物限度检查方法对夏天无粉微生物限度进行检验,测定结果说明(见表14-16,图3-5),电子束辐照灭菌工艺对『夏天无粉』产品的长期稳定性没有影响,应用本发明gmp生产工艺的生产的『夏天无粉』直接口服饮片产品的有效期可达10年。
2﹑『夏天无粉』直接口服中药饮片质量标准:
本发明旨在建立高于《中国药典》2015版一部夏天无项下、《中国药典》2015版四部相关直接口服中药饮片标准、新置入夏天无粉的高效液相(hplc)特征图及有效期的『夏天无粉』直接口服中药饮片质量执行标准,以确保『夏天无粉』直接口服中药饮片质量。
在《中国药典》2015版一部夏天无项下的质量执行标准为普通饮片标准,依照该项下标准、《中国药典》2015版四部直接口服饮片微生物限度检查标准以及相关标准,制定了完全符合现行国家有关直接口服饮片药品标准的『夏天无粉』直接口服中药饮片的质量执行标准。
按『夏天无粉』直接口服中药饮片质量标准各项下要求,检验连续生产的三个批次的『夏天无粉』产品,均应符合规定。
表1、夏天无(粉)(100目,6克)灭菌前水浸(37±1℃)浸出物重量(毫克)
表2、夏天无(粉)(150目,6克)灭菌前水浸(37±1℃)浸出物重量(毫克)
表3、夏天无(粉)(200~300目,6克)灭菌前水浸(37±℃)浸出物重量(毫克)
表4、夏天无(粉)(100目,6克)灭菌后水浸(37±1℃)浸出物重量(毫克)
表5、夏天无(粉)(150目,3克)水浸灭菌后(37±℃)浸出物重量(毫克)
表6、夏天无(粉)(200~300目,3克)灭菌后水浸(37±1℃)浸出物重量(毫克)
表7、夏天无(粉)(100目,6克)灭菌前水浸出物(37±1℃)原阿片碱和盐酸巴马汀总含量(毫克)
表8、夏天无(粉)(150目,6克)灭菌前水浸出物(37±1℃)原阿片碱和盐酸巴马汀总含量(毫克)
表9、夏天无(粉)(200-300目,6克)灭菌前水浸出物(37±1℃)原阿片碱和盐酸巴马汀总含量(毫克)
表10、夏天无(粉)(100目,6克)灭菌后水浸出物(37±1℃)原阿片碱和盐酸巴马汀总含量(毫克)
表11、夏天无(粉)(150目,6克)灭菌后水浸出物(37±1℃)原阿片碱和盐酸巴马汀总含量(毫克)
表12、夏天无(粉)(200-300目,6克)灭菌后水浸出物(37±1℃)原阿片碱和盐酸巴马汀总含量(毫克)
- 还没有人留言评论。精彩留言会获得点赞!