用于形成人类神经元细胞和神经胶质细胞的功能网络的方法与流程
本发明涉及一种用于形成人类神经元细胞和神经胶质细胞的功能网络(以下也称为神经元网络)的方法。该方法可以用于监测神经元网络的形成且同时尤其用于对影响人脑中的神经元和/或神经元网络形成的疾病进行建模。
背景技术:
d.y.kim等人athree-dimensionalhumanneuralcellculturemodelofalzheimer’sdisease,nature2014,515,274-278的实际研究描述了以基因技术方式修饰嵌入到bdbiosciences公司的
从s.koutsopoulos等人,long-termthree-dimensionalneuraltissueculturesinfunctionalizedself-assemblingpeptidehydrogels,matrigelandcollageni,actabiomater.2013,feb;9(2);5162-5169已知-类似于
在us6306922a和us6602975a中描述了一种可生物分解的光聚合的水凝胶。然而在接近uv谱的波长下聚合可能由于形成自由基而造成在细胞培养体系中的细胞死亡和dna突变。在本发明的体系中预期没有由于uv波引起的细胞损伤,因为在正常的实验室条件下且在没有uv光的情况下进行聚合。另外,取消uv诱发的光聚合物使得在此描述的水凝胶体系在高度专业化的实验室之外的应用变得明显更简单,因为不要求特殊的设备来进行聚合。
技术实现要素:
本发明的目的在于,开发一种与上述先前公开物相比显著改进的与人类来源细胞相关的模块式体外体系或方法,该体系或方法在三维基质中形成功能性神经元网络。对于此类体系而言最重要的评价指标是神经元网络的质量,该神经元网络应尽可能模仿在中枢神经系统的神经元组织中的活体情形。另外该体系应容易操作并且为在没有高度专业化的实验室的情况下(例如还有在移植方法中)进行应用提供可靠的前景。
这个目的以根据权利要求1所述的一种用于形成人类神经元细胞和神经胶质细胞的功能网络的方法来实现。改进方案在从属权利要求中给出。其他权利要求涉及该方法的用途。
根据本发明,在用于形成人类神经元细胞和神经胶质细胞的功能网络的方法中,将这些细胞引入到具有成分聚乙二醇(peg)和肝素的合成水凝胶体系并在其中培养。在此这些细胞预先已经与这些凝胶成分之一、即peg或肝素混合并且与之一起引入到peg-肝素水凝胶体系中,使得在该三维水凝胶聚合期间这些细胞已经处于该水凝胶体系中。
有利地,在该方法中,将人类神经元细胞与神经胶质细胞共同培养,其中这些人类神经元细胞是人类神经元干细胞和前体细胞、或者源自无限增殖的人类神经元前体细胞系、或者是由中脑获得的原代人类神经元前体细胞。
根据一个有利的实施方式,这些人类神经元细胞是来自诱导性多功能干细胞(ipsc)的人类神经干细胞和前体细胞或者衍生自原代人类皮层细胞。
所形成的网络的功能尤其能够通过表达成熟的神经元皮层标记物、对神经递质的响应(例如以钙流入的形式)以及通过电生理学活性来描述。
根据本发明的一个优选的实施变体,该peg-肝素水凝胶体系是包含多臂聚乙二醇(星形peg)的星形peg-肝素水凝胶体系,该水凝胶体系优选通过可酶裂解的肽序列(mmp肽)来交联,由此该星形peg-肝素水凝胶体系是可裂解的且可局部重构的。特别优选地,四臂聚乙二醇(四臂星形peg)作为多臂聚乙二醇。
在一个实施变体中,该水凝胶的水凝胶基质通过硫醇封端的星形peg-肽共轭物和由马来酰亚胺(优选由4-6个马来酰亚胺基团)官能化的肝素的共价交联构成。在此该水凝胶基质的交联通过迈克尔加成来进行。
替代地,该星形peg-肝素水凝胶体系的水凝胶基质由肝素和共价的星形peg-肽共轭物通过自组织来非共价地构成。在此,该星形peg-肽共轭物包括两个或更多个肽的共轭物,这些共轭物耦合到聚合物链上。该肽序列包含重复的二肽模序(ba)n,其中b是具有带正电的侧链的氨基酸,a是丙氨酸,并且n是5至20、优选5或7的数。
根据本发明的一个特别有利的实施方式,该水凝胶具有通过存储模量表征的可变的机械特性。该存储模量优选在300-600帕斯卡的范围内可变。存储模量的这个范围可以例如通过调节这两种材料成分的混合比(即通过改变交联度(与改变peg对肝素的摩尔比同义))、或者通过改变材料成分的固体含量(即聚合原料的浓度)来改变并且优选借助于振荡式流变法来确定。
在本发明的一个优选的实施方式中,用信号分子和/或用从细胞外基质(ezm)的蛋白质衍生的功能性肽单元(优选粘附肽)来改性该peg-肝素水凝胶体系。
根据本发明的另一种设计,与人类间充质干细胞和内皮细胞一起进行该人类神经元细胞和神经胶质细胞的共同培养,该人类间充质干细胞和内皮细胞以与该人类神经元细胞和神经胶质细胞共同定位的方式存在。
在该方法中,有利地可以使用基因修饰的人类神经元干细胞。这些细胞在水凝胶(优选星形peg-肝素水凝胶)中自然成熟,同时构成完全分化的神经元亚型,它们对于神经元标记物蛋白质如ctip2+、satb2+和tau+为阳性。此外,在使用peg-肝素水凝胶时的培养生存超过10周。
在本发明的方法中,通过快速形成水凝胶,即30秒至最大2分钟,避免了不利的局部去混合作用和不均匀性。快速的、稳健的水凝胶形成是本发明方法的一个实质性优点。
本发明的另一个方面涉及根据本发明方法可获得的人类神经元三维功能网络。通过使用该方法可以将单个神经元联结成三维网络并且显示出在生理上相关的细胞功能。在0.18mm3的体积中例如发育出超过200个子网络,这些子网络进一步彼此联结。每个子网络在此具有总数大于12000个的分支。在本发明的三维细胞培养体系中可以证明强大的网络形成作用以及具有不同类型的完全分化的神经元和共同定位的神经胶质细胞的神经元分支,如稍后将在实施例中详细说明的。
在使用该水凝胶体系的情况下,本发明的方法能够实现:
·模仿人类三维网络结构和人类神经元网络的功能,尤其在形态、细胞类型和分化方面,
·保证细胞培养的稳定性,使得能够在更长的培养时长中维持细胞培养并且尤其在长时间分析期间保持稳定,
·水凝胶基质、生物分子组成和物理特性(如存储模量)的准确调节或匹配,从而可以为了神经元发育和为了对疾病建模而测试不同的外源性细胞指导性(zellinstruktive)信号和信号物质(例如可溶性因子)、细胞外基质的成分和机械特性,
·所构成的神经元网络对有效物质的反应类似于在活体条件下并且因此开启了如下可能性:替代成本密集的动物实验模型并且此外可靠的测试方法还提供治疗上的有效物质,
·确定神经元细胞的电生理活性和隔膜通道活性,
·例如以高分辨率的图片和拍摄技术分析单独的细胞,以便能够研究三维神经元网络中的信号传导和神经元回路,
·实时分析尤其神经元网络的发育过程,
·阵列技术(例如打印)和区域异质性,以便发展器官仿真,
·在使用源自患者的细胞的情况下定制化药物的可使用性,
·与内皮细胞的共同培养,以便研究神经元网络形成与类活体条件下血管形成的相互作用,
·获取对于单独细胞化验、体外细胞扩展和移植目的而言必需的单独细胞。
·移植非毒性且可生物分解的材料;
·多于十周的长时间培养;
·将神经元网络和细胞数量的变化以及进展定量化。
本发明的另一个方面涉及本发明的方法用于监测神经元网络形成的用途。因此尤其由于在三维水凝胶体系中细胞培养的透明性,对神经元网络形成的实时监测是可行的。
在使用本发明方法的情况下监测网络形成可以实现对以下项的定量分析:在该神经元网络之内的神经元细胞的细胞生长,分支的长度、数量和密度和/或连接性和/或电生理活性。
由此还可以对影响人脑中的神经元和神经元网络形成的疾病、神经系统的发育障碍或神经退化疾病进行建模。
在此,该方法的一个特别有利的应用在于对由疾病相关的蛋白质聚集(例如淀粉样蛋白-β-42)造成的神经毒性和/或神经元干细胞可塑性改变进行建模。
在使用本发明方法的情况下监测网络形成还适合于对影响神经元活性和/或网络形成的分子和/或有效物质或药物的测试。
附图说明
本发明设计的其他细节、特征和优点将从参照相关附图对实施例的后续说明得出。附图示出:
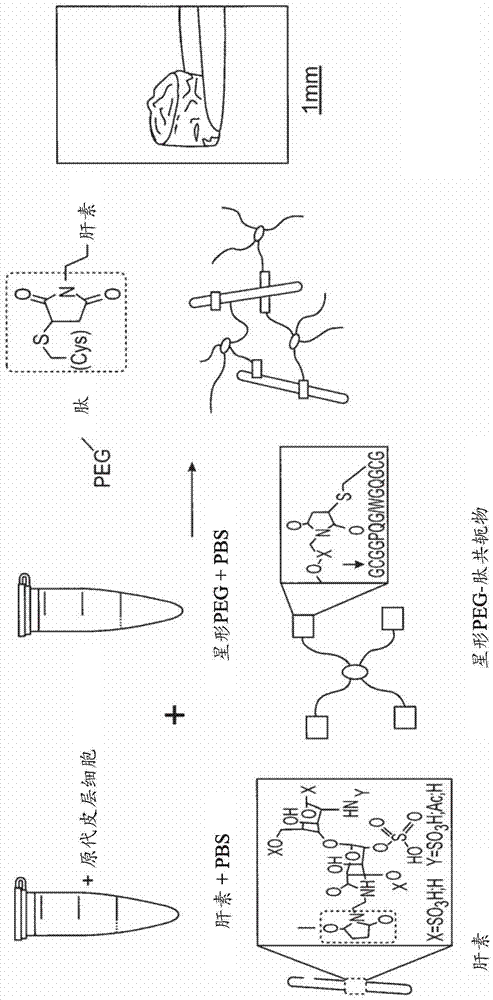
图1:用于制造水凝胶的实施例的图形展示,
图2:神经网络在三周时间段中成熟的显微镜照片,
图3:包含高密度神经和神经胶质网络的三周龄的凝胶的全面三维展示,
图4:针对突触素(syn)和乙酰化微管蛋白(atub)的经封装神经元的免疫反应性,
图5:在加入神经递质谷氨酸盐之前和之后的总荧光强度的测量,
图6:在使用不同标记物/染色剂的情况下对具有三周龄细胞的水凝胶的三重染色,
图7:开始细胞培养之后一周的用合成核苷溴代脱氧尿苷(brdu)孵育所包含的细胞的结果,
图8:由新产生的神经元构成不同的神经元亚型,
图9:在三周之后包含在水凝胶中并且通过增殖新产生的神经元干细胞和前体细胞,
图10:神经丝的表达作为人类神经元干细胞和前体细胞(nspc)的完全成熟的分化状态的另外证据,
图11:制造peg-肝素水凝胶以研究淀粉样蛋白-β-42-多肽在原代人类皮层细胞(phcc)中的作用的图形展示,
图12:水凝胶三重免疫染色,其中针对乙酰化微管蛋白的抗体作为神经元细胞质标记物蛋白质、aβ42作为用于肽聚集体的标记物并且gfap作为用于神经胶质细胞的细胞质标记物,
图13:在没有aβ42(a)、具有细胞内aβ42(a’)和具有细胞外aβ42(a”)的水凝胶中骨架化的经连接的神经元路径的最大强度投影,
图14:在水凝胶中由(a)诱导性多功能干细胞(ipsc)和(b)原代人类皮层细胞(phcc)衍生的人类神经元干细胞和前体细胞(nspc)的针对乙酰化微管蛋白(acet.tubulin,图片a/b)、gfap(图片a”/b”)(用抗体)和核染色(dapi,图片a’/b’)的双重免疫染色,
图15:借助于显微镜照片和定量分析来比较从ipsc(a)或phcc(b)衍生的人类神经元干细胞和前体细胞(nspc)的神经元延伸
图16:星形peg-hep凝胶和其中嵌入的phcc的显微镜对比照片,用于研究白细胞介素-4对aβ42毒性的影响,
图17:具有嵌入的phcc的matrigel和星形peg-肝素水凝胶的显微镜照片,用于比较神经胶质的细胞群体(gfap)、神经元网络形成(乙酰化微管蛋白)以及干细胞群体(sox2)和神经可塑性能力。
图1示出用于制造水凝胶的实施例的示意性图形展示。根据这个展示,使用了原代人类皮层细胞(phcc)。首先将其与肝素一起引入磷酸盐缓冲的盐溶液(pbs)中。在此展示中,将由四臂聚乙二醇(星形peg)和可酶裂解的肽形成的共轭物用作水凝胶的除肝素以外的其他成分,其中peg在每个臂上与肽分子共轭。这些成分与肝素和细胞一起引入磷酸盐缓冲的盐溶液(pbs)中。该水凝胶的水凝胶基质通过硫醇封端的(半胱氨酸侧链,简称cys)星形peg-肽共轭物和由马来酰亚胺官能化的肝素的共价交联构成,其中该水凝胶基质的交联通过迈克尔加成来进行。
以下附图中的多个附图分别展示了显微镜图片,其上分别可以在右下看到一个符号。这个符号显示了一个眼睛,要么从上方要么从侧向观察圆柱形的水凝胶。
从上方观察的眼睛表示,具有此标志的图片是一系列图片在z轴上的最大强度投影的图片。
从侧向观察的眼睛表示,具有此标志的图片是一系列图片在x轴上的最大强度投影的图片。
图2展示了神经网络在三周时间段中的成熟情况。细胞质的神经胶质细胞标记物gfap(来自英文名称“glialfibrillaryacidicprotein”,酸性神经胶质纤维蛋白质)的染色标记了神经胶质细胞的细胞质,其相对于神经元表现出了增长。神经元的细胞质用乙酰化的微管蛋白(atub)来染色。图片a-a”分别显示在嵌入一周之后在所包含的细胞的状态的z轴上的最大强度投影的典型图片。图片b-b”分别显示在嵌入2周之后在所包含的细胞的状态的z轴上的最大强度投影的典型图片。图片c-c”分别显示在嵌入三周之后在所包含的细胞的状态的z轴上的最大强度投影的典型图片。在第一行中可以看到gfap和atub阳性的细胞的组合式染色。在第二行和第三行可以看到,这些细胞分别对标记物atub和gfap做出阳性反应。
图3示出了包含高密度神经和神经胶质网络的三周龄的凝胶的全面三维展示。用gfap染色的神经胶质细胞与用乙酰化的微管蛋白(atub)染色的神经元密切地相互作用,这是出现活体情形的表现。细胞核染色剂4’,6-二脒-2-苯基吲哚,简称dapi,标记了双链的核dna。用dapi标记的细胞在将样品固定以进行分析的时间点是活的。图3中的图片a示出了在atub和dapi双重阳性神经元方面的完整网络。图片b示出了在gfap和dapi双重阳性神经胶质细胞方面的完整网络。
图4示出了在所嵌入神经元的细胞连接和突触末梢
在图5中展示了在加入神经递质谷氨酸盐时总荧光强度的测量结果。在此,图片a1示出在加入神经递质谷氨酸盐之前(-谷氨酸盐)和之后(+谷氨酸盐)从图片a(a2)的细胞1、2和3发射的总荧光强度的测量。图片a2的细胞1、2、3用钙传感器gcampf6转染,当细胞作为对所添加的谷氨酸盐的响应显示出细胞内钙流入时,该钙传感器产生高强度的荧光信号。因此,在a1的图上可以观察到升高的荧光信号,这意味着,转染的细胞针对神经递质进行反应,如在活体情形下所实现的。在加入神经递质谷氨酸盐之前将图片a2中的细胞嵌入到peg-肝素水凝胶体系中。图片a3和a4示出了嵌入在peg-肝素水凝胶体系中的gcampf6转染的细胞的大幅度增加。图片a3示出了加入谷氨酸盐之前的细胞。图片a4示出了加入谷氨酸盐之后由于钙离子流入而测量到的高强度信号。
图6示出了具有三周龄的细胞的水凝胶的三重染色,具有针对神经元细胞质标记物β-iii-微管蛋白(tubb3)、细胞质的神经胶质细胞标记物gfap和dna染色剂4’,6-二脒-2-苯基吲哚(dapi)的免疫反应性。可以看到成簇的细胞的不同形貌特性:在图片中左上明显定向的细胞延伸和在左中部与神经胶质细胞混合的网格状神经元网络。图片a’-a’”示出了tubb3、gfap、dapi的光学通道的单独照片。
开始培养包含在peg-肝素凝胶中的细胞一周之后,将其用合成的核苷溴代脱氧尿苷(brdu)孵育3小时。结果可以在图7中看到,其中箭头分别指向染色的细胞。图片a示出了用抗brdu抗体染色的细胞(细胞核染色)。图片a’示出了,通过抗brdu抗体染色的细胞对于细胞质神经元标记物蛋白质乙酰化微管蛋白(atub)也是阳性的。图7借助于brdu染色示出了,包含在水凝胶中的细胞增殖并且具有神经元身份(通过乙酰化微管蛋白染色的细胞)。
图8示出,从嵌入在水凝胶中并且在其中新出现的神经元产生了不同的神经元亚型,这些亚型等于在活体中在神经元的细胞分化过程中产生的细胞型。在此图片a示出,在水凝胶体系中的细胞对于神经元前体细胞mash1(还以英文名称“achaete-scute家族bhlh转录因子1”,ascl1而已知)和双皮层/dcx是阳性的。图片a’和a”示出用于dcx和mash1染色的单独的光学通道。
图9示出,嵌入水凝胶中并且通过增殖新出现的神经元干细胞和前体细胞在三周之内成熟为细胞,这些细胞表达了成熟皮层神经元的标记物蛋白质,例如ctip2和satb2。
在此图片a示出,在水凝胶体系中的细胞对于核皮层标记物ctip2(还以英文名称“b细胞cll/淋巴瘤11b”,bcl11b而已知)以及神经元的细胞质标记物tubb3是双重阳性的。
在此,图片a’中的箭头指向tubb3阳性的神经元的ctip2阳性的细胞核。图片b示出,这些细胞对于核皮层标记物satb2(其名称为英文名称“特异at序列结合蛋白2"的缩写)以及神经元的细胞质标记物tubb3是双重阳性的。在图片b’中,箭头指向tubb3阳性的神经元的satb2阳性的细胞核。
从图10表现出,细胞对于细胞核染色剂dapi和神经丝的细胞质神经元蛋白质是双重阳性的,该神经丝在成熟神经元中被表达。在此图片a’示出来自图片a的用于dapi染色的光学通道。神经丝的表达是人类神经元干细胞和前体细胞(nspc)在其嵌入和在peg-肝素水凝胶中成熟之后的完全成熟的分化状态的另一个证明。
图11包含制造peg-肝素水凝胶以研究淀粉样蛋白-β-42-多肽(aβ42)在原代人类皮层细胞中的作用的图形展示。在步骤1中将第二传代(passage)的细胞以5x103每cm2的密度放置在培养皿中。为了aβ42神经毒性模型的目的,同样将第二传代的细胞以5x103/cm2的密度放置在培养皿中并且用2μm的aβ42孵育48小时(步骤1’)。
在48小时之后收获细胞并且在步骤2中在8x106个细胞每ml的浓度下重新悬浮到磷酸盐缓冲的盐溶液(pbs)中。然后加入相同体积的肝素溶液(pbs中45μg/μl)并且在步骤3中将两者混合至4x106个细胞/ml的最终浓度。在用aβ42包裹嵌入peg-肝素水凝胶体系中的细胞的细胞外环境的情况下,在步骤3’中加入浓度为40μm的aβ-42-肽混合物。
为了浇注凝胶,在步骤3中将细胞溶液、pbs和肝素与等体积的星形peg混合。在这个步骤中,根据步骤3’浇注的凝胶具有20μm的细胞外aβ42浓度。在所有水凝胶中的细胞浓度为2x106个细胞/ml。用于形成凝胶的反应持续两分钟。在浇注之后将凝胶放置在24孔培养板中,其中每个孔包含培养介质。为了培养和孵育凝胶,在37℃下使用5%co2/95%空气的比率。可以将凝胶培养至所希望的时间点。
图12示出了水凝胶三重免疫染色,其中针对乙酰化微管蛋白的抗体作为神经元细胞质标记物蛋白质、aβ42作为用于肽聚集体的标记物并且gfap作为用于神经胶质细胞的细胞质标记物。图12示出了三周龄的凝胶的y轴上的最大强度投影图,在图片a-a”中没有aβ-42、在图片b-b”中具有细胞内aβ42、在图片c-c”中具有细胞外aβ42。在第一行图片(即图片a-c)中展示了用于以乙酰化的微管蛋白染色的通道,乙酰化的微管蛋白突出了所形成的神经元网络。在第二行图(a’-c’)中展示了来自第1行的神经元网络以及所形成的aβ-42的淀粉样蛋白聚集体,该聚集体已经在凝胶的整个体积中传播开。在aβ42聚集体的存在下神经元网络的损失是显著的,见图片b’和c’与不含aβ-42聚集体的样品(参见图片a’)的比较。在第3行中展示了用于gfap染色的通道。由于aβ42聚集体造成的细胞损失和神经元网络损失的量化在后面的图13中展示。
图13示出了在没有aβ42(a)、具有细胞内aβ42(a’)和具有细胞外aβ42(a”)的凝胶中骨架化的经连接的神经元路径的最大强度投影。
图a-a”示出在所有情况下的用于atub阳性细胞的通道,即在图12的没有aβ42(a)、具有细胞内aβ42(a’)以及具有细胞外aβ42(a”)的对照的情况下。图13的图片b示出了在没有aβ42、具有细胞内aβ42、具有细胞外aβ42的凝胶内的平均细胞数的量化。图片c示出了在没有aβ42、具有细胞内aβ42、具有细胞外aβ42的凝胶内的平均网络数的量化。图片d示出了在没有aβ42、具有细胞内aβ42、具有细胞外aβ42的水凝胶内每个网络的平均分支数的量化。
为了实现通过人类神经元干细胞和前体细胞(nspc)构成神经网络的培养条件,用mmp可裂解的位置来产生三维peg-肝素水凝胶。这种修改使得细胞能够将其环境重新结构化。水凝胶合成在tsurkanm.v.等人,definedpolymer-peptideconjugatestoformcell-instructivestarpeg-heparinmatricesinsitu.advancedmaterials(2013)中描述。
当细胞在聚合步骤中被引入这种peg-肝素水凝胶时,出人意料地观察到,在引入细胞之后一周,凝胶已经包含少量分散的具有3d分支形貌的gfap阳性的神经胶质细胞。在细胞培养两周之后,观察到对于乙酰化微管蛋白阳性的神经元扩散并以簇排列。在培养三周之后,细胞培养显示出具有散布的神经胶质细胞的广泛、精细的神经元网络。另外,nspc的3d培养可以通过突触标记物突触素来染色,突触素在神经元结和结点处累积,这表明与2d培养相比更成熟的突触连接。与之相反,在用神经元和神经胶质细胞的2d培养中没有观察到在突触处的簇中染色的突触素。
3d水凝胶中的神经元还是对于神经递质(如谷氨酸盐)有响应的,这可以通过提高细胞内钙水平来证明,该细胞内钙水平通过用cmv促进剂驱动的钙传感器转染gcamp6f表达的质粒来确定。这个结果显示出,nspc的3d培养能够产生神经元和神经胶质细胞在三维排列中的完整网络。较老的皮层亚型标记物(如ctip2和satb2)、原神经标记物mash1和dcx以及完全成熟的神经标记物神经丝(用于完全分化的神经元的标记物蛋白质)也在nspc培养中得以表达,这表明在3d培养中存在的神经元细胞在主导条件下发育成成熟的神经元。
还使用了淀粉样蛋白-β-42肽,一种与阿尔茨海默病相关的错误折叠的蛋白质,以便将其毒性和其对神经元网络的影响进行建模。使用三维水凝胶体系来进行培养的本发明方法还能以此方式用作神经退化疾病的模型。可以看出,淀粉样蛋白-β-42的聚积在活体中和体外都影响神经元网络形成和神经元连接性。为了研究淀粉样蛋白-β-42(aβ42)是否影响神经元网络,进行了培养,其方式为在引入到水凝胶体系中之前用aβ42处理细胞(细胞内aβ42)或者在引入细胞之前用aβ42孵育水凝胶(细胞外aβ42)。与其中可以观察到广泛的神经网络形式的形成的对照凝胶相比,细胞内和细胞外aβ42显著影响了网络形成。与对照凝胶相比,用aβ42处理的凝胶包含明显减少的细胞和网络数量。另外还可以观察到,即使在用aβ42处理的凝胶中形成了若干网络,这些网络也包含明显更少的每网络分支数量。还已经发现,aβ42处理与在人脑中类似地导致了轴突的营养不良。这个结果显示,3d凝胶可以重现aβ42的人类病理生理学,它对神经元网络的形成施加了毒性作用,而无论神经元干细胞或前体细胞的神经形成能力如何。此外,三维水凝胶体系可以用作实际的筛选平台,以便测试在aβ42的存在下也能够恢复人类干细胞的神经形成能力和神经元网络形成的化合物。
在现有技术的改进方案中使用模块式且良好可控的水凝胶材料体系,该体系能够实现将独立地细胞指导性的信号模块化,这些信号在天然的细胞环境(所谓的细胞外基质(ezm))中出现,但是尤其将网络的物理特性(水凝胶的刚性在200pa至6kpa的范围内)、可分解性和生物分子组成(用粘性肽和信号肽、可溶细胞活素和生长因子功能化)模块化,如从tsurkanm.v.等人,definedpolymer-peptideconjugatestoformcell-instructivestarpeg-heparinmatricesinsitu.advancedmaterials(2013)中已知的。因此可以按系统性的方式(并且彼此独立地)测试一系列材料特性中多个参数。此外,水凝胶在温和、对细胞友好的条件下交联,以便实现细胞的高生存能力。此外这些细胞可以在基质之内以区域的异质性来挤压细胞,以便产生具有良好生存能力的分化结构。
所使用的三维培养包含对成熟神经元的标记物蛋白质阳性的神经元细胞,例如ctip2和satb2。这是对于在培养中存在的成熟皮层神经元的指标,该指标示出非常类似于活体条件下的细胞分化度。另外,可以在3d中测量所培养的细胞的电生理活性和隔膜通道活性,这是同样示出根据本发明所使用体系的活体类特征的函数。
具有全面的神经元网络的培养可以在三周之内产生并且可以存活至少10周。由于快速产生和培养条件,用于基于ips的定制化药物的水凝胶3d培养可以在每种脑疾病期间应用,以便例如在临床治疗之前对患者细胞测试不同有效物质的效果。此外,本发明的方法使得神经胶质和神经元前体群落的快速扩展更容易并且可以应用于要求大量细胞的基于细胞的疗法。
在此首次描述的3d水凝胶细胞培养体系的另一个实质性优点是包围细胞的凝胶材料的透明度。为了分析目的,3d培养是透明的并且可以用于显微实时拍照和要求组织的高透明度的其他分析。与此相对地,3d培养可以实现通过光学和显微学方法对网络形成和神经元分支的定量测量,其中可以观察在培养的整个时间段上的网络形成。如已经提及的,该体系还可以实现对单独神经元和神经元回路的电生理活性和隔膜通道活性的测量。此外,已经开发了一种算法,以便跟踪凝胶中的细胞化合物并且定量地展示统计结果。
根据当时的认识水平,优选使用的具有原代人类皮层细胞的星形peg-肝素培养体系是用于神经元细胞的唯一的3d培养体系,该培养体系提供了可定量且完整的神经元网络。
与通过本发明方法可获得的大得多的神经元网络(在根据本发明使用的peg-肝素水凝胶提供的整个培养空间上延伸)相比,在kim等人的体系中,神经元网络质量明显更低。在根据koutsopouloss.等人的体系中确定了较低的细胞存活能力并且该网络的质量也明显劣于细胞响应性的星形peg-肝素体系所提供的。
此外,这两种体系(kim/koutsopoulos等人)基于bd-matrigel,即一种从engelbreth-holm-swarm(ehs)小鼠恶性肿瘤(一种肿瘤组织)提取的细胞外基质。除了对于matrigel已知的不同批次的大幅度波动(这使得结果的可重现性变得复杂)之外,包含此类产品的肿瘤型的信号物质和细胞成分改变对这些细胞的正常的分子信号传导。因此,此类产品不适合于研究脑发育以及移植和/或研究神经退化过程,因为这些在活体中的分子过程与在肿瘤组织中存在的环境非常不同。根据本发明使用的水凝胶体系基于合成的peg和具有充分已知的分子特性(如分子量分布和功能,总是在使用前进行测试)的、生物衍生的但经提纯的肝素。因此,当前的体系也没有显示出可重现性问题而且也没有免疫形成反应。
dawaizhang和koutsopoulus等人还使用了自组织的肽水凝胶和胶原蛋白类型i凝胶用于培养神经元细胞。在胶原蛋白的情况下,与matrigel类似,出现不同批次的变化。在所有其他迄今为止使用的水凝胶体系(例如puramatrix、自组织肽、胶原蛋白i和matrigel)中,物理特性是尤其不受限定的并且大幅度变动的,并且不能独立于生物分子组成而变化。与之对应地,在此使用的材料不允许独立地研究力学和生物分子刺激的影响并且遭受较差的可重现性。
因为由细胞外基质(ezm)的组成和排列形成的这些不同的刺激形成了用于影响干细胞活性和组织的新形成的关键参数,所以由现有技术已知的体系不允许彼此分离地研究力学和生物分子信号。相反,由于在多个由细胞外基质衍生的信号与其多效性作用之间的复杂共同作用,体外测试在鉴别外源性刺激对组织结构化的功能时形成了挑战。
这样可以应用在此使用的良好限定的且可以模块化匹配的peg-肝素水凝胶,以便将机械和生物分子信号彼此独立地模块化,因为水凝胶的组成可以独立地调节(tsurkanm.v.等人,definedpolymer-peptideconjugatestoformcell-instructivestarpeg-heparinmatricesinsitu.advancedmaterials(2013))。另外,本发明的3d水凝胶体系还是细胞响应性的,例如通过mmp可裂解的位置,这例如能够实现由细胞触发的重构过程和通过适合的基质进行的替换,以便实现与在脑组织中活体条件的更大相似度。先前描述的已知的用于三维神经元网络的方法缺少受限定的组成,该受限定的组成允许将3d培养体系的机械和生物分子特性以及3d水凝胶中的细胞外基质的依赖于细胞的再组织针对性地模块化。
因此,所使用的3d细胞培养平台用作有利的细胞培养体系,以便在干细胞活性和分化方面解释基质特性的作用,其前提是这些细胞动态地与水凝胶体系共同作用来产生覆盖细胞的细胞外基质。另外,所使用的3d水凝胶体系不仅可以共价地用粘性分子或信号分子覆层还可以非共价地用结合肝素的信号分子覆层。总体上可以关于人类神经元干细胞和前体细胞的细胞增殖以及神经元网络形成来系统性地研究多个细胞指导性的外源性信号的影响。
许多3d体系(包括类器官)不能形成大小和形状可重现的结构。本发明的3d培养可以适配这两个参数并且可以被针对性地控制并因此提供实质上更好地限定的3d细胞培养条件。
在us6,306,922a和us6,602,975a中描述的可生物分解的水凝胶是光聚合的水凝胶。也就是说,为了在特定电磁条件下聚合和形成凝胶,需要特殊的发射紫外光(uv光)的设备。uv光导致在嵌入的细胞处产生自由基并且导致诱发细胞凋亡的信号通路,这些信号通路可能导致细胞死亡并且不利地影响细胞活力。uv光还造成dna突变和嵌入细胞的细胞dna的损伤。与此相反,在本文中描述的创新的3d水凝胶体系中,基质在室温下且在没有使用uv光的情况下聚合。以此方式不产生细胞处的dna损伤和突变,从而更好地保持细胞功能。另外,取消uv诱发的聚合允许在不使用昂贵设备的情况下使用该3d水凝胶体系。这个优点使得该体系对用户友好并且因此对于在高度专业化的实验室之外使用而言是理想的。
此外,当前体系是在使用质粒的情况下能够实现针对性的基因异常表达的唯一体系,用以过度表达基因的可工作版本(增强功能)或者调控基因,例如通过使用sirna(小干扰rna)或非功能性的显性负性的基因变体(减弱或丧失功能)。
已经描述了通过质粒表达体系驱动的钙传感器(gcamp)的使用。该异常表达体系涉及匹配3d凝胶的质粒转染方法。
与关于在使用matrigel的3d培养中对阿尔茨海默病(ad)建模的先前报道相比,peg-肝素-3d凝胶允许显著更快地发育网络,该网络例如对于在高通过量有效物质筛选平台中的应用提供了优点。
迄今为止在使用人类神经元的3d凝胶体系中没有能够看到完整的网络形成。迄今为止的3d培养使用了漂浮型或嵌入matrigel的体系并且使用了经修饰的细胞。
在先前的3d培养中不能检验网络形成的质量,因为网络的形成不能定量化。通过本发明方法获得的三维培养能够实现对网络形成的定量测量,例如轴突和神经突的长度和数量、分支和联结点以及神经元分支的数量。迄今为止这都是不可能的。此外,根据本发明使用的体系允许在细胞培养周期期间所嵌入细胞的实时拍照和监测。
用于成熟皮层神经元的3d培养表达了皮层标记物,例如ctip2和satb2。
在所培养的细胞中可以在3d中测量电生理活性和隔膜通道活性,其方式为在应用质粒载体的情况下转染基因。在关于骨架中或作为类器官的3d培养的先前研究中,必须操作细胞的基因组。通过可能的转染方法可以在不从基因方面改变细胞自身或使用病毒的情况下进行异常表达。
具有扩展的神经元网络的培养可以在3周之内产生并且可以保持生命大于16周。由于快速产生和培养条件,用于基于ips的定制化药物的3d培养也可以在脑疾病期间应用,以便例如在临床治疗之前在患者自身的细胞上测试不同有效物质对患者的效果。
该培养是光学透明的并且可以用于实时拍照和要求组织的明显可见性的其他分析。先前已知的基于3d骨架或基于类器官的体系不是这种情况。
不需要在基因方面修饰这些细胞即可形成3d网络,
本发明的方法在使用水凝胶体系的情况下能够实现神经胶质细胞和神经元前体细胞群落的快速表达并且可以用于需要大量细胞的基于细胞的疗法。
具体实施方式
实例1
在实例1中使用了原代人类皮层细胞(phcc)。
从怀孕21周胎儿的组织捐献者的大脑皮质中分离phcc,并且从sciencellresearchlaboratory(srl,目录编号1800)公司在第一传代中以冷冻状态获取。细胞认证为对于hiv-1、hbv、hcv、支原体、细菌、酵母菌和真菌为阴性。将phcc放置在常规的t75烧瓶或24孔板中,并且在使用星形胶质细胞介质(srl,目录编号1801)的情况下通过5%的胎牛血清(srl,目录编号0010)、1%的星形胶质细胞生长剂(srl,目录编号1852)和1%的青霉素/链霉素溶液(srl,目录编号0503)补充,在37℃下具有5%co2/95%空气的气氛下的孵化器中培养。
如在tsurkan等人,advancedmaterials2013,vol.25(18)pp.2606-2610中描述地制造了peg-肝素水凝胶,有以下变化:在使用
实例2
peg-肝素的形成和细胞的嵌入
如在tsurkan等人,advancedmaterials2013,vol.25(18)pp.2606-2610中描述地制造了peg-肝素凝胶,有以下变化:
从培养容器在使用
为了使用已经用淀粉样蛋白-β-42(aβ42)预处理的凝胶,在将细胞从培养容器中取出之前以及在将细胞嵌入水凝胶之前用2μm的aβ42孵育细胞48小时。为了产生包含aβ42的凝胶环境,首先将细胞溶解在4μl的100μmaβ42-肽在pbs中的溶液中。将6μl肝素溶液(0.448mghep-hm6溶解在6μlpbs中)和10μl的星形peg-mmp溶液(0.347mg星形peg-mmp溶解在10μlpbs中)加入其中并且如先前所述进行混合。在这种凝胶混合物中,aβ42的浓度为20μm并且细胞的浓度为2x106个细胞每ml。
实例3
为了使用已经用淀粉样蛋白-β-42(aβ42)预处理的凝胶,在将细胞从培养容器中取出之前以及在将细胞嵌入水凝胶之前用2μm的aβ42孵育细胞48小时。
免疫细胞化学
将所有水凝胶用以冰冷却的多聚甲醛固定并且在室温下孵育1.5小时,清洗之后在pbs中在4℃下过夜。对于免疫细胞化学,将水凝胶在封堵液(由在pbs中的10%正常羊血清、1%牛血清蛋白、0.1%triton-x组成)中封堵4小时过夜。在不时更换pbs的情况下在4℃下连续两天清洗凝胶。在清洗之后在室温下用次级抗体孵育凝胶6小时(封堵液中1:500)。在2小时的3个清洗步骤之后分别进行dapi染色(在pbs中1∶3000,室温下2小时)。
荧光拍照
对于水凝胶,在使用leica-sp5型的反向共焦和多光子显微镜的情况下进行荧光拍照。将水凝胶放置在具有玻璃底部的培养皿中。将60μl的pbs添加到水凝胶的顶部,以便防止干燥。在使用潜水镜(25x)的情况下捕捉z堆叠(z-stapel)。每个z堆叠具有500μm的z距离。
原代人类皮层(phcc)和衍生自ipsc的神经元干细胞和前体细胞(nspc)在星形peg-肝素水凝胶中的发育对比
图14示出显微镜照片,从而能够在星形peg-肝素水凝胶中形成神经元网络能力方面比较嵌入的phcc和衍生自ipsc的nspc。在此,图片a-a”示出了嵌入到星形peg-肝素水凝胶中的衍生自ipsc的nspc的500μm厚z堆叠的最大强度投影,这些水凝胶用rgd肽改性、对于乙酰化微管蛋白(乙酰化的微管蛋白,见图片a)染色、用dapi(图片a’)染色以及用gfap(图片a”)染色。图片b-b”示出了嵌入到星形peg-肝素水凝胶中的phcc的500μm厚z堆叠的最大强度投影,对于乙酰化微管蛋白(乙酰化的微管蛋白,见图片b)染色、用dapi(图片b’)染色以及用gfap(图片b”)染色。
图15在图片a中示出在tubb3染色之后人类皮层nspc的神经元延伸的最大强度投影。图15的图片b示出在tubb3染色之后衍生自ipsc的nspc的神经元延伸的最大强度投影。图片c在图表中示出图片a和b的神经元网络特性的定量化和对比。
根据本发明使用的水凝胶可以共价地用不同的由基质衍生的肽(如rgd(arg-gly-asp))改性或者用于可溶信号分子的有效给药。以此方式能够测试外源性信号分别对人类神经元干细胞和前体细胞增殖以及神经元网络形成的效果。能够用许多不同分子改性这种星形peg-肝素水凝胶体系的事实给了应用者创造定制环境的可能性。例如这可以实现:使peg-hep骨架与rgd肽适配于培养由ipsc衍生的人类神经元干细胞和前体细胞(nspc),如在图14中所示。这样的方法在没有rgd改性的情况下是不可能的。如图15中强调的,在比较原代人类皮层(phcc)与衍生自ipsc的神经元干细胞和前体细胞(nspc)的形成神经元网络的能力时在所使用的水凝胶体系中没有显示出差异。网络的数量以及分支的数量和长度是可比较的,如尤其图15中的图片c所示。由ipsc衍生的神经元干细胞和前体细胞(nspc)相对于原代人类皮层细胞(phcc)的非常类似的发育显示,上述水凝胶体系可以在广阔的应用范围内使用。该水凝胶体系的最有前景的应用预期是在定制药物领域。这意味着可修饰性、对治疗的可响应性(例如关于白细胞介素-4(il-4))以及大量星形peg-肝素水凝胶在相对短的时间内的可生产性。通过培养患者的由ipsc衍生的神经元,可以更好地理解不同的神经元发育障碍。所生成的水凝胶也能够用于鉴别治疗策略。
peg-肝素凝胶与衍生自ipsc的神经元干细胞和前体细胞(nspc)的制造
将从ipsc衍生的具有名称hiptm(bc1系)的人类神经元干细胞和前体细胞(nspc)从amsbio(目录编号:gsc-4311)获得。这种nsc对应于制造商的数据来构造并且在geltrex涂层的细胞培养瓶中培养。为了扩展并且进一步培养细胞,使用根据制造商指示的扩展介质。neuralxtm-nsc介质具有以下组成:2%gs22tmneuronalsupplement,10;1x非必要氨基酸,2mml-丙氨酸l-谷氨酸;20ng/mlfgf2。用accutase(invitrogen)从细胞培养瓶中溶解hiptm-nsc。在12000rpm下离心10分钟之后,在8x106个细胞/ml的密度下将hiptm-nsc重新悬浮在pbs中。对于每个水凝胶,首先将细胞重新悬浮在5微升(μl)pbs中,然后将5μl肝素溶液(在pbs中45μg/μl以及2m整合素配体作为rgd肽(tsurkan,chwalek等人,2011,maitz,freudenberg等人,2013,tsurkan,chwalek等人,2013,wieduwild,tsurkan等人2013))通过pbs中的充分涡旋溶解并且将10μl的peg加入其中,至具有2x106个细胞/ml的20μl的最终体积。将20μl液滴施加到parafilm片上。凝胶形成持续两分钟。将凝胶加到24孔培养板中,其中每个凹陷包含1ml体积的hip扩展介质。为了培养凝胶,采用在37℃下的5%co,/95%空气。然后可以将凝胶培养至所希望的时间点。
peg-hep水凝胶用于分析单独因素对神经形成可塑性和aβ42介导的毒性的影响
图16示出了具有嵌入的phcc的星形peg-hep凝胶的显微镜照片,该phcc来自没有aβ42的对照组(a-d)、具有aβ42的对照组(a’-d’)以及具有aβ42的培养和白细胞介素-4(il-4)(a”-d”),分别在用抗aβ42抗体染色之后(a-a")、在用dapi染色之后(b-b")、在用抗gfap抗体染色之后(c-c”)和在用抗sox2抗体染色之后(d-d”)。
为了测试il-4在人类中是否与先前例如在斑马鱼研究中所显示的相同地起作用,将上述星形peg-hep水凝胶与phcc一起使用。为此制造具有嵌入的phcc的水凝胶并且用aβ42孵育,如已经说明的。实验构造包含各一个阳性(具有aβ42)和一个阴性对照组(没有aβ42)以及一个具有aβ42和il-4的实验组。实验组中,用aβ42并且同时在100ng/mlil-4的存在下在介质中培养具有嵌入的phcc的星形peg-hep凝胶。在三周的培养阶段之后固定样品并且以免疫学方式针对gfap和sox2染色,以便研究il-4对神经元干细胞和前体细胞的效果。使用了核染色剂dapi以便展示所有细胞。在用aβ42处理的细胞培养中可以观察到与未处理的对照培养相比大幅回落的细胞数量,其中不仅涉及gfap阳性的神经胶质细胞还涉及sox2阳性的神经元。在用aβ42且同时用il-4处理的培养中,细胞数量总体上是与没有aβ42处理的对照培养可比较的。这些结果表明,用il-4处理可能抵消aβ42的神经毒性效果。可以论断,用白细胞介素-4处理激发了gfap阳性细胞以进行增殖,从而形成更多的神经元干细胞和前体细胞。虽然存在有神经毒性的aβ42,但il-4因此提高了嵌入的phcc的神经可塑性。这些数据总体上显示出,用il-4处理激活了人类神经元干细胞的增殖,类似于斑马鱼模型中所示的。il-4因此是未来针对aβ42介导的神经退化的疗法的重要候选物。将具有渗透细胞的序列的特异性aβ42肽加入到当前的基于水凝胶的3d培养中显示出,在此应用的细胞培养方法可以重现人类aβ42毒性的病理并且在星形peg-hep水凝胶体系中还可以研究神经保护效果。
用于制造3d细胞培养的常规方法与星形peg-hep水凝胶体系的对比
图17示出了针对gfap、sox2和乙酰化微管蛋白的免疫染色之后的显微镜照片,用于比较matrigel和星形peg-肝素水凝胶,其中分别嵌入有原代人类皮层细胞(phcc)。在此,图片a-a”’示出嵌入到matrigel中的phcc。相反,图片b-b”’嵌入到星形peg-肝素水凝胶中的phcc。图片a和b分别对于酸性神经胶质显微蛋白质(gfap)染色,以便鉴别神经胶质细胞群落;图片a’和b’分别针对乙酰化微管蛋白(乙酰化的微管蛋白)染色,以便表示神经元的网络形成。图片a”和b’包含dapi染色,以便标记所有细胞。最后,图片a”’和b”’的对比能够实现借助于sox2染色比较干细胞群落的尺度和神经可塑性能力。
在器官中的三维拓扑组织方式赋予组织如结构、匹配特异性和空间相互作用等特性,它们在常规的二维(2d)细胞培养中不可重现。由此三维(3d)细胞培养体系具有显著的优点并且可以灵活使用。基于matrigel的3d细胞培养目前形成了此类技术的优选标准,其中神经元细胞在粘性的凝胶材料中生长,细胞外基质(ezm)蛋白质如胶原蛋白和层粘连蛋白嵌入这些细胞中。然而,在基于matrigel的产品上是在化学方面未限定的并且在其组成方面是异质的并且在不同的特性(如刚性、骨架组成或生物可响应性)方面不能改变。这使得对结果的解释更困难并且几乎不能准确分析不同外源性的和旁分泌的信号对细胞发育的影响。相反,根据本发明使用的基于肝素和peg的水凝胶体系提供了有价值的优点,其方式为能够实现对生物物理和生物分子的基质信号的独立匹配。在图17中matrigel体系和本发明使用的体系之间的直接比较中容易观察到,在这两种基质体系中神经胶质细胞的细胞组成是非常接近的,但是神经形成能力和人类干细胞形成神经元网络的能力在星形peg-肝素水凝胶中明显高于matrigel基质中。在这一点上要注意的是,这两种培养体系在相同的生长介质中在没有添加剂的情况下培养相同的时间段(三周)。在星形peg-肝素水凝胶中观察到神经元网络但在matrigel体系中没有观察到,这是通过在matrigel体系中在神经元之间几乎不能鉴别出成熟的突触连接而确认的。与此相反,在星形peg-肝素水凝胶中的神经元形成了神经元网络。nspc在matrigel体系中没有展现其神经形成特性并且没有形成网络的原因可能在于高度无组织的ezm环境(其作用类似于疤痕组织)。
matrigel-3d培养的制造
对于matrigel细胞培养使用了bdbiosciences公司的matrigel(目录编号:356234)。在每次细胞培养工作和使用matrigel之前,对应于关于“厚度-凝胶方法”的制造商指示将移液管尖端和eppendorf管在-20℃冷冻。在4℃下降matrigel在冰上解冻过夜。在使用accutase(invitrogen)的情况下从细胞培养瓶中溶解第二传代的phcc。在(12000rpm下10分钟)离心之后,在2x106个细胞每ml的密度下将phcc重新悬浮在bdmatrigel中。产生了细胞/matrigel混合物的液滴,以便在37℃下固化。然后加入细胞培养介质(srl,目录编号1801)并且培养凝胶三周。在此,在制造细胞/matrigel混合物之后的那天和随后每两天更换细胞培养介质。
缩写清单
aβ42淀粉样蛋白-β-42
acet.tub乙酰化微管蛋白
atub乙酰化微管蛋白
brdu溴代脱氧尿苷
ctip2成熟皮层神经元的标记物蛋白质,还以如下英语名称已知:“b细胞cll/淋巴瘤11b”,bcl11b
dapi4’,6-二脒-2-苯基吲哚,一种细胞核染色剂
gfap酸性的细胞胶质纤维蛋白质,英文“glialfibrillaryacidicprotein”,用于细胞胶质细胞的细胞质标记物
gcamp钙传感器
hep-hm6肝素,与六个马来酰亚胺基团共轭
il-4白细胞介素-4
ipsc诱导性多功能干细胞
mmp基质金属蛋白酶
nspc人类神经元干细胞和前体细胞;英文术语neuralstemandprogenitorcells的缩写
pbs磷酸盐缓冲的盐溶液
peg聚乙二醇
phcc原代人类皮层细胞;英文术语primaryhumancorticalcells的缩写
hep肝素
satb2成熟皮层神经元的标记物蛋白质,英文名称“specialat-richsequence-bindingprotein2(特异at序列结合蛋白2)”的缩写
sox2转录因子,“决定性别区域y-box2”的缩写
星形星形的(四臂的)聚乙二醇,末端用可酶(基质金属蛋白酶)裂
peg-mmp解的肽连接基团官能化
syn突触素
tubb3β-iii-微管蛋白,神经元的细胞质标记物
- 还没有人留言评论。精彩留言会获得点赞!