脱羧的大麻树脂、其用途和制备其的方法与流程
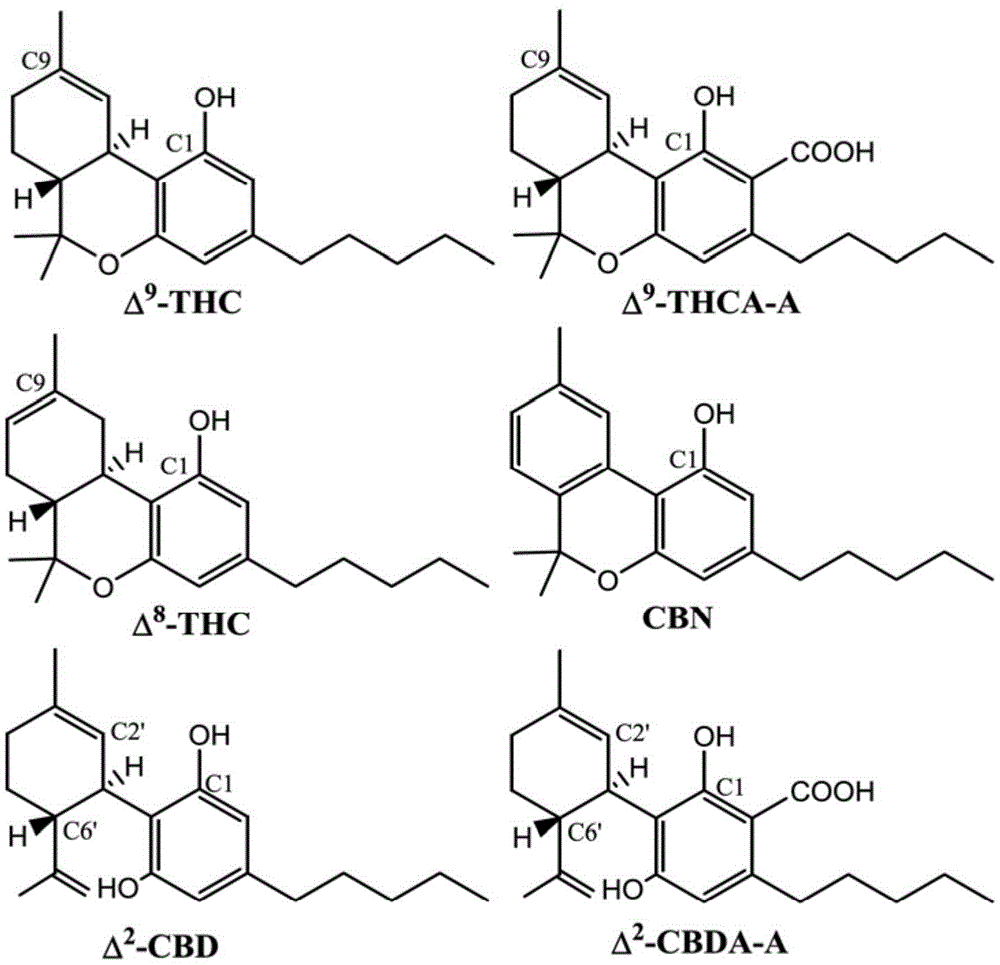
本申请要求根据巴黎公约的2016年6月29日提交的申请号为62/356,262的美国临时专利申请的优先权,其通过引用并入本文,如同其全部内容一样。发明领域本公开涉及脱羧的大麻树脂和脱羧的树脂直接作为药物或天然保健产品、或作为制备大麻衍生产品(包括药物产品、药物制剂和天然保健产品)的原料的用途。本公开还涉及包含脱羧的大麻树脂的产品和组合物。还公开了使用微波提取和脱羧反应制备脱羧的大麻树脂的方法。
背景技术:
:大麻是大麻科(cannabaceae)中的开花植物属。可以识别三个种(大麻(cannabissativa)、印度大麻(cannabisindica)和莠草大麻(cannabisruderalis))。大麻属含有高度复杂混合的化合物,迄今已鉴定出多达568种独特分子(pertwee,r.g.e.,大麻手册.牛津大学出版社:牛津大学,2014)。大麻素(cannabinoids)是大麻属中发现的最值得注意的化合物。在这些化合物中,已知δ9-四氢大麻酚(δ9-thc)、大麻酚(cbn)和大麻二醇(cannabinodiol)(cbdl)具有精神活性(pertwee,r.g.e.,大麻手册.牛津大学出版社:牛津大学,2014)。其他大麻素如大麻二酚(cannabidiol)(cbd)是一种非精神活性化合物,通过各种受体(包括肾上腺素受体和大麻素受体)发挥其生理作用(pertwee,r.g.e.,大麻手册.牛津大学出版社:牛津大学,2014)。大麻素受体(cb1和cb2)属于g-蛋白偶联受体(gpcrs)(cottone,e.;pomatto,v.;cerri,f.;campantico,e.;mackie,k.;delpero,m.;guastalla,a.;dati,c.;bovolin,p.;franzoni,m.f.大麻素受体在金鱼中广泛表达:cb2-样受体的分子克隆和不同器官中cb1和cb2mrna表达图谱的评估。鱼类生理学和生物化学2013,39(5),1287-1296)。由大麻属植物产生的植物大麻素(phytocannabinoids)以及我们体内产生的内源性大麻素(endocannabinoids)与这些受体结合。患者使用医用大麻治疗或寻求各种临床症状的缓解,包括疼痛、焦虑、癫痫发作、恶心和食欲刺激(galal,a.m.;slade,d.;gul,w.;el-alfy,a.t.;ferreira,d.;elsohly,m.a.天然存在的和相关合成的大麻素及其潜在的治疗应用。近期有关cns药物发现的专利2009,4(2),112和downer,e.j.;campbell,v.a.植物大麻素、cns细胞和开发:一个死亡的问题?植物大麻素具有神经毒性。药物和酒精评论2010,29(1),91-98)。众所周知,大麻素和内源性大麻素影响幼年时神经细胞的发育和成熟(downer,e.j.;campbell,v.a.植物大麻素、cns细胞和开发:一个死亡的问题?植物大麻素具有神经毒性。药物和酒精评论2010,29(1),91-98)。从亚麻中分离的大麻素类化合物也显示出抗炎特性(styrczewska,m.;kulma,a.;ratajczak,k.;amarowicz,r.;szopa,j.来自亚麻纤维的大麻素类抗炎化合物。细胞和分子生物学快报2012,17(3),479-499)。大多数大麻素浓缩在大麻植物结构(称为腺毛)中产生的粘性树脂中。从大麻植物分离出至少113种不同的大麻素,最常见的是δ9-四氢大麻酚酸(δ9-thc-a),其是精神活性δ9-四氢大麻酚(δ9-thc)的非活性前体。在新鲜的未干燥的大麻中发现δ9-thc-a的量可变,但是在干燥的情况下逐渐脱羧成δ9-thc,特别是在强烈加热下,例如当大麻被熏制或煮成大麻食用品时。δ9-thc不是从大麻中获得的对人具有治疗益处的唯一物质。例如,研究表明,大麻二酚(cbd)是一些大麻植株的另一个主要成分,已被发现具有抗焦虑作用并具有抗精神病特性,并且可能对人类具有神经保护作用。图1a显示存在于或可从大麻中获得的六种主要大麻素的化学结构:δ9-thc,δ9-thc-a,δ8-thc,大麻酚(cbn),δ2-cbd和大麻二酚酸(δ2-cbd-a)。图1b显示了大麻萜酚酸(cbga)至大麻二酚酸(cbda)、四氢大麻酚酸(thca)和大麻色烯酸(cbca)(它们都可以脱羧成活性大麻素形式)的大麻酚酸合酶途径。在一些情况下,非脱羧的大麻素也可具有治疗特性。脱羧是释放二氧化碳并产生中性大麻素的化学反应。在大麻的一个实例中,非精神活性δ9-thc-a可通过脱羧转化为精神活性δ9-thc。需要生产包含脱羧的大麻素的大麻树脂。本领域已知的大麻树脂或提取物可能不是一致且完全地脱羧的以及包含显著比例的thca和cbda。例如,参见wo2014/159688。本领域的大麻提取物或树脂用于例如蒸发、注入到可食用基质中、以及通过电子吸入装置吸入。因此,本领域的提取物和树脂主要包含thca和/或cbda,与它们的脱羧相对物(分别为thc和cbd)相反,并且仅在通过在可食用基质中蒸发或烹制加热提取物和树脂之后才发生脱羧作用(即,仅在加热提取物和树脂后,大麻素脱羧成其活性形式)。由于本公开的大麻树脂包含脱羧的治疗活性大麻素,它们可以直接使用。例如,本公开的大麻树脂可以直接用于治疗或用于开发用于药物产品的各种大麻制剂,其不需要进一步加热(即,脱羧)成治疗活性形式。如果必须“吸烟”或加热(即“蒸发”),许多人可能不愿意使用大麻(作为药物或天然保健产品)。这可能是因为对吸烟和电子烟(vaping)有负面看法,特别是在老一辈人中。如果大麻是更常规的形式(即片剂形式或其他药物的常规形式),许多人可能更容易接受大麻。为了生产用作药物或天然保健产品的常规形式的大麻,产品中的大麻素必须是脱羧的。还需要开发一种从大麻提取和脱羧大麻素的有效方法。迄今为止,进行大麻素酸脱羧的最简单机制是加热。其他脱羧过程需要有毒溶剂。在这些系统中,可以采用蒸馏方法如分馏来在脱羧后将有机溶剂与大麻提取物分离。除了脱羧之外,还需要从植物材料中提取大麻素。通常在脱羧之前进行提取。从大麻中提取大麻素如δ9-thca和cbda的机制已知包括超声处理、回流(索氏)提取和超临界流体萃取(sfe)。例如,us9,044,390描述了一种分级sfe方法,该方法使大麻植物材料与超临界流体溶剂系统在约750psi至25,000psi之间的压力和约-15℃至200℃之间的温度下接触。随着用于医疗、治疗和休闲目的的大麻的授权使用的增加,越来越需要一种可重复的方法来获得具有已知功效的一致的含活性大麻素的树脂,并优化活性脱羧大麻素的生产和回收。随着需求和潜在用途的增加,还需要一种可以容易地按比例放大以制造商业药物制剂、天然保健品产品或休闲用制剂的方法。技术实现要素:本公开提供了脱羧的大麻树脂。脱羧的大麻树脂包含提取树脂的植物的大麻素分布,但大麻素被脱羧。大麻素至少90%-100%脱羧(即90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%,或其任何分数,例如93.3%脱羧)。与现有技术的一些大麻树脂不同,本公开的脱羧的大麻树脂可以直接使用,例如,在治疗中使用,或者可以用作原料以开发各种药物制剂,其不需要进行加热脱羧成治疗活性形式。除了上述脱羧大麻素之外,在大麻属植物中发现其他化学物质并且在树脂中发现可溶于所用的溶剂的其他化学物质。这些化合物可包括例如萜烯、脂肪酸、叶绿素、黄酮类和其他化合物。由于萃取和脱羧的方法,一些化合物可能经历化学转化。在一些实施方案中,thc和/或cbd是脱羧的大麻树脂的主要成分。本公开内容还提供了从大麻植物材料中提取和脱羧大麻素的改进的方法,该方法包括在使用微波技术提取之前、期间或之后使大麻植物材料脱羧。在一些实施方案中,该方法包括:将大麻植物材料切碎或研磨成较小的片以形成适合于提取的大麻植物材料的大小和形式;从分解的大麻植物材料提取大麻素,通过使分解的大麻植物材料与溶剂接触成混合形式以从大麻植物材料提取大麻素;和使混合物中的大麻素脱羧,通过使混合物经受微波以形成脱羧的大麻素。在一些实施方案中,通过将植物材料暴露于合适的溶剂(例如药学上可接受的溶剂,例如选自由以下溶剂组成的组:80-100%乙醇(例如,80%,85%,90%,95%,97%,98%,100%,以及其任何整数或整数的分数)、乙二醇、异丙醇或类似溶剂的组合),和在溶剂中的植物材料进行微波获得期望的脱羧大麻素(包括树脂),一步完成提取和脱羧步骤。如果不需要100%脱羧,微波步骤的持续时间可以调整以在树脂中得到脱羧大麻素的期望的程度。在一些实施方案中,将溶剂中的植物材料置于微波炉中。在一些实施方案中,将其经受微波一定时间和/或在一定压力和/或一定温度下直至足以产生期望的含有脱羧的(生物活性)大麻素的树脂。在一些实施方案中,切碎、提取和脱羧在一个步骤中完成。在一些实施方案中,当提取和脱羧步骤在一个步骤中完成时,将分解的大麻植物材料在溶剂中悬浮(例如,通过搅拌、摇动或搅动)并进行微波处理,从而得到提取和脱羧的大麻树脂。本公开的一个实施方案是脱羧的大麻树脂,其中树脂包含来自大麻属植物的脱羧大麻素,例如δ9-四氢大麻酚酸(δ9-thca)和大麻二酚酸(cbda),在植物中大麻素各自独立地90%至100%脱羧以在树脂中分别产生δ9-四氢大麻酚(thc)和大麻二酚(cbd)。90%至100%脱羧的范围包括该范围内的任何整数或整数的分数,例如90%、88.4%和100%。脱羧的大麻树脂可进一步包含大麻酚(cbn),其他脱羧的大麻素,或任何化合物(例如萜烯,叶绿素),包括例如表32中的化合物。脱羧的大麻树脂可以包含按重量计或按体积计小于5%的溶剂,或者其可基本上不含溶剂。本公开的一个实施方案是药物组合物,其包含(i)本公开的脱羧的大麻树脂和(ii)合适的药学上可接受的载体或赋形剂。本公开的另一个实施方案是天然保健产品,其包含本公开的脱羧的大麻树脂。本公开的另一个实施方案是从植物材料提取和脱羧大麻素的方法,该方法包括:(i)从大麻植物材料提取大麻素,通过使大麻植物材料与溶剂接触从大麻植物材料中提取大麻素,大麻的提取物包括溶剂和大麻素;(ii)使(a)植物材料和(b)含大麻素的提取物中的大麻素脱羧,通过将植物材料和提取物在密封容器中在约100-200℃的温度下进行微波处理一定时间,直至足以在提取物中形成相应脱羧的大麻素。温度可以是100-200℃范围内的任何整数或整数分数,例如103℃,175.5℃和200℃。在一些实施方案中,在提取步骤之前,将植物材料分解以形成具有适合于提取的大小和形式的大麻植物材料。在一些实施方案中,提取和脱羧同时发生。在一些实施方案中,通过搅拌或搅动将大麻植物材料悬浮在溶剂中。在一些实施方案中,溶剂选自由以下溶剂组成的组:80-100%乙醇、乙二醇、异丙醇和任何上述物质的组合。溶剂与大麻植物材料的比例可以是例如使大麻植物材料浸没在密封容器中的溶剂中。在一些实施方案中,取决于反应规模,时间为约15-75分钟。在一些实施方案中,温度为约130℃至约180℃,或约150℃至约170℃。在一些实施方案中,微波具有约2.45ghz的频率和约1.22×108nm的波长。在一些实施方案中,使植物材料和提取物在密封容器中进行微波在约1-22bar的压力下发生。压力可以是1-22bar范围内的任何整数或整数的分数,例如1bar、15.5bar和18bar。在一些实施方案中,提取的和脱羧的大麻素以大麻树脂的形式或以分离的化合物的形式回收。例如,通过分离(i)单一大麻素、(ii)大麻素混合物、(iii)单一化合物、或(iv)来自树脂的化合物混合物,可从大麻树脂回收脱羧的大麻素。可以使用和/或活性炭炭过滤器回收脱羧的大麻素。在一些实施方案中,树脂中的脱羧的大麻素可以进行冬化以除去蜡。在一些实施方案中,在分解步骤之前干燥大麻植物材料。在一些实施方案中,大麻植物材料是干燥的大麻。在一些实施方案中,使用从树脂除去溶剂的进一步步骤以获得基本上无溶剂的脱羧的大麻树脂。在一些实施方案中,大麻植物材料是毛状体(trichomes)、大麻雌性花序、花苞、大麻茎、大麻叶、或其组合。在一些实施方案中,从树脂中除去溶剂。本公开的一个实施方案是以商业规模完成本公开的方法。本发明的一个实施方案是本公开的大麻树脂在天然保健产品或药物产品中的用途。鉴于以下描述,本申请的其他方面将是显而易见的。然而,应该理解的是,详细描述和具体实施例在指示本公开的实施方案的同时仅以说明的方式给出,在本公开的精神和范围内的各种改变和修改对于本领域技术人员而言将从该详细描述中变得显而易见。缩写:δ9-thc=δ9-四氢大麻酚,cbd=大麻二酚,cbn=大麻酚,cbdl=大麻二醇,cbc=大麻环萜酚(cannabichromene),cbl=大麻环酚(cannabicyclol),cbe=大麻艾尔松(cannabielsoin),cbg=大麻萜酚(cannabigerol),thv=四氢次大麻酚(tetrahydrocannabivarin),cbdv=次大麻二酚(cannabidivarin),cbcv=大麻铬黄素(cannabichromevarin),thca=四氢大麻酚酸,cbda=大麻二酚酸,cbna=大麻酚酸,cbca=大麻环萜酚酸(cannabichromenicacid),cbla=大麻环酸(cannabicyclolicacid),cbea=cannabielsoic酸,cbga=大麻萜酚酸(cannabigerolicacid),thcva=四氢次大麻酚酸(tetrahydrocannabivarinicacid),c1-thcra=tetrahydrocannabiorcolic酸,c4-thca=c4-四氢大麻酚酸,cbnd=脱氢大麻二酚(cannabinodiol)。附图的简要说明为了可以容易地理解主题,通过附图中的示例示出了实施方案,其中:图1a显示了大麻中存在的六种主要大麻素的化学结构:δ9-thc,δ9-thc-a,δ8-thc,cbn,δ2-cbd和δ2-cbd-a;图1b显示了大麻萜酚酸(cbga)至大麻二酚酸(cbda)、四氢大麻酚酸(thca)和大麻环萜酚酸(cbca)的大麻酸合酶途径;图2a显示了医用大麻和脱羧的大麻树脂;图2b是医用大麻脱羧前,品种1的质谱图;图2c是医用大麻脱羧后,品种1的质谱图;图3是说明根据本申请的一个实施方案从大麻植物材料提取和脱羧大麻素的方法的框图;图4显示了δ8-thc的标准曲线(选择离子检测(sir)色谱图被整合,并绘制auc与浓度(ug/ml)的关系图;图5显示了δ9-thc的标准曲线(选择离子检测(sir)色谱图被整合,并绘制auc与浓度(ug/ml)的关系图;图6显示了thca的标准曲线(选择离子检测(sir)色谱图被整合,并绘制auc与浓度(ug/ml)的关系图;图7显示了cbd的标准曲线(选择离子检测(sir)色谱图被整合,并绘制auc与浓度(ug/ml)的关系图;图8显示了cbda的标准曲线(选择离子检测(sir)色谱图被整合,并绘制auc与浓度(ug/ml)的关系图;图9显示了cbn的标准曲线(选择离子检测(sir)色谱图被整合,并绘制auc与浓度(ug/ml)的关系图;图10显示了在不同温度下使用微波辐射提取在大麻植物材料样品中存在的δ9-thc和thc-a的相对量;图11显示了使用乙醇、索氏提取和sfe、不使大麻进行微波条件的大麻提取物中各种大麻素的浓度;图12显示了使用乙醇、索氏提取和sfe、然后微波加热的大麻提取物中各种大麻素的浓度;图13显示了仅在不同温度下微波加热后大麻的各种大麻素的浓度;图14显示了在不同温度下微波加热以及随后的sfe提取后大麻的各种大麻素的浓度;图15显示了在不同温度下微波加热和随后的sfe提取后大麻的各种大麻素的浓度,其中将thc的酸性和中性形式加在一起代表每种方法提取的总thc;图16显示了在170℃、15分钟从微波提取得到的大麻提取物的正离子模式(150-500m/z)的质量扫描色谱图;图17显示了在170℃、15分钟从微波提取获得的大麻提取物的m/z=315的单离子记录(sir)(+ve)检测;图18显示了在170℃、15分钟从微波提取获得的大麻提取物的m/z=359的sir(+ve)检测;图19显示了在170℃、15分钟从微波提取得到的大麻提取物的负离子模式(150-500m/z)的质量扫描色谱图;图20显示了在170℃、15分钟从微波提取获得的大麻提取物的m/z=313的sir(-ve)检测;图21显示了在170℃、15分钟从微波提取获得的大麻提取物的m/z=357的sir(-ve)检测;图22显示了在130℃、10分钟从微波提取得到的大麻提取物的正离子模式(150-500m/z)的质量扫描色谱图;图23显示了在130℃、10分钟从微波提取获得的大麻提取物的m/z=315的sir(+ve)检测;图24显示了在130℃、10分钟从微波提取获得的大麻提取物的m/z=359的sir(+ve)检测;图25显示了在130℃、10分钟微波提取得到的大麻提取物的负离子模式(150-500m/z)的质量扫描色谱图;图26显示了在130℃、10分钟从微波提取得到的大麻提取物的m/z=313的sir(-ve)检测;和图27显示了在130℃、10分钟从微波提取获得的大麻提取物的m/z=357的sir(-ve)检测;图28a在大麻提取物脱羧前在质谱中看到的选择信号的概览;图28b在大麻提取物脱羧后在质谱中看到的选择信号的概览。详细说明如前所述,四氢大麻酚(thc),或更确切地说其主要异构体δ9-thc,是大麻的主要精神活性成分(或大麻素)。与thc不同,其相应的酸性thc-a(或其主要异构体δ9-thc-a)是在未加工的和活的大麻中发现的非精神活性大麻素。δ9-thc是已知的大麻素的化合物族的仅仅之一。例如,δ8-thc是δ9-thc的双键异构体,并且是大多数大麻品种的次要成分。两种化合物之间的主要化学差异是δ9-thc易被氧化成大麻酚(cbn),而δ8-thc不会氧化成大麻酚,因为它非常稳定。δ8-thc在很大程度上产生与δ9-thc类似的心理测量效应,但通常被认为比δ9-thc的效力低50%。另一方面,当给予人类时,cbd本身没有或有有限的心理测量活性,然而如下所述,cbd包括其他治疗性质。在大麻植物中,cbga是一种前体以及大麻酚(cbn),是thc的代谢物。随着大麻的成熟,thc逐渐分解为具有精神活性特性的cbn。图1显示了大麻中存在的六种主要大麻素的化学结构:δ9-thc,δ9-thc-a,δ8-thc,cbn,δ2-大麻二酚(δ2-cbd或cbd)和δ2-大麻二酚酸(δ2-cbd-a或cbd-a)。图2a、2b和2c显示了脱羧的大麻树脂和医用大麻脱羧前(b)和后(c)的品种1的质谱,并且分别表明cbda和thca100%转化为cbd和thc。转到图3,显示了用于从大麻植物材料提取和脱羧大麻素的方法100。通常,方法100包括在步骤102干燥未加工的大麻植物材料,分解大麻植物材料以形成具有适于在步骤104提取的大小和形式的大麻植物材料,从分解的大麻植物材料提取大麻素,其通过使分解的大麻植物材料与溶剂接触以从大麻植物材料提取大麻素,以及使大麻素脱羧,其通过使提取物进行微波处理以形成脱羧的大麻素。当大麻素在植物中时、当大麻素在提取物中时、或可能在两者中,发生大麻素的脱羧。在一些实施方案中,提取物在封闭的反应容器中在足以形成脱羧的大麻素的温度和时间下经受微波。任选地回收提取的和脱羧的大麻素。回收可包括从大麻植物材料的提取物中滤除溶剂以分离脱羧的大麻素。在一些实施方案中,该方法包括在脱羧之前、期间或之后的提取步骤。在一些实施方案中,本公开的方法包括一个以上的提取步骤。在一些实施方案中,脱羧步骤可在提取之前、期间或之后进行。在本公开的一个实施方案中,使用用于提取和脱羧的一步法,其中将大麻植物材料(其适于制备,例如任选地如本文所述的干燥和分解)置于合适的提取溶剂中(例如,药学上可接受的溶剂,例如乙醇、甘油和异丙醇,以及本领域技术人员已知的其他溶剂,保持悬浮或溶液(例如通过搅拌、搅动、摇动或本领域技术人员已知的其他方式),并且在一定温度、压力和时间下搅拌的同时进行微波辐射以获得适当地提取和脱羧的大麻素,其可以被回收用作混合物或单独的化学组分(例如用作治疗或药物产品)。在一些实施方案中,溶剂可以是食品级油和/或中链甘油三酯,例如椰子油。与其他已知的提取和脱羧方法(例如简单加热)相比,这种方法在将大麻素酸转化为其脱羧形式方面更有效。特别地,图11和12分别显示了使用乙醇、索氏提取和sfe,不使大麻进行进入微波条件以及随后进行微波加热的大麻植物材料提取物中不同大麻素的各种浓度。通过使单独使用溶剂萃取、单独使用索氏提取(例如溶剂和加热)和单独使用sfe(例如溶剂和加热)测量的浓度(如图11所示)与使用溶剂萃取然后通过微波、索氏提取然后通过微波和sfe然后通过微波测量的浓度(如图12所示)比较,在溶剂萃取、索氏提取和sfe增加微波加热可以大大提高thc,cbd和cbn浓度,并降低提取物中的thca浓度。图13和14进一步显示当提取物在约170℃下暴露于微波辐射约20分钟时,实现提取物中高浓度的thc、cbd、cbn和thca。下面提供了有关工作变量的更多细节。干燥102在步骤102,可以干燥大麻植物材料以降低水/水分含量。本文中,大麻植物材料包括任何大麻植物,包括但不限于大麻、印度大麻和莠草大麻及其所有亚种(例如,印度大麻亚种包括原变种(var.indica)和野生变种(var.kafiristanica)),包括野生或驯化型大麻植物及其变体,包括大麻化学变型(以化学组成为特征的变种),其天然地含有不同量的单独大麻素以及由其遗传杂交、自交或杂交产生的植物。因此,术语“大麻植物材料”相应地解释为包含源自一种或多种大麻植物的植物材料。“大麻植物材料”包括活的或新鲜的大麻和干燥的大麻。此外,可以使用大麻植物的任何部分,包括但不限于毛状体、花蕾、花苞、叶、茎和可能含有大麻素的任何其他植物部分。此外,尽管雌性植物可以产生比雄性植物更高浓度的大麻素,但是雌性(包括“雌性化植物”)和雄性植物均可以使用。在大麻植物材料经历提取和脱羧之前,任选的干燥步骤102可用于从大麻植物材料除去过量水分。从大麻植物材料去除水分有助于在提取和/或脱羧过程的后期阶段提供均匀的加热。或者,新鲜的大麻植物材料(例如,直接来自植物)可用于随后的分解、提取和脱羧步骤。在此,步骤102中的大麻植物材料的干燥可以通过任何方式进行,例如在60-75℃的温度范围内的烘箱或类似条件下,或者使用真空烘箱或类似条件持续数小时,例如4小时、或6小时或8小时,取决于水分的量。在干燥过程中,当使用烘箱中的加热元件或其他过程中的红外加热进行加热时,一些大麻素羧酸形式可以转变为它们的脱羧的大麻素形式。分解104在分解步骤104中,可以分解大麻植物材料以产生适于通过微波加热进行提取和脱羧的大小和形式的大麻植物材料。大麻植物材料的毛状体(即树脂腺)几乎是来自芽、扇叶(fanleaves)和茎的表面的微观的、蘑菇状突起。虽然相对复杂,但毛状体主要由茎和头构成。大麻素如thc的产生主要发生在毛状体的头部。大麻素集中在植物的毛状体中。毛状体可以很容易地从大麻植物材料表面脱落。术语“适于提取和脱羧的大小和形式”是指大麻植物材料段的粒度减小。在本文中,步骤104中的大麻植物材料的分解可以通过任何机械手段进行,包括通过压碎(crushing)、粉碎(smashing)、研磨(grinding)、磨碎(pulverizing)、浸渍(macerating)、崩解(disintegration)或如本领域技术人员已知的等效方法,其将大麻植物材料减小成适合于提取和/或脱羧的大小和形式的小块。在一个示例性实施方案中,超声处理还可用于使大麻植物材料松散,其与适当溶剂(例如乙醇)接触和/或通过分解细胞膜使其适于提取和/或脱羧。在另一个示例性实施方案中,可以用研钵和研杵进行浸渍以产生适合于提取和/或脱羧的大小和形式的大麻植物材料。在某些实施方案中,大麻植物材料的尺寸减小,使得其粒径在1mm至10mm的范围内。提取106在完成分解步骤104后,可以进行提取步骤106。应当注意,在脱羧步骤108之前或之后,提取步骤106可以相对于脱羧步骤108作为单独的步骤发生,或者如下所述,提取步骤106和脱羧步骤108可以同时发生。为避免疑义,应该理解的是,任何提取,包括但不限于在溶剂存在下的超声处理、回流(索氏)提取和超临界流体萃取(sfe),可以在脱羧步骤108之前或之后进行。此外,还应该理解,分解(104)、萃取(106)和脱羧(108)也可以在一个步骤中发生。在一个实施方案中,提取步骤106可以包括使来自分解的大麻材料的大麻素与溶剂接触,该分解的大麻材料是分解步骤104的产物。在一些实施方案中,提取步骤106中的溶剂处理除去非大麻素杂质,留下基本上纯的大麻素制剂。已经表明,非极性液体溶剂可用于该功能。因此,合适的非极性溶剂基本上包括任何非极性溶剂,其极性明显低于大麻素,这样通过用溶剂处理除去比大麻素极性更大的杂质。过滤和本领域技术人员已知的其他方法也可用于除去杂质。有用的非极性溶剂包括但不限于c5-c12直链或支链烷烃,或c1-c12醇的碳酸酯。挥发性更高的c5-c12烷烃可能特别有用,因为它们更容易从提取物中除去。此外,已经批准用于药物组合物的溶剂,例如乙醇(例如95%乙醇)可能是特别有用的。如本领域技术人员已知的,特别有用的溶剂包括戊烷、己烷、庚烷、异辛烷、和乙醇,和/或其混合物等。在提取步骤106的一个实施方案中,可将分解的大麻植物材料加入溶剂中并同时进行超声处理。本文中,超声处理是指超声振动(例如>20khz)应用于干燥或未干燥的大麻植物材料的细胞碎片、大分子和细胞膜。可以通过本领域已知的任何方法提供超声振动。在一个示例性实施方案中,大麻植物材料和溶剂的混合物的超声处理可以在25℃下进行5-25分钟,其中大麻植物材料和溶剂的比例使得所有大麻植物材料完全浸没在反应容器中的溶剂中。完成大麻植物材料和溶剂的混合物的超声处理后,从混合物中除去溶剂。可通过本领域已知的任何方法除去溶剂,包括但不限于过滤和/或蒸发。超声处理后过滤的一个实施方案是在玻璃烧结漏斗上真空过滤,以分离滤液中的所得提取物和植物材料。然后可以对后者进行进一步的提取,例如索氏提取或本领域技术人员已知的其他溶剂提取,例如sfe。在提取步骤106的另一个实施方案中,可从大麻植物材料中提取大麻素,大麻植物材料在步骤104中通过回流(索氏)提取而分解。在回流(索氏)提取期间,在步骤104中分解的大麻植物材料通常悬浮在容器中的加热溶剂上方。在蒸馏烧瓶中将溶剂加热至回流,使得溶剂蒸气沿蒸馏臂向上行进并溢流到容纳未加工的大麻材料的容器中。悬挂在未加工的大麻材料上方的冷凝器确保在未加工的大麻材料上方升起的任何溶剂蒸气冷却并随后滴回到容纳未加工的大麻材料的容器中。容器缓慢地用温热的溶剂填充,使得大麻素开始溶解到温热的溶剂中。当容器填充时,通过虹吸管将其排空,使得溶剂返回蒸馏烧瓶。可以允许该循环重复多次,持续数小时或数天。优选地,回流(索氏)提取在高于用于提取的相应溶剂的沸点的溶剂温度下进行,并且进行约3至5小时的时间。一旦提取完成,可以通过本领域已知的任何方法除去溶剂,包括但不限于如前所述的过滤和/或蒸发。代替如上所述的超声处理或回流(索氏)提取,本申请所涵盖的提取步骤106的另一个实施方案是通过sfe从大麻植物材料提取大麻素。sfe是指使用超临界流体作为提取溶剂将一种或多种组分(提取剂)与另一种组分(基质)分离的方法。提取通常来自固体基质(例如大麻植物材料),但也可以来自液体或树脂材料(例如,大麻油(hashoil))。虽然可以使用许多超临界流体,但二氧化碳(co2)是sfe最常用的超临界流体。在其他示例性实施方案中,co2可以通过本领域技术人员已知的共溶剂如乙醇或甲醇进行改性。超临界流体的萃取条件高于临界温度(例如,co2温度31℃)和临界压力(例如,co2压力74bar)。添加改性剂(例如但不限于乙醇)可能需要改变这些提取条件。示例性sfe系统包含用于co2(以及任何其他溶剂)的泵,用于容纳大麻材料的压力元件,用于维持系统中的压力的装置和收集容器。将液体泵送到加热区,在加热区将其加热到超临界条件。然后液体进入提取容器,在那里液体迅速扩散到固体基质中并溶解待提取的大麻材料。溶解的物质(例如,大麻素)在较低压力下从萃取区扫入分离器,并且萃取的物质沉积。然后可以将co2冷却,再压缩和再循环,或排放到大气中。这里,在一些实施方案中,在提取步骤106中进行的sfe提取的温度可以在35-55℃的范围内。此外,在一些实施方案中,在提取步骤106中进行的sfe提取的压力可以在65-85bar的范围内。本公开中的sfe发生在约40℃,背压调节器压力为12mpa,并且使用200-600nm的光电二极管阵列(在254nm处监测)监测提取的化合物。系统的采集时间和方法时间各自可以变化几分钟至60分钟,理想地在15至30分钟之间,这取决于超临界流体的比例,以及用于萃取的共溶剂改变。在具体实施方案中,sfe可以连续多次进行。在这样的实施方案中,sfe是分数sfe。如前所述,使用溶剂进行超声处理和回流(索氏)提取,一旦sfe完成,可通过本领域已知的任何方法除去溶剂,包括但不限于过滤和/或蒸发。微波辅助萃取和脱羧108植物性大麻素酸如δ9-thc-a的脱羧是反应时间和温度的函数。例如,浓缩的δ9-thc-a在溶液中脱羧成δ9-thc,δ9-thc的降解随温度而变化。因此,温度控制对于控制脱羧产物的期望比例是重要的。然而,在文献中已经讨论了常规家用微波在大麻加工中的使用,其具有混合的、不一致的结果,并且不一定特别用于在溶剂中提取和脱羧。此外,为了获得100%的脱羧,必须在一段时间内保持温度而不燃烧大麻材料或沸腾/蒸发溶剂。如果温度高于所用溶剂的沸点,则溶剂将沸腾和/或蒸发。为了在期望的时间内维持温度以使大麻素完全脱羧但不燃烧大麻植物材料或煮沸/蒸发与大麻一起的溶剂,微波容器(即密封容器)必须处于压力下。密封容器(vessel)或容器(container)确保容器(vessel)或容器(container)中的压力。如图3所示,微波辅助提取可以在机械分解步骤104之后立即进行,或者在如上所述的初步提取步骤106之后进行。微波辅助提取和脱羧108可以包括将大麻植物材料悬浮在溶剂中,并在足以形成脱羧的大麻素的温度、压力和时间下,在密闭容器中使混合物经受微波。这里,术语“微波”是指波长范围从1米到1毫米的电磁辐射的形式;频率在300mhz(100cm)和300ghz(0.1cm)之间。此外,在微波辅助提取和脱羧步骤108中的溶剂处理再次除去非大麻素杂质,留下基本上纯的大麻素制剂。因此,非极性液体溶剂可用于此功能。在一个实施方案中,在微波辅助提取和脱羧步骤108中使用乙醇作为液体溶剂。在另一个实施方案中,在微波辅助提取和脱羧步骤108中使用95%乙醇作为液体溶剂。由于乙醇的沸点为78℃,并且大麻的脱羧过程是压力依赖性的(如上所述),因此温度控制在微波辅助提取步骤108中是重要的。在一个示例性实施方案中,分别促进cbda和thca脱羧成cbd和thc的合适条件是将大麻植物材料悬浮在溶剂(例如乙醇)中,然后使该混合物经受电磁辐射(例如微波),波长范围为106-109nm,频率为300mhz-300ghz。在一个实施方案中,条件还包括,例如以下:温度范围为40-250℃,温度升高2-5℃/秒,压力范围为0-20bar(2mpa,290psi),微波功率范围为0-400w,2.45ghz或微小的变化和调整,以适应特定的溶剂和/或反应条件,达到期望的温度并完成脱羧。如果需要搅拌,可以使用可变磁力搅拌器(300-900rpm)。在另一个示例性实施方案中,微波辅助萃取和脱羧可以在100-200℃的温度下进行(包括该范围内的所有可能的整数和整数分数,例如163.5℃、130-170℃、150-170℃或130-150℃)。在另一个示例性实施方案中,微波辅助萃取和脱羧可以在2-22bar的压力下进行(包括该范围内的所有可能的整数和整数分数),例如10.7bar或17bar或18bar或19bar或20bar或21bar。大麻植物材料可悬浮在溶剂中并分别经受2.45ghz和1.22×108nm的频率和波长的微波,温度范围为130-190℃。未加工的大麻材料可以悬浮在溶剂中并分别经受2.45ghz和1.22×108nm的频率和波长的微波,温度范围为150-190℃,溶剂是乙醇。在另一个实施方案中,可以将大麻植物材料悬浮在溶剂中,并且在经受微波之前将混合物搅拌一段规定的时间(例如0-30秒或合理的时间长度以悬浮材料)。在一个实施方案中,规定的时段是30秒。在另一个实施方案中,可以将大麻材料悬浮在溶剂中,并且可以在经受微波的同时搅拌混合物。在一个实施方案中,规定的时段是10分钟,而在另一个实施方案中,规定的时段是20分钟。下面提供了工作微波变量表以供参考。表1以下参数可以由用户设置,这取决于所使用的微波设备的类型和可用于用户设置的选项:功率(off)=加热反应混合物时施加的恒定功率或最大功率。初始功率(off)=加热反应混合物时最初施加的功率。固定保持时间(on)=如果为on,则在达到目标温度或目标压力时开始倒计时,即达到设定温度或压力所需的初始时间不包括在加热时间内。压力(off)=反应的目标压力。冷却(off)=如果为off,则在加热过程中不进行冷却。吸收(normal)=如果为normal,则施加的功率最初在200到400w之间,具体取决于目标温度。温度=目标温度。(注意:温度由外部红外传感器监控,可以实时测量玻璃瓶的表面温度。)总时间=所有步骤的总时间。预搅拌=加热过程前的搅拌时间。搅拌速度=磁力搅拌子的转速。观察并推断以下参数。供应的功率=用于达到目标温度的功率。保温功率=用于维持目标温度的功率。反应压力=反应过程中的最大压力。在一些实施方案中,脱羧的大麻素产物可以直接使用或在使用前进一步加工、纯化或回收。回收110任选地,在进行微波处理后,可以在回收步骤110从所得悬浮液中回收脱羧的大麻素的制剂。在一个实施方案中,通过从大麻植物材料提取物中过滤溶剂以分离脱羧的大麻素或包含脱羧的大麻素的部分,从而回收提取的和脱羧的大麻素。在另一个实施方案中,通过适当的垫和/或活性炭(例如木炭)过滤以获得澄清的溶液用于后续加工或使用,从而回收提取的和脱羧的大麻素。在该实施方案中,可以置于玻璃烧结漏斗中,然后与活性炭分层堆积。过滤剂可以通过真空过滤用乙醇洗涤,并且可以将提取物溶解在适当体积的合适溶剂如乙醇中并转移到漏斗中。然后可以施加真空,并且可以用溶剂洗涤过滤剂,直到大麻素完全洗脱。然后将所得滤液浓缩至干燥(例如在25℃)。本领域技术人员还可以设想使用功能化膜、纤维素过滤器等来完成上述回收任务,代替和活性炭垫。或者,可以收集来自步骤108的所得脱羧的大麻素制剂,并随后根据步骤106中所述的任何提取方法进行处理,包括但不限于超声处理、回流(索氏)提取和/或sfe。用途和产品脱羧的大麻树脂可以(i)直接用作药物、天然保健产品或用于休闲用途,或(ii)用作制备产品的原料,例如用于脱羧的大麻素的已知用途的药物、天然保健产品,或休闲用品,例如已知的治疗或精神活性用途。在一个实施方案中,本公开的脱羧的树脂可以直接使用,例如作为药物或作为天然保健产品。在一个实施方案中,可以形成药物组合物,其包含通过所公开的方法产生的所得脱羧的大麻素树脂,其还可以包含合适的药学上可接受的载体或赋形剂。除了脱羧的大麻素之外,本公开的药物组合物可以另外包含一种或多种其他活性药物成分。根据期望的用途和给药方式,药物组合物可以制备成各种剂型,无论是口服(例如片剂或液体形式),雾状还是其它形式(气溶胶、吸入器或静脉内适用的制剂),根据需要使用本领域熟知的技术。用于各种不同剂型的药学上可接受的载体或赋形剂是本领域公知的,包括载体、稀释剂、填充剂、粘合剂、润滑剂、崩解剂、助流剂、着色剂、颜料、掩味剂、甜味剂、食用香料、增塑剂、和任何可接受的辅助物质,如吸收促进剂、渗透促进剂、表面活性剂、助表面活性剂和专用油。适当的赋形剂部分基于剂型、预期的给药方式、预期的释放速率和制造可靠性来选择。常用类型的赋形剂的实例包括各种聚合物、蜡、磷酸钙和糖。本领域技术人员将参考药物制剂的已知方法,例如remington:药学技术与实践,第22版,由allen,loydv.,jr编辑,2012。在以下实施例中描述了本发明,提出这些实施例是为了帮助理解本发明,并且不应该被解释为以任何方式限制在随后的权利要求中限定的本发明的范围。实施例实验1:脱羧的大麻树脂通过uplc-ms对药用大麻进行提取和化学分析。提取方法图2a显示了药用大麻和脱羧的大麻树脂。如方案1中的相应流程图所示,进行了四种类型的提取方法。(a)超声波处理(b)索氏提取(c)超临界流体萃取(omar,j.olivares,m.等人,j.sep.sci.2013,36,1397-1404,通过引用并入本文。)(d)封闭系统微波提取(在乙醇、己烷或异丙醇或液体co2中),如下面实验5-9中所述。方案1.各种提取方法的流程图方案1.各种提取方法的流程图(a)超声波处理(b)索氏提取(c)超临界流体萃取(d)封闭系统提取(cse)uplc-ms方法。使用配备有四元溶剂管理器和样品管理器ftn的acquityuplch-class系统分析大麻素标准物、供体样品中的大麻提取物和大麻素。用于监测样品的检测器是ms3100质谱仪。苯甲酮、咖啡因或δ9-thc-d3用作内标物。条件列于表2中。表2.uplc-ms色谱条件提取结果表3.从品种1的提取方法a-d获得的提取物和主要大麻素的量。表4.方法d(封闭系统微波提取)后获得的提取物和主要大麻素的量。通过uplc-ms进行化学分析。在医用大麻脱羧之前(图2b)和之后(图2c)的品种1的质谱分别表明cbda和thca100%转化为cbd和thc。如在uplc-ms的化学分析期间观察到的,封闭系统微波提取同时提供大麻素的提取和脱羧。实验2:进一步比较各种提取方法,大麻素的脱羧和标准曲线的产生方法1a:超声提取(超声处理)。一般步骤:1.称重干燥的植物材料并使用研钵和研杵浸渍。2.加入溶剂(25-130ml)并将混合物在25℃下超声处理5分钟。3.使用真空过滤在玻璃烧结漏斗上倒出并过滤溶剂。4.对留下的纤维材料重复步骤2和3两次。5.将滤液浓缩至干燥(25℃),然后称重(绿色树脂)。下表5显示了三种常见大麻品种的超声处理结果。表5:在三种大麻品种上用各种溶剂进行超声提取的结果。方法1b:在/活性炭上过滤。接着方法1a(如上所述),将提取物用和活性炭过滤,以除去提取物的绿色。结果如表6所示。一般步骤:1.将置于玻璃烧结漏斗中,然后与活性炭分层堆积。2.将提取物溶解在1ml乙醇中并转移至漏斗。3.将含有提取物的小瓶用1.5ml乙醇洗涤两次并转移至漏斗。4.然后施加真空并用乙醇洗涤过滤剂直至滤液不再具有uv活性(60-70ml)。5.将滤液浓缩至干燥(25℃),然后称重(橙色树脂)。表6:三种大麻品种用/活性炭的提取物过滤的结果方法2:索氏提取一般步骤:1.称重干燥的植物材料并使用研钵和研杵浸渍。2.然后将压碎的材料转移到纤维素提取套管(43×123mm;2mm厚)3.然后将套管插入大型提取器(尺寸:55/50)4.将溶剂(400ml)和搅拌子加入圆底烧瓶中,然后将其置于合适的drysyn加热器(drysynheatingblock)中并连接至提取器。5.然后将提取器连接到大型冷凝器(尺寸:55/50)并在120℃下回流3.5小时。6.回流完成后,将溶剂浓缩至干燥(25℃),然后称重(绿色树脂)。下表7提供了根据前述步骤的大麻的索氏提取的结果。表7:大麻的索氏提取的结果。方法3:超临界流体萃取(sfe)一般步骤:1.称重干燥的植物材料并使用研钵和研杵浸渍。2.将压碎的植物材料转移到10ml提取容器中,并进行以下任一条件。3.合并所有馏分并浓缩至干燥(25℃),然后称重(绿色树脂)。方法3a:sfe条件溶剂a=co2溶剂b=乙醇温度=40℃bpr=12mpapda=200-600nm(在254nm处监测)采集时间=30分钟方法时间=30.2分钟i.5分钟静态,1:1a/b。ii.25分钟动态,1:1a/b(流速=10ml/min;补水泵=0.2ml/min)。iii.每5分钟收集一次馏分。方法3b:sfe条件溶剂a=co2溶剂b=乙醇温度=40℃bpr=12mpapda=200-600nm(在254nm处监测)i.15分钟动态,100%a(流速=10ml/min),每7.5分钟收集馏分,采集时间=15分钟方法时间=15.2分钟。ii.30分钟动态,80:20a/b(流速=10ml/min;补水泵=1ml/min),每5分钟收集一次馏分,采集时间=30分钟方法时间=30.2分钟。下表8显示了根据用于大麻的方法3a和3b中概述的sfe的结果。表8:根据两组条件的大麻的sfe提取的结果。方法4:用乙醇的微波辅助提取(mae)随后sfe。用mae测定分别促进cbda和thca脱羧成cbd和thc的合适条件。用于该提取的溶剂是乙醇。但是,由于乙醇的沸点为78℃,因此必须确定在微波条件下在密封容器中仅加热乙醇时可达到的最高温度。一般步骤:1.将乙醇(11ml)和搅拌子置于20ml微波小瓶中,然后密封。2.一般微波条件:a.预搅拌=30秒b.运行时间=15分钟c.吸收=正常结果显示在下表9中。表9:在微波条件下在密封容器中仅加热乙醇时可以实现的最高温度的测定。试验#温度(℃)结果1200达到最大系统压力;由于高压而中止运行2150运行完成3190达到最大系统压力;由于高压而中止运行4180达到最大系统压力;由于高压而中止运行5170运行完成一旦确定了可以加热乙醇的最高温度,对大麻进行以下条件:一般步骤:1.称重干燥的植物材料并使用研钵和研杵浸渍。2.将压碎的植物材料与搅拌子一起转移到20ml或5ml微波小瓶中。3.将乙醇(11ml或3ml)加入到小瓶中,使得植物材料完全浸没。然后将小瓶密封并置于下面的微波条件下:a.预搅拌=30秒b.运行时间=10分钟c.吸收=正常4.过滤悬浮液,分别收集滤液和植物纤维。5.浓缩滤液并使植物纤维经受以下sfe条件:溶剂a=co2溶剂b=乙醇温度=25℃bpr=12mpapda=200-600nm(在254nm处监测)采集时间=20分钟方法时间=20.2分钟6.梯度从100%a到50%;0.1分钟-15分钟(流速=10ml/min;补给泵=1ml/min)。7.每7.5分钟收集馏分。结果显示在下表10中。表10:在各种微波温度下通过微波和sfe提取大麻表14(下面提供)显示了大麻素的分析和定量。方法5.sfe/索氏提取/超声提取,然后微波处理树脂(用于脱羧)。一般步骤:1.将从方法1a(乙醇提取物),2和3a中分离的树脂溶解在3-3.5ml乙醇中,并转移到5ml微波小瓶中。2.加入搅拌子,将小瓶密封并置于下列微波条件下:a.温度=150℃b.预搅拌=30秒c.运行时间=10分钟d.吸收=正常3.然后浓缩反应混合物。结果显示在下表11中。表11:经受微波加热后的树脂重量。色谱分析(hplc/ms/pda)通过配备有2545二元梯度模块lc,pda2998光电二极管阵列检测器(190-800nm)和3100质谱仪(60-2000da)的lc-pda-ms测定大麻提取物的色谱图。lc在x-bridge分析型c18柱(4.6mm×150mm,5μmi.d.)上以1.5ml/min的流速进行。使用esi(﹢ve)模式记录质谱。使用针头式过滤器(0.22μm,emdmillopore)过滤注入样品。色谱条件如下:流动相:a:水/0.1%甲酸b:甲醇/0.1%甲酸梯度:0至25分钟:30%a/70%b100%b25至28分钟:100%b28至30分钟:100%b30%a/70%b30至35分钟:30%a/70%b进样量:10μl流速:1.5ml/min总运行时间:35分钟uplc/ms。使用配备有四元溶剂管理器、样品管理器ftn、acquitybeh柱(2.1×50mm,c18,1.7μm)的acquityuplch-class系统分析大麻提取物和大麻素标准品。进样板和柱分别保持在15℃和40℃。用于监测样品的检测器是ms3100质谱仪。色谱条件如下:流动相:a:水/0.1%甲酸b:甲醇/0.1%甲酸梯度:0至4.5分钟:30%a/70%b100%b4.5至5.0分钟:100%b5.0至5.2分钟:100%b30%a/70%b5.2至6.0分钟:30%a/70%b进样量:2μl流速:0.6ml/min总运行时间:6分钟大麻素的标准曲线:标准大麻素样品购自cerilliant认证的参考标准品,以1.0mg/ml甲醇溶液的形式存在。1.δ8-四氢大麻酚(δ8-thc,cat#.t-032,lotfe10011501)2.δ9-四氢大麻酚(δ9-thc,cat#.t-005,lotfe05271502)3.δ9-四氢大麻酚酸a(thca-a,cat#.t-093,loter02101506)4.δ2-大麻二酚(cbd,cat#.c-045,lotfe012881502)5.大麻二酚酸(cbda,cat#.c-144,lotfe0181602)6.大麻酚(cbn,cat#.c-046,lotfe06081502)大麻素1-6的化学结构在图1中提供。使用水/0.1%甲酸和甲醇/0.1%甲酸制备每种标准样品的工作储备溶液。每种储备样品的最终浓度在30%水/0.1%甲酸和70%甲醇/0.1%甲酸中为50μg/ml。用流动相(30%水/0.1%甲酸和70%甲醇/0.1%甲酸)稀释储备样品(50μg/ml)以获得以下浓度:0,0.1,0.5,1.0,2.5,5.0,7.5和10.0μg/ml。并非所有浓度都包括在标准曲线的构建中。由于饱和电平的非常低的信号,排除了一些大麻素浓度(例如0.1或10.0μg/ml)。每种浓度一式三份进行。进行2μl进样并记录信号长达6分钟。监测并记录sir﹢ve(311、315和359m/z)或sir﹣ve(313和357)和正离子模式中的质量扫描(150-500m/z)。整合sir色谱图并绘制auc对浓度(μg/ml)的曲线。表12:大麻素标准曲线-概述。如上所述的每种大麻素1-6的标准曲线在图4-9中提供。图4显示了δ8-thc的标准曲线。线性拟合:y=10948149x+2153365,r=0.9984。图5显示了δ9-thc的标准曲线。线性拟合:y=11609869x+2187215,r=0.9980。图6显示thca的标准曲线。线性拟合:y=14550967x+119886,r=0.9992。图7显示了cbd的标准曲线。线性拟合:y=9601901x+1448932,r=0.9978。图8显示了cbda的标准曲线。线性拟合:y=9096880x+111409,r=0.9993。图9显示了cbn的标准曲线。线性拟合:y=2595328x-397594,r=0.9967。表13提供了在不同温度下使用微波提取方法获得的提取物中大麻素的浓度(μg/ml)。将微波反应后剩余的固体物质(植物纤维)暴露于sfe萃取(方法3a)。每个微波反应的总体积为3ml。表13:在不同温度下使用微波提取方法获得的提取物中大麻素的浓度(μg/ml)图10显示了在不同温度下使用微波方法提取的样品中存在的δ9-thc和thc-a的量。每种形式的thc的量显示为thc(中性和酸性形式)总量的百分比。表14显示了在进行方法5后大麻提取物中大麻素的量。参见表11。注意:cbn似乎是在thca的基于微波的脱羧过程中形成的。cbda没有定量。表14:在按照方法5进行后,大麻提取物中大麻素的量μw=微波炉nd=未确定上述数据的图显示在图11和12中,其中图11显示了使用etoh、索氏提取和sfe的提取物中的浓度,没有使大麻进行微波条件,图12显示了首先使用etoh或索氏提取或sfe提取大麻的大麻素的浓度,然后微波加热。表15显示了在不同温度下使用微波提取方法获得的提取物中大麻素的产率(mg/g植物材料)。将微波反应后留下的固体物质(植物纤维)暴露于sfe萃取(方法3a)。每个微波反应的总体积为3ml。cbda没有定量。表15:在不同温度下使用微波提取方法获得的提取物中大麻素的产率(mg/g植物材料)图13显示仅微波加热后从大麻获得的大麻素。图14显示微波,随后进行sfe提取。来自微波溶剂和sfe提取的大麻素加在一起。图15显示了微波加热后接着sfe提取的大麻中的各种大麻素浓度。在图15中,两种提取物中的大麻素已加在一起。将酸性和中性形式的thc一起加入以表示通过每种方法提取的总thc。图16显示使用ms3100质量检测器以esi的正离子模式记录的质量扫描(150-500m/z)的色谱图。样品从170℃,15分钟的微波提取获得。箭头指向cbd、cbda、δ9-thc和thca的保留时间。由于样品浓度较低,此色谱图中的峰不明显。对该样品获得的单离子记录(sir﹢ve)显示代表cbd和δ9-thc(图17),cbda和thca(图18)的各个峰。如果在此模式下不存在或未检测到分析物,则显示预期的保留时间图17显示了从在170℃下15分钟的微波提取获得的样品中检测大麻二酚(cbd)和δ9-四氢大麻酚(δ9-thc)的单离子记录(sir﹢ve,m/z=315)(质量扫描如图16所示)。图18显示了从在170℃下15分钟的微波提取获得的样品中检测大麻二酚酸(cbda)和四氢大麻酚酸(thca)的单离子记录(sir﹢ve,m/z=359)(质量扫描如图16所示)。正离子模式(esi﹢ve)对于检测大麻素的酸性形式不是有利的。图19显示使用ms3100质量检测器以esi的负离子模式记录的质量扫描(150-500m/z)的色谱图。样品从170℃,15分钟的微波提取获得。箭头指向cbd、cbda、δ9-thc和thca的保留时间。由于样品浓度较低,此色谱图中的峰不明显。对该样品获得的单离子记录(sir-ve)显示代表cbd和δ9-thc(图20),cbda和thca的各个峰(图21)。如果在此模式下不存在或未检测到分析物,则显示预期的保留时间。图20显示了从在170℃下15分钟的微波提取获得的样品中检测大麻二酚(cbd)和δ9-四氢大麻酚(δ9-thc)的单离子记录(sir-ve,m/z=313),(质量扫描如图19所示)。大麻素的中性形式在负离子模式下不易检测,因此与正离子模式相比没有观察到峰(参见图17)。图21显示了从在170℃,15分钟下的微波提取获得的样品中检测大麻二酚酸(cbda)和四氢大麻酚酸(thca)的单离子记录(sir-ve,m/z=357)(质量扫描如图19所示)。esi-ve模式可用于检测大麻素的酸性形式。图22显示使用ms3100质量检测器以esi的正离子模式记录的质量扫描(150-500m/z)的色谱图。样品从130℃,10分钟的微波提取获得。显示了cbd、cbda、δ9-thc和thca的保留时间。对该样品获得的单离子记录(sir﹢ve)显示代表cbd和δ9-thc(图23)和cbda和thca(图24)的各个峰。如果在此模式下不存在或未检测到分析物,则显示预期的保留时间。图23显示了从在130℃下,10分钟的微波提取获得的样品中检测大麻二酚(cbd)和δ9-四氢大麻酚(δ9-thc)的单离子记录(sir﹢ve,m/z=315)(质量扫描如图22所示)。图24显示了从在130℃下,10分钟的微波提取获得的样品中检测大麻二酚酸(cbda)和四氢大麻酚酸(thca)的单离子记录(sir﹢ve,m/z=359)(质量扫描如图22所示)。由于分析样品的浓度相对较高,因此通过负离子模式检测cbd和thc的酸性形式。图25显示使用ms3100质量检测器以esi的负离子模式记录的质量扫描(150-500m/z)的色谱图。样品从130℃,10分钟的微波提取获得。显示了cbd、cbda、δ9-thc和thca的保留时间。对该样品获得的单离子记录(sir-ve)显示代表cbd和δ9-thc(图26)和cbda和thca(图27)的各个峰。如果在此模式下不存在或未检测到分析物,则显示预期的保留时间。图26显示了在从130℃下,10分钟的微波提取获得的样品中检测大麻二酚(cbd)和δ9-四氢大麻酚(δ9-thc)的单离子记录(sir-ve,m/z=313)(质量扫描如图25所示)。中性大麻素(与正离子模式相比(图23),cbd和δ9-thc在负离子模式检测中不明显。图27显示了从在130℃下,10分钟的微波提取获得的样品中检测大麻二酚酸(cbda)和四氢大麻酚酸(thca)的单离子记录(sir-ve,m/z=357)(质量扫描如图25所示)。一些cbda和thca仍然存在显示部分脱羧。实验2的结果总结图4-9分别提供了δ8-thc,δ9-thc,thc-a,cbd,cbda和cbn的标准色谱曲线。产生这些标准曲线的浓度在0和10μg/ml之间,随后用于测定使用本文所述实施方案形成的各种产品中每种化合物的浓度。表5显示了在超声提取过程中各种溶剂的使用。在回收过滤过程中损失了最小量的大麻植物材料(见表6)。对于不同的提取方法——溶剂、索氏提取、sfe提取也表现出相似的回收率(见表7和表8)。当使用微波在乙醇中进行大麻素提取/脱羧时,由于乙醇的沸点,显示使用微波的大麻素的提取/脱羧最好在低于180℃的温度下进行,例如在160℃±10℃下进行(例如,+/-可接受的误差标准)。在所使用的条件下还显示,thca转化为thc(期望的脱羧产物)在130℃时比在100℃下更好,并且如果仅使用微波与微波和sfe进行对比,则温度高于130℃(例如150℃至170℃)显示出更高效的转化率。(参见表13和15以及图10)。然而,如果随后进行sfe,则似乎存在明显的材料损失(参见表9和10以及15)。因此,获得期望的结果的最少步骤和方法是一步提取/脱羧方法。图11和12以及表14显示提取产生的最小或没有脱羧的thc产物,而加入微波步骤导致脱羧的thc显著增加。图13显示仅在100℃和170℃之间的温度下微波辐射后来自大麻的δ9-thc、thc-a、cbd和cbn的浓度。图13显示当乙醇用作溶剂时,在130℃和170℃之间的温度下的微波辐射是最佳的。图14显示在微波辐射和随后的sfe提取之后,在100℃和170℃之间的温度下来自大麻植物材料的δ9-thc、thc-a、cbd和cbn的浓度。使用sfe提取似乎不会显著增加脱羧的大麻素的产率。图15显示了在100℃和170℃之间的温度范围内微波辐射和随后的sfe提取后来自大麻的总thc、cbd和cbn的浓度,其中将thc的酸性和中性形式加在一起以代表通过每种方法提取的总thc。再次,使用sfe提取似乎不会显著增加脱羧的大麻素的产率。从上述结果看来,显著的脱羧产物thc由微波提取产生,并且添加第二提取步骤如sfe似乎不会改变大麻素分布。它进一步表明,单独微波提取或微波和sfe提取相结合后,cbd和thc组分都存在于提取物中。总之,本公开显示大麻植物材料的提取和脱羧可以使用微波同时进行,微波设定在低于提取溶剂(例如乙醇)的沸点的温度,而不需要单独的提取步骤。这优化了脱羧的大麻素的形成和回收,并且可以产生更一致和可重复的产品,具有一致和可重复的功效和治疗结果。在使用微波之前还可以包括提取步骤。微波步骤之后的提取步骤是可能存在的,不是必要的。实验3:超临界流体萃取(sfe)一般步骤:1.称重干燥的植物材料并使用研钵和研杵浸渍。2.将压碎的植物材料转移到10ml提取容器中,并进行以下任一条件。3.每5分钟收集每次运行的馏分并合并,浓缩至干燥(25℃),然后称重(绿色树脂)。4.用相同的植物纤维进行三次提取。a)sfe条件溶剂a=co2溶剂b=乙醇温度=25℃bpr=12mpapda=200-600nm(在254nm监测)流速=10ml/min;补给泵=1ml/min采集时间=30分钟方法时间=30.2分钟i.0.1分钟-25分钟;a中0-50%b的梯度26分钟;100%a30分钟;100%a下表16显示了相应的结果。表16.sfe后的提取物的重量。实验4:用乙醇的提取物的微波辅助脱羧(mae)一般步骤:1.将从上述sfe方法中分离的提取物溶解在5-10ml乙醇中,并将适当体积转移至5ml微波小瓶中。2.在5ml微波小瓶中加入额外量的乙醇和搅拌子。3.将小瓶密封并进行以下两种微波条件之一:(a)温度=150℃;运行时间=10分钟;搅拌速度=600rpm;吸收=正常(b)温度=100℃;运行时间=30分钟;搅拌速度=600rpm;吸收=正常4.然后将溶液在转移至20ml小瓶后在35℃下浓缩。结果显示在下表17中。表17.经过微波加热后树脂的重量。实验5:用乙醇的额外的微波辅助提取(mae),脱羧条件优化一般步骤:1.将干燥的植物材料称重并使用实验室搅拌器以22,000rpm浸渍60秒。2.将压碎的植物材料重新称重和搅拌子转移至20ml微波小瓶中。3.将乙醇(10ml)加入到小瓶中,然后将其密封并进行以下微波条件:(a)温度=170℃;运行时间=15分钟;预搅拌=30秒;搅拌速度=900rpm;吸收=正常。(b)温度=150℃;运行时间=20分钟;预搅拌=30秒;搅拌速度=900rpm;吸收=正常。4.过滤悬浮液,分别收集滤液和植物纤维。5.然后将滤液在35℃浓缩,然后用乙醇转移到20ml小瓶中,再在35℃下浓缩,然后储存在冰箱中。结果显示在下表18中。表18a由于压力增加,无法达到理想的温度;小瓶的盖弹出,导致溶剂和植物纤维从小瓶泄露。由于上述步骤3中的条件(b)证明在该规模上是成功的,因此使用该微波条件进行随后的脱羧并且一式三份进行。但是,进行了以下修改:步骤1:以18,000rpm混合4秒。步骤4:通过硅藻土/活性炭进行过滤(如先前在更早的报道中所述)。步骤5:然后将滤液在35℃浓缩,称重,使用乙醇转移至20ml小瓶中,然后储存在冰箱中。结果显示在下表19中。表19该实验显示了提取方法的一致性。实验6:大麻提取(1克规模)一般步骤(~1.0g一批;浸渍前):1.将干燥的植物材料称重并使用实验室搅拌器以18,000rpm浸渍4秒。2.将压碎的植物材料重新称重(~0.875g)并转移至20ml微波小瓶中并加入搅拌子。3.将乙醇(10ml)加入到小瓶中,然后将其密封并进行以下微波条件:温度=150℃;运行时间=20分钟;预搅拌=30秒;搅拌速度=900rpm;吸收=正常。4.将悬浮液用硅藻土/活性炭过滤,分别收集滤液和植物纤维。5.然后将滤液在35℃浓缩,然后用乙醇转移到20ml小瓶中,再在35℃下浓缩,然后储存在冰箱中。6.一式三份进行脱羧。冬化步骤:1.将树脂溶解在乙醇(10ml/g)中并在40℃下在水浴中加热5分钟。2.使用干冰/丙酮浴将含有提取物溶液的小瓶冷却至-75℃,保持3-4小时。3.用预先称重的注射式过滤器在20ml小瓶中过滤溶液。过滤技术参数:低蛋白结合(pvdf)膜;孔径0.22μm;直径33毫米。4.用乙醇洗涤过滤器,使用干冰/丙酮浴在-75℃下冷却5分钟。5.在35℃浓缩滤液并称重提取物。6.在通风橱中干燥2-3天后称重注射式过滤器表20.使用的大麻植物的量和在冬化之前和之后获得的提取物的量。表21.冬化前和后分离的提取物中大麻素的量(以树脂的%和植物的mg/g计)。n.d.=未确定;在进行内标重新分析之前,样品用完。a仅基于第2次和第3次运行的平均值计算。结果总结:1克规模批次的大麻提取和脱羧成功。实验7:使用修改的条件的更大规模的mae(约3.75g一批;浸渍前)1.称量干燥的植物材料(每批约3.75g)并使用实验室搅拌器以18,000rpm浸渍4秒。2.将压碎的植物材料重新称重和搅拌子转移至3×20ml微波小瓶(每小瓶约1.2g植物纤维)3.将95%-100%乙醇(12ml)加入到小瓶中,然后将其密封并进行以下微波条件:温度=150℃;运行时间=30分钟;预搅拌=30秒;搅拌速度=900rpm;吸收=正常注意:脱羧时间增加到30分钟,因为分析显示在该规模下脱羧不完全。4.在脱羧后合并3×20ml小瓶,过滤悬浮液,分别收集滤液和植物纤维。5.然后将滤液在35℃下浓缩,然后使用乙醇转移至20ml小瓶中并再次在35℃下浓缩,称重并储存在冰箱中。6.一式两份进行脱羧。结果显示在下表22中。表22b植物纤维以粉末状的芽形式提供。大小合适,因此没有进一步浸渍。c由于压力增加,无法达到150℃的所需温度。结果总结:从上面的结果可以得出结论,较大规模的微波辅助提取是成功的,在3-4克规模。通过适当调整条件,可以将此方法放大为多克和更大的规模。实验8:用乙醇的大规模微波辅助提取(mae)(a)一般步骤(约3.75克一批;浸渍前):1.将干燥的植物材料称重并使用实验室搅拌器以18,000rpm浸渍4秒。2.将压碎的植物材料重新称重和搅拌子转移至3×20ml微波小瓶(每小瓶约1.2g植物纤维)。3.将95%-100%乙醇(12ml)加入到小瓶中,然后将其密封并进行以下微波条件:温度=150℃;运行时间=30分钟;预搅拌=30秒;搅拌速度=900rpm;吸收=正常。注意:脱羧时间增加到30分钟,因为分析显示在该规模下脱羧不完全。4.脱羧后合并所有20ml小瓶,过滤悬浮液,分别收集滤液和植物纤维(第一批)。5.然后将滤液在35℃下浓缩,然后使用乙醇转移至20ml小瓶中并再次在35℃下浓缩,称重并储存在冰箱中。6.一式两份进行脱羧。冬化步骤:1.与先前描述的相同表23.使用的大麻植物的量和在冬化前和后获得的提取物的量。n.d.=没有确定。由于压力增加,无法达到150℃的期望温度;对芽没有进一步的处理。a在第1次运行中没有进行冬化;仅在第2次运行完成冬化。b植物纤维以粉末状的芽形式提供。大小合适,因此没有进一步浸渍。表24.冬化前和后分离的提取物中大麻素的量(以树脂的%和植物的mg/g计)。n.d.=未确定;在进行内标再分析之前,样品用完。a仅基于第2次运行的计算。(b)一般步骤(约7.5克一批;浸渍前):1.称量干燥的植物材料并使用实验室搅拌器以18,000rpm浸渍10秒。2.将压碎的植物材料重新称重和搅拌子转移至6×20ml微波小瓶(每小瓶约1.2g植物纤维)。3.参见上文(a)中的步骤3-6。冬化步骤:1.与先前描述的相同表25.使用的种类1(thc:7.18/cbd:8.6)的量和在冬化前和后获得的提取物的量。表26.在冬化前和后分离的种类1提取物中大麻素的量(以树脂的%和植物的mg/g计)(c)一般步骤(约4.0和7.0克一批;浸渍前):1.称量干燥的植物材料并使用实验室搅拌器以18,000rpm浸渍10秒。2.将压碎的植物材料重新称重和搅拌子转移至20ml微波小瓶(每小瓶约1.2g植物纤维)。3.对于约4.0g一批,参见上面(a)中的步骤3-5。4.对于约7.0g一批,参见上面(a)中的步骤3-5。冬化步骤:1.与先前描述的相同表27.使用的品种1植物(thc7.18/cbd8.6)的量和在冬化前和后获得的提取物的量。表28.冬化前和后分离的品种1提取物中大麻素的量(以树脂的%和植物的mg/g计)。结果总结:提取和脱羧3.75克规模批次的大麻是成功的。实验9:用乙醇的更大规模的微波辅助提取(mae)和冬化1.称取干燥的植物材料(每批约7.5g)并使用实验室搅拌器以18,000rpm浸渍10秒钟。2.将压碎的植物材料重新称重和搅拌子转移至6×20ml微波小瓶(每小瓶约1.2g植物纤维)。3.将95%-100%乙醇(12ml)加入到小瓶中,然后将其密封并进行以下微波条件:温度=150℃;运行时间=30分钟;预搅拌=30秒;搅拌速度=900rpm;吸收=正常。4.在脱羧后合并3×20ml小瓶,过滤悬浮液,分别收集滤液和植物纤维。5.然后将滤液在35℃下浓缩,然后使用乙醇转移至20ml小瓶中并再次在35℃下浓缩,称重并储存在冰箱中。6.将树脂溶解在乙醇(10ml/g)中。7.使用干冰/丙酮浴将含有提取溶液的小瓶冷却至-75℃,保持4小时。8.用预先称重的注射式过滤器在20ml小瓶中过滤溶液。过滤规格:低蛋白结合(pvdf)膜,孔径0.22μm,直径33mm。9.用乙醇洗涤过滤器,使用干冰/丙酮浴在-75℃冷却5分钟10.将滤液在35℃下浓缩并在40℃下真空干燥2天(通过水浴),然后称重提取物。11.在通风橱中干燥2-3天后称重注射式过滤器。结果显示在下表29中。表29结果总结:7.5g大规模批次的大麻提取和脱羧成功。这些实验表明,本发明的方法一致地提取大麻素并使其脱羧,并且可以以商业规模使用。实验10:冬化冬化是通常用于在0±10℃温度范围内除去蜡和其他部分可溶材料的方法。如果提取物中不存在蜡,或者这种疏水性分子被分解,并且在冰浴或低于零的温度下固化,则该方法可能不适用。实验10a为了除去蜡,将储存在冰箱(-5℃)中1-3周的提取物溶液按如下方式操作:1.20ml小瓶中使用注射式过滤器过滤溶液。过滤规格:低蛋白结合(pvdf)膜孔径0.22μm直径13米2.将滤液在35℃下浓缩并在40℃下真空干燥3天(通过水浴)。3.然后重新称量提取物。实验10b1.将树脂溶于95%-100%乙醇(10ml/g)中,在水浴中于40℃加热5分钟。2.使用干冰/丙酮浴将含有提取物溶液的小瓶冷却至-75℃,保持3-3.75小时。3.用预先称重的注射式过滤器在20ml小瓶中过滤溶液(参见上面的过滤器规格);用乙醇洗涤过滤器,使用干冰/丙酮浴在-75℃下冷却5分钟。4.将滤液在35℃下浓缩,称重提取物。5.在通风橱中干燥2-3天后称重注射式过滤器。结果显示在下表30a和b中。表30a.在冬化方法前和后分离的提取物的量表30b.在冬化方法前和后分离的提取物的平均下表31a和b显示在冬化方法前和后分离的每克pf植物材料的提取物中大麻素(以毫克计)的量。表31a.每克pf植物材料的提取物中大麻素(以毫克计)的量表31b.每克植物材料的提取物中平均大麻素(以毫克计)结果总结:提取物的冬化成功地从提取物中除去蜡。实验11:脱羧前和后的药用大麻的化学方法提取:称量干燥的植物材料(1g)并转移到研钵中并使用研杵浸渍。然后将压碎的植物材料转移到10ml容器中并进行超临界流体萃取(sfe),超临界co2作为溶剂a,乙醇作为溶剂b。光电二极管阵列检测器设置为监测200-600nm范围内的波长以及背压调节器设定为12mpa。使用的sfe条件为:流速=10ml/min(co2和从动泵(slavepumps))和1ml/min(补给泵);温度=25℃;梯度:100%a-50%a(0.1-25分钟),100%b(25-26分钟)和100%a(26-30分钟)。一旦该方法完成,将所有馏分合并,并在减压下(在25℃)浓缩至干燥,得到0.28g绿色粘性树脂。其用于进一步的处理和分析。活化:通过使用微波对大麻提取物进行加热来进行植物大麻素的活化。向5ml大小的微波小瓶中装入溶解在乙醇(2ml)中的大麻提取物(27.72mg)。将小瓶密封并在150℃下在压力容器中加热10分钟,得到绿色粘性提取物。将其在35℃浓缩至干燥,得到活化的大麻提取物作为树脂(21.2mg)。图28a和28b显示了如在大麻提取物的脱羧前(a)和后(b)的质谱中所示的选择信号,以及它们相应的化合物类别的概览。粗体信号是在大麻素生物合成途径中识别的化合物。表32.品种i大麻提取物脱羧后化学组成的潜在变化。左栏表示通过超临界流体萃取(sfe)获得的大麻提取物中存在的、但不在脱羧的树脂中存在的潜在化合物。然后,使用微波技术使该提取物经受加热条件,右栏显示识别的新的化学品,其在使用本公开中描述的微波技术之前在大麻提取物中不存在。表32封闭系统、微波提取提供了大麻素的同时提取和脱羧。在天然大麻提取物中,可以观察到63种化合物(图28a),并且在脱羧的大麻提取物中,可以存在多达22种新的化合物(表32)。来自树脂的多达26种化合物在脱羧的大麻树脂中不存在,但在脱羧步骤之前存在于大麻树脂中。实验12:无溶剂的脱羧的大麻树脂一般步骤为了从脱羧的树脂中除去溶剂,采用以下步骤:蒸馏器或旋转蒸发器用于蒸发萃取和脱羧过程中使用的溶剂,浓缩并获得无溶剂的脱羧的树脂。在溶剂蒸发期间,使用比环境温度更高的温度来促进溶剂的更快蒸发。另外,可以使用真空在低于大气压的压力下促进除去溶剂。通常,这些方法已经很好地建立并且是本领域技术人员已知的。所得的脱羧的大麻树脂可以包含小于5%的溶剂,或树脂可以不含溶剂。在根据马库什组或其他替代的组合描述本发明的方面或实施方案的情况下,本发明不仅包括作为整体列出的整个组,而且包括该组的单独地每个成员和主要组的所有可能的亚组,以及缺少一个或多个组成员的主要组。本发明还设想在要求保护的发明中明确排除任何组成员中的一个或多个。这里可以以范围格式呈现数值数据。应当理解,这样的范围格式仅仅是为了方便和简洁而使用,并且应该被灵活地解释为不仅包括明确地作为范围的限制引用的数值,而且还包括包含在该范围内的所有单独的数值或子数值,如每个数值和子范围被明确地列举。例如,约1至约4.5的数值范围应该被解释为不仅包括明确列举的1至约4.5的限制,而且还包括诸如2,3,4的单独数字和诸如1至3,2至4的子范围等。相同的原理适用于仅叙述一个数值的范围,例如“小于约4.5”,其应被解释为包括所有上述值和范围。此外,无论范围的广度或所描述的特性如何,都应该应用这种解释。尽管出于清楚和理解的目的已经在一些细节上描述了前述公开内容,但是本领域技术人员将理解,通过阅读本公开,可以在不脱离所附权利要求中公开的真实范围的情况下,进行各种形式和细节上的改变。所有出版物,专利和专利申请通过引用整体并入本文,其程度如同每个单独的出版物,专利或专利申请被具体和单独地指出通过引用整体并入。权利要求书(按照条约第19条的修改)1.一种脱羧的大麻树脂,其中所述树脂含有来自大麻属植物的脱羧的大麻素,使得该植物中的δ9-四氢大麻酚酸(δ9-thca)和大麻二酚酸(cbda)大麻素各自独立地为90%至100%脱羧以在树脂中分别产生δ9-四氢大麻酚(thc)和大麻二酚(cbd),其中所述脱羧的大麻树脂包括大麻倍半萜酚和/或大麻萜酚。2.如权利要求1所述的脱羧的大麻树脂,其中δ9-thca和cbda大麻素为92%至100%脱羧。3.如权利要求1所述的脱羧的大麻树脂,其中δ9-thca和cbda大麻素为94%至100%脱羧。4.如权利要求1所述的脱羧的大麻树脂,其中δ9-thca和cbda大麻素为96%至100%脱羧。5.如权利要求1所述的脱羧的大麻树脂,其中δ9-thca和cbda大麻素为98%至100%脱羧。6.如权利要求1所述的脱羧的大麻树脂,其中δ9-thca和cbda大麻素为99%至100%脱羧。7.如权利要求1所述的脱羧的大麻树脂,其中δ9-thca和cbda大麻素为100%脱羧。8.如权利要求1-7中任一项所述的脱羧的大麻树脂,其中所述树脂还包含大麻酚(cbn)。9.如权利要求1-8中任一项所述的脱羧的大麻树脂,其中所述树脂中的溶剂按重量或体积计小于5%。10.如权利要求1-9中任一项所述的脱羧的大麻树脂,其中所述树脂基本上不含溶剂。11.一种药物产品,其包含(i)权利要求1-10中任一项所述的脱羧的大麻树脂和(ii)合适的药学上可接受的载体或赋形剂。12.一种天然保健产品,其包含权利要求1-10中任一项所述的脱羧的大麻树脂。13.一种从大麻植物材料提取并脱羧大麻素的方法,所述方法包括:(i)从所述大麻植物材料提取大麻素,通过使所述大麻植物材料与溶剂接触从所述大麻植物材料提取大麻素,大麻的提取物包括该溶剂和大麻素;和(ii)使(a)该植物材料和(b)含有大麻素的提取物中的大麻素脱羧,通过使该植物材料和提取物在密封容器或密封器皿中在约100-200℃的温度下进行微波处理直至足以形成相应的脱羧的大麻素的时间,所述方法在进行微波处理后进一步产生大麻倍半萜酚和/或大麻萜酚。14.如权利要求13所述的方法,其中在提取步骤之前,将所述植物材料分解以形成具有适于提取的大小和形式的大麻植物材料。15.如权利要求13-14中任一项所述的方法,其中所述提取和脱羧同时发生。16.如权利要求15所述的方法,其中通过搅拌或搅动将所述大麻植物材料悬浮在溶剂中。17.如权利要求13-16中任一项所述的方法,其中所述溶剂选自由以下溶剂所组成的组:80-100%乙醇,乙二醇,异丙醇和任何上述物质的组合。18.如权利要求13-16中任一项所述的方法,其中溶剂与大麻植物材料的比例使得大麻植物材料浸没在密封容器中的溶剂中。19.如权利要求13-16中任一项所述的方法,其中根据反应的规模,时间段为约15-75分钟。20.如权利要求13-16中任一项所述的方法,其中所述温度为约130℃至约180℃。21.如权利要求20所述的方法,其中所述温度为约150℃至约170℃。22.如权利要求13-16中任一项所述的方法,其中所述微波具有约2.45ghz的频率和约1.22×108nm的波长。23.如权利要求13-16中任一项所述的方法,其中使所述植物材料和提取物在密封容器或密封器皿中经受微波是在约2-22bar的压力下进行。24.如权利要求13-23中任一项所述的方法,其中提取的和脱羧的大麻素以大麻树脂的形式回收。25.如权利要求24所述的方法,其中所述大麻树脂包括大麻倍半萜酚和/或大麻萜酚。26.如权利要求13-23中任一项所述的方法,其中提取的和脱羧的大麻素以分离的化合物的形式回收。27.如权利要求24所述的方法,其中通过从所述大麻树脂分离(i)单一大麻素、(ii)大麻素混合物、(iii)单一化合物或(iv)化合物的混合物,从所述大麻树脂回收脱羧的大麻素。28.如权利要求24所述的方法,其中使用和/或活性炭炭过滤器回收脱羧的大麻素。29.如权利要求24所述的方法,其中所述树脂中的脱羧的大麻素经过冬化以除去蜡。30.如权利要求14所述的方法,其中在所述植物材料被分解的步骤之前,干燥所述大麻植物材料。31.如权利要求13-30中任一项所述的方法,其中所述大麻植物材料是干燥的大麻。32.如权利要求24所述的方法,还包括从树脂中除去溶剂的步骤,以获得基本上无溶剂的脱羧的大麻树脂。33.如权利要求13-32中任一项所述的方法,其中所述大麻植物材料是毛状体、大麻雌性花序、花苞、大麻茎、大麻叶、或多种或其组合。34.如权利要求13-33中任一项所述的方法,其中从所述树脂中除去溶剂。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1