用于治疗HER2阳性转移性乳腺癌的组合物和方法与流程
本发明的领域是药学上增强的免疫疗法,特别是涉及用表达嵌合抗原受体和微管抑制剂的遗传修饰的天然杀伤细胞治疗。
背景技术:
背景描述包括可用于理解本发明的信息。并不承认本文提供的任何信息是现有技术或与当前要求保护的发明相关,或者具体或隐含地引用的任何出版物是现有技术。
本文中的所有出版物均以引用的方式并入,其程度如同每个单独的出版物或专利申请被具体和单独地指出以通过引用并入。如果并入的参考文献中术语的定义或用法与本文提供的术语的定义不一致或相反,则本文提供的术语的定义适用,且该术语在该参考文献中的定义不适用。
微管蛋白靶向药物通常在细胞中产生有丝分裂纺锤体组装、染色体分离和细胞分裂中的各种缺陷,因此已成为治疗各种癌症的选择,特别是卵巢癌、乳腺癌、肺癌、膀胱癌、前列腺癌、食道癌和其它类型的实体瘤癌症。不幸的是,大多数微管蛋白靶向药物具有严重的副作用,特别是对快速分裂的健康细胞。此外,由于溶解性和蛋白结合较差,这些药物中的至少一些(例如紫杉醇)的递送受到限制。为了克服这些困难,紫杉醇可以与白蛋白纳米颗粒偶联。然而,毒性仍然是一个显著问题。
人表皮生长因子受体2(her2)在多达20%的浸润性乳腺癌中过表达,并且与更具侵袭性的肿瘤、更短的复发时间和较差的总体存活相关。her2靶向疗法已经实现了显著的临床益处,包括单克隆抗体和小分子抑制剂。
最近,免疫疗法已经成为癌症疗法中有希望的选择,通常基于t细胞和腺病毒基因递送,已报道了至少中度和暂时成功。为了增加免疫疗法中细胞介导的杀伤,可以使用天然杀伤细胞(nk细胞)。nk细胞是过继性癌症免疫疗法的重要效应子细胞类型,晚期癌症患者的早期临床试验已经证明了未经修饰和激活的nk-92细胞(ank)的安全性,几个月内没有多次间隔输注的细胞因子风暴的证据。最近,发现nk细胞可以被工程化以表达一种或多种嵌合抗原受体(car)以增强其抗肿瘤活性,并且稳定的克隆her2特异性nk-92细胞系(her2.tank)在体外介导选择性和依次杀死表达her2的mda-mb-453细胞(molther.2015;23(2):330-338)。体内实验还显示了这种her2.tank细胞在mda-mb-453/egfp的鼠异种移植物中的富集,并且her2.tank细胞也减少了肾细胞癌模型中肺转移的数量。
尽管这种治疗似乎在患者中具有显著较低的毒性和不良副作用,但仍未以一致的方式实现完全和永久性缓解或根除癌细胞。此外,患有晚期her2阳性乳腺癌的患者经常表现出原发性耐药性,并且最初对这些疗法敏感的患者不可避免地随时间获得抗性。因此,仍然需要用于基于nk细胞的癌症免疫疗法的改善的组合物和方法,以及her-2阳性转移性乳腺癌中更有效的疗法。
技术实现要素:
本发明的主题涉及用于癌症免疫疗法的各种药物组合物、其应用和方法,其中,将活化nk细胞或具有进一步遗传修饰的活化nk细胞与癌症治疗剂一起施用以帮助产生对癌症更强大的治疗应答或另外预防复发。在优选方面中,活化nk细胞是永生化的或基于nk92细胞,并且癌症治疗剂是在延长的时间段内以低剂量节拍性施用的抗体(例如曲妥珠单抗等)或化学治疗药物(例如紫杉醇、nant-紫杉醇等)。在特别优选的实施方式中,活化nk细胞经遗传修饰以表达针对癌症表位或fc受体(例如cd16受体)的嵌合抗原受体(car),更优选表达高亲和力fc受体(例如cd16a受体,在位置158处具有缬氨酸的cd16a受体等)和免疫刺激细胞因子(例如il-2),优选在细胞内保留。
在一些实施方式中,通过施用活化nk细胞或具有进一步遗传修饰的活化nk细胞并共同施用癌症治疗剂(例如抗体、化学治疗药物等)而考虑了治疗或预防癌症复发的方法。在优选实施方式中,在施用活化nk细胞之前或之后,不止一次施用化学治疗药物。在此类实施方式中,优选进一步修饰活化nk细胞以表达针对癌症表位的car。
优选将本发明主题的nk细胞修饰为活化的,并且在一些实施方式中永生化以促进增殖,并且优选为nk92细胞。考虑了活化nk细胞可以进一步经遗传修饰以使其具有的杀伤细胞免疫球蛋白样受体(kir)的表达降低或消除。活化nk细胞所考虑的其它修饰包括增强的抗体依赖性细胞介导的细胞毒性(adcc)活性、fc受体(例如cd16)或高亲和力fc受体(例如cd16a受体,在位置158处具有缬氨酸的cd16a受体)的表达,或免疫刺激细胞因子(例如il-2)的表达,优选在细胞内保留。可以修饰活化nk细胞以表达嵌合抗原受体,其对癌症相关抗原、癌症特异性抗原或癌症新表位具有结合特异性(例如通过具有所需结合特异性的胞外域,通过scfv部分等)。在一些实施方式中,有利的是照射或另外影响活化nk细胞以减少或避免细胞复制。
在一些实施方式中,本发明主题的癌症治疗剂包括化学治疗药物(例如微管蛋白靶向药物、紫杉醇、与蛋白偶联的紫杉醇、与白蛋白纳米颗粒偶联的紫杉醇等)和抗体(例如对肿瘤相关抗原、肿瘤特异性抗原或癌症新表位具有结合特异性的抗体,对her2具有结合特异性的抗体,曲妥珠单抗等)。
本发明主题的一些组合物包括另外的活化nk细胞,其中一些已被遗传修饰以表达嵌合抗原受体(例如对癌症相关抗原、癌症特异性抗原或癌症新表位等具有结合特异性),fc受体(例如cd16受体等)或高亲和力fc受体(例如cd16a受体,在位置158处具有缬氨酸的cd16a受体等),以及表达免疫刺激细胞因子(例如il-2),优选在细胞内保留,而其它活化nk细胞未被进一步遗传修饰。
在本发明主题的一些方法中,施用活化nk细胞之后,在单独的事件中施用另外修饰的nk细胞或未经遗传修饰的nk细胞(例如分开至少一天施用等)。在一些实施方式中,在施用活化nk细胞之前进行癌症治疗剂的共同施用,但是考虑了可以在活化nk细胞之后施用癌症治疗剂,或者在之前和之后均施用。优选地,使用低剂量(例如单独给予时药物的最大批准剂量的50%、25%或10%等)施用化学治疗药物,优选在一周或更长时间内使用低剂量重复施用,或间隔至少两天施用。在优选治疗方法中,癌症治疗剂的施用方案和活化nk细胞的施用对于减小患者肿瘤的大小是有效的。
从以下优选实施方式的详细描述以及附图中,本发明主题的各种目的、特征、方面和优点将变得更加明显,附图中相同的数字表示相同的部件。
附图说明
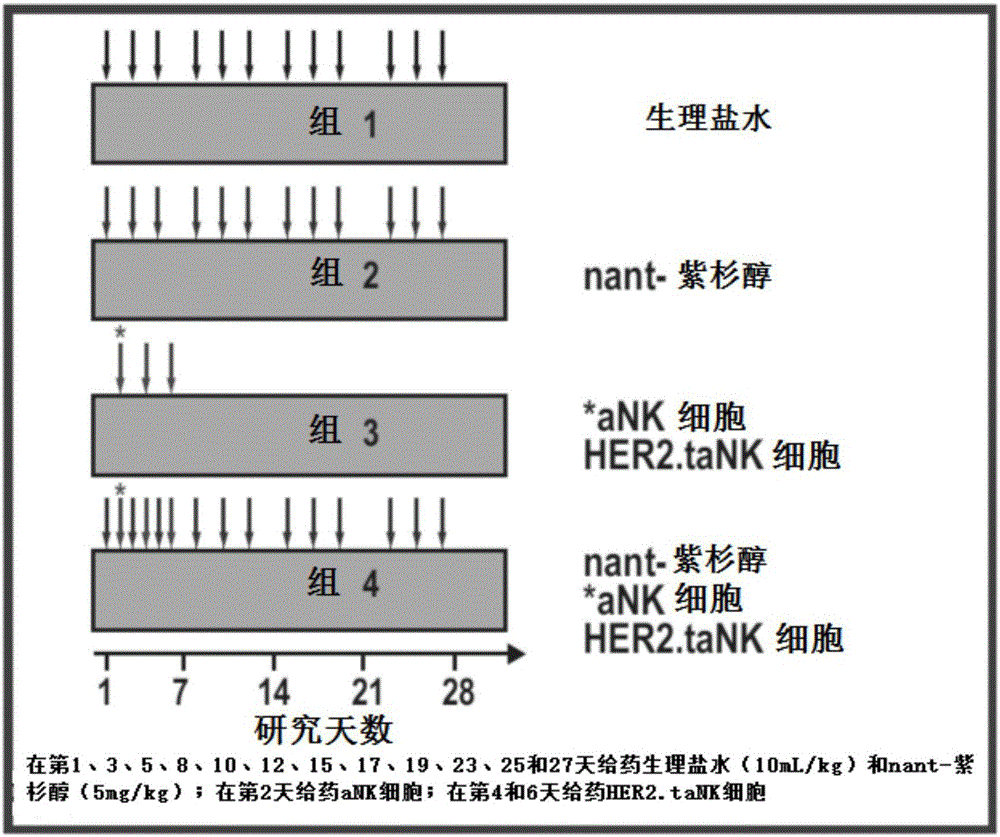
图1是描绘根据本发明主题的组合疗法的示例性施用方案和比较数据的图。
图2a是描绘图1的治疗的肿瘤体积的治疗后变化的图。
图2b是描绘图1的治疗的平均体重的治疗后变化的图。
图2c是描述在第32天每次测量对图1的治疗的肿瘤生长抑制的表。
图3a是描绘90天观察周期的肿瘤体积的治疗后变化的图。
图3b是描绘90天观察周期的平均体重的治疗后变化的图。
图4a是描绘10个样品组的施用方案的表。
图4b是描绘图4a的样品组1-6的肿瘤体积的治疗后变化的图。
图4c是描绘图4a的样品组1-6的平均体重的治疗后变化的图。
图4d是描绘图4a的样品组1、4和7-10的肿瘤体积的治疗后变化的图。
图4e是描绘图4a的样品组1、4和7-10的平均体重的治疗后变化的图。
图4f是描绘图4a的每个样品组的肿瘤生长抑制和体重变化的表。
图5a是对小鼠中pbs处理的细胞的切割的半胱天冬酶-3的ihc染色的描述。
图5b是对小鼠中曲妥珠单抗处理的细胞的切割的半胱天冬酶-3的ihc染色的描述。
图5ca是对小鼠中hank细胞处理的细胞的切割的半胱天冬酶-3的ihc染色的描述。
图5d是对小鼠中hank细胞和曲妥珠单抗组合处理的细胞的切割的半胱天冬酶-3的ihc染色的描述。
具体实施方式
发明人现在已经发现,在一些节拍性低剂量方案的实施方式中,通过共同施用癌症治疗剂(例如抗体、化学治疗药物等)可以协同地增加施用活化nk细胞或具有进一步遗传修饰的活化nk细胞的治疗效果。在优选方面中,进一步修饰活化nk细胞以表达嵌合抗原受体(例如对癌症相关抗原、癌症特异性抗原和癌症新表位具有结合特异性)。还可以修饰nk细胞以表达高亲和力fc受体(例如cd16a受体,在位置158处具有缬氨酸的cd16a受体等),以及表达免疫刺激细胞因子(例如il-2),优选在细胞内保留。在一些实施方式中,共同施用具有进一步遗传修饰的活化nk细胞和不具有进一步遗传修饰的活化nk细胞。
在特别优选的方面中,活化nk细胞是nk-92衍生物并且被修饰以具有至少一种杀伤细胞免疫球蛋白样受体(kir)的减少或消除的表达,这将使这种细胞组成型活化(通过缺乏或减少抑制)。因此,合适的修饰细胞可以具有一种或多种经修饰的杀伤细胞免疫球蛋白样受体,其被突变以减少或消除与mhci类分子的相互作用。当然,应该注意的是,也可以缺失一个或多个kir或抑制表达(例如通过mirna、sirna等)。最典型地,多于一个kir将被突变、缺失或沉默,并且特别考虑的kir包括具有两个或三个结构域的那些,其具有短或长的胞质尾。从不同的角度来看,修饰、沉默或缺失的kir将包括kir2dl1、kir2dl2、kir2dl3、kir2dl4、kir2dl5a、kir2dl5b、kir2ds1、kir2ds2、kir2ds3、kir2ds4、kir2ds5、kir3dl1、kir3dl2、kir3dl3和kir3ds1。可以使用本领域已知的方案制备这种修饰的细胞。或者,也可以作为ank细胞(活化的自然杀伤细胞)从nantkwest商购获得(参见urlwww.nantkwest.com)这种细胞。在更进一步考虑的方面中,活化的自然杀伤细胞也可以源自患者并且可以按照本领域已知的方案离体活化。
nk-92是细胞溶解性癌细胞系,其在患有非霍奇金淋巴瘤的受试者的血液中被发现,然后被离体永生化。nk-92细胞源自nk细胞,但缺乏正常nk细胞所显示的主要抑制性受体,同时保留了大部分活化受体。nk-92细胞不会攻击正常细胞,也不会在人体中引发不可接受的免疫排斥应答。nk-92细胞系的表征公开在wo1998/49268和美国专利申请公开号2002-0068044中。
在一些实施方式中,进一步遗传修饰ank以表达嵌合抗原受体。考虑到这些细胞基于永生化或另外操作的细胞,其允许快速扩增至治疗相关量。因此,可以对这些细胞进行遗传工程化以具有扩展的复制潜力,或者是nk92衍生物。在一些实施方式中,进一步遗传修饰ank细胞以表达免疫刺激细胞因子(例如il-2),优选在细胞内保留。在特别优选的方面中,进一步遗传修饰的ank包含编码嵌合t细胞受体的重组核酸。最典型地,嵌合t细胞受体将具有scfv部分或针对肿瘤相关抗原(例如cea-cam)、肿瘤特异性抗原(例如her2、psa、psma等)或癌症新表位具有结合特异性的其它胞外域。有许多方法可以进一步遗传工程化ank细胞以表达这种嵌合t细胞受体,并且所有方式都被认为适用于本文。例如,合适的嵌合抗原受体可以包含scfv部分和/或针对肿瘤相关抗原、肿瘤特异性抗原或癌症新表位具有结合特异性的其它胞外域。或者,也可以作为tank细胞('靶向活化的自然杀伤细胞')从nantkwest商购获得这种细胞。
最典型地,嵌合抗原受体被工程化以对一种或多种癌症相关抗原具有亲和力(或携带对癌症相关抗原具有特异性的抗体),并且考虑到所有已知的癌症相关抗原被认为适合使用。例如,癌症相关抗原包括cea、muc-1、cypb1等。同样,当嵌合抗原受体被工程化以对癌症特异性抗原具有亲和力(或携带对癌症相关抗原具有特异性的抗体)时,考虑到所有已知的癌症特异性抗原被认为适合使用。例如,癌症特异性抗原包括psa、her-2、psa、brachyury等。当细胞被工程化以对癌症新表位具有亲和力(或携带对癌症新表位具有特异性的抗体)时,考虑到所有已知的识别新表位的方式将导致合适的靶标。例如,可以通过肿瘤活组织检查(或淋巴活组织检查或转移部位的活组织检查)和匹配的正常组织(即来自同一患者的非患病组织)的全基因组分析并通过这样获得的组学信息的同步位置引导比对比较(例如us2012/0059670)以在第一步中从患者肿瘤中鉴定新表位。潜在抗原或新表位靶标的另外过滤或鉴定可以基于潜在靶标的预期或实际(非)表达水平、亚细胞定位或细胞外展示。然后可以进一步过滤鉴定的新表位以匹配患者的hla类型而增加新表位抗原呈递的可能性。最优选地,这种匹配可以在计算机中完成。如pct/us14/29244中所述,也可分离或产生针对新表位的抗体。
可选地,或另外地,活化nk细胞还可以与表达高亲和力fcγ受体(cd16)的遗传修饰的nk细胞组合,优选其中,受体已经结合如上所述的对癌症相关抗原、癌症特异性抗原和癌症新表位具有结合特异性的抗体。在一些实施方式中,nk细胞是经修饰以表达高亲和力fcγ受体的nk-92衍生物(例如在位置158处具有缬氨酸的cd16、cd16a、cd16a等)。fcγ受体的高亲和力变体的序列是本领域已知的,并且所有产生和表达的方式都被认为适用于本文。这种受体的表达被认为允许使用患者应答于本文考虑的治疗而产生的抗体,或者对患者肿瘤细胞、特定肿瘤类型(例如her2neu、psa、psma等)特异性的抗体,或者与癌症相关的抗体(例如cea-cam)以特异性靶向肿瘤细胞。有利地,可以作为hank细胞('高亲和力天然杀伤细胞)从nantkwest商购获得这些细胞,然后可以进一步修饰这些细胞。
无论活化nk细胞和遗传修饰的nk细胞的类型如何,考虑到细胞用于药物组合物中,通常配制成无菌可注射组合物,具有每剂量单位104-1011个细胞,更通常105-109个细胞。然而,替代制剂也被认为适用于本文,并且本文考虑了所有已知的施用途径和方式。在优选实施方式中,在施用前照射细胞以努力限制细胞的增殖。应当理解的是,可以使用其它适当的细胞修饰以减少或阻止细胞增殖。如本文所用,术语“施用”药物组合物或药物是指药物组合物或药物的直接和间接施用,其中,药物组合物或药物的直接施用通常由医疗保健专业人员(例如医生、护士等)进行,并且其中,间接施用包括向医疗保健专业人员提供或给予药物组合物或药物以直接施用(例如通过注射、输注、口腔递送、局部递送等)的步骤。
虽然不限制本发明的主题,但活化nk细胞与遗传修饰的nk细胞的比例通常在1:100和100:1之间,更通常在1:2和2:1之间,1:3和3:1之间,1:4和4:1之间,1:5和5:1之间,1:6和6:1之间,1:7和7:1之间,1:8和8:1之间,1:9和9:1之间,1:10和10:1之间,1:20和20:1之间,1:30和30:1之间或1:50和50:1之间。此外,考虑到当经过几次注射(通常分开至少一天或两天)施用时,活化nk细胞与进一步遗传修饰的nk细胞的比例通常是相等的。然而,还明确考虑了比例的适度变化。例如,可以在分开一天或两天的单次注射中进行一次至五次(或更多次)组合细胞的施用。在另一个示例中,施用可以包括最初的一次或两次(或更多次)活化nk细胞输注,然后随后输注另外的遗传修饰的nk细胞(一次或两次或更多次)。在其它示例中,进一步遗传修饰的nk细胞的施用可以与活化nk细胞的施用交替。
虽然一些实施方式可以涉及掺入化学治疗药物、ank细胞和tank细胞的组合物或方法,但应理解的是,这种实施方式可以替代或添加其它癌症治疗剂或活化nk细胞。例如,实施方式可以包括一种或多种化学治疗药物,一种或多种抗体,ank细胞,tank细胞(具有相同或不同结合特异性的car),或hank细胞(对相同或不同的结合底物具有高亲和力),或癌症治疗剂、ank细胞、tank细胞和hank细胞的任何组合。
应当理解的是,虽然单独的hank细胞和抗体(例如曲妥珠单抗)治疗可以显著减小肿瘤大小,但是考虑到组合治疗协同地减小肿瘤大小或预防癌症复发。癌症靶向抗体治疗和hank细胞治疗之间的协同作用的潜在机制是抗体诱导的抗体靶向肿瘤的免疫刺激,用于增加hank细胞的识别和杀伤,可能通过hank细胞的高亲和力cd16a受体(v158)扩增。因此,本发明的主题考虑到通过共同施用特异性靶向癌症、肿瘤或癌症相关结构的抗体以及通常对癌细胞具有高亲和力(例如通过nkg2d)或对特定癌症、肿瘤或与特定癌症相关的结构具有高亲和力的nk细胞平台的剂量来治疗特异性癌症。此类治疗可以进一步包含以低剂量节拍性方案施用的化学治疗药物以进一步增强癌症肿瘤大小的减小或预防肿瘤复发。
可以在延长的时期(例如至少一周、两周、三周或更长时间)内施用本发明主题的化学治疗药物,因此施用可以在2到10次之间,或者在5到15次之间或甚至更多次进行。最典型地,化学治疗药物的施用被分开至少一天或两天(在一些情况下甚至更长)。无论化学治疗药物的施用次数/间隔如何,优选化学治疗药物以低剂量施用。当单独给予时,特别优选的低剂量等于或小于药物最大批准剂量的50%、或等于或小于药物最大批准剂量的40%、或等于或小于药物最大批准剂量的30%、或等于或小于药物最大批准剂量的20%,或等于或小于药物最大批准剂量的10%。低剂量化疗被认为可以减少对免疫系统细胞的不利影响,因此有助于保护患者对癌症相关抗原的免疫反应。
在一些实施方式中,本发明主题的癌症治疗剂是化学治疗药物。虽然不限制本发明的主题,但通常优选化学治疗药物是抗微管剂,并且最优选紫杉醇(其可以与蛋白偶联,例如白蛋白纳米颗粒如在nant-紫杉醇,
在一些实施方式中,化学治疗药物与嵌合载体蛋白缀合物偶联,特别是嵌合白蛋白药物缀合物。最优选地,嵌合载体蛋白是经遗传工程化以具有一个或多个fc结合结构域的白蛋白,其中,将白蛋白进一步与化学治疗药物偶联。考虑的组合物将具有通用结构
t-x-a-y-d
其中,t是靶向部分,x是靶向部分与白蛋白或其它载体蛋白a的偶联模式,并且其中,化学治疗药物d通过偶联模式y与白蛋白或其它载体蛋白偶联。在最优选方面中,靶向部分是抗体或抗体衍生物,x是fc结合蛋白,a是人血清白蛋白,且d是以适当方式(特别非共价地)与白蛋白偶联的紫杉酚衍生物(例如紫杉醇)。
考虑的化学治疗药物组合物还可以省略产生嵌合载体蛋白的需要,并且依赖于靶向部分和治疗药物与载体蛋白的直接或间接非共价结合。这些化合物具有通用结构
t-n1-a-n2-d
其中,t是靶向部分,n1是靶向部分与白蛋白或其它载体蛋白a的非共价偶联模式,并且其中,化学治疗药物d通过非共价偶联模式n2与白蛋白或其它载体蛋白偶联。在最优选方面中,靶向部分是抗体或抗体衍生物,n1和n2是疏水相互作用,a是人血清白蛋白,且d是与白蛋白偶联的紫杉酚衍生物(例如紫杉醇),特别是紫杉酚衍生物(例如紫杉醇)。
取决于特定化学治疗药物和载体蛋白,应当理解的是,连接方式可以有很大变化,载体蛋白和药物之间的适当偶联包括非共价偶联、共价偶联和遗传融合。例如,当载体蛋白是白蛋白时,可以利用与药物的疏水和/或非共价相互作用。另一方面,药物也可以通过一种或多种特异性化学反应附着到载体上,通常使用白蛋白上的游离赖氨酸的连接,或通过马来酰亚胺或dac连接到白蛋白的cys34等。因此,从不同的角度来看,可以将亲水性药物与白蛋白共价偶联,而疏水性药物可以通过疏水相互作用附着。
本发明主题的一些方法和组合物包括作为癌症治疗剂的抗体。通常优选这种抗体对特定癌症、肿瘤或癌症相关的细胞内或细胞外结构具有结合特异性。特别优选的实施方式包括对乳腺癌肿瘤具有特异性结合亲和力的抗体,更具体地是her2阳性乳腺癌肿瘤(例如曲妥珠单抗)。然而,应当理解的是,本发明的主题考虑到使用其它或另外的癌症相关抗体(例如阿仑单抗、阿巴伏单抗、阿比珠单抗、阿德木单抗、阿托珠单抗、培化阿珠单抗、阿麦妥昔单抗、麻安莫单抗、anetumabravtansine、阿泊珠单抗、ascrinvacumab、阿特珠单抗(、巴维昔单抗、贝利木单抗、贝伐单抗、莫-比伐珠单抗、贝伦妥单抗-维多汀、brontictuzumab、卡妥索单抗、西妥昔单抗、clivatuzumabtetraxetan、达雷木单抗、依决洛单抗、厄马索单抗、依他昔单抗、奥佐米星单抗、吉瑞昔单抗、格莱木单抗-维多汀、替-伊莫单抗、伊匹木单抗、拉贝珠单抗、nivolumab、尼妥珠单抗、nivolumab、阿托珠单抗、奥法木单抗、奥戈伏单抗、帕尼单抗、派姆单抗、pemtumomab、培妥珠单抗、雷莫芦单抗、利妥昔单抗、tacatuzumabtetraxetan、托西莫单抗、曲妥珠单抗-美坦新偶联物、伏妥昔单抗、扎芦木单抗、扎木单抗等)。
在一些实施方式中,在活化nk细胞的剂量之前将抗体施用于患者。优选地,在施用活化nk细胞(例如nk92、ank、tank、hank或其组合)之前至少三小时,将抗体的剂量递送至患者,尽管考虑到在nk细胞处理前超过4、5、6、12、18、24或32小时递送抗体。此外,考虑到连续或分批施用抗体以及nk细胞的方法。作为抗体的替代物或者除了它们之外,可以施用其它癌症治疗剂(例如化学治疗剂)。
实施例1
在一种示例性治疗方法中确定her2.tank与节拍性nant-紫杉醇(abraxane)的组合在her2阳性乳腺癌的小鼠模型中的功效,发明人使用如前所述的her2.tank细胞(molther.2015;23(2):330-338)。将mda-mb-453细胞(0.1ml在50%基质胶中的1×108细胞/ml)皮下注射到雌性nod/scid小鼠(7至8周龄)的左右侧腹区域。当肿瘤达到约100mm3时,将小鼠随机分配成4组,每组4只小鼠,给予(静脉注射)生理盐水、nant-紫杉醇、γ-照射(10gy)的ank细胞/her2.tank细胞,或nant-紫杉醇加γ-照射(10gy)的ank细胞/her2.tank细胞(对细胞进行γ-照射以阻止细胞复制)。在给予前每周两次用卡尺测量肿瘤生长,然后每周两次;在注射细胞之前,在给予之前称重动物,然后每周两次。所有数据均以平均值±sem表示,并使用anova和学生t检验进行统计分析。
图1示意性地描绘了所述治疗方法的四种不同治疗方案。在第1、3、5、8、10、12、15、17、19、23、25和27天施用生理盐水(10ml/kg)和nant-紫杉醇(5mg/kg);在第2天施用ank细胞;在第4天和第6天施用her2.tank细胞。可以从图2a和2b中容易地看出肿瘤体积随着生理盐水注射而增加,并且单独使用her2.tank细胞和nant-紫杉醇适度地抑制肿瘤体积。出乎意料的是,在整个实验期间,用nk/her2.tank细胞和nant-紫杉醇的结合治疗产生了显著且持久的肿瘤体积减小,而her2.tank细胞和ank细胞适度且暂时地影响了体重。图2c中的表反映了在第32天表达为肿瘤生长抑制的变化,并且显示了使用组合治疗方案的癌症生长显著减小。
应当理解的是,虽然单独的nant-紫杉醇和单独的ank细胞/her2.tank细胞显著抑制her2阳性乳腺癌小鼠模型中的肿瘤生长,但是nant-紫杉醇加上ank细胞/her2.tank细胞的组合似乎具有协同作用,导致显著的肿瘤消退,并且与单独的每种试剂相比具有显著更好的疗效。值得注意的是,在实验早期仅施用两次her2.tank细胞,但对肿瘤生长具有持久影响。在这组实验中证明了低剂量紫杉醇和基于nk细胞的免疫疗法之间协同作用的潜在机制是紫杉醇诱导的肿瘤免疫刺激,以通过抗原级联增加识别并通过靶向肿瘤的nk-92平台杀死肿瘤。因此,结果说明了在转移性乳腺癌和其它癌症患者的临床试验中将节拍性(低剂量)化疗法与基于nk的免疫疗法相结合的潜力。
因此,考虑的治疗可以包括靶向特异性癌症或癌症相关结构的基于细胞的组合物,以节拍性方式且低剂量将癌症治疗药物(例如化学治疗药物)与所述组合物共同施用。有利地,这种治疗提供了肿瘤大小的显著减小(或预防癌症的复发),同时癌症治疗剂对患者的不利影响最小。
图3a和3b描绘了与上述类似的90天治疗方案和观察期。应当注意的是,在图3a中,尽管在单独的ank/her2.tank治疗方案和nant-紫杉醇治疗方案下肿瘤体积早期(前30天)减小,但肿瘤在30天标记后继续生长。两种治疗方案均未能在her2阳性乳腺癌的小鼠模型中提供延长或维持的肿瘤减小。最值得注意的是,两种治疗方案下的肿瘤体积超过当开始治疗时(即100mm3)的肿瘤体积。实际上,接近90天标记,ank/her2.tank治疗方案和nant-紫杉醇治疗方案的肿瘤体积分别为~400mm3和~200mm3。
特别值得注意的是,组合的ank/her2.tank和nant-紫杉醇治疗方案不仅导致肿瘤体积的意外协同减小,而且还意外地导致her2阳性乳腺癌小鼠模型中延长和维持的肿瘤减小。事实上,虽然单独的ank/her2.tank治疗方案和nant-紫杉醇治疗方案分别早在第20天和第40天无法阻止肿瘤生长,但在90天观察期间,组合ank/her2.tank和nant-紫杉醇治疗方案均成功地减小肿瘤尺寸并阻止显著的肿瘤生长。这些结果表明组合的ank/her2.tank和nant-紫杉醇治疗方案不仅能在短时间内(30天)有效协同减小肿瘤大小,而且有利于增强对her2阳性乳腺癌的免疫应答或另外预防肿瘤再生长达90天。特别值得注意的是,这些证据表明本发明主题的治疗对于预防癌症复发是显著有效的。
此外,如图3b所示,在90天观察期内,组合的ank/her2.tank和nant-紫杉醇治疗方案(前10天)的早期体重减轻会迅速反弹至超过治疗前体重,表明组合治疗的明显毒性作用是短期的,或者患者另外适应治疗方案的负面生物学效应。
实施例2
在第二种示例性治疗方法中确定hank细胞与曲妥珠单抗的组合在her2阳性乳腺癌的小鼠模型中的功效的,发明人使用如前所述的hank细胞。通过用含有cd16的高亲和力v变体(在位置158处具有缬氨酸)和细胞内保留的il-2的双顺反子质粒载体转染亲本ank细胞系来开发hank细胞,这使得hank细胞能够在不存在外源性il-2的情况下生长。该质粒含有cd16和il-2的一些人源序列,它们都没有任何转化特性。
将mda-mb-453细胞(0.1ml的1×108/ml在50%基质胶中)皮下注射到雌性nod-scidil2rγ空(nsg,jacksonlaboratory)小鼠(7至8周龄)的左右侧腹区域。如图4a所示,当肿瘤达到约100mm3时,将小鼠随机分配到10组中的一组中,每组4只小鼠,并在尾静脉中静脉内给予生理盐水(pbs)、igg1(1gm/kg和3mg/kg剂量)、曲妥珠单抗(1gm/kg和3mg/kg剂量)、如前所述的hank细胞(1x107个细胞)、igg1和hank细胞的组合治疗(1gm/kg和3mg/kg剂量的igg1)、以及曲妥珠单抗和hank细胞的组合治疗(1gm/kg和3mg/kg剂量的曲妥珠单抗)。如图4f所示,igg1和曲妥珠单抗对照组每周接受一次剂量,持续四周,而每周施用一次生理盐水、hank细胞和igg1/曲妥珠单抗和hank细胞的组合治疗方案抗体达四周,并且每周施用两次hank细胞达四周。在组合治疗中,在注射hank细胞前,小鼠接受抗体剂量至少3小时。
每周两次测量肿瘤生长和动物重量,如图4b-4f中所记录。使用双向anova评估各组之间肿瘤体积或体重变化的差异的统计学分析,其中重复测量,然后进行bonferroni测试,如图4f中报告的(p值)。使用graphpadprism软件版本5分析所有数据。p<0.05被认为是统计学上显著的。报道的图4f的t/c(%)是δt/δc×100,其中δt和δc分别是治疗组和对照组在第29天和第1天测量之间的平均肿瘤体积的变化。mwl是观察到的治疗周期的最大动物体重减轻。
对照和1mg/kg剂量抗体组(图4a的组1-6)的肿瘤大小和体重变化的记录结果描绘于图4b和4c中。应该注意的是,生理盐水和igg1治疗各自导致肿瘤大小的净增加,而曲妥珠单抗
特别值得注意的是,曲妥珠单抗(1mg/kg)和hank细胞的组合治疗令人惊讶地导致肿瘤大小的协同和显著减小(每个图4f的t/c值为-60.1%)。每种单独的曲妥珠单抗方案和hank细胞方案的肿瘤大小减小与组合的曲妥珠单抗和hank细胞方案的肿瘤大小的协同减小之间的显著差异表明施用方案小于1mg/kg的曲妥珠单抗与hank细胞的组合可协同减小her2阳性乳腺癌模型的肿瘤大小(例如每千克不超过0.9mg、0.8mg、0.7mg、0.6mg、0.5mg、0.4mg、0.3mg、0.2mg或0.1mg)。
对照和3mg/kg剂量抗体组(图4a的组1、4、7-10)的肿瘤大小和体重变化的记录结果描绘于图4d和4e中。应该注意的是,与1mg/kgigg1和hank细胞治疗相比,igg13mg/kg和hank细胞治疗出乎意料地导致肿瘤大小减小一倍以上(与-26.4%相比,t/c值分别为-10.7%;图4f)。这表明增加的抗体浓度通常可以增强hank细胞对her2阳性乳腺癌的抗肿瘤活性。
还值得注意的是,单独3mg/kg曲妥珠单抗治疗以及3mg/kg曲妥珠单抗和hank细胞组合治疗导致大致相同的肿瘤减小。这表明如此高剂量的曲妥珠单抗掩盖了曲妥珠单抗和hank细胞组合治疗的协同作用。因此,在曲妥珠单抗和hank细胞组合治疗中,较低剂量的曲妥珠单抗(例如2.5mg/kg、2mg/kg、1.5mg/kg、1.2mg/kg、0.8mg/kg、0.6mg/kg、0.4mg/kg等)可能更有效地用于her2阳性乳腺癌的肿瘤减小。
此外,与包括每剂量1x107个细胞的hank细胞的所有治疗相关的体重的波动和净减少表明较低剂量的hank细胞(例如5x106、1x106、5x105、1x105、5x104、1x104等)更有效地降低剂量对患者的潜在毒性作用,并且可能增加由曲妥珠单抗和hank细胞组合治疗引起的肿瘤大小的协同减小。然而,应该注意的是,观察到与hank细胞或组合治疗相关的体重减轻被认为是显著的。
另外,用切割的半胱天冬酶-3兔单克隆抗体(cellsignaling,cat#9579)以1:100染色石蜡包埋的肿瘤,并用苏木精复染色。如图5a至5d所示,与生理盐水对照和单独的任一种试剂相比,这种染色显示与曲妥珠单抗(1mg/kg)和hank细胞组合治疗相关的半胱天冬酶3活性增加。
在一些实施方式中,用于描述和要求保护本发明某些实施方式的表示成分、性质的量如浓度、反应条件等的数字应理解为在某些情况下由术语“约”修饰。因此,在一些实施方式中,书面描述和所附权利要求书中列出的数值参数是近似值,其可以根据特定实施方式寻求获得的所需特性而变化。在一些实施方式中,数值参数应根据报告的有效数字的数量并通过应用普通的舍入技术来解释。尽管阐述本发明的一些实施方式的宽范围所列出的数值范围和参数是近似值,但具体实施例中列出的数值尽可能精确地被报告。在本发明的一些实施方式中呈现的数值可能含有必然由其各自的测试测量中发现的标准偏差引起的某些误差。
如本文的描述和随后的权利要求中所使用的,“一个”,“一种”和“该”的含义包括复数指代,除非上下文另有明确说明。此外,如在本文的描述中所使用的,除非上下文另有明确规定,否则“在...中”的含义包括“在...中”和“在......上”。
对于本领域技术人员显而易见的是,在不脱离本文的发明构思的情况下,除了已经描述的那些之外的更多修饰是可能的。因此,除了所附权利要求的范围之外,本发明的主题不受限制。此外,在解释说明书和权利要求时,所有术语应以与上下文一致的最可能广泛的方式解释。特别地,术语“包括”和“包含”应该被解释为以非排他的方式指代元素、组分或步骤,表明所引用的元素、组分或步骤可以存在,或者利用或与未明确引用的其它元素、组分或步骤组合。当说明书权利要求涉及选自由a、b、c......和n组成的组中的至少一种时,文本应解释为只需要组中的一个元素,而不是a加n,或b加n等。
权利要求书(按照条约第19条的修改)
1.一种试剂盒,其包含:
多种活化nk细胞,其中,所述多种活化nk细胞的第一部分进一步经遗传修饰以(a)表达对癌症相关抗原、癌症特异性抗原或癌症新表位具有结合特异性的嵌合抗原受体,或(b)表达选自由cd16受体、cd16a受体和在位置158处具有缬氨酸的cd16a受体组成的组中的fc受体;并且
其中,所述多种活化nk细胞的第二部分未经进一步遗传修饰;以及
选自由抗体和化学治疗药物组成的组中的癌症治疗剂。
2.根据权利要求1所述的试剂盒,其中,所述活化nk细胞是nk92细胞。
3.根据权利要求1所述的试剂盒,其中,所述活化nk细胞是永生化的。
4.根据权利要求1所述的试剂盒,其中,所述活化nk细胞使其具有的至少一种杀伤细胞免疫球蛋白样受体(kir)的表达降低或消除。
5.根据权利要求1所述的试剂盒,其中,所述活化nk细胞经遗传修饰以增强抗体依赖性细胞介导的细胞毒性(adcc)活性。
6.(删除)
7.根据权利要求1所述的试剂盒,其中,所述fc受体是在位置158处具有缬氨酸的cd16a受体。
8.根据权利要求1所述的试剂盒,其中,所述活化nk细胞的第一部分进一步经遗传修饰以表达对癌症相关抗原、癌症特异性抗原或癌症新表位具有结合特异性的嵌合抗原受体。
9.根据权利要求1所述的试剂盒,其中,所述活化nk细胞的第一部分进一步经遗传修饰以表达具有scfv部分的嵌合抗原受体。
10.根据权利要求8所述的试剂盒,其中,所述嵌合抗原受体具有针对肿瘤相关抗原、肿瘤特异性抗原或癌症新表位具有结合特异性的胞外域。
11.根据权利要求8所述的试剂盒,其中,所述嵌合抗原受体对癌症相关抗原具有结合特异性。
12.根据权利要求8所述的试剂盒,其中,所述嵌合抗原受体对癌症特异性抗原具有结合特异性。
13.根据权利要求8所述的试剂盒,其中,所述嵌合抗原受体对癌症新表位具有结合特异性。
14.根据权利要求1所述的试剂盒,其中,照射所述活化nk细胞以减少或避免复制。
15.根据权利要求1所述的试剂盒,其中,所述癌症治疗剂是化学治疗药物。
16.根据权利要求1所述的试剂盒,其中,所述癌症治疗剂是微管蛋白靶向药物。
17.根据权利要求1所述的试剂盒,其中,所述癌症治疗剂是紫杉醇。
18.根据权利要求17所述的试剂盒,其中,所述紫杉醇与蛋白偶联。
19.根据权利要求17所述的试剂盒,其中,所述紫杉醇与白蛋白纳米颗粒偶联。
20.根据权利要求1所述的试剂盒,其中,所述癌症治疗剂是抗体。
21.根据权利要求1所述的试剂盒,其中,所述癌症治疗剂是针对肿瘤相关抗原、肿瘤特异性抗原或癌症新表位具有结合特异性的抗体。
22.根据权利要求1所述的试剂盒,其中,所述癌症治疗剂是对her2具有结合特异性的抗体。
23.根据权利要求1所述的试剂盒,其中,所述癌症治疗剂是曲妥珠单抗。
24.(删除)
25.(删除)
26.(删除)
27.一种治疗或预防癌症复发的方法,其包括:
施用活化nk细胞,其中,所述活化nk细胞进一步经遗传修饰;以及
共同施用选自由抗体和化学治疗药物组成的组中的癌症治疗剂。
28.根据权利要求27所述的方法,其中,所述活化nk细胞进一步经遗传修饰以使其具有的至少一种杀伤细胞免疫球蛋白样受体(kir)的表达降低或消除。
29.根据权利要求27所述的方法,其中,所述活化nk细胞进一步经遗传修饰以增强抗体依赖性细胞介导的细胞毒性活性。
30.根据权利要求27所述的方法,其中,所述活化nk细胞进一步经遗传修饰以表达fc受体。
31.根据权利要求30所述的方法,其中,所述fc受体选自由cd16受体、cd16a受体和在位置158处具有缬氨酸的cd16a受体组成的组。
32.根据权利要求27所述的方法,其中,所述活化nk细胞进一步经遗传修饰以表达对癌症相关抗原、癌症特异性抗原或癌症新表位具有结合特异性的嵌合抗原受体。
33.根据权利要求32所述的方法,其中,所述嵌合抗原受体对癌症相关抗原具有结合特异性。
34.根据权利要求32所述的方法,其中,所述嵌合抗原受体对癌症特异性抗原具有结合特异性。
35.根据权利要求32所述的方法,其中,所述嵌合抗原受体对癌症新表位具有结合特异性。
36.根据权利要求32所述的方法,其中,所述嵌合抗原受体对her2具有结合特异性。
37.根据权利要求27所述的方法,其中,施用所述活化nk细胞的步骤还包括施用多种活化nk细胞,其中,所述活化nk细胞的第一部分进一步经遗传修饰以表达对癌症相关抗原、癌症特异性抗原或癌症新表位具有结合特异性的嵌合抗原受体。
38.根据权利要求37所述的方法,其中,所述活化nk细胞的第二部分进一步经遗传修饰以表达选自由cd16受体、cd16a受体和在位置158处具有缬氨酸的cd16a受体组成的组中的fc受体。
39.根据权利要求37所述的方法,其中,施用所述活化nk细胞的步骤包括施用所述活化nk细胞,然后在分开的事件中施用经遗传修饰的活化nk细胞的第一部分,并且其中,所述分开的事件间隔至少一天。
40.根据权利要求27所述的方法,其中,施用所述活化nk细胞的步骤还包括施用未经进一步遗传修饰的第二活化nk细胞。
41.根据权利要求40所述的方法,其中,施用所述活化nk细胞的步骤包括施用所述第二活化nk细胞,然后在分开的事件中施用经遗传修饰的活化nk细胞,并且其中,所述分开的事件间隔至少一天。
42.根据权利要求27所述的方法,其中,在施用所述活化nk细胞之前,进行共同施用所述癌症治疗剂的步骤至少一次。
43.根据权利要求27所述的方法,其中,在施用所述活化nk细胞之后,进行共同施用所述癌症治疗剂的步骤至少一次。
44.根据权利要求27所述的方法,其中,所述癌症治疗剂是化学治疗药物。
45.根据权利要求27所述的方法,其中,使用低剂量进行共同施用所述化学治疗药物的步骤。
46.根据权利要求45所述的方法,其中,当单独给予时,所述低剂量小于药物最大批准剂量的50%。
47.根据权利要求45所述的方法,其中,当单独给予时,所述低剂量小于药物最大批准剂量的25%。
48.根据权利要求45所述的方法,其中,当单独给予时,所述低剂量小于药物最大批准剂量的10%。
49.根据权利要求45所述的方法,其中,在至少一周内重复施用所述低剂量。
50.根据权利要求51所述的方法,其中,间隔至少两天施用所述低剂量。
51.根据权利要求44所述的方法,其中,所述化学治疗药物是紫杉醇。
52.根据权利要求27所述的方法,其中,所述癌症治疗剂是对her2具有结合特异性的抗体。
53.根据权利要求27所述的方法,其中,所述癌症治疗剂是曲妥珠单抗。
54.根据权利要求27所述的方法,其中,患者的肿瘤大小减小。
55.(删除)
56.(删除)
57.根据权利要求1-2中任一项所述的试剂盒,其中,所述活化nk细胞是永生化的。
58.根据权利要求1-2和57中任一项所述的试剂盒,其中,所述活化nk细胞使其具有的至少一种杀伤细胞免疫球蛋白样受体(kir)的表达降低或消除。
59.根据权利要求1-2和57-58中任一项所述的试剂盒,其中,所述活化nk细胞经遗传修饰以增强抗体依赖性细胞介导的细胞毒性(adcc)活性。
60.(删除)
61.根据权利要求55-59中任一项所述的试剂盒,其中,所述fc受体是在位置158处具有缬氨酸的cd16a受体。
62.根据权利要求1-2和57-61中任一项所述的试剂盒,其中,所述活化nk细胞的第一部分进一步经遗传修饰以表达对癌症相关抗原、癌症特异性抗原或癌症新表位具有结合特异性的嵌合抗原受体。
63.根据权利要求1-2和57-62中任一项所述的试剂盒,其中,所述活化nk细胞的第一部分进一步经遗传修饰以表达具有scfv部分的嵌合抗原受体。
64.根据权利要求62-63中任一项所述的试剂盒,其中,所述嵌合抗原受体具有针对肿瘤相关抗原、肿瘤特异性抗原或癌症新表位具有结合特异性的胞外域。
65.根据权利要求62-64中任一项所述的试剂盒,其中,所述嵌合抗原受体对癌症相关抗原具有结合特异性。
66.根据权利要求62-65中任一项所述的试剂盒,其中,所述嵌合抗原受体对癌症特异性抗原具有结合特异性。
67.根据权利要求62-66中任一项所述的试剂盒,其中,所述嵌合抗原受体对癌症新表位具有结合特异性。
68.根据权利要求1-2和57-67中任一项所述的试剂盒,其中,照射所述活化nk细胞以减少或避免复制。
69.根据权利要求1-2和57-68中任一项所述的试剂盒,其中,所述癌症治疗剂是化学治疗药物。
70.根据权利要求1-2和57-69中任一项所述的试剂盒,其中,所述化学治疗药物是微管蛋白靶向药物。
71.根据权利要求1-2和57-70中任一项所述的试剂盒,其中,所述化学治疗药物是紫杉醇。
72.根据权利要求71所述的试剂盒,其中,所述紫杉醇与蛋白偶联。
73.根据权利要求71所述的试剂盒,其中,所述紫杉醇与白蛋白纳米颗粒偶联。
74.根据权利要求1-2和57-73中任一项所述的试剂盒,其中,所述癌症治疗剂是抗体。
75.根据权利要求1-2和57-74中任一项所述的试剂盒,其中,所述抗体针对肿瘤相关抗原、肿瘤特异性抗原或癌症新表位具有结合特异性。
76.根据权利要求1-2和57-75中任一项所述的试剂盒,其中,所述抗体对her2具有结合特异性。
77.根据权利要求1-2和57-76中任一项所述的试剂盒,其中,所述抗体是曲妥珠单抗。
78.根据权利要求1-2和57-77中任一项所述的试剂盒,其中,所述活化nk细胞的第一部分进一步经遗传修饰以表达对癌症相关抗原、癌症特异性抗原或癌症新表位具有结合特异性的嵌合抗原受体。
79.根据权利要求78所述的试剂盒,其中,所述活化nk细胞的第一部分进一步经遗传修饰以表达选自由cd16受体、cd16a受体和在位置158处具有缬氨酸的cd16a受体组成的组中的fc受体。
80.(删除)
81.一种药物组合物,其包含药学上可接受的载体与组合物的组合,所述组合物包含根据权利要求55-80中任一项所述的试剂盒的内容物。
82.根据权利要求81所述的药物组合物,其中,所述组合物以减少患有癌症的患者的肿瘤大小的有效量存在。
83.根据权利要求81所述的药物组合物,其中,所述组合物以治疗或预防癌症复发的有效量存在。
84.根据权利要求81所述的药物组合物,其中,所述组合物配制用于口腔施用或注射施用。
85.包含根据权利要求1-2和57-79中任一项所述的试剂盒的内容物的组合物在制备药物组合物中的应用。
86.根据权利要求1-2和57-79中任一项所述的试剂盒在治疗或预防癌症复发中的应用。
87.根据权利要求1-2和57-79中任一项所述的试剂盒在治疗或预防her2阳性乳腺癌复发中的应用。
88.根据权利要求1-2和57-79中任一项所述的试剂盒在减小肿瘤大小中的应用。
89.一种减小肿瘤大小的方法,其包括向患有癌症的受试者施用根据权利要求1-2和57-79中任一项所述的试剂盒的步骤。
90.一种治疗或预防癌症复发的方法,其包括向患有癌症的受试者施用根据权利要求1-2和57-79中任一项所述的试剂盒的步骤。
91.(删除)
92.(删除)
93.根据权利要求27和28中任一项所述的方法,其中,所述活化nk细胞进一步经遗传修饰以增强抗体依赖性细胞介导的细胞毒性活性。
94.根据权利要求27、28和93中任一项所述的方法,其中,所述活化nk细胞进一步经遗传修饰以表达fc受体。
95.根据权利要求94所述的方法,其中,所述fc受体选自由cd16受体、cd16a受体和在位置158处具有缬氨酸的cd16a受体组成的组。
96.根据权利要求27、28和93-95中任一项所述的方法,其中,所述活化nk细胞进一步经遗传修饰以表达对癌症相关抗原、癌症特异性抗原或癌症新表位具有结合特异性的嵌合抗原受体。
97.根据权利要求96所述的方法,其中,所述嵌合抗原受体对癌症相关抗原具有结合特异性。
98.根据权利要求96所述的方法,其中,所述嵌合抗原受体对癌症特异性抗原具有结合特异性。
99.根据权利要求96所述的方法,其中,所述嵌合抗原受体对癌症新表位具有结合特异性。
100.根据权利要求96所述的方法,其中,所述嵌合抗原受体对her2具有结合特异性。
101.根据权利要求27、28和93-100中任一项所述的方法,其中,施用所述活化nk细胞的步骤还包括施用多种活化nk细胞,其中,所述活化nk细胞的第一部分进一步经遗传修饰以表达对癌症相关抗原、癌症特异性抗原或癌症新表位具有结合特异性的嵌合抗原受体。
102.根据权利要求101所述的方法,其中,所述活化nk细胞的第二部分进一步经遗传修饰以表达选自由cd16受体、cd16a受体和在位置158处具有缬氨酸的cd16a受体组成的组中的fc受体。
103.根据权利要求101所述的方法,其中,施用所述活化nk细胞的步骤包括施用所述活化nk细胞,然后在分开的事件中施用经遗传修饰的活化nk细胞的第一部分,并且其中,所述分开的事件间隔至少一天。
104.根据权利要求27、28和93-103中任一项所述的方法,其中,施用所述活化nk细胞的步骤还包括施用未经进一步遗传修饰的第二活化nk细胞。
105.根据权利要求104所述的方法,其中,施用所述活化nk细胞的步骤包括施用所述第二活化nk细胞,然后在分开的事件中施用经遗传修饰的活化nk细胞,并且其中,所述分开的事件间隔至少一天。
106.根据权利要求27、28和93-105中任一项所述的方法,其中,在施用所述活化nk细胞之前,进行共同施用所述癌症治疗剂的步骤至少一次。
107.根据权利要求27、28和93-106中任一项所述的方法,其中,在施用所述活化nk细胞之后,进行共同施用所述癌症治疗剂的步骤至少一次。
108.根据权利要求27、28和93-107中任一项所述的方法,其中,所述癌症治疗剂是化学治疗药物。
109.根据权利要求27、28和93-108中任一项所述的方法,其中,使用低剂量进行共同施用所述化学治疗药物的步骤。
110.根据权利要求109所述的方法,其中,当单独给予时,所述低剂量小于药物最大批准剂量的50%。
111.根据权利要求109所述的方法,其中,当单独给予时,所述低剂量小于药物最大批准剂量的25%。
112.根据权利要求109所述的方法,其中,当单独给予时,所述低剂量小于药物最大批准剂量的10%。
113.根据权利要求109-112中任一项所述的方法,其中,在至少一周内重复施用所述低剂量。
114.根据权利要求109-113中任一项所述的方法,其中,间隔至少两天施用所述低剂量。
115.根据权利要求109-114中任一项所述的方法,其中,所述化学治疗药物是紫杉醇。
116.根据权利要求27、28和93-107中任一项所述的方法,其中,所述癌症治疗剂是对her2具有结合特异性的抗体。
117.根据权利要求27、28和93-107中任一项所述的方法,其中,所述癌症治疗剂是曲妥珠单抗。
118.根据权利要求27、28和93-117中任一项所述的方法,其中,患者的肿瘤大小减小。
- 还没有人留言评论。精彩留言会获得点赞!