基于领域本体知识库的药品不良反应智能监测方法与流程
本发明涉及药品不良反应监测领域,特别涉及一种基于领域本体知识库的药品不良反应智能监测方法。
背景技术
目前,应用较为广泛的药品不良反应(adversedrugreaction,adr)监测方法主要有:
1)自发呈报系统:2001年我国建立了“国家药品不良反应监测系统”,该系统是我国adr报告信息管理的主要应用平台,主要以“自发呈报”的方式被动采集医疗机构、药品生产厂家、经营企业的adr报告,该方法主要存在adr情况漏报、误报、迟报等问题。
2)中国医院药物警戒系统:2016年由国家药品不良反应监测中心发起构建的“中国医院药物警戒系统”,通过与医院信息管理系统(hospitalinformationsystem,简称his)连接,实现了adr智能搜索和发现、快速上报等功能,使adr的“被动”监测转化为“主动”监测。然而,该系统依然存在一些问题:①医疗机构的adr均由人工判断上报,adr的判断经验或知识并没有得到系统的整合,系统无法获取到这些知识,并进行学习;②随着国家对上报数据的规范化标准化要求,上报至国家数据库中的报告数据已经基本归一化,这些报告是系统可以进行学习的知识库,却并未得到利用;③系统中的adr智能搜索功能是基于lucene的全文搜索技术实现的,并未考虑语义搜索,因此查全率与查准率低。
技术实现要素:
本发明要解决的技术问题在于,针对现有技术的上述缺陷,提供一种能实现语义查询扩展、提高智能监测方法中搜索引擎工具检索结果的查全率与查准率的基于领域本体知识库的药品不良反应智能监测方法。
本发明解决其技术问题所采用的技术方案是:构造一种基于领域本体知识库的药品不良反应智能监测方法,包括如下步骤:
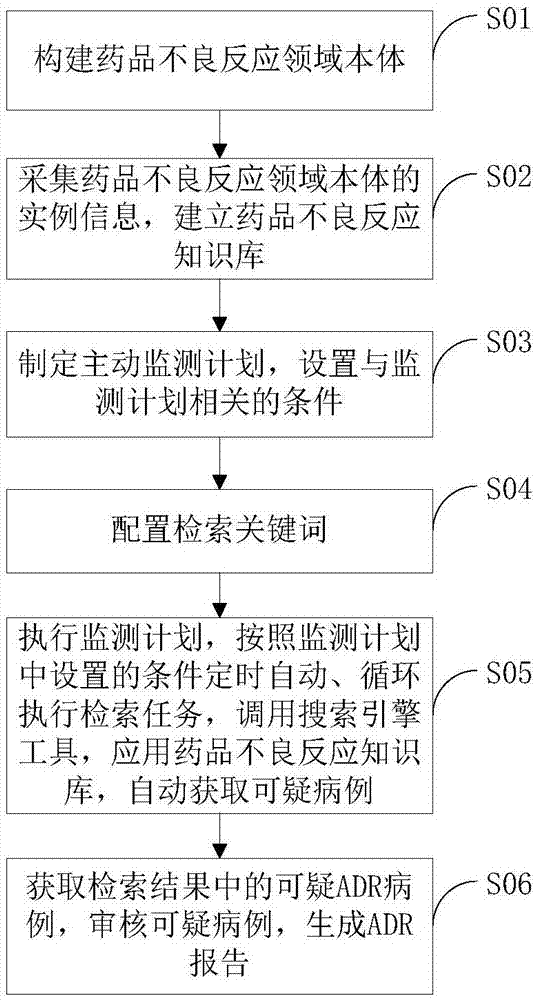
a)构建药品不良反应领域本体;
b)采集所述药品不良反应领域本体的实例信息,建立药品不良反应知识库;
c)制定主动监测计划,设置与所述监测计划相关的条件;
d)配置检索关键词;
e)执行所述监测计划,按照所述监测计划中设置的条件定时自动、循环执行检索任务,调用搜索引擎工具,应用所述药品不良反应知识库,自动获取可疑病例;
f)获取检索结果中的可疑adr病例,审核可疑病例,生成adr报告。
在本发明所述的基于领域本体知识库的药品不良反应智能监测方法中,所述步骤a)进一步包括:
a1)定义本体类;所述本体类至少包括药品不良反应事件、临床表现、实验室检查、疾病、病人和药品;
a2)定义本体属性;所述本体属性包括对象属性和数据类型属性;
a3)根据所述药品不良反应领域本体的元素构成,得到关系数据库的实体-关系结构;
a4)根据所述关系数据库的实体-关系结构,将本体关系存入所述关系数据库中,得到实例数据存储数据库。
在本发明所述的基于领域本体知识库的药品不良反应智能监测方法中,所述步骤b)进一步包括:
b1)构建并更新基础资源库,执行步骤b2)或步骤b2');
b2)根据已有的结构化资源库建立药品不良反应相关的实体词库,将构建的所述实体词库作为分词器分词时所需调用的词典;
b3)解析已收集的adr历史报告库、药品说明书规则库和adr主动监测知识库,根据所述药品不良反应领域本体的结构,在所述adr历史报告库、药品说明书规则库和adr主动监测知识库中确定需要抽取并转化的与药品不良反应/药品不良反应事件相关的结构化信息及非结构化信息;
b4)从所述adr报告中采集非结构化文本信息,并将其转化为结构化信息,执行步骤b5);
b2')按照所述药品不良反应知识库的存储结构,通过直接映射的方式从所述adr历史报告库、药品说明书规则库和adr主动监测知识库中抽取结构化信息,执行步骤b5);
b5)将实例中的结构化信息与规整转化后的结构化信息进行合并,得到实例内容,等待信息的存储;
b6)将获取的所述实例内容写入所述关系数据库中与本体实例相关的表中,写入时同时计算实例知识权重。
在本发明所述的基于领域本体知识库的药品不良反应智能监测方法中,所述步骤b4)进一步包括:
b41)所述实体词库应用分词器对文本信息进行分词;
b42)根据所述实体词库对分词结果进行实体标注,在所述实体标注的过程中对不良反应定性的词语进行判断处理,并对否定词进行标注;
b43)对标注结果进行解析,并对出现否定词的无用信息进行过滤;
b44)将所述标注结果转换为结构化信息;所述结构化信息中至少包括存在于adr报告及药品说明书不良反应描述中相关的adr信息。
在本发明所述的基于领域本体知识库的药品不良反应智能监测方法中,所述步骤e)进一步包括:
e1)获取检索关键词;
e2)根据所述药品不良反应知识库的语义关系,将所述检索关键词映射为药品不良反应领域本体中的实例及其属性值;
e3)将所述检索关键词在所述药品不良反应知识库中进行查询扩展,得到本体语义扩展结果集;
e4)对所述本体语义扩展结果集中的实例集合按照实例知识权重由高至低的顺序进行排序;
e5)输出经过实例知识权重排序的查询扩展结果集;
e6)以所述查询扩展结果集为检索条件,应用所述搜索引擎工具对被检索的业务数据资源库进行匹配查询,得到最终检索结果集,并将其返回给用户,在所述最终检索结果集中按照实例知识权重的高低对检索出来的可疑adr病例列表进行排序。
在本发明所述的基于领域本体知识库的药品不良反应智能监测方法中,所述实体至少包括本体、类、属性、类实例、对象属性实例、数据属性实例、类关系、属性关系、实例关系和约束关系。
在本发明所述的基于领域本体知识库的药品不良反应智能监测方法中,所述对象属性至少包括引发、导致、治疗、缓解、表现、患有、服用、具有、检查、发生、无关、相关、关联、关注和体现。
在本发明所述的基于领域本体知识库的药品不良反应智能监测方法中,所述药品不良反应事件对应的数据类型属性包括事件名称、事件程度等级和发生时间;所述药品对应的数据类型属性包括批准文号、商品名、通用名、规格、剂型和生产厂家;所述疾病对应的数据类型属性包括疾病编码和疾病名称;所述临床表现对应的数据类型属性包括体征值、体征说明、体征数值符号、体征值计量单位、症状名称和症状所属系统;所述实验室检查对应的数据类型属性包括检验项所属系统、检验值上限、检验值下限、检验值计量单位和检验结果;所述病人对应的数据类型属性包括性别、年龄、是否妊娠、是否哺乳、肝功能不全级别、肾功能不全级别和体重指数。
在本发明所述的基于领域本体知识库的药品不良反应智能监测方法中,所述实例知识权重的计算公式如下:
weight(ii)=αweight(ii1)+βweight(ii2)+γweight(ii3);
其中,weight(ii)为第i个实例ii的权重,α、β和γ均为调节参数,且满足α+β+γ=1;weight(ii1)是根据实例ii的j项属性的权重weight(pij)计算出的实例的权重,weight(ii2)是根据实例ii出现的频数freq(ii)及当前新增实例总数n计算出的实例的权重,weight(ii3)表示实例ii中出现的对药品不良反应描述的程度关键词获取的权重,weight(ii3)来源于专家的评分。
在本发明所述的基于领域本体知识库的药品不良反应智能监测方法中,weight(ii1)的计算公式为:
其中,weight(pij)为实例ii的j项属性的权重,weight(pij)来源于专家的评分,λ是调节参数,为大于0的实数,kj为1或0,当属性值为空时,kj=0;当属性值不为空时,kj=1;
weight(ii2)的计算公式为:
其中,freq(ii)为实例ii在新增实例中出现的总次数,n为当前新增实例总数,θ是调节参数,为大于1的实数。
实施本发明的基于领域本体知识库的药品不良反应智能监测方法,具有以下有益效果:由于通过建立药品不良反应领域本体,将药品不良反应相关知识资源以及已上报adr报告整合成一个领域本体知识库,即药品不良反应知识库,然后应用该药品不良反应知识库能实现语义查询扩展,提高智能监测方法中搜索引擎工具检索结果的查全率与查准率。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明基于领域本体知识库的药品不良反应智能监测方法一个实施例中的流程图;
图2为所述实施例中基于领域本体知识库的药品不良反应智能监测方法的整体流程架构图;
图3为所述实施例中构建药品不良反应领域本体的具体流程图;
图4为所述实施例中本体类中部分类的结构示意图;
图5为所述实施例中实体-关系结构的结构示意图;
图6为所述实施例中药品不良反应反应领域本体在关系数据库中生成的表的示意图;
图7为所述实施例中采集药品不良反应领域本体的实例信息,建立药品不良反应知识库的具体流程图;
图8为所述实施例中从adr报告中采集非结构化文本信息,并将其转化为结构化信息的具体流程图;
图9为所述实施例中执行监测计划,按照监测计划中设置的条件定时自动、循环执行检索任务,调用搜索引擎工具,应用药品不良反应知识库,自动获取可疑病例的具体流程图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
在本发明基于领域本体知识库的药品不良反应智能监测方法实施例中,该基于领域本体知识库的药品不良反应智能监测方法的流程图如图1所示。图2为本实施例中基于领域本体知识库的药品不良反应智能监测方法的整体流程架构图。图1中,该基于领域本体知识库的药品不良反应智能监测方法包括如下步骤:
步骤s01构建药品不良反应领域本体:本步骤中,构建药品不良反应领域本体,关于具体如何进行构建,后续会进行详细描述。
步骤s02采集药品不良反应领域本体的实例信息,建立药品不良反应知识库:在构建药品不良反应领域本体时,药品不良反应领域本体中的主要信息来自于专家的经验,当药品不良反应领域本体中的概念、关系及属性等内容趋于稳定后,可在药品不良反应领域本体的结构基础上收集实例信息,建立可直接应用并能够不断优化的药品不良反应知识库,也就是本步骤中的采集药品不良反应领域本体的实例信息,建立药品不良反应知识库。
药品不良反应知识库中的数据主要来源于临床医学资源库(包括icd10、who-art、医学主题词库等)、adr历史报告库、药品说明书规则库、adr主动监测知识库等。在这些与药品不良反应相关的资源中,涉及了结构化及非结构化的数据,为了能够有效地收集实例信息构建药品不良反应知识库,本发明涉及知识库数据抽取的流程,后续会进行详细描述。
步骤s03制定主动监测计划,设置与监测计划相关的条件:本步骤中,制定主动监测计划,设置监测计划中监测范围、监测时间等与监测计划相关的条件。
步骤s04配置检索关键词:本步骤中,配置检索关键词,主要是指通过配置监测计划中的关注品种或不良反应事件,以此实现关注品种不良反应的监测或某类不良反应事件发生情况的监测。
步骤s05执行监测计划,按照监测计划中设置的条件定时自动、循环执行检索任务,调用搜索引擎工具,应用药品不良反应知识库,自动获取可疑病例:本步骤中,执行监测计划,在执行监测计划的过程中,按照监测计划中设置的条件定时自动、循环执行检索任务,调用搜索引擎工具(即智能检索工具),应用药品不良反应知识库,自动获取可疑病例。
步骤s06获取检索结果中的可疑adr病例,审核可疑病例,生成adr报告:本步骤中,获取检索结果中的可疑adr病例,医师/药师审核可疑病例,生成adr报告。通过步骤s03至步骤s06,可以实现药品不良反应智能监测,其主要是基于知识库应用搜索引擎建立主动监测计划,实现药品不良反应的智能检索与监测。
由于通过建立药品不良反应领域本体,将药品不良反应相关知识资源以及已上报adr报告整合成一个领域本体知识库,即药品不良反应知识库,然后应用该药品不良反应知识库能实现语义查询扩展,提高智能监测方法中搜索引擎工具检索结果的查全率与查准率。
对于本实施例而言,上述步骤s01还可进一步细化,其细化后的流程图如图3所示。图3中,该步骤s01进一步包括:
步骤s11定义本体类:本步骤中,定义本体类。根据药品不良反应领域本体的构建范围,可确定所构建的药品不良反应领域本体中包含的类(即本体类)至少包括药品不良反应事件、临床表现、实验室检查、疾病、病人和药品,构建的本体类中的部分类的结构示意图如图4所示。
步骤s12定义本体属性:本步骤中,定义本体属性,本体属性包括对象属性(objectproperties)和数据类型属性(dataproperties)。对确定的本体类进行分析可得药品不良反应领域本体中涉及的对象属性至少包括:引发、导致、治疗、缓解、表现、患有、服用、具有、检查、发生、无关、相关、关联、关注和体现。药品不良反应领域本体中涉及的数据类型属性如表1所示。
表1
从表1中可以看出,药品不良反应事件对应的数据类型属性包括事件名称、事件程度等级和发生时间;药品对应的数据类型属性包括批准文号、商品名、通用名、规格、剂型和生产厂家;疾病对应的数据类型属性包括疾病编码和疾病名称;临床表现对应的数据类型属性包括体征值、体征说明、体征数值符号、体征值计量单位、症状名称和症状所属系统;实验室检查对应的数据类型属性包括检验项所属系统、检验值上限、检验值下限、检验值计量单位和检验结果;所述病人对应的数据类型属性包括性别、年龄、是否妊娠、是否哺乳、肝功能不全级别、肾功能不全级别和体重指数。
步骤s13根据药品不良反应领域本体的元素构成,得到关系数据库的实体-关系结构:本步骤中,根据药品不良反应领域本体的元素构成,得到关系数据库的实体-关系结构,关系数据库的实体-关系结构的结构示意图如图5所示。关系数据库中主要包括的实体至少包括:本体(ontology)、类(class)、属性(property)、类实例(individual_class)、对象属性实例(individual_object_property)、数据属性实例(individual_data_property)、类关系(relation_class)、属性关系(relation_property)、实例关系(relation_individual)和约束关系(restriction_relation)。
步骤s14根据关系数据库的实体-关系结构,将本体关系存入关系数据库中,得到实例数据存储数据库:本步骤中,根据关系数据库的实体-关系结构,将本体关系存入关系数据库中,得到实例数据存储数据库,图6为本实施例中药品不良反应反应领域本体在关系数据库中生成的表的示意图。通过上述步骤s13至步骤s14,实现基于药品不良反应领域本体构建实例数据存储数据库。
对于本实施例而言,上述步骤s02还可以进一步细化,其细化后的流程图如图7所示。图7中,上述步骤s02进一步包括:
步骤s21构建并更新基础资源库:本步骤中,采集下载最新数据,完善基础资源库,保证基础资源库的最优状态。执行完本步骤,执行步骤s22或步骤s22'。
步骤s22根据已有的结构化资源库建立药品不良反应相关的实体词库,将构建的实体词库作为分词器分词时所需调用的词典:本步骤中,根据已有的国家药品批文库、icd10、医学主题词库、who-art、实验室检验等结构化资源库建立药品、症状、疾病、药品不良反应、检验项目等药品不良反应相关的实体词库,将构建的实体词库作为分词器分词时所需调用的词典。
步骤s23解析已收集的adr历史报告库、药品说明书规则库和adr主动监测知识库,根据药品不良反应领域本体的结构,在adr历史报告库、药品说明书规则库和adr主动监测知识库中确定需要抽取并转化的与药品不良反应/药品不良反应事件相关的结构化信息及非结构化信息:本步骤中,步骤s23解析已收集的adr历史报告库、药品说明书规则库和adr主动监测知识库,根据药品不良反应领域本体的结构,从adr历史报告库、药品说明书规则库和adr主动监测知识库中确定需要抽取并转化的与药品不良反应/药品不良反应事件相关的结构化信息及非结构化信息。
步骤s24从adr报告中采集非结构化文本信息,并将其转化为结构化信息:本步骤中,在adr报告中的不良反应过程描述及药品说明书中的不良反应中包含描述adr的文本信息,从adr报告中采集非结构化文本信息,并将其转化为结构化信息。执行完本步骤,执行步骤s25。
步骤s22'按照药品不良反应知识库的存储结构,通过直接映射的方式从adr历史报告库、药品说明书规则库和adr主动监测知识库中抽取结构化信息:本步骤中,采集结构化信息,直接通过数据库映射关联抽取数据,具体而言,就是按照药品不良反应知识库的存储结构,通过直接映射的方式从adr历史报告库、药品说明书规则库和adr主动监测知识库中抽取结构化信息。例如:在adr历史报告中可采集的结构化信息主要包括:药品不良反应名称、药品不良反应严重程度、病人基本信息(性别、年龄、体重等)、原患疾病(疾病名称、疾病编码等)、药品信息(药品通用名、批准文号、规格、生产厂家等),直接将这些信息按照药品不良反应知识库的存储结构进行映射抽取。执行完本步骤,执行步骤s25。
步骤s25将实例中的结构化信息与规整转化后的结构化信息进行合并,得到实例内容,等待信息的存储:本步骤中,将实例中的结构化信息与规整转化后的结构化信息进行合并,得到实例内容,等待信息的存储。
步骤s26将获取的实例内容写入关系数据库中与本体实例相关的表中,写入时同时计算实例知识权重:本步骤中,将获取的实例内容写入关系数据库individual_class、individual_object_property、individual_data_property及relation_individual等与本体实例相关的表中,写入时需计算写入后实例知识的权重,实例知识权重的计算公式如下:
weight(ii)=αweight(ii1)+βweight(ii2)+γweight(ii3);
其中,weight(ii)为第i个实例ii的权重,α、β和γ均为调节参数,且满足α+β+γ=1;weight(ii1)是根据实例ii的j项属性的权重weight(pij)计算出的实例的权重,weight(ii2)是根据实例ii出现的频数freq(ii)及当前新增实例总数n计算出的实例的权重,weight(ii3)表示实例ii中出现的对药品不良反应描述的程度关键词获取的权重,weight(ii3)来源于专家的评分。
weight(ii1)的计算公式为:
其中,weight(pij)为实例ii的j项属性的权重,weight(pij)来源于专家的评分,λ是调节参数,为大于0的实数,kj为1或0,当属性值为空时,kj=0;当属性值不为空时,kj=1;
weight(ii2)的计算公式为:
其中,freq(ii)为实例ii在新增实例中出现的总次数,n为当前新增实例总数,θ是调节参数,为大于1的实数。
对于本实施例而言,上述步骤s24还可进一步细化,其细化后的流程图如图8所示。图8中,上述步骤s24进一步包括:
步骤s241实体词库应用分词器对文本信息进行分词:本步骤中,步骤s22建立的实体词库应用分词器对文本信息进行分词。
步骤s242根据实体词库对分词结果进行实体标注,在实体标注的过程中对不良反应定性的词语进行判断处理,并对否定词进行标注:本步骤中,根据实体词库对分词结果进行实体标注,标注时还需对如常见、偶见、罕见、肯定、可能等对不良反应定性的词语进行判断处理,此外还需对可能出现的未见、无、未诉等否定词进行标注。
步骤s243对标注结果进行解析,并对出现否定词的无用信息进行过滤:本步骤中,对标注结果进行解析,并对出现否定词的无用信息进行过滤。
步骤s244将标注结果转换为结构化信息:本步骤中,将标注结果转换为结构化信息,该结构化信息中主要包括症状定性关键词、adr名称、adr所属系统、关注检验指标、检验指标定性关键词等存在于adr报告及药品说明书不良反应描述中相关的adr信息。
对于本实施例而言,上述步骤s05还可进一步细化,其细化后的流程图如图9所示。图9中,上述步骤s05进一步包括如下步骤:
步骤s51获取检索关键词:本步骤中,获取检索关键词。
步骤s52根据药品不良反应知识库的语义关系,将检索关键词映射为药品不良反应领域本体中的实例及其属性值:本步骤中,根据药品不良反应知识库的语义关系,将获取的检索关键词映射为药品不良反应领域本体中的实例及其属性值。
步骤s53将检索关键词在药品不良反应知识库中进行查询扩展,得到本体语义扩展结果集:本步骤中,将检索关键词在药品不良反应知识库中进行查询扩展,得到本体语义扩展结果集。
步骤s54对本体语义扩展结果集中的实例集合按照实例知识权重由高至低的顺序进行排序:本步骤中,对本体语义扩展结果集中的实例集合按照实例知识权重由高至低的顺序进行排序。
步骤s55输出经过实例知识权重排序的查询扩展结果集:本步骤中,输出经过实例知识权重排序的查询扩展结果集。
步骤s56以查询扩展结果集为检索条件,应用搜索引擎工具对被检索的业务数据资源库进行匹配查询,得到最终检索结果集,并将其返回给用户,在最终检索结果集中按照实例知识权重的高低对检索出来的可疑adr病例列表进行排序:本步骤中,以查询扩展结果集为检索条件,应用搜索引擎工具对被检索的业务数据资源库进行匹配查询,得到最终检索结果集,并将其返回给用户,在最终检索结果集中按照实例知识权重的高低对检索出来的可疑adr病例列表进行排序。
总之,本发明构建了药品不良反应领域本体,并通过对实例数据的采集,建立可应用于药品不良反应领域的药品不良反应知识库。本发明在基于lucene的全文搜索技术等相关搜索引擎工具基础上通过应用本体知识库,调用已有的知识实例,实现检索关键词的语义查询扩展,从而进一步提高智能搜索工具的查询率与查准率。通过基于智能监测方法建立的adr主动监测和专项监测计划,定期自动获取医院adr可疑病例,从而减少医院adr的漏报和迟报等问题。通过提高智能搜索工具的查全率与查准率,能够进一步提高医院药品不良反应事件的上报率,减轻上报人的工作负担,并提高其工作的积极性,对提升上市后药品安全性监测与评价能力、有效促进医疗机构合理用药、加强药品风险管理具有重要意义。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!