一种多层血管支架及其制备方法与流程
本发明属于医疗器材技术领域,具体涉及一种多层血管支架及其制备方法。
背景技术
聚合物类的血管支架多采用聚乳酸作为基体材料,但聚乳酸在血管内会促使血栓的形成;已有的大多数血管支架放置在血管内后,其支架上负载的药物涂层通常在1个月内释放完毕,血管内膜可能未能修复完全,并且在药物释放完毕后,支架处无药物,进一步的增加了血栓形成的几率。
现有技术中的抗血栓血管支架多是通过在支架上涂覆抗血栓药物,例如专利cn201320855841.1公开了一种防血栓的新型血管支架,该防血栓支架包括第一防血栓药物层和第二防血栓药物层,通过两层负载有防血栓药物的涂层来实现防血栓;但在该专利的血管支架还存在生物活性较低,可能导致支架在体内的发生异物反应,并且该支架的功能单一,不具备的修复血管功能。
技术实现要素:
本发明的目的在于:解决上述现有技术中的不足,提供一种多层血管支架以及制备该多层血管支架的方法。
为了实现上述目的,本发明采用的技术方案为:一种多层血管支架,包括支架本体,所述支架本体具有内管、外管和多个支撑条,内管套装于所述外管,支撑条径向设于所述内管的外壁,所述支撑条的一端有所述内管的外壁连接,所述支撑条的另一端与所述外管的内壁连接,所述内管的内壁涂覆有第一涂层,所述外管的外壁涂覆有第二涂层。
进一步的,多个所述支撑条成辐射状分布在所述内管的外表面。
进一步的,所述内管的壁厚为0.10-0.2mm,内管的内径为2.50-4.50mm,所述外管的壁厚为0.05-0.1mm,相邻所述支撑条之间的距离为0.10-0.50mm,所述支撑条的直径为0.01-0.1mm。
制备该多层血管支架的方法,包括以下步骤:
(a)支架本体:将聚乳酸加入到挤出机中,挤出管材,激光切割管材,得到内管,将内管放置在相应的模具中,将熔融状态下的形状记忆高分子加入到该模具中,冷却至室温,干燥,在内管的外壁制得支撑条;将负载有雷帕霉素的溶液涂覆在支撑条的外表面,干燥;在将内管放置在相应的模具中,将形状记忆高分子加入到该模具中,冷却至室温,干燥,在支撑条的远离内管的一端制得外管;
(b)第一涂层:将肝素类药物与氧化铝水溶凝胶混合均匀,超声喷涂在上述步骤(a)制得的支架本体的内管的内表面,20-25℃下干燥,制得第一涂层,再将氧化铝水溶凝胶涂覆第一涂层的表面,20-25℃下干燥,制得凝胶涂层;其中,第一涂层的厚度为1-3um,凝胶涂层的厚度为2-5um;
(c)第二涂层:将grgd-蛛丝蛋白、明胶和聚己内酯加入到容器中,搅拌均匀,向容器中加入依次加入甲酸和氯仿,搅拌均匀,得到电纺液,在上述步骤(a)中支架本体的外管的外表面静电纺丝1-2h,在支架本体的外表面形成5-10um的第二涂层。
进一步的,所述grgd-蛛丝蛋白、明胶和聚己内酯的重量份数比为0.1-0.5:1-10:1-10。
进一步的,所述肝素类药物为依诺肝素钠、那屈肝素钙或达肝素钠中的一种。
进一步的,所述氧化铝水溶凝胶的制备方法为:将异丙醇铝加入到20℃的水中,搅拌均匀,再加入氯仿溶液,将溶液体系加热到60-80℃,搅拌均匀,在60-80℃下静置,待液体分层后,提取无机相,将无机相超声搅拌1-3h,冷却至室温,得到所述氧化铝水凝胶。
进一步的,所述第一涂层中肝素类药物与氧化铝水溶凝胶的重量组份比为1:5-10。
进一步的,在所述步骤(c)中,静电纺丝的电压为5-20kv,静电纺丝的喷头与支架本体的距离为20-50cm,支架本体的转速为10-100rpm。
由于采用了上述技术方案,本发明的有益效果是:
本发明的多层血管支架由内管、外管以及支撑条组成,内管套装在外管内,支撑条在内管和外管之间,支撑条以及外管均为形状记忆高分子,在血管中可径向扩张,将血管撑开;支架在扩张时,没有轴向的回缩,减小了支架对血管的损坏。在内管的内壁涂覆第一涂层,该第一涂层中含有肝素类药物,在第一涂层外涂覆有氧化铝水溶凝胶层,肝素类药物可防止血栓形成;在支撑条上涂覆有雷帕霉素,雷帕霉素在血管中先释放,而肝素类药物由于有氧化铝水溶凝胶层的保护,较后释放,两种药物协同作用,延长支架的抗血栓时间,减少血栓的形成;在管的外壁涂覆有第二涂层,第二涂层为grgd-蛛丝蛋白、明胶和聚己内酯的涂层,可增加支架的生物活性,减少聚合物支架在体内的异物反应,同时表层材料有促进愈合的功效,能促进血管内膜的形成,从而达到修复血管的目的。
附图说明
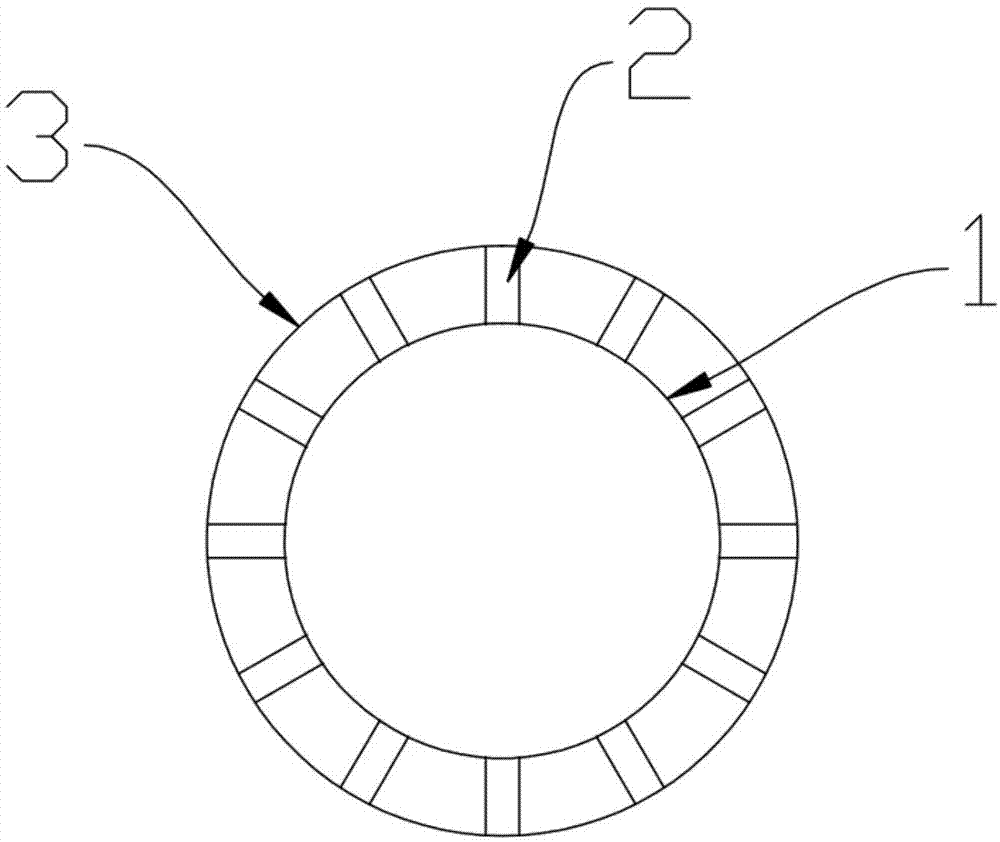
图1为本发明的支架的左视示意图
图2为本发明的支架的内管和支撑条的主视示意图
附图标记:1-内管,2-支撑条,3-外管。
具体实施方式
参照附图1-2,对本发明的实施方式做具体的说明。
实施例1:
(a)将分子量为90万da的聚乳酸加入到挤出机中,挤出壁厚为0.2mm的管材,激光切割管材,将管材的壁切割成网状结构,得到内管1,内管1的内径为4mm,将内管1放置制备支撑条2的模具中,将熔融状态下的形状记忆高分子加入到该模具中,冷却至室温,干燥,在内管1的外壁制得支撑条2,多个所述形支撑条2成辐射状分布在所述内管1的外表面,支撑条2的直径为0.05mm,相邻支撑条2之间的距离为0.5mm;随后将负载有雷帕霉素的溶液涂覆在支撑条2的外表面,干燥;再将内管1放置在制备外管3的模具中,将形状记忆高分子加入到该模具中,冷却至室温,干燥,在支撑条2的远离内管1的一端制得外管3,外管3的壁厚为0.05mm,此时,外管3的外径为7mm;支撑条2的两端分别与内管1和外管3连接,形成一个整体。
(b)第一涂层:将1份依诺肝素钠与5份氧化铝水溶凝胶混合均匀,超声喷涂在上述步骤(a)制得的支架本体的内管1的内表面,25℃下干燥,制得第一涂层,再将氧化铝水溶凝胶涂覆第一涂层的表面,25℃下干燥,制得凝胶涂层;其中,第一涂层的厚度为3um,凝胶涂层的厚度为2um;
(c)第二涂层:将0.1份grgd-蛛丝蛋白、1份明胶和1份聚己内酯加入到容器中,搅拌均匀,向容器中加入依次加入甲酸和氯仿,搅拌均匀,得到电纺液,在上述步骤(a)中支架本体的外管3的外表面静电纺丝2h,在支架本体的外表面形成2um的第二涂层。其中,静电纺丝的工作电压为5kv,喷头与支架本体的距离为20cm,支架本体的转速为50rpm。将制备好的支架压缩在输送管内,压缩后的支架的外管3的外径为2mm。
在本实施例中,制备氧化铝水溶凝胶的方法为:将异丙醇铝加入到20℃的水中,搅拌均匀,再加入氯仿溶液,将溶液体系加热到60℃,搅拌均匀,在60℃下静置,待液体分层后,提取无机相,将无机相超声搅拌3h,冷却至室温,得到所述氧化铝水凝胶。
本实施例制备的支架具有内管1、外管3和多个支撑条2,内管1套装于所述外管3,多个支撑条2径向设于所述内管1的外壁,多个支撑条2呈辐射状分布,内管1的壁为镂空的网状架构,所述支撑条2的一端有所述内管1的外壁连接,所述支撑条2的另一端与所述外管3的内壁连接,所述内管1的内壁涂覆有第一涂层,所述外管3的外壁涂覆有第二涂层。
实施例2:
(a)将分子量为100万da的聚乳酸加入到挤出机中,挤出壁厚为0.2mm的管材,激光切割管材,得到内管1,内管1的内径为4mm,将内管1放置制备支撑条2的模具中,将熔融状态下的形状记忆高分子加入到该模具中,冷却至室温,干燥,在内管1的外壁制得支撑条2,多个所述形支撑条2成辐射状分布在所述内管1的外表面,支撑条2的直径为0.01mm,相邻支撑条2之间的距离为0.4mm;随后将负载有雷帕霉素的溶液涂覆在支撑条2的外表面,干燥;再将内管1放置在制备外管3的模具中,将形状记忆高分子加入到该模具中,冷却至室温,干燥,在支撑条2的远离内管1的一端制得外管3,外管3的壁厚为0.1mm;外管3的外径为7mm,支撑条2的两端分别与内管1和外管3连接,形成一个整体。
(b)第一涂层:将1份那屈肝素钙与8份氧化铝水溶凝胶混合均匀,超声喷涂在上述步骤(a)制得的支架本体的内管1的内表面,20℃下干燥,制得第一涂层,再将氧化铝水溶凝胶涂覆第一涂层的表面,20℃下干燥,制得凝胶涂层;其中,第一涂层的厚度为2um,凝胶涂层的厚度为5um;
(c)第二涂层:将0.3份grgd-蛛丝蛋白、3份明胶和5份聚己内酯加入到容器中,搅拌均匀,向容器中加入依次加入甲酸和氯仿,搅拌均匀,得到电纺液,在上述步骤(a)中支架本体的外管3的外表面静电纺丝2h,在支架本体的外表面形成2um的第二涂层。其中,静电纺丝的工作电压为10kv,喷头与支架本体的距离为30cm,支架本体的转速为10rpm。
实施例3:
(a)将分子量为90万da的聚乳酸加入到挤出机中,挤出壁厚为0.1mm的管材,激光切割管材,得到内管1,内管1的内径为3mm,将内管1放置制备支撑条2的模具中,将熔融状态下的形状记忆高分子加入到该模具中,冷却至室温,干燥,在内管1的外壁制得支撑条2,多个所述形支撑条2成辐射状分布在所述内管1的外表面,支撑条2的直径为0.1mm,相邻支撑条2之间的距离为0.5mm;随后将负载有雷帕霉素的溶液涂覆在支撑条2的外表面,干燥;再将内管1放置在制备外管3的模具中,将形状记忆高分子加入到该模具中,冷却至室温,干燥,在支撑条2的远离内管1的一端制得外管3,外管3的壁厚为0.1mm;支撑条2的两端分别与内管1和外管3连接,形成一个整体。
(b)第一涂层:将1份达肝素钠与10份氧化铝水溶凝胶混合均匀,超声喷涂在上述步骤(a)制得的支架本体的内管1的内表面,23℃下干燥,制得第一涂层,再将氧化铝水溶凝胶涂覆第一涂层的表面,23℃下干燥,制得凝胶涂层;其中,第一涂层的厚度为1um,凝胶涂层的厚度为3um;
(c)第二涂层:将0.5份grgd-蛛丝蛋白、10份明胶和5份聚己内酯加入到容器中,搅拌均匀,向容器中加入依次加入甲酸和氯仿,搅拌均匀,得到电纺液,在上述步骤(a)中支架本体的外管3的外表面静电纺丝2h,在支架本体的外表面形成6um的第二涂层。其中,静电纺丝的工作电压为20kv,喷头与支架本体的距离为50cm,支架本体的转速为100rpm。
实施例4:
(a)将分子量为120万da的聚乳酸加入到挤出机中,挤出壁厚为0.2mm的管材,激光切割管材,得到内管1,将内管1放置制备支撑条2的模具中,将熔融状态下的形状记忆高分子加入到该模具中,冷却至室温,干燥,在内管1的外壁制得支撑条2,多个所述形支撑条2成辐射状分布在所述内管1的外表面,支撑条2的直径为0.05mm,相邻支撑条2之间的距离为0.5mm;随后将负载有雷帕霉素的溶液涂覆在支撑条2的外表面,干燥;再将内管1放置在制备外管3的模具中,将形状记忆高分子加入到该模具中,冷却至室温,干燥,在支撑条2的远离内管1的一端制得外管3,外管3的壁厚为0.05mm;支撑条2的两端分别与内管1和外管3连接,形成一个整体。
(b)第一涂层:将1份依诺肝素钠与10份氧化铝水溶凝胶混合均匀,超声喷涂在上述步骤(a)制得的支架本体的内管1的内表面,25℃下干燥,制得第一涂层,再将氧化铝水溶凝胶涂覆第一涂层的表面,25℃下干燥,制得凝胶涂层;其中,第一涂层的厚度为1um,凝胶涂层的厚度为5um;
(c)第二涂层:将0.5份grgd-蛛丝蛋白、3份明胶和10份聚己内酯加入到容器中,搅拌均匀,向容器中加入依次加入甲酸和氯仿,搅拌均匀,得到电纺液,在上述步骤(a)中支架本体的外管3的外表面静电纺丝2h,在支架本体的外表面形成5um的第二涂层。其中,静电纺丝的工作电压为20kv,喷头与支架本体的距离为20cm,支架本体的转速为10rpm。
在本实施例中,制备氧化铝水溶凝胶的方法为:将异丙醇铝加入到20℃的水中,搅拌均匀,再加入氯仿溶液,将溶液体系加热到80℃,搅拌均匀,在80℃下静置,待液体分层后,提取无机相,将无机相超声搅拌3h,冷却至室温,得到所述氧化铝水凝胶。
对比试验例1:该对比试验例与上述实施例1的不同之处在于,在内管1的内壁和支撑条2上均未涂覆药物,其余的与实施例1相同。
对比试验例2:该对比试验例与实施例1的不同之处在于,在内管1的内壁上未涂覆药物,其余与实施例1相同。
对比试验例3:与实施例2的不同之处在于,在外管3的外壁未涂覆第二涂层,其余的与实施2相同。
对上述实施例1-4以及对比试验例1-2的血管支架进行抗血栓性检查:取新鲜血液,在血液中加入少量抗凝剂,将该血液滴加在支架,使血液能沿内管1壁以及内光和外管3支架顺利延流,重复滴15次,观察支架表面,其结果如表1所示:
表1
从表1中可以得出,实施例1-4的血管支架的抗血栓性好,在支架的上没有血液和蛋白的沉积。
将上述实施例1-4以及对比试验例1-3的血管支架植入到正常兔子的血管内,分别在植入后的不同时间内造影观察支架处血管的最小径,以及支架降解情况、血栓形成情况和炎症反应,其结果表明,实施例1-4的支架在1年后开始降解,在这1年的时间内,均无血栓和严重的炎症反应出现,说明实施例1-4的支架的抗血栓性能和生物相容性较好;对比试验例1的支架在植入后1个月,开始出现血栓,在第3个月时,支架处的血管已经完全堵塞。对实验例2的支架植入后的第2.5个月时,开始出现血栓,在第5个月时,血管已经完全堵塞,血液不能顺利流过。对比试验例3的支架在第8个月时,出现严重的炎症反应,在第10个月时,出现了少量的血栓。比较实施例1、对比试验例1和对比试验例2,可以得出,本发明的支架在具有较好的生物相容性,支架在血管中不易发生炎症反应,同时,支架上的雷帕霉素最先释放,第一涂层中的肝素类药物较后释放,延长了抗血栓药物的释放时间,减小血栓。比较实施例2、对比试验例3,可以得出,发明的支架的生物相容相好,不易产生炎症反应。
- 还没有人留言评论。精彩留言会获得点赞!