PD-1抗体和MEK抑制剂联合在制备治疗肿瘤的药物中的用途的制作方法
pd-1抗体或其抗原结合片段和mek抑制剂联合在制备治疗肿瘤的药物中的用途。
背景技术:
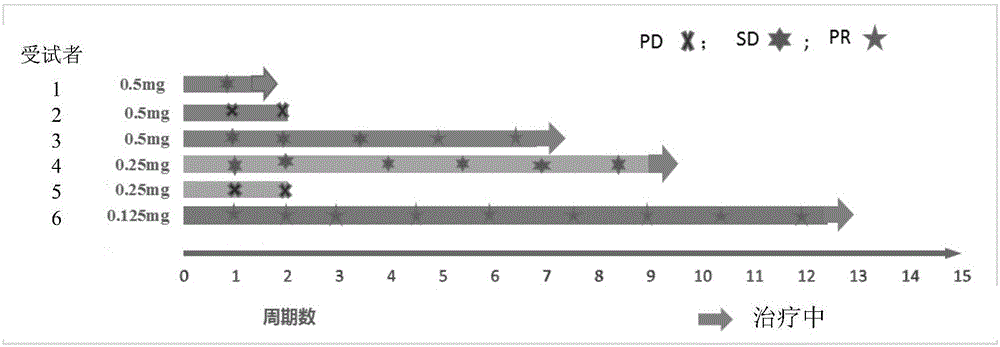
:恶性肿瘤的发生和发展与细胞内信号传导通路的异常持续激活密切相关。mapk(mitogen-activatedproteinkinase,有丝分裂员活化的蛋白激酶)组成的信号通路控制着细胞的多个重要生理过程,其中erk通路(extracellularregulatedproteinkinasepathway,ras-raf-mek1/2-erk1/2,胞外调节蛋白激酶)是人类肿瘤中最常发生的级联信号异常的经典mapk通路。erk通路的异常激活通常是由ras(ratsarcomagene,大鼠肉瘤蛋白同源基因)和raf(rapidlyacceleratedfibrosarcoma,迅速型加速纤维肉瘤激酶)基因家族成员的获得性突变导致([j].biochimicaetbiophysicaacta(bba)-molecularcellresearch,2007,1773(8):1263-1284.)。其中胆管癌、大肠癌、肺癌、膀胱癌、胰腺癌和前列腺癌均存在ras编码基因,而黑色素瘤、乳头状甲状腺癌和低分化卵巢癌存在braf基因突变。braf及其下游靶标mek是mapk通路中的激酶,在细胞增殖中起重要作用([j].drugdesign,developmentandtherapy,2016,10:43.)。而pd-1(程序性死亡受体1)抗体可以特异性识别并结合淋巴细胞表面pd-1,阻断pd-1/pd-l1信号通路,进而激活t细胞对肿瘤的免疫杀伤作用,调动机体免疫系统而清除体内肿瘤细胞。随着pd-1/pd-l1免疫治疗研究的逐步深入,发现很多患者对免疫检查点治疗不敏感或随之耐药,xiabu等人的荟萃分析研究表明,以pd-1/pd-l1为靶点的免疫治疗耐药可能与某些基因的上调有关,下列该类耐药标记物如il-10、vegfa、vegfc、flt1、angpt2以及单核细胞和巨噬细胞驱化因子([j].trendsinmolecularmedicine,2016,22(6):448-451.)参与免疫表达。mek蛋白激酶是正常t细胞和ras信号通路突变肿瘤的重要调控靶点之一,抑制mek可阻断小鼠幼稚t细胞的增殖,且通过损伤tcr驱动的细胞凋亡增强之前活化的t细胞的抗肿瘤活性,因此mek抑制剂和以pd-1/pd-l1靶点的抗体联用可产生持久的肿瘤抑制效果([j].immunity,2016,44(3):609-621.)。wo2016040892公开了选自pembrolizumab等的pd-1抗体和mek抑制剂联用治疗多种肿瘤;wo2016011160公开了选自nivolumab、pembrolizumab等的pd-1抗体和mek抑制剂联用治疗多种b-raf拮抗剂耐受性肿瘤;wo2014195852及wo2014193898公开了trametinib或dabrafenib联合与pd-l1抗体或pd-1抗体联用治疗b-rafv600突变型黑色素瘤;wo2013019906公开了多种pd-1抗体与多种mek抑制剂联合治疗b-rafv600e突变型肿瘤。目前已有多项pd-1或pd-l1联合mek抑制剂用于治疗肿瘤的临床研究正在开展中。wilsonh.miller等人公开atezolizumab(pd-l1)联合cobimetinib治疗转移性黑色素瘤的临床研究显示,二者联用与二者单独使用相比具有更高的dcr(疾病控制率)和中位无进展生存期(mpfs)(atezolizumab(a)+cobimetinib(c)inmetastaticmelanoma(mel):updatedsafetyandclinicalactivity[j].2017.);michellerohlfs等人报道braf抑制剂+/-mek抑制剂并联合pd-1免疫检查点阻断剂(pembrolizumab或nivolumab)治疗转移性黑素瘤的临床研究结果,显示入组患者mpfs为7.6个月,其中braf抑制剂+mek抑制剂+pd-1免疫检查点阻断剂组为8.5个月,braf抑制剂+pd-1免疫检查点阻断剂组为7.2个月,受试者耐受良好(brafwithorwithoutmekinhibitionpluspd-1checkpointblockadeforthetreatmentofmetastaticmelanoma[j].2016.);antoniribas等人报道pembrolizumab联合dabrafenib和trametinib治疗brafv600e/k突变的晚期黑色素瘤的临床研究结果,显示可评价的15名受试者中的orr(总缓解率)为60%,但3名受试者发生中性粒细胞减少等严重不良反应(pembrolizumabincombinationwithdabrafenibandtrametinibforbraf-mutantadvancedmelanoma:phase1keynote-022study[j].2016)。综上所述,虽然目前关于pd-1抗体与mek抑制剂的研究已有报道,但多以braf抑制剂联合mek抑制剂和pd-l1抗体为主,且受试者临床获益及安全性未达到令人满意的效果,因此治疗领域仍需要进一步探索合适的pd-1抗体与mek抑制剂联用治疗复发难治性肿瘤。本发明提供的抗pd-1抗体,wo201508584公开了该抗体的序列和制备方法,目前pd-1抗体正处于国内临床i期,安全性良好,已报到的临床研究结果已经显示出其具有一定的抗肿瘤作用([j].journalofclinicaloncology35(2017):e15572-e15572);另外本发明提供的mek抑制剂,wo2015058589公开了其结构和制备方法,体外研究显示具有较好的肿瘤抑制活性,具体结构如下所示:技术实现要素:本发明提供一种免疫治疗剂和mek抑制剂联合在制备治疗肿瘤的药物中的用途,所述免疫治疗剂选自pd-1抗体或其抗原结合片段;所述mek抑制剂选自azd-8330、gdc-0623、ci-1040、wx-554、tak-733、hl-085、bi-847325、cep-1347、binimetinib、pimasertib、cobimetinib、pd-0325901、ro-5126766、trametinib、refametinib、as-703988、e-6201、selumetinib、或如下所示的化合物(1)或其可药用盐,本发明优选的实施例方案中,所述mek抑制剂优选自binimetinib、pimasertib、cobimetinib、trametinib、refametinib、化合物(1)或其可药用盐。pd-1抗体或其抗原结合片段是已知的,优选所述的pd-1抗体或其抗原结合片段的轻链可变区包含分别如seqidno:4、seqidno:5和seqidno:6所示的lcdr1、lcdr2和lcdr3。所述的pd-1抗体或其抗原结合片段的重链可变区包含分别如seqidno:1、seqidno:2和seqidno:3所示的hcdr1、hcdr2和hcdr3。其中,前面所述的各cdr序列如下表所示:名称序列编号hcdr1symmsseqidno:1hcdr2tisgggantyypdsvkgseqidno:2hcdr3qlyyfdyseqidno:3lcdr1lasqtigtwltseqidno:4lcdr2tatsladseqidno:5lcdr3qqvysipwtseqidno:6优选的,所述的pd-1抗体或其抗原结合片段为pd-1人源化抗体。优选的,人源化抗体轻链可变区序列为如seqidno:10所示的序列或其变体;所述的变体优选在轻链可变区有0-10的氨基酸变化;更优选为a43s的氨基酸变化。所述人源化抗体重链可变区序列为如seqidno:9所示的序列或其变体;所述变体优选在重链可变区有0-10的氨基酸变化;更优选为g44r的氨基酸变化。前述的人源化抗体重、轻链的可变区序列如下所示:重链可变区evqlvesggglvqpggslrlscaasgftfssymmswvrqapgkglewvatisgggantyypdsvkgrftisrdnaknslylqmnslraedtavyycarqlyyfdywgqgttvtvssseqidno:9轻链可变区diqmtqspsslsasvgdrvtitclasqtigtwltwyqqkpgkapklliytatsladgvpsrfsgsgsgtdftltisslqpedfatyycqqvysipwtfgggtkveikseqidno:10优选的,人源化抗体轻链序列为如seqidno:8所示的序列或其变体;所述的变体优选在轻链可变区有0-10的氨基酸变化;更优选为a43s的氨基酸变化。所述人源化抗体重链序列为如seqidno:7所示的序列或其变体;所述变体优选在重链可变区有0-10的氨基酸变化;更优选为g44r的氨基酸变化。特别优选的所述的pd-1人源化抗体轻链序列为如seqidno:8所示的序列,重链序列为如seqidno:7所示的序列。前述的pd-1人源化抗体重、轻链的序列如下所示:重链evqlvesggglvqpggslrlscaasgftfssymmswvrqapgkglewvatisgggantyypdsvkgrftisrdnaknslylqmnslraedtavyycarqlyyfdywgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkseqidno:7轻链diqmtqspsslsasvgdrvtitclasqtigtwltwyqqkpgkapklliytatsladgvpsrfsgsgsgtdftltisslqpedfatyycqqvysipwtfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgecseqidno:8本发明优选的实施例方案中,在本发明优选的实施例方案中,所述肿瘤选自恶性肿瘤、良性肿瘤;所述恶性肿瘤选自恶性上皮肿瘤、肉瘤、骨髓瘤、白血病、淋巴瘤、黑色素瘤、头颈部肿瘤、脑部肿瘤、腹膜癌、混合型肿瘤、儿童恶性肿瘤;所述恶性上皮肿瘤选自肺癌、乳腺癌、肝癌、胰腺癌、结直肠癌、胃癌、胃食管腺癌、食管癌、小肠癌、贲门癌、子宫内膜癌、卵巢癌、输卵管癌、外阴癌、睾丸癌、前列腺癌、阴茎癌、肾癌、膀胱癌、肛门癌、胆囊癌、胆管癌、畸胎瘤、心脏肿瘤;所述头颈部肿瘤选自鼻咽癌、喉癌、甲状腺癌、舌癌、口腔癌;所述肉瘤选自askin瘤、软骨肉瘤、尤文氏肉瘤、恶性血管内皮瘤、恶性神经鞘瘤、骨肉瘤、软组织肉瘤;所述骨髓瘤选自孤立型骨髓瘤、多发型骨髓瘤、弥漫型骨髓瘤、白血病型骨髓瘤、髓外型骨髓瘤;所述白血病选自急性淋巴性白血病、慢性淋巴性白血病、急性骨髓性白血病、慢性骨髓性白血病、多毛细胞性白血病、t细胞淋巴细胞白血病、大颗粒淋巴细胞性白血病、成人t细胞白血病;所述淋巴瘤选自非霍奇金淋巴瘤、霍奇金淋巴瘤;所述脑部肿瘤选自神经上皮组织肿瘤、颅神经和脊髓神经肿瘤、脑膜组织肿瘤;所述儿童恶性肿瘤选自肾母细胞瘤、神经母细胞瘤、视网膜母细胞瘤、儿童生殖细胞肿瘤。在本发明另外一个优选的实施例方案中,所述肺癌选自所述肺癌选自非小细胞肺癌、小细胞肺癌;所述乳腺癌选自所述乳腺癌选自激素受体(hr)阳性乳腺癌、人表皮生长因子受体-2(her2)阳性乳腺癌、三阴乳腺癌;所述肾癌选自透明肾细胞癌、乳头状肾细胞癌、嫌色细胞性肾细胞癌、集合管癌;所述神经上皮组织肿瘤选自优选星形细胞瘤、间变性星形细胞瘤、胶质母细胞瘤;所述肝癌选自原发性肝癌、继发性肝癌,所述原发性肝癌选自肝细胞癌、胆管细胞癌、混合性肝癌;所述结直肠癌选自结肠癌、直肠癌。在本发明另外一个优选的实施例方案中,所述肿瘤选自霍奇金淋巴瘤、非霍奇金淋巴瘤、前列腺癌、胰腺癌、肺癌、食管癌、肝癌、胆管癌、乳腺癌、结直肠癌、胃癌、肾癌、急性髓性淋巴细胞白血病、骨髓增生异常综合征、胶质瘤、原发部位不明的肿瘤。在本发明优选的实施例方案中,所述肿瘤由pd-1介导和/或表达pd-l1。在本发明优选的实施例方案中,所述肿瘤选自ras突变型肿瘤、raf突变型肿瘤、ras/raf/mek通路异常型肿瘤、ras/raf通路异常型肿瘤。在本发明优选的实施例方案中,所述ras突变型选自hras突变型、kras突变型、nras突变型;所述raf突变型选自a-raf突变型、b-raf突变型。其中b-raf突变型优选自b-rafv600e突变型、b-rafv600k突变型、b-rafv600d突变型、b-rafv600r突变型。在本发明中,上述突变为阳性突变。在本发明优选的实施例方案中,所述肿瘤选自中晚期肿瘤、复发难治性肿瘤、经化疗药物治疗失败和/或复发肿瘤、经放疗失败和/或复发肿瘤、经靶向药物治疗失败和/或复发肿瘤、经免疫治疗失败和/或复发肿瘤。在本发明优选的实施例方案中,所述肿瘤对免疫治疗剂或免疫疗法或表现为抵抗或耐药,优选的,所述免疫治疗剂是以pd-1和/或pd-l1或ctla-4(细胞毒性t淋巴细胞相关蛋白4)为靶点;所述免疫疗法选自免疫检查点阻断(icb)疗法、嵌合抗原受体t细胞免疫疗法(car-t疗法)、自体细胞免疫疗法(cik疗法)。在本发明优选的实施例方案中,优选的,所述免疫治疗剂选自pd-1抗体、pd-l1抗体、ctla-4抗体,所述pd-1抗体包括但不限于pidilizumab、medi-0680、amp-224、pf-06801591、tsr-042、js-001、gls-010、pdr-001、genolimzumab、camrelizumab、bgb-a317、ibi-308、regn-2810、pembrolizumab、nivolumab;所述pd-l1抗体包括但不限于msb-0011359-c、ca-170、ly-3300054、bms-936559、durvalumab、avelumab、atezolizumab;所述ctla-4抗体包括但不限于ipilimumab、ak-104、jhl-1155、ator-1015、agen-1884、prs-010、tremelimumab、ibi-310、mk-1308、bms-986218、sn-ca21、fpt-155、kn-044、cg-0161、onc-392、agen-2041、pbi-5d3h5。本发明优选的实施例方案中,所述的pd-1抗体或其抗原结合片段剂量选自1-10mg/kg,优选自1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg,更优选1mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、10mg/kg。本发明优选的实施例方案中,所述的pd-1抗体或其抗原结合片段剂量选自50-600mg,优选自50mg、60mg、70mg、75mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、375mg、400mg、425mg、450mg、475mg、500mg、600mg,更优选自60mg、100mg、200mg、400mg、600mg。本发明优选的实施例方案中,所述mek抑制剂剂量选自0.01-500mg,优选自0.1mg、0.25mg、0.5mg、0.75mg、1mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、12.5mg、15mg、17.5mg、20mg、22.5mg、25mg、30mg、45mg、50mg、60mg、70mg、75mg、80mg、90mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、400mg、500mg,更优选0.25mg、0.5mg、1mg、2mg、3mg、4mg、10mg、15mg、20mg、30mg、45mg、50mg、60mg、75mg、100mg。本发明优选的实施例方案中,所述mek抑制剂选自化合物(1)或其可药用盐,其剂量选自0.01-500mg,优选自0.1mg、0.25mg、0.5mg、0.75mg、1mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、12.5mg、15mg、17.5mg、20mg、22.5mg、25mg、30mg。本发明优选的实施例方案中,所述化合物(1)的可药用盐选自对甲苯磺酸盐。在本发明中,pd-1抗体或其抗原结合片段与mek抑制剂联合用于肿瘤治疗,二者的给药次序为mek抑制剂给药在pd-1抗体或其抗原结合片段给药之前,或二者同时给药,或mek抑制剂给药在pd-1抗体或其抗原结合片段给药之后;优选的,mek抑制剂给药在pd-1抗体或其抗原结合片段给药之前。在本发明中,pd-1抗体或其抗原结合片段与mek抑制剂联合用于肿瘤治疗,二者可在同一个给药周期给药。在本发明中,所述治疗周期可为1天、3天、1周、2周、3周(21天)、3-4周(21-28天)、4周(28天),优选3周或3-4周或4周。在本发明中,所述治疗周期包括但不限于化疗周期或放疗周期或其他相关靶向药物治疗周期或免疫治疗周期。在本发明中,mek抑制剂与pd-1抗体或其抗原结合片段可在在相同或不同的治疗周期内联合用于治疗肿瘤,在治疗肿瘤的过程中,mek抑制剂与pd-1抗体或其抗原结合片段联合给药的同时或之前或之后还可联合依据不同肿瘤优选的化疗方案或放疗治疗方案或靶向小分子药物治疗方案或免疫治疗方案治疗肿瘤,所述免疫治疗方案包括但不限于细胞免疫疗法(如car-t疗法,肿瘤疫苗、cik疗法等);此外mek抑制剂和pd-1抗体或其抗原结合片段的联合给药也可不联合其他治疗方案单独进行。在本发明中,pd-1抗体或其抗原结合片段与mek抑制剂在联用的同时,或之前、或之后可进行按照各种肿瘤诊疗规范或指导原则所推荐的不同病理分型和进展阶段肿瘤的治疗方案,所述的肿瘤诊疗规范或指导原则包括但不限于nccn(美国国立综合癌症网络发布各种恶性肿瘤临床实践指南)或中国卫生部颁布的恶性肿瘤诊疗规范。在本发明中,pd-1抗体或其抗原结合片段与mek抑制剂在相同的治疗周期内(如28天为一个治疗周期)联合用于治疗肿瘤,mek抑制剂与pd-1抗体或其抗原结合片段同步给药或在pd-1抗体或其抗原结合片段之前或在pd-1抗体或其抗原结合片段之后给药;在相同的给药周期内,mek抑制剂在一个连续的时间段内给药,优选1-21天连续给药、1-28天连续给药,所述连续的时间段可在一个治疗周期的任意一个时间点开始,优选治疗周期开始时;相同的给药周期内,pd-1抗体或其抗原结合片段给药频率可为2周/次、3周/次或4周/次,也可以在一个治疗周期的第1天和第15天给药。本发明关于“联合”是一种给药方式,是指在一定时间期限内给予至少一种剂量的pd-1抗体或其抗原结合片段和至少一种剂量的mek抑制剂,其中两种物质都显示药理学作用。所述的时间期限可以是一个给药周期内,优选4周内,3周内,2周内,1周内,或24小时以内,更优选12小时以内。可以同时或依次给予pd-1抗体或其抗原结合片段和mek抑制剂。这种期限包括这样的治疗,其中通过相同给药途径或不同给药途径给予pd-1抗体或其抗原结合片段和mek抑制剂。本发明所述联合的给药方式选自同时给药、独立地配制并共给药或独立地配制并相继给药。在本发明中,本发明进一步涉及的药物中的用途,其中所述pd-1抗体或其抗原结合片段的给药频次为一日一次、一日二次、一日三次、一周一次、二周一次、三周一次、一月一次,所述mek抑制剂的给药频次为一日一次、一日二次、一日三次、一周一次、二周一次、三周一次、一月一次。在特别优选的实施方案中,所述pd-1抗体或其抗原结合片段的给药频次为二周一次,所述mek抑制剂的给药频次为一日一次。在本发明优选的实施方案中,所述的pd-1抗体或其抗原结合片段以注射的方式给药,例如皮下或静脉注射,注射前需将pd-1抗体或其抗原结合片段配制成可注射的形式。特别优选的pd-1抗体或其抗原结合片段的可注射形式是注射液或冻干粉针,其包含pd-1抗体或其抗原结合片段、缓冲剂、稳定剂,任选地还含有表面活性剂。缓冲剂可选自醋酸盐、柠檬酸盐、琥珀酸盐、以及磷酸盐中的一种或几种。稳定剂可选自糖或氨基酸,优选二糖,例如蔗糖、乳糖、海藻糖、麦芽糖。表面活性剂选自聚氧乙烯氢化蓖麻油、甘油脂肪酸酯、聚氧乙烯山梨醇酐脂肪酸酯,优选所述聚氧乙烯山梨醇酐脂肪酸酯为聚山梨酯20、40、60或80,最优选聚山梨酯20。最为优选的pd-1抗体或其抗原结合片段的可注射形式包含pd-1抗体或其抗原结合片段、醋酸盐缓冲剂、海藻糖和聚山梨酯20。本发明所述联合的给药方式选自同时给药、独立地配制并共给药或独立地配制并相继给药。本发明所述联合的给药途径选自经口给药、胃肠外给药、经皮给药,所述胃肠外给药包括但不限于静脉注射、皮下注射、肌肉注射。本发明提供上述免疫治疗剂联合上述mek抑制剂作为治疗肿瘤的药物,其中所述免疫治疗剂选自pd-1抗体或其抗原结合片段。在本发明中,提供了一种治疗的办法,包括向患者施用上述免疫治疗剂和上述mek抑制剂,其中所述免疫治疗剂选自pd-1抗体或其抗原结合片段。本发明还提供了一种药物套组,或者一种药物包装盒,其中含有前述的mek抑制剂和pd-1抗体或其抗原结合片段。本发明还提供了一种药物组合物,包含前述的有效量的pd-1抗体或其抗原结合片段和mek抑制剂,以及一种或多种可药用的赋型剂、稀释剂或载体。附图说明图1.各受试者的治疗评估情况发明详述一、术语为了更容易理解本发明,以下具体定义了某些技术和科学术语。除显而易见在本文件中的它处另有明确定义,否则本文使用的所有其它技术和科学术语都具有本发明所属领域的一般技术人员通常理解的含义。术语“人源化抗体(humanizedantibody)”,也称为cdr移植抗体(cdr-graftedantibody),是指将小鼠的cdr序列移植到人的抗体可变区框架,即不同类型的人种系抗体构架序列中产生的抗体。可以克服嵌合抗体由于携带大量小鼠蛋白成分,从而诱导的强烈的抗体可变抗体反应。此类构架序列可以从包括种系抗体基因序列的公共dna数据库或公开的参考文献获得。如人重链和轻链可变区基因的种系dna序列可以在“vbase”人种系序列数据库(在因特网www.mrccpe.com.ac.uk/vbase可获得),以及在kabat,e.a.等人,1991sequencesofproteinsofimmunologicalinterest,第5版中找到。在本发明一个优选的实施方案中,所述的pd-1人源化抗体小鼠的cdr序列选自seqidno:1,2,3,4,5,6。术语“抗原结合片段”,指具有抗原结合活性的fab片段,fab‘片段,f(ab’)2片段,以及与人pd-1结合的fv片段sfv片段;包含本发明所述抗体的选自seqidno:1至seqidno:6中的一个或多个cdr区。fv片段含有抗体重链可变区和轻链可变区,但没有恒定区,并具有全部抗原结合位点的最小抗体片段。一般地,fv抗体还包含在vh和vl结构域之间的多肽接头,且能够形成抗原结合所需的结构。也可以用不同的连接物将两个抗体可变区连接成一条多肽链,称为单链抗体(singlechainantibody)或单链fv(sfv)。本发明的术语“与pd-1结合”,指能与人pd-1相互作用。本发明的术语“抗原结合位点”指抗原上不连续的,由本发明抗体或抗原结合片段识别的三维空间位点。术语“免疫疗法”指免疫疗法是利用免疫系统来治疗疾病,在本发明中主要指通过提高肿瘤细胞的免疫原性和对效应细胞杀伤的敏感性,激发和增强机体抗肿瘤免疫应答,并应用免疫细胞和效应分子输注宿主体内,协同机体免疫系统杀伤肿瘤、抑制肿瘤生长。具体实施方式以下结合实施例用于进一步描述本发明,但这些实施例并非限制本发明的范围。实施例1:化合物(1)对甲苯磺酸盐联合pd-1抗体治疗晚期实体瘤临床研究1、受试抗体和化合物pd-1抗体按wo2015085847公开的方法制备,对应其代号为h005-1,其重、轻链的序列如本发明中seqidno:7和seqidno:8。批号:p1512,200mg/支,配成20mg/ml备用。化合物(1)对甲苯磺酸盐(以下称为化合物a)可按wo2016155473按公开的方法制备,制成片剂,规格为0.125mg/片、0.5mg/片、2mg/片。2、入组受试者标准(1)年龄18-70岁;(2)诊断为晚期实体瘤且无相应标准治疗或治疗无效;(3)具有ras或raf阳性突变;(4)ecog评分0-1分;(5)预期寿命至少3个月;(6)必须具有足够的骨髓、肝、肾、肺和心脏功能。3、给药方法入组受试者首先接受化合物a单次给药,口服后洗脱7-10天,然后进入连续给药阶段,化合物a片剂每日一次,连续28天为一个周期;连续给药第1周期的第1和第15天接受h005-1,剂量为200mg/次。联合给药直至疾病进展、毒性不耐受、受试者主动撤销知情通知书或研究者判断受试者不再适合继续接受治疗。截止目前,10名患有复发或转移性结直肠癌受试者参加剂量递增阶段的临床试验。受试者接受化合物a(0.125mg/qd,0.25mg/qd和0.5mg/qd)和pd-1抗体(200mg)联合治疗。共有5名受试者已退出该项研究。2例受试者疾病进展、1例受试者发生治疗无关的sae、1例脑转移受试者(不符合入组标准)和1例受试者(0.5mg/qd剂量组)经历剂量限制性毒性。仍有5名受试者在研究治疗中,其中2名受试者为pr(分别为11.5个月和7个月),另外2名受试者为稳定疾病(分别为9个月和1个月)。1名受试者即将接受肿瘤评估。各受试者的治疗评估情况如图1所示。各受试者的基因突变情况如下:受试者的基因型序列表<110>江苏恒瑞医药股份有限公司<120>pd-1抗体和mek抑制剂联合在制备治疗肿瘤的药物中的用途<160>10<170>siposequencelisting1.0<210>1<211>5<212>prt<213>鼠源(musmusculus)<400>1sertyrmetmetser15<210>2<211>17<212>prt<213>鼠源(musmusculus)<400>2thrileserglyglyglyalaasnthrtyrtyrproaspservallys151015gly<210>3<211>7<212>prt<213>鼠源(musmusculus)<400>3glnleutyrtyrpheasptyr15<210>4<211>11<212>prt<213>鼠源(musmusculus)<400>4leualaserglnthrileglythrtrpleuthr1510<210>5<211>7<212>prt<213>鼠源(musmusculus)<400>5thralathrserleualaasp15<210>6<211>9<212>prt<213>鼠源(musmusculus)<400>6glnglnvaltyrserileprotrpthr15<210>7<211>443<212>prt<213>人工序列(artificialsequence)<220><221>peptide<222>(1)..(443)<223>重链序列<400>7gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530metmetsertrpvalargglnalaproglylysglyleuglutrpval354045alathrileserglyglyglyalaasnthrtyrtyrproaspserval505560lysglyargphethrileserargaspasnalalysasnserleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargglnleutyrtyrpheasptyrtrpglyglnglythrthrval100105110thrvalserseralaserthrlysglyproservalpheproleuala115120125procysserargserthrsergluserthralaalaleuglycysleu130135140vallysasptyrpheprogluprovalthrvalsertrpasnsergly145150155160alaleuthrserglyvalhisthrpheproalavalleuglnserser165170175glyleutyrserleuserservalvalthrvalproserserserleu180185190glythrlysthrtyrthrcysasnvalasphislysproserasnthr195200205lysvalasplysargvalgluserlystyrglyproprocyspropro210215220cysproalaproglupheleuglyglyproservalpheleuphepro225230235240prolysprolysaspthrleumetileserargthrprogluvalthr245250255cysvalvalvalaspvalserglngluaspprogluvalglnpheasn260265270trptyrvalaspglyvalgluvalhisasnalalysthrlysproarg275280285glugluglnpheasnserthrtyrargvalvalservalleuthrval290295300leuhisglnasptrpleuasnglylysglutyrlyscyslysvalser305310315320asnlysglyleuproserserileglulysthrileserlysalalys325330335glyglnproarggluproglnvaltyrthrleuproproserglnglu340345350glumetthrlysasnglnvalserleuthrcysleuvallysglyphe355360365tyrproseraspilealavalglutrpgluserasnglyglnproglu370375380asnasntyrlysthrthrproprovalleuaspseraspglyserphe385390395400pheleutyrserargleuthrvalasplysserargtrpglnglugly405410415asnvalphesercysservalmethisglualaleuhisasnhistyr420425430thrglnlysserleuserleuserleuglylys435440<210>8<211>214<212>prt<213>人工序列(artificialsequence)<220><221>peptide<222>(1)..(214)<223>轻链序列<400>8aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysleualaserglnthrileglythrtrp202530leuthrtrptyrglnglnlysproglylysalaprolysleuleuile354045tyrthralathrserleualaaspglyvalproserargphesergly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglnvaltyrserileprotrp859095thrpheglyglyglythrlysvalgluilelysargthrvalalaala100105110proservalpheilepheproproseraspgluglnleulyssergly115120125thralaservalvalcysleuleuasnasnphetyrproarggluala130135140lysvalglntrplysvalaspasnalaleuglnserglyasnsergln145150155160gluservalthrgluglnaspserlysaspserthrtyrserleuser165170175serthrleuthrleuserlysalaasptyrglulyshislysvaltyr180185190alacysgluvalthrhisglnglyleuserserprovalthrlysser195200205pheasnargglyglucys210<210>9<211>116<212>prt<213>人工序列(artificialsequence)<220><221>peptide<222>(1)..(116)<223>重链可变区<400>9gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530metmetsertrpvalargglnalaproglylysglyleuglutrpval354045alathrileserglyglyglyalaasnthrtyrtyrproaspserval505560lysglyargphethrileserargaspasnalalysasnserleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargglnleutyrtyrpheasptyrtrpglyglnglythrthrval100105110thrvalserser115<210>10<211>107<212>prt<213>人工序列(artificialsequence)<220><221>peptide<222>(1)..(10)<223>轻链可变区<400>10aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysleualaserglnthrileglythrtrp202530leuthrtrptyrglnglnlysproglylysalaprolysleuleuile354045tyrthralathrserleualaaspglyvalproserargphesergly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglnvaltyrserileprotrp859095thrpheglyglyglythrlysvalgluilelys100105当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1