对于依赖于应用的有效载荷、受控药代动力学分布和肾脏清除的药物设计的制作方法
关于联邦政府赞助的研究与开发的声明
本发明在美国国立卫生研究院授予的合同号r01eb015476的政府支持下完成。美国政府享有本发明的某些权利。
背景
非侵入式成像技术使得能够获得患者的内部结构或特征的图像。特别是,这种非侵入式成像技术依赖于各种物理原理,比如通过目标体积的x射线光子的差分传输或声波反射,以采集数据并构建图像或者表示受试者的内部特征。
例如,在基于x射线的成像技术中,x射线辐射贯穿目标受试者(比如人类患者),并且辐射的一部分撞击其中收集强度数据的检测器。在数字x射线系统中,检测器产生代表撞击检测器表面的离散像素区域的辐射量或强度的信号。然后可处理信号以生成可显示以供查看的图像。
在一项这种基于x射线的技术(称为计算机断层扫描(ct))中,扫描仪可在围绕患者的多个视角位置投射来自x射线源的x射线束。x射线束在其穿过物体时会被衰减,并由一组检测器元件进行检测,这些检测器元件会产生表示检测器上入射x射线强度的信号。对信号进行处理以产生代表沿着x射线路径的物体的线性衰减系数的线积分的数据。这些信号一般称为“投影数据”或仅称为“投影”。通过使用重建技术(比如滤波反投影),可生成图像,该图像表示患者或成像物体的目标区域的体积或体积渲染。在医学情境下,然后可从重建的图像或渲染的体积定位或识别目标病理或其他结构。
为了增强某些目标解剖体类型与其他组织之间的图像对比度,可采用造影剂,当给予时,造影剂会增加其所存在的组织的不透明度。例如,在临床x射线/ct成像中,目标解剖体可为含有血液的脉管系统或器官实质,其否则在没有造影剂的情况下很难在x射线下与邻接组织区分开。
然而,目前的成像造影剂具有多种限制。例如,碘化小分子的相对小尺寸使得其能够几乎立即开始从血池立即分布到间质液中,从而在给予后的几分钟内基本上稀释了造影剂。这限制了其中采集的图像在目标血管和器官中含有最大造影剂浓度的可用时间。因此,即使在采集窗口内,由于对比度增强至少部分地取决于成像体积中目标解剖隔室内该药剂的浓度,分布效果可能会影响采集窗口中不同时间获得的图像的可比性。此外,构成这种药剂的分子尺寸存在上限,因为较大的分子可能无法被患者的肾脏有效去除。通过肾脏的去除很重要,以便该药剂不会保留在患者体内的这种器官(比如肾脏、肝脏和脾脏)中。快速的肾脏清除通常通过最大程度地减少组织对该药剂的暴露来降低毒性的可能性。
简述
以下概述范围与原始要求保护的主题相称的某些实施方案。这些实施方案不旨在限制要求保护的主题的范围,而是这些实施方案仅旨在提供可能实施方案的简要概述。实际上,本发明可包括可与以下阐述的实施方案相似或不同的多种形式。
在一个方面,提供一种可注射到受试者(例如患者)体内的药剂。根据该方面,所述药剂包含纳米粒子或分子,其尺寸确定为在受试者的组织、器官或身体隔室(bodilycompartment)之间实现特定程度的分布或缺乏分布,同时仍通过肾脏消除。
在另一方面,提供一种用于实施对比度增强的图像采集的方法。根据该方面,确定患者或患者体内要成像的解剖学区域的尺寸。基于患者或解剖学区域的尺寸,确定用于采集患者或患者体内解剖学区域的一个或多个图像的x射线能谱。基于解剖学尺寸或x射线能谱中的一者或二者,选择一种或多种x射线衰减元素用作造影剂的成分。给予患者造影剂。造影剂包含具有选定尺寸的纳米粒子或分子,以实现患者的组织、器官或身体隔室之间特定程度的分布或缺乏分布,同时仍被肾脏消除。采集患者的一个或多个对比度增强的图像。
在另一方面,提供一种用于使用可注射到患者体内的一种或多种类型的药物来实施程序的方法。根据该方面,作为程序的一部分,将所述一种或多种类型的药物给予患者。当存在超过一种药物时,可同时或顺序注射。所述类型的药物中的一种或多种包含具有选定尺寸的纳米粒子或分子,以实现患者的组织、器官或身体隔室之间特定程度的分布或缺乏分布,同时仍被肾脏消除。
附图简述
当参考附图阅读以下详述时,将更好地理解本发明的这些和其他特征、方面和优点,其中在整个附图中相似的字符表示相似的部分,其中:
图1为根据本公开的方面被配置为采集患者的ct图像并处理图像的计算机断层扫描(ct)系统的实施方案的示意图;
图2描绘说明内皮单层对不同stokes-einstein半径的分子的渗透性的曲线;
图3描绘猪血浆中造影剂碘普罗胺的浓度,其作为时间的函数说明;
图4描绘在x射线峰值能量范围内各种元素的ct图像对比度;
图5描绘根据本方法的方面的造影剂纳米粒子的实例的剖面图和化学视图;
图6描绘在给猪注射tacz纳米粒子造影剂或碘普罗胺(一种常规的碘化小分子造影剂)之后,将其包裹在脂肪等效包装(adipose-equivalentencasement)中的猪的ct图像;
图7描绘使用tacz纳米粒子造影剂或碘普罗胺(一种常规的碘化小分子造影剂)生成的猪的ct图像的多读取器评价结果;
图8描绘评价猪血浆中的tacz纳米粒子或碘普罗胺的研究结果;和
图9描绘评价猪尿中的tacz纳米粒子或碘普罗胺的研究结果。
详述
以下将描述一个或多个具体实施方案。为了提供对这些实施方案的简要描述,可能未在说明书中描述实际实施的所有特征。应当意识到,在任何这种实际实施的开发中,如在任何工程或设计项目中,都必须做出多种特定于实施的决策,以实现开发人员的特定目标,比如遵守与系统相关和与业务相关的限制,这可能因实施而异。此外,应当意识到,这种开发工作可能是复杂且耗时的,但是对于受益于本公开的普通技术人员而言,这仍将是设计、制作和制造的例行工作。
当介绍本发明各种实施方案的元素时,冠词“一(a)”、“一个(an)”、“该(the)”和“所述(said)”旨在意指存在一种或多种元素。术语“包含(comprising)”、“包括(including)”和“具有(having)”旨在为包括性的,并且意指除所列元素以外可能存在另外的元素。此外,以下讨论中的任何数字实例旨在为非限制性的,并且因此另外的数值、范围和百分比处于所公开实施方案的范围内。
尽管通常在医学成像的情境下提供以下讨论,但是应当意识到,本技术不限于这种成像情境。实际上,在这种成像情境下提供实例和解释仅是通过提供真实世界的实施和应用的例子以便于解释。然而,本方法也可用于其他药物(drug)或药物剂(pharmacologicalagent)递送的情境,包括(但不限于)癌症治疗药物、pet示踪剂(发出γ辐射的分子)、磁性元素和/或不同造影剂和/或与治疗剂组合的造影剂的多种或混合有效载荷的递送。通常,在其中受控药代动力学分布和/或肾脏清除为因素的任何药剂递送情境下,本方法都可能是合宜的。
如本文更详细讨论的,可从本方法中受益的一种类型的给予药剂为造影剂,其被用于医学成像中以增强目标解剖体与其他组织之间的图像对比度。例如,在临床x射线或计算机断层扫描(ct)成像中,目标解剖体可为含有血液的脉管系统或器官实质,在这种情况下,将造影剂注射到血流中,其中造影剂增加它所存在的体积的相对不透明度。
造影剂的功效取决于多种因素,包括造影剂中的x射线衰减元素、该元素的注射浓度、所扫描的患者/解剖体的直径以及使用的相关x射线谱、造影剂的药代动力学(pk)特性、要扫描的器官和组织的血液动力生理学以及造影剂注射之后实施扫描时的时间。如本文讨论的,构成造影剂的分子或纳米粒子的尺寸可能在血池分布(或者更普遍地,药代动力学分布)和肾脏清除方面具有重要性。本方法不仅在基于x射线的造影剂、而且在可能会遇到类似问题的用于其他形态的造影剂的情境下解决这些问题中的某些,并且更普遍地适用于其中受控药代动力学分布和肾脏清除中的一者或二者令人关注的任何给予药物。本文中,令人关注的分布在组织、器官或身体隔室之间。此外,本方法解决同时或顺序给予的多种造影剂和/或药物的给予,其中当与其他药物组合给予时,每种药物的药代动力学特性和/或图像对比度增强特性被设计用于最佳功效。
如将意识到的,在以下讨论的各种实施方案中使用的纳米粒子的尺寸为本公开的焦点。纳米粒子和分子可采取各种形状和形式,包括球形、椭圆形、棒形等。在以下讨论中,分子或纳米粒子的相关尺寸可为最大尺度、最小尺度、流体动力学直径、流体动力学半径、stokes半径或一些其他尺寸估值,取决于分子或纳米粒子所相互作用的生物学结构。在分子和纳米粒子的情境下,以下使用的术语“尺寸”意指传递相关尺寸以产生观察到的生物学效应或实现期望的生物学效应;术语“尺寸”的使用并不意味着在形状或形式上的限制,或者特定尺度的尺寸。此外,常规的小分子造影剂通常尺寸为单分散性的,即所有分子的尺寸均相同;然而,纳米粒子制剂通常尺寸为多分散性的,即纳米粒子制剂通常将具有尺寸分布。尺寸分布可为gaussian分布,但不一定如此。本文中,“标称纳米粒子尺寸”是指尺寸分布的模式;“尺寸范围最小值”是指某一尺寸,大部分(例如约90-95%)纳米粒子包括在大于其内;“尺寸范围最大值”是指某一尺寸,大部分(例如约90-95%)纳米粒子包括在小于其内;和“尺寸范围”是指尺寸范围最小值和尺寸范围最大值之间的所有尺寸。
为了便于解释,本文讨论了解释本方法的某些实例,因为该方法可能与医学成像系统情境下造影剂的递送相关。作为一个具体实例,首先将提供可用于生成对比度增强图像的一种这样的系统(在此为ct系统)的操作原理的简要说明,使得其中可采用造影剂的情境更加明显。然而,如可以意识到的,该实例仅旨在提供一种框架和背景,以在医学上有用的情境下更好地理解药剂(比如造影剂)递送的某些方面,并且不应视为将本方法限制于造影剂或用于ct成像的造影剂。确实,本方法在其中受控药代动力学分布和/或肾脏清除有问题的各种情况下可能是有益的。此外,即使在图像对比度的情境下,本方法对于除ct之外的各种成像形态(包括(但不限于)磁共振成像(mri)和正电子发射断层扫描(pet))的造影剂递送也可为有用的。
在这种情境下,图1说明用于采集和处理图像数据(包括其中可能存在造影剂的体积的图像数据)的ct成像系统10的实施方案。特别是,计算机断层扫描系统10采集x射线投影数据并将投影数据重建为用于显示和分析的体积重建。为使某些以其他方式在x射线下无法与周围组织相对区分开的物质和结构成像,可给予患者造影剂,其增加存在造影剂的区域(比如血管或其他脉管系统以及器官实质)的x射线不透明度。
考虑到这一点,ct成像系统10包括一个或多个x射线源12,其在成像期间生成x射线光子。生成的x射线束20进入其中受试者(例如患者24)所处的区域。受试者使光束20中的至少一部分x射线光子衰减,导致衰减的x射线光子26撞击在由本文讨论的多个检测器元件(例如像素)形成的检测器阵列28上。关于本讨论,一些部分的x射线衰减可归因于一种或多种造影剂,其在成像之前和/或期间给予患者,以便在成像时存在于目标区域中。
检测器28通常限定检测器元件的阵列,当暴露于x射线光子时,其每一个元件产生电信号。采集并处理电信号以生成一个或多个投影数据集。在所描绘的实例中,检测器28连接于系统控制器30,后者命令采集由检测器28生成的数字信号。
系统控制器30命令成像系统10的操作并且可处理所采集的数据。系统控制器30可向x射线源12提供功率、焦点位置、控制信号等(比如经所描绘的x射线控制器38),并且可控制ct机架(或x射线源12和检测器28附接到的其他结构支撑)的操作和/或在检查过程中患者支撑的平移和/或倾斜。
另外,系统控制器30可经电机控制器36来控制用于分别移动受试者24和/或成像系统10的组件的线性定位子系统32和/或旋转子系统34的操作。这种组件便于在相对于患者的不同位置和角度处采集投影数据,这继而使得成像区域能够进行体积重建。
系统控制器30可包括数据采集系统(das)40。das40接收由检测器28的读出电子器件收集的数据,比如来自检测器28的数字信号。然后,das40可转换和/或处理数据,以供基于处理器的系统(比如计算机42)进行后续处理。计算机42可包括可存储由计算机42处理的数据的一个或多个非暂时性存储设备46或与之通信、待由计算机42处理的数据或将由计算机42的图像处理电路44执行的指令。
计算机42还可适应于控制由系统控制器30启用的特征(即扫描操作和数据采集),比如响应于操作员经操作员工作站48提供的命令和扫描参数。系统10还可包括连接于操作员工作站48的显示器50,其使得操作员能够查看相关系统数据、成像参数、原始成像数据、重建的图像或体积等。另外,系统10可包括打印机52,后者连接于操作员工作站48并被配置为打印任何期望的测量结果。显示器50和打印机52也可直接(如图1所示)或经操作员工作站48连接于计算机42。此外,操作员工作站48可包括或连接于图像存储与传输系统(pacs)54。pacs54可连接于远程系统或客户端56、放射科信息系统(ris)、医院信息系统(his)或者内部或外部网络,使得位于不同位置的其他人可访问图像数据。
考虑到前面对整个成像系统10的讨论,可以意识到,ct成像系统10为一种类型的成像系统,其对于某些成像程序,可受益于使用根据本方法设计和给予的造影剂。特别是,这种药剂对于通过比如本文讨论的系统成像可具有改善的特性。
关于可使用如图1所示的ct系统10用于采集图像(比如血管图像)的造影剂,目前临床上可注射的ct/x射线造影剂通常为碘化小分子(即衰减元素固定于碘),分子尺寸为约1nm-2nm级,导致其具有几乎相同的药代动力学(pk)特性(例如分布速率常数(α)、分布半衰期(t½a)、清除速率常数(β)、清除半衰期(t½)等),这可能并不理想。出于本目的,可以理解的是,对于处于合适的临床浓度(即240-400mg/ml)下的造影剂,粘度最多为~20mpa·s和同渗重摩最多为~1600mosm是可接受的,尽管为了患者舒适,优选同渗重摩为~280mosm。
此外,这种小分子可装配在构成毛细血管壁的内皮细胞之间的空间之间,这称为内皮间连接(iej)。特别是,正常非神经毛细血管的iej允许分子或纳米粒子以~3.5nm的流体动力学直径进行传质最多达到相对锐截止。这示于图2,其描绘了说明内皮单层对不同stokes-einstein半径的分子的渗透性(p)的曲线。如图2所示,内皮渗透性的截止尺寸(并因此从血液快速分布到间质液)约为1.5nm-2nm的半径,或者为3nm-4nm的直径。然而,该截止值还可能取决于所讨论的分子或纳米粒子的形状因数、表面电荷以及该分子或纳米粒子与体内可能存在的其他分子种类的潜在缔合。
鉴于内皮渗透性的这个图示,可以意识到,在给予之后,小分子造影剂立即开始从血池分布到间质液中。由于该“分布相”,血池中造影剂的浓度在注射之后第一分钟内立即两倍或更多倍稀释。这示于图3,其中说明猪血浆中造影剂碘普罗胺的浓度随时间的变化,分布相和消除相两者均明显。
如图3所示,注射之后,与所有碘化小分子造影剂相似,碘普罗胺立即开始在血液(身体体积的~6%)与间质液(身体体积的~21%)之间平衡浓度。该分布以相对快的速率发生,其半衰期(t½a)为分钟级,并且在图3中表示为分布相。如图3所示,碘普罗胺在血浆中的分布相半衰期远小于5分钟。因此,由于单独的这种初始分布过程,血液中的分子浓度将在远小于10分钟内降低为约4分之一。然而,药物同时通过肾脏以较低速率从血液中清除,其t½为1-2小时级(在图3中表示为消除相),导致另外降低血液浓度。
因此,可以意识到,成像体积的对比度由于快速分布相而降低可能会影响某些诊断检查,比如静脉相和延迟相肝脏ct扫描。这导致相比如果造影剂不分布且因此血池中的浓度较高所将获得的,某些类型疾病(比如静脉血栓形成或肝脏肿瘤)的检出率较低,和血管解剖体的轮廓描绘较差。
如上所述,分布相为造影剂从脉管系统分布到间质液的结果。如果可控制构成造影剂的分子或纳米粒子的尺寸范围最小值,则可减轻或者甚至消除从血池到间质组织空间的分布。以这种方式,可将药物配制成驻留于脉管系统中,同时进行较慢的消除相,在此期间药物从体内消除。由于药物在很大程度上被限制在脉管系统和器官内的血容量或血池中,直到被消除为止,因此该药剂可称为“血池造影剂”。更普遍地,可将任何药物设计为具有该特性,这可用于限制某些组织或器官对该药物的暴露。
如果可控制构成造影剂的分子或纳米粒子的尺寸范围最大值,则可影响清除机理。以这种方式,药物可配制成主要经肾脏(即通过肾脏)清除。肾脏清除的尺寸限制(例如流体动力学尺寸限制)为约5-6nm,例如5.5nm;然而,肾脏滤过效率取决于几个因素,包括尺寸、形状和电荷。在备选方案中,在尺寸范围最大值被选择为小于约3-4nm,例如小于约3.4nm的情况下,调整分布以在成像期间远离血池。
尽管快速分布和肾脏清除为小分子造影剂的特性,但是相比之下,其他考虑的药剂包含的纳米粒子尺寸太大而无法通过肾脏清除,即无法进行肾脏清除。例如,用于临床前动物成像的基于纳米粒子的造影剂通常具有数十或数百纳米的尺寸,并因此大于可进行肾脏有效清除的尺寸。由于这种药剂的尺寸阻止其通过内皮间连接分布并且还阻止肾脏清除,因此可称为“血池”或“长循环”药剂。取而代之的是,这种大粒子通过网状内皮系统(res)清除,导致在身体组织中的保留时间延长。后者的一个缺点是这种保留会干扰后续x射线/ct检查。在其他情况下,药剂在体内的保留可能与患者中不利的健康后果相关。因此,这些大的纳米粒子药剂通常不太期望用作通用造影剂。或者,包含大尺寸纳米粒子的造影剂已被设计成可生物降解为小分子,以使得能够更快速地消除,但在这种情况下,消除时间取决于生物降解的速率以及生物降解分子的分布和消除速率二者,导致复杂的药代动力学特征和延长的清除期。
尽管一些造影剂中纳米粒子的尺寸小于上述肾脏截止值,但其尺寸也小于iej截止值,并因此具有与小分子药剂类似的pk特性,即其经受快速分布相,其中药剂在血池和组织的间质液之间平衡。
考虑到前面对现有造影剂限制性的讨论,可以意识到,在药剂的设计或构建中应考虑某些特性。例如,有用的造影剂应基于非毒性实体,当将其以大剂量(~10g-90g的主要x射线衰减元素)注射到血流中时耐受性良好,应包括在40-140kev的范围内提供良好x射线衰减的衰减元素,应具有可接受的粘度和同渗重摩,应在尺寸和表面化学方面可调整或可设计以优化pk特性,和应具有快速的肾脏清除。此外,根据本文讨论的某些实施,这种造影剂可使得能够定制或选择为特定患者选择的特定衰减元素,比如基于患者或解剖体尺寸(例如直径),并且将保留在血池中而不是从血池分布到间质液中。关于患者尺寸作为考虑因素,进行成像的患者或解剖体越大(例如解剖学尺寸越大),则用于成像操作的x射线能量就越高,以使患者解剖体获得足够的穿透力以在重建图像中获得合适的信噪比。如本文所讨论的,不同的造影剂可能更好地适合于不同的x射线能量范围。
关于本文讨论的造影剂的设计或配置的另一个考虑因素为该药剂是要用于光谱ct还是用于放射摄影成像情境,其中以两个或更多个不同的x射线发射光谱采集投影数据(例如在双能成像情境下的高能和低能)或使用区分能量的检测机制。在这种光谱成像情境下,用于给定患者或解剖学尺寸的合适的衰减元素可能不同于对常规单能成像可能合适的衰减元素。
考虑到这一点,本方法采用造影剂(或其他给予药剂),其为一种纳米粒子,具有:核(由原子序数(z)在碘(z=53)至铋(z=83)范围内的元素构成);两性离子壳(以促进可接受的pk、粘度和同渗重摩);并且纳米粒子尺寸有助于血池分布和快速肾脏清除,比如纳米粒子尺寸范围为约3.5nm-5.5nm。然而,如本文所讨论的,具体尺寸范围可取决于表面化学,特别是表面电荷。因此,最佳纳米粒子尺寸可在某种程度上取决于所使用的具体纳米粒子包衣。
本方法可允许定制粒子的核(例如有效载荷)和粒子的壳两者,使得能够在定制整体粒子的特性(例如纳米粒子尺寸、表面电荷和形状因数)方面具有更大的灵活性。
考虑到这一点,关于用于基于x射线的成像的造影剂的核,这种核对于患者和成像程序应具有合适的x射线衰减特性。举例来说,用于本方法的造影剂的核或有效载荷材料可选自基于原子序数(z)包括和在约53(碘)-83(铋)之间的元素的分子。不知毒性和以足够的商业上可接受的量在可接受的成本下可得的该范围内元素的实例包括碘、钡、镧、铈、镨、钕、钐、铕、钆、铽、镝、钬、铒、铥、镱、镥、铪、钽、钨和铋。同样,该范围内的商业上昂贵或难以获得的元素(比如铼、锇、铱、铂和金)可能用途有限,比如在专门应用中。
考虑到这一点,x射线衰减核的选择可基于患者/解剖学考虑、规定的成像方案(例如多能或单能)以及相应元素的k边缘衰减特性。
关于患者和/或解剖体尺寸,如上所述,可以较高的x射线能量(较高的kvp)对较大的患者进行成像以获得较大组织范围的足够穿透。继而可使用较高的z元素作为衰减材料改善较高能量x射线的衰减,但有一些注意事项如下所述。例如,在基于患者尺寸选择合适的x射线衰减核方面,z≤67的元素可适合于较小的患者,而z≥60的元素更适合于较大的患者,对于z值在60-67之间的元素存在一定程度的重叠。
选择合适的衰减元素的另一个考虑因素为该元素是否呈现出k边缘效应,这与k壳电子的结合能相关。该k边缘效应可表现为在x射线发射光谱区域衰减的跃升。如图4所示,在一定的峰值x射线能量范围显示出适合于本文讨论的药剂的核有效载荷的多种元素的对比度。如图4中可以看到的那样,某些目标元素呈现出k边缘效应,而其他元素则没有。例如,碘在临床上有用的x射线能量下没有呈现出k边缘效应(碘的k边缘能量为33kev,远低于用于全身成像的典型x射线能量),反而在临床上有用的x射线能量范围内随着峰值电压的增加呈现出衰减单调减小。相比之下,那些在能量范围内的某个点衰减不会单调减小或者衰减增加的元素会呈现出k边缘效应,比如在100-120kev之间的铋和在80-100kev之间的钽。
这种k边缘效应的重要性在于,其提供在选择用作本文所述的造影剂的衰减核的元素时要考虑的另一个因素。例如,x射线管电压(kvp)可至少部分地基于患者和/或解剖学尺寸(如上所述)以及基于所使用的x射线衰减元素的特性衰减来选择。举例来说,基于碘的造影剂可能不适合用于较大的患者,因为碘随着kvp的增加而呈现出衰减单调减小,从而导致在较大患者中的对比度损失。
取而代之,可选择在目标能量范围内呈现出对比度增加或稳定的更合适的衰减元素,以用于较大的患者或解剖学尺寸。对于单能ct,合适的衰减元素可为k边缘能量稍低于所检测光谱平均能量的衰减元素。对于光谱ct(例如双能或多能),合适的衰减元素可为k边缘位于合适的诊断能量范围内(40kev-140kev之间)的衰减元素。
如本文所述,所选择的衰减元素(或其他有效载荷)被生物相容性壳围绕。所考虑的造影剂的一个实例纳米粒子200如图5所示,其中氧化钽核202被羧基甜菜碱两性离子壳204围绕(tacz)。在该实例中,通过动态光散射评价,粒子尺寸为多分散性的,标称尺寸为~3.1nm-3.5nm,标准偏差为~0.5nm,从而尺寸范围为~2.1nm-4.5nm。可以意识到,可采用其他合适的生物相容性壳。
如本文所述,本方法允许在造影剂纳米粒子的尺寸方面进行一定程度的定制,比如产生足够大以保留在血池中的纳米粒子(即不分布到间质液中,通常对应于尺寸大于约3-4nm,例如大于约3.5nm),但足够小以进行肾脏清除(通常对应于尺寸小于约5-6nm,例如小于约5.5nm)。如上所述,形状因数和表面化学也可能影响这些特性,并因此也可能是确定合适尺寸的因素。
此外,本方法也可用于产生造影剂纳米粒子,其能够用于表征相对于健康脉管系统具有比正常iej大或缺乏iej(比如发生在肿瘤或发炎的组织中)的微脉管系统。特别是,具有能够通过肿瘤iej但不能通过健康脉管系统的iej传质的尺寸的造影剂(或治疗)粒子可用于检测肿瘤和炎症,表征肿瘤微脉管系统和/或使得能够早期评估对治疗的反应。因此,除了肿瘤或发炎的组织内之外,这种药剂将保留在血池中。相反,在一些正常组织(比如肝脏)中,由于存在内皮孔,因此内皮窦对于较大尺寸的纳米粒子为高度多孔的。在这种多孔组织中,孔隙率的降低或丧失为疾病的信号,比如在肝纤维症中。因此,具有允许通过健康的窦状内皮孔进行更快速传质但通过患病的窦状内皮孔的传质减少的纳米粒子尺寸的药剂将可用于检测和监测这种组织的疾病。
通过将药剂分成两个分立的方面,即有效载荷或核方面和壳方面,可实现两个益处:(1)衰减和生物相容性的功能分别由核和壳分开提供,并因此任一种功能的设计可在某种程度上独立于其他功能而变化;(2)可调整纳米粒子的尺寸,以实现最佳药代动力学(pk)(如上所述),而不会影响衰减或生物相容性的功能(需要注意的是,粒子尺寸可能会影响粘度和同渗重摩)。这可允许关于患者和成像程序两方面高度定制。例如,可生成一种造影剂,由于衰减材料的策略性选择,其在ct检查的早(动脉)相期间提供等于或高于由常规碘化药剂(以相同质量浓度注射的药剂)所提供的对比度增强,并且使用尺寸优化的药剂在后(静脉和延迟)相期间的对比度可基本上高于常规小分子药剂(其分布到间质液中)。
考虑到前述,使用图5所示的tacz造影剂进行了大鼠和猪的ct扫描。在这些研究中,将碘化小分子药剂与原型tacz药剂进行了比较,如上所述,后者为具有氧化钽核和羧基甜菜碱两性离子壳的纳米粒子。如上所述,tacz实现的粒子尺寸为多分散性的,标称尺寸为~3.1-3.5nm,和标准偏差为~0.5nm,导致尺寸范围为~2.1nm-4.5nm,因此包括一些小于期望的3.5nm阈值(即iej截止值)的粒子。
结果以两种形式获得:经图像质量评价的临床益处和经血液样本的药代动力学(pk)建模。
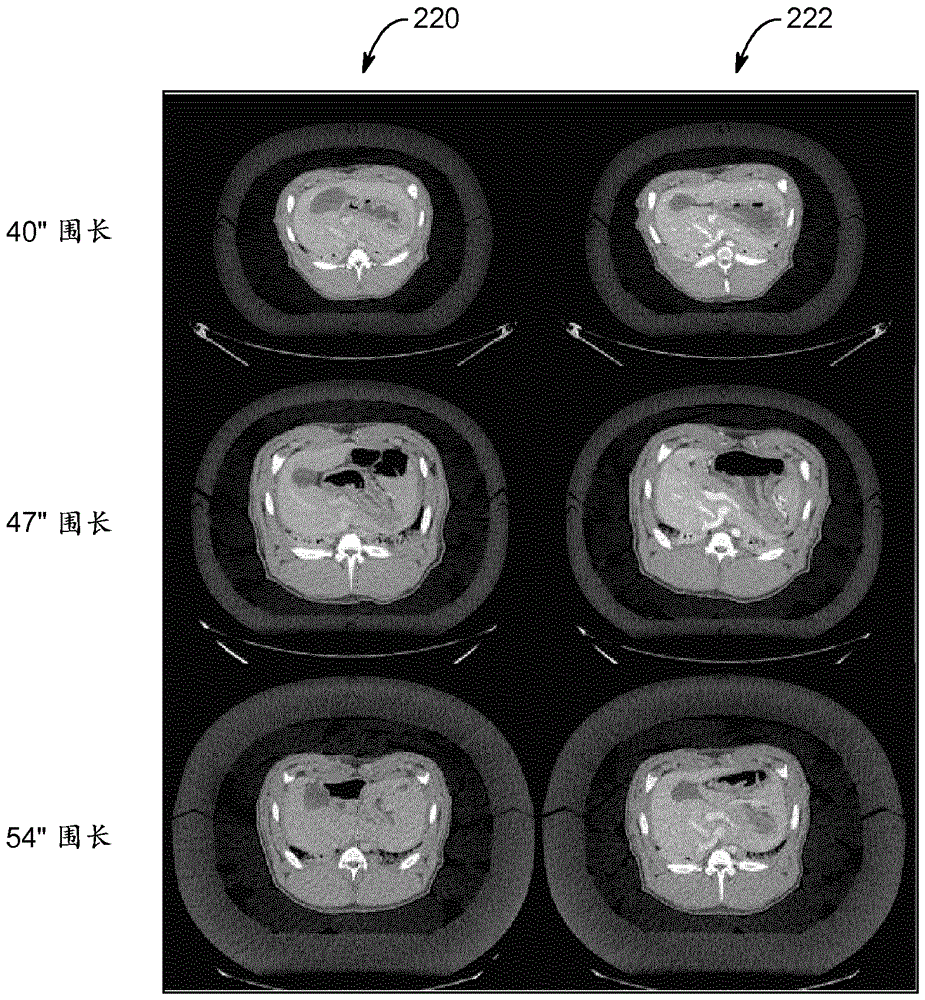
通过比较猪的ct扫描观察到临床益处,在此期间,使用碘化小分子临床造影剂或tacz依序扫描相同动物。扫描间隔一天至一周进行,并且扫描序列随机化。扫描期间,将猪包裹在塑料的脂肪等效包装中,以模拟一系列大患者尺寸。在注射之后30-300秒的几个时间点对猪的肝脏进行扫描。放射科医生使用预定义的标准(比如指定血管中的图像对比度)对每个时间点的图像质量进行评级。结果如图6和7所示。
在图6中,左侧的图像220使用常规碘化造影剂碘普罗胺采集,而右侧图像220使用上述tacz纳米粒子造影剂采集。垂直地,图像基于患者尺寸排列。如图6所示,随着患者尺寸的增加(并且x射线能量相应地增加),由基于碘的药物提供的图像对比度增强相对于由tacz提供的对比度增强减小。
在图7中,多读取器评价的结果以图表形式提供。除了活性元素钽的作用之外,造影剂的药代动力学会影响图像对比度,尤其是在静脉图像中,在更后的时间,在血液通过毛细血管并且小分子造影剂开始分布到间质液之后,会增强。相反,较大tacz粒子的浓度在介入时间内基本上没有降低。
因此,这些结果证明了在大型患者中,(比如在如本文所述的复合造影剂的核中)使用基于z高于碘的元素的造影剂的益处。另外,在图7中评价的静脉相扫描中还证明了调整粒子尺寸以保留在血池内的益处,其中相比比小分子药剂,tacz的血池分布产生高得多的图像对比度,和因此高得多的血管可检测性。
在分开的分析中,通过分析注射造影剂之后2-240分钟采集的血液样本中活性元素(碘或钽)的浓度获得pk建模。结果显示两个不同的指数分量,可基于其速率常数将它们指定为上述分布和消除过程,如图8所示。
然而,如图8所示,当使用tacz时,观察到3个不同指数过程。特别是,像碘化小分子(例如碘普罗胺)一样,某部分纳米粒子药剂tacz以分钟级的t½a和小时级的t½分布到间质液中。在该图中,显示平均(n=6头猪)分布t½a=1.7分钟,和平均清除t½=96分钟。然而,tacz曲线含有在碘普罗胺曲线中未发现的指数分量,其t½d=15分钟。这可归因于包含大于iej截止尺寸的纳米粒子的注射药剂的尺寸分布部分。因此,血液中钽的浓度(来自较大的纳米粒子)没有像碘化药剂一样被稀释,导致在1-3分钟时钽的浓度高达碘的两倍。这使得在临床上重要的成像时间,使用tacz相对于碘普罗胺导致更高的图像对比度。此外,似乎这些大的纳米粒子在t½d=15分钟时被肾脏从血液中清除,导致清除比碘普罗胺更快。
可以注意的是,图8的tacz曲线显示出血液中钽的浓度正在降低,但是没有显示这是由于分布还是由于清除。因此,在几个时间点测量排泄到猪膀胱中的钽和碘剂量,以检验以下假设:t½d=15分钟的指数对应于肾脏清除而不对应于缓慢分布过程。为了产生这些结果,假定假设是正确的,估计预期将在尿中积累的所注射药剂的量。然后测量膀胱中所注射药剂的量。鉴于该模型包括所有尿(包括肾脏、输尿管和膀胱中的尿),但仅测量膀胱中的尿,结果大体上一致(图9),从而支持该假设。
注意,该概念可扩展到包括受益于有效载荷可互换性、血池分布和肾脏清除的其他药物或药剂递送应用。这些包括用于pet、mri和其他成像形态的造影剂。本文所述方法的其他用途包括(但不限于)癌症治疗药物的递送(比如其中纳米粒子从肿瘤的可渗透性微血管渗漏而纳米粒子壳设计成被肿瘤消化)、放射性物质作为有效载荷的递送(比如本文所述粒子的纳米粒子壳被功能化以附接于病理(比如肿瘤),并且药物/有效载荷可用作pet示踪剂,但具有如由粒子尺寸和包衣特性提供的血池分布的优势)、以及在共有纳米粒子壳内多种或混合有效载荷(包括具有不同衰减特性的多种x射线衰减元素和/或放射性有效载荷和/或治疗药物)的递送。
另外,注射或给予患者可包含多种或不同粒子类型的混合物,每种粒子具有相同或不同pk特性和/或具有不同有效载荷。例如,不同有效载荷可为x射线衰减元素、放射性有效载荷和/或治疗药物。例如,使用多针注射器,可同时或依序地注射这些药剂。例如,使用分开定时注射的一种特定应用为在不同时间注射具有不同衰减元素的造影剂。这种方法将使得能够使用光谱成像来同时对静脉和肝实质(使用材料分解以突出显示较早注射)及动脉(使用材料分解以突出显示更后注射)进行成像,从而减少x射线剂量和改善工作流程。
通常,在其中受控药代动力学分布和/或肾脏清除为因素的任何药剂递送情境下,本方法均可为合宜的。
本发明的技术效果包括纳米粒子,其尺寸足够大以保留在血池中,但足够小以进行肾脏清除。这种粒子具有超过较小实体(尺寸与目前的小分子造影剂相似的分子或纳米粒子)的重要益处。例如,该药剂将比对比成像情境下的较小实体具有更高的血浆浓度和产生更高的图像对比度;较大粒子将具有基本上比较小粒子更高的每粒子有效载荷,这是因为核的体积(和因此的质量)随其半径的立方而增加;因此,在对比成像或治疗情境下,对于给定浓度所需的粒子更少;如果使用较少的较大粒子以提供给定浓度,则同渗重摩和粘度会降低;并且肾脏清除率更高。
该书面描述使用实例来公开本发明,包括最佳模式,并且还使得本领域的任何技术人员能够实践本发明,包括制造和使用任何设备或系统以及进行任何结合的方法。本发明可取得专利的范围通过权利要求定义,并且可包括本领域技术人员想到的其他实例。如果这种其他实例具有与权利要求的字面语言没有不同的结构元素,或者如果它们包括与权利要求的字面语言有非实质性差异的等同结构元素,则其旨在处于权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!