包含胰淀素、胰淀素激动剂受体或胰淀素类似物和共聚氨基酸的可注射水溶液形式的组合物的制作方法
本发明涉及用于治疗糖尿病的胰淀素注射疗法、胰淀素激动剂受体或胰淀素类似物。
本发明涉及可注射水溶液形式的组合物,其ph包括6.0至8.0,至少包含胰淀素、胰淀素激动剂受体或胰淀素类似物和根据本发明的带有羧酸根电荷及疏水基的共聚氨基酸,以及另外包含胰岛素(不包括等电点pi包括5.8至8.5的基础胰岛素)的组合物。本发明还涉及包含根据本发明的组合物的药物制剂。最后,本发明还涉及根据本发明的带有羧酸根电荷及疏水基的共聚氨基酸的用途,即为了稳定胰淀素、胰淀素激动剂受体或胰淀素类似物的组合物以及进一步包含胰岛素的胰淀素、胰淀素受体激动剂或胰淀素类似物组合物。
1型糖尿病是导致胰腺β细胞破坏的自身免疫性疾病。已知这些细胞产生胰岛素,其主要作用是调节外周组织中的葡萄糖的利用(gerich1993,controlofglycaemia)。因此,受1型糖尿病影响的患者罹患慢性高血糖症,并且必须自我施用外源性胰岛素,以便控制这种高血糖症。胰岛素疗法使得有可能极大地改变这些患者的预期寿命。然而,由外源性胰岛素对糖血提供控制并不是最佳的,特别是在进餐后。这与这些患者在进餐后产生胰高血糖素的事实有关,其导致储存在肝脏中的一部分葡萄糖释放,而在健康人中并非如此。这种胰高血糖素介导的葡萄糖产生使这些患者的糖血调节问题恶化。
已经证实由胰腺的β细胞产生且因此在1型糖尿病患者中也缺乏的另一种激素胰淀素在餐后糖血的调节中起关键作用。胰淀素也称为“胰岛淀粉样多肽”或iapp,其是与胰岛素一起储存和共同分泌的37个氨基酸的肽(schmitz2004amylinagonists)。这种肽被描述为阻断由胰腺的α细胞产生胰高血糖素。因此,胰岛素和胰淀素具有互补和协同作用,因为胰岛素使得有可能降低血液中的葡萄糖浓度,而胰淀素使得有可能通过抑制内源性胰高血糖素的产生(分泌)来减少内源性葡萄糖进入血液。
餐后糖血调节的这一问题对于服用胰岛素的2型糖尿病患者来说非常类似,是因为他们的疾病已导致他们的β细胞的质量有非常显著的损失,且因此他们产生胰岛素和胰淀素的能力有非常显著的损失。
就溶解性和稳定性而言,人胰淀素的性质与药物要求不相容(goldsburycs、coopergj、goldiekn、mullersa、saafiel、gruijterswt、misurmp、engela、aebiu、kistlerj:polymorphicfibrillarassemblyofhumanamylin.jstructbiol119:17-27,1997)。已知胰淀素会形成淀粉样纤维,其导致形成不溶于水的斑块。尽管其是天然激素,但仍有必要开发类似物,以便解决这些溶解性问题。
因此胰淀素的物理化学性质使其无法使用:胰淀素在酸性ph下仅稳定约十五分钟,且在中性ph下稳定不到一分钟。
amylin公司开发了一种胰淀素类似物-普兰林肽,用于缓解人胰淀素的稳定性的缺乏。以名称symlin销售的这种产品在2005年被fda批准用于治疗1型和2型糖尿病。其必须一天三次在饭前一小时内皮下施用,以便改善对餐后糖血的控制。这种肽在酸性ph下配制,并且被描述为当溶液的ph大于5.5时原纤化。专利us5.686.411中描述了类似物变体。
因此,当设想在中性ph下的制剂时,就稳定性而言,这种类似物并不令人满意。
迄今为止,还没有可能稳定人胰淀素以制备药品的办法。然而,对患者而言,能利用这种生理激素的人体形式将是有益的。还将有益的是能够配制ph中性胰淀素受体的类似物或激动剂。
此外,人们将希望能够将胰淀素水溶液、胰淀素类似物或胰淀素激动剂受体与餐时胰岛素混合,因为这两种产品要在饭前施用。这将进一步使得有可能模拟生理机能,因为这两种激素是由β细胞响应进食而共同分泌的,以便改善对餐后糖血的控制。
然而,考虑到事实上出于化学稳定性的原因,餐时胰岛素的溶液的ph接近中性,就溶解性和稳定性而言,不可能获得满足药物要求的水溶液。
由于这个原因,roche的专利申请us2016/001002描述了一种泵,其包括两个单独的储器,以使得有可能利用单个医疗装置共同施用这两种激素。然而,此专利并没有解决将这两种激素在溶液中混合的问题,而将这两种激素在溶液中混合将使得有可能用市场上已有的仅包括一个储器的常规泵来施用它们。
xeris的专利申请wo2013067022通过采用有机溶剂代替水对胰淀素稳定性及其与胰岛素的相容性问题提供解决方案。没有水似乎解决了稳定性问题,但有机溶剂的使用带来了有关糖尿病患者使用的长期安全性方面的问题,还有与标准医疗装置的相容性方面的问题,涉及所使用的管路、连接和增塑剂。
novonordisk的专利申请wo2007104786描述了一种方法,该方法通过添加衍生自甘油磷酸甘油酯、特别是衍生自二肉豆蔻酰甘油磷酸甘油酯(dmpg)的磷脂来使得有可能稳定作为胰淀素类似物的普兰林肽和胰岛素的溶液。然而,这种解决方案需要使用大量的dmpg,这可能会带来局部耐受性的问题。此外,如申请wo2018122278中所述,dmpg导致组合物在0-4℃下呈现相对较差的物理稳定性。
据申请人所知,还没有令人满意的办法使得有可能在水溶液中组合餐时胰岛素和人胰淀素、胰淀素激动剂受体或胰淀素类似物,以便能够用常规装置进行施用。
酸性制剂ph和快速原纤化是获得基于胰淀素和普兰林肽的中性ph的药物制剂的障碍,而且也是将胰淀素或普兰林肽与其它药物活性成分、特别是肽或蛋白质组合的障碍。
申请人观察到意外的是,根据本发明的共聚氨基酸在6.0至8.0的ph下稳定胰淀素、胰淀素激动剂受体或胰淀素类似物的组合物。实际上,包含胰淀素、胰淀素激动剂受体或胰淀素类似物与根据本发明的共聚氨基酸组合的组合物表现出随时间推移的稳定性提高,这对于药物开发非常有趣。
申请人还报道了根据本发明的共聚氨基酸使得有可能另外获得包含餐时胰岛素和胰淀素、胰淀素激动剂受体或胰淀素类似物的组合物,所述组合物是澄清的,并且针对原纤化的稳定性提高。
用于测量蛋白质或肽的稳定性的经典方法包括使用硫代黄素t(也称为tht)来测量原纤维的形成。这种方法使得有可能通过测量荧光的增加来测量原纤维形成之前的等待时间,并且在有可能使现象加速的温度和搅拌条件下进行测量。根据本发明的组合物在原纤维形成之前具有的等待期明显大于在所关注的ph下的胰淀素、胰淀素激动剂受体或胰淀素类似物的等待期。
根据本发明的组合物在所需ph下具有物理稳定性,并且可能具有化学稳定性。
在一个实施方案中,本发明涉及可注射水溶液形式的组合物,其ph包括6.0至8.0,至少包含:
a)胰淀素、胰淀素受体激动剂和胰淀素类似物;
b)带有羧酸根电荷及疏水基hy的共聚氨基酸,所述共聚氨基酸由谷氨酸或天冬氨酸单元组成,并且所述疏水基-hy选自根据如下所定义的式x的基团:
其中
-gpr选自根据式vii、vii'或vii”的基团:
-相同或不同的gpg和gph选自根据式xi或xi’的基团;
-gpa选自根据式viii的基团
其中a’选自根据式viii’、viii”或viii”’的基团
-gpl选自根据式xii的基团
gpc是根据式ix的基团:
-*指示由酰胺官能团结合的不同基团的连接位点;
-a是等于0或等于1的整数,且如果a=0,则a’=1,并且如果a=1,则a’=1、2或3;
-a’是等于1、等于2或等于3的整数;
-b是等于0或等于1的整数;
-c是等于0或等于1的整数,且如果c等于0,则d等于1或等于2;
-d是等于0、等于1或等于2的整数;
-e是等于0或等于1的整数;
-g是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数;
-h是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数,且g、h或l中的至少一者不同于0;
-l是等于0或等于1的整数,且如果l=0,则l’=1,并且如果l=1,则l’=2;
-r是等于0、1或等于2的整数,且
-s’是等于0或等于1的整数;
-并且如果e不同于0,则g、h或l中的至少一者不同于0;
-并且如果a=0,则l=0;
-a、a1、a2和a3相同或不同,为包含1至8个碳原子且任选被来自饱和、不饱和或芳族环的基团取代的直链或支链烷基;
-b是未取代的包含4至14个碳原子和1至5个氧原子的基团醚或聚醚,或任选包含芳族环的包含1至9个碳原子的直链或支链烷基。
-cx是任选包含环状部分的单价直链或支链烷基,其中x指示碳原子数,且:
■当疏水基-hy带有1个-gpc时,则9≤x≤25,
■当疏水基-hy带有2个-gpc时,则9≤x≤15,
■当疏水基-hy带有3个-gpc时,则7≤x≤13,
■当疏水基-hy带有4个-gpc时,则7≤x≤11,
■当疏水基-hy带有至少5个-gpc时,则6≤x≤11,
-g是1至8个碳原子的直链或支链二价烷基,所述烷基带有一个或多个游离羧酸官能团。
-r是选自由以下组成的组的基团:包含1至12个碳原子的二价直链或支链烷基;带有一个或多个-conh2官能团的包含1至12个碳原子的二价直链或支链烷基;或包含4至14个碳原子和1至5个氧原子的未取代的醚或聚醚基团。
-根据式x的疏水基-hy以如下方式与plg结合:
○经由疏水基-hy的羰基与plg所带有的氮原子之间的共价键,从而形成由plg所带有的胺官能团和疏水基-hy的前体-hy'所带有的酸官能团反应得到的酰胺官能团,和
○经由疏水基-hy的氮原子与plg所带有的羰基之间的共价键,从而形成由疏水基-hy的前体-hy’的胺官能团和plg所带有的酸官能团反应得到的酰胺官能团。
-疏水基数与谷氨酸或天冬氨酸单元数之间的比率m在0<m≤0.5之间;
-当几个疏水基由共聚氨基酸所带有时,则它们是相同的或不同的,
-plg链的谷氨酸或天冬氨酸单元的聚合度dp包括5至250;
-游离羧酸呈在由na+和k+组成的组中选择的碱阳离子盐形式。
在一个实施方案中,组合物的特征在于,组合物不包含等电点pi包括5.8至8.5的基础胰岛素。
在一个实施方案中,组合物的特征在于,组合物不包含glp-1、glp-1类似物或目前被称为glp-1ra的glp-1受体激动剂。
在一个实施方案中,组合物的特征在于,组合物既不包含等电点pi为5.8至8.5的基础胰岛素,也不包含glp-1、glp-1类似物或目前被称为glp-1ra的glp-1受体激动剂。
在一个实施方案中,本发明涉及不含等电点pi包括5.8至8.5的基础胰岛素的组合物,其呈ph包括6.0至8.0的可注射水溶液的形式,至少包含:
a)胰淀素、胰淀素受体激动剂和胰淀素类似物;
b)带有羧酸根电荷及疏水基hy的共聚氨基酸,所述共聚氨基酸由谷氨酸或天冬氨酸单元组成,并且所述疏水基-hy选自根据如下所定义的式x的基团:
其中
-gpr选自根据式vii、vii'或vii”的基团:
-相同或不同的gpg和gph选自根据式xi或xi’的基团;
-gpa选自根据式viii的基团
其中a’选自根据式viii’、viii”或viii”’的基团
--gpl选自根据式xii的基团
-gpc是根据式ix的基团:
-*指示由酰胺官能团结合的不同基团的连接位点;
-a是等于0或等于1的整数,且如果a=1,则a’=1、2或3;
-a’是等于1、等于2或等于3的整数;
-b是等于0或等于1的整数;
-c是等于0或等于1的整数,且如果c等于0,则d等于1或等于2;
-d是等于0、等于1或等于2的整数;
-e是等于0或等于1的整数;
-g是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数;
-h是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数,且g、h或l中的至少一者不同于0;
-l是等于0或等于1的整数,且如果l=0,则l’=1,并且如果l=1,则l’=2;
-r是等于0、1或等于2的整数,且
-s’是等于0或等于1的整数;
-并且如果e不同于0,则g、h或l中的至少一者不同于0;
-并且如果a=0,则l=0;
-a、a1、a2和a3相同或不同,为包含1至8个碳原子且任选被来自饱和、不饱和或芳族环的基团取代的直链或支链烷基;
-b是未取代的包含4至14个碳原子和1至5个氧原子的基团醚或聚醚,或任选包含芳族环的包含1至9个碳原子的直链或支链烷基。
-cx是任选包含环状部分的单价直链或支链烷基,其中x指示碳原子数,且:
■当疏水基-hy带有1个-gpc时,则9≤x≤25,
■当疏水基-hy带有2个-gpc时,则9≤x≤15,
■当疏水基-hy带有3个-gpc时,则7≤x≤13,
■当疏水基-hy带有4个-gpc时,则7≤x≤11,
■当疏水基-hy带有至少5个-gpc时,则6≤x≤11,
-g是1至8个碳原子的直链或支链二价烷基,所述烷基带有一个或多个游离羧酸官能团。
-r是选自由以下组成的组的基团:包含1至12个碳原子的二价直链或支链烷基;带有一个或多个-conh2官能团的包含1至12个碳原子的二价直链或支链烷基;或包含4至14个碳原子和1至5个氧原子的未取代的醚或聚醚基团。
-根据式x的疏水基-hy以如下方式与plg结合:
○经由疏水基-hy的羰基与plg所带有的氮原子之间的共价键,从而形成由plg所带有的胺官能团和疏水基-hy的前体-hy'所带有的酸官能团反应得到的酰胺官能团,和
○经由疏水基-hy的氮原子与plg所带有的羰基之间的共价键,从而形成由疏水基-hy的前体-hy’的胺官能团和plg所带有的酸官能团反应得到的酰胺官能团。
-疏水基数与谷氨酸或天冬氨酸单元数之间的比率m在0<m≤0.5之间;
-当几个疏水基由共聚氨基酸所带有时,则它们是相同的或不同的,
-plg链的谷氨酸或天冬氨酸单元的聚合度dp包括5至250;
-游离羧酸呈在由na+和k+组成的组中选择的碱阳离子盐形式。
所谓“烷基”意指不包含杂原子的直链或支链碳链。
所述共聚氨基酸是谷氨酸和/或天冬氨酸单元链中的统计共聚氨基酸。
所述带有羧酸根电荷及疏水基hy的共聚氨基酸可在25℃的温度下以低于100mg/ml的浓度溶于ph为6.0至8.0的水溶液。
根据本发明呈可注射水溶液形式的组合物是澄清溶液。所谓“澄清溶液”意指满足美国和欧洲药典中关于可注射溶液所述的标准的组合物。在美国药典中,针对注射(<1>)在<1151>部分中定义了溶液(根据usp35参考<788>,并且根据usp35在<788>中以及根据usp38在<787>、<788>和<790>usp38(从2014年8月1日起)中详细说明)。在欧洲药典中,可注射溶液必须符合第2.9.19和2.9.20部分中给出的标准。
所谓“可溶”意指适合制备在25℃蒸馏水中浓度小于100mg/ml的不含颗粒的澄清溶液。
所谓等电点为5.8至8.5的基础胰岛素意指这样的胰岛素,其在ph7下不溶,并且其在标准糖尿病模型中的作用持续时间包括8至24小时或长于24小时。
式中的*指示所示各元素的连接位点。
在一个实施方案中,hy包含超过30个碳原子。
在一个实施方案中,根据本发明的组合物的特征在于,hy包含15至100个碳原子。
在一个实施方案中,根据本发明的组合物的特征在于,hy包含30至70个碳原子。
在一个实施方案中,根据本发明的组合物的特征在于,hy包含40至60个碳原子。
在一个实施方案中,根据本发明的组合物的特征在于,hy包含20至30个碳原子。
在一个实施方案中,当a’=1时,x包括11至25(11≤x≤25)。具体地,当x包括15和16(x=15或16)时,则r=1,且r是醚或聚醚基团,并且当x大于17(x≥17)时,则r=1,且r是醚或聚醚基团。
在一个实施方案中,当a’=2时,x包括9至15(9≤x≤15)。
在一个实施方案中,组合物的特征在于,ph包括6.6至7.8。
在一个实施方案中,组合物的特征在于,ph包括7.0至7.8。
在一个实施方案中,组合物的特征在于,ph包括6.8至7.4。
在一个实施方案中,当r=2时,则与plg结合的gpr基团选自根据式vii的gpr。
在一个实施方案中,当r=2时,则与plg结合的gpr基团选自根据式vii的gpr,且第二个gpr选自根据式vii”的gpr。
在一个实施方案中,当r=2时,则与plg结合的gpr基团选自根据式vii”的gpr。
在一个实施方案中,当r=2时,则与plg结合的gpr基团选自根据式vii”的gpr,且第二个gpr选自根据式vii的gpr。
在一个实施方案中,g、h或l中的至少一者不同于0。
在一个实施方案中,g、h或l中的至多一者不同于0。
在一个实施方案中,g和h中的至少一者等于1。
在一个实施方案中,a=1,且l=1。
在一个实施方案中,如果l=0,则g或h中的至少一者等于0。
在一个实施方案中,如果l=1,则g和h中的至少一者等于0。
在一个实施方案中,g=h=0,a=1,gpa是根据式viii的基团,其中s’=1且a’根据式viii'或viii”,并且l=1。
在一个实施方案中,g和h中的至少一者等于1。
在一个实施方案中,a=0。
在一个实施方案中,g+h≥2。
在一个实施方案中,g大于或等于2(g≥2)。
在一个实施方案中,h大于或等于2(g≥2)。
在一个实施方案中,g+h≥2且l等于0(a=1=0)。
在一个实施方案中,g+h≥2且b等于0(b=0)。
在一个实施方案中,g或h大于或等于2(g≥2),且b等于0。
在一个实施方案中,g+h≥2,b等于0(b=0),且e等于1(e=1)。
在一个实施方案中,g或h大于或等于2(g≥2),b等于0(b=0),且e等于1(e=1)。
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中根据如下所定义的式xc’,r=2:
其中gpr1是根据式vii的基团。
其中gpr、gpg、gpa、gpl、gph、gpc、r、a、a’、g、h、l和l’具有上面给出的定义。
在一个实施方案中,所述疏水基-hy选自根据式x的基团,其中根据如下所定义的式xc’,r=2::
其中gpr1是根据式vii”的基团。
其中gpr、gpg、gpa、gpl、gph、gpc、r、a、a’、g、h、l和l’具有上面给出的定义。
在一个实施方案中,所述疏水基-hy选自根据式x的基团,其中
-l=0,
-根据如下所定义的式xd。
其中
-gpr选自根据式vii、vii'或vii”的基团:
-gpg选自根据式xi或xi’的基团:
-gpa选自根据式viii的基团,其中s’=1,由式viiia表示,或式viii的基团,其中且s’=0,由式viiib表示:
-gpc是根据式ix的基团:
-*指示由酰胺官能团结合的不同基团的连接位点;
-a是等于0或等于1的整数,且如果a=0,则a’=1’,并且如果a=1,则a’=1或a’=2;
-a’是等于1或等于2的整数,且;
○如果a’等于1,则a等于0或等于1,并且gpa是根据式viiib的基团,且
○如果a’等于2,则a等于1,并且gpa是根据式viiia的基团;
-b是等于0或等于1的整数;
-c是等于0或等于1的整数,且如果c等于0,则d等于1或等于2;
-d是等于0、等于1或等于2的整数;
-e是等于0或等于1的整数;
-g是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数;
-h是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数,且g或h中的至少一者不同于0;
-r是等于0、1或等于2的整数,且
-s’是等于0或等于1的整数;
-并且如果e不同于0,则g、h或l中的至少一者不同于0;
-并且如果a=0,则l=0;
-a1是包含1至8个碳原子且任选被来自饱和、不饱和或芳族环的基团取代的直链或支链烷基;
-b是未取代的包含4至14个碳原子和1至5个氧原子的基团醚或聚醚,或任选包含芳族环的包含1至9个碳原子的直链或支链烷基;
-cx是任选包含环状部分的单价直链或支链烷基,其中x指示碳原子数,且:
■当疏水基-hy带有1个-gpc时,则9≤x≤25,
■当疏水基-hy带有2个-gpc时,则9≤x≤15,
■当疏水基-hy带有3个-gpc时,则7≤x≤13,
■当疏水基-hy带有4个-gpc时,则7≤x≤11,
■当疏水基-hy带有至少5个-gpc时,则6≤x≤11,
-g是1至8个碳原子的烷基,所述烷基带有一个或多个游离羧酸官能团。
-r是选自由以下组成的组的基团:包含1至12个碳原子的二价直链或支链烷基;带有一个或多个-conh2官能团的包含1至12个碳原子的二价直链或支链烷基;或包含4至14个碳原子和1至5个氧原子的未取代的醚或聚醚基团。
-根据式x的一个或多个疏水基hy以如下方式与plg结合:
○经由疏水基-hy的羰基与plg所带有的氮原子之间的共价键,从而形成由plg所带有的胺官能团和疏水基的-hy前体所带有的酸官能团反应得到的酰胺官能团,和
○经由疏水基-hy的氮原子与plg所带有的羰基之间的共价键,从而形成由疏水基的-hy前体的胺官能团和plg所带有的酸官能团反应得到的酰胺官能团。
-疏水基数与谷氨酸或天冬氨酸单元数之间的比率m包括0<m≤0.5;
-当几个疏水基由共聚氨基酸所带有时,则它们是相同的或不同的,
-游离羧酸呈在由na+和k+组成的组中选择的碱阳离子盐形式。
在一个实施方案中,所述疏水-hy选自根据如下所定义的式x的基团,其中l=0,
-gpa选自根据式viii的基团,其中s’=1,且a’选自根据式viii”或viii’”的基团;
其中
-gpr选自根据式vii、vii'或vii”的基团:
-gpg选自根据式xi或xi’的基团:
-gpa选自根据式viiic或viiid的基团:
-gpc是根据式ix的基团:
-*指示由酰胺官能团结合的不同基团的连接位点;
-a是等于0或等于1的整数,且如果a=0,则a’=1,或者如果a=1,则a’=2或3;
-a’是等于2或等于3的整数,且;
○如果a’等于1,则a等于0,且
○如果a’等于2或3,则a等于1,且gpa是根据式viiic或viiid的基团;
-b是等于0或等于1的整数;
-c是等于0或等于1的整数,且如果c等于0,则d等于1或等于2;
-d是等于0、等于1或等于2的整数;
-e是等于0或等于1的整数;
-g是等于1、等于2、等于3、等于4、等于5或等于6的整数;
-h是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数,且g或h中的至少一者不同于0;
-r是等于0、1或等于2的整数,且
-s’是等于1的整数;
-并且如果e不同于0,则g、h或l中的至少一者不同于0;
-并且如果a=0,则l=0;
-a1、a2、a3相同或不同,为包含1至8个碳原子且任选被来自饱和、不饱和或芳族环的基团取代的直链或支链烷基;
-b是未取代的包含4至14个碳原子和1至5个氧原子的基团醚或聚醚,或任选包含芳族环的包含1至9个碳原子的直链或支链烷基;
-cx是任选包含环状部分的单价直链或支链烷基,其中x指示碳原子数,且:
■当疏水基-hy带有1个-gpc时,则9≤x≤25,
■当疏水基-hy带有2个-gpc时,则9≤x≤15,
■当疏水基-hy带有3个-gpc时,则7≤x≤13,
■当疏水基-hy带有4个-gpc时,则7≤x≤11,
■当疏水基-hy带有至少5个-gpc时,则6≤x≤11,
-根据式x的一个或多个疏水基hy以如下方式与plg结合:
○经由疏水基的羰基与plg所带有的氮原子之间的共价键,从而形成由plg所带有的胺官能团和疏水基的前体-hy'所带有的酸官能团反应得到的酰胺官能团,和
○经由疏水基的氮原子与plg所带有的羰基之间的共价键,从而形成由疏水基的-hy前体的胺官能团和plg所带有的酸官能团反应得到的酰胺官能团。
-g是1至8个碳原子的烷基,所述烷基带有一个或多个游离羧酸官能团。
-r是选自由以下组成的组的基团:包含1至12个碳原子的二价直链或支链烷基;带有一个或多个-conh2官能团的包含1至12个碳原子的二价直链或支链烷基;或包含4至14个碳原子和1至5个氧原子的未取代的醚或聚醚基团。
-疏水基数与谷氨酸或天冬氨酸单元数之间的比率m在0<m≤0.5之间;
-当几个疏水基由共聚氨基酸所带有时,则它们是相同的或不同的,
-游离羧酸呈在由na+和k+组成的组中选择的碱阳离子盐形式。
在一个实施方案中,r=0,且根据式x的疏水基经由疏水基的羰基与plg所带有的氮原子之间的共价键与plg结合,从而形成由plg前体所带有的胺官能团和疏水基的前体hy'所带有的酸官能团反应得到的酰胺官能团,和
在一个实施方案中,r=1,且根据式x的疏水基以如下方式与plg结合:
■经由疏水基的氮原子与plg所带有的羰基之间的共价键。从而形成由疏水基的前体-hy’的胺官能团和plg所带有的酸官能团反应得到的酰胺官能团,或
■经由疏水基的羰基与plg所带有的氮原子之间的共价键,从而形成由疏水基-hy的前体-hy’的酸官能团和plg所带有的胺官能团反应得到的酰胺官能团。
在一个实施方案中,如果gpa是根据式viiic的基团,且r=1或2,则:
-gpc直接或间接与nα1和nα2结合,并且plg直接或经由gpr间接与nβ1结合,或者
-gpc直接或间接与nα1和nβ1结合,并且plg直接或经由gpr间接与nα2结合;或者
-gpc直接或间接与nα2和nβ1结合,并且plg直接或经由gpr间接与nα1结合。
在一个实施方案中,如果gpa是根据式viiic的基团,且r=0,则:
-gpc直接或间接与nα1和nα2结合,并且plg直接或间接与nβ1结合;或者
-gpc直接或间接与nα1和nβ1结合,并且plg直接或间接与nα2结合;或者
-gpc直接或间接与nα2和nβ1结合,并且plg直接或间接与nα1结合。
在一个实施方案中,如果gpa是根据式viiid的基团,且r=1或2,则
-gpc直接或间接与nα1、nα2和nβ1结合,并且plg直接或经由gpr间接与nβ2结合;或者
-gpc直接或间接与nα1、nα2和nβ2结合,并且plg直接或经由gpr间接与nβ1结合;或者
-gpc直接或间接与nα1、nβ1和nβ2结合,并且plg直接或经由gpr间接与nα2结合;或者
-gpc直接或间接与nα2、nβ1和nβ2结合,并且plg直接或经由gpr间接与nα1结合
在一个实施方案中,如果gpa是根据式viiid的基团,且r=0,则
-gpc直接或间接与nα1、nα2和nβ1结合,并且plg直接或间接与nβ2结合;或者
-gpc直接或间接与nα1、nα2和nβ2结合,并且plg直接或间接与nβ1结合;或者
-gpc直接或间接与nα1、nβ1和nβ2结合,并且plg直接或间接与nα2结合;或者
gpc直接或间接与nα2、nβ1和nβ2结合,并且plg直接或间接与nα1结合
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中根据如下所定义的式xa,a=1且a’=1:
其中gpa是根据式viii的基团,并且a’选自根据式viii’的基团,其中s’=0,且gpa是根据式viiib的基团。
且gpr、gpg、gpl、gph、gpc、a1、r、g、h、l和l’具有上面给出的定义。
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中根据如下所定义的式xb,a=1:
其中gpa是根据式viii的基团,并且a’选自根据式viii’的基团,其中s’=1,且gpa是根据式viiia的基团。
且gpr、gpg、gpl、gph、gpc、a1、a’、r、g、h、l和l’具有上面给出的定义。
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中如下所定义,a=1:
其中gpa是根据式viii的基团,并且a选自根据式viii”的基团,其中s’=1,且gpa是根据式viiic的基团。
且gpr、gpg、gpl、gph、gpc、a1、a2、r、g、h、a’、l和l’具有上面给出的定义。
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中a=1
如下所定义:
其中gpa是根据式viii的基团,并且a选自根据式viii”’的基团,其中s’=1,且gpa是根据式viiid的基团。
且gpr、gpg、gpl、gph、gpc、a1、a2、a3、a’、r、g、h、l和l’具有上面给出的定义。
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中根据如下所定义的式xc,r=1:
其中gpr是根据式vii的基团。
且gpr、gpa、gpl、gph、gpc、r、a、g、h、l、a’和l’具有上面给出的定义。
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中根据如下所定义的式xc,r=1:
其中gpr是根据式vii’的基团。
且gpr、gpa、gpl、gph、gpc、r、a、g、h、l、a’和l’具有上面给出的定义。
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中根据如下所定义的式xc,r=1:
其中gpr是根据式vii”的基团。
且gpr、gpa、gpl、gph、gpc、r、a、g、h、l、a’和l’具有上面给出的定义。
在一个实施方案中,所述至少一个疏水基-hy选自根据如下所定义的式x的基团:
其中gpc是根据式ix的基团,其中e=0,且gpc是根据式ixa’的基团。
在一个实施方案中,所述至少一个疏水基-hy选自根据如下所定义的式x的基团:
其中gpc是根据式ix的基团,其中e=1,b=0,且gpc是根据式ixd’的基团。
在一个实施方案中,所述至少一个疏水基-hy选自根据如下所定义的式x的基团:
其中gpc是根据式ix的基团,其中e=1,且gpc是根据式ixd’的基团。
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中根据如下所定义的式xd’,r、g、a、l、h等于0:
*-gpc式xd’。
在一个实施方案中,所述至少一个疏水基-hy选自根据式x的基团,其中根据如下所定义的式xd’,r、g、a、l、h等于0:
*-gpc式xd’
其中gpc是根据式ix的基团,其中e=0,b=0,且gpc是根据式ixc’的基团。
在一个实施方案中,根据本发明的组合物的特征在于,所述疏水基选自根据式x的疏水基,其中gpa是根据式viiib的基团,a’=1且l=0。
gpr、gpg、gpa、gph、gpc、r、g、h和a具有上面给出的定义。
在一个实施方案中,根据本发明的组合物的特征在于,所述疏水基选自根据式x的疏水基,其中a’=2,且a=1,并且l=0,由下式xf表示:
gpr、gpg、gpa、gph、gpc、r、g和h具有上面给出的定义。
在一个实施方案中,根据本发明的组合物的特征在于,所述疏水基选自根据式x的疏水基,其中h=0,l=0,且l’=1,由下式xg表示:
gpr、gpg、gpa、gpc、r、g、a和a’具有上面给出的定义。
在一个实施方案中,根据本发明的组合物的特征在于,所述疏水基选自根据式x的疏水基,其中h=0,a’=1,由下式xh表示:
gpr、gpg、gpa、gpc、r、a和g具有上面给出的定义。
在一个实施方案中,根据本发明的组合物的特征在于,所述疏水基选自根据式x的疏水基,其中h=0,a’=2,且a=1,由下式xi表示:
gpr、gpg、gpa、gpc、r和g具有上面给出的定义。
在一个实施方案中,a=0,
在一个实施方案中,h=1,且g=0,
在一个实施方案中,h=0,且g=1,
在一个实施方案中,r,=0,g=1,且h=0。
在一个实施方案中,r=1,且gpr选自根据式vii'或vii”的基团,并且h=0。
在一个实施方案中,r=1,g=0,且gpr是根据式vii’的基团,并且h=0。
在一个实施方案中,r=1,g=0,且gpr是根据式vii’的基团,并且h=1。
在一个实施方案中,r=1,g=0,且gpr是根据式vii’的基团,gpa选自根据式viiia或viiib的基团,并且h=0。
在一个实施方案中,r=1,g=0,gpr是根据式vii’的基团,gpa选自根据式viia'或viiib的基团,并且h=1。
在一个实施方案中,r=1,g=0,且gpr是根据式vii’的基团,gpa是根据式viiia的基团,并且h=0。
在一个实施方案中,r=1,g=0,gpr是根据式vii’的基团,gpa是根据式viiia的基团,并且h=1。
在一个实施方案中,r=1,g=0,gpr是根据式vii’的基团,gpa是根据式viiib的基团,并且h=0。
在一个实施方案中,r=1,g=0,gpr是根据式vii’的基团,gpa是根据式viiib的基团,并且h=1。
在一个实施方案中,r=0,且gpa选自根据式viiia和viiib的基团。
在一个实施方案中,r=0,g=0,且gpa选自根据式viiia和viiib的基团。
在一个实施方案中,r=0,gpa选自根据式viiia和viiib的基团,且h=0。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含2至12个碳原子的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含2至6个碳原子的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含2至6个碳原子的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含2至4个碳原子的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含2至4个碳原子的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含2个碳原子的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含1至11个碳原子的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含1至6个碳原子的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含2至5个碳原子且带有或多个酰胺官能团(-conh2)的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含2至5个碳原子且带有或多个酰胺官能团(-conh2)的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是这样的基团,其中r是选自由下式表示的基团组成的组的基团:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为根据式x1的基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为根据式x2的基团的基团。
在一个实施方案中,组合物的特征在于,根据式x的疏水基是这样的基团,其中r经由酰胺官能团与共聚氨基酸结合,该酰胺官能团由相对于酰胺官能团(-conh2)的δ或ε位(或者4或5位)上的碳所带有。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含4至14个碳原子和1至5个氧原子的未取代的直链醚或聚醚基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为醚基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含4至6个碳原子的醚基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含6个碳原子的二价直链烷基的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为由式
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为聚醚基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为包含6至10个碳原子和2至3个氧原子的直链聚醚基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是这样的基团,其中r是选自由下式表示的基团组成的组的聚醚基团:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为根据式x3的基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为根据式x4的基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是这样的基团,其中r是选自由下式x5和x6表示的基团组成的组的聚醚基团:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为根据式x5的聚醚基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中r为根据式x6的聚醚基团的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是这样的基团,其中gpg和/或gph基团是根据式xi’,其中g是由下式z表示的包含6个碳原子的烷基:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中根据式xi包含gpg和/或gph的基团,其中g是由下式z表示的包含4个碳原子的烷基:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中根据式xi包含gpg和/或gph基团的基团,其中g是由-(ch2)2-ch(cooh)一表示的包含4个碳原子的烷基。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中根据式xi包含gpg和/或gph基团的基团,其g是由-ch((ch2)2cooh)-表示的包含4个碳原子的烷基。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中根据式xi包含gpg和/或gph基团的基团,其中g是由式-ch2-ch-(cooh)表示的包含3个碳原子的烷基。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是其中根据式xi包含gpg和/或gph的基团,其中g基团是由-ch(ch2)cooh)-表示的包含3个碳原子的烷基。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xa、xb、xc、xd、xe、xf、xg、xh和xi的疏水基是这样的基团,其中根据式viii包含gpa基团,且其中a1、a2或a3选自由下式表示的基团组成的组:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中根据式ix的基团gpc选自由下式ixe、ixf或ixg表示的基团组成的组的基团:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是这样的基团,其中根据式ix的基团gpc选自由式ixe、ixf或ixg组成的组,其中b等于0,分别对应于下面表示的式ixh、ixi和ixj:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中gpc基团对应于式ix或ixe的基团,其中b=0且对应于式ixh。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由直链烷基组成的组的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由支链烷基组成的组的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xd、xe、xf、xg、xh和xi的疏水基是其中cx选自由包含19至14个碳原子的烷基组成的组的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由下式表示的基团组成的组的基团:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由包含15至16个碳原子的烷基组成的组的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由下式表示的基团组成的组的基团:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由下式表示的基团组成的组的基团:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由包含17至25个碳原子的烷基组成的组的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由包含17至18个碳原子的烷基组成的组的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由下式表示的烷基组成的组的基团:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由包含18至25个碳原子的烷基组成的组的基团。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中cx选自由下式表示的烷基组成的组的基团:
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基,其中根据式ix的gpc基团选自由这样的基团组成的组,其中cx选自由包含14至15个碳原子的烷基组成的组。
在一个实施方案中,组合物的特征在于,根据式x、xc’、xd、xa、xb、xd’、xc、xe、xf、xg、xh和xi的疏水基是其中根据式ix的gpc基团选自由这样的基团组成的组的基团,其中cx选自由下式表示的基团组成的组:
在一个实施方案中,共聚氨基酸选自式xxxb的共聚氨基酸,其中疏水基-hy选自根据式x、xc’、xdxa、xb、xc、xe、xg和xh的疏水基的组,其中a’=1,且l’=1,并且gpc是根据式ixe的基团。
在一个实施方案中,共聚氨基酸选自式xxxb的共聚氨基酸,其中疏水基-hy选自根据式x、xc’、xd、xa、xb、xc、xe、xg和xh的疏水基的组,其中a’=1,且l’=1,并且gpc是根据式ix的基团,其中e=0。
在一个实施方案中,共聚氨基酸选自式xxxb的共聚氨基酸,其中疏水基-hy选自根据式x、xc’、xd、xa、xb、xc、xf、xg和xi的疏水基的组,其中a’=2或l’=2,并且gpc是根据式ixe的基团。
在一个实施方案中,共聚氨基酸选自式xxxb的共聚氨基酸,其中疏水基-hy选自根据式x、xc’、xd、xa、xb、xc、xf、xg和xi的疏水基的组,其中a’=2,且l’=2,并且gpc是根据式ix的基团,其中e=0。
在一个实施方案中,共聚氨基酸选自式xxxa的共聚氨基酸,其中疏水基-hy选自根据式x、xc’、xd、xa、xb、xc、xe、xg和xh的疏水基的组,其中a’=1,且l’=1,并且gpc是根据式ixe的基团。
在一个实施方案中,共聚氨基酸选自根据式xxxa的共聚氨基酸,其中疏水基-hy选自根据式x、xc’、xd、xa、xb、xc、xf、xg和xi的疏水基的组,其中a’=2或l’=2,并且gpc是根据式ixe的基团。
在一个实施方案中,共聚氨基酸选自根据式x的共聚氨基酸的组,其中gpr是根据式vii的基团,gph是根据式xi的基团,且gpc是根据式ix的基团,其中e=1且b=0。
在一个实施方案中,共聚氨基酸选自根据式x的共聚氨基酸的组,其中gpr是根据式vii的基团,gph是根据式xi的基团,且gpc是根据式ix的基团,其中e=1且b=0,并且x=13。
在一个实施方案中,共聚氨基酸是聚-l-谷氨酸钠,其根据下面在实施例b1中描述所示的化学式在其末端之一被修饰。
在一个实施方案中,共聚氨基酸是聚-l-谷氨酸钠,其根据下面在实施例b18中描述所示的化学式在其末端之一被修饰。
在式中,*指示疏水基与plg或不同的基团gpr、gpg、gpa、gpl与gpc之间用以形成酰胺官能团的连接位点。
hy基团经由酰胺官能团与plg连接。
hy、gpr、gpg、gpa、gpl和gpc基团彼此是各自独立地相同或不同的残基。
在一个实施方案中,组合物的特征在于,带有羧酸根电荷及疏水基的共聚氨基酸选自根据下式xxx的共聚氨基酸:
其中,
●d独立地表示-ch2-基团(天冬氨酸单元)或-ch2-ch2-基团(谷氨酸单元),
●hy是选自根据式x的疏水基的疏水基,
●r1是选自根据式x的疏水基的疏水基,其中r=0或r=1,并且gpr是根据式vii'或vii”的基团,或选自由以下组成的组的基团:h、c2至c10的直链酰基、c3至c10的支链酰基、苄基、末端“氨基酸”单元和焦谷氨酸根,
●r2是选自根据式x的疏水基的疏水基或-nr'r”,r’和r”基团相同或不同,选自由h、c2至c10的直链、支链或环状烷基、苄基组成的组,且所述r’和r”烷基可一起形成一个或多个碳饱和的、不饱和的和/或芳族的环,和/或可包含选自由o、n和s组成的组的杂原子,
●x表示h或选自包括金属阳离子的组的阳离子实体;
●n+m表示共聚氨基酸的聚合度dp,即每一共聚氨基酸链的单体单元的平均数,且5≤n+m≤250。
在本说明书中,带有羧酸根电荷及至少一个根据式x的疏水基的共聚氨基酸也可以被称为“共聚氨基酸”。
我们称“统计共聚氨基酸”为带有羧酸根电荷及至少一个疏水基的共聚氨基酸,即根据式xxxa的共聚氨基酸。
在一个实施方案中,组合物的特征在于,带有羧酸根电荷及疏水基的共聚氨基酸选自根据式xxx的共聚氨基酸,其中根据下式xxxa,r1=r’1,且r2=r'2:
其中,
-m、n、x、d和hy具有上面给出的定义,
-r’1是选自由h、c2至c10的直链酰基、c3至c10的支链酰基、苄基、末端“氨基酸”单元和焦谷氨酸根组成的组的基团,
-r'2是选自由h、c2至c10的直链、支链或环状烷基、苄基组成的组的疏水基,且所述r’和r”烷基可一起形成一个或多个碳饱和的、不饱和的和/或芳族的环,和/或可以包含选自由o、n和s组成的组的杂原子,
我们称“统计共聚氨基酸”为带有羧酸根电荷及至少一个疏水基的共聚氨基酸,即根据式xxxb的共聚氨基酸。
在一个实施方案中,组合物的特征在于,带有羧酸根电荷及疏水基的共聚氨基酸选自根据式xxx的共聚氨基酸,其中根据下式xxxb,n=0:
其中m、x、d、r1和r2具有上面给出的定义,并且至少r1或r2是根据式x的疏水基。
在一个实施方案中,组合物的特征在于,带有羧酸根电荷及疏水基的共聚氨基酸选自根据式xxx的共聚氨基酸,其中其中根据式xxxb,n=0,且r1或r2是根据式x的疏水基。
在一个实施方案中,组合物的特征在于,带有羧酸根电荷及疏水基的共聚氨基酸选自根据式xxxb的共聚氨基酸,其中r1是根据式x的疏水基,其中r=0,或者r=1,并且根据式vii’包含gpr。
在一个实施方案中,组合物的特征在于,带有羧酸根电荷及疏水基的共聚氨基酸选自根据式xxxb的共聚氨基酸,其中r1是根据式x的疏水基,其中r=0,或者r=1,并且根据式vii”包含gpr。
在一个实施方案中,组合物的特征在于,带有羧酸根电荷及疏水基的共聚氨基酸选自根据式xxxb的共聚氨基酸,其中r2是根据式x的疏水基。
在一个实施方案中,组合物的特征在于,r1是选自由c2至c10直链酰基、c3至c10支链酰基、苄基、末端“氨基酸”单元和焦谷氨酸根组成的组的基团。
在一个实施方案中,组合物的特征在于,r1是选自由c2至c10直链酰基或c3至c10支链酰基组成的组的基团。
在一个实施方案中,组合物的特征在于,带有羧酸根电荷及疏水基的共聚氨基酸选自根据式xxx、xxxa或xxxb的共聚氨基酸,其中d基团是-ch2-基团(天冬氨酸单元)。
在一个实施方案中,组合物的特征在于,带有羧酸根电荷及疏水基的共聚氨基酸选自根据式xxx、xxxa或xxxb的共聚氨基酸,其中d基团是-ch2-ch2-基团(谷氨酸单元)。
在一个实施方案中,组合物的特征在于,疏水基数与谷氨酸或天冬氨酸单元数之间的m比率包括0.007至0.3。
在一个实施方案中,组合物的特征在于,疏水基数与谷氨酸或天冬氨酸单元数之间的m比率包括0.01至0.3。
在一个实施方案中,组合物的特征在于,疏水基数与谷氨酸或天冬氨酸单元数之间的m比率包括0.02至0.2。
在一个实施方案中,根据本发明的组合物的特征在于,n+m包括10至250。
在一个实施方案中,组合物的特征在于,n+m包括10至200。
在一个实施方案中,组合物的特征在于,n+m包括15至150。
在一个实施方案中,组合物的特征在于,n+m包括15至100。
在一个实施方案中,组合物的特征在于,n+m包括15至80。
在一个实施方案中,组合物的特征在于,n+m包括15至65。
在一个实施方案中,组合物的特征在于,n+m包括20至60。
在一个实施方案中,组合物的特征在于,n+m包括20至50。
在一个实施方案中,组合物的特征在于,n+m包括20至40。
本发明还涉及带有羧酸根电荷及疏水基hy的共聚氨基酸,所述共聚氨基酸由谷氨酸或天冬氨酸单元组成,且所述疏水基-hy选自根据如下所定义的式x的基团:
其中
gpr选自根据式vii、vii'或vii”的基团:
-相同或不同的gpg和gph选自根据式xi或xi’的基团;
-gpa选自根据式viii的基团
其中a’选自根据式viii’、viii”或viii”’的基团
--gpl选自根据式xii的基团
-gpc是根据式ix的基团:
-*指示由酰胺官能团结合的不同基团的连接位点;
-a是等于0或等于1的整数,且如果a=1,则a’=1、2或3;
-a’是等于1、等于2或等于3的整数;
-b是等于0或等于1的整数;
-c是等于0或等于1的整数,且如果c等于0,则d等于1或等于2;
-d是等于0、等于1或等于2的整数;
-e是等于0或等于1的整数;
-g是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数;
-h是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数,且g、h或l中的至少一者不同于0;
-l是等于0或等于1的整数,且如果l=0,则l’=1,并且如果l=1,则l’=2;
-r是等于0、1或等于2的整数,且
-s’是等于0或等于1的整数;
-并且如果e不同于0,则g、h或l中的至少一者不同于0;
-并且如果a=0,则l=0;
-a、a1、a2和a3相同或不同,为包含1至8个碳原子且任选被来自饱和、不饱和或芳族环的基团取代的直链或支链烷基;
-b是未取代的包含4至14个碳原子和1至5个氧原子的基团醚或聚醚,或任选包含芳族环的包含1至9个碳原子的直链或支链烷基。
-cx是任选包含环状部分的单价直链或支链烷基,其中x指示碳原子数,且:
■当疏水基-hy带有1个-gpc时,则9≤x≤25,
■当疏水基-hy带有2个-gpc时,则9≤x≤15,
■当疏水基-hy带有3个-gpc时,则7≤x≤13,
■当疏水基-hy带有4个-gpc时,则7≤x≤11,
■当疏水基-hy带有至少5个-gpc时,则6≤x≤11,
-g是1至8个碳原子的直链或支链二价烷基,所述烷基带有一个或多个游离羧酸官能团。
-r是选自由以下组成的组的基团:包含1至12个碳原子的二价直链或支链烷基;带有一个或多个-conh2官能团的包含1至12个碳原子的二价直链或支链烷基;或包含4至14个碳原子和1至5个氧原子的未取代的醚或聚醚基团。
-根据式x的疏水基-hy以如下方式与plg结合:
○经由疏水基-hy的羰基与plg所带有的氮原子之间的共价键,从而形成由plg所带有的胺官能团和疏水基-hy的前体-hy'所带有的酸官能团反应得到的酰胺官能团,和
○经由疏水基-hy的氮原子与plg所带有的羰基之间的共价键,从而形成由疏水基-hy的前体-hy’的胺官能团和plg所带有的酸官能团反应得到的酰胺官能团。
-疏水基数与谷氨酸或天冬氨酸单元数之间的比率m在0<m≤0.5之间;
-当几个疏水基由共聚氨基酸所带有时,则它们是相同的或不同的,
-plg链的谷氨酸或天冬氨酸单元的聚合度dp包括5至250;
-游离羧酸呈在由na+和k+组成的组中选择的碱阳离子盐形式。
本发明还涉及根据如下所定义的式x’的疏水基-hy的前体hy’:
其中
gpr选自根据式vii、vii'或vii”的基团:
-同或不同的gpg和gph选自根据式xi或xi’的基团;
-gpa选自根据式viii的基团
其中a’选自根据式viii’、viii”或viii”’的基团
--gpl选自根据式xii的基团
-gpc是根据式ix的基团:
-*指示由酰胺官能团结合的不同基团的连接位点;
-a是等于0或等于1的整数,且如果a=1,则a’=1、2或3;
-a’是等于1、等于2或等于3的整数;
-b是等于0或等于1的整数;
-c是等于0或等于1的整数,且如果c等于0,则d等于1或等于2;
d是等于0、等于1或等于2的整数;
e是等于0或等于1的整数;
g是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数;
-h是等于0、等于1、等于2、等于3、等于4、等于5或等于6的整数,且g、h或l中的至少一者不同于0;
-l是等于0或等于1的整数,并且l’=0,且如果l=1,则l’=2;
-r是等于0、1或等于2的整数,且
-s’是等于0或等于1的整数;
-并且如果e不同于0,则g、h或l中的至少一者不同于0;
-并且如果a=0,则l=0;
-a、a1、a2和a3相同或不同,为包含1至8个碳原子且任选被来自饱和、不饱和或芳族环的基团取代的直链或支链烷基;
-b是未取代的包含4至14个碳原子和1至5个氧原子的基团醚或聚醚,或任选包含芳族环的包含1至9个碳原子的直链或支链烷基。
-cx是任选包含环状部分的单价直链或支链烷基,其中x指示碳原子数,且:
■当疏水基-hy带有1个-gpc时,则9≤x≤25,
■当疏水基-hy带有2个-gpc时,则9≤x≤15,
■当疏水基-hy带有3个-gpc时,则7≤x≤13,
■当疏水基-hy带有4个-gpc时,则7≤x≤11,
■当疏水基-hy带有至少5个-gpc时,则6≤x≤11,
-g是1至8个碳原子的直链或支链二价烷基,所述烷基带有一个或多个游离羧酸官能团。
-r是选自由以下组成的组的基团:包含1至12个碳原子的二价直链或支链烷基;带有一个或多个-conh2官能团的包含1至12个碳原子的二价直链或支链烷基;或包含4至14个碳原子和1至5个氧原子的未取代的醚或聚醚基团。
-根据式x的疏水基-hy以如下方式与plg结合:
○经由疏水基-hy的羰基与plg所带有的氮原子之间的共价键,从而形成由plg所带有的胺官能团和疏水基-hy的前体-hy'所带有的酸官能团反应得到的酰胺官能团,和
○经由疏水基-hy的氮原子与plg所带有的羰基之间的共价键,从而形成由疏水基-hy的前体-hy’的胺官能团和plg所带有的酸官能团反应得到的酰胺官能团。
-疏水基数与谷氨酸或天冬氨酸单元数之间的比率m在0<m≤0.5之间;
-当几个疏水基由共聚氨基酸所带有时,则它们是相同的或不同的,
-游离羧酸呈在由na+和k+组成的组中选择的碱阳离子盐形式。
胰淀素或胰岛淀粉样多肽(iapp)是37个残基的肽激素。其与胰岛素一起由胰腺β细胞以约100∶1的比率共同分泌。胰淀素通过如下方式在糖血调节中发挥作用:停止分泌内源性胰高血糖素,减缓胃排空并支持饱腹感,从而减少血糖的餐后糖血波动。
iapp利用89个残基的编码序列吸收。淀粉样多肽前胰岛(proiapp,前胰淀素,前胰岛蛋白)在胰腺β细胞中以67个氨基酸derso前肽(7404道尔顿)的形式产生,并经历包括蛋白酶切割的翻译后修饰以产生胰淀素。
在本申请中,所提到的胰淀素是指专利us5,124,314和us5,234,906中描述的化合物。
所谓“类似物”当用于指肽或蛋白质时意指这样的肽或蛋白质,其中组成初级序列的一个或多个氨基酸残基已被其它氨基酸残基取代,和/或其中已增加了一个或多个组成氨基酸残基。类似物的此定义允许的同源性百分比为50%。在胰淀素的情况下,类似物可例如通过取代一种或多种天然或非天然或模拟肽的酸而衍生自初级胰淀素氨基酸序列。
所谓“衍生的”当用于指肽或蛋白质时意指被所提到的肽或蛋白质或类似物中不存在的取代基化学修饰的肽或蛋白质或类似物,即通过产生共价键被修饰的肽或蛋白质,是为了引入非氨基酸型取代基。
胰淀素受体激动剂是指模拟胰淀素作用的一项或多项特征的化合物。
在论文yan等人,pnas,第103卷,第7期,第2046-2051页,2006中描述了胰淀素衍生物。
在一个实施方案中,取代基选自由脂肪链组成的组。
专利us5,686,411、us6,114,304或us6,410,511中描述了胰淀素类似物。
在一个实施方案中,组合物的特征在于,胰淀素、胰淀素受体激动剂或胰淀素类似物是胰淀素。
在一个实施方案中,胰淀素受体激动剂是胰淀素。
在一个实施方案中,组合物的特征在于,胰淀素类似物或胰淀素受体激动剂是由astrazenecaab公司销售的普兰林肽
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比大于或等于1。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括1.5至75。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括1.8至50。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括2至35。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括2.5至30。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括3至30。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括3.5至30。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括4至30。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括5至30。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括7至30。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括9至30。
在一个实施方案中,共聚氨基酸/胰淀素摩尔比包括3至75。
在一个实施方案中,共聚氨基酸/胰淀素摩尔比包括7至50。
在一个实施方案中,共聚氨基酸/胰淀素摩尔比包括10至30。
在一个实施方案中,共聚氨基酸/胰淀素摩尔比包括15至30。
在一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括1.5至75。
在一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括2至50。
在一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括3至30。
在一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括4至30。
在一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括5至30。
在一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括8至30。
在一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括10至30。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括1.5至150。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括1.8至100。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括2至70。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括2.5至60。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括3至60。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括3.5至60。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括4至60。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括5至60。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括7至60。
在一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括9至60。
在一个实施方案中,疏水基hy/胰淀素摩尔比包括5至60。
在一个实施方案中,疏水基hy/胰淀素摩尔比包括10至60。
在一个实施方案中,疏水基hy/胰淀素摩尔比包括15至60。
在一个实施方案中,疏水基hy/普兰林肽摩尔比包括1.5至60。
在一个实施方案中,疏水基hy/普兰林肽摩尔比包括2至60。
在一个实施方案中,疏水基hy/普兰林肽摩尔比包括3至60。
在一个实施方案中,疏水基hy/普兰林肽摩尔比包括4至60。
在一个实施方案中,疏水基hy/普兰林肽摩尔比包括5至60。
在一个实施方案中,疏水基hy/普兰林肽摩尔比包括8至60。
在一个实施方案中,疏水基hy/普兰林肽摩尔比包括10至60。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括1.0至70。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括1.2至45。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括1.3至30。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括1.7至27。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括2.0至27。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括2.3至27。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括2.7至27。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括3.3至27。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括4.7至27。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括6.0至27。
在一个实施方案中,共聚氨基酸/胰淀素质量比包括2.0至67。
在一个实施方案中,共聚氨基酸/胰淀素质量比包括4.7至27。
在一个实施方案中,共聚氨基酸/胰淀素质量比包括6.7至27。
在一个实施方案中,共聚氨基酸/胰淀素质量比包括10至27。
在一个实施方案中,共聚氨基酸/普兰林肽质量比包括1.0至67。
在一个实施方案中,共聚氨基酸/普兰林肽质量比包括1.3至45。
在一个实施方案中,共聚氨基酸/普兰林肽质量比包括2.7至27。
在一个实施方案中,共聚氨基酸/普兰林肽质量比包括3.3至27。
在一个实施方案中,共聚氨基酸/普兰林肽质量比包括5.3至27。
在一个实施方案中,共聚氨基酸/普兰林肽质量比包括6.7至27。
在一个实施方案中,组合物的特征在于,其还包含胰岛素。
在一个实施方案中,组合物的特征在于,胰岛素是餐时胰岛素。餐时胰岛素在ph7下可溶。
餐时胰岛素是指所谓的快速或“短效”胰岛素。
所谓的快速餐时胰岛素是必须满足在膳食期间由摄入蛋白质和糖类引起的需求的胰岛素;它们必须在不到30分钟内起作用。
在一个实施方案中,所谓的“短效”餐时胰岛素是人胰岛素。
在一个实施方案中,餐时胰岛素是如欧洲和美国药典中描述的重组人胰岛素。
人胰岛素例如有以商品名
所谓的快速(速效)餐时胰岛素是通过重组获得的胰岛素,且其一级序列已被修饰以缩短其作用持续时间。
在一个实施方案中,所谓的速效餐时胰岛素选自包括赖脯胰岛素
在一个实施方案中,餐时胰岛素是赖脯胰岛素。
在一个实施方案中,餐时胰岛素是赖谷胰岛素。
在一个实施方案中,餐时胰岛素是门冬胰岛素。
下表列出了关于胰岛素的药典推荐的胰岛素及其相应的mg量:
在赖谷胰岛素的情况下,100u=3.49mg的赖谷胰岛素(根据与
然而,在正文的其余部分,u被系统无差别地用于所有胰岛素的量和浓度。以mg为单位的各自相应值是上面针对以u、ui或usp为单位表示的值给出的值。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度包括240至3000μm(40至500u/ml)。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度包括600至3000μm(100至500u/ml)。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度包括600至2400μm(100至400u/ml)。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度包括600至1800μm(100至300u/ml)。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度包括600至1200μm(100至200u/ml)。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度为600μm(100u/ml)。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度为1200μm(200u/ml)。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度为1800μm(300u/ml)。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度为2400μm(400u/ml)。
在一个实施方案中,其涉及一种药物制剂,其特征在于胰岛素的浓度为3000μm(500u/ml)。
在一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比大于或等于1。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括1.5至75。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括1.8至50。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括2至35。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括2.5至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括3至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括3.5至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括4至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括5至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括7至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括9至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素摩尔比包括5至75。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素摩尔比包括10至50。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素摩尔比包括15至30。
在一个实施方案中,共聚氨基酸/普兰林肽摩尔比大于或等于1。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括1.5至75。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括2至50。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括3至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括4至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括5至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括8至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽摩尔比包括10至30。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括1.5至150。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括1.8至100。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括2至70。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括2.5至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括3至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括3.5至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括4至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括5至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括7至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素、胰淀素受体激动剂或胰淀素类似物摩尔比包括9至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素摩尔比包括5至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素摩尔比包括10至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/胰淀素摩尔比包括15至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/普兰林肽摩尔比包括1.5至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/普兰林肽摩尔比包括2至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/普兰林肽摩尔比包括3至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/普兰林肽摩尔比包括4至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/普兰林肽摩尔比包括5至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/普兰林肽摩尔比包括8至60。
在包含餐时胰岛素的一个实施方案中,疏水基hy/普兰林肽摩尔比包括10至60。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括1.0至70。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括1.2至45。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括1.3至30。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括1.7至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括2.0至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括2.3至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括2.7至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括3.3至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括4.7至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素、胰淀素受体激动剂或胰淀素类似物质量比包括6.0至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素质量比包括3.3至67。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素质量比包括6.6至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/胰淀素质量比包括10至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括1.0至67。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括1.2至45。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括1.3至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括1.7至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括2.0至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括2.3至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括2.7至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括3.3至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括4.7至27。
在包含餐时胰岛素的一个实施方案中,共聚氨基酸/普兰林肽质量比包括6.0至27。
此外,特别有利的是将与或不与餐时胰岛素相组合的胰淀素、胰淀素受体激动剂或胰淀素类似物与glp-1、glp-1类似物、通常被称为glp-1ra的glp-1受体激动剂组合。这特别使得有可能增强胰岛素的作用,并且被推荐用于某些类型的糖尿病治疗。
在一个实施方案中,glp-1、glp-1类似物或glp-1ra被称为“速效的”。所谓“速效的”意指glp-1、glp-1类似物或glp-1ra,其在人体皮下注射后的表观消除半衰期少于8小时,特别是少于5小时,优选少于4小时,或甚至少于3小时,如艾塞那肽和利西拉肽。
在一个实施方案中,glp-1、glp-1类似物或glp-1ra选自由艾塞那肽或
在一个实施方案中,glp-1、glp-1类似物或glp-1ra是艾塞那肽或
在一个实施方案中,glp-1、glp-1类似物或glp-1ra是利西拉肽或
在一个实施方案中,艾塞那肽、其类似物或衍生物及其药学上可接受的盐的浓度包括在0.01至1.0mg/100u胰岛素的区间内。
在一个实施方案中,艾塞那肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.01至0.5mg/100u胰岛素。
在一个实施方案中,艾塞那肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.02至0.4mg/100u胰岛素。
在一个实施方案中,艾塞那肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.03至0.3mg/100u胰岛素。
在一个实施方案中,艾塞那肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.04至0.2mg/100u胰岛素。
在一个实施方案中,艾塞那肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.04至0.15mg/100u胰岛素。
在一个实施方案中,利西拉肽、其类似物或衍生物及其药学上可接受的盐的浓度包括在0.01至1mg/100u胰岛素的区间内。
在一个实施方案中,利西拉肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.01至0.5mg/100u胰岛素。
在一个实施方案中,利西拉肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.02至0.4mg/100u胰岛素。
在一个实施方案中,利西拉肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.03至0.3mg/100u胰岛素。
在一个实施方案中,利西拉肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.04至0.2mg/100u胰岛素。
在一个实施方案中,利西拉肽、其类似物或衍生物及其药学上可接受的盐的浓度为0.04至0.15mg/100u胰岛素。
在一个实施方案中,根据本发明的组合物的实施方式是,在共聚氨基酸的存在下,以包括在10/90至90/10的区间内的体积比混合胰淀素和glp-1、glp-1类似物或glp-1ra受体激动剂的商品溶液。
在一个实施方案中,根据本发明的组合物不含餐时胰岛素。
在一个实施方案中,根据本发明的组合物不包含glp-1、glp-1类似物或目前被称为glp-1ra的glp-1受体激动剂。
本发明还涉及还包含离子性物质的组合物,所述离子性物质使得有可能提高组合物的稳定性。
本发明还涉及选自阴离子、阳离子和/或两性离子的组的离子性物质用以提高组合物的物理化学稳定性的用途。
在一个实施方案中,离子性物质包含多于10个碳原子。
所述离子性物质选自阴离子、阳离子和/或两性离子的组。所谓两性离子意指在两个非相邻原子上带有至少一个正电荷和至少一个负电荷的物质。
所述离子性物质单独使用或混合使用,优选混合使用。
在一个实施方案中,阴离子选自有机阴离子。
在一个实施方案中,有机阴离子包含少于10个碳原子。
在一个实施方案中,有机阴离子选自由乙酸根、柠檬酸根和琥珀酸根组成的组。
在一个实施方案中,阴离子选自矿物来源的阴离子。
在一个实施方案中,矿物来源的阴离子选自由硫酸根、磷酸根和卤离子组成的组,特别是氯离子。
在一个实施方案中,阳离子选自有机阳离子。
在一个实施方案中,有机阳离子包含少于10个碳原子。
在一个实施方案中,有机阳离子选自由铵组成的组,例如2-氨基-2-(羟甲基)丙烷-1,3-二醇,其中胺呈铵形式。
在一个实施方案中,阳离子选自矿物来源的阳离子。
在一个实施方案中,矿物来源的阳离子选自由锌(特别是zn2+)和碱金属(特别是na+和k+)组成的组。
在一个实施方案中,两性离子选自有机来源的两性离子。
在一个实施方案中,两性离子选自氨基酸。
在一个实施方案中,氨基酸选自由甘氨酸、丙氨酸、缬氨酸、异亮氨酸和亮氨酸组成的组中的脂族氨基酸。
在一个实施方案中,氨基酸选自由脯氨酸组成的组中的环状氨基酸。
在一个实施方案中,氨基酸选自由半胱氨酸、丝氨酸、苏氨酸和甲硫氨酸组成的组中的羟基或硫氨基酸。
在一个实施方案中,氨基酸选自由苯丙氨酸、酪氨酸和色氨酸组成的组中的芳族氨基酸。
在一个实施方案中,氨基酸选自由天冬酰胺和谷氨酰胺组成的组中侧链的羧基官能团被酰胺化的氨基酸。
在一个实施方案中,有机来源的两性离子选自由具有不带电荷的侧链的氨基酸组成的组。
在一个实施方案中,有机来源的两性离子选自由二酸或酸性氨基酸组成的组。
在一个实施方案中,氨基酸选自由谷氨酸和天冬氨酸组成的组,任选呈盐的形式。
在一个实施方案中,有机来源的两性离子选自由碱性氨基酸或所谓的阳离子性氨基酸组成的组。
在一个实施方案中,所谓的“阳离子性”氨基酸选自精氨酸、组氨酸和赖氨酸,特别是精氨酸和赖氨酸。
非常特别地,两性离子包含与正电荷一样多的负电荷,因此在等电点和/或在6.0至8.0的ph下总电荷为零。
所述离子性物质以盐的形式被引入到组合物中。这些的引入可在将它们于组合物中溶解之前以固体形式进行,或者以溶液的形式进行,特别是浓溶液的形式。
例如,以选自氯化钠、氯化锌、磷酸钠、硫酸钠等的盐的形式添加矿物来源的阳离子。
例如,以选自柠檬酸钠或钠钾或乙酸钠的盐的形式添加有机来源的阴离子。
例如,以选自精氨酸盐酸盐、组氨酸盐酸盐的盐的形式或者以举例如组氨酸或精氨酸的非盐形式添加氨基酸。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于10mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于20mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于30mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于50mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于75mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于100mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于200mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于300mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度大于或等于900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于1500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于1200mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于400mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于300mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于200mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度小于或等于100mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括100至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括200至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括300至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括400至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括500至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括600至1000mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括100至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括200至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括300至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括400至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括500至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括600至900mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括100至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括200至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括300至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括400至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括500至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括600至800mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括100至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括200至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括300至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括400至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括500至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括600至700mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括100至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括200至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括300至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括400至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括500至600mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括100至500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括200至500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括300至500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括400至500mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至400mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至400mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至400mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至400mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至400mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括100至400mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括200至400mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括300至400mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至300mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至300mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至300mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至300mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至300mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括100至300mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括200至300mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至200mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至200mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至200mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至200mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至200mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括100至200mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至100mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至100mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至100mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至100mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括75至100mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至75mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至75mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至75mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括50至75mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括10至50mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括20至50mm。
在一个实施方案中,组合物中离子性物质的总摩尔浓度包括30至50mm。
在一个实施方案中,所述离子性物质以5至400mm的浓度存在。
在一个实施方案中,所述离子性物质以5至300mm的浓度存在。
在一个实施方案中,所述离子性物质以5至200mm的浓度存在。
在一个实施方案中,所述离子性物质以5至100mm的浓度存在。
在一个实施方案中,所述离子性物质以5至75mm的浓度存在。
在一个实施方案中,所述离子性物质以5至50mm的浓度存在。
在一个实施方案中,所述离子性物质以5至25mm的浓度存在。
在一个实施方案中,所述离子性物质以5至20mm的浓度存在。
在一个实施方案中,所述离子性物质以5至10mm的浓度存在。
在一个实施方案中,所述离子性物质以10至400mm的浓度存在。
在一个实施方案中,所述离子性物质以10至300mm的浓度存在。
在一个实施方案中,所述离子性物质以10至200mm的浓度存在。
在一个实施方案中,所述离子性物质以10至100mm的浓度存在。
在一个实施方案中,所述离子性物质以10至75mm的浓度存在。
在一个实施方案中,所述离子性物质以10至50mm的浓度存在。
在一个实施方案中,所述离子性物质以10至25mm的浓度存在。
在一个实施方案中,所述离子性物质以10至20mm的浓度存在。
在一个实施方案中,所述离子性物质以20至300mm的浓度存在。
在一个实施方案中,所述离子性物质以20至200mm的浓度存在。
在一个实施方案中,所述离子性物质以20至100mm的浓度存在。
在一个实施方案中,所述离子性物质以20至75mm的浓度存在。
在一个实施方案中,所述离子性物质以20至50mm的浓度存在。
在一个实施方案中,所述离子性物质以20至25mm的浓度存在。
在一个实施方案中,所述离子性物质以50至300mm的浓度存在。
在一个实施方案中,所述离子性物质以50至200mm的浓度存在。
在一个实施方案中,所述离子性物质以50至100mm的浓度存在。
在一个实施方案中,所述离子性物质以50至75mm的浓度存在。
关于矿物来源的阳离子,特别是zn2+,其在组合物中的摩尔浓度可包括0.25至20mm,特别是0.25至10mm或0.25至5mm。
在一个实施方案中,组合物包含锌。
在一个实施方案中,组合物包含0.2至2mm的锌。
在一个实施方案中,组合物包含nacl。
在一个实施方案中,组合物包含10至250mm的nacl。
在一个实施方案中,组合物包含15至200mm的nacl。
在一个实施方案中,组合物包含20至150mm的nacl。
在一个实施方案中,组合物包含25至100mm的nacl。
在一个实施方案中,根据本发明的组合物还包含浓度为0至500μm/100u胰岛素的锌盐。
在一个实施方案中,根据本发明的组合物还包含浓度为0至400μm/100u胰岛素的锌盐。
在一个实施方案中,根据本发明的组合物还包含浓度为0至300μm/100u胰岛素的锌盐。
在一个实施方案中,根据本发明的组合物还包含浓度为0至200μm/100u胰岛素的锌盐。
在一个实施方案中,根据本发明的组合物还包含浓度为0至100μm/100u胰岛素的锌盐。
在一个实施方案中,根据本发明的组合物还包含缓冲剂。
在一个实施方案中,根据本发明的组合物包含浓度为0至100mm的缓冲剂。
在一个实施方案中,根据本发明的组合物包含浓度为15至50mm的缓冲剂。
在一个实施方案中,根据本发明的组合物包含选自由磷酸盐缓冲剂、tris(三羟甲基氨基甲烷)和柠檬酸钠组成的组的缓冲剂。
在一个实施方案中,缓冲剂是磷酸钠。
在一个实施方案中,缓冲剂是tris(三羟甲基氨基甲烷)。
在一个实施方案中,缓冲剂是柠檬酸钠。
在一个实施方案中,根据本发明的组合物还包含防腐剂。
在一个实施方案中,防腐剂选自由间甲酚和苯酚组成的组,其为单独的或混合的。
在一个实施方案中,防腐剂的浓度包括10至50mm。
在一个实施方案中,防腐剂的浓度包括10至40mm。
在一个实施方案中,根据本发明的组合物还包含表面活性剂。
在一个实施方案中,表面活性物质选自由丙二醇和聚山梨醇酯组成的组。
根据本发明的组合物还包含添加剂,如张度剂。
在一个实施方案中,张度剂选自由甘油、氯化钠、甘露糖醇和甘氨酸组成的组。
根据本发明的组合物还可包含所有符合药典并与以常规浓度使用的胰岛素相容的赋形剂。
本发明还涉及根据本发明的药物制剂,其特征在于,其是通过干燥和/或冻干得到的。
在局部和全身释放的情况下,设想的施用途径是静脉内、皮下、皮内或肌内。
还设想了透皮、口服、经鼻、经阴道、经眼、经口和经肺施用方式。
本发明还涉及可植入或可输送的泵,其包含根据本发明的组合物。
本发明还涉及根据本发明的组合物的用途,其旨在被置于可植入或可输送的泵中。
本发明还涉及ph为6.0至8.0的制剂,其包含胰淀素、胰淀素激动剂受体或胰淀素类似物和根据本发明的共聚氨基酸。
本发明还涉及ph为6.0至8.0的单剂量制剂,其包含胰淀素、胰淀素激动剂受体或胰淀素类似物、根据本发明的共聚氨基酸和如上所定义的glp-1、glp-1类似物或glp-1ra。
本发明还涉及ph为6.6至7.8的制剂,其包含胰淀素、胰淀素激动剂受体或胰淀素类似物和根据本发明的共聚氨基酸。
本发明还涉及ph为6.6至7.8的单剂量制剂,其包含胰淀素、胰淀素激动剂受体或胰淀素类似物和根据本发明的共聚氨基酸以及如上所定义的餐时胰岛素。
本发明还涉及ph为6.6至7.6的制剂,其包含胰淀素、胰淀素激动剂受体或胰淀素类似物和根据本发明的共聚氨基酸。
本发明还涉及ph为6.6至7.6的单剂量制剂,其包含胰淀素、胰淀素激动剂受体或胰淀素类似物和根据本发明的共聚氨基酸以及如上所定义的餐时胰岛素。
在一个实施方案中,单剂量制剂还包含如上所定义的共聚氨基酸。
在一个实施方案中,制剂呈可注射溶液的形式。
根据本发明的组合物的制备提供的优点是能够通过简单地将胰淀素、胰淀素激动剂受体或胰淀素类似物的水溶液和根据本发明的带有羧酸根电荷及至少一个疏水基的共聚氨基酸以水溶液或以冻干形式混合来进行制备。如果需要的话,将制剂调节到ph为6.0至8.0。
根据本发明的组合物的制备提供的优点是能够通过简单地将胰淀素、胰淀素激动剂受体或胰淀素类似物的水溶液、餐时胰岛素和根据本发明的带有羧酸根电荷及至少一个疏水基的共聚氨基酸以水溶液或以冻干形式混合来进行制备。如果需要的话,将制剂调节到ph为6.0至8.0。
在一个实施方案中,通过超滤浓缩餐时胰岛素和共聚氨基酸的混合物。
如果需要的话,用赋形剂如甘油、间甲酚、氯化锌和聚山梨醇酯
在一个实施方案中,组合物的特征在于,所述组合物的稳定性通过tht测量高于参考组合物的稳定性,所述参考组合物包含胰淀素、胰淀素受体激动剂和胰淀素类似物,但不包含带有羧酸根电荷及疏水基hy的共聚氨基酸。
在一个实施方案中,组合物的特征在于,所述组合物的稳定性按tht测量高于参考组合物的稳定性,所述参考组合物包含胰淀素受体激动剂和胰淀素类似物;与胰岛素相组合,但不包含带有羧酸根电荷及疏水基hy的共聚氨基酸。
在一个实施方案中,组合物的特征在于,所述组合物的稳定性通过tht测量高于参考组合物的稳定性,所述参考组合物包含胰淀素、胰淀素受体激动剂和胰淀素类似物与glp-1、glp-1类似物或glp-1受体激动剂相组合,但不包含带有羧酸根电荷及疏水基hy的共聚氨基酸。
在一个实施方案中,组合物的特征在于,所述组合物的稳定性通过tht测量高于参考组合物的稳定性,所述参考组合物包含胰淀素、胰淀素受体激动剂和胰淀素类似物与glp-1、glp-1类似物或glp-1受体激动剂,但不包含带有羧酸根电荷及疏水基hy的共聚氨基酸。
本发明还涉及带有羧酸根电荷及疏水基hy的共聚氨基酸用以稳定包含胰淀素受体激动剂和胰淀素类似物的组合物的用途。
本发明还涉及带有羧酸根电荷及疏水基hy的共聚氨基酸用以稳定组合物的用途,所述组合物包含胰淀素受体激动剂和胰淀素类似物及餐时胰岛素,以及可能的glp-1、glp-1类似物或glp-1受体激动剂。
本发明还涉及稳定胰淀素和胰淀素受体激动剂及胰淀素类似物的组合物的方法,或稳定包含胰淀素受体激动剂和胰淀素类似物及餐时胰岛素以及可能的glp-1、glp-1类似物或glp-1受体激动剂的组合物的方法。
以下实施例是对本申请的描述,然而并不是限制性的。
附图说明:
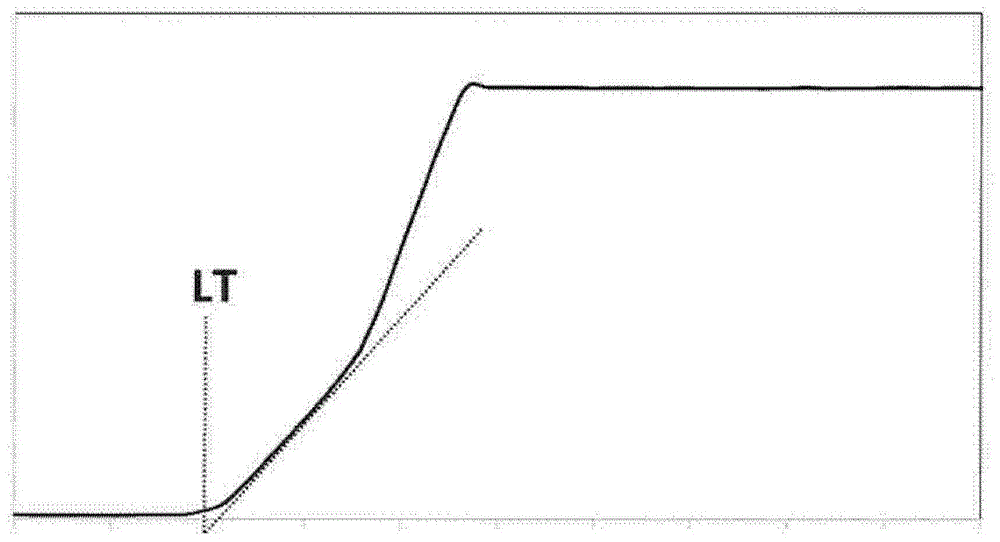
图1:
此图在曲线上图示通过荧光监测硫代黄素t来确定等待时间(lt),纵坐标轴上是荧光值(单位u.a.,任意单位),且横坐标上是以分钟为单位的时间。
a部分-用于得到基团-hy的中间疏水hyd的合成
实施例a1:分子a1
分子1:通过fmoc-lys(fmoc)-oh与树脂2-cl-三苯甲基氯之间的反应得到的产物。
在室温下向fmoc-lys(fmoc)-oh(7.32g,12.40mmol)在二氯甲烷(60ml)中的悬浮液中添加dipea(4.32ml,24.80mmol)。完全溶解(10分钟)后,将得到的溶液倒在先前在二氯甲烷中洗涤的树脂2-cl-三苯甲基氯(100-200目,1%dvb,1.24mmol/g)(4.00g,4.96mmol)上,在室温下搅拌2小时后,添加hplc级甲醇(0.8ml/g树脂,3.2ml),并将介质在室温下搅拌15分钟。将树脂过滤,依次用二氯甲烷(3x60ml)、dmf(2x60ml)、二氯甲烷(2x60ml)、异丙醇(1x60ml)和二氯甲烷(3x60ml)洗涤。
分子2:通过分子1与80∶20dmf/哌啶混合物之间的反应得到的产物。
将先前用dmf洗涤的分子1用80∶20dmf/哌啶混合物(60ml)吸收。在室温下搅拌30分钟后,将树脂过滤,依次用dmf(3x60ml)、异丙醇(1x60ml)和二氯甲烷(3x60ml)洗涤。
分子3:通过分子2与fmoc-glu(otbu)-oh之间的反应得到的产物。
向fmoc-glu(otbu)-oh(10.55g,24.80mmol)和1-[双(二甲氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu,9.43g,24.80mmol)在混合物1∶1dmf/二氯甲烷(60ml)中的悬浮液中添加dipea(8.64ml,49.60mmol)。完全溶解后,将得到的溶液倒在分子2上。在室温下搅拌2小时后,将树脂过滤,依次用dmf(3x60ml)、异丙醇(1x60ml)和二氯甲烷(3x60ml)洗涤。
分子4:通过分子3与50∶50dmf/吗啉混合物之间的反应得到的产物。
将先前用dmf洗涤的分子3用50∶50dmf/哌啶混合物(60ml)吸收。在室温下搅拌1小时15分钟后,将树脂过滤,依次用dmf(3x60ml)、异丙醇(1x60ml)和二氯甲烷(3x60ml)洗涤。
分子5:通过分子4与分子11之间的反应得到的产物。
在dmf(60ml)中采用与用于分子3的方法类似的方法应用于分子4和分子11(8.07g,24.80mmol),得到分子5。
分子6:通过分子5与80∶20二氯甲烷/1,1,1,3,3,3-六氟-2-丙醇(hfip)混合物之间的反应得到的产物。
将分子5用80∶20二氯甲烷/1,1,1,3,3,3-六氟-2-丙醇(hfip)(60ml)混合物吸收。在室温下搅拌20分钟后,将树脂过滤,并用二氯甲烷(2x60ml)洗涤。将溶剂在减压下蒸发。然后用二氯甲烷(60ml)、然后用二异丙醚(60ml)对残留物进行两次共蒸发。通过硅胶色谱法(二氯甲烷、甲醇)纯化产物。得到分子6的白色固体。
产量:2.92g(6步52%)
rmn1h(cd3od,ppm):0.90(6h);1.22-2.47(88h);3.13-3.25(2h);3.45-3.76(4h);4.24-4.55(5h)。
lc/ms(esi+):1131.9(计算值([m+h]+):1131.8)。
分子7:通过分子6与n-boc乙二胺之间的反应得到的产物。
在室温下向分子6(2.82g,2.49mmol)在me-thf(20ml)中的溶液中依次添加n-羟基苯并三唑(hobt,496mg,3.24mmol)和n-boc乙二胺(boceda,440mg,2.74mmol)。将混合物冷却到0℃,然后添加(3-二甲基氨基丙基)-n’-乙基碳二亚胺(edc,621mg,3.24mmol)盐酸盐。将介质在0℃下搅拌15分钟,然后在室温下搅拌18h。将有机相用二氯甲烷(30ml)稀释,并用饱和nh4cl水溶液(2x20ml)、饱和nahco3水溶液(2x20ml)和饱和nacl水溶液(2x20ml)洗涤。将有机相经na2so4干燥,过滤并在减压下浓缩。在乙腈中重结晶后得到分子7的白色固体
产量:2.47g(78%)
rmn1h(cdcl3,ppm):0.87(6h);1.09-1.77(77h);1.84-2.49(20h);2.99-3.83(10h);4.16-4.25(1h);4.27-4.47(4h);5.68(0.1h);5.95-6.08(0.9h);6.91-7.14(2h);7.43-7.57(1h);7.68-7.78(1h);8.22-8.35(1h)。
lc/ms(esi+):1273.9(计算值([m+h]+):1273.9)。
分子a1
在室温下向分子7(2.47g,1.94mmol)在二氯甲烷(20ml)中的溶液中添加4nhcl在二噁烷(7.27ml)中的溶液,然后将介质在室温下搅拌16小时。在减压下浓缩、共蒸发并用二异丙醚洗涤后,得到分子a1的白色固体,呈hcl盐的形式。将此固体溶解在水(100ml)中,然后通过添加naoh1n水溶液将ph调节至7。将溶液冻干,并通过在甲苯中共蒸发来干燥冻干物。得到分子a1的白色固体。
产量:1.64g(80%)
rmn1h(cd2od,ppm):0.90(6h);1.15-2.59(70h);3.06-3.86(10h);4.19-4.43(5h)。
lc/ms(esi+):1061.8(计算值([m+h]+):1061.8)。
实施例a2:分子a2
分子8:通过肉豆蔻酸与l-谷氨酸甲酯之间的偶联得到的产物。
在室温下向肉豆蔻酸(35.0g,153.26mmol)在四氢呋喃(thf)(315ml)中的溶液中依次添加n-羟基琥珀酰亚胺(nhs,17.81g,154.79mmol)和n,n-二环己基羧二酰亚胺(dcc,31.94g,154.79mmol)。将介质搅拌48小时,同时将温度升至室温,在烧结过滤器上过滤,然后添加到l-谷氨酸甲酯(24.95g,154.9mmol)和n,n-二异丙基乙胺(dipea,99.0g,766.28mmol)在水(30ml)中的溶液中。将反应介质在20℃下搅拌48小时,然后在减压下浓缩。添加水(200ml),并通过依次添加乙酸乙酯(acoet,100ml)、然后是na2co3的5%水溶液(50ml)来吸收得到的混合物。然后将水相用acoet(100ml)再次洗涤,通过添加10%hcl的水溶液酸化,并将产物用二氯甲烷(dcm,3x150ml)萃取。将有机相经na2so4干燥,过滤并在减压下浓缩。得到分子8的白色固体。
产量:47.11g(84%)
rmn1h(cdcl3,ppm):0.87(3h);1.07-1.66(22h);2.02-2.11(1h);2.18-2.36(3h);2.39-2.47(1h);2.50-2.58(1h);3.69(3h);4.54-4.59(1h);6.62(1h);8.26(1h)。
lc/ms(esi+):372.2(计算值([m+h]+):372.3)。
分子9:通过分子8与l-谷氨酸甲酯之间的偶联得到的产物。
采用与用于制备分子8的方法类似的方法并应用于分子8(35.0g,94.21mmol)和l-谷氨酸甲酯(15.33g,95.15mmol),在乙腈中重结晶后得到分子9的白色固体
产量:24.0g(49%)
rmn1h(dmso-d6,ppm):0.85(3h);1.06-1.51(22h);1.70-1.94(3h);1.96-2.15(3h);2.29-2.40(4h);3.58(3h);3.58(3h);4.16-4.22(1h);4.25-4.32(1h);7.93(1h);8.16(1h);12.66(1h)。
lc/ms(esi+):515.3(计算值([m+h]+):515.3)。
分子10:通过分子9与n-boc乙二胺之间的反应得到的产物。
在0℃下,向分子9(24.0g,46.63mmol)在dcm(285ml)中的悬浮液中依次添加hobt(714mg,46.66mmol)、boceda(8.97g,55.96mmol)在dcm(25ml)中的溶液、然后是edc(9.83g,51.30mmol)。将介质在0℃下搅拌1小时,然后在室温下搅拌18h。将有机相用饱和nahco3水溶液(2x300ml)、1nhcl的水溶液(2x300ml)、饱和nacl水溶液(500ml)洗涤。添加甲醇(40ml),将有机相经na2so4干燥,过滤并在减压下浓缩。在乙腈中重结晶后得到分子10的白色固体
产量:27.15g(89%)
rmn1h(cdcl3,ppm):0.87(3h);1.07-1.68(22h);1.42(9h);1.97-2.18(4h);2.22-2.31(2h);2.35-2.55(4h);3.19-3.29(2h);3.30-3.38(2h);3.66(3h);3.68(3h);4.34-4.41(1h);4.42-4.48(1h);5.54(1h);6.99-7.18(2h)7.56(1h)。
lc/ms(esi+):657.4(计算值([m+h]+):657.4)。
分子a2
在0℃下向分子10(27.15g,41.33mmol)在dcm/甲醇混合物(410ml)中的溶液中添加4nhcl在二噁烷(51.7ml)中的溶液,然后将介质在0℃下搅拌2小时,然后在室温下搅拌16小时。在减压下浓缩后,在甲醇(2x150ml)中共蒸发,在乙腈中重结晶后得到分子a2的白色固体,呈盐酸盐的形式。
产量:23.2g(95%)
rmn1h(dmso-d6,ppm):0.85(3h);1.05-1.52(22h);1.71-1.85(2h);1.87-2.03(2h);2.07-2.18(2h);2.24-2.37(4h);2.84(2h);3.24-3.38(2h);3.58(3h);3.58(3h);4.17-4.24(2h);7.95-8.08(5h);8.14(1h)。
lc/ms(esi+):557.3(计算值([m+h]+):557.4)。
实施例a3:分子a3
分子11:通过肉豆蔻酰氯与l-脯氨酸之间的反应得到的产物。
在0℃下向l-脯氨酸(300.40g,2.61mol)在2n苏打水溶液(1.63l)中的溶液中经1h缓慢添加肉豆蔻酰氯(322g,1.30mol)在二氯甲烷(dcm,1.63l)中的溶液。在此添加之后,经3h将反应介质升至20℃,然后搅拌2h。将混合物冷却到0℃,然后经15分钟添加37%hcl水溶液(215ml)。将反应介质在0℃至20℃下搅拌1小时。将有机相分离,用10%hcl水溶液(3x430ml)、饱和nacl水溶液(430ml)洗涤,经na2so4干燥,通过棉进行过滤,然后在减压下浓缩。将残留物在50℃下溶解在庚烷(1.31l)中,然后将溶液逐渐冷却到室温。使用玻璃棒引发结晶后,将介质在40℃下再次加热30分钟,然后经4小时返回到室温。在烧结过滤器上过滤、用庚烷(2x350ml)洗涤并在减压下干燥后,得到白色固体。
产量:410g(97%)
rmn1h(cdcl3,ppm):0.88(3h);1.28(20h);1.70(2h);1.90-2.10(3h);2.36(2h);2.51(1h);3.47(1h);3.56(1h);4.61(1h)。
lc/ms(esi):326.4;326.4(计算值([m+h]+):326.3;([2m+h]+):651.6)。
分子12:通过分子11与l-谷氨酸甲酯之间的偶联得到的产物。
采用与用于制备分子8的方法类似的方法并应用于分子11(30.0g,92.17mmol)和l-谷氨酸甲酯(15.60g,96.78mmol),在回流丙酮中重结晶、冷却到室温并在烧结过滤器上过滤后,得到分子12的白色固体。如上所述,将滤液蒸发,并将残留物在丙酮中沉淀,重复此操作3次。
产量:15.5g(36%)
rmn1h(dmso-d6,ppm):0.85(3h);1.07-1.37(20h);1.40-1.50(2h);1.71-2.27(8h);2.30-2.40(2h);3.28-3.54(12h);3.58(1.3h);3.59(1.7h);4.14-4.28(1h);4.28-4.37(1h);8.06(0.55h);8.33(0.45h);12.64(1h)。
lc/ms(esi+):469.2(计算值([m+h]+):469.3)。
分子13:通过分子12与n-boc乙二胺之间的反应得到的产物。
采用与用于制备分子10的方法类似的方法并应用于分子12(15.5g,33.05mmol)和l-谷氨酸甲酯(5.83g,36.36mmol),在乙腈中重结晶后得到分子13的白色固体
产量:19.8g(83%)
rmn1h(dmso-d6,ppm):0.85(3h);1.07-1.55(22h);1.37(9h);1.69-2.19(7h);2.22-2.36(3h);2.91-3.17(4h);3.28-3.60(5h);4.11-4.18(0.7h);4.20-4.28(1h);4.38-4.42(0.3h);6.74(1h);7.64(0.7h);7.87(0.7h);7.98(0.3h);8.22(0.3h)。
lc/ms(esi+):611.4(计算值([m+h]+):611.4)。
分子a3
采用与用于制备分子a2的方法类似的方法并应用于分子13(16.8g,27.50mmol),在乙腈中重结晶后得到分子a3的白色固体,呈盐酸盐的形式
产量:13.5g(90%)
rmn1h(dmso-d6,ppm):0.85(3h);1.08-1.52(22h);1.70-2.37(10h);2.80-2.90(2h);3.22-3.62(4h);3.57(3h);4.15-4.28(1.75h);4.41-4.44(0.25h);7.81-8.13(4.5h);8.24-8.29(0.25h)8.33-8.39(0.25h)。
lc/ms(esi+):511.3(计算值([m+h]+):511.4)。
实施例a4:分子a4
分子14:通过月桂酰氯与l-脯氨酸之间的反应得到的产物
采用与用于制备分子11的方法类似的方法并应用于月桂酰氯(27.42g,685.67mmol)和l-脯氨酸(60.0g,247.27mmol),得到分子14的白色固体。
产量:78.35g(96%)
rmn1h(cdcl3,ppm):0.87(3h);1.26(16h);1.70(2h);1.90-2.10(3h);2.35(2h);2.49(1h);3.48(1h);3.56(1h);4.60(1h)。
lc/ms(esi+):298.1(计算值([m+h]+):298.2)。
分子15:通过分子14与l-谷氨酸甲酯之间的偶联得到的产物。
采用与用于制备分子8的方法类似的方法并应用于分子14(34.64g,116.46mmol)和l-谷氨酸甲酯(19.14g,118.79mmol),在乙腈中重结晶后得到分子15的白色固体
产量:37.28g(73%)
rmn1h(cdcl3,ppm):0.85(3h);1.08-1.42(16h);1.54-1.06(2h);1.80-2.47(10h);3.42-3.80(2h);3.65(2.55h);3.67(0.45h);4.37-4.40(0.15h);4.51-4.58(0.85h);4.58-4.67(1h);7.26(0.15h)7.65(0.85h);8.06(1h)。
lc/ms(esi+):441.1(计算值([m+h]+):441.3)。
分子16:通过分子15与n-boc乙二胺之间的反应得到的产物。
采用与用于制备分子10的方法类似的方法并应用于分子15(37.30g,84.66mmol)和l-谷氨酸甲酯(14.92g,93.13mmol),在乙腈中重结晶后得到分子16的白色固体
产量:43.10g(87%)
rmn1h(dmso-d6,ppm):0.85(3h);1.08-1.53(18h);1.37(9h);1.70-2.36(10h);2.91-3.60(9h);4.11-4.18(0.7h);4.21-4.28(1h);4.38-4.42(0.3h);6.38(0.1h);6.74(0.9h);7.65(0.7h);7.87(0.7h);7.99(0.3h);8.22(0.3h)。
lc/ms(esi+):583.4(计算值([m+h]+):583.4)。
分子a4
采用与用于制备分子a2的方法类似的方法并应用于分子16(43.10g,73.96mmol),在乙腈中重结晶后得到分子a4的白色固体,呈盐酸盐的形式
产量:31.90g(83%)
rmn1h(dmso-d6,ppm):0.85(3h);1.05-1.37(16h);1.39-1.52(2h);1.70-2.37(10h);2.29-2.91(2h);3.20-3.62(7h);4.16-4.29(1.7h);4.42-4.46(0.3h);7.86-8.18(4.6h);8.32(0.3h);8.40(0.3h)。
lc/ms(esi+):483.2(计算值([m+h]+):483.3)。
实施例a5:分子a5
分子17:通过1-氨基-4,7,10-三氧杂-13-十三烷胺与碳酸叔丁苯酯之间的反应得到的产物。
在80℃下向1-氨基-4,7,10-三氧杂-13-十三烷胺(112.29g,509.71mmol)在乙醇(510ml)中的溶液中逐滴添加碳酸叔丁苯酯(49.50g,254.86mmol)。将反应介质在80℃下搅拌3小时30分钟,然后在减压下浓缩。将残留物溶解在水(250ml)中,用37%hcl溶液将ph调节至2.3,并用甲基叔丁基醚(mtbe,2x150ml)萃取混合物。通过添加2nnaoh溶液将水相碱化至ph12.6,并用dcm(3x250m>)萃取。将有机相用1nnaoh的水溶液(1x100ml)、饱和nacl水溶液(100ml)洗涤,经na2so4干燥,过滤并在减压下浓缩。得到分子17的黄色油状物。
产量:54.4g(67%)
rmn1h(cdcl3,ppm):1.40-1.58(11h);1.73-1.81(4h);2.80-2.84(2h);3.20-3.70(14h);5.11(1h)。
lc/ms(esi+):321.2(计算值([m+h]+):321.2)。
分子18:通过分子12与分子17之间的偶联得到的产物。
采用与用于制备分子10的方法类似的方法并应用于分子12(20.46g,43.66mmol)和分子17(16.79g,52.39mmol),通过快速色谱法(洗脱液:dcm、甲醇)纯化,将残留物溶解在dcm(300ml)中,将有机相用nahco3的水溶液(2x150ml)、10%hcl的水溶液(2x150ml)、饱和nacl水溶液(2x150ml)洗涤,经na2so4干燥并在减压下浓缩后,得到分子18的白色蜡状物。
产量:30.15g(90%)
rmn1h(dmso-d6,ppm):0.85(3h);1.09-1.52(31h);1.55-1.67(4h);1.69-2.36(10h);2.91-2.98(2h);3.02-3.17(2h);3.28-3.61(17h);4.12-4.17(0.7h);4.20-4.28(1h);4.39-4.42(0.3h);6.37(0.1h);6.71(0.9h);7.59(0.7h);7.85(0.7h);7.94(0.3h);8.21(0.3h)。
lc/ms(esi+):771.4(计算值([m+h]+):771.5)。
分子a5
采用与用于制备分子a2的方法类似的方法并应用于分子18(30.0g,38.91mmol),残留物在水(500ml)中溶解并冻干后,得到分子a5的白色固体,呈盐酸盐的形式。
产量:25.2g(91%)
rmn1h(dmso-d6,ppm):0.85(3h);1.06-1.37(20h);1.39-1.52(2h);1.58-1.66(2h);1.70-2.37(12h);2.78-2.85(2h);3.01-3.15(2h);3.31-3.62,(17h);4.11-4.17(0.7h);4.19-4.27(1h);4.41-4.44(0.3h);7.63-7.71(0.7h);7.90-8.24(4h);8.28-8.35(0.3h);
lc/ms(esi+):671.4(计算值([m+h]+):671.5)。
实施例a7:分子a7
分子21:通过分子11与l-赖氨酸之间的偶联得到的产物。
采用与用于制备分子8的方法类似的方法并应用于分子11(133.00g,408.61mmol)和l-赖氨酸(31.36g,214.52mmol),在丙酮中结晶2次后得到分子21的白色固体。
产量:106.50g(68%)
rmn1h(dmso-d6,ppm):0.85(6h);1.26(40h);1.35-1.50(6h);1.50-2.10(10h);2.10-2.25(4h);3.01(2h);3.31-3.55(4h);4.10-4.40(3h);7.68(0.6h);7.97(1h);8.27(0.4h);12.50(1h)。
lc/ms(esi):761.8(计算值([m+h]+):762.1)。
分子22:通过分子21与n-boc-l-赖氨酸甲酯之间的偶联得到的产物。
采用与用于制备分子10的方法类似的方法并应用于分子21(43.00g,56.50mmol)在thf中的溶液和n-boc-l-赖氨酸甲酯盐酸盐(20.12g,67.79mmol),得到分子22的透明固体,并且不经进一步纯化即使用。
产量:55.80g(98%)
rmn1h(dmso-d6,ppm):0.86(6h);1.08-2.03(64h);1.37(9h);2.07-2.30(4h);2.84-3.09(4h);3.29-3.57(4h);3.58-3.65(3h);4.14-4.43(4h);6.40(0.1h);6.74(0.9h);7.69(0.6h);7.82(0.6h);7.95-8.06(1h);8.11-8.20(0.4h);8.26(0.4h)。
lc/ms(esi):1003.8(计算值([m+h]+):1003.8)。
分子23:通过分子23的皂化得到的产物。
通过在0℃下缓慢添加在水(185ml)中的lioh溶液(2.00g,83.41mmol)来吸收分子22(55.80g,55.61mmol)在1∶1thf/水的混合物(370ml)中的溶液。在0℃下搅拌16小时后,将介质在减压下浓缩,并将残留物重新溶解在水(500ml)中。添加dcm(500ml),将非均相混合物冷却到10℃,并通过添加10%hcl的水溶液酸化至ph1。将水相用dcm(2x300ml)萃取,将合并的有机相用饱和nacl水溶液(2x300ml)洗涤,经na2so4干燥,过滤并在减压下浓缩。在丙酮中结晶后得到分子23的白色固体。
产量:46.10g(84%)
rmn1h(吡啶-d6,ppm):0.85(6h);1.05-2.03(67h);2.07-2.61(10h);3.12-3.93(8h);4.54-4.93(2h);4.98-5.16(2h);7.35-7.45(1h);8.34-8.63(1h);8.94-9.41(2h)。
lc/ms(esi):989.8(计算值([m+h]+):989.8)。
分子a7
在0℃下向分子23(12.00g,12.13mmol)在二氯甲烷(40ml)中的溶液中添加4nhcl在二噁烷(15.20ml)中的溶液,然后将介质在0℃下搅拌15小时,并在室温下搅拌5小时。将反应物混合物在减压下浓缩,将残留物溶解在dcm(120ml)和2nnaoh(60ml)的混合物中。分离各相后,将有机相由2nnaoh的溶液(60ml)洗涤,经na2so4干燥,并在减压下浓缩。
产量:10.90g(98%)
rmn1h(dmso-d6,ppm):0.86(6h);1.05-2.27(70h);2.45-2.52(2h);2.90-3.58(6h);3.67-3.76(1h);4.02-4.10(0.6h);4.11-4.17(0.4h);4.20-4.26(0.6h);4.30-4.39(1h);4.42-4.46(0.4h);7.29-7.42(1h);7.71-7.80(0.6h);7.97-8.05(0.6h);8.10-8.24(0.4h);8.33-8.45(0.3h);
lc/ms(esi):887.7(计算值([m-h]-):887.7)。
实施例a5a:分子a5a
分子3a:通过fmoc-lys(fmoc)-oh与树脂2-c1-三苯甲基氯之间的反应得到的产物。
在室温下向fmoc-lys(fmoc)-oh(7.32g,12.40mmol)在dcm(60ml)中的悬浮液中添加dipea(4.32ml,24.80mmol)。完全溶解(10分钟)后,将得到的溶液倒在先前在适于在固体介质上进行肽合成的反应器中用dcm洗涤的树脂2-c1-三苯甲基氯(100-200目,1%dvb,1.24mmol/g)(4.00g,4.96mmol)上。在室温下搅拌2小时后,添加hplc级甲醇(0.8ml/g树脂,3.2ml),并将介质在室温下搅拌15分钟。将树脂过滤,依次用dcm(3x60ml)、dmf(2x60ml)、dcm(2x60ml)、异丙醇(1x60ml)和dcm(3x60ml)洗涤。
分子4a:通过分子3a与80∶20dmf/哌啶混合物之间的反应得到的产物。
将先前用dmf洗涤的分子3a用80∶20dmf/哌啶混合物(60ml)吸收。在室温下搅拌30分钟后,将树脂过滤,依次用dmf(3x60ml)、异丙醇(1x60ml)和dcm(3x60ml)洗涤。
分子5a:通过分子4a与8-(9-芴甲氧羰基-氨基)-3,6-二氧杂辛酸(fmoc-o2oc-oh)之间的反应得到的产物。
向fmoc-o2oc--oh(9.56g,24.80mmol)和1-[双(二甲氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu,9.43g,24.80mmol)在混合物1∶1dmf/dcm(60ml)中的悬浮液中添加dipea(8.64ml,49.60mmol)。完全溶解后,将得到的溶液倒在分子4a上。在室温下搅拌2小时后,将树脂过滤,依次用dmf(3x60ml)、异丙醇(1x60ml)和二氯甲烷(3x60ml)洗涤。
分子6a:通过分子5a与80∶20dmf/哌啶混合物之间的反应得到的产物。
采用与用于分子4a的方法类似的方法应用于分子5a,得到分子6a。
分子7a:通过分子6a与月桂酸之间的反应得到的产物。
采用与用于分子5a的方法类似的方法应用于分子6a和dmf(60ml)中的月桂酸(4.97g,24.80mmol),得到分子7a。
分子8a:通过分子7a与80∶20二氯甲烷/1,1,1,3,3,3-六氟-2-丙醇(hfip)混合物之间的反应得到的产物。
将分子7a用80∶20二氯甲烷/1,1,1,3,3,3-六氟-2-丙醇(hfip)(60ml)混合物吸收。在室温下搅拌20分钟后,将树脂过滤,并用二氯甲烷(2x60ml)洗涤。将溶剂在减压下蒸发。然后用二氯甲烷(60ml)、然后用二异丙醚(60ml)对残留物进行两次共蒸发。在乙腈中重结晶后得到分子8a的白色固体
产量:2.63g(6步66%)
rmn1h(cdcl3,ppm):0.87(6h);1.09-1.66(40h);1.77-1.98(2h);2.13-2.29(4h);3.24-3.75(18h);3.95-4.07(4h);4.65-4.70(1h);6.23-6.37(1h);6.39-6.62(1h);6.74-6.91(1h);7.38-7.54(1h)。
lc/ms(esi):801.6(计算值([m+h]+):801.6)。
分子9a:通过分子8a与n-boc乙二胺之间的反应得到的产物。
在室温下向分子8a(2.63g,3.29mmol)在氯仿(20ml)中的溶液中依次添加hobt(654mg,4.27mmol)和boceda(580mg,3.62mmol)。将混合物冷却到0℃,然后添加edc(819mg,4.27mmol)。将介质在0℃下搅拌15分钟,然后在室温下搅拌18h。将有机相用饱和nh4cl水溶液(2x10ml)、nahco3饱和水溶液(2x10ml)和饱和nacl水溶液(2x10ml)洗涤。将有机相经na2so4干燥,过滤并在减压下浓缩。通过硅胶色谱法(洗脱液:二氯甲烷、甲醇)纯化后,得到分子9a的白色固体。
产量:2.37g(76%)
rmn1h(cdcl3,ppm):0.87(6h);1.08-1.47(34h);1.43(9h);1:48-170(7h);1.78-1.87(1h);2.14-2.25(4h);3.16-3.71(22h);3.92-4.04(4h);4.47-4.52(1h);5.33(1h);6.10(1h);6.65-7.01(1h);7.11-7.30(2h);7.47-7.63(1h)。
分子a5a
在室温下向分子9a(2.37g,2.51mmol)在二氯甲烷(50ml)中的溶液中添加4nhcl在二噁烷(6.3ml)中的溶液,然后将介质在室温下搅拌2小时。在减压下浓缩后,将残留物溶解在二氯甲烷(50ml)中,然后用1nnaoh的水溶液(2x12.5ml)和饱和nacl水溶液(25ml)洗涤。将有机相经na2so4干燥,过滤并在减压下浓缩。在乙腈中重结晶后得到分子a5a的白色固体
产量:1.57g(74%)
rmn1h(cdcl3,ppm):0.87(6h);1.08-1.43(34h);1.48-1.71(7h);1:74-1.93(3h);2.14-2.25(4h);2.79-2.86(2h);3.17-3.71(20h);3.93-4.05(4h);4.47-4.54(1h);6.08-6.29(1h);6.84-7.01(1h);7.15-7.32(2h);7.50-7.64(1h)。
lc/ms(esi):843.6(计算值([m+h]+):843.7)。
实施例a6a:分子a6a
分子10a:通过视黄酸的氢化得到的产物。
在室温下将视黄酸(19.0g,63.24mmol)在甲醇(450ml)中的溶液在10%钯/碳(1.9g)存在下置于氢气氛(1atm)中。过夜后,将反应介质在烧结过滤器上过滤,然后将滤液在减压下浓缩。得到分子10a的无色油状物。
产量:19.50g(99%)
rmn1h(cdcl3,ppm):0.45-2.01(35h);2.10-2.17(1h);2.33-2.38(1h);11.14(1h)。
lc/ms(esi):309.3(计算值([m-h]+):309.3)。
分子11a:通过boc-1-氨基-4,7,10-三氧杂-13-十三烷胺与分子10a之间的反应得到的产物。
采用与用于制备分子9a的方法类似的方法并应用于分子10a(19.3g,62.15mmol)和boctota(23.9g,74.58mmol),得到分子11a的橙色油状物。
产量:37.05g(97%)
rmn1h(cdcl3,ppm):0.43-1.71(49h);2.13-2.17(1h);3.17-3.24(2h);3.32-3.39(2h);3.51-3.66(12h);4.77(0.1h);4.94(0.9h);6.13(0.9h);6.29(0.1h)。
lc/ms(esi):613.5(计算值([m+h]+):613.5)。
分子a6a
采用与用于制备分子a5a的方法类似的方法应用于分子11a(34.9g,56.94mmol),得到分子a6a的橙色油状物。
产量:28.5g(97%)
rmn1h(cdcl3,ppm):0.41-1.96(42h);2.13(1h);2.78(2h);3.31-3.36(2h);3.53(4h);3.55-3.58(4h);3.60-3.63(4h);6.43(1h)。
lc/ms(esi):513.5(计算值([m+h]+):513.5)。
实施例a8:分子a8
分子15a:通过癸酸与l-亮氨酸之间的反应得到的产物。
采用与用于制备分子8的方法类似的方法并应用于癸酸(8.77g,50.94mmol)和l-亮氨酸(7.00g,53.36mmol),得到分子15a的白色固体。
产量:9.17g(66%)
rmn1h(dmso-d6,ppm):0.82-0.89(9h);1.18-1.65(17h);2.04-2.14(2h);4.19-4.23(1h);7.98(1h);12.40(1h)。
lc/ms(esi):286.2(计算值([m+h]+):286.2)。
分子16a:通过分子15a与l-赖氨酸甲酯之间的反应得到的产物。
向分子15a(9.16g,32.11mmol)在thf(160ml)中的溶液中依次添加三乙胺(8.12g,80.27mmol)和2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲鎓四氟硼酸盐(tbtu),并将介质在室温下搅拌30分钟。添加l-赖氨酸的二氯氢化物甲酯(3,.g,16.86mmol),并将反应介质搅拌3小时,然后在减压下浓缩。将残留物用acoet(200ml)稀释,将有机相过滤,并用1nhcl的水溶液、然后用水洗涤,经na2so4干燥,过滤并在减压下浓缩。在乙腈中研磨残留物后得到分子16a的白色固体
产量:7.33g(66%)
rmn1h(dmso-d6,ppm):0.80-0.91(18h);1.06-1.72(38h);2.03-2.16(4h);2.91-3.07(2h);3.60(1.15h);3.61(1.85h);4.13-4.28(2h);4.33-4.44(1h);7.79-7.92(3h);8.13-8.26(1h)。
lc/ms(esi)695.7(计算值([m+h]+):695.6)。
分子17a:通过分子16a的皂化得到的产物。
在0℃下向分子16a(7.33g,10.55mmol)在thf/甲醇/水(105ml)混合物中的溶液中添加lioh(505.13mg,21.09mmol),然后将介质在室温下搅拌20小时,并在减压下浓缩。将水相用1nhcl溶液酸化至ph1,并将形成的固体过滤,用水洗涤并在减压下干燥,得到分子17a的白色固体。
产量:7.09g(99%)
rmn1h(dmso-d6,ppm):0.80-0.89(18h);1.18-1.73(40h);2.03-2.16(4h);2.91-3.05(2h);4.03-4.13(1h);4.21-4.27(1h);4.31-4.40(1h);7.79-8.02(4h)。
lc/ms(esi):681.7(计算值([m+h]+):681.6)。
分子18a:通过分子17a与n-boc乙二胺之间的反应得到的产物。
采用与用于制备分子16a的方法类似的方法应用于分子17a(7.09g,10.41mmol)和n-boc乙二胺(1.83g,11.45mmol),在乙腈中研磨后得到分子18a的白色固体
产量:6.64g(77%)
rmn1h(dmso-d6,ppm):0.80-0.91(18h);1.15-1.73(49h);2.03-2.18(4h);2.92-3.13(6h);4.05-4.30(3h);6.71-6.83(1h);7.69-8.23(5h)。
lc/ms(esi):824.0(计算值([m+h]+):823.7)。
分子a8
采用与用于制备分子a5a的方法类似的方法并应用于分子18a(3.00g,3.64mmol),无需碱洗,残留物在甲醇中共蒸发4次后,得到分子a8的米色固体,呈盐酸盐的形式。
产量:2.66g(96%)
rmn1h(dmso-d6,ppm):0.80-0.91(18h);1.15-1.76(40h);2.03-2.19(4h);1.78-2.89(2h);2.91-3.07(2h);3.22-3.37(2h);4.08-4.14(1h);4.17-4.28(2h);7.81-8.36(8h)。
lc/ms(esi):723.7(计算值([m+h]+):723.6)。
实施例a9:分子a9
分子19a:13-甲基十四烷酸
在氩气下将镁屑(5.50g,226.3mmol)引入到烘干的三颈圆底烧瓶中。用无水thf(25ml)覆盖镁,并在室温下添加数滴1-溴-2-甲基丙烷以引发反应。在观察到放热并且介质略微浑浊后,经1小时逐滴添加用thf(60ml)稀释的剩余1-溴-2-甲基丙烷(28.42g,207mmol),同时保持介质的温度稳定在65至70℃。然后将反应介质通过回流加热2小时。
在处于氩气下的三颈圆底烧瓶中,向cucl(280mg,2.83mmol)溶于先前在0℃下蒸馏的n-甲基吡咯烷酮(nmp)的溶液中逐滴添加11-溴十一烷酸(25g,94.27mmol)溶于thf(60ml)的溶液。然后,向此溶液中逐滴添加在thf(50ml)中稀释的稍热的有机镁的溶液,以便保持介质的温度低于25℃。然后将混合物在室温下搅拌16小时。将介质冷却到0℃,并通过缓慢添加1nhcl的水溶液至ph1(300ml)使反应停止,并用己烷(100ml)和乙酸乙酯(2x75ml)萃取介质。有机相用1nhcl的水溶液(100ml)、水(100ml)洗涤并经na2so4干燥后,将溶液过滤并在真空下浓缩,得到棕色固体。通过快速色谱法(环己烷、乙酸乙酯)纯化后,得到白色固体。
产量:18.1g(79%)
rmn1h(cdcl3,ppm):0.87(6h);1.11-1.18(2h);1.20-1.38(16h);1.51(1h);1.63(2h);2.35(2h)。
分子20:通过分子19a与l-亮氨酸之间的反应得到的产物。
在室温下向分子19a(18.05g,74.46mmol)在thf(745ml)中的溶液中依次添加dcc(14.63g,70.92mmol)和nhs(8.16g,70.92mmol)。在室温下搅拌40小时后,将介质冷却到0℃保持20分钟,然后在烧结过滤器上过滤。将l-亮氨酸(9.77g,74.46mmol)、dipea(86ml)和水(150ml)添加到滤液中。在室温下搅拌20小时后,用以nahco3饱和的水溶液(200ml)稀释介质。将水相用乙酸乙酯(2x200ml)洗涤,并用hcl2n的水溶液酸化至ph1。过滤沉淀物,用水彻底漂洗,并在50℃和真空下干燥。将固体在戊烷中研磨3次,进行声处理,然后过滤,得到白色固体。
产量:18.8g(75%)
rmn1h(cdcl3,ppm):0.86(6h);0.96(6h);1.12-1.18(2h);1.20-1.78(22h);2.24(2h);4.58-4.63(1h);5.89(1h)。
lc/ms(esi):356.2(计算值([m+h]+):356.6)。
分子21a:通过分子20与boc-三(乙二醇)二胺之间的反应得到的产物。
在室温下向分子20(16.7g,46.97mmol)在thf(235ml)中的溶液中添加dipea(20.3)和tbtu。搅拌20分钟后,添加boc-三(乙二醇)二胺(14g,56.36mmol)。在室温下搅拌5小时后,将混合物在真空下浓缩。将残留物用乙酸乙酯(500ml)移除,用饱和nahco3水溶液(3x200ml)、1nhcl的水溶液(3x200ml)和饱和nacl水溶液(3x200ml)洗涤。经na2so4干燥、过滤并在真空下浓缩后,将残留物通过快速色谱法(环己烷、乙酸乙酯、甲醇)纯化,得到无色油状物。
产量:23.5g(85%)
rmn1h(cdcl3,ppm):0.86(6h);0.93(6h);1.10-1.17(2h);1.19-1.08(31h);2.18(2h);3.23-3.65(12h);4.41-4.56(1h);5.12-5.47(1h);5.99-6.11(0.75h);6.48-6.65(1h);7.30-7.40(0.25h)。
分子a9
采用与用于制备分子a5a的方法类似的方法应用于分子21a(23.46g,40.04mmol),无需碱洗,将在真空下浓缩后得到的残留物在乙腈/丙酮混合物中研磨。移除上清液,并将糊状残留物在真空下干燥。然后将残留物在丙酮(150ml)中研磨,并将呈盐酸盐形式的分子a9的白色固体过滤,在丙酮中漂洗,然后在真空下干燥。
产量:13.0g(64%)
rmn1h(dmso-d6,ppm):0.79-0.90(12h);1.09-1.61(24h);2.03-2.17(2h);2.92-2.98(2h);3.15-3.23(2h);3.40(2h);3.50-3.58(4h);3.61(2h);4.30-4.23(1h);7.88-8.14(5h)。
lc/ms(esi):486.4(计算值([m-]+):486.8)。
实施例a10:分子a10
分子22a:通过辛酰氯与l-脯氨酸之间的反应得到的产物。
采用与用于制备分子11的方法类似的方法并应用于辛酰氯(150.0g,0.922mol)和l-脯氨酸(212.3g,1.844mol),用10%hcl水溶液(3x300ml)、饱和nacl水溶液(300ml)洗涤有机相,经na2so4干燥,通过棉过滤,在减压下浓缩,然后通过快速色谱法(洗脱液:dcm、meoh)纯化残留物之后,得到分子22a的无色油状物。
产量:134g(60%)
rmn1h(cdcl3,ppm):0.87(3h);1.10-1.52(8h);1.57-1.74(2h);1.79-2.52(6h);3.37-3.67(2h);4.37-4.42(0.07h);4.53-5.63(0.93h);9.83(1h)。
lc/ms(esi):242.1(计算值([m+h]+):242.2)。
分子23a:通过分子22a与l-赖氨酸之间的偶联得到的产物。
向冷却到低于5℃的分子22a(132g,0.547mol)在thf(924ml)中的溶液中依次添加nhs(66.1g,0.574mol)和dcc(118.5g,0.574mol)。搅拌21小时后,通过沉淀移除沉淀物,并在15℃下经30分钟将滤液添加到l-赖氨酸(41.98g,0.287mol)在去离子水(82ml)dipea(476ml,2.735mol)的混合物中的溶液。在室温下搅拌23小时后,将反应介质在减压下浓缩,得到油状残留物,将其在水(1.3l)中稀释。将水相用acoet(2x0.5l)洗涤两次,冷却到10℃以下的温度,通过添加6nhcl溶液(120ml)进行酸化,达到ph为1,然后用dcm(3x0.6l)萃取3次。将有机相合并,用nacl的饱和溶液(0.6l)洗涤,经na2so4干燥,然后在减压下浓缩。将得到的泡沫状物用丙酮(240ml)在回流下吸收2小时。在10℃下过夜后,逐滴添加戊烷(240ml)。搅拌1小时后,通过在真空下过滤回收沉淀物,用戊烷和丙酮的1∶1混合物(150ml)洗涤,然后在真空下干燥。
产量:83.9g(52%)
rmn1h(cdcl3,ppm):0.87(6h);1.06-1.78(25h);1.80-2.41(13h);2.80-3.72(6h);4.30-4.39(0.15h);4.46-4.70(2,.85h);7.84(1h);7.93(1h)。
lc/ms(esi):593.5(计算值([m+h]+):593.4)。
分子24:通过分子23a与l-赖氨酸甲酯之间的反应得到的产物。
向分子23a(76.26g,0.129mol)中依次添加hopo(3.57g,32.1mmol)、二盐酸盐lysome(15.0g,64.3mmol)和edc(34.53g,0.18mol),然后添加先前冷却到5℃的dmf(600ml)。溶解后,逐滴添加三乙胺(43.9ml,0.315mol),同时使添加结束后的温度保持在5℃以下2小时。在室温下过夜后,将反应介质倒在水/冰混合物(2kg)和dcm(0.5l)上。搅拌15分钟后,分离各相。用dcm(2x0.4l)萃取水相。将有机相合并,用1nhcl溶液、然后用饱和nacl溶液(0.5l)洗涤,经na2so4干燥,在减压下浓缩,然后通过快速色谱法(洗脱液:dcm、meoh)纯化残留物。
产量:56.7g(67%)
rmn1h(cdcl3,ppm):0.87(12h);1.10-2.40(82h);2.86-3.72(17h);4.16-4.60(7h);6.83-8.01(6h)。
分子a10
将分子24(4.0g,3.05mmol)在乙二胺(30ml)中的溶液在50℃下加热过夜。然后将反应介质用甲基-四氢呋喃稀释,然后将有机相用饱和nacl溶液(4x30ml)洗涤4次,然后用水(2x50ml)洗涤两次,之后经na2so4干燥,然后在减压下浓缩。将残留物在回流的乙腈中溶解30分钟,然后将溶液冷却到室温,同时搅拌过夜。然后通过在真空下过滤回收白色沉淀物,用冷乙腈(2x20ml)洗涤,然后在真空下干燥。
产量:3.0g(74%)
rmn1h(cdcl3,ppm):0.87(12h);1.09-2.37(84h);2.74-4.56(25h);6.85-8.00(7h)。
lc/ms(esi):1338.0(计算值([m+h]+):1338.0)。
实施例a11:分子a11
通过在2-氯三苯甲基氯(ctc)(40.0g,1.16mmol/g)树脂上进行固相中的肽合成(spps)的常规方法得到分子a11。
在dipea(3.0当量)的存在下在dcm(10v)中进行第一fmoc-lys(fmoc)-oh(1.5当量)氨基酸的接枝。在反应结束时用甲醇(0.8ml/g树脂)封盖未反应的位点。
在hatu(2.5当量)和dipea(3.7当量)的存在下在dmf(10v)中进行被保护的氨基酸fmoc-glu(otbu)-oh(2.5当量)、fmoc-pro-oh(2.5当量)和肉豆蔻酸(2.5当量)的偶联。
使用80∶20dmf/哌啶的溶液(10v)移除保护性fmoc基团。
使用80∶20dcm/hfip的溶液(10v)从树脂上裂解产物。
在减压下浓缩后,通过硅胶色谱法(二氯甲烷、甲醇)纯化残留物。
产量:56.5g(65%)
rmn1h(cd3od,ppm):0.90(6h);1.22-2.53(140h);3.12-3.25(2h);3.43-3.80(4h);4.17-4.54(9h)。
lc/ms(esi+):1894.5(计算值([m+h]+):1894.2)。
实施例a12:分子a12
分子25:通过法尼醇的氢化得到的产物。
在氩气下向法呢醇(60.00g,269.82mmol)在thf(1200ml)中的溶液中添加氧化铂(pto2,613mg,2.70mmol),并将介质置于1atm的二氢下,然后在室温下搅拌6小时。通过硅藻土过滤并在thf中漂洗后,在减压下浓缩后得到分子25的黑色油状物。此化合物不经另外的纯化即使用。
产量:61.60g(100%)
rmn1h(cdcl3,ppm):0.85(3h);0.87(6h);0.90(3h)1.01-1.43(15h);1.47-1.66(3h);3.62-3.76(2h)。
分子26:通过分子25的氧化得到的产物。
向分子25(61.60g,269.68mmol)在二氯乙烷/水(1350ml/1080ml)混合物中的溶液中依次添加四丁基溴化铵(46.95g,145.63mmol)、乙酸(416ml,7.28mol),然后分次添加kmno4(127.85g,809.04mmol),同时保持温度在11℃与13℃之间。然后将反应介质搅拌4小时30分钟,回流,冷却到0℃,然后用37%hcl溶液(50ml)酸化至ph1。逐步添加na2so3(186.94g),同时将温度保持在0℃与10℃之间并搅拌介质,直至其完全变为无色。用37%hcl溶液将介质酸化至ph1,然后添加水(500ml)和dcm(500ml)。分离各相,并用dcm(2x500ml)萃取水相。将合并的有机相用10%hcl的水溶液(400ml)、水(2x400ml)、饱和nacl水溶液(400ml)洗涤,经na2so4干燥,过滤并在减压下浓缩。通过快速色谱法(洗脱液:环己烷、acoet)纯化后,得到分子26的黄色油状物。
产量:54.79g(84%)
rmn1h(cdcl3,ppm):0.85(3h);0.87(6h);0.97(3h);1.03-1.43(13h);1.52(1h);1.91-2.01(1h);2.11-2.18(1h);2.32-2.39(1h)。
lc/ms(esi-):241.3(计算值([m-h]-):241.2)。
分子27:通过分子26与l-脯氨酸甲酯之间的偶联得到的产物。
在0℃下向分子26(54.70g,225.66mmol)在dcm(1500ml)中的溶液中依次添加hobt(3.46g,22.57mmol)、dipea(117.92,676.97mmol)、l-脯氨酸甲酯盐酸盐(56.05g,338.49mmol),然后添加edc(64.89g,338.49mmol)。将反应混合物在0℃下搅拌1小时,然后在室温下搅拌18小时。然后将介质用dcm(1000ml)稀释,然后以饱和nahco3水溶液(2x1l)、1nhcl的水溶液(2x1000ml)和nacl的水溶液(2x1000ml)洗涤。将有机相经na2so4干燥,过滤并在减压下浓缩,得到分子27的黄色油状物,其不经进一步纯化即使用。
产量:77.15g(97%)
rmn1h(dmso-d6,ppm):0.79-0.89(12h);0.98-1.43(13h);1.51(1h);1.70-2.32(7h);3.33-3.42(0.4h);3.46-3.57(1.6h);3.59(2.4h);3.67(0.6h);4.23-4.32(0.8h);4.53-4.62(0.2h)。
lc/ms(esi+):354.2(计算值([m+h]+):354.3)。
分子28:通过分子27的皂化得到的产物。
在0℃下向分子27(77.15g,218.22mmol)在thf/meoh1∶1的混合物(1454ml)中的溶液中逐滴添加lioh(7.84g,327.33mmol)在水(727ml)中的溶液。将反应混合物在0℃下搅拌18小时,然后在室温下搅拌5小时。将有机溶剂在减压下蒸发。添加水(500ml)、10%hcl的水溶液(200ml)和dcm(800ml),并分离各相。用dcm(2x1l)萃取水相。将有机相合并,用水(500ml)、nacl的水溶液(500ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到分子28的黄色油状物,其不经进一步纯化即使用。
产量:71.72g(97%)
rmn1h(dmso-d6,ppm):0.73-0.95(12h);0.95-1.42(13h);1.51(1h);1.65-2.32(7h);3.24-3.64(2h);4.13-4.28(0.8h);4.37-4.50(0.2h);12.44(1h)。
lc/ms(esi+):340.2(计算值([m+h]+):340.3)。
分子a12
通过在2-氯三苯甲基氯(ctc)(34.5g,1.16mmol/g)树脂上进行固相中的肽合成(spps)的常规方法得到分子a12。
在dipea(10.0当量)的存在下在dcm(10v)中进行二胺乙烯(10.0当量)的接枝。在反应结束时用甲醇(0.8ml/g树脂)封盖未反应的位点。
在hatu(相对于酸为1.0当量)和dipea(相对于酸为2.0当量)的存在下在1∶1dcm/dmf混合物(10v)中进行被保护的氨基酸fmoc-lys(fmoc)-oh(1.5当量)、fmoc-glu(ome)-oh(3.0当量)和分子28(3.0当量)的偶联。
使用80∶20dmf/哌啶的溶液(10v)(与赖氨酸偶联后)或在dmf中为50%的吗啉的溶液(与谷氨酸偶联后)撤除保护性fmoc基团。
使用50∶50dcm/tfa的溶液(10v)从树脂上裂解产物。蒸发后,将残留物溶解在methf(450ml)中,并将有机相用饱和nahco3水溶液(3x450ml)和饱和nacl水溶液(200ml)洗涤。经na2so4干燥后,将有机相过滤,在减压下浓缩,并通过硅胶色谱法(二氯甲烷、甲醇、nh4oh)纯化残留物。
产量:13.95g(7步31%)。
rmn1h(dmso-d6,ppm):0.73-0.91(24h);0.96-2.41(56h);2.72(2h);2.89-3.10(2h);3.15-3.26(2h);3.26-3.51(4h);3.57(3h);3.58(3h);3.99-4.50(5h)6.07(2h);7.59-8.39(5h)。
lc/ms(esi+):1118.2(计算值([m+h]+):1117.8)。
实施例a13:分子a13
分子29:通过由n-boc-乙二胺引发l-谷氨酸-γ-苄酯n-羧基酸酐聚合得到的产物。
在反应器中,在25℃下将l-谷氨酸-γ-苄酯n-羧基酸酐(39.44g,149.82mmol)溶解在dmf(81ml)中。然后搅拌混合物,直到完全溶解,冷却到-10℃,然后快速引入boceda(6.00g,37.45mmol)在dmf(7ml)中的溶液。将反应介质在0℃下搅拌3小时,然后添加hcl在1.4二噁烷中的溶液(3.33m,11.8ml,39.29mmol)。在室温下搅拌反应介质,然后倒入用冰浴冷却的meoh/ipe溶液(125ml/495ml)。在室温下搅拌65小时后,将沉淀物在烧结过滤器上过滤,用ipe(2x90ml)洗涤,并在30℃和减压下干燥。
产量:21.71g(54%)
dp(根据rmn1h估计):4.9
呈盐酸盐形式的分子29的平均计算摩尔质量为1270.9g/mol。
rmn1h(dmso-d6,ppm):1.35(9h);1.72-2.09(9.8h);2.23-2.60(9.8h);2.86-3.19(4h);3.85(1h);4.14-4.52(3.9h);4.86-5.23(9.8h);6.33-6.85(1h);7.09-7.55(24.5h);7.88-8.42(6.9h);8.67(1h)。
分子30:通过肉豆蔻酰氯与分子29之间的偶联得到的产物。
呈盐酸盐形式的分子29(12.46g,9.80mmol)在dcm(115ml)中溶解后,将溶液冷却到0℃。然后依次添加以下物质:三乙胺(2.35g,23.24mmol)以及肉豆蔻酰氯(3.16g,12.79mmol)在dcm(16ml)中的溶液。将反应介质在0℃下搅拌4h,然后在[室]温下搅拌2小时,之后倒在ipe(920ml)上。在室温下搅拌14小时后,将沉淀物过滤,用etoh(2x145ml,然后100ml)洗涤,并在30℃和减压下干燥。
产量:9.77g(69%)
dp(根据rmn1h估计):5.1
分子30的平均计算摩尔质量为1488.7g/mol。
rmn1h(cdcl3,ppm):0.87(3h);1.07-1.51(29h);1.51-1.64(2h);1.80-2.75(22.4h);2.98-3.73(4h);3.84-4.50(5.1h);4.86-5.32(10.2h);5.71-6.47(1h);6.72-8.38(31.6h)。
分子a13
在0℃下向分子30(4.70g,3.16mmol)在dcm(31ml)中的溶液中添加tfa(31ml)。将反应介质在0℃下搅拌2小时,然后在减压和室温下浓缩。使残留物返回到dcm(100ml)中,然后在减压和室温下干燥浓缩。将残留物溶解在dcm(100ml)中,并用ph=10.4的碳酸盐缓冲水溶液(326ml,然后是2x200ml)、然后用hcl的水溶液(0.1n,2x200ml)洗涤。将有机溶液经na2so4干燥,过滤,然后在40℃和减压下干燥浓缩。
产量:3.96g(88%)
dp(根据rmn1h估计):5.2
呈盐酸盐形式的分子a13的平均计算摩尔质量为1446.9g/mol。
rmn1h(tfa-d,ppm):0.91(3h);1.17-1.47(20h);1.60-1.74(2h);1.99-2.78(22.8h);3.41-4.05(4h);4.62-4.83(5.2h);5.05-5.35(10.4h);6.99-8.02(26h)。
实施例a14:分子a14
分子31:通过分子14与boc-乙二胺之间的反应得到的产物。
采用与用于制备分子10的方法类似的方法并应用于分子14(12.00g,40.35mmol)和boceda(7.76g,48.42mmol),得到分子31的无色油状物并且不经进一步纯化即使用。
产量:17.40g(94%)
rmn1h(cdcl3,ppm):0.86(3h);1.11-1.68(18h);1.41(9h);1.80-2.38(6h);3.06-3.35(4h);3.37-3.49(1h);3.51-3.73(1h);4.26-4.31(0.1h);4.45-4.52(0.9h);4.91-5.19(1h);6.97(0.1h);7.23(0.9h)。
lc/ms(esi+):440.4(计算值([m+h]+):440.3)。
分子a14
采用与用于制备分子a2的方法类似的方法并应用于分子31(8.85g,20.13mmol)在dcm中的溶液,碱洗、在减压下浓缩、然后在乙腈中重结晶之后,得到分子a14的白色固体
产量:6.53g(96%)
rmn1h(dmso,ppm):0.85(3h);1.07-1.56(20h);1.68-2.03(4h);2.09-2.29(2h);2.50-2.58(2h);2.96-3.11(2h);3.21-3.59(2h);4.17-4.21(0.65h);4.25-4.29(0.35h);7.68(0.65h);8.00(0.35h)
lc/ms(esi):340.3(计算值([m+h]+):340.3)。
.3).
实施例a15:分子a15
通过在2-氯三苯甲基氯(ctc)(16.0g,1.16mmol/g)树脂上进行固相中的肽合成(spps)的常规方法得到分子a15。
在dcm(10v)中进行二胺乙烯(20.0当量)的接枝。在反应结束时用甲醇(0.8ml/g树脂)封盖未反应的位点。
在hatu(相对于酸为1.0当量)和dipea混合物(相对于酸为1.5当量)的存在下在dcm(10v)(lys和分子11偶联)或1∶1dcm/dmf混合物(10v)中进行被保护的氨基酸fmoc-lys(fmoc)-oh(3.0当量)、fmoc-glu(obn)-oh(4.0当量)和分子11(3.0当量)的偶联。
使用80:20dmf/哌啶的溶液(10v)(与赖氨酸偶联后)或在dmf中为1%的dbu的溶液(与谷氨酸偶联后)移除保护性fmoc基团
使用50∶50dcm/tfa的溶液(10v)从树脂上裂解产物。浓缩后,将残留物溶解在乙酸乙酯(400ml)中,并将有机相用ph10的碳酸盐缓冲水溶液(1m)(2x400ml)、然后是饱和nacl水溶液(400ml)洗涤。经na2so4干燥后,将有机相过滤,在减压下浓缩,并通过硅胶色谱法(二氯甲烷、甲醇、nh4oh)、然后通过在乙腈中重结晶来纯化残留物。
产量:16.20g(7步70%)。
rmn1h(dmso-d6,ppm):0.85(6h);1.11-2.57(72h);2.50-5.57(2h);2.90-3.08(4h);3.36-3.61(4h);4.06-4.43(5h);5.08(4h);7.27-7.40(10h);7.51-8.31(5h)。
lc/ms(esi+):1242.0(计算值([m+h]+):1241.9)。
实施例a16:分子a16
分子32:通过spps得到的产物
通过在2-氯三苯甲基氯(ctc)(50.0g,1.14mmol/g)树脂上进行固相中的肽合成(spps)的常规方法得到分子32。
在dipea(2.6当量)的存在下在dcm(10v)中进行第一fmoc-glu(otbu)-oh(1.3当量)氨基酸的接枝。在反应结束时用甲醇(0.8ml/g树脂)封盖未反应的位点。
在hatu(相对于酸为1.0当量)和dipea(相对于酸为1.5当量)的存在下在dmf(10v)中进行被保护的氨基酸fmoc-glu(otbu)-oh(1.3当量)和分子11(3.0当量)的偶联。
使用80∶20dmf/哌啶的溶液(10v)撤除保护性fmoc基团。
使用80∶20dcm/hfip的溶液(10v)从树脂上裂解产物。
在减压下浓缩后,通过在二异丙醚中研磨来纯化残留物。
产量:35.78g(90%)
rmn1h(cdcl3,ppm):0.88(3h);1.19-1.35(20h);1.43(9h);1.44(9h);1.55-1.67(2h);1.90-2.46(14h);3.46-3.54(1h);3.63-3.71(1h);4.33-4.40(1h);4.43-4.52(2h)7.35(0.05h);7.40(0.05h);7.63(0.95h);7.94(0.95h)。
lc/ms(esi+):696.4(计算值([m+h]+):696.5)。
分子33:通过分子32与n-cbz乙二胺之间的反应得到的产物。
采用与用于制备分子7的方法类似的方法,并且在dipea(15.0ml,86.22mmol)的存在下应用于分子32(30.0g,43.11mmol)和n-cbz乙二胺盐酸盐(cbzeda·hcl,11.93g,51.73mmol),得到分子33的米色固体。其不经另外的纯化即使用。
产量:37.6g(100%)
rmn1h(cdcl3,ppm):0.88(3h);1.19-1.34(20h);1.42(9h);1.44(9h);1.52-2.54(16h);3.16-3.70(6h);4.08-4.15(1h);4.19-4.25(1h);4.43-4.53(1h);5.00(1h);5.08(1h);6.56(1h);7.00(1h);7.24-7.37(5h);7.59(1h);8.41(1h)。
lc/ms(esi+):872.5(计算值([m+h]+):872.6)。
分子a16
在氩气的气氛下向分子33(37,.6g,43.11mmol)在甲醇(376ml)中的溶液中添加pd/al2o3(3.76g)。将混合物置于氢气氛(7巴)下,并在室温下搅拌72小时。在p4过滤器上进行催化剂的p4过滤后,然后通过omnipore0.2μmptfe亲水膜,将滤液在减压下蒸发,得到分子a16,呈粘性油状物的形式。
产量:31.06g(98%)
rmn1h(cdcl3,ppm):0.88(3h);1.19-1.35(20h);1.43(9h);1.46(9h);1.56-1.67(2h);1.92-2.12(6h);2.24-2.54(8h);2.71(2h);2.90(2h);3.22-3.32(1h);3.42-3.51(1h);3.55-3.64(1h);3.73-3.81(1h);4.13-4.21(1h);4.26-4.33(1h);4.39-4.48(1h);7.10(1h);7.71(1h);8.45(1h)。
lc/ms(esi+):738.5(计算值([m+h]+):738.5)。
分子a17
通过在2-氯三苯甲基氯(ctc)(64.66g,1.16mmol/g)树脂上进行固相中的肽合成(spps)的常规方法得到分子a17。
在dipea(10.0当量)的存在下在dcm(10v)中进行二胺乙烯(10.0当量)的接枝。在反应结束时用甲醇(0.8ml/g树脂)封盖未反应的位点。
在hatu(相对于酸为1.0当量)和dipea(相对于酸为2.0当量)的存在下进行被保护的氨基酸fmoc-glu(otbu)-oh(1.5当量)和分子28(1.5当量)的偶联,对于谷氨酸的偶联在1∶1dcm/dmf(10v)混合物中进行,或者对于分子28的偶联在dmf(10v)中进行。
使用50∶50dmf/吗啉的溶液(10v)移除保护性fmoc基团。
使用50∶50dcm/tfa的溶液(10v)从树脂上裂解产物。蒸发后,将残留物溶解在methf(500ml)中,并将有机相用na2co3的5%水溶液(3x250ml)洗涤,然后用methf(1x150ml)萃取水相。将合并的有机相经na2so4干燥并过滤。添加在meoh中的hcl溶液(1.25m),然后将介质在减压下浓缩。在硅胶(二氯甲烷、甲醇)上纯化残留物,得到分子a17的盐酸盐,呈浅棕色固体形式。
产量:12.48g(5步30%)。
rmn1h(dmso-d6,ppm):0.76-0.90(12h);0.97-1.41(13h);1.45-1.55(1h);1.68-2.40(11h);2.77-2.92(2h);3.20-3.64(4h);3.57(3h);4.15-4.49(2h);7.90-8.48(5h)。
lc/ms(esi+):525.5(计算值([m+h]+):525.4)。
实施例a18:分子a18
分子34:通过植醇的氢化得到的产物。
在氩气下向植醇(260.00g,878.78mmol)在乙醇(1.25l)中的溶液中添加在水中为50%的雷尼镍(30.75g,175.36mmol)。将介质置于1巴的二氢下,然后在室温下搅拌8小时。在硅藻土/二氧化硅/硅藻土垫上过滤并在乙醇中漂洗后,在减压下浓缩后得到分子34的无色油状物。
产量:261.40g(定量)
rmn1h(cdcl3,ppm):0.84(6h);0.86(6h);0.89(3h)1.00-1.46(22h);1.46-1.68(3h);3.61-3.73(2h)。
分子35:通过分子34的氧化得到的产物。
采用与用于制备分子26的方法类似的方法应用于分子34(29.00g,97.13mmol),得到分子35的黄色油状物。
产量:28.70g(94%)
rmn1h(cdcl3,ppm):0.84(6h);0.86(6h);0.97(3h);1.00-1.41(20h);1.52(1h);1.96(1h);2.14(1h);2.35(1h);11.31(1h)。
lc/ms(esi):311.1(计算值([m-h]+):311.3)。
分子36:通过分子35与l-脯氨酸甲酯之间的偶联得到的产物。
采用与用于制备分子27的方法类似的方法应用于分子35(18.00g,57.59mmol)和l-脯氨酸甲酯(14.31g,86.39mmol),得到分子36的黄色油状物。
产量:23.20g(95%)
rmn1h(dmso-d6,ppm):0.78-0.89(15h);0.97-1.43(20h);1.43-1.56(1h);1.70-1.96(4h);1.96-2.32(3h);3.33-3.56(2h);3.59(0.6h);3.67(2.4h);4.27(0.8h);4.57(0.2h)。
lc/ms(esi):424.4(计算值([m+h]+):424.4)。
分子37:通过分子36的皂化得到的产物。
采用与用于制备分子28的方法类似的方法应用于分子36(21.05g,49.68mmol),得到分子37的黄色油状物。
产量:20.40g(99%)
rmn1h(dmso-d6,ppm):0.77-0.91(15h);0.97-1.43(20h);1.43-1.56(1h);1.67-1.96(4h);1.96-2.29(3h);3.26-3.56(2h);4.20(0.8h);4.41(0.2h)。
lc/ms(esi):410.3(计算值([m+h]+):410.4)。
分子a18
通过在2-氯三苯甲基氯(ctc)(26.72g,1.16mmol/g)树脂上进行固相中的肽合成(spps)的常规方法得到分子a18。
采用与用于制备分子a17的方法类似的方法应用于4,7,10-三氧杂-1,13-十三烷二胺(tota,68.30g,310.0mmol)、fmoc-glu(ome)-oh(23.77mmol,62.00mmol)和分子37(19.04g,46.50mmol),得到分子a18的黄色油状物,呈盐酸盐形式。
产量:5.53g(5步23%)。
rmn1h(dmso-d6,ppm):0.76-0.89(15h);0.97-2.38(36h);2.77-2.87(2h);3.00-3.17(3h);3.32-3.54(13h);3.57(3h);4.09-4.18(0.75h);4.20-4.29(1h);4.39-4.47(0.25h);7.63-8.36(5h)。
lc/ms(esi+):755.7(计算值([m+h]+):755.6)。
实施例a19:分子a19
以与分子a16相同的方式,通过在spps阶段期间使用分子14代替分子11来合成分子a19。
总产量(3个阶段):32.6g(81%)
rmn1h(cdcl3,ppm):0.88(3h);1.20-1.35(16h);1.43(9h);1.46(9h);1.56-1.68(2h);1.93-2.11(6h);2.24-2.55(10h);2.85(2h);3.19-3.29(1h);3.38-3.48(1h);3.55-3.64(1h)3.74-3.82(1h);4.14-4.21(1h);4.25-4.32(1h);4.41-4.50(1h);7.03(1h);7.69(1h);8.42(1h)。
lc/ms(esi):710.4(计算值([m+h]+):710.5)。
实施例a20:分子a20
通过在2-氯三苯甲基氯(ctc)(40.00g,1.16mmol/g)树脂上进行固相中的肽合成(spps)的常规方法得到分子a20。
在dcm(10v)中进行二胺乙烯(20.0当量)的接枝。在反应结束时用甲醇(0.8ml/g树脂)封盖未反应的位点。
在hatu(相对于酸为1.0当量)和dipea(相对于酸为1.5当量)的存在下在dmf(10v)中进行被保护的氨基酸fmoc-lys(fmoc)-oh(1.5当量)、fmoc-glu(otbu)-oh(2.5当量)和分子11(2.5当量)的偶联。
使用80∶20dmf/哌啶的溶液(10v)移除保护性fmoc基团。
使用50∶50dcm/tfa的溶液(10v)从树脂上裂解产物。蒸发后,将残留物溶解在水(600ml)中,通过添加naoh5n的溶液将溶液的ph调节至7,然后将产物冻干。通过硅胶柱色谱法(二氯甲烷、甲醇、nh4oh)纯化冻干物,得到呈白色固体形式的分子a20。
产量:24.6g(7步50%)。
rmn1h(meod-d4,ppm):0.90(6h);1.18-2.45(68h);2.45-2.60(2h);3.05-3.11(2h);3.11-3.19(1h);3.23-3.33(1h);3.43-3.66(4h);3.82-3.94(2h);4.10-4.51(5h)。
lc/ms(esi+):1061.9(计算值([m+h]+):1061.8)。
b部分-疏水共聚氨基酸的合成
i)根据式xxx、xxxa、xxxb的共聚氨基酸
共聚氨基酸b1:聚-l-谷氨酸钠,其在其末端之一被分子a1修饰,并且数均摩尔质量(mn)为2800g/mol
在先前烘干的烧瓶中,将l-谷氨酸-γ-苄酯n-羧基酸酐(8.95g,34mmol)溶解在无水dmf(34ml)中。将混合物冷却到4℃,然后快速引入分子a1(1.64g,1.55mmol)在氯仿(6.6ml)中的溶液。将混合物在4℃与室温之间搅拌68小时,然后加热到65℃持续2小时。一半的溶剂在减压下被蒸馏,然后将反应介质冷却到室温,并在搅拌的同时逐滴倒入二异丙醚(300ml)中。通过过滤回收白色沉淀物,用二异丙醚(5x50ml)洗涤,然后在30℃和减压下干燥,以便得到白色固体。将固体(7.9g)在tfa(30ml)中稀释,然后在0℃下逐滴添加33%氢溴酸(hbr)在乙酸(21ml,120mmol)中的溶液。将溶液在室温下搅拌2小时,然后在搅拌的同时逐滴倒在二异丙醚/水的1∶1混合物(v/v)(360ml)之上。搅拌2小时后,使非均相混合物静置过夜。通过过滤回收白色沉淀物,依次用ipe(2x30ml)、然后用水(2x30ml)洗涤。将得到的固体溶解在水(200ml)中,同时通过添加1n苏打水溶液将ph调节至7。添加水(65ml)。将混合物通过0.45μm过滤器过滤,然后通过针对0.9%nacl溶液超滤、然后通过水进行纯化,直到渗透物的导电度小于50μs/cm。然后将共聚氨基酸浓缩至约理论值25g/l,将ph调节至7,并将水溶液通过0.2μm过滤。用水和丙酮稀释此溶液,以便得到12g/l的按质量计含30%丙酮的溶液,然后通过活性碳过滤器(3mr53slp)对其进行过滤。蒸馏丙酮(40℃,100毫巴),并通过针对0.9%nacl溶液、然后针对水进行超滤来纯化溶液,直到渗透物的导电度小于50μs/cm。然后将共聚氨基酸溶液浓缩,并将ph调节至7。将水溶液通过0.2μm过滤,并在4℃下储存。
干萃取物:17.8mg/g
dp(根据rmn1h估计):26
根据rmn1h:i=0.038
共聚氨基酸b1的平均计算摩尔质量为4994g/mol。
有机hplc-sec(peg校准):mn=2800g/mol
共聚氨基酸b2:聚-l-谷氨酸钠,其被分子a2修饰,对其酯进行了皂化,并且数均摩尔质量(mn)为5200g/mol
共聚氨基酸b2-1:由己胺引发l-谷氨酸-γ-苄酯n-羧基酸酐聚合得到的聚-l-谷氨酸
在带夹套的反应器中,将l-谷氨酸-γ-苄酯n-羧基酸酐(500g,1.90mol)溶解在无水dmf(1100ml)中。然后搅拌混合物,直到完全溶解,冷却到0℃,然后快速引入己胺(6.27ml,47.5mmol)。将混合物在0℃下搅拌5h,在0℃与20℃之间搅拌7h,然后在20℃下搅拌7h。然后将反应介质加热到65℃保持2h,冷却到55℃,并经1h30引入甲醇(3300ml)。然后将反应混合物冷却到0℃并搅拌18小时。通过过滤回收白色沉淀物,用二异丙醚(2x800ml)洗涤,然后在30℃和减压下干燥,得到聚(γ-苄基-l-谷氨酸)(pblg)。
在氩气氛下向pblg(180g)在n,n-二甲基乙酰胺(dmac,450ml)中的溶液中添加pd/al2o3(36g)。将混合物置于氢气氛(10巴)下,并在60℃下搅拌24小时。冷却到室温并在烧结p4上过滤催化剂后,然后通过omnipore0.2μmptfe亲水膜过滤,经45分钟时段并在搅拌的同时将ph2的水溶液(2700ml)逐滴地滴在dmac溶液上。搅拌18小时后,通过过滤回收白色沉淀物,用水(4x225ml)洗涤,然后在30℃和减压下干燥
共聚氨基酸b2
在40℃下将共聚氨基酸b2-1(15.0g)溶解在dmf(230ml)中,然后添加n-甲基吗啉(nmm,11.57g,114.4mmol)。同时,将呈盐酸盐形式的分子a2(10.17g,17.2mmol)放入在dmf(250ml)中的悬浮液中并添加三乙胺(2.39ml,17.2mmol),然后在搅拌的同时略微加热混合物,直到完全溶解。向冷却到25℃的共聚氨基酸溶液中依次添加分子a2的溶液、n-氧化物2-羟基吡啶(hopo,3.81g,34.3mmol)、然后是edc(6.58g,34.3mmol)。将反应介质在25℃下搅拌2h,通过0.2mm织物过滤器过滤,并在搅拌的同时逐滴地滴在含有15%nacl溶液和hcl(ph2)的2.6l水之上。添加结束时,用1nhcl的溶液将ph重新调节至2,并使悬浮液静置过夜。收集沉淀物,然后用2x100ml水漂洗。通过缓慢添加1nnaoh的水溶液直到ph7,将得到的白色固体溶解在1.2l水中,同时搅拌,然后将溶液通过0.45μm过滤器过滤。添加乙醇(按质量计30%),然后将溶液通过活性碳过滤器(3mr53slp)过滤。在搅拌的同时缓慢添加10nnaoh的溶液,直至ph13,然后将混合物搅拌2小时。通过添加37%hcl溶液中和至ph7后,通过针对nacl的0.9%溶液、然后针对水进行超滤来纯化得到的澄清溶液,直到渗透物的导电度小于50μs/cm。然后将共聚氨基酸溶液浓缩,并将ph调节至7。将水溶液通过0.2μm过滤,并在4℃下储存。
干萃取物:22.6mg/g
dp(根据rmn1h估计):40
根据rmn1h:i=0.15
共聚氨基酸b2的平均计算摩尔质量为9301g/mol。
有机hplc-sec(peg校准):mn=5200g/mol。
共聚氨基酸b3:聚-l-谷氨酸钠,其被分子a3修饰,对其酯进行了皂化,并且数均摩尔质量(mn)为4900g/mol
在40℃下将共聚氨基酸b2-1(12.0g)溶解在dmf(92ml)中,然后添加n-甲基吗啉(nmm,9.25g,91.5mmol)。同时,制备盐酸盐形式的分子a3(7.51g,13.7mmol)和n,n-二异丙基乙胺(dipea,2.39ml,13.7mmol)在dmf(27ml)中的溶液。向冷却到25℃的共聚氨基酸溶液中依次添加分子a3的溶液、n-氧化物2-羟基吡啶(hopo,3.05g,27.4mmol)。将混合物冷却到0℃,然后添加edc(5.26g,27.4mmol)。在0℃下5分钟后,将反应介质在25℃下搅拌2h,通过0.2mm织物过滤器过滤,并在搅拌的同时逐滴地滴在含有15%nacl溶液和hcl(ph2)的950ml水之上。添加结束时,用1nhcl的溶液将ph重新调节至2,并使悬浮液静置过夜。收集沉淀物,然后用3x100ml水漂洗。通过在搅拌的同时缓慢添加naoh1n的水溶液直到ph7将得到的固体溶解在1l水中。一旦完全溶解,通过添加10nnaoh溶液将ph经2小时调节至ph12,然后经1小时调节至ph13。通过添加37%hcl溶液中和至ph7后,将此溶液用水和乙醇稀释,以便得到按质量计含有30%乙醇的12g/l溶液,然后通过活性碳过滤器(3mr53slp)将其过滤。将溶液通过0.45μm过滤器过滤,然后通过针对0.9%nacl溶液超滤进行纯化,直到渗透物的导电度小于50μs/cm。然后将共聚氨基酸溶液浓缩,并将ph调节至7。将水溶液通过0.2μm过滤,并在4℃下储存。
干萃取物:20.6mg/g
dp(根据rmn1h估计):40
根据rmn1h:i=0.15
共聚氨基酸b3的平均计算摩尔质量为8977g/mol。
有机hplc-sec(peg校准):mn=4900g/mol。
共聚氨基酸b4:聚-l-谷氨酸钠,其被分子a4修饰,对其酯进行了皂化,并且数均摩尔质量(mn)为4700g/mol
采用与用于制备共聚氨基酸b3的方法类似的方法应用于分子a4的盐酸盐(7.12g,13.7mmol)和共聚氨基酸b2-1(12.0g),得到被分子a4修饰的聚-l-谷氨酸钠,对其酯进行了皂化。
干萃取物:19.4mg/g
dp(根据rmn1h估计):40
根据rmn1h:i=0.15
共聚氨基酸b4的平均计算摩尔质量为8809g/mol。
有机hplc-sec(peg校准):mn=4700g/mol。
共聚氨基酸b5:聚-l-谷氨酸钠,其被分子a5修饰,对其酯进行了皂化,并且数均摩尔质量(mn)为5400g/mol
采用与用于制备共聚氨基酸b3的方法类似的方法应用于分子a5的盐酸盐(9.71g,13.7mmol)和共聚氨基酸b2-1(12.0g),得到被分子a5修饰的聚-l-谷氨酸钠,对其酯进行了皂化。
干萃取物:20.8mg/g
dp(根据rmn1h估计):40
根据rmn1h:i=0.15
共聚氨基酸b5的平均计算摩尔质量为9939g/mol。
有机hplc-sec(peg校准):mn=5400g/mol。
共聚氨基酸b7:聚-l-谷氨酸钠,其在其末端之一被分子a7修饰,并且数均摩尔质量(mn)为2500g/mol
采用与用于制备共聚氨基酸b1的方法类似的方法应用于分子a7(2.50g,2.74mmol)和l-谷氨酸-γ-苄酯n-羧基酸酐(15.89g,60.4mmol),得到聚-l-谷氨酸钠,其在其末端之一被分子a7修饰。
干萃取物:20.3mg/g
dp(根据rmn1h估计):26
根据rmn1h:i=0.038
共聚氨基酸b7的平均计算摩尔质量为3893g/mol。
有机hplc-sec(peg校准):mn=2500g/mol
共聚氨基酸b13:聚-l-谷氨酸钠,其在其末端之一被分子a11修饰,对其酯进行了脱保护,并且数均摩尔质量(mn)为3000g/mol
在带夹套的反应器中,将l-谷氨酸-γ-苄酯n-羧基酸酐(24.50g,93.05mmol)溶解在无水dmf(55ml)中。然后搅拌混合物,直到完全溶解,冷却到0℃,然后快速引入己胺(0.56ml,4.23mmol)。将混合物在0℃下搅拌48h,然后依次添加以下物质:分子a11(9,.g,5.08mmol)在dmf(50ml)中的溶液、hopo(564mg,5.08mmol)和edc(973mg,5.08mmol)。将反应介质在0℃下搅拌1h,在0℃与20℃之间搅拌2h,然后在20℃下搅拌16h。然后在室温下在搅拌的同时将此溶液加入到1∶1h2o/meoh混合物(10v)中。4小时后,通过过滤回收白色沉淀物,用二异丙醚(2x100ml)、水(2x100ml)和1∶1h2o/meoh混合物(2x100ml)洗涤,然后在减压下干燥。
将得到的固体溶解在tfa(220ml)中,并在室温下搅拌2小时30分钟。然后在室温下在搅拌的同时将此溶液倒入水(10v)中。搅拌2小时30分钟后,通过过滤回收白色沉淀物,用水(2x200ml)洗涤,然后在减压下干燥。
将得到的固体溶解在n,n-二甲基乙酰胺(dmac,210ml)中,在氩气氛下添加pd/al2o3(2.1g)。将混合物置于氢气氛(6巴)下,并在60℃下搅拌24小时。冷却到室温并在烧结p4上过滤催化剂后,然后通过omnipore0.2μmptfe亲水膜过滤,经45分钟时段并在搅拌的同时将含有15%nacl的ph2的水溶液(6v)逐滴地滴在dmac溶液上。搅拌18小时后,通过过滤回收白色沉淀物,用水洗涤,然后在减压下干燥。将得到的固体溶解在水(600ml)中,同时通过添加1n苏打水溶液将ph调节至7。然后将ph调节至ph12,并将溶液搅拌1小时。中和至ph7后,通过0.2μm过滤溶液,用乙醇稀释,以便得到按质量计含有30%乙醇的溶液,然后通过活性碳过滤器(3mr53slp)过滤。将溶液通过0.45μm过滤器过滤,然后通过针对0.9%nacl溶液超滤进行纯化,直到渗透物的导电度小于50μs/cm。然后将共聚氨基酸溶液浓缩,并将ph调节至7。将水溶液通过0.2μm过滤,并在4℃下储存。
干萃取物:23.5mg/g
dp(通过rmn1h估计)=24,因此i=0.042
共聚氨基酸b13的平均计算摩尔质量为5377g/mol。
有机hplc-sec(peg校准):mn=3000g/mol。
共聚氨基酸b14:聚-l-谷氨酸钠,其在其末端之一被分子a12修饰,对其酯进行了脱保护,并且数均摩尔质量(mn)为3300g/mol
共聚氨基酸b14-1:聚-l-谷氨酸苄酯,其在其末端之一被分子a12修饰。
在先前烘干的烧瓶中,将l-谷氨酸-γ-苄酯n-羧基酸酐(50.00g,189.39mmol)溶解在无水dmf(65ml)中。然后搅拌混合物,直到完全溶解,冷却到0℃,然后快速引入分子a12(9.65g,8.63mmol)在dmf(50ml)中的溶液。将混合物从0℃到室温搅拌2小时,然后加热到65℃持续2小时。将反应介质冷却到室温,并在搅拌的同时逐滴倒入二异丙醚(1.8ml)中。通过过滤回收白色沉淀物,用二异丙醚洗涤两次,然后在30℃和真空下干燥,以便得到白色固体。
共聚氨基酸b14
将共聚氨基酸b14-1溶解在dmac(250ml)中,然后在氩气氛下添加pd/al2o3(5.0g)。将混合物置于氢气氛(10巴)下,并在60℃下搅拌24小时。冷却到室温并在烧结p4上过滤催化剂后,然后通过omnipore0.2μmptfe亲水膜过滤,经45分钟时段并在搅拌的同时将ph2的水溶液(6v)逐滴地滴在dmac溶液上。搅拌18小时后,通过过滤回收白色沉淀物,用水洗涤,然后在减压下干燥。将得到的固体溶解在水(1.25l)中,同时通过添加1n苏打水溶液将ph调节至7。然后将ph调节至ph13,并将溶液搅拌3小时。中和至ph7后,通过0.2μm过滤溶液,用乙醇稀释,以便得到按质量计含有30%乙醇的溶液,然后通过活性碳过滤器(3mr53slp)过滤。将溶液通过0.45μm过滤器过滤,然后通过针对0.9%nacl溶液超滤进行纯化,直到渗透物的导电度小于50μs/cm。然后将共聚氨基酸溶液浓缩,并将ph调节至7。将水溶液通过0.2μm过滤,并在4℃下储存。
干萃取物:25.7mg/g
dp(通过rmn1h估计)=24,因此i=0.042
共聚氨基酸b14的平均计算摩尔质量为4720g/mol。
有机hplc-sec(peg校准):mn=3300g/mol。
共聚氨基酸b15:聚-l-谷氨酸钠,其被分子a13修饰,对其酯进行了脱保护,并且数均摩尔质量(mn)为4400g/mol
采用与用于制备共聚氨基酸b3的方法类似的方法应用于分子a13的盐酸盐(3.39g,2.34mmol)和共聚氨基酸b2-1(2.04g),在含有按质量计30%乙醇的混合物中在ph13下进行5小时的皂化步骤,得到被分子a13修饰的聚-l-谷氨酸钠,对其酯进行了脱保护。
干萃取物:15.7mg/g
dp(根据rmn1h估计):40
根据rmn1h:i=0.15
共聚氨基酸b15的平均计算摩尔质量为12207g/mol。
有机hplc-sec(peg校准):mn=4400g/mol。
共聚氨基酸b17:聚-l-谷氨酸钠,其在其末端之一被分子a15修饰,对其酯进行了脱保护,并且数均摩尔质量(mn)为1000g/mol
采用与用于制备共聚氨基酸b14的方法类似的方法应用于分子a15(10.85g,8.74mmol)和l-谷氨酸-γ-苄酯n-羧基酸酐(23.00g,87.37mol),在ph12下进行2小时的皂化步骤,得到聚-l-谷氨酸钠,其在其末端之一被分子a15修饰,对其酯进行了脱保护。
干萃取物:23.9mg/g
dp(根据rmn1h估计):10
根据rmn1h:i=0.1
共聚氨基酸b17的平均计算摩尔质量为2576g/mol。
水相hplc-sec(peg校准):mn=1000g/mol。
共聚氨基酸b18:聚-l-谷氨酸钠,其被分子a16修饰,对其酯进行了脱保护,并且数均摩尔质量(mn)为5000g/mol
采用与用于制备共聚氨基酸b3的偶联类似的偶联应用于分子a16(31.06g,42.08mmol)和共聚氨基酸b2-1(36.80g),在酸沉淀步骤后得到米色固体。将此固体在tfa(100g/l)中稀释,并将混合物在室温下搅拌3小时。然后在搅拌的同时将溶液逐滴地滴在水(3v)之上。搅拌16小时后,通过过滤回收沉淀物,然后用水洗涤。将得到的固体溶解在水中,同时通过添加10n苏打水溶液将ph调节至7。一旦溶解完成,通过添加naoh的1n溶液经1小时将ph调节至ph12。通过添加1nhcl溶液中和至ph7后,通过与用于制备共聚氨基酸b3的方法类似的方法纯化产物(木炭过滤和超滤)。得到被分子a16修饰的聚-l-谷氨酸钠,对其酯进行了脱保护。
干萃取物:28.2mg/g
dp(根据rmn1h估计):40
根据rmn1h:i=0.15
共聚氨基酸b18的平均计算摩尔质量为9884g/mol。
有机hplc-sec(peg校准):mn=5000g/mol。
共聚氨基酸b19:聚-l-谷氨酸钠,其被分子a17修饰,对其酯进行了脱保护,并且数均摩尔质量(mn)为4900g/mol
采用与用于制备共聚氨基酸b3的方法类似的方法应用于分子a17的盐酸盐(7.35g,13.09mmol)和共聚氨基酸b2-1(11.45g),在含有按质量计30%乙醇的混合物中在ph13下进行3小时的皂化步骤,得到被分子a17修饰的聚-l-谷氨酸钠,对其酯进行了脱保护。
干萃取物:25.7mg/g
dp(根据rmn1h估计):40
根据rmn1h:i=0.15
共聚氨基酸b19的平均计算摩尔质量为9062g/mol。
有机hplc-sec(peg校准):mn=4900g/mol。
共聚氨基酸b20:聚-l-谷氨酸钠,其被分子a18修饰,对其酯进行了脱保护,并且数均摩尔质量(mn)为5800g/mol
采用与用于制备共聚氨基酸b3的方法类似的方法应用于分子a18的盐酸盐(5.43g,6.86mmol)和共聚氨基酸b2-1(6.00g),在含有按质量计30%乙醇的混合物中在ph13下进行3小时的皂化步骤,得到被分子a18修饰的聚-l-谷氨酸钠,对其酯进行了脱保护。
干萃取物:22.0mg/g
dp(根据rmn1h估计):40
根据rmn1h:i=0.15
共聚氨基酸b20的平均计算摩尔质量为10444g/mol。
有机hplc-sec(peg校准):mn=5800g/mol。
共聚氨基酸b21:聚-l-谷氨酸钠,其被分子a19修饰,对其酯进行了脱保护,并且数均摩尔质量(mn)为5000g/mol
采用与用于制备共聚氨基酸b18的方法类似的方法应用于分子a19(32.64g,45.97mmol)和共聚氨基酸b2-1(40.20g),得到被分子a19修饰的聚-l-谷氨酸钠,对其酯进行了皂化。
干萃取物:26.2mg/g
dp(根据rmn1h估计):40
根据rmn1h:i=0.15
共聚氨基酸b21的平均计算摩尔质量为9716g/mol。
有机hplc-sec(peg校准):mn=5000g/mol。
共聚氨基酸b22:聚-l-谷氨酸钠,其在其末端之一被分子a20修饰,并且数均摩尔质量(mn)为1900g/mol
采用与用于制备共聚氨基酸b14的方法类似的方法应用于在chcl3(53ml)中的分子a20(13.28g,12.51mmol)和在dmf(270ml)中的l-谷氨酸-γ-苄酯n-羧基酸酐(72.46g,275.2mmol),在ph12下进行1小时30分钟的皂化步骤,得到聚-l-谷氨酸钠,其在其末端之一被分子a20修饰。
干萃取物:27.3mg/g
dp(根据rmn1h估计):20
根据rmn1h:i=0.05
共聚氨基酸b22的平均计算摩尔质量为4087g/mol。
水相hplc-sec(peg校准):mn=1900g/mol。
ii)根据式xxx和xxxb的共聚氨基酸
共聚氨基酸b7’:聚-l-谷氨酸钠,其在其末端之一被分子a5a修饰,并且数均摩尔质量(mn)为2600g/mol
共聚氨基酸b7’-1:聚-l-谷氨酸苄酯,其在其末端之一被分子a5a修饰。
在先前烘干的烧瓶中,将l-谷氨酸-γ-苄酯n-羧基酸酐(10.1g,38.4mmol)溶解在无水dmf(19ml)中。然后搅拌混合物,直到完全溶解,冷却到0℃,然后快速引入分子a5a(1.47g,1.74mmol)在氯仿(3.7ml)中的溶液。将混合物从0℃和室温搅拌2小时,然后加热到65℃持续2小时。将反应介质冷却到室温,并在搅拌的同时逐滴倒入二异丙醚(0.29l)中。通过过滤回收白色沉淀物,用二异丙醚(5x50ml)洗涤两次,然后在30℃和真空下干燥,以便得到白色固体。
共聚氨基酸b7’
在三氟乙酸(tfa,132ml)中稀释共聚氨基酸b7’-1(8.33g,33.0mmol),然后将溶液冷却到4℃。然后逐滴添加在乙酸中的33%hbr溶液(92.5ml,0.528mol)。将混合物在室温下搅拌2小时,然后在搅拌的同时逐滴地倾倒在二异丙醚和水的1∶1混合物(v/v)(0.8l)之上。搅拌2小时后,使非均相混合物静置过夜。通过过滤回收白色沉淀物,用ipe(2x66ml)、然后用水(2x66ml)洗涤。然后将得到的固体溶解在水(690ml)中,同时通过添加1n苏打水溶液将ph调节至7。溶解后,通过添加水(310ml)将理论浓度调节至理论值20g/l,将溶液通过0.45μm过滤器过滤,然后通过针对nacl0.9%的溶液、然后针对水超滤进行纯化,直到渗透物的导电度小于50μs/cm。将得到的溶液通过0.2μm过滤,并在2-8℃下储存。
干萃取物:17.3mg/g
dp(根据rmn1h估计):24
根据rmn1h:i=0.042
共聚氨基酸b7’的平均计算摩尔质量为4430g/mol。
有机hplc-sec(peg校准):mn=2600g/mol。
实施例b8:共聚氨基酸b8-聚-l-谷氨酸钠,其在其末端之一被分子a6a修饰,并且数均摩尔质量(mn)为2400g/mol
共聚氨基酸b8-1:聚-l-谷氨酸苄酯,其在其末端之一被分子a6修饰。
在先前烘干的烧瓶中,将l-谷氨酸-γ-苄酯n-羧基酸酐(19.0g,72.2mmol)溶解在无水dmf(19ml)中。然后搅拌混合物,直到完全溶解,冷却到0℃,然后快速引入分子a6a(1.68g,3.28mmol)在氯仿(3.7ml)中的溶液。将混合物从0℃到室温搅拌2小时,然后加热到65℃持续2小时。将反应介质冷却到室温,并在搅拌的同时逐滴倒入二异丙醚(0.29ml)中。通过过滤回收白色沉淀物,用二异丙醚(5x50ml)洗涤两次,然后在30℃和真空下干燥,以便得到白色固体。
共聚氨基酸b8
采用与用于制备共聚氨基酸b7’的方法类似的方法应用于共聚氨基酸b8-1(14.6g,61.5mmol),得到聚-l-谷氨酸钠,其在其末端之一被分子a6a修饰。
干萃取物:21.3mg/g
dp(根据rmn1h估计):23
根据rmn1h:i=0.043
共聚氨基酸b8的平均计算摩尔质量为3948g/mol。
有机hplc-sec(peg校准):mn=2400g/mol。
共聚氨基酸b10:聚-l-谷氨酸钠,其在其末端之一被分子a8修饰,并且数均摩尔质量(mn)为3100g/mol
共聚氨基酸b10-1:聚-l-谷氨酸苄酯,其在其末端之一被分子a8修饰。
向合适的容器中依次引入分子a8的盐酸盐(2.308g,3.04mmol)、氯仿(120ml)、分子筛
在先前烘干的烧瓶中,将l-谷氨酸-γ-苄酯n-羧基酸酐(20.0g,76.0mmol)溶解在无水dmf(19ml)中。然后搅拌混合物,直到完全溶解,冷却到0℃,然后快速引入先前制备的分子a8在氯仿(3.7ml)中的溶液。将混合物从0℃到室温搅拌2小时,然后加热到65℃持续2小时。将反应介质冷却到室温,并在搅拌的同时逐滴倒入二异丙醚(0.29ml)中。通过过滤回收白色沉淀物,用二异丙醚(5x50ml)洗涤两次,然后在30℃和真空下干燥,以便得到白色固体。
共聚氨基酸b10
采用与用于制备共聚氨基酸b7’的方法类似的方法应用于共聚氨基酸b10-1(15.2g,60.8mmol),得到聚-l-谷氨酸钠,其在其末端之一被分子a8修饰。
干萃取物:34.1mg/g
dp(根据rmn1h估计):31
根据rmn1h:i=0.032
共聚氨基酸b10的平均计算摩尔质量为5367g/mol。
有机hplc-sec(peg校准):mn=3100g/mol。
实施例b11:共聚氨基酸b11-聚-l-谷氨酸钠,其在其末端之一被分子a9修饰,并且数均摩尔质量(mn)为3000g/mol
共聚氨基酸b11-1:聚-l-谷氨酸苄酯,其在其末端之一被分子a9修饰。
在适当的容器中依次引入分子a9的盐酸盐(2.023g,3.87mmol)、氯仿(120ml)、分子筛
采用与用于制备共聚氨基酸b8-1的方法类似的方法应用于先前制备的分子a9的溶液和l-谷氨酸-γ-苄酯n-羧基酸酐(25.5g,96.8mmol),得到共聚氨基酸b11-1。
共聚氨基酸b11
采用与用于制备共聚氨基酸b7’的方法类似的方法应用于共聚氨基酸b11-1(18.4g,77.3mmol),得到聚-l-谷氨酸钠,其在其末端之一被分子a9修饰。
干萃取物:28.0mg/g
dp(根据rmn1h估计):29
根据rmn1h:i=0.034
共聚氨基酸b11的平均计算摩尔质量为4828g/mol。
有机hplc-sec(peg校准):mn=3000g/mol。
共聚氨基酸b12:聚-l-谷氨酸钠,其在其末端之一被分子a10修饰,并且数均摩尔质量(mn)为2700g/mol
共聚氨基酸b12-1:聚-l-谷氨酸苄酯,其在其末端之一被分子a10修饰。
采用与用于制备共聚氨基酸b10-1的方法类似的方法应用于分子a10(3.0g,2.24mmol)和l-谷氨酸-γ-苄酯n-羧基酸酐(12.99g,49.3mmol),得到共聚氨基酸b12-1。
共聚氨基酸b12
采用与用于制备共聚氨基酸b7’的方法类似的方法应用于共聚氨基酸b12-1(13.2g,48.0mmol),得到聚-l-谷氨酸钠,其在其末端之一被分子a10修饰。
干萃取物:13.2mg/g
dp(根据rmn1h估计):24
根据rmn1h:i=0.042
共聚氨基酸b12的平均计算摩尔质量为4924g/mol。
有机hplc-sec(peg校准):mn=2700g/mol。
c部分:组合物
实施例c1:制备ph6.6的含有间甲酚(29mm)和甘油(174mm)的0.6mg/ml普兰林肽溶液
通过溶解购自ambiopharm的粉末形式的普兰林肽来制备普兰林肽的5mg/ml浓溶液。将此溶液添加到赋形剂(间甲酚、甘油)的浓溶液中,以便得到目标最终组合物。通过添加naoh/hcl将ph调节至6.6。
实施例c1-1:制备ph6.6的含有间甲酚(29mm)和甘油(174mm)的0.9mg/ml普兰林肽溶液
借助于与实施例c1a中所述的方案类似的方案得到ph6.6的含有间甲酚(29mm)和甘油(174mm)的0.9mg/ml普兰林肽溶液。溶液是澄清的。
实施例c2:制备ph6.6的含有共聚氨基酸b3、间甲酚(29mm)和甘油(174mm)的0.6mg/ml普兰林肽溶液
通过将赋形剂(间甲酚、甘油)的浓溶液添加到共聚氨基酸b3的浓溶液中来制备共聚氨基酸b3和赋形剂的浓溶液。
将普兰林肽在ph4下和赋形剂的5mg/ml浓溶液添加到共聚氨基酸b3的此浓溶液中,以便得到最终组合物c2-1至c2-5(表1)。通过添加naoh/hcl将ph调节至6.6。
表1:ph6.6的普兰林肽在共聚氨基酸b3中的不同浓度的溶液的组成和视觉外观。
实施例c3:制备ph6.6的含有根据本发明的不同共聚氨基酸、间甲酚(29mm)和甘油(174mm)的0.6mg/ml普兰林肽溶液
采用与实施例c2中所述的方案类似的方案,得到ph7.4的含有根据本发明的不同共聚氨基酸、间甲酚(29mm)和甘油(174mm)的0.6mg/ml普兰林肽溶液0.6mg/ml普兰林肽溶液(表2和2a)。
表2:在不同共聚氨基酸存在下的ph6.6的0.6mg/ml普兰林肽溶液的组成和视觉外观。
表2a:在不同共聚氨基酸存在下的ph6.6的0.6mg/ml普兰林肽溶液的组成和视觉外观。
实施例c8:制备ph6.6的含有根据本发明的不同共聚氨基酸、间甲酚(29mm)和甘油(174mm)、nacl和任选氯化锌的0.6mg/ml普兰林肽溶液
通过将赋形剂(间甲酚、甘油、nacl、氯化锌)的浓溶液添加到根据本发明的共聚氨基酸的浓溶液中来制备根据本发明的共聚氨基酸和赋形剂的浓溶液。
将普兰林肽在ph4下和赋形剂的5mg/ml浓溶液添加到根据本发明的共聚氨基酸的此浓溶液中,以便得到最终组合物c8-5至c8-15(表2b和2c)。通过添加naoh/hcl将ph调节至6.6。
表2b:在根据本发明的不同共聚氨基酸、氯化钠和任选氯化锌存在下的ph6.6的0.6mg/ml普兰林肽溶液的组成和视觉外观。
表2c:在根据本发明的不同共聚氨基酸、氯化钠和任选氯化锌存在下的ph6.6的0.6mg/ml普兰林肽溶液的组成和视觉外观。
实施例c4:在ph6.6下制备含有间甲酚(29mm)、甘油(174mm)及氯化锌(229μm)的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液。
将c1中所述的普兰林肽的5mg/ml浓溶液添加到赋形剂(间甲酚、甘油、氯化锌)的浓溶液中。通过溶解购自amphastar的粉末形式的人胰岛素来制备500iu/ml人胰岛素溶液。将此溶液添加到普兰林肽和赋形剂的浓溶液中,以便得到目标最终组合物。通过添加naoh/hcl将ph调节至6.6。
实施例c5:在ph6.6下制备含有共聚氨基酸b3、间甲酚(29mm)、甘油(174mm)及氯化锌(229μm)的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液。
通过将赋形剂(间甲酚、甘油、氯化锌)的浓溶液添加到共聚氨基酸b3的浓溶液中来制备共聚氨基酸b3和赋形剂的浓溶液。
将ph4的普兰林肽的5mg/ml浓溶液、然后是500iu/ml人胰岛素溶液添加到共聚氨基酸b3和赋形剂的浓溶液中,以便得到最终目标组合物(表3)。通过添加naoh/hcl将ph调节至6.6。
根据上述方案制备溶液c4和c5-1至c5-5。
表3:0.6mg/ml普兰林肽和人胰岛素的溶液在ph6.6下和在共聚氨基酸b3中的不同浓度下的组成和视觉外观。
实施例c6:在ph6.6下制备含有根据本发明的不同共聚氨基酸、间甲酚(29mm)、甘油(174mm)及氯化锌(229μm)的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液。
采用与实施例c5类似的方法,得到ph6.6下的含有根据本发明的共聚氨基酸、间甲酚(29mm)、甘油(174mm)及氯化锌(229μm)的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液。
根据上述方案制备溶液c6-1和c6-11(表4和4a)。
表4:在不同共聚氨基酸存在下的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液在ph6.6下的组成和视觉外观。
表4a:在不同共聚氨基酸存在下的0.6mg/ml的普兰林肽和100iu/ml人胰岛素的溶液在ph6.6下的组成和视觉外观。
实施例c10:制备含有共聚氨基酸b8、间甲酚(29mm)和甘油(174mm)以及变化含量的氯化钠和氯化锌的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液。
通过将赋形剂(间甲酚、甘油、氯化钠、氯化锌)的浓溶液添加到共聚氨基酸b8的浓溶液中来制备共聚氨基酸b8和赋形剂的浓溶液。
将ph4的普兰林肽的5mg/ml浓溶液、然后是500iu/ml人胰岛素溶液添加到共聚氨基酸b8和赋形剂的此浓溶液中,以便得到最终目标组合物。通过添加naoh/hcl将ph调节至6.6。
根据上述方案制备溶液c10-6和c10-7。
表4b:在不同共聚氨基酸以及不同浓度的氯化钠和氯化锌存在下的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液在ph6.6下的组成和视觉外观。
*包含来自人胰岛素的溶液的0.23mm的zncl2的组合物。
混合物的视觉观察和tht原纤化测量的结果。
原理
肽的不良稳定性可能会导致形成定义为有序大分子结构的淀粉样原纤维。这些有可能导致在样品中形成凝胶。
硫代黄素t(tht)的荧光的跟踪测试用于分析溶液的物理稳定性。硫代黄素是小的探针分子,当其与淀粉样蛋白类型原纤维结合时具有特征性荧光特征(naiki等人(1989)anal.biochem.177,244-249;levine(1999)methods.enzymol.309,274-284)。
这种方法使得有可能针对未稀释溶液中的低浓度的tht监测原纤维的形成。这种监测是在37℃搅拌的同时在加速稳定的条件下进行的。
实验条件
在临测量开始前制备样品。每种组合物的制备描述于相关实施例中。将硫代黄素t从浓缩的母体溶液添加到组合物中,以便诱导组合物的微不足道的稀释。组合物中硫代黄素t的浓度为2μm。
将150μl体积的组合物引入到96孔盘的一个孔中。每一组合物采用在同一盘中的三次测试(重复三次)进行分析。盘用透明薄膜密封,以便阻止组合物的蒸发。
然后将此盘放在读盘器(envision2104multilabel,perkinelmer)的外壳中。将温度设定在37℃,并开始以1mm的幅度进行960rpm的横向搅拌。
随着时间的推移,以442nm的激发波长和482nm的发射波长进行每一孔中的荧光强度的读取。
原纤化过程表现为在称为等待时间的时段过后荧光的强增加。
对于每一孔,此时段被以图形方式确定为荧光信号基线与在荧光的初始强增加期间确定的作为时间的函数的荧光曲线的斜率之间的交叉点。记录的等待时间的值对应于对三个孔取得的等待时间的测量值的平均值。
图形确定的一个实例如图1所示。
此图在曲线上图示通过荧光监测硫代黄素t来确定等待时间(lt),纵坐标轴上是荧光值(单位u.a.,任意单位),且横坐标上是以分钟为单位的时间。
实施例ca1:在不同浓度的共聚氨基酸b3存在下的ph6.6的0.6mg/ml普兰林肽的溶液的稳定性
表5:通过溶液c1、c2-1和c2-5的tht来测量等待时间。
没有共聚氨基酸的ph6.6(c1)的普兰林肽的溶液的等待时间短;含有共聚氨基酸b3的溶液的等待时间较长。
实施例ca2:在不同共聚氨基酸存在下的ph6.6的0.6mg/ml普兰林肽溶液的稳定性。
表6:通过组合物和c3-1和c3-33的tht来测量等待时间。
没有共聚氨基酸的ph6.6(c1)的普兰林肽的溶液的等待时间短。根据本发明的共聚氨基酸使得有可能在测试条件下获得长于3小时的等待时间。
实施例ca2a:在ph6.6下在不同共聚氨基酸、间甲酚(29mm)和甘油(174mm)以及不同含量的nacl和氯化锌存在下的0.6mg/ml普兰林肽溶液的稳定性
表6a:通过组合物c3-7、c3-5、c3-18和c8-5至c8-10的tht来测量等待时间。
没有共聚氨基酸的ph6.6(c1)的普兰林肽的溶液的等待时间短;在氯化钠或氯化钠和氯化锌存在下的含有根据本发明的共聚氨基酸的溶液的等待时间较长。
实施例ca2b:在ph6.6下在不同共聚氨基酸、间甲酚(29mm)和甘油(174mm)以及不同含量的nacl和氯化锌存在下的0.6mg/ml普兰林肽溶液的稳定性
表6b:通过组合物c3-19、c3-27和c8-11至c8-16的tht来测量等待时间。
没有共聚氨基酸的ph6.6(c1)的普兰林肽的溶液的等待时间短;在氯化钠或氯化钠和氯化锌存在下的含有根据本发明的共聚氨基酸的溶液的等待时间较长。
实施例ca3:在不同浓度的共聚氨基酸b3存在下的0.6mg/ml普兰林肽和100iu/ml人胰岛素溶液在ph6.6下的组成和视觉外观。
表7:通过组合物和c5-1和c5-5的tht来测量等待时间。
*表示溶液是浑浊的。
没有共聚氨基酸(c4)的在ph6.6下的0.6mg/ml普兰林肽和100iu/ml人胰岛素溶液是浑浊的。在共聚氨基酸b3的存在下在ph6.6下的澄清0.6mg/ml普兰林肽和人胰岛素100iu/ml的溶液的等待时间在b3/普兰林肽摩尔比为1的情况下长于0.5小时,并且对于b3/普兰林肽摩尔比大于2的情况可长于4小时。
实施例ca4:在不同共聚氨基酸存在下在ph6.6下的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液的稳定性。
表8:通过组合物c6-1至c6-4和c6-5的tht来测量等待时间。
表8a:通过组合物和c6-5和c6-4的tht来测量等待时间
在ph6.6(c4)下的普兰林肽和人胰岛素的溶液是浑浊的。根据本发明的共聚氨基酸使得有可能在测试条件下获得长于1小时的等待时间。
实施例ca7:制备含有共聚氨基酸b8、间甲酚(29mm)和甘油(174mm)以及变化含量的氯化钠和氯化锌的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液。
表14b:通过组合物c6-4和c10-6至c10-7的tht来测量等待时间
*包含来自人胰岛素的溶液的0.23mm的zncl2的组合物。
在ph6.6(c4)下的普兰林肽和人胰岛素的溶液是浑浊的。与在没有锌盐的溶液c6-4’情况下获得的等待时间相比,添加含b8的氯化锌使得有可能显著增加等待时间。
cb:根据本发明的组合物的稳定性研究。
视觉检查程序:
对装有1ml制剂的3ml小瓶或药筒进行视觉检查,以便检测可见颗粒或浑浊的出现。此检查根据欧洲药典(ep2.9.20)的建议进行:使小瓶经受至少2000lux的光照,并在白色背景和黑色背景前面进行观察。稳定性的周数或月数对应于含有可见颗粒的溶液开始浑浊的持续时间。
这些结果符合美国药典(usp<790>)。
实施例cb1:在ph6.6下在共聚氨基酸、间甲酚(29mm)和甘油(174mm)存在下的0.9mg/ml和0.6mg/ml的普兰林肽的溶液在30℃下在小瓶和药筒中的物理稳定性。
过滤(0.22μm)溶液c1、c1-1、c8-14和c3-21。通过自动注射针将1ml溶液引入到3ml玻璃药筒中和引入到3ml玻璃小瓶中。将药筒和小瓶置于30℃静态烘箱中,然后每2周进行观察。
表15:在共聚氨基酸b1和b13存在下的0.6mg/ml的普兰林肽组合物在30℃药筒中的物理稳定性结果。
ph6.6的0.9mg/ml和0.6mg/ml的普兰林肽溶液在30℃下在小瓶中的物理稳定性不到7周。ph6.6的0.9mg/ml的普兰林肽溶液在药筒中的物理稳定性不到2周。
在共聚氨基酸b1存在下的ph6.6的0.6mg/ml普兰林肽溶液在30℃药筒中的物理稳定性超过12周。
在共聚氨基酸b13存在下的ph6.6的0.6mg/ml普兰林肽溶液在30℃药筒和小瓶中的物理稳定性超过9周。
实施例cb2:在ph6.6下在共聚氨基酸b1b20、间甲酚(29mm)、甘油(174mm)和锌(229μm)存在下,在ph6.6下的0.6mg/ml普兰林肽和胰岛素100iu/ml的溶液在30℃小瓶和药筒中的物理稳定性。
过滤(0.22μm)溶液c6-6和c6-7。通过自动注射针将1ml溶液引入到3ml玻璃药筒中和引入到3ml玻璃小瓶中。将药筒和小瓶置于30℃静态烘箱中,然后每2周进行观察。
*溶液自制备以来浑浊。
表16:0.6mg/ml的普兰林肽组合物在30℃小瓶和药筒中的物理稳定性结果。在共聚氨基酸6.6存在下的胰岛素100iu/ml。
在ph6.6下的0.6mg/ml的普兰林肽和100iu/ml人胰岛素的溶液是浑浊的。
在共聚氨基酸b1存在下在ph6.6下的0.6mg/ml的普兰林肽和100iu/ml人胰岛素的溶液在30℃小瓶中的物理稳定性超过12周,且在30℃药筒中的物理稳定性超过12周。
在共聚氨基酸b20存在下在ph6.6下的0.6mg/ml的普兰林肽和100iu/ml人胰岛素的溶液在30℃药筒中的物理稳定性超过9周。
实施例cb3:在ph6.6下在共聚氨基酸、间甲酚(29mm)和甘油(174mm)存在下的0.6mg/ml普兰林肽溶液在37℃药筒中的物理稳定性。
过滤(0.22μm)溶液c3-21。将1ml溶液引入到3ml自注射笔式玻璃药筒中。到3ml自注射笔式玻璃药筒中。将药筒置于静态条件下的37℃烘箱中,然后每2周进行观察。
表17:在共聚氨基酸存在下的0.6mg/ml普兰林肽组合物在37℃药筒中的物理稳定性结果。
在共聚氨基酸b1存在下的ph6.6的0.6mg/ml普兰林肽溶液在37℃药筒中的物理稳定性超过9周。
实施例cb4:在ph6.6下在共聚氨基酸、间甲酚(29mm)和甘油(174mm)和锌(229μm)存在下的0.6mg/ml普兰林肽和100iu/ml胰岛素的溶液在37℃药筒中的物理稳定性。
过滤(0.22μm)溶液c6-6和c6-7。将1ml溶液引入到3ml自注射笔式玻璃药筒中。将药筒置于静态条件下的37℃烘箱中,然后每2周进行观察。
*溶液自制备以来浑浊。
表18:在共聚氨基酸存在下的0.6mg/ml普兰林肽组合物在37℃药筒中的物理稳定性结果。
在ph6.6下的0.6mg/ml普兰林肽和100iu/ml人胰岛素的溶液是浑浊的。
在共聚氨基酸存在下的ph6.6的0.6mg/ml普兰林肽溶液在37℃药筒中的物理稳定性超过3周。
- 还没有人留言评论。精彩留言会获得点赞!