用于分析物分析的基于人工神经网络深度学习的方法、装置、学习策略及系统与流程
本发明涉及一种利用人工神经网络深度学习技术分析测量对象的方法、装置、学习方法及系统。更具体地,本发明涉及一种利用人工神经网络深度学习技术分析测量对象的方法、装置、学习方法及系统,应用人工神经网络深度学习技术从对传感器所获得的信号进行转换图像化的数据识别出相当于测量对象的区域,并从该区域提取确定测量对象种类或浓度所需的各种要素,以预测最适合的测量对象的种类和浓度。
背景技术:
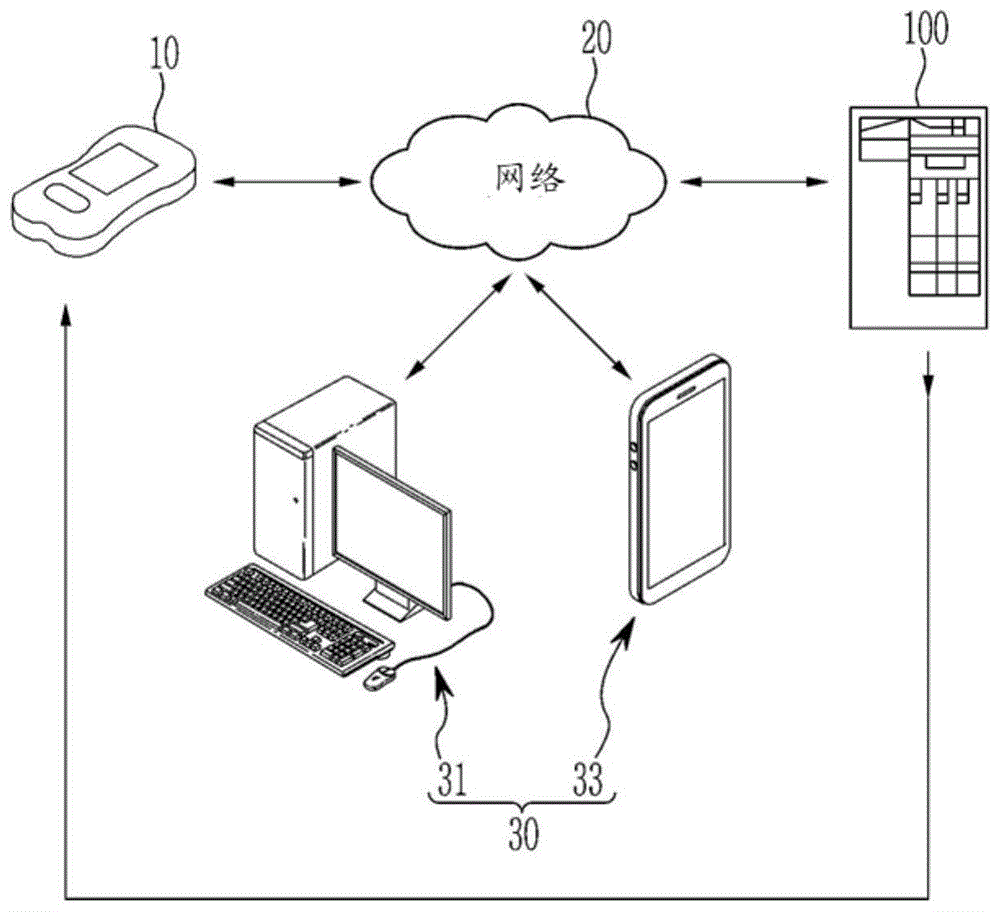
:通常,体外诊断产品最重要的标准之一是测量结果的准确度。对于这样的产品,当存在测量对象时,检测传感器输出信号,分析仪识别出该信号并应用预定的校准曲线或算法发送定量或定性结果。测量结果的准确度可能受到各种变量(例如干扰物、外部环境和样品特性)引起的干扰作用的影响。比如用于测量血糖的电化学传感器,由于诸如电极表面上氧化的测量对象之外的物质的存在或者粘度等血液性质的变化导致的血糖向电极的扩散系数(diffusioncoefficient)或者电极表面上的反应速率(reactionrate)的变化等,输出的电信号可能会受到影响。为了尽量减少或消除这样的影响,代替向传感器施加简单的dc电压的方式,采用了施加具有各种类型图案波形的输入电压并利用适当的统计数学技术处理从电极反应获得的波形的方法。自2010年代以来,进军血糖测量市场的公司有所增加,而且每个国家扩大了国民保险,因此降低价格的压力也有所增加。为了提高用户的安全性,主要的标准管理组织和认证机构正在加强对准确度和利用人工神经网络深度学习技术分析测量对象的方法、装置及系统的标准。例如,由于2008年开始的竞争性招标制度(competitivebidding),美国联邦医疗保险支付的保险金已减少到不到一半,而2016年发布的fda新指南对准确度的要求和各种干扰物质的干扰影响的限制比现有血糖仪的规格要严格得多(https://www.fda.gov/downloads/medicaldevices/deviceregulationandguidance/guidancedocuments/ucm380325.pdf)。为了在竞争如此激烈以及对测量系统的性能的要求加强的血糖仪市场中生存,需要开发成本低性能高的系统,这种矛盾的开发目标只有通过出色的技术进步才有可能实现。为了降低血糖测量系统的生产成本,需要性能有限的硬件(例如stm8l系列mcu)和容易生产的结构简单的传感试条。另一方面,为了改善血糖测量系统的性能,采用深度学习之类的需要高水平运算的方法时,需要配备通过蓝牙等发送和运算数据的系统或者实现通信以在云系统中另行运算的系统,以便使用可实现高性能运算的芯片或智能手机的功能,这与当前的市场趋势相悖。即使在有限的硬件实现了深度学习算法之类的需要大量运算的算法,仍然存在测量血糖的时间很长的问题。为了在当前的血糖仪市场上具有竞争力,必须能够在输入分析物后约8秒内输出估算的血糖浓度。此外,要想将血糖试条(strip)的生产成本降至最低,继续使用在现有生产工艺中生产的仅具有一对电极的试条较为有利。另一方面,仅通过从这种有限结构的电极获得的信息和现有信号处理方法很难准确地估算出血液中的葡萄糖。技术实现要素:技术问题为了解决上述的问题提出了本发明,本发明旨在提供一种利用人工神经网络深度学习技术分析测量对象的方法、装置及系统,可以在现有多元线性回归(multiplelinearregression)方法的基础上改善算法的准确度、精密度和血细胞比容包括在内的干扰校正性能,并且可以提供基于可用结构有限的仪表硬件和传感试条实现的优化的血糖估算人工智能的深度学习技术。另外,本发明旨在提供一种利用人工神经网络深度学习技术分析测量对象的方法、装置及系统,完成了数据维数缩减、算法架构缩减,以在有限的硬件中也能实现复杂的算法。此外,本发明旨在提供一种利用人工神经网络深度学习技术分析测量对象的方法、装置及系统,即使采用运算量大的算法,也可以有效地进行计算,将运算时间尽量减小到适合于血糖仪的8秒以内。另外,本发明旨在提供一种分析测量对象的方法、装置及低成本系统,通过从由数量有限的电极获得的信息可最大限度地提取数据中包含的附加信息的技术,可以获得利用多电极的效果。技术方案本发明涉及一种利用人工神经网络深度学习技术分析测量对象的系统,其特征在于,所述系统包括:生物特征信息测量装置;以及基于分析生物特征信息的人工智能的深度学习服务器,所述深度学习服务器具备:信号获取单元,用于获取基于电化学反应的信号,将通过所述生物特征信息测量装置采集的血液注入具有一对电极的传感器会引起所述电化学反应;信号处理单元,用于将从所述信号获取单元获取的信号预处理为用于人工智能深度学习的信号;生物特征信息测量算法生成单元,用于利用深度学习人工神经网络技术自动提取利用通过所述信号处理单元处理的信号进行优化的生物特征信息测量算法;以及优化算法结果提供单元,用于向所述生物特征信息测量装置提供优化的生物特征信息测量算法。根据本发明的另一个方面的利用人工神经网络深度学习技术的血糖测量装置,其特征在于,所述血糖测量装置包括:连接器,具有一对电极的电化学生物传感器安装于所述电连接器;电流电压转换器,其与所述连接器电连接;数字模拟转换器电路,用于控制成对所述电化学生物传感器的一对电极施加恒定电压,并施加三角波循环电压、方波、阶梯波或其他变形的三角函数形式的波形的电压;以及微控制器,用于控制这些电压,所述微控制器具备人工智能深度学习算法计算单元,用于根据从利用人工神经网络深度学习技术分析测量对象的系统获得的优化的基于人工智能的深度学习算法自动计算血糖。根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量方法可包括:准备试样的步骤;将电化学生物传感器装设于生物特征信息测量装置的步骤;在所述生物传感器与试样接触血液浸湿所述电化学生物传感器的工作电极和辅助电极的瞬间施加恒定电压,并且施加所述恒定电压后在计时施加电压结束点连续施加三角波循环电压或方波、阶梯波或其他变形的三角函数形式的波形的步骤;以及由通过优化的人工智能深度学习血糖测量算法来测量的响应电流计算出血糖测量值的步骤。根据本发明的另一个方面的基于分析生物特征信息的人工智能的深度学习方法可包括:通过电化学反应获取信号的步骤,将通过生物特征信息测量装置采集的血液注入具有一对电极的传感器(strip)会引起所述电化学反应;将所获取的信号处理为用于人工智能深度学习的信号的步骤;形成由信号特征提取单元和血糖值预测单元组成的用于测量血糖的算法架构的步骤;通过调整算法中的变量来学习血糖测量算法,以便能够最准确地预测血糖预测值为真值的血糖值的步骤;进行优化的步骤。发明效果根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的方法、装置及系统,可以在现有多元线性回归(multiplelinearregression)方法的基础上改善算法的准确度、精密度和血细胞比容包括在内的干扰校正性能,并且可以提供基于可用结构有限的仪表硬件和传感试条实现的优化的血糖估算人工智能的深度学习技术。另外,根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的方法、装置及系统,可以完成数据维数缩减、算法架构缩减,以在有限的硬件中也能实现复杂的算法。根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的方法、装置及系统,即使采用运算量大的算法,也可以有效地进行计算,将运算时间尽量减小到适合于血糖仪的8秒以内。此外,根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的方法、装置及系统,通过从由数量有限的电极获得的信息可最大限度地提取数据中包含的附加信息的技术,可以获得利用多电极的效果。附图说明图1是根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的系统的概念图。图2是根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的学习系统中基于分析生物特征信息的人工智能的深度学习服务器的结构图。图3是根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量装置的内部结构图。图4是根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量方法的流程图。图5是示出根据现有方法和所提出的方法的临床测试准确度性能的图。图6是示出根据现有方法和所提出的方法的噪声敏感度评估的图。图7是根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法中施加的电压及其响应电流,图8是异常信号的示例图,图9是下采样方法的概念图,图10是下采样的例子,图11是示出利用数据关系图的信息提取方法的图。图12是根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法的算法架构概念图,图13是算法特征提取单元的结构图,图14是特征提取单元的层结构图,图15是算法血糖估算单元的结构图。图16是集成算法结构图。图17是根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法的流程图。具体实施方式在下文中,将参照附图详细描述根据本发明的一个实施例的利用基于人工神经网络的深度学习技术分析测量对象的方法、装置及系统。在本说明书中,根据本发明的一个实施例的利用基于人工神经网络的深度学习技术分析测量对象的方法、装置及系统是用于说明本发明的示例而已,本发明的保护范围不限于实施例。图1是根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的系统的概念图。如图1所示,根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的系统1可包括:生物特征信息测量装置10,其具有最少数量的一对电极;基于分析生物特征信息的人工智能的深度学习服务器100,其利用基于人工智能的深度学习技术向所述生物特征信息测量装置10提供可测量生物特征信息的优化算法;网路20,用于通过有线或无线连接所述生物特征信息测量装置10和所述基于分析生物特征信息的人工智能的深度学习服务器100;以及计算机、智能终端等用户终端30,用于存储注册所述生物特征信息测量装置10中测量的生物特征信息或者可以辅助所述基于分析生物特征信息的人工智能的深度学习服务器100的学习。在本文中,网路20是生物特征信息测量装置10、个人计算机31、智能终端33、基于分析生物特征信息的人工智能的深度学习服务器100彼此可收发信息的网路,如公用电话网、互联网等,根据本发明的应用领域,可以利用各种类型的网路,这落入本发明的范围。生物特征信息测量装置10配备有可利用2g、3g、lte、wi-fi等骨干通信网的调制解调器,因此每当用户测量生物特征信息时,就会生成具备生物特征信息测量装置10的标识和所测量的生物特征信息的生物特征信息报文,还可以将所生成的生物特征信息报文发送到基于分析生物特征信息的人工智能的深度学习服务器100。当所述生物特征信息测量装置10不能通信时,可以通过个人计算机31或智能终端33等用户终端30将具备生物特征信息测量装置10的标识和所测量的生物特征信息的生物特征信息报文发送到基于分析生物特征信息的人工智能的深度学习服务器100。图2是根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的学习系统中基于分析生物特征信息的人工智能的深度学习服务器的结构图。如图2所示,所述基于分析生物特征信息的人工智能的深度学习服务器100可包括:信号获取单元110,用于通过电化学反应获取一维时间序列数据(timeseriesdata),将通过所述生物特征信息测量装置10采集的血液注入传感器(strip)会引起所述电化学反应;信号处理单元130,用于排除从所述信号获取单元110获取的信号中血液注入异常和硬件异常导致的异常信号、或者对信号进行预处理,以获得所述生物特征信息测量装置10中可以利用的优化的生物特征信息测量算法;生物特征信息测量算法生成单元150,用于利用深度学习人工神经网络技术自动提取利用通过所述信号处理单元130处理的信号进行优化的生物特征信息测量算法的特征;以及优化算法结果提供单元170,用于向所述生物特征信息测量装置10提供优化的生物特征信息测量算法。所述信号处理单元130通过正规化(normalization)或标准化(standardization)将数据转换成具有一定大小(scale)或分布(distribution),以使所述生物特征信息测量算法生成单元150能够学习,而对转换的数据可利用多路数据组合或域转换(如时域或频域)等信号处理和数据转换进行数据图像化。所述生物特征信息测量算法生成单元150可包括:算法架构单元151,用于形成用于血糖测量的算法架构;算法学习单元153,用于调整算法中的变量,使得能够最准确地预测血糖预测值为真值的血糖值;以及集成算法单元155,用于通过组合一种以上算法来算出最终预测值,以提高预测血糖值的准确度和精密度。另外,所述算法架构单元151可包括:特征提取单元151a,用于提取通过所述信号处理单元130进行信号预处理的生物特征信息信号数据中包含的测量对象的特征;以及血糖值预测单元151b,用于利用通过所述特征提取单元151a获得的特征来估算血糖值。所述算法架构单元151利用深度学习人工神经网络技术从反映测量对象的成分、血细胞比容、温度、干扰物质的特性等周围环境的图像中自动提取要分类或测量的反映结果值的特征。所述算法学习单元153使用所提取的特征经算法学习过程导出结果值的误差最小的人工神经网络层之间的权重(weight)和偏差(bias)。所述算法架构单元151可用作通过人工神经网络算法估算符合目的的特定值的回归模型,而且可用作对测量对象的种类进行分类的分类器。在本说明书中,作为优选实施例描述了校正因血糖测量时的血细胞比容而产生测量误差,但是与葡萄糖检测一样,通过引入特定酶,对各种代谢物质如β-羟丁酸(又称酮)、胆固醇、乳酸、肌酸酐、过氧化氢、醇、氨基酸、谷氨酸等有机物或无机物的浓度也能以相同的方法校正测量值。因此,本发明通过改变试样层组合物中包含的酶的种类,可以用于各种代谢物质的定量。例如,通过使用β-羟丁酸脱氢酶(β-hydroxybutyratedehydrogenase)、葡萄糖氧化酶(glucoseoxidase,gox)、葡萄糖脱氢酶(glucosedehydrogenase,gdh)、谷氨酸氧化酶(glutamateoxidase)、谷氨酸脱氢酶(glutamatedehydrogenase)、胆固醇氧化酶、胆固醇酯酶、乳酸氧化酶、抗坏血酸氧化酶、醇氧化酶、醇脱氢酶、胆红素氧化酶等,可以进行β-羟丁酸、葡萄糖、谷氨酸、胆固醇、乳酸、抗坏血酸、醇及胆红素等的定量。在根据本发明的一个实施例的生物特征信息测量装置10中,工作电极和辅助电极设置成在不同平面上面对面,并且可以应用所述工作电极上涂覆有包括根据物质的酶和电子传递介质的试剂组合物的逆向型电化学生物传感器。另外,在根据本发明的一个实施例的生物特征信息测量装置10中,工作电极和辅助电极设置在一个平面上,并且可以应用所述工作电极上涂覆有包括根据物质的酶和电子传递介质的试剂组合物的平面型电化学生物传感器。参照图3和图4描述根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量方法和装置。图3是根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量装置的内部结构图。如图3所示,根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量装置10保持现有电化学生物传感器即试条1的一对工作电极和辅助电极的结构,当施加恒定电压后再施加三角波循环电压、方波、阶梯波或其他变形的三角函数形式的波形时,可以根据优化的基于血糖估算人工智能的深度学习算法提供血糖测量值,通过根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的方法,可以在现有多元线性回归(multiplelinearregression)方法的基础上改善算法的准确度、精密度和血细胞比容包括在内的干扰校正性能。根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量装置10,即使在有限的硬件中也有效地计算优化的基于血糖估算人工智能的深度学习算法,可以在8秒以内的运算时间内进行计算。根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量装置10设置成,当所述电化学生物传感器1安装于连接器11时,所述连接器11与电流电压转换器12电连接,微控制器15(mcu)通过数字模拟转换器电路13(dac)施加恒定电压,并且可将三角波循环电压施加到所述试条1的工作电极上。为此,根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量装置10的固件(firmware)首先将能产生预定的三角波循环电压的常数存储在存储器中,当施加恒定电压时,将设定的常数写入转换器电路13的寄存器,当施加三角波循环电压时,以设定的时间周期增加/减小存储在所述存储器中的常数值并写入转换器电路13的寄存器中。然而,这里给出的施加的循环电压的波形是示例而已,并不局限于此,还包括对所属领域的工作人员理所当然的所有波形的循环电压。所述微控制器15根据写入所述转换器电路13的寄存器中的常数值向试条的两个电极之间施加该电压。如图3所示,当施加恒定电压以及施加三角波循环电压时,通过所述试条1测量的响应电流经过所述连接器11和所述电流电压转换器12,可以直接通过模拟数字转换器电路14(adc)进行测量。另一方面,根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量装置10还包括异常信号处理单元16和人工智能深度学习算法计算单元17,所述异常信号处理单元16在检测到所述试条1与所述连接器11连接不良或者血液注入异常和硬件异常导致的异常信号时,可以通过发出警报、显示于显示器等进行提醒,并避免所述人工智能深度学习算法计算单元17中进行不必要的计算。所述人工智能深度学习算法计算单元17可以通过由所述基于分析生物特征信息的人工智能的深度学习服务器100导出的优化的人工智能深度学习血糖测量算法在8秒以内由通过所述试条1测量的响应电流求出血糖测量值。下面参照图4描述根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量方法。图4是根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量方法的流程图。参照图4,根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量方法,准备试样(s110),例如将逆向型电化学生物传感器1装设于生物特征信息测量装置10(s120),在所述生物传感器1与试样(血液)接触血液浸湿所述电化学生物传感器1的工作电极和辅助电极的瞬间通过所述电流电压转换器12施加恒定电压(s130),并且施加所述恒定电压后在计时施加电压结束点连续施加三角波循环电压(s140)。所述异常信号处理单元16判断感应电流是否为异常信号(s150),当判断为异常信号时,可以通过发出警报、显示于显示器等进行提醒(s151)。另外,当判断为不是异常信号时,可以在所述人工智能深度学习算法计算单元17中由通过优化的人工智能深度学习血糖测量算法测量的响应电流求出血糖测量值。[比较例]与根据本发明的一个实施例的利用人工神经网络深度学习技术的血糖测量方法一样,通常利用现有多元线性回归的血糖测量方法通过生物特征信息测量装置10向现有的平面型或逆向型电化学生物传感器施加恒定的电压以及施加三角形循环波,以测量施加工作电极中还原的电子传递介质的氧化电势而产生的电流值,由此求出血糖的浓度。首先,关于准确度性能,对安装有采用多元线性回归方法进行计算的算法的现有方法(以下称为现有方法)和本发明所提出的方法(本案发明)进行如下比较。总共进行2次准确度性能评估,在标准分析仪ysi2300系统中对相同试样实施与所获得的分析值的比较(以下所有实施例的比较标准是与ysi2300的测量值的比较),对此[表1]和图5中示出了现有方法和所提出的方法,2次临床测试都确认了新的算法结果在统计学上(p=0.047)得到改善。即,针对数据组1和2,应用现有方法和所提出的方法对数量分别为1040、600的样品测量iso15197标准的血糖浓度为100mg/dl以上时相对于参考值在±15%以内、血糖浓度小于100mg/dl时相对于参考值在±15mg/dl以内的准确度。对标准分析仪的测量值的偏差(bias)是血糖浓度小于100mg/dl时通过(血糖估算值-参考值)进行计算,血糖浓度为100mg/dl以上时通过((血糖估算值-参考值)/参考值)*100进行计算。作为显示准确度性能的指标采用了准确度、偏差平均及均方根偏差度(rootmeansquarebias;rmsb)。rmsb是通过进行计算。表1示出了从采用现有方法多元线性回归分析法的系统获得的血糖测量值和从采用根据本发明的一个实施例的深度学习算法的系统获得的血糖测量值相对于从标准分析仪ysi2300系统获得的测量值的偏差度(bias)比较。【表1】偏差平均:偏差绝对值平均(15mg/dl或%)rmsb:偏差均方根(15mg/dl或%)图5是示出根据现有方法和所提出的方法的临床测试准确度性能的图。通过图5和表1可知,所提出的方法的准确度在一次和两次测试中为98.9%、99.7%,与现有方法的98.7%、98.5%相比,准确度得到改善。另外,与现有方法相比,在所提出的方法中,偏差(bias)平均得到改善(5.6→4.9,5.7→4.4),并且rmsb得到改善(11.1→9.8,13.1→6.7)。另外,表2示出了从采用现有方法的多元线性回归分析法的系统获得的血糖测量值和从采用根据本发明的一个实施例的深度学习算法的系统获得的血糖测量值相对于从血细胞比容为42%的试样获得的血糖测量值的平均偏差度(bias)比较。如表2所示,实施了血细胞比容影响评估,与现有方法相比,所提出的方法显示出更好的结果。试样是标准葡萄糖溶液,标准葡萄糖溶液是指通过将从静脉抽取的血液与15%至65%的血细胞比容匹配并使用葡萄糖分析仪(即,ysi的2300statplus)调制成具有特定葡萄糖浓度的血液,对具有预备浓度的标准血液试样在23度下分别进行10次测量。对于血细胞比容影响评估,根据iso15197标准,以各葡萄糖的血细胞比容为42%的试样的平均为准,当葡萄糖小于100mg/dl时,血细胞比容的平均之差为10mg/dl以下,当葡萄糖为100mg/dl以上时,血细胞比容的平均之差应为10%以下。表2所示的值是以葡萄糖为340mg/dl、血细胞比容为42%的试样的血糖值为准各血细胞比容下的平均差的值。根据血细胞比容产生平均差。由此可知,血糖估算值根据血液中血细胞比容的量而改变。为了现有方法和所提出的方法的血细胞比容校正能力的定量比较,采用了平均绝对离差(mean-absolute-difference,mad)。mad是以42%的血细胞比容为准对各血细胞比容的平均差取绝对值平均的值。更具体地,在现有方法中,对于血细胞比容影响,在葡萄糖为340mg/dl的情况下,mad为5.9,但是在所提出的方法中,mad为3.5,血细胞比容校正能力得到了改善。【表2】单位:mg/dl或%mean-absolute-difference(mad):平均绝对离差另外,实施了精密度性能评估。算法的精密度是以iso15197为准血糖浓度小于100mg/dl的用血糖估算值的标准偏差来计算,血糖浓度为100mg/dl以上的用变异系数(coefficientofvariation,cv)来计算。cv是将各实验条件的血糖值标准偏差除以算术平均的值。另一方面,表3示出了从采用现有方法的多元线性回归分析法的系统获得的血糖测量值和从采用根据本发明的一个实施例的深度学习算法的系统通过反复测量获得的血糖测量值的精密度比较。当葡萄糖小于100mg/dl时,利用测量值的标准偏差值,当葡萄糖为100mg/dl以上时,利用测量值的变异系数(cv)。如[表3]所示,对于根据本发明的一个实施例的血液中特定物质的浓度测量方法的精密度结果,与根据比较例的血液中特定物质的浓度测量方法相比,方差比检验的f-检验结果获得p=0.000,从而确认统计学上有明显的改善。【表3】单位sd,mg/dl(<100mg/dl)cv,%(≥100mg/dl)关于噪声敏感度性能,参照图6来说明。如图6所示,确认了对试条反应信号施加一定大小的随机噪声时算法值的影响。确认了施加现有信号标准偏差的0~40%大小的随机噪声时算法值的变化。在临床上重要的110mg/dl的情况下,现有方法中根据噪声大小均方根误差(root-mean-square-error,rmse)为约5~37mg/dl,而所提出的方法中均方根误差为约4~9mg/dl,对噪声的稳定性得到改善。下面参照图7至图17详细描述利用人工神经网络深度学习技术分析测量对象的学习方法。图7是根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法中施加的电压及其响应电流,图8是异常信号的示例图,图9是下采样方法的概念图,图10是下采样的例子,图11是示出利用数据关系图的信息提取方法的图。图12是根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法的算法架构概念图,图13是算法特征提取单元的结构图,图14是特征提取单元的层结构图,图15是算法血糖估算单元的结构图。图16是集成算法结构图,图17是根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法的流程图。根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法,其在信号获取单元110通过电化学反应获取一维时间序列数据(timeseriesdata),将通过所述生物特征信息测量装置10采集的血液注入传感器(strip)会引起所述电化学反应(s210)。在温度为5~50℃、血细胞比容为10~70%及葡萄糖为10~630mg/dl的各种实验条件下,在温度和湿度可控的室内如[表4]所示的变量和实验条件下获得了实验数据。表4示出用于获取学习数据的实验条件。【表4】变量实验条件温度5、9、13、18、23、28、34、42、50(℃)葡萄糖10、35、70、120、180、250、330、420、520、630(mg/dl)血细胞比容10、20、30、42、49、56、70(%)用于获得实验数据的血液是在上述的实验条件下制备的血液。制备血液的方法是使用收集在抗凝管中的静脉血,通过离心分离将静脉血分离成血浆和血细胞。对于血细胞比容,通过调节血浆和血细胞混合比进行匹配,然后加入要制备的浓度的葡萄糖,从而制备了各实验条件的血液。在所使用的试条中,毛细管结构的试样池中配置有一对电极(工作电极和辅助电极),所述一对电极上涂覆有试剂,所述试剂是包括酶、电子传递介质及各种稳定剂和分散剂的试剂。如果采用从二个电极试条每秒获取数据400次的方式来获取单份血液样品数据,则为了测量3秒的孵化(等待试条中的酶和血液发生化学反应的时间)和反应,需要对施加2.65秒的序列电压(sequencevoltage)收集总共2260个数据。例如,通过施加的序列电压和血液反应获得的数据如图7所示。为了获取学习所需的数据,大量研究人员必须在可保持恒温和恒湿的室内研究相当长的一段时间。在实施例中,通过组合温度、葡萄糖和血细胞比容实验条件反复测量,总共获得了约1亿个以上的数据。对于通过组合所述信号获取单元110中获取的温度、葡萄糖、血细胞比容实验条件反复测量而获得的数据,信号处理单元130通过正规化(normalization)或标准化(standardization)将数据转换成具有一定大小(scale)或分布(distribution)。对转换的数据利用多路数据组合或域转换(如时域或频域)等信号处理和数据转换进行数据图像化。对于所述信号处理单元130,如图8所示,获取信号时血液注入异常和硬件异常导致产生异常数据,例如出现尖峰噪声时,通过异常信号排除算法将异常信号处理为错误。为了对异常信号进行错误处理,采用了数据随时间变化的程度到一定值以上时提取的方式和数据超出正常信号中可能出现的信号范围时提取的方式。另一方面,对于从电极获得的电化学反应信号,采用每秒收集数据400次的方式通过施加特定序列电压2.65秒来收集1060次数据,在本发明的生物特征信息测量装置10的情况下,要想在有限的硬件如stm32lmcu中处理所有1060次数据,如果是实施例的算法构架,就会发生需要约32秒的问题。测量血糖所需时间为32秒表示,作为产品商品性会降低,因此需要优化。为了在有限的硬件中处理运算量大的算法,应用了低秩近似(rowrankapproximation)方法和下采样方法,以减小由1060个组成的原始信号维数。在根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法中,信号处理单元130作为信号预处理实施了下采样方法,算法的运算量减少到十分之一水平,并且可以保持时序信号的特征,如图9所示。如图10所示,尽管数据大小减少到十分之一水平,还是获得了仍具有现有时序信号的特征的信号。下采样结果,测量血糖所需的时间从约32秒减少到3秒。如图11所示,在根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法中,信号处理单元130应用了根据时间的数据关系图和域变化,以从由单个电极获得的血液样品的原始信号获得附加信息。在根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法中,将原始信号转换成进行微分和积分的信号后加入。因此,输入信号包括从传感器获得的原始信号以及该信号的微分和积分信号。由此,可以通过从单个电极获得的信号获得从多个电极获得信号的效果。图12是根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法的算法架构概念图,图13是算法特征提取单元的结构图,图14是特征提取单元的层状(layer)结构图,图15是算法血糖估算单元的结构图,图16是集成算法结构图。另一方面,如图12所示,在根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法中,用于测量血糖的算法架构单元(150)形成用于测量血糖的算法架构(s230)。用于测量血糖的算法架构分为信号特征提取单元151和血糖值预测单元153。算法的大小越大,计算能力越大,但是消耗的资源也会增加。为了在有限的硬件如血糖仪中实现运算量大的算法如深度学习,需要算法架构最小化技术。目的不仅是减少算法的大小,还在于尽量避免性能下降,同时缩小算法架构。为了缩小算法架构,通过应用删除非关键连接(权重)的连接修剪(connectionpruning)、相似连接(权重)分组的权重编码共享(weightencoding-sharing)及算法模型正规化技术尽量避免算法的性能下降,并缩小了算法架构的大小。所述特征提取单元151的输入信号是经过如上所述的信号预处理过程的大小为1x106的数据。为了提取数据中包含的特征,大致组成5个层状结构。由多层组成所述特征提取单元151的理由是通过多层加工可从原始数据(rawdata)获得的抽象特征使其具体化。所述特征提取单元151的各层中设置用于提取特征的卷积(卷积)过滤器。在根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法中,根据输入信号,原始信号使用了大小为1x5的过滤器,而微分和积分信号使用了大小为1x3的过滤器,各层所使用的过滤器的数量如[表5]所示。表5是实施例中使用的过滤器的尺寸和数量。【表5】各层由执行卷积的部分和执行批规范化(batchnormalization)的部分、激活函数及最大池化(maxpooling)组成。[卷积]卷积是利用如图13所示的过滤器从头到尾的顺序进行数据的运算。卷积运算为n是过滤器大小。[批规范化和relu]采用批规范化和relu是为了解决关于深度学习可能成为问题的协变量偏移(covariateshift)和梯度消失(gradientvanishing)问题。对于批规范化,当数据具有k个维数时,对每个维数通过如下公式进行计算。对于relu函数,由如下的式对通过批规范化求出的进行计算。[池化]为了减小通过卷积运算导出的数据大小,特征提取单元中应用了最大池化和均值池化(meanpooling)。各层由执行卷积的部分和执行批规范化的部分、激活函数及最大池化或均值池化组成。图14是由5个层组成的特征提取单元的各层的例子。算法特征提取单元根据各信号会输出32种特征。所述血糖值预测单元153中使用利用特征提取单元求得的32个特征来估算血糖值。所述血糖值预测单元153由总共两个层组成。通过利用32个值,第一层中用32x16权重阵列将32个特征缩小为16个,第二层中用16x8权重阵列将16个特征缩小为8个,再最终估算血糖值。将每个特征称为节点(node),相邻层的节点都连接在一起。通过学习来确定这些节点的权重。如图15所示,所述算法学习单元160学习血糖测量算法。此时,调整算法中的变量,使得能够最准确地预测血糖预测值为真值的血糖值。算法中的变量可以是所述特征提取单元151的过滤器的值或所述血糖值预测单元153的节点之间的权重等。优化的目的是使损失函数(lossfunction)最小化。损失函数定义为血糖值和预测值的均方根误差值。作为优化损失(loss)的方法应用了利用梯度下降优化器(gradientdescentoptimizer)、动量优化(momentumoptimization)、nesterov加速梯度(nesterovacceleratedgradient)、adagrad、rmsprop和adam优化等使性能最大化的方法。为了根据血糖预测值和真值之差更新算法中的变量,采用了adam优化,变量的更新程度取决于学习率(η),在本算法中设置为0.00001。基本损失优化过程如下。1.设置要优化的变量和学习率2.重复学习直到血糖预测值和真值之差最小为止1)每次重复学习时,随机选择一部分学习数据2)计算对所选数据的预测值和真值之差的补偿程度3)根据计算的补偿程度,按照学习率更新算法中要优化的变量为了减少算法运算时间,如果运算所需的最少数据累积,则数据的运算与收集分开进行。也就是说,所采用的方式不是收集所有数据后进行运算的方式,而是同时进行数据收集和运算的方式。在本实施例中,当收集数据后进行运算时,需要大约3.3秒的运算时间,但是通过上述的方法,可使所有运算在收集数据后约1秒内完成,从而将运算时间缩短约2.3秒。接下来,所述集成算法单元170通过组合一种以上算法来算出最终预测值,以提高预测血糖值的准确度和精密度。如图16所示,当输入信号为原始信号、微分和积分信号三种信号时,分别预测血糖值,通过由三种算法求得的血糖值的加权平均计算出最终血糖值。最终值计算方法可以根据各算法的重要度赋予不同权重,而且利用三个算法的输出值,还可以进一步构建小规模网路算法。参照图17再次简述根据本发明的一个实施例的基于分析生物特征信息的人工智能的深度学习方法的流程图。根据本发明的另一个方面的基于分析生物特征信息的人工智能的深度学习方法可包括:通过电化学反应获取信号的步骤(s210),将通过生物特征信息测量装置采集的血液注入具有一对电极的传感器(strip)会引起所述电化学反应;将所获取的信号处理为用于人工智能深度学习的信号的步骤(s230);形成由信号特征提取单元和血糖值预测单元组成的用于测量血糖的算法架构的步骤(s240);通过调整算法中的变量来学习血糖测量算法,以便能够最准确地预测血糖预测值为真值的血糖值的步骤(s250);以及进行优化的步骤(s260)。工业实用性根据本发明的一个实施例的利用人工神经网络深度学习技术分析测量对象的方法、装置及系统,可以在现有多元线性回归(multiplelinearregression)方法的基础上改善算法的准确度、精密度和血细胞比容包括在内的干扰校正性能,并且可以提供基于可用结构有限的仪表硬件和传感试条实现的优化的血糖估算人工智能的深度学习技术。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1