一种基于体液免疫阻断的抗肿瘤药物组合物及其应用的制作方法
本发明涉及生物医药技术领域,尤其涉及基于体液免疫阻断的抗肿瘤药物组合物及其应用。
背景技术:
原发性肝细胞肝癌(hepatocellularcarcinoma,hcc)是目前世界上最常见的恶性肿瘤之一,其发生率和死亡率均高居各种恶性肿瘤前列。中国是肝癌的高发区,占全世界hcc人总数的55%。早期肝癌的治疗方法以根治性切除为主。然而,即便在肝癌早期进行过手术治疗的人,5年生存率只有50%;晚期肝癌人更是缺乏有效的治疗方法。因此,寻求新的肝癌治疗手段是目前亟待解决的医学难题。
肿瘤是癌细胞在适宜的微环境中生长的结果。间质微环境的组成以及类型决定了肿瘤的进展和退化。其中,免疫细胞是肿瘤间质的重要组分。肿瘤细胞不仅可以通过自身基因组的突变获得恶性生物学特征,还能通过多种方式来改变间质免疫细胞的表型和功能,进而加剧肿瘤的进程。若能重新启动并维持免疫系统对肿瘤细胞的识别和杀伤,则可以恢复机体正常的抗肿瘤免疫反应,从而控制与清除肿瘤。因此,研究肿瘤微环境中免疫细胞组成,特点及功能,研制以间质免疫细胞为靶标的新型肿瘤治疗手段,成为目前肿瘤治疗领域充满前景的一个新方向。
b细胞是特异性免疫反应的重要组成部分。此外,b细胞也具有很强的免疫调节功能,在维持组织平衡、调控细胞免疫应答的强度与持续性方面也发挥重要作用。临床研究表明b细胞也是肿瘤间质的重要免疫组分,但它们在人体肿瘤的研究目前仍处于起步阶段。国内外关于b细胞在肿瘤发生及进展过程中的作用尚不清楚。进一步研究b细胞在肿瘤进展中的作用及具体调控机制,很可能有助于建立新型的肝癌免疫治疗策略。
表观遗传沉默(包括组蛋白和dna的甲基化修饰)是一种重要的致癌机制。因此,表观遗传重编程显示出作为抗肿瘤治疗策略的巨大潜力。目前表观遗传治疗肿瘤的基本思路是:通过组蛋白甲基转移酶ezh2抑制剂以及dna甲基转移酶dnmt1抑制剂的使用,解除肿瘤细胞cxcl10基因及组蛋白上的甲基化修饰,从而促进其表达。上调表达的cxcl10进一步募集细胞毒t细胞进入肿瘤,从而促进肿瘤的清除。然而,除了招募t细胞外,cxcl10还会引起包括b细胞在内的多种免疫细胞的改变,重塑整个肿瘤免疫环境。表观遗传重编程对整个免疫系统的综合影响,决定了其在治疗过程中的效果。因此,综合评价表观遗传重编程对肿瘤免疫微环境的影响,探讨有效的联合治疗方案对提高表观遗传治疗的效果有着极其重要的意义。
技术实现要素:
本发明的目的是为了解决上述现有技术的缺点和不足,提供一种基于体液免疫阻断的抗肿瘤药物组合物及其应用。
本发明所采用的技术方案如下:
一种基于体液免疫阻断的抗肿瘤药物组合物,包含表观遗传抑制剂和体液免疫阻断物。
进一步地,所述表观遗传抑制剂包含组蛋白甲基转移酶ezh2抑制剂和dna甲基转移酶dnmt1抑制剂,且两者的重量比为150:1;所述组蛋白甲基转移酶ezh2抑制剂为gsk126或tazemetostat,所述dna甲基转移酶dnmt1抑制剂为5-aza-dc、decitabine(地西他滨)、triclabendazole(三氯苯达唑)、azacitidine(阿扎胞苷)、tetrahydrouridine(四氢尿苷)、aza-t-dcyd、fluorocyclopentenylcytosine、guadecitabinesodium、cedazuridine、tdcyd或fdcyd。
进一步地,所述体液阻断物为b细胞特异性清除抗体、fcγr封闭抗体、fcγr下游信号通路syk抑制剂或fcγr下游信号通路btk抑制剂。
进一步地,所述b细胞特异性清除抗体为rituximab(利妥昔单抗)、ofatumumab(奥法木单抗)、obinutuzumab(奥滨尤妥珠单抗)、alemtuzumab(阿仑单抗)、ibritumomab(替伊莫单抗)、tositumomab(托西莫单抗)或blinatumomab(博纳吐单抗),且所述b细胞特异性清除抗体与所述表观遗传抑制剂的重量比为50:151。
进一步地,所述fcγr封闭抗体与所述表观遗传抑制剂的重量比为50:151。
进一步地,所述fcγr下游信号通路syk抑制剂为fostamatinib(福他替尼)、cerdulatinib(赛度替尼)、gusacitinib(asn002)或entospletinib(gs9973),且所述fcγr下游信号通路syk抑制剂与所述表观遗传抑制剂的重量比为25:151。
进一步地,所述fcγr下游信号通路btk抑制剂为ibrutinib(依鲁替尼)或acalabrutinib,且所述fcγr下游信号通路btk抑制剂与所述表观遗传抑制剂的重量比为125:151。
本发明还包括所述基于体液免疫阻断的抗肿瘤药物组合物在制备提高人体内t细胞抗肿瘤免疫应答药物或在制备治疗与预防癌症药物中的应用。
进一步地,所述应用中的肿瘤为实体瘤。
更进一步地,所述实体瘤为原发性肝细胞肝癌。
本发明与现有技术相比,具有以下优点:
1、该药物组合物为基于表观遗传治疗与体液免疫阻断的联合用药组合物,可有效恢复t细胞的抗肿瘤免疫应答,更好的抑制肿瘤生长。
2、由于体液免疫阻断物清除了表观遗传抑制剂所带来的负反馈作用,两者联合用药产生了协同作用。
为了更好地理解和实施,下面结合附图详细说明本发明。
附图说明
图1是体液免疫阻断物治疗对荷瘤小鼠肿瘤生长以及抗肿瘤t细胞免疫反应情况的影响。
图2是表观遗传治疗对荷瘤小鼠肿瘤生长及肿瘤中免疫细胞情况的影响。
图3是清除b细胞后的荷瘤小鼠响应表观遗传治疗的情况。
图4是联合用药组合物治疗对荷瘤小鼠肿瘤生长及抗肿瘤t细胞免疫反应情况的影响。
具体实施方式
本发明中选用的所有材料、试剂和仪器都为本领域熟知的,但不限制本发明的实施,其他本领域熟知的一些试剂和设备都可适用于本发明以下实施方式的实施。
本发明实施例使用的表观遗传抑制剂为组蛋白甲基转移酶ezh2抑制剂gsk126和dna甲基转移酶dnmt1抑制剂5-aza-dc。以下实施例中使用的组蛋白甲基转移酶ezh2抑制剂gsk126由selleck公司(美国)购得;dna甲基转移酶dnmt1抑制剂5-aza-dc由sigmaaldrich公司(美国)购得。
本发明实施例使用的体液免疫阻断物为b细胞特异性清除抗体、fcγr封闭抗体、fcγr下游信号通路syk抑制剂或fcγr下游信号通路btk抑制剂。以下实施例中的b细胞特异性清除抗体选用鼠cd20特异性清除抗体(anti-mousecd20antibody,本发明中简称αcd20),由bioxcell公司(美国)购得;以下实施例使用的fcγr封闭抗体为鼠cd16/cd32封闭抗体(anti-mousecd16/cd32antibody,本发明中简称αfcγrs)由bioxcell公司(美国)购得;以下实施例使用的fcγr下游信号通路syk抑制剂为syk特异性抑制剂r406,由selleck公司(美国)购得;以下实施例使用的fcγr下游信号通路btk抑制剂为btk特异性抑制剂ibrutinib,由selleck公司(美国)购得。
另外,以下实施例所采用的鼠cd8免疫组化特异抗体由r&d公司(美国)购得;鼠cd20免疫组化特异抗体、颗粒酶b(granzymeb)以及穿孔素(perforin)流式抗体由ebioscience公司(美国)购得。
本发明的实施例采用以下实验方法:
1、小鼠成瘤及处理
(1)小鼠处理
选用6周龄的c57bl/6小鼠,在其肝被膜下种植1×106小鼠肝癌细胞系hepa1-6。通过腹腔注射的方式对小鼠进行处理(pbs处理、或同型对照抗体处理、或鼠cd20特异性清除抗体、或鼠fcγr封闭抗体处理、或r406处理、或ibrutinib处理、或gsk126+5-aza-dc处理、或gsk126+5-aza-dc联合上述任意一种阻断体液免疫反应药物的处理,每三天注射一次)。在部分实验中,小鼠预先经过鼠cd20特异性清除抗体处理,原位成瘤后再进行pbs处理或gsk126+5-aza-dc处理。成瘤17天后处死小鼠,分离并测量肿瘤大小,以备后续实验。
(2)小鼠用药浓度
ezh2抑制剂(gsk126):30mg/kg;
dnmt1抑制剂(5-aza-dc):0.2mg/kg;
鼠cd20特异性清除抗体(αcd20):10mg/kg;
鼠fcγr封闭抗体(αfcγrs):10mg/kg;
syk抑制剂(r406):5mg/kg;
btk抑制剂(ibrutinib):25mg/kg;
2、免疫组化
(1)预处理:取出55℃烤片1h,放于二甲苯中脱蜡两次,每次10min;依次用100%、95%、90%、80%、70%的乙醇洗一次,每步3min,后用双蒸水洗3min;0.3%的双氧水处理10min,双蒸水再洗3次,每次3min;浸泡于修复液中,用微波炉进行热修复,室温冷却半小时;用1×pbs洗三次,每次3min;
(2)杂交染色:用鼠特异性cd8抗体或鼠特异性cd20抗体进行孵育,4℃过夜;恢复室温,弃去抗体液,用1×pbs洗三次,每次5min;加入偶联辣根过氧化物酶(hrp)的二抗,37℃半小时;用1×pbs洗三次,每次5min;加入dab显色液进行显色,然后用苏木精复染。
(3)计数:染色后20倍镜下随机拍5个视野,通过imagineproplus软件计算cd20和cd8阳性细胞数量。
3、小鼠肿瘤中免疫细胞的分离及流式检测
(1)肿瘤中免疫细胞的分离:将肿瘤剪碎并加入iv型胶原酶和i型dna酶,37℃摇床中消化45min;hbss终止,200目筛网过滤后4℃,450g离心8min,收集下层细胞;hbss重悬,4℃,50g离心1min,收集上层细胞悬液;细胞悬液加到ficol上,20℃,450g离心25min进行密度梯度分离;吸取富集免疫细胞的白膜层,pbs重悬,4℃,450g离心8min沉淀细胞;重悬计数。
(2)免疫细胞的流式染色:将收集的细胞按照1×106/管分装至流式管中,4℃,胞外染色30min;facsbuffer中止,4℃,450g离心8min,弃上清;打散细胞后边震荡边加入固定剂(beckmancoulter),室温固定15min;facsbuffer中止,4℃,650g离心8min,弃上清;破膜剂室温孵育5min;4℃,胞内染色30min;facsbuffer中止,4℃,450g离心8min。
(3)流式检测:数据由gallios流式细胞仪(beckmancoulter)采集,flowjo软件(6.0.0.0)分析。
实施例1
通过小鼠成瘤实验研究成熟b细胞对肿瘤生长以及抗肿瘤t细胞免疫反应的影响。
上述小鼠成瘤实验设置阴性对照组和实验组。阴性对照组小鼠给与腹腔注射同型对照抗体处理或pbs处理,实验组小鼠给与腹腔注射鼠cd20特异性清除抗体、或鼠fcγr封闭抗体处理、或syk抑制剂r406处理、或btk抑制剂ibrutinib处理。上述成瘤实验所采用的小鼠品系为c57bl/6,所采用的肿瘤细胞株为小鼠肝癌细胞株hepa1-6。
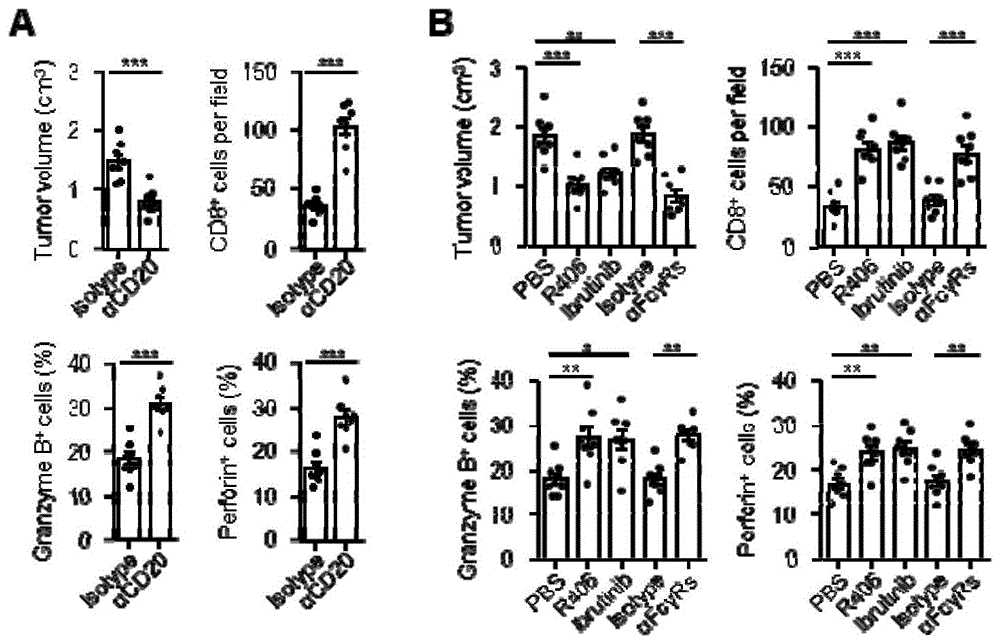
如图1所示,为体液免疫阻断物治疗对荷瘤小鼠肿瘤生长以及抗肿瘤t细胞免疫反应情况的影响。图1a为清除b细胞对荷瘤小鼠肿瘤及抗肿瘤t细胞免疫影响统计图;图1b为封闭fcγr或阻断fcγr下游信号通路syk、btk对荷瘤小鼠肿瘤生长及抗肿瘤t细胞免疫反应影响统计图。在图1中,a图显示使用特异性抗体清除b细胞能显著削弱肿瘤的生长,并且伴随抗肿瘤t细胞免疫反应的增强。而如b图所示,与清除b细胞的效果类似,使用抗体封闭fcγr或抑制fcγr下游信号通路syk、btk等阻断体液免疫反应也能有效的扩大抗肿瘤t细胞反应,并抑制肿瘤的生长。
对实验结果进行对比分析表明:与阴性对照组相比,使用b细胞特异性清除抗体、或fcγr封闭抗体、或fcγr下游信号通路抑制剂r406或ibrutinib均能有效抑制肿瘤的生长,增加肿瘤中浸润的细胞毒t细胞的数量并且提高抗肿瘤t细胞表达杀伤分子granzymeb与perforin的水平,统计学分析具有显著性差异。因此推测,肝癌中成熟b细胞(体液免疫的发生)很可能主动帮助肿瘤进展。阻断体液免疫可成为治疗肝癌的新的策略。
实施例2
通过小鼠成瘤实验研究表观遗传治疗对肿瘤生长以及抗肿瘤t细胞免疫反应的影响。
上述小鼠实验设置阴性对照组和实验组。阴性对照组小鼠给与腹腔注射pbs处理,实验组小鼠给与腹腔注射表观遗传抑制剂gsk126+5-aza-dc处理。上述成瘤实验所采用的小鼠品系为c57bl/6,所采用的肿瘤细胞株为小鼠肝癌细胞株hepa1-6。
如图2所示,为表观遗传治疗对荷瘤小鼠肿瘤生长及肿瘤中免疫细胞情况的影响。图2a为表观遗传治疗对肿瘤大小影响统计图;图2b为表观遗传治疗对肿瘤中细胞毒t细胞及b细胞数量影响统计图;图2c为表观遗传治疗对小鼠肿瘤中细胞毒t细胞表达功能分子影响统计图;图2d为表观遗传治疗对小鼠肿瘤中b细胞成熟分化影响统计图。在图2中,a图显示单独使用表观遗传抑制剂非但无法有效抑制肿瘤,反而促进其生长。而如b图所示,表观遗传抑制剂的使用并不能增加细胞毒t细胞的数量,但大幅度上调了肿瘤中b细胞的浸润。更重要的是,如c和d图所示,这些增加的b细胞在肿瘤中发生了成熟(d),最终削弱肿瘤中t细胞的杀伤功能(c)。
对实验结果进行对比分析表明:与阴性对照组相比,实验组小鼠肿瘤生长显著更大。进一步分析肿瘤中浸润免疫细胞数量发现,实验组小鼠肿瘤中细胞毒t细胞的数量并未显著改变,而肿瘤中浸润的b细胞数量则大幅度上调,并且更多分化为产生免疫球蛋白igg的成熟浆细胞。与此对应,在实验组小鼠肿瘤中t细胞表达杀伤分子granzymeb以及perforin的水平被显著削弱。因此推测,表观遗传抑制剂的单独使用由于同时引起了成熟b细胞介导的负反馈通路,最终抑制了抗肿瘤t细胞反应,无法有效治疗肿瘤。
实施例3
通过小鼠成瘤实验研究成熟b细胞对表观遗传治疗效果的影响。
上述成瘤实验所用小鼠均预先利用特异性抗体清除b细胞。实验设置阴性对照组和实验组。阴性对照组小鼠给与腹腔注射pbs处理,实验组小鼠给与腹腔注射表观遗传抑制剂gsk126+5-aza-dc处理。上述成瘤实验所采用的小鼠品系为c57bl/6,所采用的肿瘤细胞株为小鼠肝癌细胞株hepa1-6。
如图3所示,为清除b细胞后,荷瘤小鼠响应表观遗传治疗的情况。图3a为清除b细胞后,表观遗传治疗对小鼠肿瘤大小影响统计图;图3b为清除b细胞后,表观遗传治疗对小鼠肿瘤中细胞毒t细胞数量影响统计图;图3c为清除b细胞后,表观遗传治疗对小鼠肿瘤中细胞毒t细胞表达功能分子影响统计图。在图3中,a图显示清除b细胞后,使用表观遗传抑制剂能显著抑制肿瘤的生长。与此同时,如b和c图所示,清除b细胞后,使用表观遗传抑制剂能大幅度上调肿瘤中细胞毒t细胞的浸润数量,并增强其产生杀伤因子的能力。
对实验结果进行对比分析表明:与阴性对照组相比,实验组小鼠肿瘤明显更小,肿瘤中细胞毒t细胞的数量大幅度增加,并伴随杀伤功能分子的表达显著上调。因此推测,阻断b细胞介导的体液免疫反应能打破表观遗传治疗过程中产生的负反馈通路,更好的提高治疗的效果。
实施例4
通过小鼠成瘤实验研究联合用药组合物对肿瘤生长以及抗肿瘤t细胞免疫反应的影响。
上述小鼠实验设置对照组和实验组。对照组小鼠给与腹腔注射pbs处理、或单独表观遗传抑制剂处理、或单独体液免疫阻断物(fcγr封闭抗体、或syk抑制剂、或btk抑制剂)处理,实验组小鼠给与腹腔注射联合组合物处理。上述成瘤实验所采用的小鼠品系为c57bl/6,所采用的肿瘤细胞株为小鼠肝癌细胞株hepa1-6。
如图4所示,为联合用药组合物治疗对荷瘤小鼠肿瘤生长及抗肿瘤t细胞免疫反应情况的影响。图4a为组合物治疗对肿瘤大小影响统计图;图4b为组合物治疗对肿瘤中细胞毒t细胞浸润数量影响统计图;图4c为组合物治疗对小鼠肿瘤中细胞毒t细胞表达功能分子影响统计图。在图4中,与清除b细胞的效果一致,通过抗体封闭fcγr或抑制fcγr下游信号通路syk、btk等阻断体液免疫反应的手段能与表观遗传抑制剂发挥协同作用,更有效的抑制肿瘤的生长(a图),更大幅度的上调肿瘤中细胞毒t细胞的浸润数量(b图),并且进一步增强其产生杀伤因子的能力(c图)。
对实验结果进行对比分析表明:与阴性对照组相比,联合药物处理组小鼠肿瘤明显更小,肿瘤中细胞毒t细胞的数量大幅度增加,并伴随杀伤功能分子的表达显著上调。更重要的是,与单独进行表观遗传治疗以及单独体液免疫阻断物处理相比,联合用药组合物对肿瘤大小以及抗肿瘤t细胞免疫反应都有更优的效果。
在本发明中,所采用的表观遗传抑制剂为组蛋白甲基转移酶ezh2抑制剂gsk126和dna甲基转移酶dnmt1抑制剂5-aza-dc,其与体液免疫阻断物联合使用可以清除其负反馈作用,并起到协同作用。因此,在临床中使用的组蛋白甲基转移酶ezh2抑制剂包括但不限于以下药物gsk126或tazemetostat,以及在临床中使用的dna甲基转移酶dnmt1抑制剂包括但不限于以下药物5-aza-dc、decitabine(地西他滨)、triclabendazole(三氯苯达唑)、azacitidine(阿扎胞苷)、tetrahydrouridine(四氢尿苷)、aza-t-dcyd、fluorocyclopentenylcytosine、guadecitabinesodium、cedazuridine、tdcyd或fdcyd,所述组蛋白甲基转移酶ezh2抑制剂任一药物和所述dna甲基转移酶dnmt1抑制剂任一药物联合起来与体液免疫阻断物共同使用,同样可以抑制其负反馈作用并起到协同作用,用来抑制肿瘤。
由于鼠cd20特异性清除抗体可以清除表观遗传抑制剂的负反馈作用,且能与表观遗传抑制剂起到协同作用。因此目前临床治疗中使用的b细胞特异性清除抗体包括但不限于以下药物rituximab(利妥昔单抗)、ofatumumab(奥法木单抗)、obinutuzumab(奥滨尤妥珠单抗)、alemtuzumab(阿仑单抗)、ibritumomab(替伊莫单抗)、tositumomab(托西莫单抗)或blinatumomab(博纳吐单抗)也可以起到清除表观遗传抑制剂的负反馈作用且可以与表观遗传抑制剂起到协同作用。
由于鼠fcγr封闭抗体可以清除表观遗传抑制剂的负反馈作用,且能与表观遗传抑制剂起到协同作用。因此目前临床治疗中使用的fcγr封闭抗体也可以起到清除表观遗传抑制剂的负反馈作用且可以与表观遗传抑制剂起到协同作用。
由于syk抑制剂r406可以清除表观遗传抑制剂的负反馈作用,且能与表观遗传抑制剂起到协同作用。因此目前临床治疗中使用的fcγr下游信号通路syk抑制剂包括但不限于以下药物fostamatinib(福他替尼)、cerdulatinib(赛度替尼)、gusacitinib(asn002)或entospletinib(gs9973)也可以起到清除表观遗传抑制剂的负反馈作用且可以与表观遗传抑制剂起到协同作用。
由于btk抑制剂ibrutinib可以清除表观遗传抑制剂的负反馈作用,且能与表观遗传抑制剂起到协同作用。因此目前临床治疗中使用的fcγr下游信号通路btk抑制剂包括但不限于ibrutinib(依鲁替尼)、acalabrutinib也可以起到清除表观遗传抑制剂的负反馈作用且可以与表观遗传抑制剂起到协同作用。
综上所述,本发明提供的基于表观遗传治疗与体液免疫阻断的抗肿瘤联合用药组合物在提高肿瘤患者体内t细胞抗肿瘤免疫反应,以及在制定临床抗肿瘤治疗策略上均有广泛的应用。同时,由于体液免疫阻断物清除了表观遗传抑制剂所带来的负反馈作用,两者联合用药产生了协同作用,可有效恢复t细胞的抗肿瘤免疫应答,抑制肿瘤生长。因此,该药物组合物具有较好的临床应用前景。
本发明并不局限于上述实施方式,如果对本发明的各种改动或变形不脱离本发明的精神和范围,倘若这些改动和变形属于本发明的权利要求和等同技术范围之内,则本发明也意图包含这些改动和变动。
- 还没有人留言评论。精彩留言会获得点赞!